Белки представляют собой наиболее распространенные органические соединения клетки; обычно они составляют от 30 до 70% массы сухих веществ клеток. Все белки построены из четырех самых распространенных биологических элементов-углерода, водорода, азота и кислорода. В среднем белки содержат 50% С, 7% Н, 23% О и 16% N. Кроме того, в белках имеется до 3% серы, которая играет важную роль в стабилизации трехмерной структуры почти всех белков за счет образования дисульфидных (S–S) связей между атомами серы, расположенными в различных участках полимерной цепи. Молекулярные массы этих неповторяющихся полимеров изменяются в широких пределах от 6000 до миллиона и более. На рис. 2.14 изображены два основных типа пространственной структуры белков – фибриллярный и глобулярный.
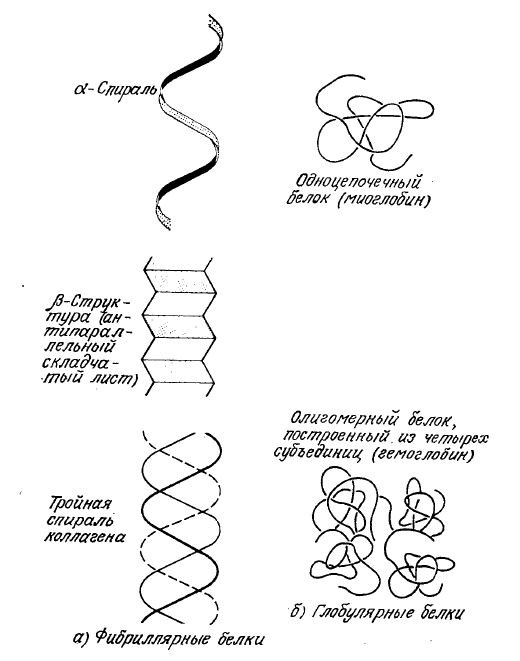
РИС. 2.14. Два основных типа структур белков и их варианты-фибриллярные (а) и глобулярные (б).
Преобладание в клетке веществ белковой природы неудивительно, если принять во внимание разнообразие их биологических функций (табл. 2.6). Главнейшая функция белков заключается в катализе. Белковые катализаторы, называемые ферментами, определяют скорость происходящих в клетке химических реакций. Ферменты локализуются в самых различных участках клетки, а некоторые из них находятся в растворенном или суспендированном виде в цитоплазме и таким образом равномерно распределяются по всему объему клетки. Другие ферменты связаны с мембранами или существуют в виде ассоциатов с другими веществами, с которыми они образуют надмолекулярные агрегаты. Некоторые связанные с мембранами белки, называемые пермеазами, помогают транспортировать специфические питательные вещества в клетку.
Таблица 2.6. Различные биологические функции белков

Другие белки являются структурными элементами клеточных мембран, а ряд белков выполняет двигательные функции. У многих одноклеточных организмов имеются небольшие образования, по форме напоминающие волоски, которые называются жгутиками. Эти жгутики движутся под действием способных сокращаться белков, обеспечивая тем самым перемещение всей клетки. Другие нитевидные и трубчатые придатки, называемые фимбриями, участвуют в инициировании связывания патогенных бактерий с чувствительными к ним тканями.
Белки выделяют, очищают и характеризуют различными физическими и химическими методами. Методы разделения белков (гл. 11) основаны на различиях в их молекулярных свойствах, которые в свою очередь частично определяются природой составляющих их аминокислот; последним мы и посвятим следующий раздел.
2.4.1. Белковые аминокислоты и полипептиды
Мономерными звеньями полипептидов являются α-аминокислоты общей формулы
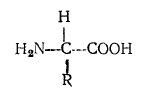
Таким образом, аминокислоты различаются природой группы R связанной с α-углеродным атомом (соседним с карбоксильной группой). Поскольку в общем случае все заместители у этого атома углерода различны (за исключением глицина, у которого R = Н), этот углеродный атом асимметричен.
Многие биологически важные органические соединения, в том числе сахара и аминокислоты, оптически активны, т. е. обладают по меньшей мере одним асимметрическим атомом углерода и поэтому могут существовать в двух формах, как это показано ниже на примере аминокислот:
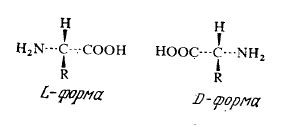
Раствор одного изомера вращает плоскость поляризации света вправо (правая или d-форма) или влево (левая или l-форма). Оптическая изомерия представляет собой чрезвычайно важное явление, поскольку при отсутствии ферментов, превращающих один изомер в другой, живые организмы могут усваивать только один из изомеров. Ферменты, как правило, также катализируют превращения только одного из оптических изомеров. Это свойство ферментов используется в промышленности для разделения смесей рацемических ациламинокислот, когда гидролизу подвергается только один из изомеров, так что в продуктах реакции содержатся два существенно различающихся и, следовательно, легче разделяемых вещества. Подробнее этот процесс мы рассмотрим в гл. 4. Поскольку метод прямого физического разделения оптических изомеров дорог и неэффективен, подобные микробиологические и ферментативные (а также химические) способы разделения могут оказаться гораздо более выгодными.
Интересно, что в подавляющем большинстве белков найдены только L-изомеры аминокислот. D -Аминокислоты в природных источниках встречаются редко; они были обнаружены в клеточных стенках некоторых микроорганизмов и в ряде антибиотиков. Кислотная (–СООН) и основная (–NH2) группировки аминокислот в водных растворах могут подвергаться ионизации.
Таблица 2.7. Величины рК (-lg К) концевых аминных и карбоксильных групп, а также группировок в бокоrых цепях Ra
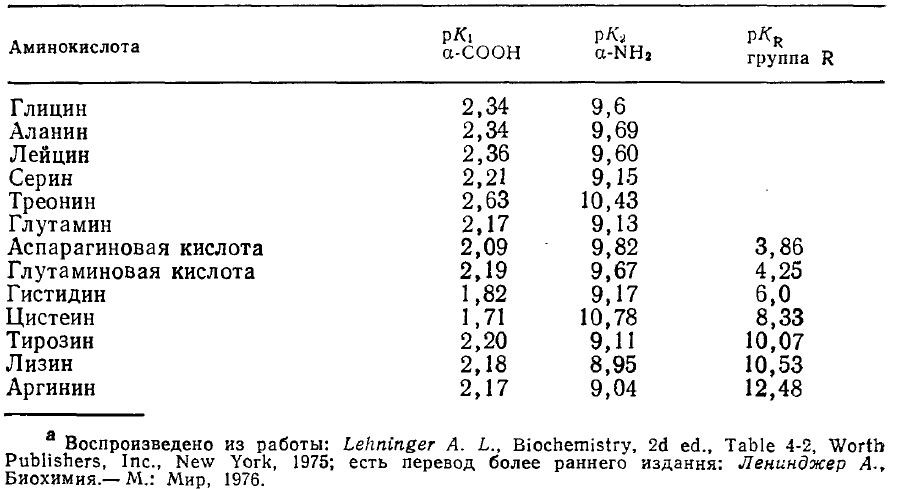
Аминокислота несет положительный заряд (катион) при низких значениях рН и отрицательный заряд (анион) при высоких рН. При некотором промежуточном значении рН аминокислота представляет собой биполярный ион (цвиттер-ион) с нулевым результирующим зарядом. Эта величина рН называется изоэлектрической точкой и определяется природой заместителя R (табл. 2.7). В изоэлектрической точке аминокислота под влиянием электрического поля не способна мигрировать ни к аноду, ни к катоду, и, кроме того, ее растворимость минимальна. На этих свойствах аминокислот основаны такие методы разделения смесей, как ионный обмен, электродиализ и электрофорез (гл. 11).
На рис. 2.15 приведены формулы 20 аминокислот, обычно встречающихся в белках. Помимо характерных для всех аминокислот карбоксильной и аминной (кроме пролина) групп не которые из них содержат ионизирующиеся группы и в заместителе R. Для одних аминокислот типичны неполярные гидрофобные группы R, в других заместители R обладают гидрофильными свойствами. Как мы увидим в следующем разделе, природа этих боковых цепей важна, с точки зрения как функции белка, так и его структуры.
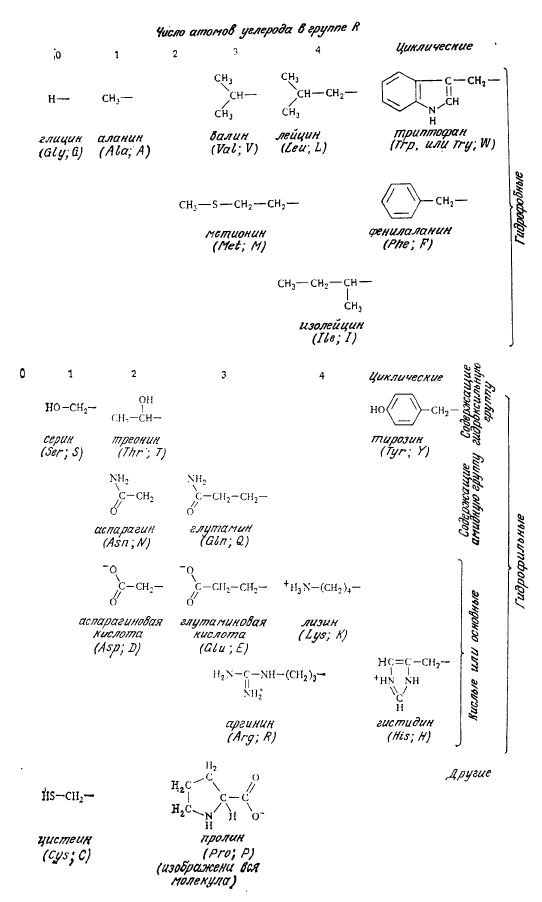
РИС. 2.15. 20 белковых аминокислот.
Простые белки представляют собой полимеры, образующиеся путем конденсации одних только аминокислот. Реакция конденсации, лежащая в основе синтеза белков, осуществляется между аминогруппой одной аминокислоты и карбоксильной группой другой и приводит к образованию пептидной связи:
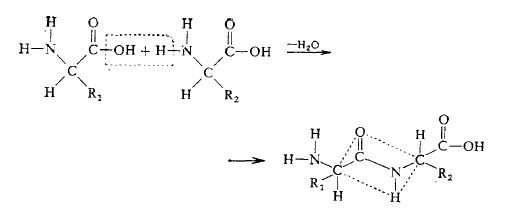
Пептидная связь частично имеет характер двойной связи, поэтому шесть атомов (на схеме они лежат внутри прямоугольника, ограниченного штриховыми линиями) расположены в одной плоскости. Запомните, что каждая аминокислота соединяется с последующей пептидной связью, поэтому вся белковая цепь может строиться с помощью одного фермента; в то же время порядок расположения аминокислот определяется другими механизмами (гл. 6).
Название образовавшегося в результате возникновения пептидной связи фрагмента (аминокислотного остатка) производят от названия соответствующей аминокислоты путем добавления окончания ил; например, остатками глицина и аланина являются глицил и аланил соответственно. Перечисление остатков в олигопептиде начинают с конца, несущего свободную аминогруппу.
Полипептиды представляют собой сравнительно короткие цепи, построенные из аминокислотных остатков (рис. 2.16). Понятно, что по мере увеличения длины цепи физико-химические свойства полимера все в большей степени будут определяться природой групп R аминокислотных остатков, а роль концевых аминной и карбоксильной групп будет все менее и менее важной. Полипептидами принято называть относительно небольшие nолиаминокислотные цепи. Многие полипептиды имеют большое 'биологическое значение; в частности, к числу полипептидов относится ряд гормонов, например, инсулин, гормон роста и соматостатин.
Большие полиаминокислотные цепи называют белками; граница между полипептидами и белками строго не определена; обычно считают, что она лежит в пределах 50-100 аминокислотных остатков. Поскольку средняя молекулярная масса аминокислотного остатка составляет около 120, то молекулярная масса белков должна превышать 10 000; известны отдельные белки с молекулярной массой более миллиона.
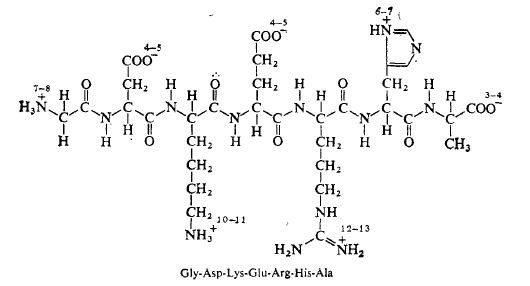
РИС. 2.16. Гипотетический полипептид с различными ионизированными группами. Запомните,
что перечисление аминокислотных остатков начинают с N-конца последовательности.
Числа возле каждой ионизированной группы указывают соответствующие величины рК.
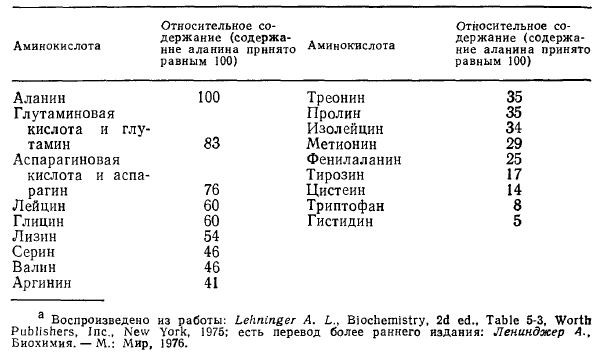
Аминокислотный состав какого-либо белка или смеси белков может быть определен с помощью автоматического аминокислотного анализатора. Полный гидролиз белка осуществляют нагреванием в 6 н. HCI в течение 10-24 ч при 100-120 °С. При этом с количественным выходом в виде гидрохлоридов образуются все аминокислоты (за исключением триптофана, аспарагина и глутамина); их разделяют и определяют количественно. Для определения содержания триптофана можно применить щелочной гидролиз. Результаты такого изучения белков из кишечной палочки Е. coli приведены в табл. 2.8. Эти и ряд других данных показывают, что не все 20 аминокислот (перечисленных на рис. 2.15) входят в состав любого белка. Ни в одном известном белке аминокислоты не содержатся в эквимолярных количествах. Для любого конкретного белка, однако, относительные количества различных аминокислот представляют собой строго определенные величины.
Таблица 2.8. Относительные количества различных аминокислот в белках Е. colia
Аминокислоты не являются единственными компонентами белков. В состав многих сложных белков входят другие органические или даже неорганические группировки, называемые простетическими группами. Если белок построен только из остатков аминокислот, его иногда, как уже упоминалось выше, называют простым белком. Широко известный пример сложных белков представляет гемоглобин- переносчик кислорода в красных кровяных тельцах,- в состав молекулы которого входят четыре группировки гема, представляющие собой железосодержащие металлоорганические комплексы. В близком по структуре, но меньшем по молекулярной массе миоглобине имеется один гем. Каждая молекула фермента оксидазы L-аминокислот, катализирующей дезаминирование ряда L-аминокислот, содержит два остатка флавинадениндинуклеотида (FAD) (см. рис. 2.9). Как указывалось выше, простетической группой рибосом можно считать РНК.
2.4.2. Структура белков
Способность белков выполнять множество специфически функций (табл. 2.6) большей частью обусловлена тем обстоятельством, что белки могут существовать в самых различных конформациях. В целях облегчения анализа строения белков принято подразделять их структуру на три уровня, а при наличии нескольких полипептидных цепей рассматривают еще и четвертый уровень. Приведенные в табл. 2.9 данные показывают, что каждый структурный уровень определяется различными факторами, которые в сумме обеспечивают все разнообразие структур и функций белков.
Таблица 2.9. Структура белков

2.4.3. Первичная структура
Под первичной структурой белка подразумевают свойственную ему последовательность аминокислотных остатков. Первым белком, у которого удалось выяснить полную первичную структуру, был инсулин (Сэнджер и сотрудники, 1955 г.). Теперь можно считать доказанным, что для любого белка характерен не только определенный аминокислотный состав, но и специфическая аминокислотная последовательность. Как мы увидим ниже (разд. 6.1), эта последовательность определяется нуклеотидной последовательностью ДНК.
Детальное изучение методов определения аминокислотной последовательности не входит в цели настоящей книги, поэтомv мы ограничимся только самыми общими сведениями. Существует много методов расщепления белка на различные полипептидные фрагменты. Известны, например, ферменты, способные расщеплять связи между строго определенными аминокислотными остатками. Определить аминокислотную последовательность образующихся относительно коротких полипептидных цепей можно далее с помощью методов, разработанных Сэнджером и другими исследователями. Известные частично перекрывающиеся последовательности фрагментов белка затем комбинируют таким образом, чтобы в конце концов получить полную картину, характеризующую аминокислотную последовательность всего белка. На автоматических приборах для определения аминокислотной последовательности в белках (секвенаторах) с вращающимся реакционным сосудом можно последовательно определить до 100 аминокислотных остатков в цепи; для определения одного остатка требуется около 2 ч. Предложенный недавно газофазный метод позволил значительно снизить количество белка, необходимое для определения его аминокислотной последовательности. Например, для выяснения полной первичной структуры полипептида, состоящего из 50 аминокислотных остатков, на газофазном секвенаторе требуется 50-100 пикамолей вещества, а на анализаторе с вращающимся сосудом 1-5 наномолей вещества. Как мы увидим позднее в гл. 6, аминокислотная последовательность белка может быть выяснена и косвенным путем на основе результатов экспериментального определения нуклеотидной последовательности соответствующего гена.
В настоящее время известна аминокислотная последовательность многих полипептидов и белков. Пока что в белках не было обнаружено повторяющихся участков с идентичными последовательностями, хотя некоторые данные позволяют предположить, что подобная картина возможна для ряда фибриллярных белков. В качестве примера на рис. 2.17 приведена аминокислотная последовательность фермента из яичного белка, называемого лизоцимом. Как мы уже неоднократно отмечали, нумерация аминокислотных остатков начинается с N-концевого, в данном случае лизина, и завершается С-концевым остатком, которым в этом ферменте является лейцин.
Боковые цепи аминокислотных остатков взаимодействуют друг с другом и с непосредственным окружением белка, тем самым определяя геометрическую конфигурацию белковой молекулы. Складывание полипептидной цепи в строго определенную трехмерную структуру приводит к белковой молекуле сложной, запутанной формы типа изображенной на рис. 2.17, б для случая лизоцима. Такое сложное пространственное строение белка детерминируется в первую очередь его первичной структурой.
Значююсть первичной структуры белков становится особенно очевидной, если учесть, что она в свою очередь определяется клеточной системой кодирования (разд. 6.1). Таким образом, а:'линокис,1отная последовательность белков является как бы тем звеном, которое соединяет главный командный центр клетки, ДНК, со сложными, высокоспецифичными молекулами белков, осуществляющими и регулирующими разнообразные биохимические процессы, необходимые для роста и выживания клетки.
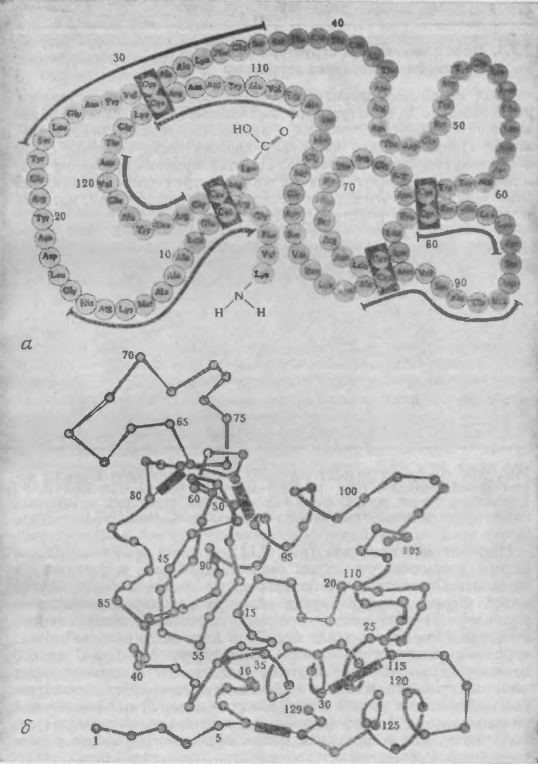
РИС. 2.17. а – аминокислотная последовательность или первичная структура фермента
яичного белка лизоцима; 6 – трехмерная (третичная) структура молекулы кристаллического .лизоцима.
2.4.4. Пространственная структура белков;
вторичная и третичная структуры
Под вторичной структурой белков понимают относительное расположение в пространстве аминокислотных остатков, занимающих соседние положения в аминокислотной последовательности. Напомним, что частичная двоесвязность амидной связи обусловливает ее планарность. По этой причине вращение возможно только вокруг двух из каждых трех связей пептидной цепи (рис. 2.18), что ограничивает число конформаций, которые может принимать короткий участок цепи.
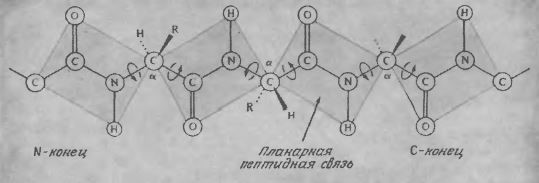
РИС. 2.18. Планарная природа пептидной связи ограничивает вращение вокруг связей пептидной цепи.
Как мы уже отмечали (рис. 2.14), существуют две основные формы вторичной структуры белков: α-спираль и -структура (β-слой). Считается, что конформация фибриллярных белков волос, шерсти и ряда других объектов стабилизируется водородными связями между атомами соседних аминокислотных остатков. При свертывании белковой цепи в спираль возможно образование таких же связей между группой –С=О одного остатка и группой –NH другого, отделенного от первого тремя аминокислотными остатками. Такое связывание без существенной деформации связей и углов полипептидной цепи возможно только при одной конформации, называемой α-спиралью. Предполагается, что в молекуле коллагена, самого распространенного белка высших животных, имеются три α-спиральных участка, объединенных в одну суперспираль. Жесткие и относительно малоэластичные молекулы коллагена выполняют механическую (опорную) функцию. Коллаген обнаружен в коже, сухожилиях, роговице глаза и многих других органах; он важен в иммобилизации ферментов и клеток и как составляющая часть биосовместимых материалов.
Водородные связи не отличаются высокой прочностью, поэтому α-спиральные структуры легко разрушаются. Белки могут терять спиральную структуру в водных растворах в результате конкурентного образования водородных связей с молекулами воды. Если волокна шерсти обработать паром и растянуть, то белки шерсти принимают иную конформацию, называемую β-структурой (β-слоем, складчатым слоем). Последняя характерна для нативных белков волокна шелка. β-Структура также стабилизирована водородными связями, однако в этом случае они возникают между соседними параллельными цепями. Для этой структуры характерны гибкость и в то же время высокая устойчивость к растяжению.
Свойства вторичной структуры фибриллярных белков используются в пищевой промышленности. Некоторые пищевые продукты растительного происхождения, например, соевые бобы, являются ценными источниками незаменимых аминокислот; в то же время они не обладают консистенцией и текстурой мясных продуктов. Для придания им этих качеств растворенные глобулярные белки перерабатывают в так называемый «текстурированный белок» путем их трансформации в структуры, более близкие к линейным.
В результате чрезвычайно трудоемких и сложных экспериментов удалось определить полное пространственное строение (третичную структуру) нескольких белков. Для этой цели выращивали кристаллы чистого белка, которые затем изучали методом рентгеноструктурного анализа. В результате рассеяния рентгеновских лучей на атомах образуется сложная дифракционная картина, которая содержит информацию о деталях строения белка при разрешении до 2 А. Дешифровка этой информации в случае миоглобина (рис. 2.19) потребовала расчета 10 000 рядов Фурье, поэтому выяснение строения белков этим методом в общем случае целесообразно только при условии использования высокоэффективных компьютеров.
Как показано на рис. 2.17, б и 2.19, третичная структура белков, особенно глобулярных, чрезвычайно сложна. На указанных рисунках без труда можно найти области со спиральной вторичной структурой, а в молекуле лизоцима, кроме того, имеются и участки с β-структурой. Каким путем стабилизируются эти структуры и какой цели служит класс соединений, молекулы которых обладают таким разнообразным строением?
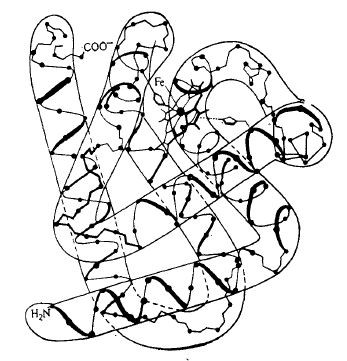
РИС. 2.19. Трехмерная структура миоглобина. Точками указаны положения
α-углеродных атомов 121 аминокислотного остатка в этом белке, выполняющем
функцию переносчика кислорода. В середине верхней части молекулы
более крупным кружком выделен атом железа, расположенный в центре единственного гема белка.
Взаимодействия между боковыми группами R, удаленными друг от друга в аминокислотной последовательности белков, определяют характер складывания или изгиба белковой цепи с образованием компактных конфигураций, типичных для глобулярных белков. Трехмерная структура белка формируется в первую очередь за счет некоторых слабых взаимодействий, в том числе ионных и водородных связей, а также гидрофобного взаимодействия между неполярными группами R. (рис. 2.20).
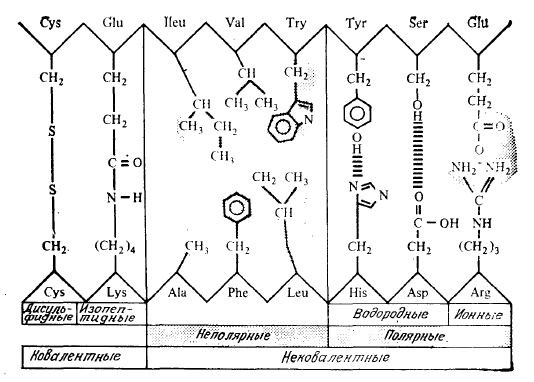
РИС. 2.20. Различные типы связей и взаимодействий, стабилизирующих молекулярную структуру белка.
Подобно рассмотренным ранее мицеллам, образующимся из липидов, у многих глобулярных белков гидрофобные остатки сконцентрированы во внутренней части молекулы, а более гидрофильные группировки располагаются на ее поверхности. Такая конформация, иногда называемая моделью масляной капли, вероятно, наиболее устойчива в естественной для нативных белков водной среде. (Чем, по вашему мнению, отличается от описанной структура белка, входящего в состав клеточной мембраны?)
В биохимической технологии со многих точек зрения чрезвычайно важно понять, что эти слабые взаимодействия легко нарушаются при различных изменениях окружающей среды. В биологических системах энергия водородной связи составляет от 3 до 7 ккал/моль, а энергия ионной связи обычно равна 5 ккал/моль, поэтому уже умеренное нагревание может нарушить некоторые из этих связей. Изменение рН, ионной силы, физические воздействия и добавки органических веществ, очевидно, также могут нарушать третичную структуру белков, свойственную им в нативной форме.
В создании устойчивых конформаций белков важную роль играют также ковалентные связи, особенно часто образующиеся между двумя остатками цистеина. Дисульфидная связь образуется между двумя группами -SH путем элиминирования двух атомов водорода:
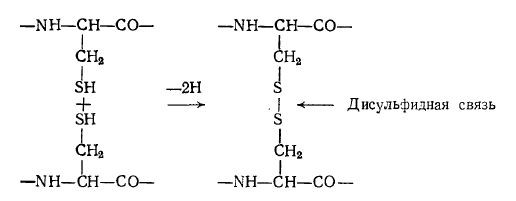
Дисульфидные мостики играют роль поперечных связей в полипептидной цепи, а иногда они связывают две различные цепи; молекула инсулина, например, представляет собой две цепи, содержащие 21 и 30 аминокислотных остатков, соединенные·двумя дисульфидными связями; третий дисульфидный ·мостик образует внутреннюю поперечную связь в короткой цепи (рис. 2.21). По сравнению с указанными выше слабыми связями дисульфидные ковалентные мостики более устойчивы к термическому воздействию. В то же время дисульфидные связи легко восстанавливаются избытком сульфгидрильных соединений, например, β-меркаптоэтанолом.
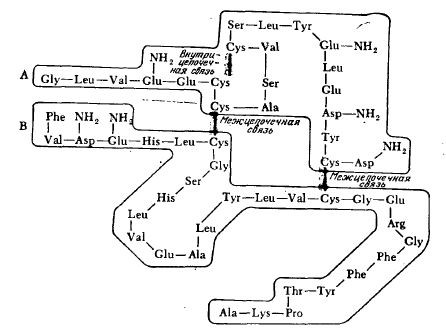
РИС. 2.21. Дисульфидные мостики связывают две пептидные цепи, называемые цепью А
(21 аминокислотный остаток) и цепью В (30 остатков), в изображенной здесь молекуле бычьего инсулина;
инсулины других видов животных построены аналогичным образом.
Обратите внимание на третью внутрицепочечную дисульфидную связь между двумя остатками короткой цепи А.
Конформация белка в существенной степени определяет его биологическую активность. Многочисленные экспериментальные факты свидетельствуют о том, что во многих случаях белок способен выполнять свойственную ему функцию, только находясь в определенной трехмерной структуре. Этот принцип, в частности, положен в основу так называемой модели «замка и ключа», достаточно наглядно объясняющей высокую специфичность белковых ферментов, катализирующих биохимические превращения. Известно, что данный фермент способен превращать только определенные соединения, называемые субстратами. Согласно модели замка и ключа (рис. 2.22), фермент обладает специфическим участком («замком»), который по своей структуре комплементарен молекуле субстрата («ключу»), поэтому с ферментом могут связываться (и, следовательно, подвергаться дальнейшим каталитическим превращениям) только субстраты, обладающие необходимой пространственной структурой. Полученные в ходе изучения третичной структуры белков данные не только подтвердили эту гипотезу, но и помоrли глубже понять механизм каталитического эффекта ферментов; на этой теме мы остановимся подробнее в следующей главе. Неоднократно показано, что непосредственная связь между пространственным строением белков и их высокоспецифическими взаимодействиями с другими веществами характерна также для пермеаз, гормонов, антител и других белков.
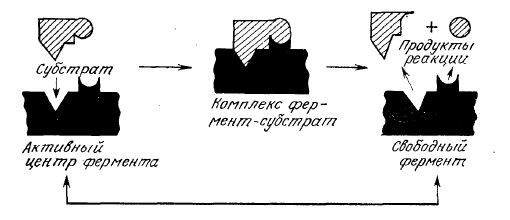
РИС. 2.22. Упрощенная схема модели ферментативного катализа типа «замок и ключ».
Здесь форма каталитически активного центра фермента (замка) комплементарна форме субстрата (ключа).
Если белок находится в условиях, отличающихся от его обычного биологического окружения, он может подвергаться структурным изменениям, которые обычно сопровождаются потерей его функциональных свойств (рис. 2.23); этот процесс называют денатурацией. Денатурация может быть вызвана, например, относительно небольшими изменениями рН и температуры раствора; в этом случае, как правило, она не сопровождается разрушением ковалентных связей. При медленном охлаждении разбавленного раствора денатурированного белка до свойственной ему в природных условиях температуры часто происходит обратный процесс, называемый ренатурацией, сопровождающийся восстановлением функции белка. Как и в случае многих других превращений, повышение температуры способствует росту энтропии (разупорядоченности) и, следовательно, разрушению глобулярных структур белков; охлаждение благоприятствует осуществлению взаимодействий, обеспечивающих компактную структуру белка и его ренатурацию.
Принимаемая белком и определяющая его свойства конформация характеризуется минимумом свободной энергии молекулы. Пока что эту концепцию нельзя использовать для предсказания структуры и функции белка, если известна только его аминокислотная последовательность. Она может, однако, оказаться полезной в тех случаях, когда необходимо высказать обоснованные предположения об изменении свойств белка в условиях конкретного технологического процесса (которые часто существенно отличаются от условий существования нaтивного белка) или в результате частичного изменения его аминокислотной последовательности. В частности, эта концепция помогает понять, почему связанный с твердой поверхностью фермент менее активен, чем тот же фермент в растворе.
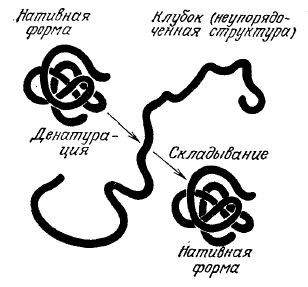
РИС. 2.23. Денатурированный под влиянием тех или иных факторов
белок часто может вновь принять нативную биологически активную конформацию,
как только действие этих факторов прекращается. Такого рода эксперименты показывают,
что первичная структура белка определяет его вторичную и третичную структуры.
В настоящей главе много внимания было уделено связи между строением белков и их функцией. В то же время не следует забывать, что в силу слабости большинства взаимодействий и связей, стабилизирующих молекулы белков, реальные конформации последних могут в существенной степени отклоняться от некоторой характерной усредненной конформации. Более того, эта способность белков в ряде случаев тесно связана с их биологической функцией подобно тому, как биологическая функция ДНК определяется ее способностью разделяться в изотермических условиях внутри клетки на две цепи. С точки же зрения биохимика-технолога относительная легкость термической или химической денатурации многих белков говорит в первую очередь о том, что ферментативные и клеточные процессы можно регулировать путем изменения, например, рН, температуры и ионной силы, только в довольно узких пределах. Денатурацию полезно учитывать и в некоторых других случаях, например, при выделении белков (гл. 11) и в конструкциях стерилизаторов (гл. 7 и 9).
2.4.5. Четвертичная структура и регулированне биологических процессов
Белки могут быть построены из нескольких полипептидных цепей (субъединиц); из таких белков наиболее широко известен, по-видимому, гемоглобин. Под четвертичной структурой белка понимают способ упаковки субъединиц. Как видно из приведенных в табл. 2.10 данных, множество белков, в особенности ферментов (обычно их названия оканчиваются суффиксом -аза), представляют собой олигомеры и поэтому должны обладать характерной четвертичной структурой. Считается, что четвертичная структура стабилизируется теми же силами и связями, что и третичная. Иногда, как в случае) инсулина, в образовании четвертичных структур участвуют дисульфидные связи, однако в большинстве приведенных в табл. 2.10 примеров субъединицы удерживаются в олигомерной молекуле белка за счет более слабых взаимодействий. Известно, что многие олигомерные белки способны к самоконденсации; так, например, разделенные α- и β-цепи гемоглобина в растворе быстро ассоциируют с образованием молекул интактного гемоглобина. Это свойство белков чрезвычайно показательно в том смысле, что оно свидетельствует (по меньшей мере в некоторых случаях) об определяющей роли биохимического одномерного кода ДНК, который характеризует не только первичную структуру белков, но и посредством ее все высшие структурные уровни белков, а, следовательно, и их специфические биологические функции.
Таблица 2.10. Характеристики некоторых олигомерных белкова

Имеющиеся в настоящее время данные показывают, что построение молекул некоторых белков из нескольких субъединиц обеспечивает выполнение по меньшей мере двух важных биологических функций: во-первых, регулирует каталитическую активность ферментов и, во-вторых, создает широкие возможности для построения родственных, но не идентичных молекул из одного и того же набора субъединиц. Иллюстрацией последней функции могут служить белки, называемые uзоферментами или изозимами. Изоферменты представляют собой различные молекулярные формы фермента, катализирующие одну и ту же реакцию в организмах одного вида. Существование изоферментов само по себе может показаться ненужным, однако на самом деле доступность параллельных, но различных каталитических процессов является важным элементом ряда систем биохимической регуляции (гл. 3 и 5). Известно, что некоторые изоферменты представляют собой олигомерные белки; описан случай изоферментов, построенных из пяти субъединиц только, двух типов. Подобную конструкцию можно считать выгодной и целесообразной, поскольку она позволяет синтезировать пять различных белков всего лишь из двух полипептидных цепей.

