В настоящее время не существует единой теории, объясняющей необычно высокую специфичность и активность ферментных катализаторов. В то же время в отношении небольшого- числа конкретных ферментов был выдвинут целый ряд вполне- вероятных гипотез, подтвержденных экспериментальными данными. По-видимому, положенные в основу этих гипотез явления в совокупности и обусловливают специфические свойства ферментов. В настоящем разделе мы вкратце рассмотрим некоторые из этих гипотез; более подробные сведения читатель сможет найти в литературе, приведенной в конце главы. Поскольку все рассматриваемые здесь гипотезы только частично объясняют механизм действия ферментов, мы не будем пытаться обобщить эти данные с целью создания единой теории ферментативной активности.
Существование фермент-субстратных комплексов доказано с помощью различных экспериментальных методов, в том числе рентгеноструктурного анализа, спектроскопических методов и электронного парамагнитного резонанса. Субстрат связывается с ферментом в определенной области молекулы фермента, называемой активным центром, где осуществляется катализируемая ферментом реакция и образуются ее продукты. В связывании субстрата с ферментом и образовании комплекса иногда принимают участие слабые взаимодействия, рассмотренные разд. 2.4.3, а в некоторых случаях при этом образуются и ковалентные связи. Как схематически показано на рис. 2.24 и 3.2, комплекс образуется тогда, когда субстратный «ключ» входит в ферментный «замок». На рис. 3.2 особенно отчетливо видно, что фермент-субстратный комплекс образуется с помощью водородных связей между субстратом и группами, расположенными в самых разных участках аминокислотной последовательности фермента.
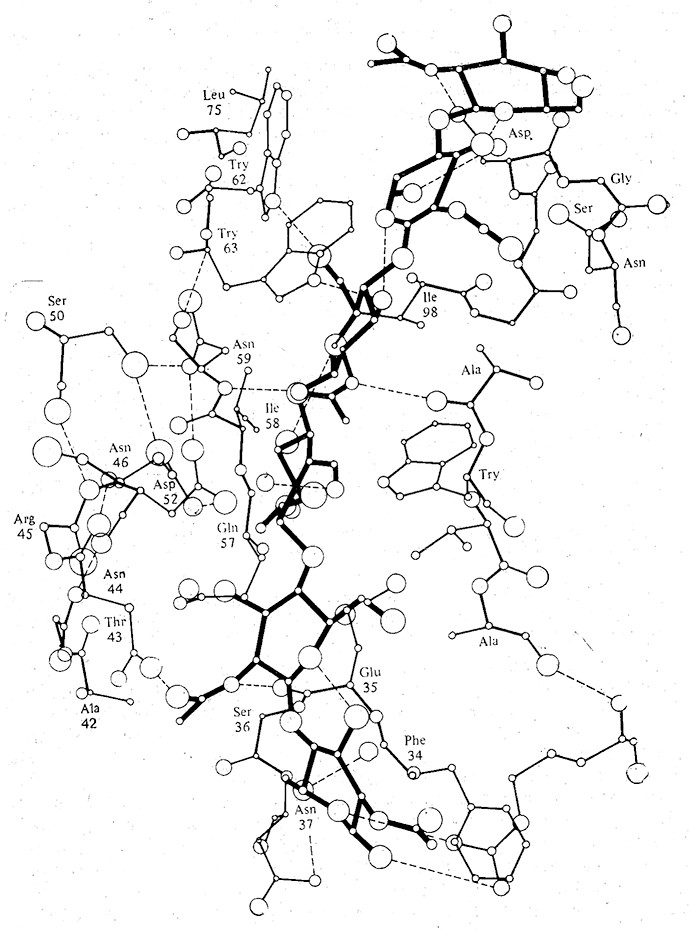
РИС. 3.2. Схематическое изображение активного центра лизоцима. Жирными линиями выделена
молекула гексасахаридного субстрата, большими и маленькими кружками обозначены атомы кислорода
и азота соответственно, а штриховыми линиями–водородные связи.
Этот пример также наглядно иллюстрирует понятие об активном центре. Молекула белка сложена таким образом, что реакционноспособные группы в боковых цепях нескольких аминокислотных остатков фермента образуют в высшей степени специфичную, пространственно организованную конструкцию, точно отвечающую конфигурации субстрата. В состав активных центров ферментов входят боковые цепи остатков Asp, Cys, Glu, His, Lys, Met, Ser, Thr, а также концевые аминные и карбоксильные группы. Поскольку в среднем возле субстрата расположено около 20 таких групп (значительно меньше, чем общее число аминокислотных остатков в молекуле фермента), принято считать, что непосредственное участие в функционировании активного центра фермента принимает только его небольшая часть. У больших ферментов может быть несколько активных центров. Большинство аминокислотных остатков, не входящих в активный центр, определяют характер складывания полинептидной цепи (вторичную структуру) и пространственное расположение одной части цепи относительно другой (третичную структуру), в результате чего и создается активный центр фермента (рис. 3.4).
Хотя ряд изложенных ниже более детальных гипотез все еще не лишен некоторых противоречий, следует подчеркнуть, «что понятия об активном центре и фермент-субстратном комплексе в настоящее время общеприняты и лежат в основе большинства теорий, объясняющих механизм действия ферментов. В дальнейшем мы также будем пользоваться этими понятиями при математическом анализе кинетики ферментативного катализа.
Два различных подхода к объяснению ферментативной активности схематически отображены на рис. 3.3. Фермент может связывать молекулы двух субстратов таким образом, что реакционноспособные группы последних будут располагаться поблизости друг от друга и от каталитических групп фермента. Это, естественно, будет способствовать ускорению химической реакции; такой эффект известен под названием эффекта сближения. Предположим далее, что молекулы двух субстратов не обладают сферической симметрией. В этом случае реакция произойдет только в том случае, когда при сближении молекулы располагаются в ориентации, обеспечивающей тесное взаимодействие реакционноспоеобных атомов или групп. Считается, что ферменты связывают молекулы субстратов, так что последние занимают особенно благоприятное положение, создавая таким образом эффект ориентации, который и обеспечивает ускорение реакции. Это явление, иногда называемое также орбитальным управлением, вносит свой вклад в процесс ферментативного катализа, однако количественную величину соответствующего эффекта в общем случае пока еще определить трудно.
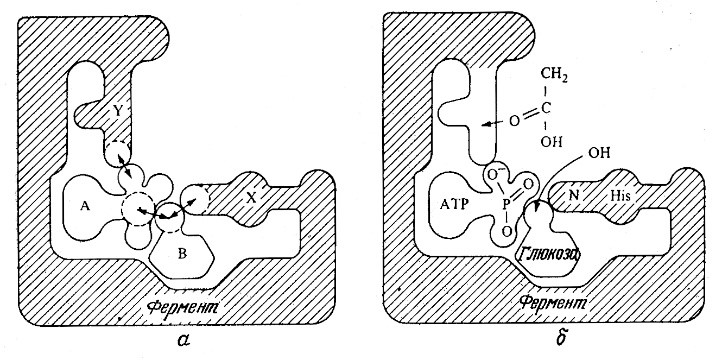
РИС. 3.3. Фермент ускоряет реакцию за счет пространственного сближения двух субстратов
(эффект сближения) и их расположения под выгодным углом (эффект ориентации).
Прежде чем приступить к краткому обзору химии ферментативного катализа, следует упомянуть еще одну гипотезу, связанную с геометрией фермента. Известно, что связывание субстрата сопровождается небольшим изменением пространственной структуры некоторых ферментов. В частности, путем изучения трехмерной структуры ферментов лизоцима и карбоксилептидазы А в виде комплексов с субстратами и без субстратов было показано, что конформации ферментов при связывании субстрата несколько изменяются. Такое индуцированное соответствие фермента и субстрата может вносить свой вклад в процесс ферментативного катализа. Предлагались также усложненные варианты модели индуцированного соответствия, в которых в ходе процесса последовательно образуется несколько промежуточных ферментсубстратных комплексов. Некоторая эластичность и гибкость молекулы фермента может способствовать тщательной пространственной поДгонке его каталитических групп и тем самым ускорению превращений каждого из промежуточных соединений. Возможно, что индуцирование субстратом изменений в конформации активного центра характерно для ферментативного катализа вообще, хотя экспериментальное обнаружение этого эффекта связано с рядом трудностей и поэтому было осуществлено только в случае нескольких ферментов.
Некоторые ферменты осуществляют реакции, хорошо известные химику-органику. Одной из таких реакций является общий кислотно-основной катализ, в котором катализатор на одной из стадий процесса захватывает или отдает протон. Этот тип катализа, в частности, лежит в основе механизма действия одного из немногих ферментов, для которых предложена достаточно убедительная полная последовательность элементарных стадий каталитического процесса (рис. 3.4). Выделяемый из поджелудочной железы химотрипсин представляет собой протеолитический (т. е. гидролизующий белки) фермент, специфично расщепляющий пептидные связи, образованные карбоксильными группами остатков тирозина, триптофана и фенила-, ланина. Считается, что в реакции химотрипсинового катализа как при отщеплении, так и при присоединении протонов роль переносчика последних играет вода. В сущности, к общему кислотно-основному катализу можно свести целый ряд очень важных в химии клетки реакций, в том числе процессы присоединения к карбонильным соединениям и гидролиз сложных эфиров.
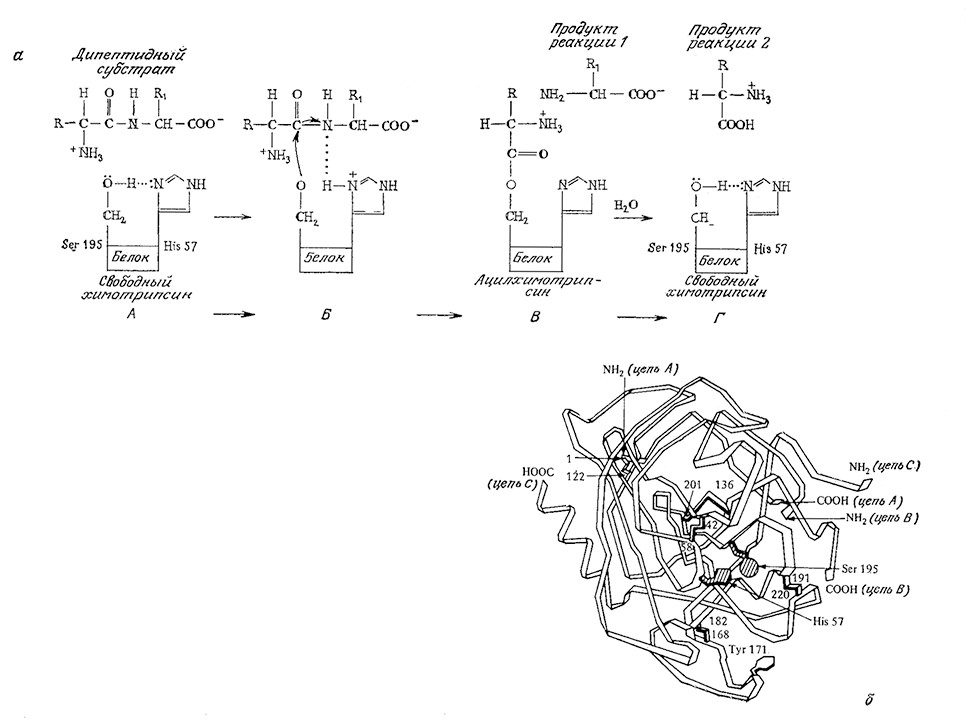
РИС. 3.4. а – предполагаемая последовательность реакций при расщеплении пептидной связи химотрипсином;
б – структура химотрипсина.
А. – Гидроксильная группа Serl95 связана водородной связью с имид- азольным атомом азота His 57.
Б. Протон очень быстро мигрирует от Serl95 к имидазольному атому азота His57. Образуется временная водородная связь между имид- азольным кольцом и субстратом, ориентирующая дипептид таким образом, что становится возможной нуклеофильная атака атома кислорода серина на карбонильный атом углерода субстрата.
В. Аминоацильная группа отрывается от дипептида и переносится к ферменту; одновременна^ образуется свободная С-концевая аминокислота-субстрата.
Г. Под действием Н2О аминоацильная группа отделяется от Serl95, в результате чего регенерируется свободный фермент
В ферментативном катализе важную роль могут играть и другие факторы, например, ковалентный катализ, деформация связей, электростатический катализ, многофункциональный катализ и эффекты растворителя (вспомните структуру масляной капли, приведенную в предыдущей главе).

