Подавляющая часть опубликованных в литературе данных по кинетике ферментативного катализа посвящена изучению начальных скоростей реакций и обратимых изменений ферментативной активности. В то же время скорость снижения каталитической активности является одной из основных характеристик ферментов при их практическом использовании. В первую очередь это относится к процессам, в которых фермент, используется в течение длительного времени, например, в проточных реакторах непрерывного действия (следующая глава будет посвящена в основном методам иммобилизации ферментов, предназначенным для их удерживания именно в таких реакторах). В подобных ситуациях полезное время жизни ферментного биокатализатора может определять экономическую целесообразность всего процесса.
Основное внимание в этом разделе будет уделено механизмам и кинетике процессов, при которых фермент теряет свою каталитическую активность; эти процессы, связанные с изменением структуры функции белков, важны и с практической точки зрения. Так, например, белки часто осаждают из культуралыюго бульона путем изменения рН или ионной силы, что сопровождается изменением конформации или химического состояния белка. На последующих стадиях очистки белков в качестве высокоспецифичных сорбентов иногда применяют антитела; инактивация последних сопровождается потерей способности узнавать и адсорбировать определенный белок. К проблемам разделения мы вернемся в гл. 11, а сейчас рассмотрим причины снижения ферментативной активности, кинетику этих процессов и сопровождающие их эффекты.
3.7.1. Механизмы денатурации белков и сопутствующие эффекты
Как мы уже знаем, структура белков стабилизуется за счет слабых взаимодействий; таким путем обеспечивается функционально важная молекулярная подвижность. С другой стороны, слабость стабилизирующих сил предполагает, что с энергетической точки зрения белки могут сравнительно легко принимать несколько альтернативных и биологически менее активных конформаций. Иллюстрацией этого свойства белков могут служить приведенные на рис. 3.26 термодинамические характеристики различных состояний α-лактальбумина. Нетрудно видеть, что разность свободных энергий нативного и полностью денатурированного состояний этого белка составляет всего лишь 9,0 ккал/моль (хотя переход из одной конформации в другую может потребовать преодоления более значительных энергетических барьеров переходных состояний). Поэтому приходится признать, что стабильность нативной структуры белков крайне низка.
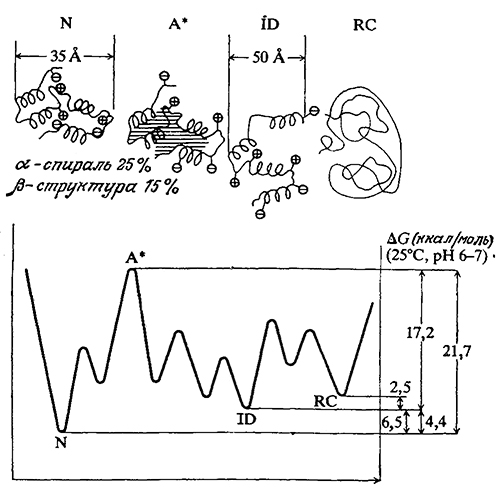
РИС. 3.26. Схематичное изображение ступенчатого разворачивания белковой молекулы α-лактальбумина и соответствующие термодинамические данные.
Обозначения: N – нативная конформация; A* – критически активированное состояние; ID – частично неупорядоченная конформация; RC – неупорядоченный клубок (полностью денатурированное состояние).
В этой связи неудивительно, что сопровождающиеся снижением активности нарушения природной геометрической и химической структуры белков могут быть вызваны множеством физических и химических факторов (табл. 3.9). Установив индивидуальные факторы, обусловливающие денатурацию белков, следует в то же время учитывать, что скорость денатурации белков определяется не каждым из этих факторов в отдельности, а их сочетанием. Например, склонность белка к денатурации при повышенных температурах может изменяться в очень широких пределах в зависимости от рН раствора, а совместное влияние определенных рН и температуры на белок в очень большой степени зависит от его природы.
Таблица 3.9. Факторы, вызывающие денатурацию белковой сопутствующие денатурации эффектыa


Можно указать целый ряд различных, но часто взаимосвязанных свойств белков, которые изменяются под воздействием перечисленных в табл. 3.9 физико-химических факторов. К внешним проявлениям денатурации белков относится изменение таких их свойств, как растворимость, тенденция к образованию гелей или к кристаллизации, а также нарушение биологической активности (каталитической активности, способности связывать антитела) растворов белков. Точно так же, как при денатурации важно прежде всего совместное действие различных факторов, так и в сопровождающих денатурацию эффектах главнейшую роль играет не каждый эффект в отдельности, а их комбинация. Например, если фермент выделяют осаждением, то существенно, чтобы условия осаждения не вызывали необратимой потери активности фермента.
3.7.2. Моделирование и кинетика процессов инактивации
В простейшей модели инактивации молекулы активного фермента (Еa) претерпевают необратимые структурные или химические изменения, приводящие к неактивной форме (Еi):
Ев → Е, (3.75)
Скорость этой реакции rd пропорциональна концентрации активной формы фермента:
rd=kdea (3.76)
Следовательно, в закрытой системе при эффективном перемешивании (примем, что в реакционной смеси нет ни субстрата, ни продукта реакции, ни ингибитора, ни иного эффектора) изменение концентрации активной формы фермента во времени будет описываться уравнением
![]()
так что
![]()
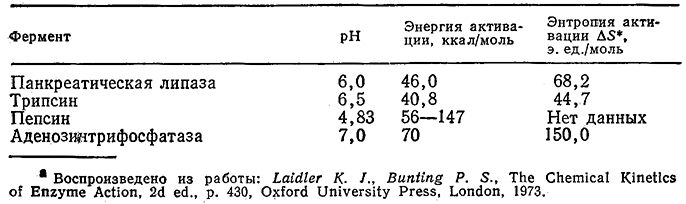
С этим выражением согласуются, в частности, приведенные на рис. 3.27 экспериментальные данные по определению активности аденозинтрифосфатазы в различных условиях. Зависимость константы инактивации ka от температуры может быть описана теорией переходного состояния [например, уравнением (3.72) при а=1] в форме, несколько отличающейся от уравнения Аррениуоа [уравнение (3.66)] для узкого температурного диапазона, представляющего интерес для биологических си-стем. В табл. 3.10 приведены величины энергии активации Е и энтропии ΔS* для денатурации ряда распространенных ферментов. Как видно из приведенных в таблице данных, для процессов денатурации белков характерны очень большие энергии активации.
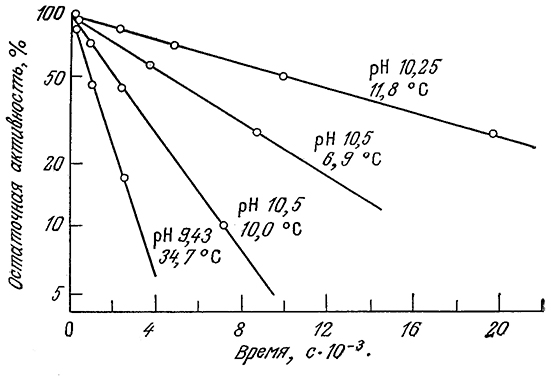
РИС. 3.27. Зависимость инактивации аденозинтрифосфатазы от времени при различных рН и температуре.
В отсутствие ферментативной активности жизнедеятельность клетки невозможна. В некоторых случаях клетка погибает уже после разрушения очень небольшой части внутриклеточных ферментов. В этой связи становится понятным, почему для стерилизации (т. е. для уничтожения всех форм микроорганизмов) газов, жидкостей или твердых тел можно использовать тепловую обработку. В гл. 7 мы узнаем детальнее, почему лишь немногие ферменты (и соответственно немногие микроорганизмы) способны без вреда для себя переносить длительное нагревание.
Данные об инактивации ферментов обычно получают, выдерживая фермент некоторое время в вызывающих денатурацию условиях без субстрата, после чего действие денатурирующих факторов снимают, создают некоторые стандартные условия, добавляют субстрат и определяют активность по начальной скорости ферментативной реакции. В присутствии субстрата скорость инактивации фермента может существенно отличаться от скорости, определенной описанным выше путем» если, например, свободный фермент и фермент-субстратный комплекс (или комплекс фермента с продуктом реакции) инактивируются с различными скоростями или если субстрат и (или) продукт реакции сами инициируют инактивацию фермента. Одну из возможностей анализа таких систем мы покажем на простом примере. Допустим, что связывание субстрата с ферментом стабилизирует последний (подобный эффект в известной степени действительно наблюдался в ряде систем). Таким образом, в нашем примере инактивации будет подвергаться только свободный фермент.
Таблица 3.10. Энергия активации и энтропия денатурации ферментова
Комбинируя такую модельную систему инактивации с простой последовательностью элементарных реакций Михаэлиса и Ментен [уравнение (3.4)], получим
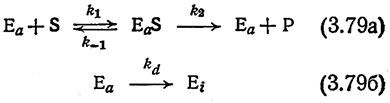
Если мы далее достаточно обоснованно допустим, что процесс инактивации происходит значительно, медленнее, чем реакции (3.79а), то, привлекая приближение квазистационарного состояния для комплекса (EαS), получим следующее выражение для скорости реакции:
![]()
где еtot,α – общая концентрация активного фермента как в свободной форме, так и в виде комплекса. Скорость изменения еtot,α выражается уравнением
![]()
Возвращаясь к расчетам кинетики квазистационарного состояния, применявшимся при выводе уравнения (3.80), мы можем выразить еα через еtot,α и параметры каталитической реакции; тогда уравнение (3.81) приобретет такую форму:
![]()
(3-82>
Из уравнений (3.80) и (3.82) следует, что скорости превращения субстрата и инактивации фермента взаимосвязаны. В частности, скорость инактивации фермента зависит от концентрации субстрата. С другой стороны, если Еα и (EαS) инактивируются с одинаковыми скоростями, то в условиях ферментативной реакции активность фермента будет снижаться точно так же, как и в отсутствие субстрата.
Обобщая эти рассуждения, нетрудно прийти к выводу, что вследствие различия в скоростях инактивации разных форм фермента (свободного фермента, разнообразных комплексов, ионизированных состояний и т. д.) скорость общей реакции зависит от любого параметра (концентраций субстрата и ингибитора, рН и т. д.), влияющего на относительные количества разных форм фермента. В частности, для описания сложной зависимости скорости инактивации от рН была разработана следующая модель:
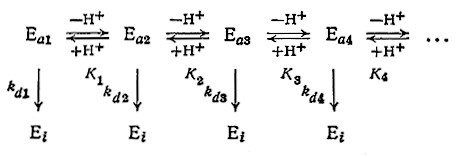
На рис. 3.28 в качестве примера такого сложного процесса изображена зависимость скорости инактивации рицина от рН (рицин не является ферментом; содержание активной формы белка определяли путем измерения растворимой фракции белка). Для некоторых других белков также наблюдался минимум скорости инактивации при определенном значении рН.
Снижение ферментативной активности во времени не всегда соответствует реакции первого порядка, т. е. уравнению (3.78). Для ряда белков найдены нелинейные зависимости логарифма активности от времени, иногда на соответствующих кривых имеется по два различных прямых участка (рис. 3.29, а). Для объяснения и анализа таких систем предложен ряд моделей. Одна из них, включающая параллельные обратимую и необратимую инактивации, нашла применение при объяснении и анализе снижения активности некоторых ферментов:
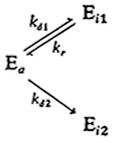
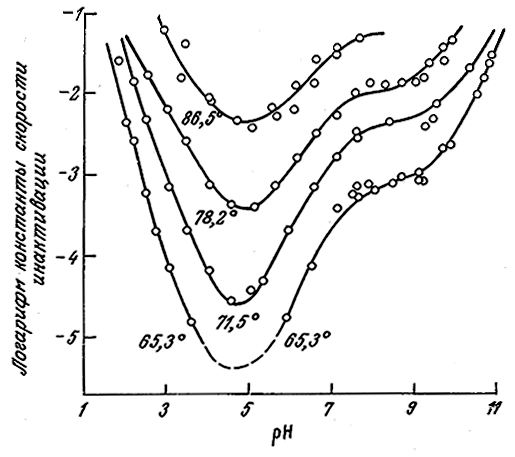
РИС. 3.28. Зависимость константы скорости реакции первого порядка
инактивации рицина от температуры и рН.
В частности, эта модель, предполагающая кинетику первого' порядка для каждой из указанных элементарных реакций, успешно использовалась для интерпретации 'результатов изучения инактивации люцифер азы, приведенных на рис. 3.29, а. Кривая процесса инактивации при 45 °С, например, была получена расчетным методом с помощью параметров- kd1=kd2 = 1,02 и kг = 0,02 ч–1.
Потеря активности в растворах протеаз представляет собой- более сложный процесс, поскольку протеазы катализируют реакцию собственного гидролиза. Эта особенность (автолиз) должна учитываться и в соответствующей модели инактивации. Приведенная ниже модель инактивации протеазы а-химотрипсина является вариантом модели (3.83), дополненной стадией автолиза:
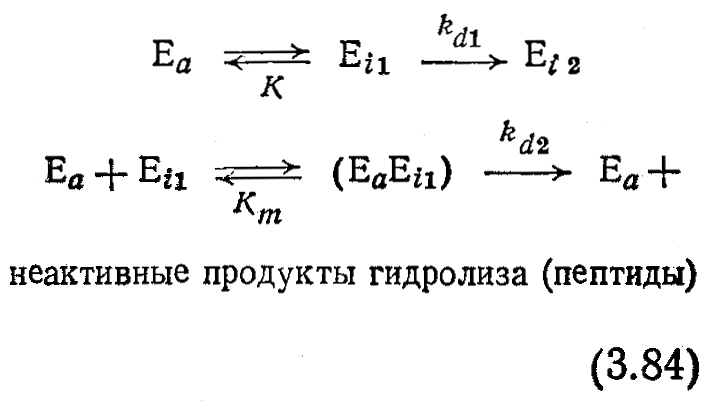
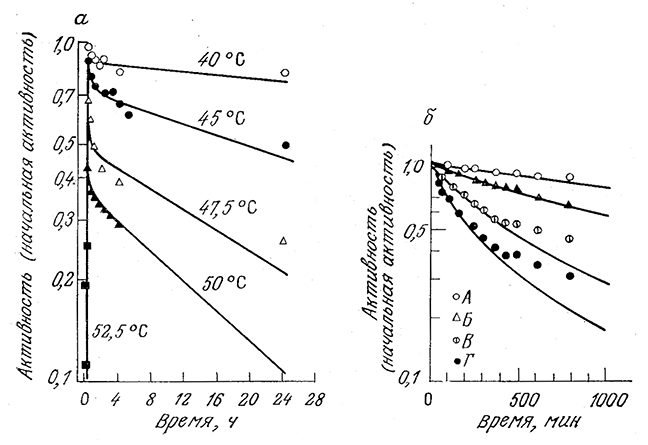
РИС. 3.29. а–инактивация препарата люциферазы при рН 6,8 и указанной температуре.
б–инактивация а-химотрипсина в растворе при рН 7,8, температуре 40 °С, концентрации Са2+ 10–3 М
и начальной концентрации фермента 7,3•10–7 М (A), 3,65•10–6 М (Б), 1,46•10–5 М (В) и 2,92•10–5 М (Г).
Некоторые особенности этой последовательности реакций были подтверждены химическими методами. Обратите внимание, в -частности, на то, что только обратимо инактивированная форма Еi1 этого очень хорошо изученного фермента способна подвергаться атаке и гидролизу активной формой протеазы Еα. Более глубокий анализ этой модели и ее применение для расчета кривых, изображенных на рис. 3.29, б, предлагается в упражнении 3.14.
Завершая обзор кинетики инактивации ферментов, следует упомянуть о подходах к анализу необратимых реакций инактивации ферментов ядами. В простейшем случае имеем
Еα+яд → Ed rd = kd•eα-(яд) (3.85)
Поскольку, однако, яды часто действуют на активный центр фермента, доступ к которому может быть блокирован связанным с ферментом субстратом, то в присутствии последнего ход анализа следует опять-таки видоизменить. Очевидно, нам нужно рассматривать процессы катализа, например, реакцию (3.79а), и отравления фермента (3.85) совместно, причем в последнем уравнении Ев будет обозначать свободный, не связанный в комплекс фермент. Подобные видоизмененные модели, которые мы не будем здесь рассматривать, могут быть созданы и для процессов инактивации, описываемых уравнениями (3.83) и (3.84).
3.7.3. Денатурация ферментов
под действием механических факторов
Механические воздействия могут нарушить сложную геометрию молекул ферментов вплоть до их полной денатурации. К числу таких воздействий относятся и гидравлические силы, возникающие при движении потока жидкости. Эксперименты позволяющие оценить влияние сдвига на ферментативную активность, проводились путем истечения через капилляр и с помощью вискозиметра с коаксиальными цилиндрами.
Обозначим символами 0 и ϒ время воздействия сдвига и его скорость соответственно (в случае истечения через капилляр под ϒ подразумевается усредненная по поперечному сечению капилляра скорость). Изучение индуцированной сдвигом денатурации; каталазы и уреазы показало, что потеря активности определяется произведением параметров 0ϒ (рис. 3.30, а). Результаты этих экспериментов еще раз свидетельствуют о том, что степень- инактивации фермента обусловливается сочетанием интенсивности денатурирующего фактора и времени его действия. В то же время изучение лактатдегидрогеназы показало, что инактивация этого фермента в потоке определяется напряжением сдвига, а не его скоростью.
Приведенные на рис. 3.30,6 данные убедительно свидетельствуют о частичной обратимости процесса индуцированной сдвигом инактивации уреазы. Кривая А отражает скорость превращения субстрата (мочевйны) в заторможенном растворе уреазы, а кривая Б получена путем определения скорости той же реакции в вискозиметре с коаксиальными цилиндрами при скорости сдвига 1717 с-1. Очевидно, что движение жидкости сопровождается снижением активности фермента. Другие точки на рис. 3.30. б были определены после снятия гидравлического воздействия различной продолжительности. В этих случаях ферментативная активность после снятия сдвигового усилия сразу же начинает возрастать, но прежнего уровня не достигает. Остаточное различие в активности было объяснено частичной необратимой инактивацией.
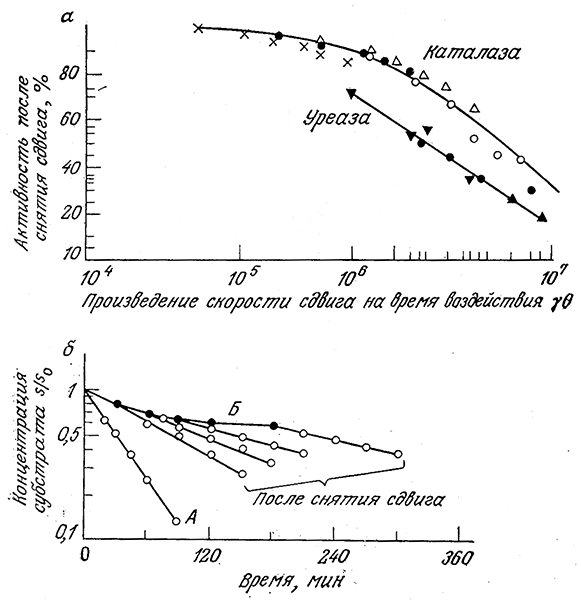
РИС. 3.30. а–инактивация каталазы и уреазы под воздействием сдвига (здесь различными символами обозначены разные скорости сдвига),
б – конверсия мочевины раствором уреазы в состоянии покоя (А), под воздействием сдвига (скорость сдвига 1717 см–1) (Б) и через разные периоды времени после снятия сдвига (0,4 единицы уреазы в 1 мл раствора, рН 6,75, 23 °С).
Характерная для ферментов чувствительность к механическим воздействиям может налагать определенные ограничения на допустимую величину гидравлического усилия в ферментных реакторах, в которых для повышения скорости массопередачи субстрата используется перемешивание, или в системах ультрафильтрации растворов ферментов, когда повышение пропускной способности мембраны сопровождается увеличением напряжения сдвига и растяжения непосредственно перед мембраной и сразу после нее.
Денатурацию белков и, следовательно, инактивацию ферментов часто вызывает и другое механическое воздействие – поверхностное натяжение. Поскольку поверхностное натяжение на границе раздела между воздухом и чистой водой составляет 80 дин/см, пенообразование обычно вызывает денатурацию белков, адсорбированных на границе раздела фаз. Граница раздела между двумя жидкими фазами характеризуется значительно более низким поверхностным натяжением; считается, например, что плазматическая мембрана клетки имеет поверхностное натяжение порядка 1 дин/см или даже меньше. Очевидно, низкие поверхностные натяжения не инактивируют ферменты, поскольку, как хорошо известно, в таких плазматических мембранах существуют многие активные белки. Пенное фракционирование представляет собой метод разделения, основанный на концентрировании выделяемого вещества на границе раздела фаз поверхностно-активное вещество – воздух; в этих условиях белки не денатурируют, так как поверхностно-активное вещество снижает поверхностное натяжение в системе вода – воздух до величин порядка 1 дин/см.
В технологических процессах и иногда в лабораторных экспериментах на скорость инактивации ферментов одновременно влияют различные механические и химические факторы, например окисление. Сложная природа проявления этих взаимозависимых факторов хорошо освещена в работе Томаса и Даннилла, в которой, в частности, тщательное изучение влияния сдвига на те же ферменты (см. рис. 3.30) привело к иным результатам и показало, что один только сдвиг вызывает незначительную инактивацию ферментов. Кроме упоминавшихся факторов на инактивацию ферментов могут оказывать влияние расширяющиеся потоки, кавитация, локальный адиабатический нагрев, следы металлов и поверхностная денатурация в полостях. Более подробные сведения о проблеме денатурации читатель может найти в приведенной в конце главы литературе. Нам же достаточно запомнить одно общее правило: если фермент in vitro на-ходится по существу в такой же среде и в таких же условиях, как и in vivo, он будет активен. При изменении любого из параметров, характерных для естественных условий существования фермента, появляется вероятность его инактивации.
Это правило находит многочисленные применения в биохимической технологии. Так, если нам нужен фермент, активный при экстремальных значениях рН или температуры, то целесообразно прежде всего попытаться найти организм, для которого эти экстремальные условия являются нормальными. Часто такой организм содержит ферменты, способные эффективно функционировать именно в таких необычных условиях. Показательным примером может служить обнаружение продуцируемых микроорганизмами ферментов, обладающих устойчивостью в щелочных средах; эти ферменты успешно применяются в качестве добавок к стиральным порошкам, растворы которых обычно имеют рН 9,0–9,5.
3.7.4. Методы стабилизации ферментов
Помимо поиска более устойчивых природных форм существует ряд методов повышения стабильности уже известных ферментов. Эти методы можно разделить на три основные группы:
а) добавление стабилизирующих веществ к среде, в которой хранится фермент или проводится ферментативная реакция;
б) химическая модификация растворимого белка;
в) иммобилизация белка на поверхности либо во всем объеме нерастворимого твердого носителя или матрицы. В нашем кратком обзоре основное внимание будет уделено первым двум методам стабилизации, а иммобилизацию и ее влияние на устойчивость белков мы обсудим в следующей главе.
К веществам, повышающим устойчивость белков, относятся субстраты, органические растворители и соли. Поскольку активный центр фермента часто представляет собой одновременно и наиболее лабильный участок его молекулы, то присутствие субстрата может стабилизировать фермент путем закрепления части молекулы белка в виде фермент-субстратного комплекса. С другой стороны, известны случаи дестабилизации ферментов соответствующими субстратами. Растворители типа многоатомных спиртов, стабилизирующие некоторые ферменты, возможно, повышают устойчивость внутримолекулярных водородных связей белка.
При низких концентрациях солей (<0,1 М) ряд катионов, например, Са2+, Zn2+, Mn2+, Fe2+, Мо2+ и Сu2+, специфично взаимодействуют с особыми ферментами, называемыми металлофер- ментами. Некоторые из перечисленных катионов являются кофакторами, и их присутствие стабилизирует фермент. Катион Са2+ участвует в стабилизации третичной структуры ряда белт ков. Образуя ионные связи с двумя различными аминокислотными остатками, ионы Са2+ могут выполнять функцию стабилизирующего мостика аналогично дисульфидным связям.
Примеры влияния различных веществ на стабильность ферментов приведены в табл. 3.11. Следует подчеркнуть, что влияние данного вещества или фактора на стабильность какого-либо фермента не всегда означает, что это вещество или фактор будут таким же образом действовать и на другие ферменты. С другой стороны, стабилизирующий эффект часто проявляетсятолько при определенном сочетании состава раствора и температуры; например, добавление небольших количеств ряда солей стабилизирует ферменты, а более высокие концентрации тех же солей обычно вызывают их денатурацию. Это правило относится и к органическим растворителям.
Таблица 3.11. Примеры методов стабилизации ферментов

Для повышения стабильности ферментов сравнительно успешно использовался также такой важный инструмент биохимических исследований, как химическая модификация белков. В одном из вариантов этого метода модификации подвергают боковые цепи остатков некоторых аминокислот, например, путем ацилирования, восстановительного алкилирования или конденсации аминогрупп нативного белка с боковыми цепями полиаминокислот.
Другой вариант химических методов стабилизации белков основан на применении бифункциональных реагентов, например, глутарового альдегида. Такие реагенты образуют поперечные связи между аминогруппами белка и тем самым, во-первых, затрудняют доступ протеаз к белку и, во-вторых, могут закреплять активную конформацию белка. Для химической стабилизации могут применяться и диимиды, связывающие поперечными амидными связями' аминные и карбоксильные группы. Эти реагенты и соответствующие реакции мы рассмотрим подробнее в ходе изучения их применения для иммобилизации ферментов.

