Катализируемые гидролитическими ферментами реакции лежат в основе не только таких очевидных макроскопических процессов, как порча пищевых продуктов, ожижение крахмала или обработка сточных вод, но и в химии процессов дозревания неспелых плодов, лизисе (автолизе) отмерших клеток, созревания мяса, производства сыра, предотвращении образования осадка в пиве, текстурировании кондитерских изделий, обработке ран или расшлихтовке текстиля. Настоящий раздел будет посвящен изучению ферментов, применяемых в указанных и других производствах, а также источников их выделения.
В табл. 4.2 приведена общая классификация важнейших гидролитических ферментов. Три основные группы гидролаз расщепляют сложноэфирные, гликозидные и различные связи с участием атома азота соответственно. Широко применяется и более детальная классификация ферментов внутри каждой из этих трех групп. Для наших целей достаточно указать, что, например, некоторые ферменты катализируют гидролиз самых разнообразных гликозидных связей, а другие могут расщеплять только один-единственный олигомер глюкозы. Таким образом, название фермента само по себе еще не определяет его субстратную специфичность.
Здесь следует еще раз подчеркнуть, что названия большинства ферментов связаны с катализируемыми ими реакциями, а не с их химической структурой1. Поскольку в этом случае не существует правила «один фермент – одна реакция», то катализирующие одну и ту же реакцию ферменты, выделенные из различных растительных или животных источников, не всегда будут иметь одну и ту же структуру, и поэтому кинетика соответствующих реакций также может быть различной. Отсюда следует, что максимальная скорость реакции, константа Михаэлиса, рН оптимума стабильности и активности и другие свойства фермента будут определяться его природой и, следовательно, источником его выделения.
__________________
1. Классификация ферментов в соответствии с рекомендациями Комиссии по ферментам приведена в табл. 3.1. Более подробно вопросы классификации ферйентов изложены в книге: Диксон М., Уэбб Э., Ферменты, т. 1–3, гл. 5, М.: Мир, 1982.
Таблица 4.2. Гидролитические ферментыа

Многие гидролазы компартментализованы в тех или иных структурных элементах клетки, отделенных от цитоплазмы мембранами. Очевидно, что такая локализация гидролаз защищает важные биополимеры цитоплазмы от деструкции. Грамположительные бактерии выделяют в среду множество гидролаз. У грамотрицательных бактерий надежным хранилищем для различных гидролаз служит ограниченное двумя мембранами пери- плазматическое пространство наружной оболочки. В клетках эукариот гидролазы могут локализоваться в ограниченных мембраной особых органоидах – лизосомах, в периплазме (в микроорганизмах типа дрожжей) или выделяться в среду. Большинство используемых в промышленности гидролитических ферментов представляет собой внеклеточные продукты жизнедеятельности микроорганизмов.
В то же время некоторые гидролазы обнаружены и в цитоплазме. Здесь они участвуют в метаболических циклах и тем самым выполняют важную функцию, помогая клетке полностью использовать ее внутренние ресурсы. Внутриклеточные гидролазы играют большую роль в методах генетической инженерии (гл. 6).
Поскольку вода является универсальным субстратом, концентрация которого составляет около 55 М, и поскольку гидролитические ферменты обычно катализируют реакции деградации, например, превращение крахмала в сахара, белков в полипептиды, липидов в глицерин, жирные кислоты и фосфат, то основой для последующего изложения нам послужат различные типы полимерных субстратов. Следует отметить, однако, что в некоторых разработанных недавно методах синтеза полипептидов в средах с низким содержанием воды природные протеазы использовались в качестве конденсирующих агентов. Очевидно, в специфических условиях протеазы могут иногда катализировать и обратную реакцию синтезу.
4.1.1. Гидролиз крахмала и целлюлозы
Находящие широкое применение амилазы представляют собой ферменты, которые гидролизуют гликозидные связи в крахмале и родственных полимерах глюкозы. Чтобы понять различие между двумя основными типами амилаз, мы должны вспомнить, что крахмал состоит из линейных полимеров глюкозы, называемых амилозой, и разветвленного полимера (амилопектина). Последний значительно более растворим по сравнению с амилозой и способен резко повышать вязкость растворов крахмала. При обработке а-амилазой вязкость растворов снижается за счет неупорядоченного разрыва любых α-1,4-гликозидных связей; по этой причине а-амилазу часто называют разжижающим крахмал ферментом1. Напротив, β-амилаза может атаковать α-1,4-связи только на невосстанавливающих концевых участках полимерной цепи, поэтому при гидролизе линейных полимеров этим ферментом всегда образуется мальтоза. По этой причине β-амилазу называют также осахаривающим ферментом. При обработке крахмала β-амилазой в конечном итоге образуется смесь мальтозы и декстринов, представляющих собой фрагменты молекул крахмала с концевыми 1,6-связями. Эти связи β-амилаза не гидролизует.
Другой осахаривающий фермент, амилоглюкозидаза (имеющая много других названий, в том числе глюкоамилаза), атакует прежде всего невосстанавливающие концевые α-1,4-связи крахмала, гликогена, декстринов и мальтозы; амилоглюкозидаза гидролизует также α-1,6-связи, но со значительно меньшей скоростью. Если целью процесса является получение глюкозы, а не мальтозы, то применяют смесь ферментов или последовательную обработку α-амилазой и глюкоамилазой; такие процессы применяются на спиртоводочных заводах (в отличие от пивоваренных предприятий), в производстве концентрированных растворов глюкозы (кукурузной патоки) и кристаллической глюкозы. Подсчитано, что в 1971 г. в США таким методом было получено 0,61 млрд. кг глюкозы. Использование амилаз в производстве глюкозы и других областях (табл. 4.3) обусловливает очень большую практическую значимость этих ферментов. Относительные количества α - и β-амилаз, применяемые в каждом конкретном случае, определяются конечной целью процесса.
_____________________
1. По-видимому, а-амилаза неспецифично разрывает гликозидные связи только в субстратах с достаточно длинной полимерной цепью; в случае более коротких олигомеров наблюдается известная специфичность.
Таблица 4.3. Области наиболее широкого применения амилазных ферментова

Амилазы получают из самых различных источников. Это и неудивительно, поскольку крахмал представляет собой обычную форму резервного углевода для самых различных форм жизни. Амилазы продуцируются рядом бактерий и плесеней; в качестве примера практически важного фермента можно привести амилазу из Clostridium acetobutylicum – микроорганизма, участвующего в микробиологическом превращении полисахаридов в бутанол и ацетон. Препараты амилазы, используемые человеком для пищевых целей, обычно получают из зерновых культур, в первую очередь из ячменя, пшеницы, ржи, овса, кукурузы, сорго и риса. В амилазах зерна отношение осахаривающей и разжижающей ферментативных активностей зависит не только от типа растения, но и от состояния зерен, в первую очередь от того, проросли ли зерна или нет. В производстве солода (размягченных проросших зерен ячменя), применяемого в пивоварении, непроросшие зерна ячменя хранят в условиях высокой влажности и соответствующей температуры, способствующих их быстрому прорастанию, причем одновременно в них возрастает содержание а-амилазы. Затем проросшие зерна медленно высушивают в печи; в сухом препарате амилазная активность не проявляется, но ферменты не подвергаются необратимой инактивации. Обладающий огромной гидролитической активностью высушенный и измельченный солод используют затем для превращения крахмала в сахара, которые впоследствии могут быть переработаны путем дрожжевого брожения.
Другие перечисленные в табл. 4.1 карбогидразы также расщепляют гликозидные связи. Сообщалось, например, что комбинированное применение пуллуланазы, которая селективно расщепляет 1,6-гликозидные связи боковых цепей, и амилазы повышает выход глюкозы из крахмала. В производстве мороженого обычно используют лактазу, расщепляющую лактозу на более сладкие моносахариды глюкозу и галактозу. Родственный фермент инвертаза гидролизует сахарозу и полисахариды, содержащие β-D-фруктофуранозильные связи. Свое название этот фермент получил после того, как было установлено, что гидролиз сахарозы в растворах и образование глюкозо-фруктозного раствора сопровождается изменением направления вращения плосжости поляризации света. Частично или полностью гидролизованный раствор сахарозы обладает двумя ценными для кондитерской промышленности качествами – он несколько более сладок, чем исходный раствор, и не кристаллизуется при упаривании до значительно более высоких концентраций.
Изучению ферментативного гидролиза целлюлозы посвящено очень много работ, проводившихся в различных странах. Прежде чем приступить к изложению этой темы, следует подчеркнуть, что ферментные препараты, используемые для деполимеризации целлюлозы и обычно называемые целлюлазой, представляют собой сложную смесь многих ферментов. Более того, природа входящих в состав целлюлазы ферментов и их относительные количества зависят от типа микроорганизма, из которого была выделена целлюлаза, а в некоторых случаях и от процесса получения ферментного препарата. Как мы уже упоминали в гл. 2 при обсуждении структуры лигноцеллюлозы, вся биомасса и промышленные отходы различных производств различаются по ряду свойств, в том числе по степени кристалличности и удельной поверхности, а также по химическому составу. Некоторые методы предварительной обработки позволяют модифицировать эти субстраты и тем самым снизить их устойчивость к гидролизу. Таким образом, скорость гидролиза целлюлозных материалов и выходы продуктов в каждом конкретном процессе зависят от совокупности нескольких факторов: во-первых, от природы и свойств субстрата, во-вторых, от результатов предварительной обработки и, в-третьих, от степени активности и специфичности индивидуальных ферментов, входящих в состав целлюлазы.
В настоящее время наиболее тщательно изучены и охарактеризованы целлюлазные системы, продуцируемые грибами Trichoderma. Как показано на рис. 4.1, в состав этих систем входят три типа ферментов, действующих на различные субстраты и образующих различные продукты реакции. На этом же рисунке указаны пути ингибирования индивидуальных ферментов по принципу обратной связи. Кинетика каждой стадии этой сложной системы реакций подчиняется уравнению Михаэлиса – Ментен со строго конкурентным или неконкурентным ингибированием. Целлюлазы с различными свойствами и активностями продуцируют и многие другие микроорганизмы, в том числе. плесени Fusarium solatii, Aspergillus niger, Penicillium funicolsum, Sporotrichum pulverulentum, Cellulomonas sp., Clostridium thermocellum и Clostridium thermosaccharolyticum.
В табл. 4.4 приведены дополнительные сведения о целлюлаз- ной системе из Т. viride. Обратите внимание на то, что для определения специфических активностей применяются различные «стандартные» субстраты. Немаловажны и размеры молекул ферментов, сравнимые с размерами микрофибрилл природной целлюлозы. Скорость гидролиза зависит главным образом от степени кристалличности целлюлозы. Соответствующие выражения, описывающие кинетику гидролиза с учетом степени кристалличности, мы опишем ниже, в примере 4.1; сейчас же вкратце обсудим химические и физические методы предварительной обработки лигноцеллюлозных материалов.
Таблица 4.4. Свойства различных типов ферментов в целлюлазной системе Т. virideа
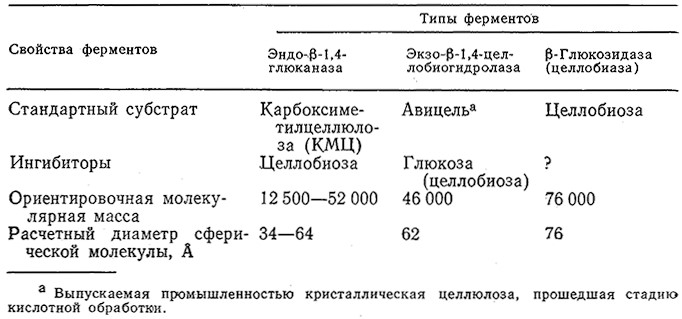
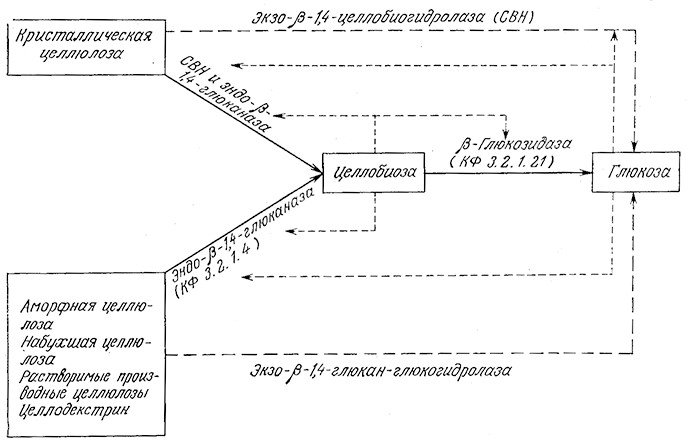
РИС. 4.1. Схема взаимодействия субстратов, целлюлаз и продуктов реакции в ходе биологической деградации целлюлозы →
основная реакция; → побочная реакция; → эффекты ингибирования
Изучение методов химической обработки древесины дает представление о влиянии лигнина на устойчивость целлюлозных материалов к ферментативному гидролизу. В бумажной промышленности для растворения лигнинов и пектинов измельченную древесину подвергают сульфитной варке (обработке водным раствором гидросульфита, содержащим свободный SO2) или сульфатной варке (обработке водным раствором NaOH и Na2S) при повышенных температуре и давлении (крафт-процесс). Путем такой обработки четырех различных пород древесины в различных условиях были получены целлюлозные массы с различным содержанием лигнина, которые затем были обработаны серной кислотой для гидролиза веществ целлюлозной природы. Результаты этого эксперимента (рис. 4.2) наглядно показывают, что способность целлюлозы к гидролизу в первую очередь зависит от количества оставшегося лигнина. Для разрушения лигнина применяют и другие методы, в том числе обработку газообразным SO2, минеральными кислотами и специфическими ферментами, которые продуцируются рядом грибов, например Sporotrichufn pulverulenium и Pleurotus ostreatus.
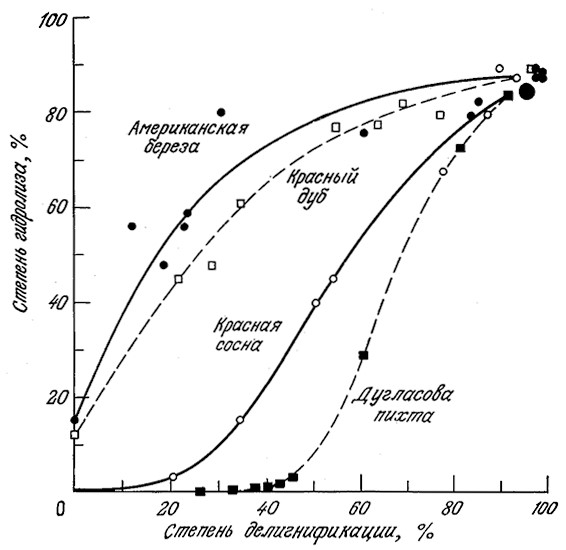
РИС. 4.2. Результаты экспериментального изучения влияния степени делигнификации
на гидролизуемость целлюлозы из четырех различных пород древесины.
Структуру целлюлозы, в том числе такие ее характеристики, как степень кристалличности, удельная поверхность, степень полимеризации, можно изменить с помощью предварительной обработки, например путем размола па шаровой или роликовой мельнице, у-облучения, пиролиза, обработки кислыми или щелочными реагентами. В качестве примера рассмотрим кинетику изменения степени кристалличности целлюлозы при кислотной обработке древесины; сведения об изменении других свойств- целлюлозы читатель может найти в приведенной в конце главы литературе.
Как показано на рис. 4.3, а, влияние предварительной обработки на кристалличность лучше всего контролировать методом рентгеноструктурного анализа. Последний позволяет определить, параметр, называемый индексом кристалличности (CrI) и рассчитываемый по эмпирическим формулам; в нашем случае (рис. 4.3, а) эта формула имеет следующий вид:
![]()
где I(am) (am – аморфный) и I(002) – интенсивности дифракции при 20=18,5 и 22,5° соответственно. Значения CrI не являются точной мерой содержания кристаллической фракции; тем не менее индекс Crl удобен для оценки изменения степени кристалличности и средних размеров кристаллитов в различных целлюлозных материалах. Приведенные на рис. 4.3, а экспериментальные данные наглядно показывают, что при многократной обработке на роликовой мельнице степень кристалличности целлюлозы снижается.
РИС. 4.3. Изменение характера дифракции рентгеновского излучения целлюлозой типа авицель после
многократных пропусканий через двухроликовую мельницу (на. кривых указано число пропусканий) (а);
после обработки целлюлозой из Т. reesei (на кривых указано время инкубирования в часах) (б).
Для расчета индекса кристалличности CrI использовались интенсивности при углах дифракции 20 = 18,5 и 22,5°.
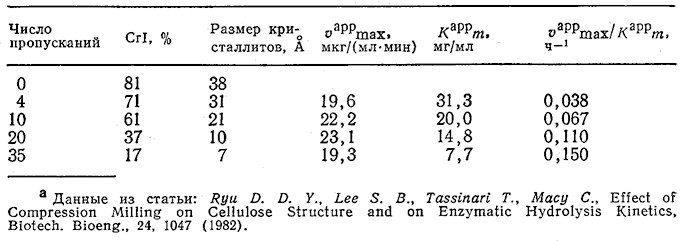
Ранее, при обсуждении структуры целлюлозы и активности целлюлазных ферментных систем, мы уже упоминали, что скорость гидролиза аморфных и паракристаллических участков- целлюлозы должна быть выше скорости гидролиза кристаллической целлюлозы. Отсюда следует, что снижение степени кристалличности целлюлозы должно сопровождаться повышением: скорости ее ферментативного гидролиза. Действительно, такая зависимость была обнаружена, в частности, при изучении гидролиза тех же целлюлозных материалов, которые исследовались в эксперименте, изображенном на рис. 4.3, а, под действием суммарного препарата целлюлаз из Trichoderma reesei MCG-77 (табл. 4.5). В табл. 4.5 приведены кажущиеся средние значения параметров в обычном уравнении Михаэлиса – Ментен; их определяли, допустив, что при измерении начальной скорости реакции целлобиоза в смеси отсутствовала.
Таблица 4.5. Влияние числа пропусканий через роликовую мельницу на кристаллическую структуру целлюлозы
типа авицель и средние кинетические параметры ее гидролиза под действием целлюлозы из Т. reeseia
Расчеты изменения скорости ферментативного гидролиза целлюлозных материалов во времени осложняются тем обстоятельством, что в ходе таких процессов меняется также относительное содержание кристаллической и аморфной фракций субстрата (рис. 4.3, б). В приведенном ниже примере мы рассмотрим модифицирование принципов моделирования, изложенных в гл. 3, в применении к системам такого рода.
В завершение этого обзора, посвященного проблеме использования целлюлозы, следует упомянуть, что существуют и другие физические и химические методы деградации целлюлозы. Так, в последние годы были разработаны усовершенствованные процессы кислотного гидролиза целлюлозы, отличающиеся применением более высоких температур и сокращенным временем обработки и позволяющие получать необходимые продукты деградации при минимальном количестве побочных веществ. Другой многообещающий метод переработки целлюлозы базируется на ее пиролитической деградации. Изучаются, разрабатываются или уже применяются также методы переработки лигноцеллюлозы, основанные на шнековой экструзии, обработке гетерогенными катализаторами, газификации в цсевдоожиженном слое и на самом старом способе переработки путем сжигания.
4.1.2. Протеолитические ферменты
Существует множество ферментов, селективно атакующих азотсодержащие соединения, особенно белки. Эти ферменты находят и разнообразные практические применения. Как и амилазы, протеазы разделяются на ферменты, гидролизующие концевые группы (экзопептидазы), и ферменты, расщепляющие внутренние пептидные связи (эндопептидазы).
Поскольку ферменты, эти важнейшие катализаторы всех живых организмов, сами являются белками, неудивительно, что протеолитические ферменты часто синтезируются сначала в неактивной форме. Неактивная форма фермента или хранится в клетке, или транспортируется от места ее синтеза к тому центру, где этот фермент необходим в активной форме; в частности, в клетке транспортируются неактивные формы пепсина, трипсина, химотрипсина и карбоксипептидазы. Активация этих протеолитических ферментов осуществляется по одному из двух путей (рис. 4.4). Интересно отметить, что активация пепсина и трипсина происходит автокаталитически: неактивный предшественник фермента является субстратом для активной формы, поэтому в результате реакции образуется большее количество активной формы фермента. Интересен и тот факт, что после превращения неактивного трипсина или пепсина в активную форму дальнейшее автокаталитическое расщепление фермента не наблюдается. Для активации второй группы ферментов, обычно экзопептидаз, необходимы ионы одного или нескольких определенных металлов/Стандартный метод определения потребности ферментов и других компонентов клетки в ионах металлов заключается в изучении изменения активности раствора фермента в процессе диализа.
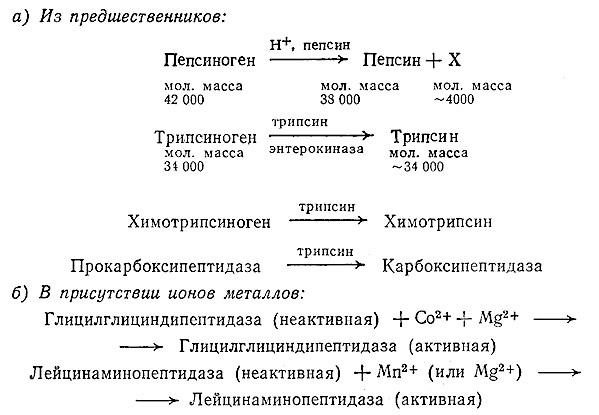
РИС. 4.4. Активация протеолитических ферментов, а – образование активных ферментов из предшественников;
б – образование активных ферментов в присутствии ионов металлов.
В промышленных масштабах протеазы выделяют из организмов животных (из поджелудочной железы), высших растений (из соков и латексов), а также из дрожжей, плесеней и бактерий. Некоторые из протеаз и области их применения перечислены в табл. 4.1.
Свободные протеазы применяются в основном в производстве моющих средств, в химической чистке, при мягчении мяса, в сыроделии (только реннин), дублении, извлечении серебра из фотографических пленок и бумаг, производстве препаратов, способствующих пищеварению, а также в медицине при лечении воспалительных процессов и вирулентных ран. В качестве добавок к моющим средствам ферменты применялись начиная уже с 1913 г., однако особенно резкий рост потребления протеаз в производстве детергентов наблюдался в конце 1960-х гг. Ферменты, способствующие удалению загрязнений белковой природы, представляют собой смесь нейтральной и щелочной бактериальных протеаз, активных в интервале рН от 6,5 до 10,0 при температурах от 30 до 60 °С. Наибольшего уровня производство ферментов для этих целей достигло в 1969 г., когда с ферментными добавками выпускалось 30–75% всех моющих средств в Западной Европе и 40% в США. Затем, однако, Федеральная комиссия по торговле США высказала опасение, что такие детергенты оказывают вредное воздействие на здоровье человека, и в 1970–1971 гг. производство бактериальных протеолитических ферментов резко сократилось. Последовавшее позднее снятие предупреждения Федеральной комиссии и внедрение усовершенствованных методов производства, при которых образование ферментных аэрозолей сводится к минимуму (путем «парафинирования»), способствовали частичному восстановлению спроса на бактериальные протеазы для детергентов. В 1980 г. в США таких протеаз было произведено на сумму около 6 млн. долл.
Различные методы мягчения разделанных мясных туш с помощью специальных агентов основаны на протеолитической активности относительно недорогих и устойчивых к действию тепла растительных протеаз папаина и бромелаина. Процесс «созревания» целых туш обычно проводят до их разделки и расфасовки путем контролируемого автолиза при температуре около 15 °С с одновременным облучением ультрафиолетом, который выполняет роль гермицидного препарата и предотвращает рост нежелательных микроорганизмов на поверхности туш.
Сырые ферментные препараты поджелудочной железы различных животных содержат все пищеварительные протеазы, в том числе трипсин, а также липазы и амилазы. Эти смеси, обладающие мощной гидролитической активностью, используются для обезволашивания (удаления волос) шкур животных и одновременного гидролиза других неколлагеновых белков. Поскольку пепсин гидролизует и коллаген (фибриллярный белок, являющийся основой кожного покрова животных), его нельзя применять при выделке кож.
В молочной промышленности широко применяется только один фермент – реннин. Реннин отщепляет гликопептид от растворимого казеината кальция и таким образом превращает его в относительно Малорастворимый параказеинат кальция, осаждающийся в виде творожного сгустка. Превращать казеинат кальция в параказеинат могут и другие протеазы, однако катализируемый ими протеолиз обычно на этом не останавливается, а поскольку продукты более глубокой деградации казеина обладают большей растворимостью, то творожный сгусток в этих условиях не образуется. Нехватка животного реннина стимулировала разработку методов получения аналогичных бактериальных ферментов, и последние уже применяются в сыроделии. Для получения реннина теленка с помощью микроорганизмов применяются также методы генетической инженерии.
Протеолитические ферменты применяются в медицине и клинической практике в качестве способствующих пищеварению средств, а также при лечении тяжелых ран. Поскольку ферменты представляют собой белки, то способствующие Пищеварению ферменты применяют только в капсулах, предохраняющих ферменты от кислой среды желудка, которая неминуемо вызвала бы их денатурацию. Из перечисленных в табл. 4.1 ферментов нет ни одного, который был бы выделен из организма человека. Введение протеаз животных человеку (а трипсин свиньи, например, отличается от трипсина человека) применяется также для подавления воспалительных процессов в тканях; реакция иммунной системы человека минимальна в случае высокоочищенных кристаллических препаратов ферментов. В отличие от живых мертвые клетки обычно не способны защищать себя от действия протеаз. На этом различии основано применение растворов протеаз для лечения вирулентных или сочащихся ран; протеазы способствуют размягчению омертвевшей ткани и клеток, облегчая тем самым дренаж ран и ускоряя их заживление.
Протеолитические ферменты, особенно трипсин, подавляют воспалительные процессы и опухоли, связанные с внутренними повреждениями и инфекциями. Их действие, вероятно, основано на растворении тромбов и осадков внеклеточных белков или на локальной активации других защитных систем организма, выполняющих те же функции, или на обоих этих факторах одновременно. Протеолитические ферменты тормозят развитие или полностью излечивают ряд тяжелых инфекционных заболеваний, приводящих к накоплению в легких слизи.
4.1.3. Применение эстераз
Ферменты этой группы расщепляют сложноэфирные связи с образованием спирта и кислоты или катализируют обратную реакцию:
![]()
Наиболее важной подгруппой эстераз являются липазы, гидролизующие жиры до глицерина и жирных кислот:
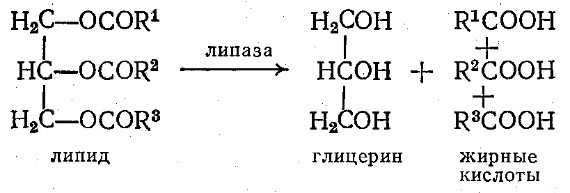
Панкреатическая липаза, выделяемая в пищеварительный тракт после нейтрализации желудочной кислотности, расщепляет непереваренные жиры до жирных кислот; при этом образуются и промежуточные продукты гидролиза – моно- и диглицериды. Как мы уже упоминали в гл. 3, нерастворимость высокомолекулярных жиров служит причиной того, что липазы проявляют заметный каталитический эффект только на границе раздела фаз вода – липид (см. рис. 3.33).
Специфичность липаз, также как и специфичность второй группы эстераз, называемых алиэстеразами, невысока. Липазы активны при гидролизе высокомолекулярных жиров и не действуют на жиры, построенные из карбоновых кислот с короткой углеводородной цепью. Последние, напротив, легко гидролизуются алиэстеразами, не активными по отношению к высокомолекулярным жирам. Активность липаз повышается в присутствии поверхностно-активных веществ (например, желчных кислот, которые стабилизируют высокую удельную поверхность жиров в эмульсиях) и ионов кальция, которые, очевидно, связывают образующиеся жирные кислоты путем осаждения или образования комплексов. Связывание жирных кислот выводит их из сферы реакции; в противном случае они действуют как ингибиторы.
В аэробных процессах очистки сточных вод, происходящих в природных условиях и применяющихся в методе активного ила (гл. 14), для поддержания необходимых форм жизни нужен постоянный приток достаточного количества кислорода. Поскольку транспорт кислорода; через жировые пленки затруднен, то на соответствующих установках приходится постоянно освобождать поверхность аэрируемых вод от таких пленок. Содержащую большое количество жиров собранную жидкость затем инкубируют с микроорганизмами, способными продуцировать внеклеточные липазы. Образование нефтяных или жировых пленок на больших площадях природных водоемов приводит к резкому снижению концентрации растворенного кислорода и таким образом к гибели всех микроорганизмов и более сложных форм жизни, не способных существовать в анаэробных условиях, если только эти организмы не могут пробиться через липидный слой.
В мясной промышленности путем обработки отрубов липазными препаратами, вызывающими частичный гидролиз жиров, можно производить относительно нежирные мясные продукты- В процессе переработки пищевых продуктов или бытовых и промышленных отходов водостоки иногда забиваются смесями нерастворимых веществ, содержащими белки, жиры и углеводы. Для предотвращения или ликвидации таких пробок успешно применяются смеси протеаз, различных карбогидраз и липаз.
Ко второй группе эстераз относят ферменты, называемые фосфатазами. Фосфатазы являются неотъемлемыми элементами внутриклеточных биосинтетических путей метаболизма, в которых используется химическая свободная энергия, высвобождающаяся при окислении клеточного топлива. Данные о практическом применении фосфатаз вне живых клеток отсутствуют.
4.1.4. Ферментные смеси, пектиновые ферменты
и другие пути использования ферментов
Вместо индивидуальных ферментов часто удобнее или целесообразнее использовать их смеси. Компоненты смеси могут принадлежать к одному и тому же типу α- и β-амилазы или трипсин и химотрипсин) или к разным классам ферментов (экстракты поджелудочной железы, представляющие собой смесь трипсина, липазы и амилазы). Так, использование специальных смесей различных амилаз позволяет повысить выход осахаренного крахмала, являющегося сырьем для производства спирта путем спиртового брожения, а смесь амилаз с меньшим содержанием β-амилазы, позволяющую понизить вязкость растворов крахмала без существенного осахаривания, целесообразнее применять, например, при расшлихтовке текстиля. Экстракты поджелудочной железы животных содержат смесь пищеварительных ферментов, которая способна выполнять многие функции ферментного комплекса панкреатической жидкости человека. По меньшей мере один препарат, выпускающийся в США в промышленном масштабе в качестве добавки к моющим средствам, содержит смесь бактериальных протеаз и амилаз; сообщалось, что этот препарат эффективнее протеаз при удалении некоторых типов загрязнений.
Окисление галактозы до галактуроновой кислоты с последующей поликонденсацией приводит к образованию полигалактуроновых кислот. Последние являются основным структурным элементом ряда природных материалов растительного происхождения, называемых пектинами. В пектинах карбоксильные группы часто этерифицированы до карбометоксильных. Фермент- пектинметилэстераза (пектинэстераза, гидролизующая пектаза) гидролизует карбометоксильные группы, а полигалактуроназы (пектиназы, пектолазы) расщепляют глнкозидные связи в пектинах. Основными источниками ферментов первого типа служат фрукты, а ферменты второго типа получают главным образом из грибов.
Пектиновые ферменты наиболее широко применяются в двух отраслях пищевой промышленности – в производстве соков и виноделии. После первичной переработки фруктов и овощей получаются очень вязкие соки, что вполне приемлемо для соков из томатов и цитрусовых, но часто нежелательно для яблочного и других соков. Путем контролируемого частичного гидролиза пектинов удается получить продукт с необходимой текучестью, но в то же время достаточно вязкий, чтобы не происходило осаждения нерастворимых веществ. В производстве яблочного сока применяют более глубокий гидролиз пектинов, благодаря чему облегчается последующее фильтрование, обеспечивающее необходимую прозрачность сока. Если в дальнейшем предполагается использовать соки в производстве желеобразных продуктов, то их обрабатывают только пектинэстеразой. Образующиеся полигалактуроновые кислоты затем желатинизируют ионами кальция.
Другой важной областью применения пектиновых ферментов является виноделие. Добавление смеси пектиновых ферментов к раздавленному винограду приводит к повышению выхода сока, более эффективному экстрагированию красящих веществ из кожуры, а также ускоряет процессы фильтрования и отжимки. Обработка пектиновыми ферментами уже перебродившего виноградного сока также дает положительный эффект, связанный с ускорением процесса отделения вина от дрожжей и осадка, повышением его прозрачности и стабильности (в основном за счет снижения концентрации суспендированных белков в готовом вине). Таким образом, как в первой, так и во второй области применения пектиновые ферменты способствуют главным образом достижению необходимой вязкости и фильтруемости полупродуктов, что положительно сказывается на экономичности процессов и на внешнем виде готовой продукции.
В будущем, возможно, пектиновые ферменты будут применяться и для обработки древесины хвойных пород. Свежесрубленная древесина таких пород, например, норвежской ели, не поддается пропитке химическими консервантами. Как оказалось, предварительная обработка пектиновыми ферментами улучшает проницаемость древесины и повышает таким образом эффективность химической пропитки.
В ограниченных масштабах применяются и другие гидролитические ферменты; кроме того, разрабатываются новые многообещающие процессы с использованием гидролаз (табл. 4.6).
Таблица 4.6. Перспективные или находящиеся в стадии разработки области применения гидролаз


