До сих пор основное внимание мы уделяли поведению ферментов в растворе, где и осуществляется их взаимодействие с растворенными субстратами. Однако, как мы уже указывали, такая ситуация не является единственно возможной. Так, на рис. 2.27, где схематически изображена прокариотическая клетка, было показано, что некоторые клеточные ферменты связаны с мембранами клетки. Аналогичные структуры имеются и в эукариотах; в митохондриях, например, со сложной системой внутренних мембран связаны ферменты, отвечающие за очень сложную последовательность реакций.
Как показано на рис. 3.31, в природе и в биохимической технологии возможны многие другие сочетания различных физических состояний фермента и субстрата. Здесь мы рассмотрим кинетику ферментативных реакций между растворами ферментов и нерастворимыми субстратами, а в следующей главе изучим реакции растворимых субстратов, катализируемые связанными с носителями ферментами.
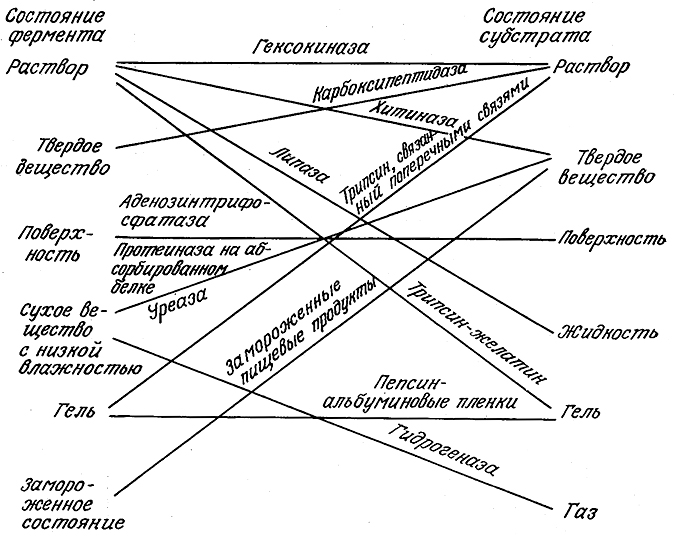
РИС. 3.31. Находящиеся в различных физических состояниях ферменты катализируют превращения
различных форм субстратов. Классический случай ферментативной реакции в растворе является
только одним из множества возможных вариантов фермент-субстратных взаимодействий.
Если субстрат одновременно может существовать в нескольких фазах, то иногда ферментативной реакции подвергается только та его часть, которая находится в растворе. Примером могут служить данные, приведенные на рис. 3.32. Поскольку все вещества в той или иной степени растворимы в воде, то небольшое количество субстрата всегда будет находиться в растворе и, следовательно, подвергаться действию фермента. В то же время скорость этого процесса может быть настолько мала, что с практической точки зрения он не будет представлять никакого интереса. Теперь рассмотрим некоторые примеры другого рода.
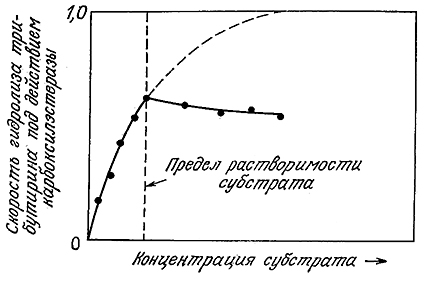
РИС. 3.32. Ферментативная реакция осуществляется только с растворенной формой субстрата.
Одним из таких примеров может являться реакция гидролиза метилбутирата под действием панкреатической липазы – фермента, образующегося в пищеварительном тракте человека и способного расщеплять жиры. В отличие от предыдущего примера здесь реакция не идет до тех пор, пока в реакционной смеси не сформируется нерастворимая форма субстрата в виде небольших капель (рис. 3.33). Очевидно, этот фермент способен проявлять свою активность только на границе раздела двух жидких фаз. Учитывая возможность денатурации фермента за счет поверхностного натяжения, интересно отметить, что, как и в случае упоминавшегося выше метода пенного фракционирования в присутствии детергентов, поверхностное натяжение на жировых каплях может существенно снизиться вследствие адсорбции желчных кислот – природных поверхностно-активных веществ, выделяемых в пищеварительный тракт.
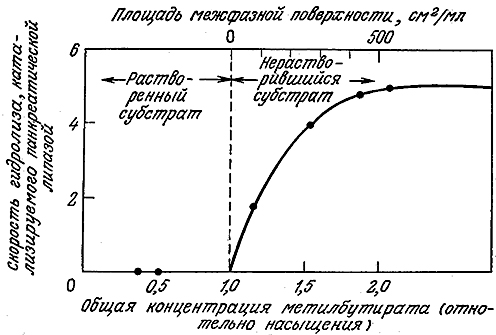
РИС. 3.33. Реакция на поверхности раздела двух жидких фаз
Другие ферменты активны в отношении как растворимой, так и нерастворимой форм субстрата. Так, например, было показано, что протеолитический фермент трипсин способен расщеплять как свободный лизодим, так и лизоцим, адсорбированный на поверхности каолинита. Сам лизоцим также может взаимодействовать с растворимыми и «нерастворимыми» субстратами. Как мы уже отмечали, лизоцим активно разрушает стенки бактериальных клеток; в то же время он способен катализировать и расщепление растворимых олигомеров, образующихся из полимеров клеточной стенки (разд. 3.4.2).
Взаимодействие растворенного фермента с нерастворимым субстратом путем адсорбции на поверхности последнего может быть описано с помощью интересного варианта рассмотренных ранее кинетических уравнений. В отличие от предыдущих случаев, когда скорость реакции возрастала пропорционально общей концентрации фермента, здесь при повышении концентрации фермента скорость реакции сначала возрастает, а затем приближается к некоторой предельной величине. Такое поведение фермент-субстратной системы наглядно иллюстрируется приведенными на рис. 3.34 данными, отражающими кинетику гидролиза твердого блока белка (в данном случае тиогеля – сшитого поперечными связями желатина) под действием трипсина.
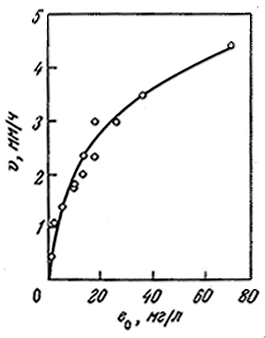
РИС. 3.34. Зависимость скорости разрушения твердого субстрата (тиогеля) от концентрации е0 фермента в растворе
Разработку достаточно обоснованной модели для кинетики гетерогенной реакции мы начнем с допущения, обратного тому, которое было положено в основу анализа скоростей ферментативных реакций в растворе – теперь мы будем считать, что фермент адсорбируется на субстрате. Обозначив символом Авакантные центры на поверхности субстрата, мы можем написать следующее уравнение:
![]()
Если общее число молей центров адсорбции на поверхности субстрата в расчете на единицу объема реакционной смеси принять равным α0, то
α0 = α+(еα) (3.87)
Из уравнения (3.87) и уравнения равновесной адсорбции фермента (3.86) следует, что
![]()
Теперь остается только допустить, что реакция завершается необратимым расщеплением комплекса ЕА. Следовательно,
![]()
По условиям модели е обозначает концентрацию свободного фермента, которая в начале эксперимента связана с общей концентрацией фермента е0 соотношением
е0 = е+(еα) (3.90)
Если начальная концентрация фермента значительно превышает начальную концентрацию субстрата (е0>>α0), то с хорошей степенью приближения можно считать, что
е0 ≈ е (3.91)
Поэтому
(3 92![]() )
)
Для реакций с твердыми субстратами ситуации, когда е0>>α0, ни в коей мере не являются исключением. Например, результаты, приведенные на рис. 3.34, были получены в эксперименте, в котором отношение е0/α0 составляло около 4000. Этим гетерогенные реакции резко отличаются от реакций в растворах, когда s0 обычно значительно больше, чем е0.
Из уравнения (3.92) следует, что график зависимости 1/v от 1/е0 (в двойных обратных координатах Лайнуивера – Бэрка) должен представлять собой прямую линию. Как показано на рис. 3.35, так оно и есть на самом деле. Здесь прямая на рис. '3.35, а выражает в другой форме те же данные, которые были приведены на рис. 3.34, а на рис. 3.35, 6 отражены аналогичные результаты, полученные для другой системы растворимый фермент – нерастворимый субстрат.
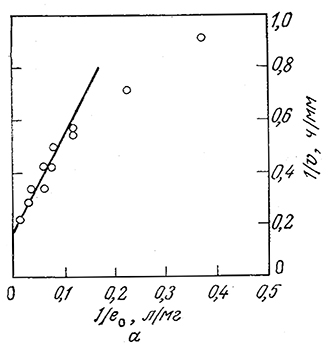
РИС. 3.35. а–зависимость скорости деструкции твердого субстрата (тиогеля) (1/v) от концентрации трипсина (1/е0) в растворе в координатах Лайнуивера – Бэрка.
б – зависимость скорости деструкции нерастворимого субстрата (частиц поли-β-гидроксибутирата) раствором фермента (деполимеразы из Р. lemoignei).
Многие источники питательных веществ для микроорганизмов представляют собой твердые частицы (в потоках сточных вод, озерах, хранилищах компоста и т. д.). Очевидно, что адсорбции и транспорту растворенных питательных веществ через клеточные мембраны должен предшествовать гидролиз этих частиц внеклеточными ферментами. Точно так же гидролиз целлюлозы ферментами типа целлюлаз требует предварительного расщепления нерастворимых частиц, поэтому надо полагать, что рассмотренная в этом разделе кинетика гетерогенных ферментативных реакций окажется пригодной для расчетов реакторов с такого типа субстратами.
В заключение следует подчеркнуть, что область применения рассмотренной кинетической модели не ограничивается твердыми субстратами; она использовалась и для описания нерастворимых жидких субстратов, диспергированных в растворе фермента (например, системы, кинетика которой изображена на рис. 3.33). Кроме того, здесь мы не принимали во внимание различий в концентрациях реагентов в основной массе жидкой фазы и на границе раздела фаз. Последнюю проблему мы рассмотрим детально в следующей главе.

