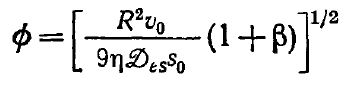Для проектирования реакторов с иммобилизованными ферментными катализаторами необходимо достаточно хорошо знать кинетические свойства иммобилизованных ферментов. Наблюдаемые каталитические свойства отдельной частицы катализатора на основе иммобилизованного фермента или реактора, в котором ферменты удерживаются полупроницаемой мембраной, определяются взаимосвязанным сочетанием двух процессов – транспорта субстрата и каталитической ферментативной реакции. В этом разделе основное внимание будет уделено изучению взаимосвязи между массопередачей и каталитической реакцией и ее влияния на каталитическую активность отдельной частицы иммобилизованного фермента.
Наше изучение путей взаимодействия массопередачи и химических процессов, определяющего общую активность, инактивацию и другие параметры иммобилизованного ферментного катализатора, мы начнем со схемы, приведенной на рис. 4.16. На этой схеме изображено поперечное сечение тонкого слоя иммобилизованного фермента, контактирующего с обеих сторон с раствором субстрата. Вдали от катализатора концентрация субстрата и другие параметры, например, рН, имеют те же значения, что и во всей реакционной среде. Эти параметры легко определить обычными методами аналитической химии.
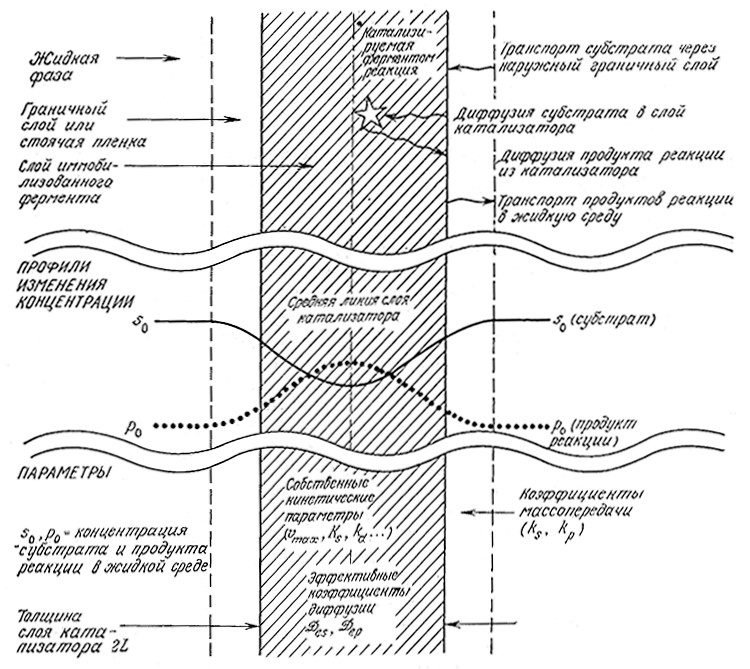
РИС. 4.16. Схема массопередачи и химических превращений в двустороннем слое иммобилизованного фермента.
Указанные в верхней части рисунка явления обусловливают специфические профили изменения концентраций субстрата
и продукта реакции, изображенные в средней части рисунка. Эти профили могут быть описаны количественно
с помощью параметров, перечисленных в нижней части схемы.
Поскольку субстрат трансформируется внутри иммобилизованного фермента и здесь же образуется продукт реакции, между раствором вдали от катализатора и активными центрами иммобилизованного фермента возникают градиенты концентраций, В частности, субстрат должен транспортироваться из раствора к наружной поверхности катализатора. В отсутствие перемешивания этот процесс осуществляется за счет молекулярной диффузии. Обычно скорость транспорта субстрата к поверхног сти катализатора повышают путем перемешивания или создания потока его раствора. Если активный фермент находится только на поверхности иммобилизованного фермента или если субстрат не может проникнуть внутрь частицы катализатора, то нац следует учитывать только эту внешнюю массопередачу. Часто>, однако, фермент равномерно распределен по всему объему проницаемой для субстрата матрицы. В таком случае каталитическая активность большей частью сосредоточена и распределена внутри гранулы катализатора, и субстрат, очевидно, должен диффундировать в гранулу до некоторого активного центра, где и осуществляется реакция. Тот же путь, но в обратном направлении, должны проходить и продукты реакции. В таких случаях необходимо учитывать как внешнюю массопередачу, так и процессы диффузии внутри частицы катализатора.
Как показано на рис. 4.16, реакция в слое иммобилизованного фермента протекает со скоростью, определяемой концентрациями внутри этого слоя. В силу упоминавшихся выше градиентов концентрации локальные скорости реакции изменяются в зависимости от положения центра реакции, а общая скорость превращения субстрата представляет собой сумму всех локальных скоростей трансформации субстрата внутри проницаемого катализатора. В стационарном состоянии эта общая скорость равна скорости транспорта субстрата к катализатору. Очевидно, что в общем случае скорость всего процесса зависит как от скорости транспорта, так и от собственной скорости каталитической реакции.
Вывод математических выражений, позволяющих описать эти взаимосвязанные процессы, и критериев, дающих возможность оценить их относительную важность, явился большим достижением химической технологии. Эти взаимосвязанные процессы играют очень большую роль в катализируемых иммобилизованными ферментами и иммобилизованными клетками реакциях; в то же время их роль часто не учитывалась как в теоретических исследованиях, так и в разработке путей практического применения иммобилизованных биокатализаторов. Поэтому мы рассмотрим здесь достаточно подробно основные принципы и методы математического моделирования процессов на иммобилизованных ферментах, а также его результаты. Еще более детально эта тема освещена в учебных пособиях по химической технологии и в ряде монографий.
4.4.1. Влияние внешнего сопротивления массопередаче
Чтобы читателю было легче усвоить некоторые основные понятия и специфическую терминологию, мы начнем с самого простого варианта. Предположим, что фермент иммобилизован только на наружных поверхностях носителя, имеющего форму пластины. В этом случае мы должны рассматривать только массопередачу из раствора к поверхности носителя и реакцию на этом носителе.
Одна из традиционных моделей, которую биохимики называют диффузионным слоем Нернста, а технологи — стоячей пленкой или граничным слоем, приводит к следующему выражению для потока (выраженному в молях в единицу времени на единицу поверхности) субстрата из жидкой фазы (биохимики иногда называют ее пулом) к границе раздела фаз:
Ns = ks(S0 — S) (4.2)
Здесь S и S0 — концентрации субстрата на границе раздела фаз и в жидкой фазе соответственно, a ks — коэффициент массопере- дачи. Последний зависит от физических свойств среды, а также от гидродинамических условий вблизи границы раздела фаз й может быть определен по известным корреляциям, рассматриваемым в гл. 8. В частности, ks возрастает при повышении скорости потока через реактор колонного типа с насадкой иммобилизованного фермента.
В стационарном состоянии субстрат не может аккумулироваться на поверхности катализатора, поэтому скорость поступления субстрата за счет массопередачи должна быть равна скорости его расхода в реакции на поверхности катализатора. Если допустить, что скорость V ферментативной реакции на поверхности (выраженная в молях в единицу времени на единице поверхности) подчиняется уравнению Михаэлиса — Ментен, то получим
![]()
Число необходимых для описания системы параметров (ks, S0 Vmax и Km) можно уменьшить до двух (Da и н) путем введения следующих безразмерных переменных:
![]()
С учетом этих параметров уравнение материального баланса по субстрату примет вид
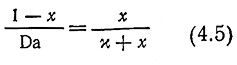
Здесь необходимо подчеркнуть физический смысл параметра; Da, числа Дамкелера:
![]()
Так, если Da значительно меньше единицы, то максимальная скорость массопередачи Намного превышает максимальную скорость реакции (низкое сопротивление массопередаче). Если же сопротивление массопередаче велико, то этот фактор ограничивает скорость всего процесса, a Da принимает значения, намного превышающие единицу. Эти случаи известны как лимитируемый реакцией режим и лимитируемый диффузией режим соответственно.
Алгебраическим преобразованием уравнения (4.5) легко получить квадратное уравнение, позволяющее определить х аналитическим путем:
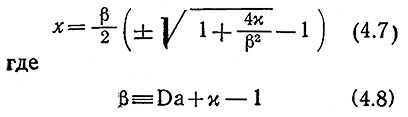
В уравнении (4.7) знаки + и — применяются при β>0 и β<0 соответственно. Если β= 0, то х=√х. Используя это выражение для S/S0, мы можем с помощью правой или левой части уравнения (4.7) оценить безразмерную наблюдаемую скорость реакции V̅/Vmaх. Следует помнить, что в общем случае зависимость V̅ от S0 не выражается уравнением Михаэлиса — Ментен. Кроме того, Km уже нельзя считать равным S1/2, когда V̅ ровно в два раза меньше наблюдаемой максимальной скорости реакции V̅maхарр, поскольку величина S1/2 зависит от Da.
Тем не менее параметр S1/2 часто называют кажущейся константой Михаэлиса (Kmapp) и используют для оценки влияния массопередачи. Если перед исследователем стоит только задача определения S1/2, такое упрощение может оказаться удобным, но в общем случае оно может привести к серьезным ошибкам. Например, можно прийти к выводу, что наблюдаемой скорости реакции соответствует следующее некорректное уравнение:
![]()
В каком-то конкретном случае это уравнение может даже удовлетворительно описывать наблюдаемую кинетику процесса, но в целом оно неверно, поскольку в нем не учтена зависимость Kmapp от свойств жидкой среды и гидродинамических свойств слоя вблизи границы раздела фаз. Как показывают экспериментальные данные, такая зависимость может резко изменять кинетику процесса (рис. 4.17).
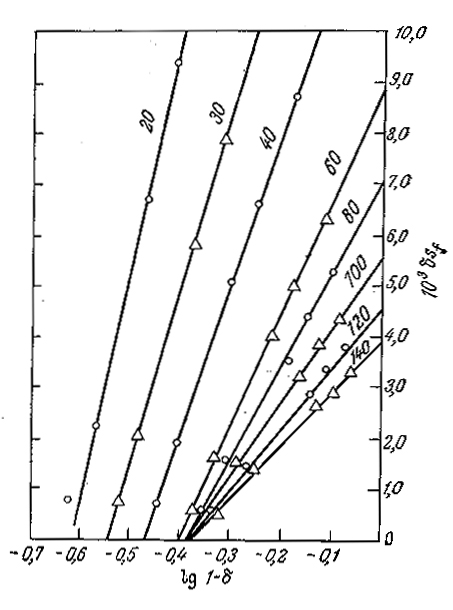
РИС. 4.17. Экспериментальное обнаружение взаимосвязи между скоростью трансформации
субстрата δ [δ= (Sf—Se)/Sf, где Sf и Sе — концентрации субстрата в исходной смеси
и в продуктах реакции соответственно] и скоростью потока {указана цифрами на кривых (мл/ч)]
в реакторе со слоем иммобилизованного фермента (изучалась реакция гидролиза этилового эфира
бензоил- L-аргинина фицииом на карбоксиметилцеллюлозе). Если бы кинетика процесса подчинялась
уравнению Михаэлиса — Ментен, то при потоке идеального вытеснения наклон всех кривых
был бы одинаков и равен Km. Изменение наклона с изменением скорости потока свидетельствует
о значительном влиянии массопередачи на кинетику процесса в целом.
В химической технологии влияние массопередачи на общую скорость реакции традиционно выражают через коэффициент эффективности ⴄ, физический смысл которого определяется следующим образом:

Следовательно, в нашем случае
![]()
Поэтому ⴄ≤1, и, таким образом, в общем случае повышение сопротивления массопередаче будет сопровождаться снижением наблюдаемой активности катализатора. На рис. 4.18 приведены результаты эксперимента, подтверждающие такую зависимость.
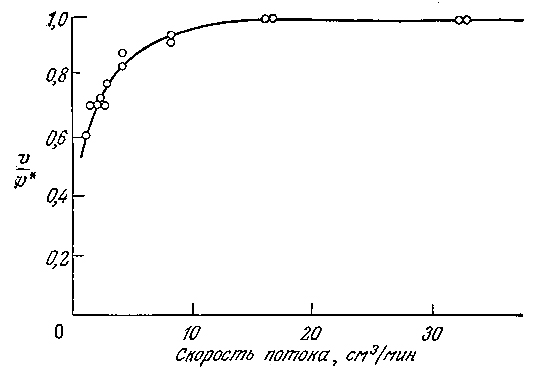
РИС. 4.18. Экспериментальный метод обнаружения эффектов внешней диффузии;
здесь V* — скорость реакции при высоких скоростях потока через насадочную колонну
(изучалась реакция гидролиза 4•10–4 M раствора n-нитроанилида N-бензоил-DL -аргинина
иммобилизованным трипсином при рН 8 и 25 °C).
Если параметр Da близок нулю (очень медленная по сравнению с максимальной скоростью массопередачи реакция), то, согласно уравнению (4.5), х приближается к единице, и, следовательно, для лимитируемого реакцией режима (Da→0)
![]()
В этом случае кинетика процесса не отличается от истинной собственной кинетики реакции на границе раздела фаз жидкость— Твердое тело. Если приготовлен новый катализатор, содержащий иммобилизованный фермент на поверхности, то всегда следует экспериментально оценить, как методика иммобилизации отразилась на каталитических свойствах фермента. Необходимое для этой цели определение параметров Vmax и Km должно проводиться в условиях, когда Da<<1; только тогда будут устранены маскирующие диффузионные эффекты.
Сведения о собственной кинетике ферментативной реакции необходимы также при разработке и проектировании реакторов с иммобилизованными ферментами, поскольку только таким путем можно достаточно надежно учесть влияние свойств жидкой среды, формы носителя фермента и характеристик смешения. Разработано много типов экспериментальных реакторов, предназначенных для изучения реакций обычного гетерогенного катализа в лимитируемом реакцией режиме. Некоторые из таких реакторов применяли и для исследования кинетики реакций, катализируемых иммобилизованными ферментами (рис. 4.19). В целях минимизации сопротивления массопередаче во всех этих реакторах вблизи катализатора создавались высокие скорости потока (большие ks, малые Da). Что касается иммобилизованных ферментов, то такой подход имеет несколько недостатков. Во-первых, как мы уже упоминали в разд. 3.7.3, гидродинамическое воздействие может вызвать частичную или даже полную денатурацию ферментов, связанных с носителем. Во-вторых, механическое перемещение одних частиц катализатора относительно других может приводить к потере фермента за счет истирания.
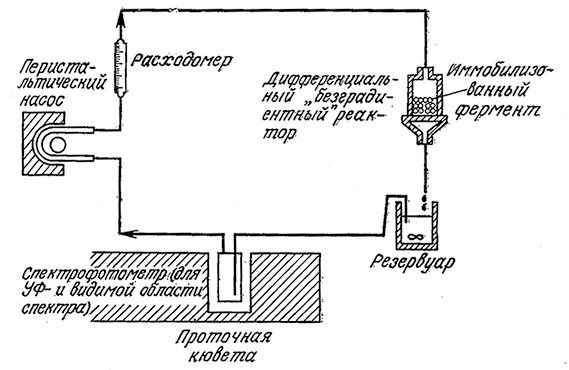
РИС. 4.19. Реактор с рециркуляцией для изучения влияния внешней массопередачи
на кинетику реакций, катализируемых иммобилизованными ферментами.
В системах, в которых скорость процесса зависит как от химической реакции, так и от массопередачи, лимитируемый диффузией режим возникает тогда, когда Omax значительно больше ksS0, т. е. при Da>>1. Для лимитируемого диффузией режима (Da→∞, н ограничен) путем ряда преобразований уравнения (4.7), включая разложение в ряд квадратного корня, можно получить следующие выражения:
![]()
Таким образом, при очень больших значениях Da реакция имеет первый порядок по общей концентрации субстрата и ее скорость V̅ совершенно не зависит от собственных параметров катализатора Vmax и Km. В такой ситуации собственные кинетические параметры иммобилизованных ферментов вообще не проявляются. В лимитируемом диффузией режиме, например, при заданном S0 наблюдаемая активность постоянна, даже если ферменты на границе раздела фаз на самом деле теряют активность,, в частности за счет изменения в неблагоприятную сторону температуры, рН или других условий процесса. Поэтому изучение скорости денатурации иммобилизованного фермента должно проводиться только в условиях» максимально приближенных к лимитируемому реакцией режиму.
4.4.2. Моделирование диффузии
и реакций внутри частицы катализатора
Как мы уже не раз упоминали выше, обычно ферменты иммобилизуют путем связывания с внутренними поверхностями пористых носителей или путем включения в матрицы, через которые может диффундировать субстрат. В таких системах для расчета наблюдаемой скорости трансформации субстрата необходимо знать профиль изменения его концентрации в частице катализатора. Для этого в свою очередь прежде всего надо найти уравнение материального баланса в стационарном состоянии для тонкого слоя проницаемого катализатора. Предположим, что фермент иммобилизован в грануле, форму которой можно считать сферической. Тогда необходимый тонкий слой будет заключен между двумя концентрическими сферами радиусов г и r+dr соответственно (рис. 4.20). Толщина этого слоя настолько мала, что все условия внутри него можно считать постоянными независимо от положения.
Символами Des и V обозначают эффективный коэффициент диффузии субстрата и локальную скорость его трансформации соответственно. Оба этих параметра принципиально отличаются от аналогичных параметров для процессов в растворе; существенна и количественная разница между ними. Рассмотрим сначала эффективный коэффициент диффузии, учитывая, что скорость диффузии любых веществ через носитель зависит от следующих факторов:
1. Часть поперечного сечения частицы катализатора занята молекулами твердого носителя и поэтому не может использоваться для диффузионного' транспорта субстратов (соответствующий параметр — пористость частицы ꜪР).
2. Сеть пор переплетена очень сложным образом, поэтому диффузия может происходить только в разрешенных, часто меняющихся направлениях (соответствующий параметр — коэффициент извилистости τ).
3. Поры могут иметь очень небольшой диаметр, сравнимый с размерами молекул субстрата (ограниченная диффузия; соответствующий параметр Kp/Kr).

РИС. 4.20. Вывод уравнения стационарного состояния сферической проницаемой гранулы
иммобилизованного фермента с помощью концепции тонкого слоя.
Теперь мы можем выразить эффективный коэффициент диффузии через эти параметры:
![]()
Здесь Ds0—коэффициент диффузии субстрата в жидкой реакционной среде. Параметр пористости Ꜫр необходимо определять экспериментально для каждого конкретного носителя. Для коэффициента извилистости обычно принимают значения, расположенные в диапазоне от 1,4 до 7. Что касается ограниченной диффузии, то соответствующий параметр Kp/Kr в первом приближении можно оценить, воспользовавшись следующим уравнением:
![]()
где rs и rр— (эквивалентный) радиус молекул субстрата и характеристический радиус поры соответственно. Неопределенность всех параметров в правой части уравнения (4.14) является причиной того, что найти достоверное значение Des расчетным путем очень трудно. Поэтому предпочтительнее оценивать Des на основе экспериментального изучения общей кинетики процесса. Этот метод мы рассмотрим позднее, после анализа взаимного влияния диффузионных и химических процессов внутри частицы иммобилизованного фермента.
Следует отметить также, что массопередача внутри частицы может зависеть от химии ее внутренних поверхностей и от наличия ионизированных групп. Более того, если в реакции участвуют или образуются ионизированные соединения, то внутри частицы катализатора могут создаваться градиенты электрического потенциала, которые в свою очередь будут изменять скорости транспорта заряженных веществ. Методы анализа и учета этих факторов читатель может найти в литературе, приведенной в конце главы.
Если допустить, что собственная кинетика локальной ферментативной реакции с участием иммобилизованного фермента подчиняется уравнению Михаэлиса — Ментен:
![]()
то параметр максимальной скорости в данном случае можно определить как произведение нагрузки носителя ферментом eimm (количество микромолей фермента в 1 г носителя) на удельную активность иммобилизованного фермента qE,imm (число микромолей субстрата, превращаемых в 1 с I мкмолем фермента) и на плотность частиц ρρ (количество граммов носителя в единице его объема):
Vmax = eimm•ρρ•qE,imm (4.17)
Напомним, что иммобилизация может изменять структуру фермента и (или) его молекулярное окружение, и, следовательно, величины qE,imm и Km для иммобилизованного фермента могут отличаться от соответствующих величин для фермента в растворе. Как мы уже отмечали в разд. 4.4.1, собственную кинетику фермента желательно изучать в условиях минимального вклада в общую кинетику системы эффектов, обусловленных массопередачей. Критерий для таких лимитируемых реакцией условий мы найдем в ходе приведенного ниже анализа.
Уравнение материального баланса по субстрату в стационарном состоянии, вывод которого приведен на рис. 4.20, представ-ляет собой обычное дифференциальное уравнение второго порядка:
![]()
Изображенную на рисунке модель необходимо дополнить граничными условиями. Профиль изменения концентрации в частице катализатора почти всегда симметричен относительно центра сферы, т. е.
![]()
В этом анализе мы допускаем, что концентрация субстрата на наружной поверхности гранулы равна концентрации субстрата S0 в жидкой среде, омывающей гранулу. (Случаи одновременного сопротивления массопередаче в граничном слое и внутри частицы будут рассмотрены в следующем разделе.) Следовательно,
![]()
Наблюдаемая общая скорость V0 утилизации субстрата частицей катализатора равна поступлению субстрата в гранулу за счет диффузии. Величина V0, выраженная в молях на единицу объема гранулы в единицу времени, составляет
![]()
Здесь символами Vp и Ap обозначены объем частицы и площадь ее наружной поверхности соответственно. Как и в предыдущем разделе, такие скорости мы будем выражать в виде безразмерного параметра, определяющего влияние диффузионных эффектов. Коэффициент эффективности ⴄ определяется как

К сожалению, если в соответствии с уравнением (4.16) у изменяется нелинейно, то определить коэффициент эффективности аналитическим путем непросто. Для этого необходимо решить в цифровой форме задачу о граничном значении [уравнения (4.18) — (4.20)] и затем по уравнению (4.21) найти V0. Такие вычисления достаточно сложны и трудоемки, поэтому мы постараемся выразить результаты в наиболее простой и в то же время достаточно общей форме. Для этого преобразуем приведенные выше уравнения в эквивалентные безразмерные выражения.
Введем параметры s̅=S/S0 и r̅=r/R; тогда уравнение (4.18) можно записать в следующей форме:
![]()
Здесь безразмерные параметры ф и β
![]()
Соответствующие уравнению (4.23) безразмерные граничные условия равны
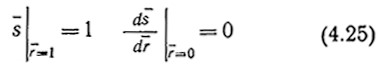
Физический смысл параметра ф, называемого модулем Тила, заключается в том, что квадрат модуля Тила представляет собой частное от деления скорости реакции первого порядка R3(Vmax/Km)S0 на скорость диффузии RDesS0. Параметр насыщения β является мерой отклонения локальных скоростей от кинетики первого порядка, причем большие значения β свидетельствуют о том, что порядок реакции приближается к нулевому.
Выразим через эти безразмерные переменные коэффициент эффективности
![]()
Согласно уравнениям (4.23) и (4.25), s̅ является функцией только r̅, ф и β, и поэтому (ds̅/dr̅)r̅=1 зависит только от β и ф. Учитывая уравнение (4.26), отсюда следует, что т) зависит только от модуля Тила и параметра насыщения:
ⴄ = f(ф, β) (4.27)
При использовании выражения (4.27) для оценки коэффициента эффективности возникает проблема, связанная с тем, что собственные параметры кинетики каталитической реакции Vmax и Km часто неизвестны. С помощью простых преобразований можно показать, однако, что при определении т) можно обойтись и без первого параметра Vmax. Действительно, из уравнений (4.26) и (4.21) следует, что
Подстановка этдго выражения в правую часть уравнения (4.27) приводит к уравнению (4.28), отражающему неявную зависимость между η, β и новым безразмерным наблюдаемым модулем Ф, который определяется следующим образом:
![]()
(Обратите внимание на то, что Ф зависит только от наблюдаемой общей скорости V0 и не зависит от собственных кинетических параметров каталитической реакции.) Решение этого неявного уравнения позволяет определить ⴄ как функцию от β и наблюдаемого модуля Ф:
ⴄ=g(Ф, β) (4.29)
На рис. 4.21 приведены графики зависимости ⴄ от Ф, выражаемые уравнением (4.29) при β→0 и β→∞. Поскольку коэффициенты эффективности для промежуточных значений Km/S0 располагаются между кривыми для этих двух предельных случаев, нетрудно видеть, что коэффициент µ сравнительно не чувствителен к последнему собственному параметру Km/S0.
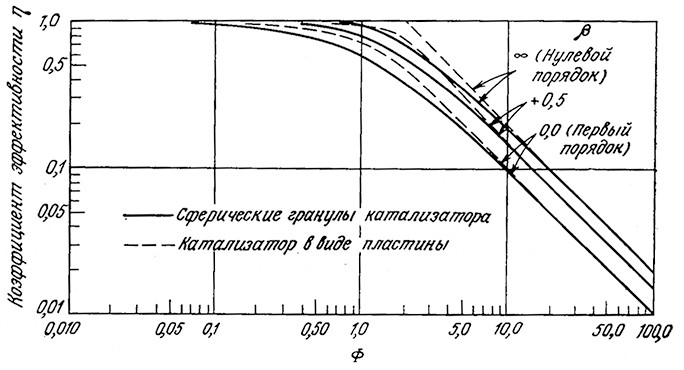
РИС. 4.21. Коэффициенты эффективности иммобилизованных ферментных катализаторов
с собственной кинетикой, описываемой уравнением Михаэлиса— Ментен (β=S0/Km).
Определение безразмерного наблюдаемого модуля Ф дано в уравнении (4.28).
Прежде чем перейти к изучению аналитических решений, основанных на приближенной оценке кинетики процессов, нам нужно найти выражение для г), применимое при больших значениях Ф (или ф) и кинетике, выражаемой уравнением Михаэлиса — Ментен. Если модуль Ф достаточно велик (Ф≥З; см. табл. 4.15), то субстрат быстрее утилизируется ферментом, чем диффундирует внутрь гранулы катализатора. В такой ситуации, когда скорость всего процесса определяется скоростью диффузии, можно допустить, что весь субстрат трансформируется в граничащем с наружной поверхностью тонком слое гранулы катализатора, поэтому эффектом кривизны (2/r•ds/dr) в уравнении (4.18) можно пренебречь. Отсюда следует, что
![]()
Таблица 4.15. Критерий для оценки влияния эффектов массопередачи на кинетику всего процесса

Если в уравнение (4.30) вместо d2s/dr2 подставить правую часть уравнения (4.31)
![]()
и затем интегрировать по s, то мы получим следующее выражение:
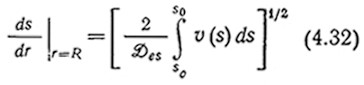
Здесь Sc и S0 — концентрации субстрата в центре частицы (г=0) и на ее поверхности (г=R) соответственно.
В случае лимитируемой диффузией реакции S0 ≈ 0, что позволяет вычислить интеграл в уравнении (4.32). Совместное решение уравнений (4.21), (4.22) и (4.32) приводит к следующему выражению для коэффициента эффективности, справедливому при достаточно больших значениях Ф или ф:
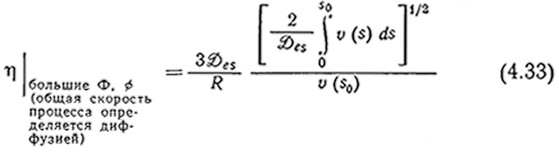
Преобразование этого уравнения для частного случая кинетики, выражаемой уравнением Михазлиса — Ментен (4.16), дает
![]()
Продолжая изучение кинетики, выражаемой уравнением Ми- хаэлиса — Ментен, отметим, что если допустить первый порядок реакции (это справедливо при S<<Km), то, согласно данным.приведенным на рис. 4.21,
V = ks (4.35)
где k-Vmax/Km, и η принимает консервативное (низкое) значение, достаточно близко приближающееся к истинному значению. Воспользовавшись линейной зависимостью (4.35), мы можем решить аналитическим путем уравнения модели лимитируемого диффузией процесса; таким образом получим
![]()
B этом выражении модуль Тила Ф равен
![]()
C помощью уравнения (4.37) можно получить изображенную на рис. 4.21 кривую, отвечающую реакции первого порядка.если использовать справедливую в такой ситуации зависимость:
Ф = µФ2 (4.38)
Другой предельный случай кинетики Михаэлиса — Ментен характерен для реакций, порядок которых приближается к нулевому (s>>Km); такую ситуацию можно определить следующим образом (k0 = Vmax):
![]()
Совместное решение задачи о граничном значении [уравнения (4.18)—(4.20)] и функции утилизации фермента показывает, что концентрация субстрата s зависит от радиуса r следующим образом:
![]()
Это выражение справедливо при всех неотрицательных значениях s, т. е. в интервале от r=R до некоторого критического радиуса r=Rc, определяемого путем решения уравнения (4.18) совместно с уравнением (4.20) при следующих граничных условиях:
![]()
Это решение приводит к кубическому уравнению относительно Rc:
![]()
Таким образом, если уравнение (4.42) имеет положительный корень (Rc/R), величина которого меньше единицы, то внутри гранулы катализатора существует иекоторая область (от r=0 до r=Rc), в которой S = 0 и V = 0. B таких случаях реакция протекает только во внешнем слое частицы (Rc<r≤R), так что
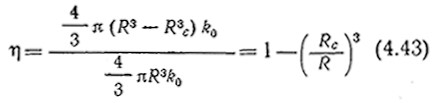
Если не существует имеющего физический смысл решения уравнения (4.42), то η = 1 и скорость трансформации субстрата во всем объеме граиулы катализатора одинакова.
Другим важным следствием изображенных на рис. 4.21 зависимостей является малое влияние геометрии частицы катализатора на взаимозависимость η и Ф. Например, коэффициент эффективности реакции первого порядка в пластине определяется выражением
![]()
Здесь ф определяется по уравнению (4.37) при Vp/Ap, равном половине толщины пластины. Эта функция во всем диапазоне значений ф отличается от функции в уравнении (4.36) не более чем на 10%. Наибольшие отличия наблюдаются при ф, близком единице; с возрастанием или убыванием ф эта разница быстро уменьшается. Незначительное влияние геометрии частиц катализатора на функцию η=f(ф) часто позволяет использоватьсле- дующие эмпирические корреляции для коэффициента эффективности пластины иммобилизованного фермента с собственнойки- нетикой, описываемой уравнением Михаэлиса — Ментен:
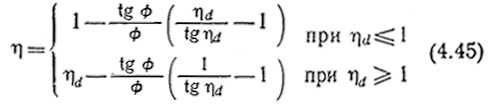
Здесь ⴄd — асимптотическое значениекоэффициентаэффектив- ности, определяемое по уравнению (4.34) Эти корреляции, первоначально разработанные для катализаторов с частицами, имеющими форму пластин, можно применять и к другимсим- метричным геометриям частиц, используя в формулировке модуля Тила в качестве параметра характеристической длины частное от деления объема частицы на ее наружную поверхность.
Малая чувствительность функции η к изменениям порядка реакции и геометрии частиц катализатора явилась основой удобного общего крйтерия, позволяющего различатьлимитируе- мые реакцией и лимитируемые диффузиейпроцессы. Этот критерий (табл. 4.15) сводится к единственному параметру Ф, который, как мы знаем, зависит только от наблюдаемых переменных. Подробнее этот критерий рассмотрен в работе [21].
B небиологическом катализе параметр η обычно рассматривают как меру эффективности использования катализатора. Если η существенно отличается от единицы, то общая скорость процесса может быть повышена путем измельчения катализатора; при этом Ф уменьшается и, следовательно, возрастает η. Такой подход может оказаться полезным и в биологическом катализе; во всяком случае, он указывает на наличие связи между размером частиц иммобилизованного фермента и максимальной эффективностью процесса.
Непосредственное изучение собственной кинетики также возможно только в тех случаях, когда фактор эффективности близок единице. Ha катализаторе с достаточно малыми размерами частиц (см. упражнение 4.5) можно экспериментально определить характер изменения скорости катализируемой иммобилизованным ферментом реакции и найти значения соответствующих кинетических параметров. Эта информация необходима длярас-- чета наблюдаемой общей кинетики реакции на более крупных частицах катализатора. Поскольку в водных растворах эффективные коэффициенты диффузии субстрата и (или) общие концентрации субстрата обычноневелики, то лимитируемый диффузией режим, как правило, обусловливается сравнительно большими размерами частиц катализатора, что может быть необходимым или для снижения перепада давлений и сопротивления потоку в реакторах с неподвижным слоем катализатора, или для предотвращения разрушения частиц катализатора в реакторах с псевдоожиженным слоем и со взвесями катализатора. Иногда лимитируемый реакцией режим трудно воспроизвести даже я лабораторных условиях. B таких случаях данные о собственных кинетических параметрах иммобилизованного фермента приходится получать описанным выше аналитическим путем на основе экспериментальных данных, усложненных диффузионными эффектами. Какэтопоказано ниже на конкретном примере, экспериментальное изучение кинетики реакций, катализируемых иммобилизованными ферментами, позволяет оценить и эффективный коэффициент диффузии субстрата.
4.4.3. Одновременное сопротивление массопередаче
в граничном слое и внутри частицы катализатора
B двух предыдущих разделах мы рассматривали особыеслу- чаи взаимного влияния массопередачи и химической реакции схематически изображенные на рис. 4.16. B общем случае, одна>'ко, субстрат должен сначала пройти через граничный слой или стоячую пленку, а затем диффундировать в частицу катализатора, где и происходит его превращение. Одна из целей нашего анализа этой наиболее общей ситуации будет заключаться в изыскании путей использования рассмотренных выше упрощенных моделей. Другими словами, нам нужно знать, когда доминирует внутреннее сопротивление массопередаче, в каких случаях определяющую роль играет внешнее сопротивление и когда нужно учитывать оба типа сопротивления.
Решение поставленных задач целесообразно начать с изучения простой модели иммобилизованного ферментного катализатора с геометрией пластины и кинетикой собственной реакции первого порядка. B таком случае уравнение материального баланса для субстрата внутри частицы в стационарном состоянии можно записать следующим образом:
![]()
с условием симметрии для средней линии
![]()
Ha внещней поверхности пластины (x=L) субстрат не аккуму- лируется. Транспорт через эту поверхность внутрь частицы катализатора путем диффузии равен транспорту в обратном направлении через граничный слой; следовательно, граничное условие выражается следующим уравнением:
![]()
Совместное решение уравнений (4.46)-(4.48) дает возможность определить коэффициент эффективности ηs, который в нашем случае может быть записан в следующей форме:
![]()
B этом выражении модуль Тила Ф имеет тот же физический смысл, что и ранее [см. уравнение (4.37) ; для геометрии пластины Vp/Ap=L]. Здесь мы ввели новый важный параметр Bi, называемый числом Био и определяемый как

Уравнение (4.49) удобнее преобразовать в другую форму:
![]()
Здесь η (η =tg ф/ф)—коэффициент эффективности катализатора в отсутствие сопротивления транспорту в граничном слое. Величину, обратную коэффициенту эффективности, можно рассматривать как меру сопротивления превращению субстрата, обусловленного требованиями к транспорту последнего. Таким образом, уравнение (4.51) отражает известное правило, гласящее, что общее сопротивление равно сумме отдельных сопротивлений.
Уравнение (4.51) позволяет ответить на вопрос, при каких условиях можно пренебречь одним из сопротивлений. Если
![]()
то можно пренебречь сопротивлением внешнего граничного слоя. Если же kL/ks намного больше единицы, то можно не принимать во внимание внутреннее сопротивление частицы катализатора. Bo всех промежуточных случаях необходимо учитывать оба сопротивления. Обратите внимание, что при больших значениях ф наблюдается обратная пропорциональная зависимость ηs от ф2. Альтернативный критерий, не требующий знания собственной константы скорости, основан на построении графиков зависимости ηs от Ф для различных Bi; при Bi≥100 влияние внешнего сопротивления незначительно.
Рассмотренные принципы анализа применимы и к иммобилизованным ферментам с другой геометрией частиц и с другой собственной кинетикой; эти случаи подробно рассмотрены в приведенной в конце главы литературе. Мы же ограничимся замечанием, что оценка типов массопередачи, оказывающих большое влияние на скорость всего процесса, всегда базируется на сравнительном изучении собственной скорости реакции, диффузионных эффектов в частице катализатора и внешней массопередачи.
4.4.4. Влияние ингибиторов, температуры
и pH на каталитическую активность
и инактивацию иммобилизованных ферментов
B предыдущей главе были рассмотрены математические выражения, описывающие процессы инактивации ферментов и влияние различных параметров (концентраций ингибиторов и активаторов, температуры, pH, ионной силы и т. д.) на ферментативную активность в растворах. B общем случае можно ожидать, чтоэти выражения будут пригодны и для описания зависимости собственной активности иммобилизованного фермента от различных параметров. B то же время, как мы уже не раз отмечали, иммобилизация может сопровождаться изменением собственных свойств фермента. Так, иммобилизованные ферменты могут иметь другие константы скорости реакций; более того, иммобилизация может даже потребовать изменения формы уравнений, описывающих влияние параметров реакции на собственную активность фермента. Для определения отклика собственной каталитической активности иммобилизованного фермента на изменения параметров реакции необходимо тщательное изучение кинетики реакции с применеНием описанных выше методов, позволяющих изучать только собственное кинетическое поведение системы, а не сочетание скоростей массопередачи и каталитических реакций.
B настоящем разделе мы прежде всего постараемся подчеркнуть то влияние, которое процессы массопередачи могут оказывать на взаимосвязь между кажущейся общей каталитической активностью иммобилизованного фермента и условиями среды. Bce необходимые данные могут быть получены путем изучения кинетики реакций первого порядка. Прежде всего следует запомнить, что наблюдаемая общаякинетика реакций с участием иммобилизованного фермента, функционирующего в лимитируемом реакцией режиме, не отличается от собственной локальной кинетики этой ферментативной реакции. Следовательно, изучаемая в этом режиме реакция будет иметь первый порядок, а константа скорости процесса будет равна собственной константе скорости ферментативной реакции. B случае же иммобилизованного ферментного катализатора, функционирующего в лимитируемом диффузией режиме, кажущийся порядок реакции также будет первым, но кажущаяся константа скорости будет равна квадратному корню из собственной константы скорости ферментативной реакции. [В общем случае если реакция протекает по n-му порядку, то кажущийся порядок этой реакции в лимитируемыхдиффузией условиях будет равен (n+1)/2.] Таким образом, кажущаяся энергия активации составит лишь половину истинной энергии активации. Точно так же и влияние изменения любых параметров реакции на наблюдаемую общую кинетику процесса будет меньшим, чем действительный эффект изменения этих же параметров на локальную, собственную кинетику ферментативной реакции. Например, если процессы инактивации, введение ингибитора или изменение pH уменьшают константу скорости собственно ферментативной реакции в 4 раза, то в лимитируемых диффузией условиях наблюдаемая общая скорость процесса уменьшится только в 2 раза.
Из всего сказанногоследует, что при изучении влияния параметров реакции на кинетику катализируемых иммобилизованными ферментами реакций следует быть предельно внимательным. Если не соблюдены лимитируемые реакцией условия или если экспериментальные данные, полученные в условиях, когда диффузия вносит определенный вклад в течение процесса, не переработаны с целью получения сведений о собственной кинетике ферментативной реакции, то любые выводы о зависимости активности иммобилизованного фермента от условий процесса будут иметь ценность только для данной партйи катализатора, только в данных условиях реакции и никоим образом не будут описывать собственное поведение иммобилизованного фермента. B таком случае любые изменения скорости потока раствора субстрата через слой катализатора, размера его частиц, структуры пор, содержания или распределения фермента в частице катализатора будут сопровождаться изменениями найденных ранее зависимостей активности катализатора от параметров процесса. Этот факт еще раз подчеркивает важность и необходимость.четкого разграничения собственных свойств иммобилизованного фермента от тех его характеристик, которые обусловлены эффектами массопередачи.
K сожалению, это обстоятельство не учитывалось во многих опубликованных в литературе работах, посвященных изучению зависимостей характеристик иммобилизованных ферментных систем от условий реакции. Поскольку в большинстве случаев иммобилизованные ферменты функционируют в условиях, когда диффузионные эффекты в заметной степени влияют на скорость процесса или даже определяют ее, то многие имеющиеся в литературе экспериментальные данные по определению скоростей инактивации и влияния pH и температуры на кинетику реакций, очевидно, не описывают собственные свойства иммобилизованных ферментов.
B то же время имеется множество фактов, свидетельствующих об изменении собственной кинетики инактивации ферментов после их иммобилизации. Предлагались и постулировались различные механизмы и интерпретации этого явления; некоторые из гипотез, которые мы вкратце здесь рассмотрим, выдержали экспериментальную проверку. Во-первых, вследствие иммобилизации ферменты удерживаются в относительно фиксированном в пространстве положении, что уменьшает вероятность таких взаимодействий между молекулами фермента, которые способствуют их инактивации за счет агрегации или автолиза (в случае протеолитических ферментов). Во-вторых, наличие нескольких связей молекулы фермента с носителем затрудняет нарушение третичной структуры белка. Сообщалось, что попытки создать комплементарную поверхности фермента микроструктуру носителя путем включения фермента в гель сопровождались резким повышением его стабильности. Аналогично иммобилизация стабилизирует активную форму ферментов, состоящих из нескольких субъединиц, и тем самым может замедлять инактивацию, обусловленную диссоциацией олигомерных белков.
Повышенная устойчивость иммобилизованных ферментов может быть также обусловлена благоприятным местным окружением, в меньшей степени инактивирующим белок, чем окружение в растворе. B качестве примеров можно привести носители, поверхности которых обладают буферными свойствами, илисни- жают местную концентрацию кислорода, или адсорбируют ферментные яды, или катализируют превращение денатурирующих веществ (например, H2O2) в безвредные соединения. Вероятно, на стабилизацию иммобилизованных ферментов могут оказывать влияние и другие факторы, которые будут выяснены в ходе последующих работ по изучению фундаментальных свойств иммобилизованных ферментов и взаимосвязи между их структурой и функцией.