Подобно любому химическому предприятию, клетка должна обладать сиетемами регулирования сложного переплетения осуществляющихся в ней химических реакций. Эти системы должны обеспечивать соответствующее потребностям клетки поступление материалов, энергии и электронов, а также высокую эффективность использования этих ресурсов. Кроме того, последовательности и циклы реакций должны быть организованы таким образом, чтобы они поддавались эффективному контролю и регулированию. B этом разделе мы изучим способы регуляции потоков веществ в многочисленных разветвленных и замкнутых путях метаболизма клетки путем модуляции активности ряда ключевых ферментов и, кроме того, рассмотрим основные особенности структуры метаболической сети. Чтобы оценить важность и эффективность этих структур и систем регуляции, достаточно ознакомиться с метаболической активностью бактерий E. coli. B богатой питательными веществами среде эти клетки делятся каждые 20 мин; при этом осуществляется огромное количество химических реакций с поразительными точностью, производительностью и сбалансированностью (табл. 5.6).
Таблица 5.6. Биосинтетическая активность в процессе 20-минутного цикла деления клеток E. colia
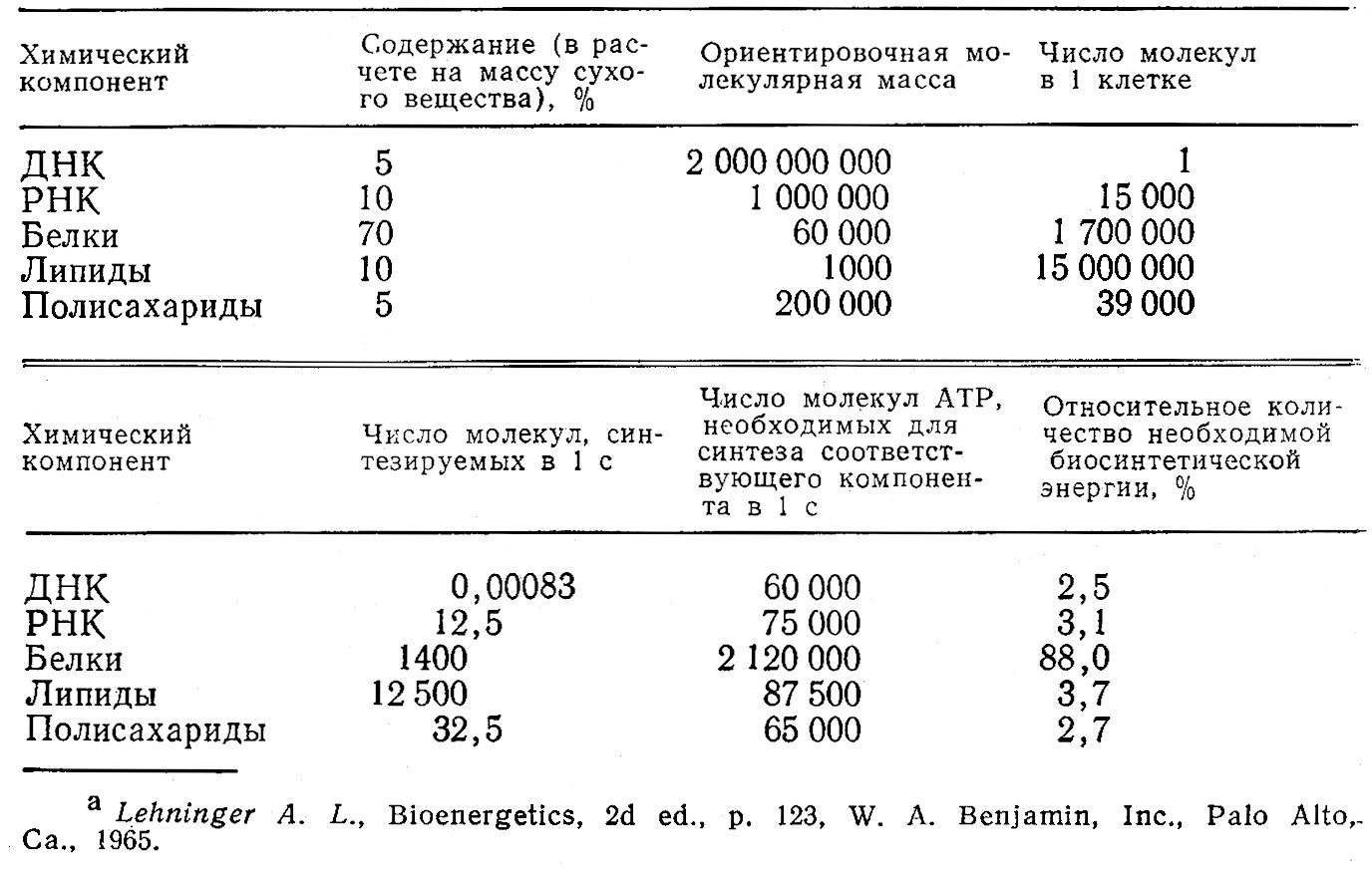
B качестве примера достаточно рассмотреть белковый синтез. Приведенные в таблице данные показывают, что в среднем в клетке синтезируется 1400 молекул белков в секунду. Поскольку белки представляют собой сравнительно большие биополимеры, при синтезе каждого из которых создается в среднем- около 300 ковалентных связей, то в среднем в одной клетке за секунду образуется около 420 000 пептидных связей. Более того, та« как белки являются информационными полимерами, составляющие их мономерные звенья должны быть соединены только в строго определенной последовательности.
За такую огромную скорость синтеза белков живой клетке приходится расплачиваться существенной частью образующейся в процессе метаболизма химической энергии. Почти всю свою энергию бактерия складывает в биосинтез, причем около 88% ее расходуется на синтез белков. Из данных табл. 5.6 следует также, что на дели биосинтеза расходуется около 2,5 миллиона молекул ATP в секунду. Поскольку всего в клетке E. coli содержится приблизительно пять миллионов молекул ATP, то этого запаса хватит клетке воего лишь на две секунды жизнедеятельности. Этот факт дает возможность оценить те огромные скорости регенерации ATP, которые необходимы для нормального функционирования клетки, а также важность регуляции скорости образования ATP в соответствии с потребностями клетки. Аналогичные выводы могут быть сделаны и в отношении других важных участников процессов первичного метаболизма NADH и NADPH.
5.8.1. Ключевые точки пересечения
и разветвления метаболических путей
Анализ путей метаболизма как сети направленных реакций позволяет выявить ключевые элементы их организации. Нераз- ветвленная последовательность метаболических реакций характерна для ряда взаимосвязанных превращений, осуществляющихся на данном пути. Исходные и конечные вещества нераз- ветвленного пути представляют собой или исходные питательные вещества, или конечные продукты метаболизма (которые в свою очередь могут задерживаться в клетке или выделяться в среду), или, наконец, исходные вещества для других путей метаболизма, т. е. точки разветвления. Обычно первая после точки разветвления метаболического пути необратимая (т. е. имеющая существенное по абсолютной величине отрицательное ΔG' при внутриклеточных условиях) реакция является аллостерически регулируемой стадией. B этом случае посредством регуляции поступления исходных веществ клетка распределяет метаболиты, используемые одновременно для нескольких целей. Соструктурной точки зрения эти метаболиты представляют собой исходные точки или узловые пункты метаболической ветви. Отсюда следует, что точки разветвления и модулируемые необратимые реакции являются теми критическими элементами, которые определяют все стороны химической активности клетки. K этому вопросу мы еще не раз вернемся в последующих разделах и главах, а изложенные выше принципы будем использовать в упрощенной технологической интерпретации клетки как химического реактора.
Прежде всего обратим внимание на важность схем разветвленных реакций с самой общей точки зрения. Оказывается, что все типы метаболической активности клетки зависят от распределения потоков трех основных реагентов: глюкозо-6-фосфата, пирувата и ацетил-СоА. Ha рис. 5.24 схематично изображены пересечения различных путей метаболизма, в которых эти реагенты являются исходными или конечными веществами. Объем потоков по каждому из путей регулируется клеткой в зависимости от метаболических потребностей и ее состава в данный момент.
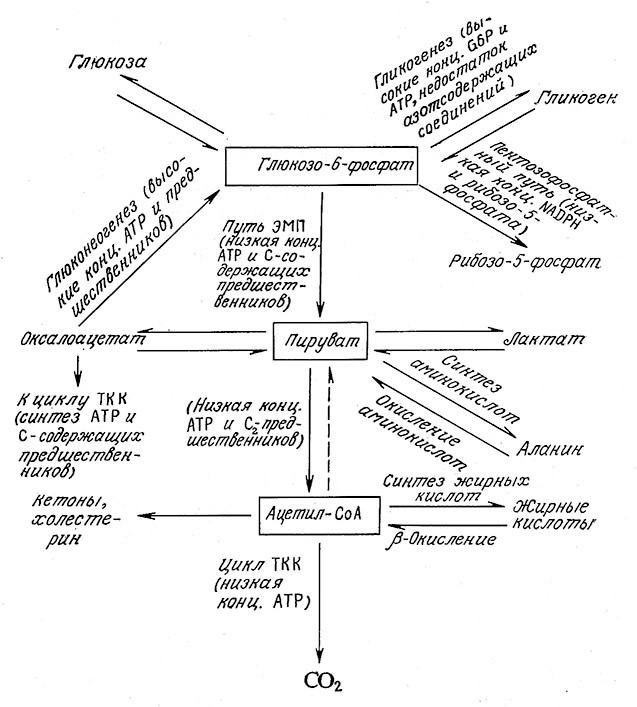
РИС. 5.24. Схема пересечения основных путей метаболизма углерода.
B клетках млекопитающих превращение ацетил-СоА в пируват не происходит.
B качестве более частного примера можно проанализировать разветвленные пути биосинтеза аминокислот, изображенные на рис. 5.12. Здесь также обращает на себя внимание наличие узловых точек, являющихся исходными пунктами для прямых последовательностей реакций, которые далее в свою очередь так-же разветвляются. B следующем разделе мы рассмотрим локализацию регуляционных центров в этой части метаболической сети.
5.8.2. Регуляция метаболизма на ферментативном уровне
Аллостерические ферменты регулируют распределение потоков веществ по различным путям метаболизма. Роль регуляторных сигналов, которые управляют активностями этих ферментов, выполняют концентрации ATP, NADH, NADPH1 а также некоторых ключевых соединений-предшественников и промежуточных веществ. Влияние некоторых из этих сигналов на разделение потоков в точках разветвления в общих чертах показано на рис. 5.24. Здесь мы рассмотрим некоторые наиболее показательные примеры регуляции метаболизма, а также осуществляющийся иногда координированный контроль нескольких путей метаболизма.
Очевидно, что концентрация ATP в клеткедолжна поддерживаться на необходимом уровне. Мерой энергетического состояния клетки может служить аденилатный энергетический заряд [4], определяемый как отношение концентрации ATP к сумме концентраций AMP, ADP и ATP:
![]()
B большинстве клеток энергетический заряд изменяется в пределах от 0,87 до 0,94.
Чтобы понять, как достигается столь высокая степень постоянства концентрации ATP, рассмотрим сначала путь ЭМП (рис. 5.25). Первичным регуляторным ферментом здесь служит фосфофруктокиназа, которая активируется ADP и ингибирует- ся АТР. Таким образом, этотферментзамедляет потокмета- болитов по путщ ЭМП, если энергетический заряд высок, и на- оборот. Аналогично действует пируваткиназа, активируемая AMP. Вспомним, что фосфорилирование глюкозы, а также peакции фруктозо-6-фосфата и фосфоенолпирувата представляют собой единственные три необратимые реакции пути ЭМП. Теперь мы можем понять причину этого явления: на первой стадий образуется ионизированное производное, прочно удерживаемое внутри клеточной оболочки, а две другие необратимые стадии представляют собой регуляторные пункты.
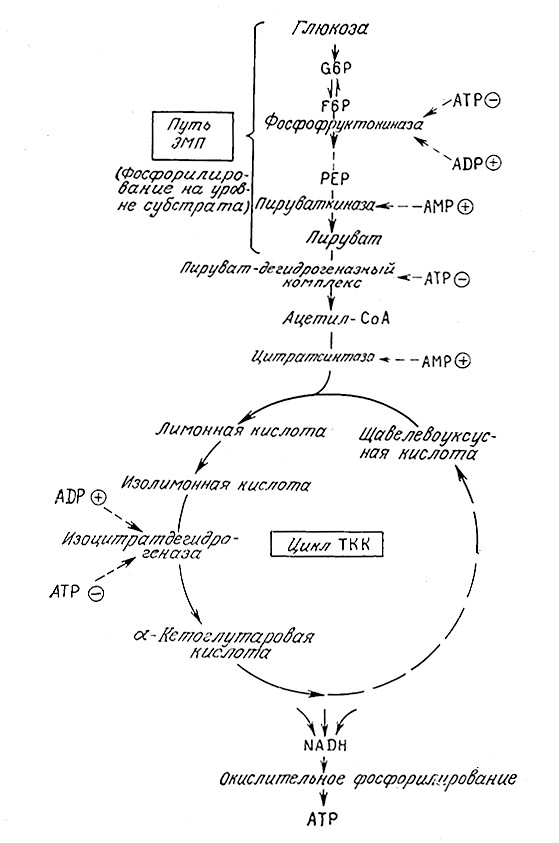
РИС. 5.25. Регуляция метаболического пути ЭМП и цикла TKK аденозинфос- фатами.
Штриховые стрелки указывают аллостерический эффект в отношении данного фермента;
знаком Ꚛ обозначена активация фермента, знаком Θ — его ингибированне.
Энергетический заряд влияет и на активность цикла TKK. Изоцитратдегидрогеназа активируется ADP и ингибируется ATP. Поскольку одна из основных функций метаболических путей ЭПМ и TKK заключается в фосфорилировании ADP, что приводит к повышению энергетического заряда клетки, нетрудно видеть, что основным типом регуляции в схеме на рис. 5.25 являются согласованные и координированные формы ингибирования по принципу обратной связи.
Для управления поступлением веществ-предшественников и процессами биосинтеза, очевидно, необходимы другие системы регуляции. Цитрат, например, служит аллостерическим модулятором нескольких ферментов. Он повышает ингибиторный эффект ATP в отношении фосфофруктокиназы. Этот факт отражает амфиболичеакую природу путей ЭМП и TKK, благодаря которой в любом из них при высоком энергетическом заряде и поступлении достаточного количества питательных веществ могут исполь- зоваться соединения с шестью атомами углерода. Цитрат является также мощным активатором первой реакции в биосинтезе жирных кислот.
Центром регуляции путей биосинтеза обычно являются стадии, следующие непосредственноза точкой разветвления. Примером такой регуляции могут служить реакции биосинтеза аминокислот семейства аспарагиновой кислоты, изображенные на рис. 5.12, где штриховые линии обозначают пути ингибирования по принципу обратной связи. Выгоды разветвленной последовательности реакций с несколькими регулируемыми стадиями очевидны: таким путем в результате ограниченного числа реакций образуется несколько конечных продуктов, причем путь синтеза каждой аминокислоты регулируется независимо. Ha первый взгляд может показаться, что в этой системе есть один дефект: высокие концентрации лизина и треонина должны, вероятно, замедлять синтез гомосерина и метионина. Ha самом же деле этого не происходит, поскольку превращение аспартата в аспартил-β-фосфат катализируют три различных фермента. Активность одного из этих ферментов не регулируется, второй ингибируется лизином, а третий ингибируется треонином. Различные ферменты, катализирующие одну и ту же реакцию, называются изозимами или изоферментами. Точно так же превращение полуальдегида аспарагиновой кислоты в гомосерин катализируют два изофермента, один из которых не регулируется, а второй ингибируется треонином. Эти факты помогают понять, какосуществляется действенный и эффективный контроль сети реакций при любом сочетании избыточных концентраций продуктов метаболизма.
Целью того или иного процесса биохимической технологии может быть производство больших количеств определенных метаболитов. B таком случае стремление добиться максимальной производительности в отношении этих соединений, очевидно, вступает в противоречие с системами жизнеобеспечения и регуляции нативного организма. Чтобы заставить клетку продуцировать необходимые метаболиты достаточно эффективно (с точки зрения человека, но не «с точки зрения» клетки), часто пытаются модифицировать регулирующие метаболизм ферменты таким образом, чтобы свойственные нативной клетке системы регуляции не срабатывали и происходило перепроизводство нужных метаболитов. Ha этой проблеме мы еще остановимся в следующей главе в ходе изучения прикладной генетики. Здесь же нам осталось рассмотреть только стехиометрические й энергетические аспекты сочетания различных метаболических дутей, а также суммарнуюстехиометрию утилизации субстра- тов, клеточного роста, образования метаболитов и выделения теплоты. B качестве введения к этой теме мы познакомимся с природой конечных продуктов метаболизма, выделяемых клеткой в среду.

