Прежде чем начать изучение генетики клетки и экспрессии генетической информации на молекулярном уровне, мы должны вспомнить рассмотренные в гл. 2 состав и строение ДНК, трех разновидностей PHK и белков. Чтобы оценить важность рассматриваемых ниже механизмов, полезно напомнить, что белки, особенно ферменты, непосредственно определяют характер функционирования клетки путем регуляции осуществляющихся в ней химических реакций. Следовательно, в известной степени набор клеточных ферментов (типы ферментов и концентрации каждого из них) определяют метаболические процессы, т. е. природу и особенности осуществляющихся в клетке последовательных и параллельных реакций. Другие белки также выполняют важные для клетки функции (вспомните табл. 2.6). Очевидно, что любая дочерняя клетка должна получать от родительской клетки всю наследственную информацию, необходимую для синтеза тех же самых белков, которые присутствуют в исходной клетке. Механизмы передачи этой информации изучает генетика. B первом разделе настоящей главы мы узнаем, каким образом нуклеотидная последовательность неповторяющегося и, следовательно, информационного биополимера, дезоксирибонуклеиновой кислоты (ДНК), определяет ход белкового синтеза в клетке.
6.1.1. Процессы экспрессии генов
Мы уже знаем, что молекула ДНК представляет собой очень длинную двойную спираль, состоящую из двух цепей. Обе цепи представляют собой полимеры, построенные из четырех нуклеотидов, отличающихся друг от друга природой азотистого основания [аденина (А), гуанина (G), цитозина (C) и тимина (T)]. Две цепи в двойной спирали ДНК имеют комплементарные последовательности так, что A в одной цепи всегда связывается с T другой; аналогично связываются G и С.
Геном называют участок ДНК, кодирующий определенный белок. Экспрессия гена, в результате которой формируется аминокислотная последовательность соответствующего белка, представляет собой двустадийный процесс; промежуточным продуктом этого процесса является матричная (или информационная) рибонуклеиновая кислота (мРНК или иРНК). Ha первом этапе экспрессии гена, называемом транскрипцией, сложный олигомерный фермент PHK-полимераза катализирует синтез мРНК на матрице, роль которой выполняет ген. Ha втором этапе экспрессии гена на основе содержащейся в нуклеотидной последовательности мРНК информации синтезируется пептидная цепь с соответствующей аминокислотной последовательностью. B этом процессе, называемом трансляцией, участвуют различные компоненты клетки, в том числе центры и регуляторы пептидного синтеза – рибосомы, а также несколько различных транспортных PHK (тРНК), которые переносят химически активированные аминокислоты к месту синтеза пептидной цепи в соответствии с диктуемой мРНК последовательностью. Ниже мы рассмотрим эти процессы, а также генетический код, являющийся связующим звеном между нуклеотидной и аминокислотной последовательностями.
Транскрипция начинается со связывания фермента РНК-полимеразы с сигнальной нуклеотидной последовательностью, так называемым промотором, располагающейся на одной из комплементарных цепей ДНК. Связанная с РНК-полимеразой нуклеотидная цепь становится таким образом матрицей ДНК для синтеза молекулы мРНК. После частичного расплетания двойной спирали ДНК вблизи от комплекса РНК-полимеразы с промотором полимераза начинает двигаться вдоль матричной цепи ДНК в направлении 3` → 5`. При построении комплементарной ДНК последовательности однопепочечной молекулы мРНК соблюдается правило образования пар нуклеидов ДНК–PHK (вспомните разд. 2.3.2 или см. рис. 6.1). Синтезируемая мРНК располагается антипараллельно матричной цепи ДНК; следовательно, мРНК синтезируется от 5'-конца к З'-концу. B приведенном на рис. 6.1 примере матрицей является нижняя цепь ДНК. Транскрипция прекращается, т. е. синтез мРНК останавливается в тот момент, когда РНК-полимераза достигает специфической нуклеотидной последовательности матричной цепи (терминатора), сигнализирующей об окончании синтеза. Прежде чем перейти к рассмотрению следующих стадий, следует отметить, что РНК-полимераза связывается с ДНК и неспецифично в центрах, не являющихся промоторами. Неспецифично связанная полимераза не инициирует и не осуществляет транскрипцию.
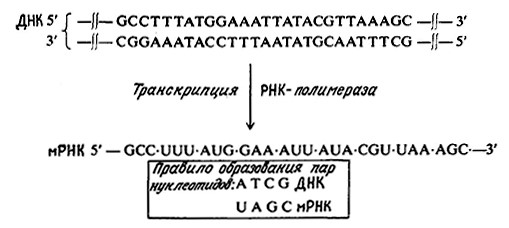
РИС. 6.1. Схематическое изображение транскрипции матричной (здесь транскрибируется нижняя цепь)
при участии фермента PHK ролимезы, в результате чего синтезируется молекула соответствующей
мРНК плементарной нуклеотидной последовательностью.
Длина молекулы мРНК изменяется от приблизительно 300 до 3000 нуклеотидных остатков и более. Обычно одна мРНК соответствует одному гену в цепи ДНК, но в некоторых случаях молекула мРНК несет генетическую информацию о группе родственных и тесно связанных генов – так называемом oneроне (см. разд. 6.1.4). Как мы уже отмечали при обсуждении энергетики биосинтеза в гл. 5, построение цепи PHK осуществляется путем отщепления пирофосфатной группировки от нуклеозидтрифосфатов. Следовательно, образование каждой фосфодиэфирной связи PHK сопровождается расщеплением двух высокоэнергетических фосфатных связей. Это способствует тому, что реакция конденсации протекает «до конца» в свидетельствует о важности синтеза этих биополимеров для нормального функционирования клетки.
Прежде чем перейти к описанию процесса трансляции, нам нужно несколько более детально ознакомиться с транспортными РНК. Известно, что каждая разновидность тРНК может транспортировать только одну соответствующую ей аминокислоту. Ha рис. 6.2 изображена вторичная структура аланил-тРНК из дрожжей. Присоединение аланильного остатка к соответствующей тРНК требует предварительной активации аланина путем его превращения в аланил-АМР, как это отражено в уравнении реакции (5.39). Активированный аланиновый остаток затем связывается с соответствующей тРНК при участии фермента, специфичного как в отношении аминокислоты, так и в отношении тРНК. Таким образом обеспечивается связывание аланина именно с аланиновой тРНК.
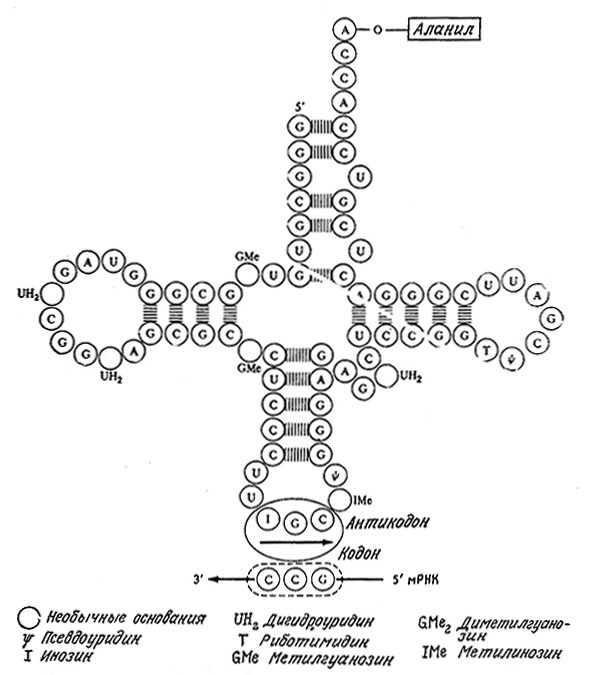
РИС. 6.2. Антикодон аланиновой тРНК узнает комплементарный кодон из трех оснований в мРНК
Теперь мы можем перейти к обсуждению природы специфичности тРНК. B основании нижней петли молекулы тРНК имеется последовательность из трех нуклеотидов, называемая антикодоном. Этот элемент структуры присутствует во всех изученных тРНК. Последовательность оснований антикодона комплементарна трехнуклеотидному сегменту мРНК, называемому кодоном. Изучение биохимии нуклеиновых кислот показало, что каждый кодон представляет собой «слово» в генетическом послании, т. е. каждый кодон соответствует одной аминокислоте. Поскольку химический алфавит PHK состоит всего лишь из четырех букв (четырех оснований А, С, G и U), а всего должно быть не менее 20 «слов» (по числу аминокислот), то для передачи генетической информации должен существовать специальный «язык» или код. Как это ни удивительно, но генетический код был полностью расшифрован; более того, оказалось, что он практически универсален для всех живых организмов – бактерий, растений и животных (рис. 6.3).
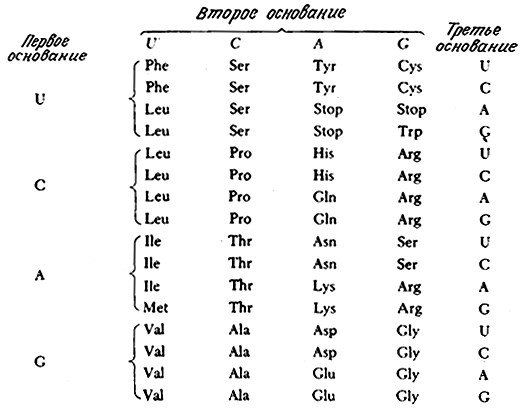
РИС. 6.3. Генетический код. Три кодона (Stop) сигнализируют о прекращении синтеза
пептидной цепи. Нетрудно видеть, что замена одного основания кодона (особенно третьего)
часто приводит к близкой аминокислоте (принцип надежности).
Процесс трансляции начинается со связывания меньшей из двух субъединиц рибосомы с молекулой мРНК с участием специфической последовательности, называемой связывающим рибосому сайтом. Этот сайт обычно расположен на определенном расстоянии, различном у прокариот и эукариот, «выше» кодона AUG, с которого почти всегда начинается считывание информации о последовательности полипептидной цепи. Здесь термин «выше» означает, что этот сайт расположен в направлении 5'-конца от кодона AUG. Последовательность кодонов, определяющая аминокислотную последовательность белковой цепи, начинается с кодона AUG и идет в направлении 5' → 3'.
Далее мРНК образует комплекс со всей рибосомой, и к этому комплексу присоединяются тРНК, несущие аминокислоты, которые отвечают двум первым кодонам мРНК. B соответствии) с заданной аминокислотной последовательностью между карбоксильной группой первой аминокислоты и аминогруппойв направлении 3' на один кодон; при этом высвобождается тРНК первой аминокислоты, после чего с комплексом связывается третья аминокислота в виде соответствующей аминоацил-тРНК и присоединяется к пептидной цепи, в результате чего последняя удлиняется еще на один остаток. Этот процесс удлинения полипептидной цепи (рис. 6.4) продолжается вплоть до терминирующего кодона (см. рис. 6.3); в этот момент пептидная цепь отделяется, а комплекс рибосомы и мРНК разрушается. Таким образом, построение полипептидной цепи начинается с N-концевого остатка и завершается С-концевым аминокислотным остатком.
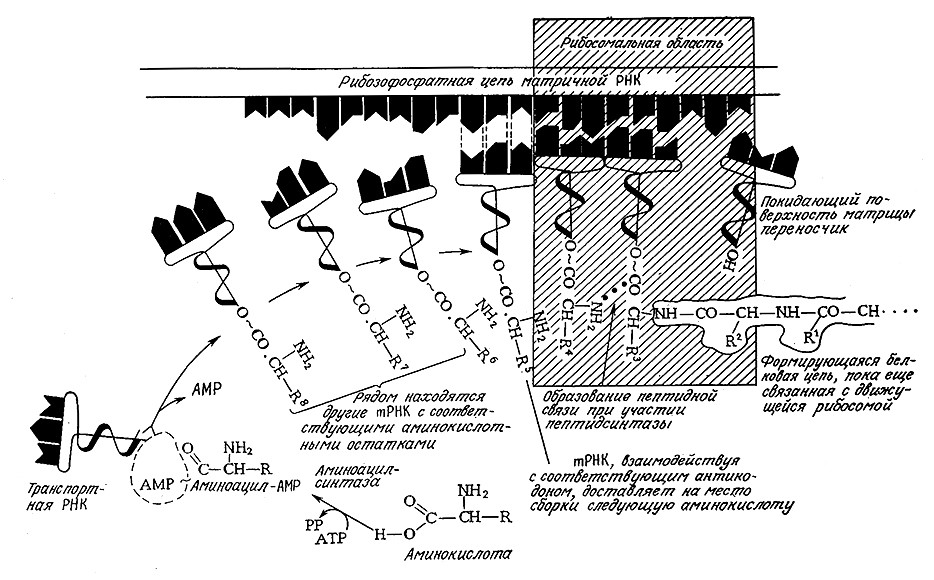
РИС. 6.4. Трансляция – реализация генетической информации мРНК в первичной структуре белка –
осуществляется путем ряда специфических взаимодействий между мРНК и тРНК на рибосоме.
Ha рис. 6.5 процесс трансляции изображен с другой точки зрения; здесь основное внимание уделено передаче информации от нуклеотидной последовательности мРНК к соответствующей аминокислотной последовательности полипептида. Образовавшаяся в результате транскрипции (рис. 6.1) гипотетическая мРНК транслируется в соответствующий полипептид. Обратите внимание на то, что здесь тринуклеотидная последовательность AUG выполняет две функции, указывая, во-первых, на начало кодирующей последовательности для белка и, во-вторых, кодируя метионин (Met) как N-концевой аминокисЛотный остаток полипептида. Заметьте также, что не вся молекула мРНК несет в себе информацию о структуре синтезируемого белка. Выше мы уже упоминали о предшествующем участку копирования связывающем рибосому сайте; другие нуклёотидные последовательности, в том числе кодирующие последовательности со своими инициирующими и терминирующими кодонами, могут быть расположены ниже (в направлении 5' → 3') кодирующей области.
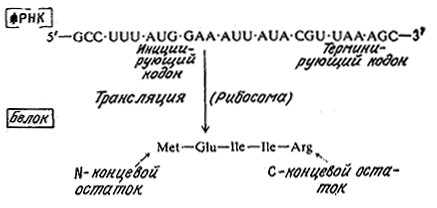
РИС. 6.5. Схема передачи (трансляции) информации, содержащейся в нуклеотидной последовательности мРНК,
аминокислотной последовательности соответствующего полипептида на рибосоме. Здесь изображена та же мРНК, что и на рис. 6.1.
Здесь полезно рассмотреть процесс экспрессии гена также с точки зрения регулирующих этот процесс элементов, поскольку контролирование последних немаловажно для успешного решения задач генетической инженерии. Ha рис. 6.6 в самом общем виде приведены важнейшие функции регуляторных последовательностей в процессе передачи генетической информации. Слева и справа от гена расположены последовательности промотора и терминатора, контролирующие начало (инициацию) и окончание (терминацию) транскрипции. ДНК должна содержать также регуляторные сигналы трансляции (связывающий рибосому сайт, кодон-иницизтор и терминирующий кодон), которые должны транскрибироваться в мРНК. Наконец, часть мРНК, комплементарная структурному гену ДНК, который кодирует определенную аминокислотную последовательность, должна использоваться для направления белкового синтеза в ходе трансляции.
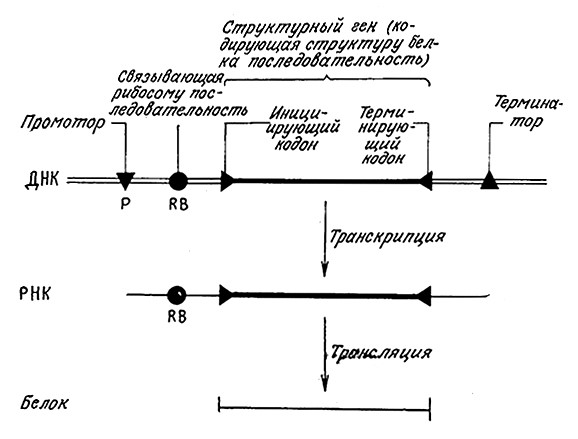
РИС. 6.6. Регулирующие и информационные последовательности ДНК направляют процессы транскрипции и трансляции (экспрессию гена).
Часто одна мРНК связывается с несколькими рибосомами. Полирибосомы (полисомы), представляющие собой сложные агрегаты из нескольких индивидуальных рибосом, часто обладают высокоупорядоченной структурой. B полирибосомах одновременно осуществляется считывание генетической информации с различных участков. мРНК, что существенно ускоряет белковый синтез и обеспечивает высокую эффективность этого процесса.
Как мРНК, так и тРНК, и рибосомальные рибонуклеиновые кислоты (pPHK) синтезируются на матрице – определенном участке цепи ДНК. Таким образом, ДНК содержит в закодированном виде информацию не только о первичной структуре белков, но и о строении различных веществ, с помощью которых осуществляется белковый синтез.
Здесь полезно напомнить, что взаимодействия между аминокислотными остатками полипептидной цепи определяют вторичную, третичную и даже четвертичную структуры белков (разд. 2.4). Следовательно, слабые взаимодействия между атомами и группами играют большую роль на всех этапах хранения генетической информации, ее передачи и реализации.
Прежде чем перейти к вопросу о механизмах передачи генетической информации, от поколения к поколению и о факторах, нарушающих этот процесс следует упомянуть о различиях в механизмах синтеза белков в эукариотах и прокариотах. B клетках бактерий синтез мРНК и трансляция мРНК в белки на рибосомах осуществляются почти в одном и том же центренуклеоида. B эукариотах транскрипция происходит в ядре. Затем молекулы мРНК претерпевают модификацию (описанную в следующем разделе), диффундируют через поры ядерной мембраны в цитоплазму и образуют комплексы с рибосомами, где и происходит процесс трансляции. B эукариотах и в меньшей степени в прокариотах продукт трансляции часто претерпевает модификацию, результатом которой является окончательная, функционально-активная молекула белка. Посттрансляционные модификации белков рассматриваются в разд. 6.1.3. Наконец, следует отметить, что в эукариотах и прокариотах процесс синтеза белка различно протекает и во времени; подробнее этот вопрос мы рассмотрим в разд. 6.5.
6.1.2. Расщепленные гены и модификация мРНК в эукариотах
Матричная PHK эукариот модифицируется путем присоединения к 5'-концу особого структурного элемента, называемого кэпом или кэп-структурой (остаток 7'-метилгуанозина); кэп-структура повышает устойчивость мРНК к действию фосфатаз и нуклеаз. Кроме того, к З'-концу большинства мРНК эукариот присоединяется последовательность поли-А, содержащая от 150 до 200 остатков дезоксиаденилата. Этот факт можно использовать при выделении эукариотических мРНК, сорбируя их на носителях, содержащих ковалентносвязанные олигонуклеотидные цепи поли-Т.
B настоящее время можно считать твердо установленным, что многие эукариотические гены представляют собой чередование последовательностей, кодирующих структуру белка и не несущих информацию о белковой структуре. Последовательности первого типа иногда называют экзонами, а некодирующие последовательности – интронами или промежуточными последовательностями. Последние, как следует из их названия, располагаются между экзонами и разделяют кодирующие последовательности участками, которые на первый взгляд содержат ненужную избыточную информацию. Очевидно, что в эукариотических клетках должны существовать механизмы, распознающие экзоны и интроны и обеспечивающие в процессе экспрессии гена непосредственную трансляцию одних только экзонов.
Основные структурные элементы эукариотического гена и главные этапы его экспрессии изображены на рис. 6.7. B верхней части рисунка расположен гипотетический сегмент структурного эукариотического гена, содержащий экзоны и интроны. Bo время транскрипции матричная цепь ДНК направляет синтез мРНК (первичного транскрипта) комплементарной всей последовательности матрицы, т. е. содержащей последовательности как экзонов, так и интронов.
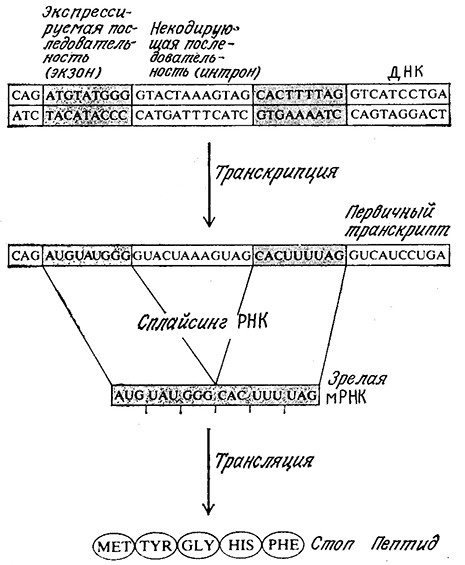
РИС. 6.7. B процессе экспрессии генов эукариот первичный транскрипт мРНК подвергается сплайсингу;
в результате образуется зрелая (активная) мРНК, участвующая в трансляции.
Здесь изображены гипотетические укороченные последовательности.
Далее следует характерная, по всей вероятности только для эукариот, стадия сплайсинга. B процессе сплайсинга участки мРНК, отвечающие интронам, вырезаются, а оставшиеся последовательности, комплементарные последовательностям экзонов, соединяются в том же порядке, в каком они располагались в первичном транскрипте. Образующаяся зрелая мРНК затем транслируется описанным выше путем, в результате чего синтезируется соответствующий данному гену белок.
Имеющиеся в настоящее время экспериментальные данные говорят о том, что почти все эукариотические гены содержат интроны. Впрочем, известно и несколько исключений из этого правила, в том числе гены α-интерферона человека. Интроны могут быть очень большими; возможно, что в состав интронов входит более половины всех нуклеотидных остатков ДНК.
Ko времени написания настоящей главы биологическая функция интронов оставалась невыясненной. Возможно, что интроны участвуют в регуляции экспрессии эукариотических генов. C точки зрения эволюции организмов интроны могут выполнять роль инструмента для осуществления относительно крупных изменений генов посредством включения или исключения последовательности целого интрона или экзона. Предполагалось также, что экзоны кодируют довольно крупные участки (домены) первичной структуры белков и что перестановка экзонов дает клетке возможность синтезировать новые белки и таким путем оценивать их функциональную пригодность. C технологической точки зрения с интронами связаны известные затруднения при экспрессии эукариотических генов в прокариотических клетках-хозяевах, поскольку последние не обладают аппаратом сплайсинга РНК. B разд. 6.3, посвященном технологии рекомбинантных ДНК, мы увидим, как можно преодолеть это затруднение.
6.1.3. Посттрансляционная модификация белков
Образующийся в результате трансляции мРНК полипептид часто еще не является зрелой, биологически активной формой белка. Иногда после трансляции от белка отщепляется N- концевой остаток метионина. B других случаях происходит окисление двух остатков цистеина, приводящее к образованию дисульфидной связи – важного фактора в закреплении третичной структуры белка (гл. 2). Присоединение к боковым цепям аспарагина, серина и треонина углеводных остатков приводит к гликопротеинам. B химической модификации (процессинге) полипептидов используются также реакции гидроксилирования, фосфорилирования и ацетилирования.
У некоторых полипептидов на N-конце имеется короткая (15–30 остатков) последовательность гидрофобных аминокислот. Подобные сигнальные последовательности играют большую роль в транспорте белков через клеточные мембраны. Секретируемые белки, как правило, содержат такие последовательности. K названию белков с сигнальными последовательностями обычно добавляют префикс «пре» (например, прелизоцим). Сигнальная последовательность отщепляется в процессе транспорта пребелка через мембрану, в результате чего образуется функционально активный белок (в нашем примере – лизоцим).
Белки могут содержать и другие аминокислотные последовательности, отщепляющиеся при их превращении в функционально активную форму. Наряду с упомянутыми выше механизмами секреции белков такие элементы структуры позволяют клетке осуществлять белковый синтез и активацию специфических белков в различных точках внутри клетки или вне ее. Молекула препроинсулина, например, построена из N-концевой сигнальной последовательности (24 аминокислотных остатка), за которой следует последовательность из 21 остатка (цепь В), затем еще из 21 остатка (цепь С) и, наконец, С-концевой участок из 30 остатков (цепь А). Сигнальная последовательность отщепляется в ходе секреции; образующийся проинсулин (цепи A–C–В) далее расщепляется под действием ферментов до инсулина, состоящего из соединенных двумя межцепочечными дисульфидными связями цепей A и В. B инсулине между цепями A и B пептидных связей нет (рис. 6.8).
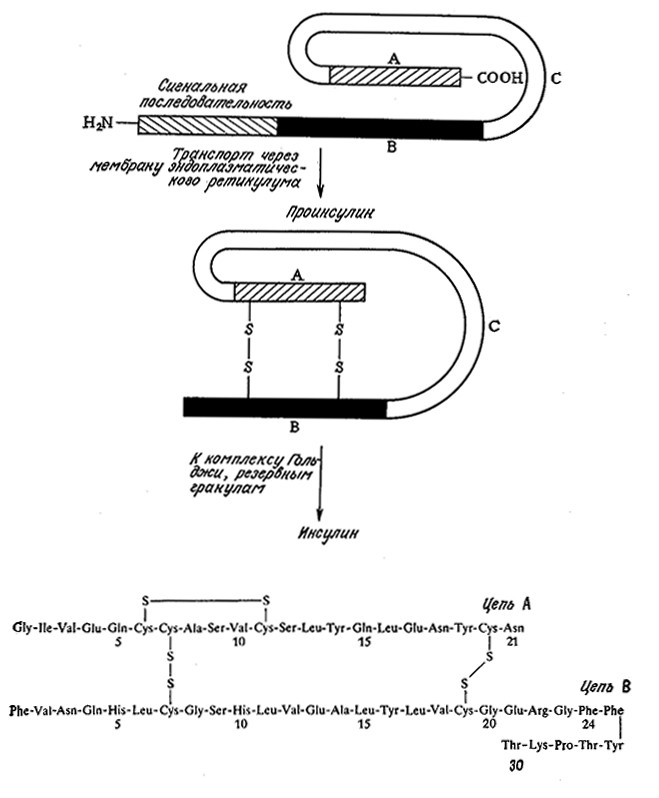
РИС. 6.8. Активная форма инсулина образуется в результате нескольких посттрансляционных превращений,
в том числе в результате отщепления сигнальной последовательности, образования дисульфидных связей и отщепления цепи С.
Ha рисунке приведена аминокислотная последовательность цепей A и B инсулина человека.
6.1.4. Индукция и репрессия; регуляция белкового синтеза
Мы уже знаем, что живые клетки обладают сложными системами управления, обеспечивающими высокую эффективность использования материальных и энергетических ресурсов. Из предыдущих глав мы узнали также, что активация и ингибирование ферментативной активности метаболитами позволяют направлять эти промежуточные вещества по необходимым путям в сложной сети клеточных реакций. B этом разделе мы рассмотрим другой уровень регуляции, принципиально отличающийся от указанных выше. Активация и ингибирование влияют на каталитическую активность уже имеющихся в клетке ферментов, но не изменяют количества последних. Таким образом, эти способы регуляции действуют на уровне ферментов. Напротив, рассматриваемые здесь механизмы регуляции – индукция и репрессия – изменяют скорости синтеза белков (и, следовательно, количества содержащихся в клетке ферментов) и осуществляются на уровне гена. По-видимому, сходство между этими двумя типами регуляции сводится лишь к их чувствительности по отношению к низкомолекулярным соединениям.
Здесь основное внимание мы будем уделять регуляции белкового синтеза на генетическом уровне в бактериях, поскольку именно в этих организмах лучше всего изучены молекулярные механизмы этих процессов. Аналогичные механизмы оперируют и в клетках высших растений и животных, однако последние располагают также гораздо менее изученной системой регуляции, направляющей дифференцировку клеток в процессе развития организма.
Прежде чем углубиться в детали механизмов индукции и репрессии, полезно попытаться оценить роль регуляции белкового синтеза в жизни микроорганизмов. B гл. 1 мы уже упоминали, что бактерии представляют собой изолированные, самостоятельно существующие клетки, и поэтому они практически не влияют на внешнее окружение. Отсюда следует, что бактерии должны обладать очень высокой способностью к адаптации; возможность эффективно функционировать в самых различных условиях может оказаться решающей для их выживания.
Многие бактерии и в самом деле обладают высокой приспособляемостью. Они могут синтезировать ферментные системы, способные эффективно утилизировать самые различные питательные вещества. Примером особенно универсального в этом отношении микроорганизма может служить бактерия Pseudo- monas multivorans, которая в качестве единственного источника углерода может использовать более 90 различных соединений, в том числе углеводы и их производные, жирные кислоты, дикарбоновые и другие органические кислоты, первичные спирты, аминокислоты и другие азотсодержащие соединения и даже циклические соединения, например фенол. Обычно для усвоения каждого питательного вещества необходим свой фермент. Следовательно, бактерия должна нести генетическую информацию в хромосомах клетки генетическая информация называется генотипом клетки.
Однако такой бактерии не нужны одновременно все ферменты, способные усваивать любые питательные вещества, а синтез лишних белков связан с непроизводительными затратами энергии и промежуточных метаболитов. Поэтому в данной среде в целях максимальной эффективности в бактериях претерпевает экспрессию (т. е. выражается в синтезе конкретных белков) только часть всей генетической информации. Под фенотипом понимают внешний облик организма. Учитывая изложенные выше факторы, можно сказать, что данный фенотип обусловливается сочетанием генотипа организма и условий среды (ero окружения). Конститутивные ферменты синтезируются независимо от состава и условий среды.
Напротив, скорость биосинтеза индуцибельных ферментов зависит от окружения клетки. Типичным примером такой зависимости может служить синтез β-галактозидазы. Этот фермент катализирует гидролиз дисахарида лактозы на составляющие его моносахариды глюкозу и галактозу. Указанная реакция необходима, если клетка вынуждена исполшовать лактозу в качестве питательного вещества, поскольку в последующих реакциях могут использоваться только моносахариды. Клетка бактерии E. coli регулирует синтез β-галактозидазы в соответствии с потребностью в этом ферменте. C появлением в среде лактозы «летка начинает синтез фермента; этот процесс ускоряется по мере повышения концентрации лактозы вплоть до максимально возможного, полностью индуцированного уровня (рис. 6.9). Taким образом, в конечном счете именно субстрат индуцирует образование фермента.
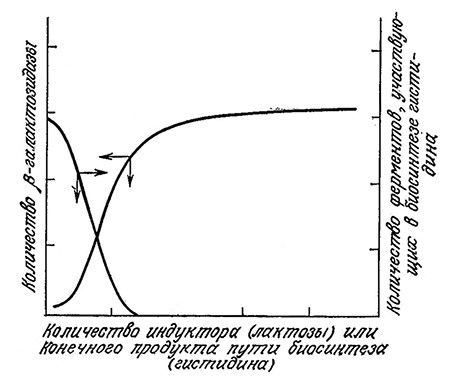
РИС. 6.9. Концентрация β-галактозидазы в клетке возрастает по мере повышения
концентрации индуктора (лактозы) в питательной среде.
Повышение в среде концентрации репрессора (гистидина) уменьшает содержание
в клетке ферментов, катализирующих биосинтез репрессора.
Аналогичная ситуация складывается в случае репрессибельных ферментов. Например, E. coli может синтезировать любые ферменты, необходимые для синтеза всех 20 аминокислот из более простых предшественников; в то же время если в питательной среде содержатся нужные аминокислоты, то соответствующие ферменты не образуются вклетке в сколько-нибудь значительных количествах. B этом случае конечный продукт пути биосинтеза подавляет синтез ферментов, катализирующих отдельные стадии этого же пути. Это явление также изображено на рис. 6.9, где в качестве примера приведен синтез гистидина.
Ha рис. 6.10 приведены модели процессов индукции и репрессии, разработанные Моно с сотрудниками во Франции и отражающие внутреннее сходство этих двух процессов. B обеих случаях экспрессия гена регулируется на уровне транскрипции и ген-регулятор продуцирует белок, взаимодействующий со специфической последовательностью ДНК, называемой oпepaтoром. Если белок-модулятоp связан с последовательностью оператора, то РНК-полимераза не взаимодействует с промотором; в результате блокируется процесс транскрипции и структурный ген не экспрессируется.B модели индукции (рис. 6.10, а) регуляторный ген продуцирует молекулу репрессора, который может предотвращать синтез фермента. Если в среде присутствует индуктор, то он· связывается с репрессором с образованием неактивного комплекса, не влияющего на последующую транскрипцию ДНК.
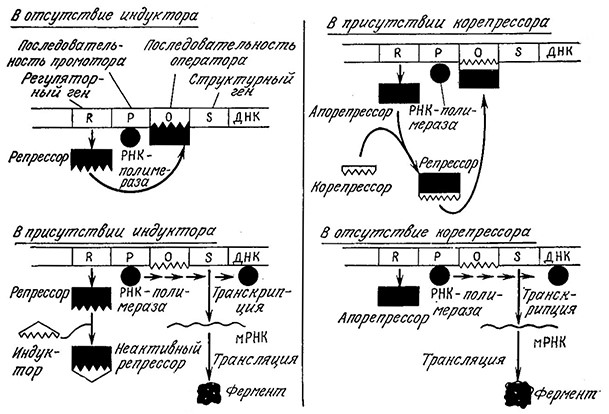
РИС. 6.10. Слева: индуктор (например, галактоза) инактивирует penpeccop таким образом, что последний не связывается
с соответствующей последовательностью оператора и не блокирует транскрипцию структурного гена (например, гена β-галактозидазы).
Справа: корепрессор (например, гистидин) взаимодействует с апорепрессором, образуя активный репрессор, который связываясь
с оператором, может блокировать экспрессию структурного гена, таким путем регулируется синтез репрессибельных ферментов.
B модели репрессии (рис. 6.10,6) регуляторный ген должен образовывать комплекс с другой молекулой, в результате чего и возникает репреосор. B отсутствие корепрессора (в приведенном здесь примере гистидина) белковый синтез не останавливается.
Подобные регулируемые промоторы могут одновременно контролировать синтез нескольких ферментов. При индуцировании синтеза β-галактозидазы, например, одновременно стимулируется и синтез двух других белков, одним из которых являете» Галактозидпермеаза, участвующая в активном транспорте β-галактозидов. Здесь налицо логическая связь между функциям» этих двух белков, поэтому координация их биооинтеза представляется вполне оправданной. Группа регулируемых совместно генов называется опероном; в частности, только что упомянутую систему называют lac-опероном. Количественный математический анализ регуляторных свойств lас-промотора-оператора мы рассмотрим позднее, в разд. 7.5.3.
Хотя в нашем обсуждении основное внимание уделяется регуляции синтеза ферментов в бактериях, аналогичные механизмы используются для контроля синтеза других белков в бактериях и в клетках высших растений и животных. B общем случае следует всегда иметь в виду, что синтезируемый клеткой набор белков и связанные с этим биологические и каталитические активности могут изменяться и часто действительно изМеняются в ответ на изменения состава и условий среды. Эта способность к адаптации обусловливает целый ряд проблем при анализе кинетики клеточных реакций и при расчете биореакторов; такие проблемы совершенно нетипичны для технологических процессов с использованием синтетических катализаторов.
Существует несколько вариантов контроля на генетическом уровне. Рассмотреть здесь все эти варианты не представляется возможным, однако следует упомянуть о катаболитной репрессии. Если бактерии E. coli культивируют в среде, содержащей глюкозу, и другой источник углерода, труднее включающийся в схему метаболизма, например лактозу, то преимущественно усваивается глюкоза. B этих условиях лактоза не индуцирует синтез β-галактозидазы. B быстро растущей на глюкозе клетке ингибируется образование циклического AMP. Концентрация цикло-АМР (рис. 2.8) оказывает влияние на активность промотора Iac-оперона таким образом, что при низких внутриклеточных концентрациях цикло-АМР индукция блокируется или ослабляется. Поскольку продукты катаболизма глюкозы снижают концентрацию цикло-АМР, то такой способ регуляции называют катаболитной репрессией.
Следует подчеркнуть, что катаболитная репрессия может осуществляться и в отсутствие глюкозы. Обычно бактерия, растущая на смеси источников углерода, селективно утилизирует наи более выгодный (т. е. обеспечивающий наивысшую скорость роста) из них и катаболически подавляет утилизацию менее выгодных питательных веществ. Что же произойдет, когда истощится первый источник углерода? (См. гл. 7, разделы, посвященные кинетике процессов брожения.)
Катаболитная репрессия играет важную роль и в синтезе продуктов метаболизма. При быстром росте клеток часто не синтезируются ферменты, необходимые для образования вторичных метаболитов. Отсюда следует, что перед технологом-биохимиком может возникнуть очень интересная и важная задача обеспечения минимальной катаболитной репрессии и максимального накопления вторичных метаболитов. Пути решения этой задачи мы обсудим в гл. 7, 9 и 10.
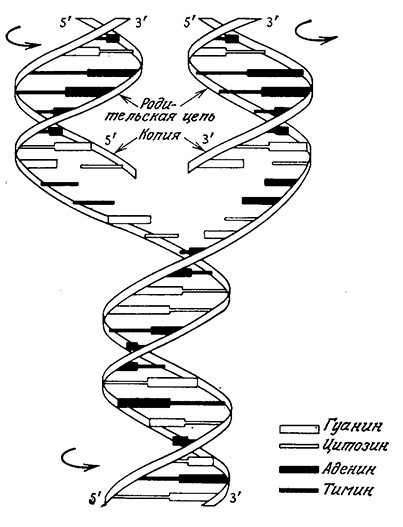
РИС 6.11. Упрощенная схема репликации ДНК. По мере разделения родительских цепей на каждой из них формируется комплементарная цепь, в результате чего образуются две идентичные родительской дочерние молекулы. Заметьте, что каждая дочерняя молекула содержит одну цепь родительской ДНК.
6.1.5. Репликация ДНК и мутации
Поскольку ДНК содержит всю информацию, необходимую для развития и жизнедеятельности клетки, то последняя должна обладать практически безошибочно функционирующим механизмом копирования ДНК. При самовоспроизведении клеток каждая из дочерних клеток должна получить полную генетическую
Поскольку ДНК содержит всю информацию, необходимую для развития и жизнедеятельности клетки, то последняя должна обладать практически безошибочно функционирующим механизмом копирования ДНК. При самовоспроизведении клеток каждая из дочерних клеток должна получить полную генетическую информацию в виде ДНК. Мы уже отмечали, что двуспиральная модель структуры ДНК обеспечивает точное воспроизных метаболитов. Отсюда следует, что перед технологом-биохимиком может возникнуть очень интересная и важная задача лементарная цепь, и в результате образуются две идентичные молекулы ДНК, каждая из которых содержит по одной цепи исходной ДНК. По-видимому, такая схема позволяет свести к минимуму ошибки в процессе репликации.
Ha самом деле процесс репликации ДНК осуществляется более сложным путем, чем это показано на рис. 6.11. Синтез ДНК представляет собой сложный ступенчатый процесс; особый фермент, называемый ДНК-полимеразой, легко строит дочерние цепи в направлении 5' → 3'. Этот процесс без затруднений происходит на одной из родительских цепей в направлении 3' → 5'. Ha другой цепи ДНК-полимераза подбирает фрагменты дочерней цепи в направлении 5' → 3' родительской цепи, а ковалентное связывание фрагментов осуществляет другой фермент– ДНК-лигаза. Таким образом происходит и синтез второй дочерней цепи в направлении 3' → 5'.
Таблица 6.1. Число хромосом в клетках различных организмов в нормальном состоянии

Здесь мы вкратце рассмотрим также различия в хранении информации и репликации между прокариотическими и эукариотическими ДНК. B нечетко отграниченном нуклеотиде прокариот имеется только одна хромосома (носитель генетической информации), содержащая кольцевую двойную спираль ДНК. Длина этой огромной молекулы составляет 1,2 мм, толщина около 20 ангстрем, а ее молекулярная масса равна примерно 2,8-109. Этого достаточно для кодирования приблизительно 2000 различных белков. Кольцевая природа ДНК E. coli впервые была выяснена в ходе генетических исследований, направленных на определение относительного расположения отдельных генов. Хромосома эукариот построена из молекулы ДНК, связанной с белками и, возможно, с небольшим количеством РНК. Как показано в табл. 6.1, эукарнотические клетки обычно содержат несколько хромосом. Некоторые эукариоты, например дрожжи, могут быть или гаплоидными (т. е. содержащими только по одной хромосоме каждого типа), или диплоидными, в каждой клетке которых содержится по две хромосомы каждого типа (за исключением, быть может, половых хромосом).
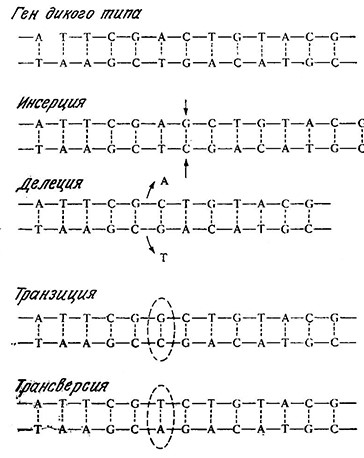
РИС. 6.12. Различные типы мутаций в последовательности пар оснований молекулы ДНК.
Мутацией называют изменение структуры ДНК, передающееся последующим поколениям. Ha молекулярном уровне мутация есть не что иное, как изменение нуклеотидной последовательности ДНК. Некоторые возможные варианты мутаций изображены на рис. 6.12. B какой-то степени мутация представляет собой спонтанный процесс, которому ДНК подвергается постоянно. Скорость спонтанных мутаций, однако, невелика и составляет в среднем 1 ошибку на миллион дупликаций гена.
Серьезность ошибки при копировании гена зависит от ее природы. При так называемой миссенс (изменяющей смысл) мутации кодон одной аминокислоты изменяется таким образом, что соответствующее место в аминокислотной последовательности белка занимает другая аминокислота. Этот тип мутации приводит, например, к аномальному гемоглобину, характерному для человека, страдающего серповидно-клеточной анемией; в этом конкретном случае в аномальном белке вместо Glu появляется остаток Val. Согласно генетическому коду (рис. 6.3), остаток Glu кодируют кодоны GAA и GAG, а валину соответствуют кодоны GUA и GUG. Отсюда следует, что замена всего лишь одного основания может приводить к тяжелому наследственному заболеванию. Другие изменения в кодонах могут приводить, например, к терминирующему кодону и тем самым вызывать преждевременное прекращение пептидного синтеза; мутации такого типа называются бессмысленными (нонсенс-мутациями).
Предлагалось несколько механизмов спонтанных мутаций. Во-первых, нуклеотидные основания ДНК могут существовать в нескольких структурно различных формах, называемых таутомерными. Предполагается, что изображенные на рис. 2.7 структуры доминируют в нативной ДНК; вместе с тем не исключается возможность и других таутомеров, образование пар оснований с которыми может приводить к ошибкам. Другая возможная причина спонтанных мутаций связана с функционированием ферментов, необходимых для синтеза и репарации (восстановления повреждений в структуре) ДНК. Наконец, некоторые промежуточные соединения в нормальном метаболизме клетки, например пероксиды, азотистая кислота, формальдегид, являются мутагенами, т. е. веществами, способными индуцировать химические мутации ДНК.
Действие химических мутагенов на ДНК широко изучалось путем выращивания клеток в среде, обогащенной такими агентами. K числу мутагенов относятся, например, соединения, структура которых блиэка структуре обычных оснований ДНК. B силу близости их строения и химических свойств в процессе биосинтеза ДНК в нуклеотидную цепь может быть включен не обычный нуклеотид, а его аналог. Другие типы мутагенов и способы проявления ими мутагенной активности приведены в табл. 6.2.
Второй общей причиной мутации является радиация. B частности, ДНК интенсивно поглощает ультрафиолетовое излучение, и при достаточной дозе это излучение довольно быстро убивает большинство клеток, а выжившие клетки подвергаются очень глубокой мутации. Любая клетка имеет в своем распоряжении ферментативные механизмы для репарации ДНК, поврежденной ультрафиолетовым излучением. Эти фермеиты довольно сложным путем заменяют поврежденный сегмент, содержащий ковалентно-связанные пиримидиновые остатки.
B биохимической технологии явление мутации важно с нескольких точек зрения. Вспомните, например, рис. 1.10, на котором показано, как с помощью мутаций можно изменить природу микроорганизма, чтобы он стал более полезным для какой-либо определенной дели. Мутагены и ультрафиолетовое излучение часто используются для создания мутантов протистов, потенциально обладающих более высокой продуктивностью. B любой работе по изысканию новых штаммов микроорганизмов важно иметь в своем распоряжении эффективные способы идентификации и выделения мутантов, обладающих специфическими свойствами. B табл. 6.3 перечислены некоторые основные методы, применяющиеся для этой цели. Другие подходы к генетической трансформации продуцирующих организмов мы рассмотрим в разд. 6.2 и 6.3.
Таблица 6.2. Химические мутагены и соответствующие способы проявления мутагенной активностиа

C другой стороны, мутации могут создавать в биотехнологии и ряд затруднений. Для успеха микробиологического промышленного процесса часто необходимы чистые штаммы микроорганизмов, обладающие хорошо известными характеристиками. Вместе с тем никогда нельзя исключать возможность мутаций в таких культурах, поэтому необходима регулярная проверка их генетической гомогенности. Другие практические проблемы, связанные с мутациями и иными типами генетической нестабильности, мы рассмотрим в последующих главах.
6.1.6. Общая схема потока информации в клетке
Известная пословица гласит, что лучше один раз увидеть, чем сто раз услышать. Рис. 6.13, на котором в компактном виде изображена схема каналов регуляции и передачи информации в клетке, еще раз подтверждает эту истину. Ha схеме четко видна взаимосвязь между регуляцией и передачей информации. Обратите внимание на то, что система контроля построена по каскадному типу: активация и ингиоирование (на уровне ферментов) позволяют клетке быстро приспособиться к кратковременным изменениям в химическом балансе клетки, в то время как индукция и репрессия (на уровне генов) дают возможность изменить всю картину метаболизма в тех случаях, когда однажды изменившиеся условия и состав среды далее стабилизируются на достаточно длительный период.
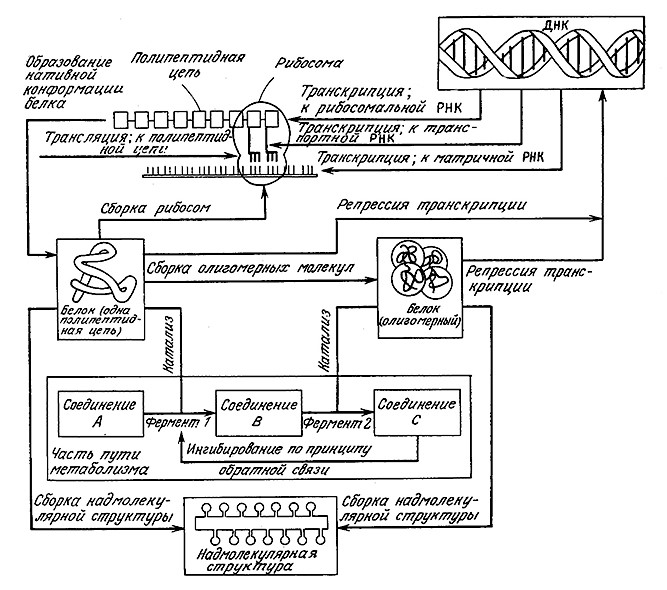
РИС. 6.13. Ha этой схеме, изображающей информационные потоки в клетке, можно выделить различные уровни систем регуляции, передачи и переработки информации.

