He только мутации, но и многие другие процессы могут изменять генетический материал клетки. C точки зрения промышленной биотехнологии эти процессы могут иметь как положительный, так и отрицательный эффекты. C одной стороны, любой метод изменения структуры клеточной ДНК может быть полезен для получения более продуктивных штаммов. С другой стороны, неожиданная модификация определенной ДНК может вызвать крайне нежелательные последствия для промышленного биотехнологического процесса.
Большая часть приведенного ниже материала относится только к бактериям, причем в большинстве случаев соответствующие исследования проводились на Е. coli. Прежде всего рассмотрим методы слияния клеток, позволяющие осуществлять генетические модификации, а разд. 6.4 посвящен методам с применением рекомбипантных ДНК и их использованию. Мы не будем рассматривать сложные специфические процессы половой рекомбинации, которые оперируют во многих эукариотах. Краткое введение в эту тему в контексте промышленно важных микроорганизмов можно найти в книге Эландера [4]·
6.2.1. Вирусы и фаги; лизогения и трансдукция
Мы знаем, что вирусы вызывают целый ряд заболеваний человека, в том числе обычные респираторные заболевания, грипп, оспу, полиомиелит, желтую лихорадку, свинку, корь и многие другие. Они способны поражать и бактерии; вирусное заражение может крайне неблагоприятно влиять на различные промышленные биологические процессы с участием бактерий, в частности в сыроделии и производстве антибиотиков. Вирусы, заражающие бактерии, называют бактериофагами или просто фагами.
Вирусные частицы построены из белков и нуклеиновой кислоты и могут включать, кроме того, липопротеины. Основная функция вирусных бельков заключается в создании оболочки (капсида), защищающей вирусную нуклеиновую кислоту, а иногда в адсорбции вируса на поверхностных рецепторах живых клеток. Вирусное заражение и его последствия обусловливаются именно нуклеиновой кислотой ДНК или РНК. В табл. 6.4 перечислены свойства ряда вирусов; вирусная нуклеиновая кислота может быть одно- или двухцепочечной, линейной или кольцевой.
Таблица 6.4. Характеристики некоторых вирусова

Вне живой клетки определенного типа вирус представляет собой инертную частицу, не способную к самовоспроизведению. Вирус размножается только после проникновения в клетку-хозяина. Таким образом, вирусы являются типичными паразитами. Короткая сводка основных различий между вирусами и живыми клетками приведена в табл. 6.5.
Теперь рассмотрим типичный «жизненный цикл» вирусов на примере инфицирующего бактерию Е. coli виру с а, называем ого фагом λ. Фаг прикрепляется к клеточной стенке и затем вводит свою ДНК в клетку. Начиная с этого момента возможны два альтернативных пути. В одном из этих путей, называемом лизогенией, ДНК фага (ее в этом случае называют профагом) внедряется в хромосому бактерии. В этом случае клетка нормально живет и самовоспроизводится, одновременно копируя профаг и создавая таким образом новые лизогенные клетки. Подобные фаги, находящиеся в лизогенном взаимодействии с клеткой-хозяином, называют умеренными.
Другой возможный вариант возникновения заражения клетки фагом называется литическим циклом; он неизбежно приводит к гибели клетки-хозяина. Инфекция литическими фагами, например фагом T2, всегда приводит к литическому циклу. Во время литического цикла фаг находится в так называемом вегетативном состоянии, когда ДНК фага, по сути дела, контролирует все клеточные процессы. Прежде всего фаговая ДНК заставляет рибосомы синтезировать ферменты, разрушающие ДНК клетки-хозяина (эта особенность, впрочем, присуща не всем вирусным инфекциям) и содействующие многократному копированию фаговой ДНК. Затем синтезируются белки, необходимые для формирования интактных частиц фага. Эти белки спонтанно соединяются с ДНК фага, образуя зрелые высокоорганизованные частицы бактериофага. По завершении процесса самосборки множества новых фагов начинается синтез фермента лизоцима. Как мы уже знаем, этот фермент разрушает муреин клеточных стенок бактерий. Таким путем осуществляется лизис, в результате которого клетки разрушаются, высвобождая множество фагов.
Таблица 6.5. Сравнение свойств вирусов и клеток

Уже этот краткий обзор природы фагов достаточно ясно показывает, почему фаговая инфекция промышленных культур бактерий может представлять собой серьезную проблему. Частицы фагов очень малы, в соответствующей среде они могут размножаться очень быстро, и в то же время в состоянии относительного покоя – лизогении их обнаружение может быть непростой задачей.
Иногда в процессе репродукции фага в клетке-хозяине образуются фаговые частицы, содержащие небольшой фрагмент (примерно от 1 до 2%) хромосомы клетки-хозяина. Когда такой трансдуцирующий фаг вводит свою ДНК в другую бактерию, перенесенная из первой клетки ДНК может подвергнуться крос- синговеру с фрагментом хромосомы нового хозяина. Результатом этого процесса, называемого трансдукцией, может быть изменение генетических характеристик клетки – нового хозяина фага. Обычно, кроссинговер осуществляется только между фрагментами ДНК, содержащими гомологичные нуклеотидные последовательности, которые контролируют сходные характеристики клеток. Например, в результате трансдукции фаг может перенести небольшой фрагмент ДНК, обеспечивающий усвоение лактозы, от утилизирующего лактозу штамма Е. coli к другому штамму Е. coli, неспособному выполнять эту операцию. На рис. 6.14 приведена упрощенная схема трансдукции и кроссинговера сегментов ДНК.
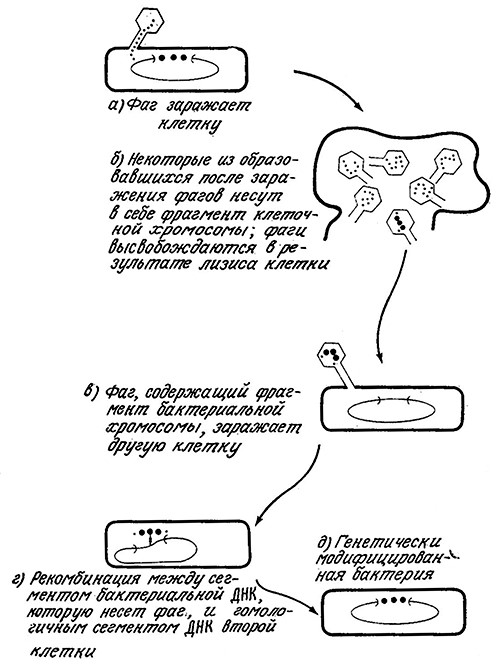
РИС. 6.14. Схематическое изображение модификации бактериальной хромосомы
путем трансдукции – процесса, протекающего при участии бактериофагов.
Известно, что трансдукцию легко претерпевают многие актиномицеты. В ходе изучения трансдукции в Streptomyces griseus с помощью фагов удалось передать способность синтезировать антибиотик стрептомицин от продуцирующего к непродуцирующему штамму. Некоторые из подвергшихся трансдукции культур обладали большей продуктивностью в отношении антибиотика, чем даже исходные синтезирующие штаммы.
6.2.2. Трансформация и конъюгация в бактериях
Под трансформацией понимают процесс переноса генетической информации из одной клетки в другую в виде свободной ДНК. В этом процессе фрагмент двухцепочечной ДНК проникает в клетку-реципиент, находящуюся в специфическом состоянии, когда она способна включать чужеродную ДНК (такие клетки называют компетентными). Если перенесенный фрагмент аналогичен фрагменту ДНК реципиента, то хромосома последнего быстро трансформируется путем кроссинговера.
Механизм трансформации позволяет включать в живые бактерии не только фрагменты хромосом, но и плазмиды. В разд. 2.3 мы узнали, что плазмидой называется молекула ДНК, существующая и реплицирующаяся независимо от бактериальной хромосомы. Плазмиды обычно представляют собой относительно небольшие кольцевые молекулы с молекулярной массой порядка 106-108 (рис. 6.15). Трансформация с помощью плазмид является одним из основных приемов в методе направленного изменения структуры ДНК, рассматриваемом в разд. 6.3.
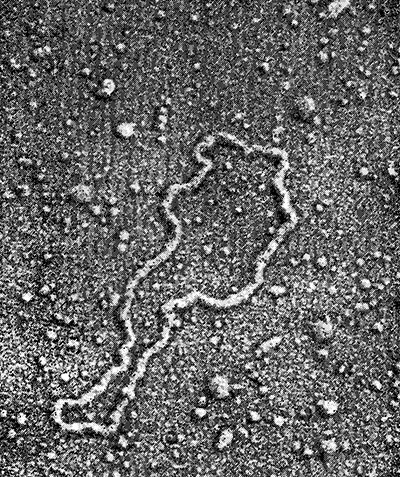
РИС. 6.15. Электронная микрофотография плазмиды pSC101 (Х230 000).
Эта кольцевая ДНК, существующая и реплицирующаяся независимо
от бактериальной хромосомы, была важным инструментом
в первых экспериментах с рекомбинантными ДНК.
Плазмиды обычно не выполняют каких-либо существенных функций в нормальных условиях жизнедеятельности клетки, но в то же время могут обеспечивать клетку рядом полезных (в специфических условиях) качеств. Установлено, например, что плазмиды, называемые R-факторами (факторами устойчивости), обусловливают устойчивость бактерий K антибиотикам.
Плазмидам близки так называемые эписомы – молекулы ДНК, которые могут или быть составной частью клеточной хромосомы, или существовать независимо от нее. Один из наиболее известных примеров эписом – фактор F (фактор фертильности), характеризующий клетки Е. coli при их конъюгации. В процессе конъюгации Е. coli содержащие F-фактор клетки (F+-клетки) передают его клеткам, не имеющим фактора F (F–клеткам); иногда и часть хромосомы F+-Клетки также передается F–-клетке. Аналогичным образом могут передаваться и R-факторы. Впрочем, некоторые F+-мутанты, обозначаемые Hfr, ведут себя по-иному; они не инфицируют F–-клетку F-фактором, а передают ей большую часть своей хромосомы, которая в результате кроссинговера с хромосомой F–- клетки образует генетически модифицированные штаммы.
Многочисленными экспериментами показано, что хромосома F+-клетки проникает в F–-клетку в линейном порядке в виде нити; если процесс прерывать через различные промежутки времени, то в F–-клегках будут находиться участки хромосомы различной длины. Последующее сравнение характеристик популяций клеток-реципиентов, содержащих различные количества хромосомного материала из F+- клеток, позволяет выяснить расположение генетического материала в хромосоме F+-клегки. Именно таким путем были получены детальные генетические карты типа изображенной на рис. 6.16. На этой карте обозначены относительные положения характерных для различных мутантов генов. Например, символ thr указывает ген, характерный для мутанта, который растет только в присутствии треонина. Расшифровка многих подобных обозначений приведена в монографии Уотсона.
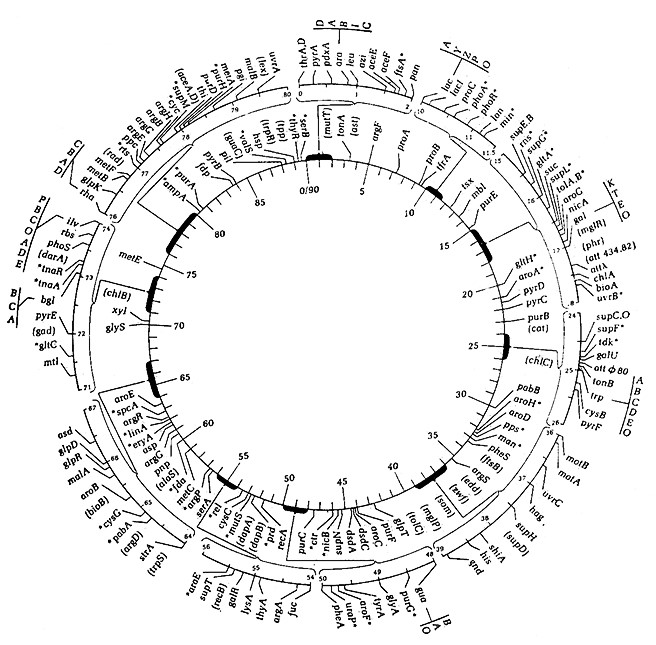
РИС. 6.16. Генетическая карта Е. colt К12, на которой показаны относительные положения различных генов в кольцевой хромосоме.
6.2.3. Слияние клеток
Глубокие генетические изменения, включающие кроссинго- вер генетического материала различных видов, могут быть достигнуты путем слияния клеток разных типов. Как показано на схеме слияния клеток микроорганизмов (рис. 6.17), первой стадией этого сложного процесса является получение протопластов– клеток, лишенных наружных стенок и окруженных только плазматическими мембранами. Для этой цели применяют различные ферменты (гидролазы клеточных стенок), а процесс гидролиза проводят в строго гипотонической среде, чтобы свести к минимуму разрушение протопластов под влиянием осмотического давления. Инкубирование протопластов приводит к регенерации клеточных стенок и восстановлению нормальной клеточной морфологии. Это обстоятельство играет решающую роль во всем процессе, поскольку в результате слияния протопластов различных штаммов нам, очевидно, необходимо в конце концов получить организм, который можно было бы далее культивировать в обычных условиях, в том числе и в крупномасштабном промышленном производстве. Слияние протопластов обычно осуществляют в растворе полиэтиленгликоля (ПЭГ), который индуцирует этот процесс, а для выделения продуктов слияния протопластов применяют методы селекции, аналогичные использующимся в традиционной генетике микроорганизмов (табл. 6.3).
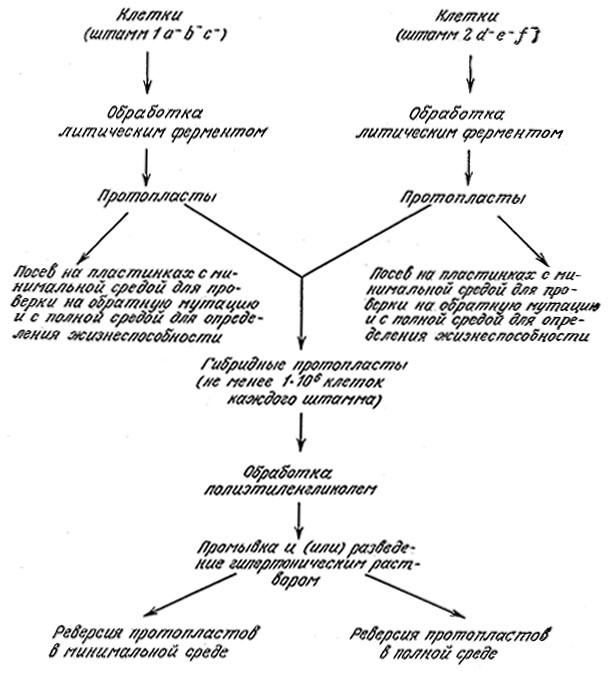
РИС. 6.17. Основные этапы работы по получению и выделению новых штаммов путем слияния
протопластов двух различных исходных штаммов.
Описанным путем успешно получали гибридные клетки различных штаммов Penicillium, Aspergillus, Streptomyces, CephaIosporiumf дрожжей и бактерий. Межвидовые гибриды получены, в частности, между различными видами Penicillium, Aspergillus, между Saccharomyces eerevisiae и Saccharomyees diastatieus, между Candida tropiealis и Saccharomyees fibuligera. Гибриды существенно различающихся видов недостаточно стабильны и через несколько поколений часто превращаются в один из родительских видов, однако в целом метод слияния протопластов представляет собой очень интересный способ существенной перестройки генетического материала клетки в одну стадию. В настоящее время проводится изучение возможности слияния протопластов быстро растущих штаммов Streptomyees с мутантными высокопродуктивными, но медленно растущими штаммами.
Метод слияния клеток может применяться и для получения гибридов клеток растительных или животных организмов. Примером могут служить имеющие уже сейчас большое практическое значение и очень перспективные гибридомы, образующиеся при слиянии продуцирующих антитела клеток лейкоцитов с клетками миеломы (рака кожи) мыши или другого животного. Каждая гибридомная клетка синтезирует только один тип антител, поэтому полученная из одной гибридомы культура клеток продуцирует моноклональные антитела. Напротив, если антитела получают путем введения в организм, например кролика, белка или другого антигена, то этот организм одновременно синтезирует множество антител, специфичных в отношении различных участков молекулы антигена. Моноклональные антитела уже в настоящее время представляют собой важный инструмент исследования и служат основой для применяемых сейчас или разрабатываемых многочисленных методов диагностирования заболеваний. В иммобилизованной форме моноклональные антитела являются чрезвычайно специфичными аффинными адсорбентами, пригодными для выделения и очистки антигенов в лабораторных и промышленных масштабах. В перспективе моноклональные антитела могут оказаться очень ценными агентами для интроскопии опухолей и транспорта лекарственных препаратов к определенным типам клеток организма.
Небольшие количества моноклональных антител удобно получать путем инокуляции гибридомных клеток в брюшную полость иммунологически совместимой мыши. Развивающаяся опухоль выделяет моноклональные антитела в окружающие опухоль жидкости организма; концентрация антител в последних достигает 1–20 мг/мл. Гибридомы можно выращивать и в культуре. В настоящее время большое внимание уделяется разработке и внедрению в производство новых конструкций реакторов, позволяющих повысить плотность клеток и их продуктивность в отношении антител, а также поиску путей снижения стоимости моноклональных антител при их крупномасштабном производстве.

