Достижения молекулярной биологии и результаты изучения закономерностей систем регуляции клеточных процессов имеют важные практические приложения. Некоторые из этих приложений, связанные с возможностью определения положения нужного или вредного гена и с последующими попытками различными методами модифицировать этот ген, были рассмотрены в предыдущем разделе. Другой подход основан на индуцировании мутации в более продуктивный штамм; о результатах такого подхода мы уже упоминали в гл. 1 в связи с повышением выхода пенициллина за счет использования особых штаммов, полученных путем ряда последовательных мутаций. В заключительной части настоящего раздела мы рассмотрим ряд других микробиологических процессов, основанных главным образом на применении специально выведенных мутантных штаммов.
Часто повышенная продуктивность мутантного микроорганизма легко объясняется изменениями в основных системах регуляции клетки. Понимание механизмов, контролирующих биосинтез необходимого продукта метаболизма, важно еще и потому, что только на этой основе можно принять обоснованное решение об обеспечивающем максимальную продуктивность составе питательной среды и о способах ее контроля. Влияние среды на продуктивность клеток мы и рассмотрим в первую очередь.
6.3.1. Системы клеточной регуляции; влияние состава среды
Существуют два подхода к решению проблемы повышения продуктивности клеток путем изменения состава среды: во-первых, можно ввести в среду индуцирующие вещества и, во-вторых, попытаться снизить количество репрессора. На первый взгляд оба этих подхода довольно очевидны, однако их практическое использование может быть связано с рядом трудностей.
Чрезвычайно эффективными индукторами биосинтеза ферментов помимо самого субстрата могут быть не подвергающиеся метаботическим превращениям аналоги субстратов. Например, галактозиды, в частности изопропил-β-D-тиогалактозид, могут повышать удельную β-галактозидазную активность Е. coil более чем в 1000 раз. Аналоги других субстратов эффективны в отношении соответствующих ферментов; так, N-ацетилацет- амид повышает амндазную активность, метидиллин ускоряет биосинтез пенициллин-β-лактамазы, а малоновая кислота способствует повышению малеатизомеразной активности.
Известно, что во многих практически важных процессах биосинтез продукта метаболизма может тормозиться за счет катаболитной репрессии. Доступность быстро усваиваемого субстрата, например сравнительно концентрированных растворов глюкозы, стимулирует рост клеток, но в то же время тормозит синтез антибиотиков пенициллина, митомицина, бацитрацина и стрептомицина. Выход пенициллина значительно повышается в условиях искусственной диауксии (рис. 7.14), т. е. при добавлении к глюкозной питательной среде медленно метаболизирующегося сахара типа лактозы. В таких условиях биомасса растет на глюкозе, а синтез пенициллина осуществляется по мере усвоения лактозы. Тот же самый эффект может быть достигнут и другим путем, если глюкозу медленно добавлять к питательной среде.
В качестве других примеров репрессоров, концентрации которых легко регулируются путем изменения состава среды, можно привести неорганический фосфат, подавляющий синтез фосфатазы в Е. coli и нуклеазы в Aspergillus quernicus, а также аммиак, подавляющий биосинтез уреазы в Proteus retgeri. Например, путем снижения концентрации фосфатного иона в питательной среде можно повысить содержание щелочной фосфатазы в Е. coli от практически нулевого уровня до примерно 5% от массы всех белков клетки. Аналогично снижение концентрации аминокислот или сульфатного иона существенно ускоряет синтез протеаз бактериями или водорослями Aspergillus niger соответственно.
Труднее поддерживать низкую концентрацию репрессора, если последний синтезируется микроорганизмом. Один из возможных подходов к решению этой задачи сводится к модифицированию клеточной мембраны таким образом, чтобы репрес- сор легко диффундировал из клетки в среду. Такой подход используется, в частности, в очень эффективном производстве глутаминовой кислоты с участием Corynebacterium glutamicum, когда выделение глутаминовой кислоты в среду индуцируется снижением концентрации 'биотина. В присутствии избытка биотина концентрации других аминокислот внутри клетки достигают максимума. Хотя механизм этого эффекта не известен, некоторые экспериментальные факты свидетельствуют о том, чтобиотин влияет на фосфолипидные компоненты клеточной мембраны.
В следующем разделе мы рассмотрим другие методы борьбы с отрицательными эффектами репрессоров.
6.3.2. Применение ауксотрофных мутантов
Ауксотрофные мутанты (методы их селекции и идентификации приведены в табл. 6.3) отличаются отсутствием ферментативной активности, необходимой для осуществления одной или нескольких стадий в каком-либо из биосинтетических путей. В результате ауксотрофы не способны синтезировать конечный продукт этого пути метаболизма. Такой мутант может выжить только при наличии в питательной среде несинтезируемого метаболита. Например, триптофановый ауксотроф будет расти только в присутствии триптофана. Если штамм сам синтезирует триптофан, то его называют прототрофным по триптофану.
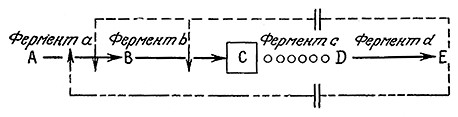
РИС. 6.18. Для повышения выхода промежуточных продуктов какого-либо пути метаболизма
можно использовать ауксотрофные мутанты. В приведенном здесь гипотетическом примере
у мутанта отсутствует фермент с и, следовательно, не синтезируется penpeccop Е.
Поскольку отсутствующие метаболиты вводятся в питательную среду, а не синтезируются ауксотрофом, то концентрации этих метаболитов регулирует, по сути дела, не микроорганизм, а инженер-технолог. С практической точки зрения такая ситуация может быть очень удобной, если несинтезируемый продукт метаболизма является репрессором. Как показано на рис. 6.18, неспособные к синтезу репрессора ауксотрофные мутанты можно заставить перепроизводить тот или иной промежуточный продукт метаболизма. Поддерживая в среде низкую концентрацию репрессора Е, можно свести к минимуму процессы ингибирования по принципу обратной связи и подавления активности ферментов (участвующих в данном пути метаболизма). При этом промежуточное соединение С (обычно являющееся субстратом фермента с, отсутствующего в данном мутанте) образуется в гораздо более высокой концентрации, чем в нативном организме.
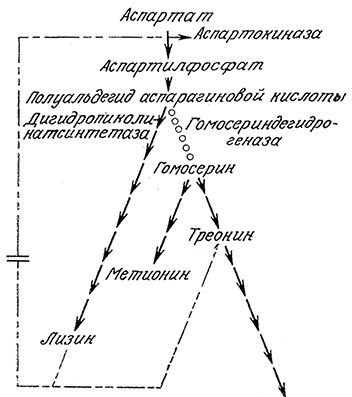
РИС. 6.19. Мутант С. glutamicum, у которого отсутствует фермент гомосерин-
дегидрогеназа, продуцирует повышенные количества L-лизина.
Как мы уже указывали в конце предыдущего раздела, в подобной ситуации может возникнуть потребность в дополнительных операциях, обеспечивающих диффузию промежуточного вещества С через клеточную мембрану в среду.
На рис. 6.19 изображен механизм, лежащий в основе промышленного способа производства L-лизина с участием ауксо- трофного мутанта С. glutamicum. В высокопродуктивном мутанте отсутствует фермент гомосериндегидрогеназа, поэтому ингибирование синтеза лизина треонином (через аспартокиназу) у этого мутанта не наблюдается. Поскольку ауксотрофный мутант не синтезирует ни треонин, ни метионин, то обе эти аминокислоты должны добавляться к питательной среде.
Сравнение регуляции путей биосинтеза аминокислот семейства аспарагиновоп кислоты в С. glutamicum (рис. 6.19) и в Е. coli (рис. 5.12) приводит к важному выводу: организмы, обладающие сходными путями биосинтеза, не обязательно имеют идентичные системы регуляции. Обратите внимание, в частности, на то, что на схеме рис. 5.12 лизин автоингибирует свой собственный биосинтез с помощью реакции, ведущей к дигидропиколиновой кислоте. В диком (немутантном) штамме С. glutamicum соответствующая стадия ингибирования отсутствует. Обнаруженная в Corynebacterium. аспартокиназная система, по-видимому, отличается от системы Е. coli тем, что первая подавляется только при совместном присутствии лизина и треонина (согласованное или поливалентное ингибирование по принципу обратной связи), а изоферменты аспартокиназы в Е. coli ингибируются одним лизином. Именно по этим причинам с промышленной точки зрения выгоднее использовать Corynebacterium.
Аналогичный подход успешно применялся при разработке высокоэффективных микробиологических процессов производства вкусовых веществ– пуриновых нуклеотидов гуанозинмонофосфата (GMP), инозинмонофосфата (IMP) и ксантинмонофосфата (XMP). Как показано на рис. 6.20, минимизация концентраций AMP и GMP с помощью ауксотрофного мутанта Brevibacterium ammoniagenes позволяет интенсифицировать биосинтез инозина и гипаксантина. Концентрация последних в среде возрастает при добавлении небольших количеств (около 10 мкг/л) ионов марганца (Mn2+). Имеющиеся в настоящее время данные показывают, что марганец изменяет проницаемость клеточных мембран.
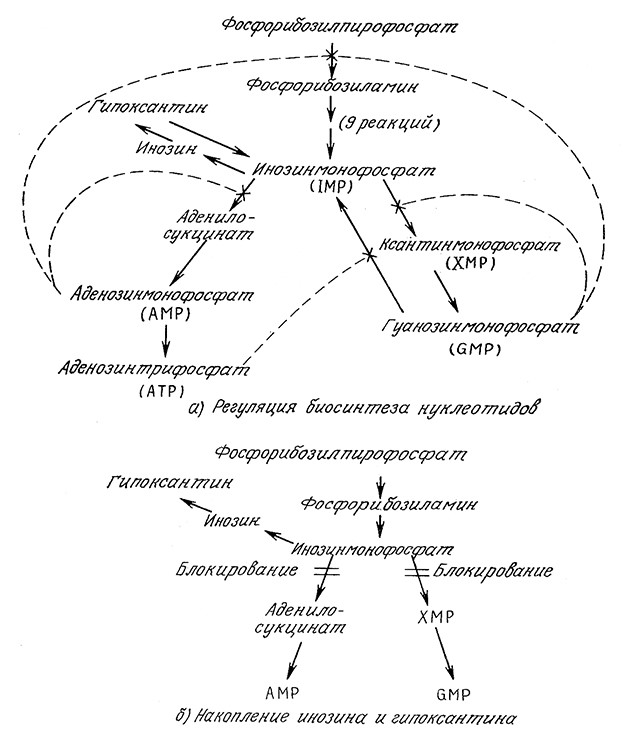
РИС. 6.20. В нормальной клетке AMP и GMP ингябируют последовательность реакций биосинтеза нуклеотидов по принципу
обратной связи на нескольких стадиях (а). В мутанте, не способном синтезировать AMP и GMP, концентрацию этих веществ
при соответствующем составе среды можно поддерживать на достаточно низком уровне,
обеспечивая таким путем повышение выхода инозина и гипоксантина (б).
6.3.3. Мутанты с модифицированными системами регуляции
Более выгодные с точки зрения их промышленного применения штаммы микроорганизмов получали также, модифицируя системы регуляции на уровне ферментов и (или) генов с помощью иных генетических трансформаций и селекции. Мутанты такого типа можно использовать для повышения выходов продуктов метаболизма и ферментов.
Чтобы добиться перепроизводства метаболита, обладающего ингибиторными и (или) репрессорными свойствами в своем пути биосинтеза, необходимо искать мутантные организмы, аллостерические ферменты и опероны которых нечувствительны к присутствию метаболита. Часто такие мутанты удается, выделить с помощью антиметаболитов – токсичных аналогов изучаемых метаболитов. В содержащей антиметаболит среде нормальные клетки не растут, поскольку антиметаболит подавляет или ингибирует биосинтез необходимого метаболита, не будучи способным выполнять функции несинтезирующегося метаболита или заменять его в последующих путях метаболизма. Напротив, картина биосинтеза и скорости реакции у штаммов с нарушенной системой регуляции по принципу обратной связи в присутствии антиметаболнта не изменяются, поэтому такие штаммы нормально развиваются и в среде, содержащей антиметаболит. В табл. 6.6 перечислены некоторые продукты жизнедеятельности микроорганизмов, выходы которых можно повысить таким путем.
Таблица 6.6. Продукты метаболизма и соответствующие аитиметаболиты,
применение которых в селекции микроорганизмов позволяет выделить более продуктивные мутантыа

Устойчивость к антиметаболитам часто обусловлена различными изменениями в системах регуляции, например частичным или полным восстановлением активности ферментов, каталитические свойства которых в нормальном пути биосинтеза подавляются. В частности, с помощью антиметаболитов можно также вести поиск мутантов с необычно высокими концентрациями биосинтезирующих ферментов. Подобный подход, например, может оказаться целесообразным при разработке процессов производства ферментов, используемых затем в других биосинтетических процессах in vitro.
Для конститутивных мутантов характерно то, что биосинтез индуцибельных или репрессибельных ферментов не зависит от наличия или отсутствия индуктора или репрессора. Путем использования конститутивных мутантов можно повысить выходы следующих ферментов: β-галактозидазы, каталазы, фосфатаз, протеаз, гомосериндегндрогеназы, инвертазы, гистидазы, пенидиллиназы и амидазы.
В приведенном выше обсуждении мы уделяли основное внимание различным подходам к повышению выхода интересующих нас веществ. Те же самые молекулярно-биологические подходы могут служить основой для поиска путей биосинтеза производных нормальных метаболитов, а также совершенно новых веществ, которые, возможно, найдут применение в фармакологии и в других областях. Эта тема вкратце рассмотрена в обзорах [4–6]. Примером практически важного процесса может служить биосинтез тетрациклинового антибиотика 6-деметилтетрациклина мутантным штаммом Streptomyces aureofaciens. 6-Деметилтетрациклин более устойчив в кислых средах, чем обычный тетрациклин, и поэтому является одним из основных антибиотиков тетрациклиновой группы, производящихся в промышленном масштабе.

