Ростом организма можно назвать упорядоченное увеличение массы всех составляющих этот организм веществ. Растущий одноклеточный организм в конце концов претерпевает деление. Следовательно, рост популяции микроорганизмов сопровождается как увеличением числа клеток, так и возрастанием массывсего клеточного вещества; для количественного математического анализа клеточного роста можно использовать любой из этих параметров. На практике применяют несколько единиц измерения клеточной массы. Так, масса сухих высокомолекулярных веществ учитывает только высокомолекулярные компоненты клетки. Под общей массой сухих веществ понимают не только высокомолекулярные, но и низкомолекулярные вещества клетки (за исключением воды). Наконец, клеточным объемом или общей клеточной массой называют массу (или объем) всех веществ клетки, в том числе и воды.
В следующей главе мы попытаемся понять закономерности роста множества клеток в питательной среде. В этом же разделе перед нами стоит более простая задача. Здесь мы рассмотрим основные события клеточного цикла, под которым понимают период времени с момента образования данной клетки в результате деления материнской клетки до последующего деления дочерней клетки. Изучение клеточного цикла должно предшествовать теме гл. 7 по двум причинам: во-первых, таким образом мы сможем оценить трудность задачи анализа событий лри одновременном росте и делении множества клеток, и, вовторых, знание основ клеточного цикла поможет в разработке необходимых моделей, которые потребуются нам в гл. 7.
Жизненный цикл изолированной клетки можно схематично изобразить в виде циклической или линейной карты (рис. 6.29). В любом случае точкой отсчета служит момент деления клетки.

РИС. 6.29. События, происходящие с момента рождения новой клетки до ее деления, могут быть представлены в виде циклической (а) или линейной (б) карт клеточного цикла. Буквами D и А обозначены деление клетки и начало синтеза ДНК соответственно.
Эту точку обычно помещают на правом конце линейной схемы клеточного цикла, а левый конец, как правило, отвечает самой молодой дочерней клетке. Для описания относительной хронологии других важных событий клеточного цикла, например начала и прекращения синтеза ДНК, удобен особый параметр а, называемый возрастом клетки или возрастом клеточного цикла. В клеточном цикле величина этого параметра обычно изменяется от нуля (момента рождения клетки) до tD, времени деления дочернего организма (для делящихся клеток); период от нуля до tD называют периодом удвоения. В этом вводном обсуждении мы принимаем, что деление клетки приводит к образованию двух дочерних идентичных клеток. Это допущение справедливо для простого бинарного деления, но при почковании, как это можно показать на примере пекарских дрожжей S. cerevisiae, могут возникать и другие ситуации.
6.5.1. Методы эксперимента;
цитометрия в потоке и синхронные культуры
Читатель, интересующийся методами экспериментального изучения клеточного цикла во всех деталях, может найти соответствующие сведения в монографии Митчисона [25]; мы же вкратце опишем только принципы основных методик. Наиболее очевидный подход, заключающийся в наблюдении жизненного цикла изолированной клетки, имеет весьма лимитированныевозможности. Этот подход требует много времени, а получаемая таким путем информация ограничена, поскольку проводить измерения на одной клетке крайне затруднительно. Поэтому такой подход имеет существенное значение только в особых случаях.
Очевидно, любые биохимические анализы проще выполнять, когда в распоряжении экспериментатора имеется множество клеток. К сожалению, популяция клеток в суспензии с очень большой степенью вероятности будет гетерогенной в том смысле, что различные клетки будут находиться в разных периодах клеточного цикла; одни клетки только что выйдут из стадии деления, другие, зрелые клетки вплотную подойдут к процессу деления, а третьи будут занимать какое-либо промежуточное положение. Обычными методами в такой популяции можно определить· лишь некоторые усредненные характеристики, но не свойства· отдельных клеток.
Для быстрой оценки некоторых свойств индивидуальных клеток в гетерогенной популяции можно использовать методыцитометрии в потоке. В этих методах пробу клеток разбавляют и иногда обрабатывают тем или иным способом, чтобы ввести· метку в определенные биохимические компоненты клетки. Затем пробу (разбавленную суспензию клеток) пропускают через ячейку, в которой измеряют характеристики индивидуальных клеток по мере их прохождения. К числу таких характеристик может относиться полный объем индивидуальной клетки, определяемый по рассеянию света или по изменению удельного сопротивления потока. Рассеяние света дает также ценную информацию о морфологии изолированой клетки и ее внутренней структуре. Для проточной цитометрии разработано большое число различных флуоресцентных маркеров, позволяющих определять общее содержание клеточной ДНК, двухцепочечной ДНК, белков, определенных ферментов, компонентов клеточной оболочки. Применяющиеся для этих целей приборы и устройства мы рассмотрим в разд. 10.3.2.
Для измерения в потоке одной характеристики индивидуальной клетки требуется всего лишь около 1 мкс, поэтому анализ, например, 105 клеток длится только несколько минут. Полученные таким способом данные обычно изображают в виде частотного распределения измеренного параметра индивидуальных клеток, т. е. в виде зависимости относительного числа клеток (частоты в пробе) от интенсивности рассеяния света или флуоресценции одной клетки. В качестве примера на рис. 6.30 приведены экспериментальные результаты оценки содержания ДНК в одной клетке среди популяции Saccharomyces cerevisiae, выросшей в проточном реакторе (см. гл. 7). Ценность таких данных заключается в том, что они непосредственно характеризуют гетерогенность популяции клеток. К тому же часто удается связать форму кривой частотного распределения с важными параметрами или характеристиками роста и деления индивидуальной клетки.
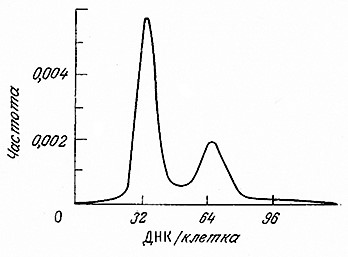
РИС. 6.30. Зависимость относительного содержания ДНК от относительного числа клеток в популяции пекарских дрожжей (Saccharomyces сегеvisiae). Относительную интенсивность флуоресценции ДНК индивидуальных клеток, окрашенных йодистым пропидием, измеряли методом проточной цитометрии в популяции 105 клеток.
Остроумные методики синхронизации культур позволяют применять и обычные методы биохимического анализа для изучения клеточного цикла. Современные методики селекции синхронных культур позволяют получать популяции клеток, находящихся на одной стадии клеточного цикла. Для этого клетки иммобилизуют на твердом носителе, а только что возникшие дочерние клетки смывают по мере их образования. Таким образом, в любой данный момент с колонки смываются клетки только одного возраста, т. е. синхронные. В другом методе суспензию клеток центрифугируют в градиенте плотности; находящиеся на различных стадиях жизненного цикла клетки различаются размерами и плотностью и поэтому разделяются. Затем зону определенной плотности, представляющую собой гомогенную популяцию, помещают в питательный раствор и выращивают.
Если мы затем проследим за изменением концентрации клеток во времени, то мы вправе ожидать ступенчатого увеличения числа клеток, поскольку число клеток должно удваиваться в каждом клеточном цикле. Приведенные на рис. 6.31 экспериментальные результаты могут служить иллюстрацией такого поведения синхронной популяции. Оказывается, что по меньшей мере в первых двух циклах популяция клеток остается гомогенной и синхронизированной; в любой момент цикла все клетки находятся примерно на одной и той же стадии развития. Как мы уже отмечали в гл. 1, гомогенные популяции являются очень удобным объектом для экспериментального исследования, поскольку они обеспечивают резкое (в миллионы раз) повышение интенсивности сигнала, отражающего характеристики индивидуальных клеток. Таким путем можно детально изучить многие особенности клеточного цикла.
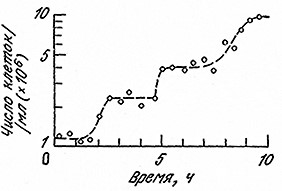
РИС. 6.31. Рост синхронной культуры дрожжей Schizosaccharomyces pombe
сопровождается ступенчатым ростом числа клеток.
Другой часто применяемый подход к получению синхронных культур называют индуцированной синхронизацией. В этом подходе популяцию вынуждают расти синхронно путем периодического изменения условий окружения. Однако поскольку такие изменения могут сопровождаться нарушением нормального метаболизма клеток, то для изучения физиологии клеток предпочтительнее методы селекции синхронных культур.
Обратите особое внимание на то, что, согласно приведенным на рис. 6.31 данным, по мере роста популяции синхронность постепенно исчезает; первоначально ступенчатая зависимость числа клеток от времени затем сменяется более плавной кривой. Причина этого кроется в потере популяцией гомогенности; тенденция к гетерогенности обусловлена стохастической природой роста и размножения клеток. Дело в том, что продолжительность клеточного цикла не является строго фиксированной, определенной величиной для всех клеток одного типа. Так, две первоначально идентичные дочерние клетки могут делиться не одновременно. В то же время продолжительность среднего жизненного цикла для популяций, состоящих из миллиардов клеток, представляет собой строго определенную величину, которая имеет большое значение при проектировании и конструировании реакторов (гл. 7).
В следующих двух разделах мы изучим картины клеточного роста и синтеза высокомолекулярных соединений в хорошо исследованной прокариоте Е. coli и эукариотическом организме Saccharomyces cerevisiae. Основное внимание в каждом из этих разделов мы будем уделять связи между репликацией ДНК и делением клетки. Очевидно, что делению родительской клетки на две дочерних должен предшествовать синтез геномов, содержащих в себе всю генетическую информацию. Следовательно, мы вправе ожидать тесной связи между процессами репликации ДНК и деления клетки; в противном случае данный вид был бы нежизнеспособен.
6.5.2. Клеточный цикл Е. coli
Простая прокариота Е. coli размножается бинарным делением; в богатой питательными веществами среде число клеток этого организма может удваиваться менее чем за 20 мин. Бактерии Е. coli имеют палочкообразную форму, длина которой может служить надежной мерой объема и массы клетки. Непосредственным изучением изменения длины отдельных клеток Е. coli под микроскопом показано, что в процессе клеточного цикла длина бактерий возрастает постоянно; зависимость длины клетки от времени удовлетворительно описывается возрастающей экспоненциальной функцией. В течение клеточного цикла аналогично изменяется и суммарное содержание всех белков.
В то же время содержание ДНК в течение клеточного цикла Е. coli изменяется довольно сложным образом; по характеру этой зависимости Е. coli резко отличается от эукариотических клеток. Координация процессов синтеза ДНК. и деления клеток в случае Е. coli зависит от ряда регуляторных и кинетических параметров, которые мы и рассмотрим ниже.
В самых различных условиях роста, когда деление осуществляется через различные промежутки времени, период репликации хромосомы Е. coli остается приблизительно постоянным (около 40 мин). В процессе синтеза ДНК скорость движения репликационной вилки (участка молекулы ДНК, в котором осуществляются разделение цепей и синтез ДНК) также остается постоянной. Следовательно, скорость синтеза ДНК прямо пропорциональна числу активных репликационных вилок. Репликация ДНК всегда начинается в определенном центре хромосомы, называемом участком начала репликации. Две вилки движутся в противоположных направлениях от участка начала репликации вокруг циклической хромосомы Е. coli и сходятся в момент окончания процесса репликации.
Регуляция процесса деления клеток связана с синтезом ДНК; бактериальная клетка делится примерно через 20 мин после того, как репликационные вилки достигают конца хромосомы. Как показано на рис. 6.32, ситуация в целом остается сравнительно простой, если Е. coli растет в среде, позволяющей клеткам делиться в среднем раз в час. В этом случае синтез ДНК осуществляется с постоянной скоростью в течение первых сорока минут клеточного цикла, и в оставшиеся двадцать минут, предшествующие делению, клетка не синтезирует ДНК. Росту клетки Е. coli с пятидесятиминутным клеточным циклом (например, при слегка повышенной температуре) отвечает более сложная картина синтеза ДНК; в этом случае новый набор репликационных вилок начинает синтез ДНК за 10 мин до деления клетки. Следовательно, в течение последних 10 мин этого клеточного цикла ДНК синтезируется вдвое быстрее, чем в любой момент медленного (часового) цикла. Нетрудно видеть, что кинетика синтеза ДНК в Е. coli и, вероятно, в некоторых других бактериях в общем случае довольно сложна и характеризуется чередованием периодов спада и повышения синтетической активности; характер чередования зависит от возраста клетки и продолжительности клеточного цикла.
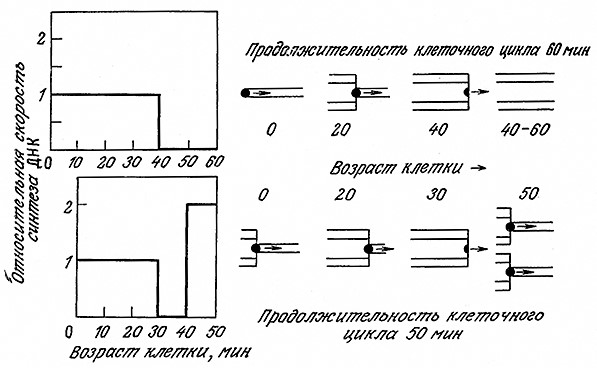
РИС. 6.32. Зависимость скорости синтеза ДНК и структуры хромосомы в Е. coli от возраста клетки и продолжительности
периода ее удвоения. В правой части рисунка схематично изображена половина хромосомы Е. coli от участка
начала репликации до участка завершения репликации. Черными точками обозначены репликационные вилки.
Относительно зависимости синтеза РНК от времени клеточного цикла имеется немного данных. Предполагается, что синтез РНК осуществляется непрерывно. В то же время показано, что для фракции РНК, представляющей собой, по-видимому, мРНК, характерны флуктуации. Следовательно, и скорость синтеза индивидуальных белков может изменяться циклически.
Такое поведение и в самом деле было обнаружено в рядеэкспериментальных работ, посвященных главным образом изучению ферментов, активность которых может быть индуцирована или подавлена. Синтез большого числа индуцибельных ферментов в бактерии можно стимулировать в любой момент клеточного цикла. В синхронной культуре скорость синтеза индуцибельных ферментов изменяется ступенчато, что, вероятно, обусловлено удвоением числа соответствующих этим ферментам генов в момент репликации ДНКВ случае репрессии ферментов имеется несколько возможностей. Если бактерии растут в условиях, когда конечный продукт участка метаболического пути подавляет синтез фермента в максимальной или в минимальной степени, то скорость синтеза фермента остается постоянной в течение промежутка времени, равного продолжительности клеточного цикла, а затем возрастает вдвое. Для промежуточных уровней подавления характерно регулярное периодическое изменение скорости синтеза фермента. Некоторые экспериментальные данные позволяют предположить, что эти периодические изменения обусловлены устойчивыми колебаниями в системе регуляции, функционирующей по принципу обратной связи.
6.5.3. Клеточный цикл эукариот
Прежде всего нам следует вспомнить, что в природе не существует типичной эукариотической клетки. В то же время модель такой воображаемой клетки оказывается очень полезной при обсуждении черт, свойственных большинству эукариот; именно в этом смысле мы будем использовать понятие о типичной эукариоте в настоящем разделе.
Возможные различия между разными типами эукариотических клеток легко оценить, если, например, проанализировать увеличение клеточной массы в процессе жизненного цикла клеток мыши и амебы (рис. 6.33). В то время как масса сухих веществ клеток мыши возрастает во времени линейно или экспоненциально, скорость роста клеток амебы постепенно уменьшается и в момент деления становится практически равной нулю. Второй вариант более типичен для эукариот вообще. Обратите внимание также на шкалу времени – клеточный цикл этих эукариот длится около суток. Впрочем, некоторые эукариотические организмы, например дрожжи, в оптимальных условиях могут делиться примерно раз в час.
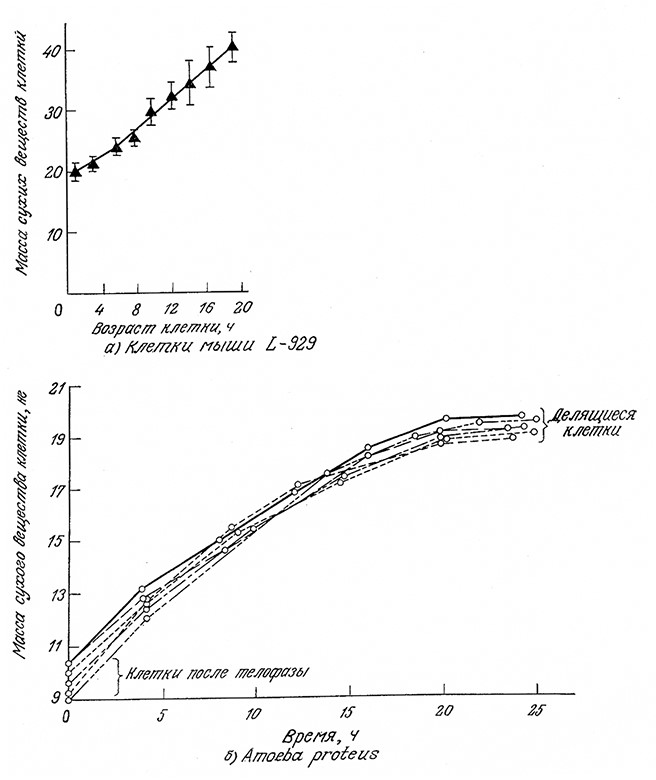
РИС. 6.33. а – Увеличение массы клетки ткани мыши в течение клеточного цикла.
б – рост массы Amoeba proteus в течение клеточного цикла; каждая кривая отвечает одной из шести различных индивидуальных клеток.
Для клеточного цикла эукариот характерна (по сравнению с прокариотами) высокая степень дифференциации между отдельными периодами цикла. Обычный цикл эукариотической клетки изображен на рис. 6.34. Он подразделяется на четыре периода: G1 , S, G2 и М; относительные продолжительности этих периодов указаны на рисунке. В периоде G1 происходит активный синтез белков и РНК, а ДНК не синтезируется. В следующем периоде S осуществляется репликация хромосом. Функция периода G2 пока еще достаточно достоверно не выяснена. Вслед за этим периодом начинается деление клеток (период М). Сложный, хорошо координированный процесс деления эукариот называют митозом. В митозе два набора хромосом разделяются и распределяются по дочерним клеткам. В медленно растущих или нерастущих культурах клетки находятся в состоянии покоя, обозначаемом символом G0.
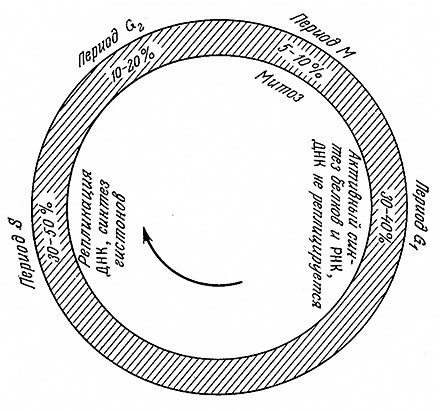
РИС. 6.34. Последовательность событий в жизненном цикле типичной эукариотической клетки.
В отличие от характерной для прокариот линейной временной зависимости синтез ферментов в эукариотах почти всегда осуществляется периодически. В определенный момент клеточного цикла наблюдается резкое повышение концентрации того или иного фермента. Имеющиеся экспериментальные данные позволяют предположить, что в основе этого явления лежит последовательный характер транскрипции ДНК.
В качестве примера, иллюстрирующего структуру клеточного цикла эукариот и асимметричное деление клеток, вкратце рассмотрим жизненный цикл размножающихся почкованием дрожжей S. cerevisiae. Этот микроорганизм широко применяется в пивоварении, производстве пищевых продуктов и генетической инженерии. Как показано на рис. 6.35, дочерняя клетка растет на материнской в виде почки. Затем, после деления, материнская клетка быстро возвращается в начальную фазу цикла почкования, в то время как обычно сравнительно небольшая дочерняя клетка должна еще в течение какого-то времени расти; только после этого она достигает типичного для начала цикла почкования состояния («старт»).
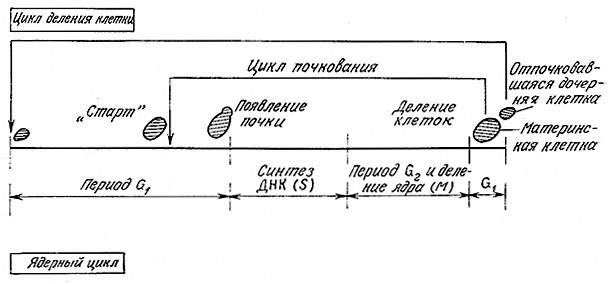
РИС. 6.35. Клеточный цикл почкующихся дрожжей S. cerevisiae.
Начало периода S примерно совпадает с появлением почки. Все непочкующиеся клетки находятся в периоде G1. Если обратиться к изображенному на рис. 6.30 распределению ДНК в индивидуальных клетках S. cerevisiae, можно достаточно обоснованно предположить, что первый пик отвечает клеткам с одним геномом, т. е. клеткам, находящимся в периоде G1. Второй пик отвечает клетками с двумя геномами, которые могут находиться в одном из двух периодов – G2 или M. Математический анализ распределений подобного типа позволяет быстро определить относительные времена пребывания клеток S. cerevisiae в периодах G1 S и G2 + M и таким образом изучать влияние генетических изменений и среды на регуляцию клеточного цикла.
В этом разделе мы ознакомились с некоторыми особенностями клеточных циклов. В сущности, в настоящее время о них имеется чрезвычайно мало данных. Как показало изучение клеточного метаболизма (гл. 5), для эффективной утилизации питательных веществ клетке необходима тщательнейшая координация чрезвычайно сложной сети химических реакций. Биохимия этих реакций известна достаточно детально, однако мы почти ничего не знаем о том, как они осуществляются in vivo. На рис. 6.36 приведены интересные данные, свидетельствующие о наличии сложных закономерностей в распределении отдельных взаимосвязанных реакций во времени. Следовательно, химические реакции в клетке локализованы не только в пространстве (например, за счет иммобилизации фермента на поверхности мембраны), но и во времени. Все эти сложные эффекты вынуждают нас проявлять крайнюю осторожность, если перед нами стоит задача математического анализа кинетики роста живых клеток.
Этим мы заканчиваем наше введение в биологические науки. Вооруженные полученными в этой и предыдущих главах знаниями, мы должны быть готовы к изучению технологии процессов с участием живых клеток. Основное внимание в последующих главах мы уделим анализу, моделированию и проектированию биологических процессов. В гл. 7 рассмотрена кинетика клеточного роста.

