Моделирование и анализ кинетики роста популяций клеток мы начнем с неструктурированных моделей, в которых биофаза характеризуется только величиной клеточной массы или численной концентрацией. Суммарную скорость роста клеточной массы rx часто выражают как μx, где x – клеточная масса в единице объема культуры, а μ – удельная скорость роста клеток, выраженная в единицах обратного времени. В этих параметрах уравнение материального баланса клеточной массы для ПРПП в стационарном состоянии будет выглядеть следующим образом:
Dxf = (D–μ)x (7.8)
Часто поступающий в проточный реактор поток раствора питательных веществ состоит только из стерильного питательного вещества, так что Xf = 0. В таком случае из уравнения (7.8) следует, что отличная1 от нуля популяция клеток может существовать в стационарном состоянии только при
D = μ (7.9)
т. е. тогда, когда удельная скорость клеточного роста равна скорости разведения. Если выполняется условие уравнения (7.9), то при стерильном питательном веществе уравнение (7.8) уже не определяет х. Неопределенность уровня популяции была подтверждена в экспериментах с культурой Bacillus linens в проточном реакторе. В этих экспериментах стационарное состояние было достигнуто через 6 ч (рис. 7.4), после чего культуру подвергали двум последовательным разведениям, при которых часть содержимого реактора, состоящего из популяции клеток и среды, удаляли и замещали чистой средой.
РИС. 7.4. Как следует из уравнения (7.9), при постоянном μ концентрация клеточной массы в проточной культуре неопределенна (В. Iineus при 26°C и D = 0,417 ч–1).
После каждого такого разведения через некоторое время в системе устанавливалось новое стационарное состояние, характеризующееся иной концентрацией клеточной массы.
7.2.1. Уравнение Моно для кинетики клеточного роста
Приведенная на рис. 7.4 зависимость характерна только для тех случаев, когда удельная скорость клеточного роста не зависит от x и s. [Здесь под s мы понимаем массовую концентрацию субстрата, лимитирующего клеточный рост.] Система становится определенной, если скорость роста клеток лимитируется каким-либо питательным веществом.
Прежде чем перейти к обсуждению деталей зависимости скорости роста от подачи питательных веществ, рассмотрим общие теоретические и практические пути создания сред для культивирования клеток. В зависимости от состава различают два типа сред. Синтетическими называют среды с четко определенным химическим составом. Как показано в табл. 7.1, такие среды создаются на основе раствора неорганических солей, к которому добавляют необходимые источники углерода, азота и энергии, а также все незаменимые витамины. Неорганические соли служат не только источником ионов, необходимых длянормального функционирования клеток, но и выполняют буферную функцию, сглаживая большие флуктуации рН в процессе роста популяций. Сложные среды содержат материалы неопределенного состава. Например, среда 4 в табл. 7.1 относится к сложным, поскольку точный химический состав дрожжевого экстракта неизвестен. В состав других сложных сред входят мясной бульон, кровяной бульон, кукурузный экстракт и сточные воды.
Таблица 7.1. Примеры синтетических и сложных средa

Основное требование, предъявляемое к среде, заключается в обеспечении высокой скорости роста клеток и(или) синтеза продуктов их жизнедеятельности. Отсюда, однако, отнюдь не следует (как можно было бы предположить чисто интуитивно), что все питательные вещества нужно подавать в большом избытке. Во-первых, избыточная концентрация питательного вещества может ингибировать рост клеток или даже привести к их гибели. Во-вторых, если клетки растут слишком интенсивно, то накапливающиеся конечные продукты метаболизма могут нарушить нормальные биохимические процессы в клетках. Поэтому обычно общий рост клеток лимитируют, ограничивая количество одного питательного вещества в среде.
Если концентрация одного незаменимого компонента среды изменяется, а концентрации всех других компонентов остаются без изменения, то, как это показано на рис. 7.5, зависимость скорости клеточного роста от концентрации незаменимого питательного вещества обычно выражается кривой типа гиперболы.
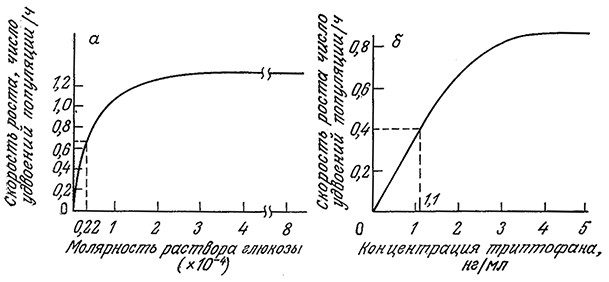
РИС. 7.5. Зависимость удельной скорости роста Е. coli от концентрации лимитирующего рост питательного вещества в глюкозной среде (а) и триптофановой среде (для мутанта, нуждающегося в триптофане) (б).
Математическое выражение, отражающее функциональную зависимость удельной скорости клеточного роста μ от концентрации незаменимого питательного вещества, было предложено Моно в 1942 г. Уравнение Моно имеет ту же форму, что и уравнение изотермы адсорбции Ленгмюра (1918 г.) и обычное уравнение скорости катализируемой ферментом реакции с одним субстратом, предложенное Анри (1902 г.) и Михаэлисом и Ментен (1913 г.), и устанавливает, что
![]()
В этом уравнении μmax – максимальная скорость роста, достигаемая при s>>Ks и постоянных концентрациях всех других незаменимых питательных веществ. Ks – это такая концентрация лимитирующего клеточный рост питательного вещества, при которой удельная скорость роста вдвое ниже максимального значения. В первом приближении можно считать, что Ks представляет собой промежуточную зону между диапазоном низких концентраций, при которых μ линейно зависит от s, и диапазоном высоких концентраций, когда μ становится независимым от s. Как показано на рис. 7.5, значения Ks для штаммов Е. coli, растущих в лимитируемых глюкозой и триптофаном средах, составляют 0,22•10–4 M и 1,1 нг/мл соответственно.
Поскольку мы уже знакомы с биохимией клетки, для нас должно быть очевидно, что уравнение Моно, скорее всего, чрезмерно упрощено. Как, однако, это часто бывает и в других областях технологии, относительно простое уравнение иногда удовлетворительно описывает определенные зависимости, хотя физический смысл параметров модели неизвестен или, возможно, даже, вообще не существует. Впрочем, в некоторых специфических ситуациях уравнению Моно можно приписать определенный физический смысл. Одна из наиболее показательных ситуаций такого типа складывается тогда, когда скорость клеточного роста лимитируется скоростью транспорта через мембрану при участии пермеаз (вспомните разд. 5.7).
В уравнении Моно (7.10) привлекает его простота, однако применение этого простого выражения требует от исследователя большой осторожности. Во-первых, величина Ks часто довольно мала, поэтому s обычно намного больше Ks и выражение s/(Ks + s) можно рассматривать как адекватное выражению для расчета отклонений μ от μmax по мере снижения концентрации s. Это соотношение предполагает также, что удельная скорость роста μ не равна нулю при любых отличных от нуля концентрациях лимитирующего скорость клеточного роста компонента. В общем случае данное условие нельзя считать доказанным для s<<.Ks.
Если скорость роста популяции клеток связана с концентрацией лимитирующего клеточный рост питательного вещества математическим выражением типа уравнения Моно, то отсюда следует, что между условиями работы реактора и кинетическими и стехиометрическими параметрами популяции клеток должны существовать определенные зависимости. Для выявления этих зависимостей можно начать с уравнения материального баланса по лимитирующему клеточный рост субстрату, связанного с балансом по, клеточной массе, поскольку μ зависит от s. В балансе по субстрату мы будем использовать экономический коэффициент Yх/s (см. разд. 5.10.1):
![]()
Тогда уравнение материального баланса по субстрату для стационарного состояния можно записать в следующей форме:
![]()
Если в это выражение подставить μ из уравнения (7.10), то получим, что
![]()
В этом случае уравнение материального баланса по клеточной массе будет выглядеть следующим образом:
![]()
Уравнения (7.12) и (7.13) часто называют моделью Моно для хемостата.
Если, как это обычно бывает, питательные вещества стерильны (xf = 0), то преобразованием этих уравнений легко найти соответствующие выражения для x и s:
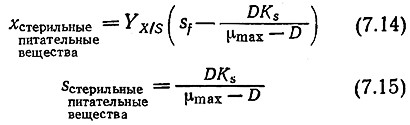
Уравнения (7.14) и (7.15) отражают зависимость x и s от скорости потока (D = FfV) в стационарном состоянии. Для очень медленных скоростей потока при заданном объеме D → 0 и, следовательно, s также приближается к нулю. Поскольку почти весь вводимый в реактор субстрат поглощается клетками, то концентрация клеточной массы на выходе из реакторах s будет равна SfYx/s.
По мере постепенного повышения D возрастает и s: сначала пропорционально D, а затем, по мере приближения D к μmax, •еще быстрее. Точно таким же образом снижается и концентрация клеточной массы – сначала в линейной зависимости от D, г затем, при .D → max, с большей скоростью. При приближении D к μmax в какой-то момент x становится равной нулю; это означает, что скорость разведения D только что превысила максимально возможную скорость роста и решение уравнения (7.14) в условиях стационарного состояния возможно только при х = 0. Потеря всех клеток в стационарном состоянии, называемая вымыванием, происходит, когда D больше Dmах; последний параметр можно определить по уравнению (7.14) при х = = 0:
![]()
На рис. 7.6 приведены отражаемые уравнениями (7.14) и (7.15) графики зависимостей концентраций субстрата и клеточной массы от D для следующего ряда значений параметров:
μmax =1,0 ч–1 Yx/s = 0,5 Ks = 0,2 г/л Sf = 10 г/л
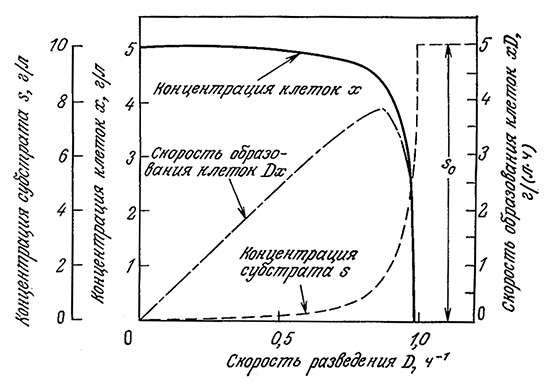
РИС. 7.6. Зависимости концентрации субстрата s в продуктах, концентраций клеточной массы x
и скорости образования клеток Dx от скорости разведения непрерывной культуры D,
вычисленные на основе модели Моно для хемостата (μmax =1 ч–1, Ks=0,2 г/л, Yх/s = 0,5, sf = 10 г/л).
Заметьте, что вблизи точки вымывания реакционная смесь становится очень чувствительной к колебаниям D; даже небольшое изменение D сопровождается относительно большим изменением x и (или) s.
Эту зависимость необходимо иметь в виду в тех случаях, когда целью непрерывного микробиологического процесса является производство биомассы. Скорость продуцирования клеток в единице объема реактора равна Dx; на кривой зависимости Dx от D (рис. 7.6) имеется резкий максимум. Максимальную скорость образования клеток можно вычислить, решив дифференциальное уравнение
![]()
в котором для описания χ как функции от D используется уравнение (7.14). Решение уравнения (7.17) дает
![]()
Если, как это часто бывает на практике, Sf>>Ks, то Dмакс.произв. приближается к μmax и, следовательно, находится вблизи точки вымывания. В такой ситуации, изображенной, в частности, на рис. 7.6, как правило, чтобы избежать диапазона наибольшей чувствительности, целесообразно не добиваться максимальной скорости образования биомассы. Вообще при решении любых проблем оптимизации в поисках сравнительно легко регулируемых параметров важно не забывать практические аспекты сочетания чувствительности, регулируемости и надежности.
При изучении закономерностей образования конечных продуктов непрерывных микробиологических процессов введем еще один коэффициент Yр/х, представляющий собой отношение
![]()
Изучив в гл. 5 стехиометрию образования продуктов метаболизма, мы уже знаем, что коэффициент Yр/х постоянен при микробиологических процессах типа I, но в других процессах изменяется. Применение этого коэффициента позволяет записать уравнение материального баланса для продукта жизнедеятельности клеток в стационарном состоянии в форме
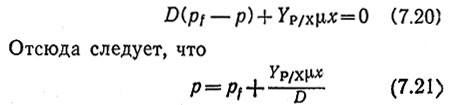
Вместе с приведенными выше уравнениями, выражающими зависимость μ и x от параметров процесса, уравнение (7.21) позволяет вычислить концентрацию продукта в выходящем из реактора потоке. Производительность реактора по отношению к продукту равна pD и при постоянном Yp/x максимальна, если D имеет значение, определяемое уравнением (7.18). Следовательно, при попытках добиться максимальной производительности процесса также необходимо учитывать фактор чувствительности. [При каком значении D величина pD максимальна, если Yp/x=f(D)?]
В качестве примера на рис. 7.7 приведены результаты экспериментального изучения роста культуры бактерий Aerobacter aerogenes в проточном реакторе. Экспериментальные результаты и описанная выше простая математическая модель качественно вполне согласуются. В то же время найденная скорость образования клеточной массы и найденная концентрация субстрата остаются приблизительно постоянными в значительно более широком диапазоне условий, чем следует из рассчитанных по уравнению Моно данных (рис. 7.6). Кроме того, модель Моно не согласуется с экспериментальными данными при очень низких и очень высоких скоростях разведения. В следующем разделе мы изучим эти две экстремальные ситуации и попытаемся понять, почему в таких случаях модель Моно неприменима.
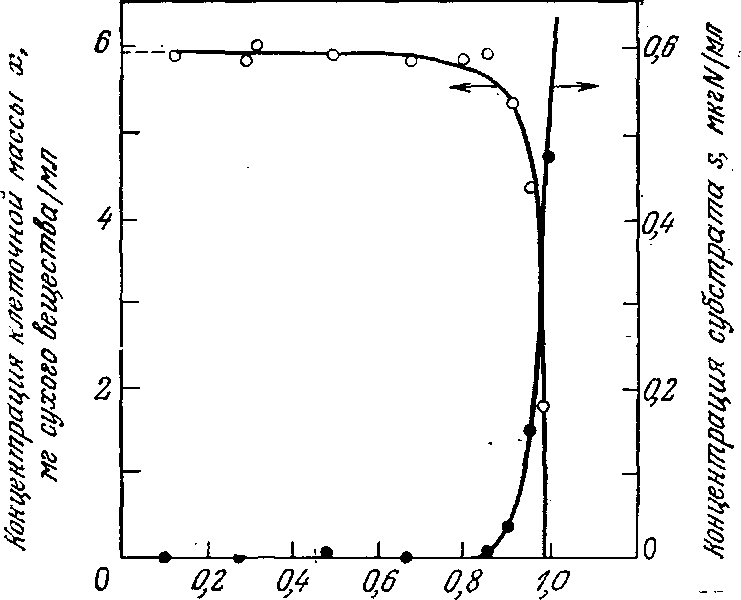
РИС. 7.7. Экспериментально найденные параметры роста непрерывной культуры (A. aerogenes) качественно согласуются с моделью Моно.
7.2.2. Влияние эндогенного метаболизма
и метаболизма поддержания на кинетику клеточного роста
Приведенные на рис. 7.8 данные для культуры A. aerogenes показывают, что при малых скоростях разведения концентрация клеток заметно снижается. Аналогичное поведение наблюдалось и в случае кормовых дрожжей Torula utilis. Эту особенность, противоречащую модели Моно для хемостата, можно объяснить, если в модели учесть возможность эндогенного метаболизма. Под эндогенным метаболизмом подразумеваются происходящие в клетке реакции, в которых расходуются клеточные вещества. Чтобы учесть этот эффект, дополним уравнение Моно слагаемым – kex:
![]()
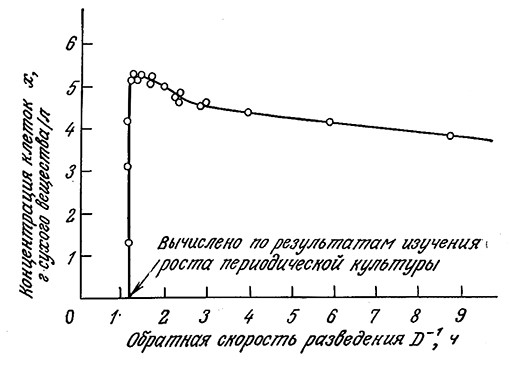
РИС. 7.8. Снижение концентрации клеточной массы (культура A. aerogenes)·в глицериновой среде
в проточном реакторе при уменьшении скорости разведения противоречит модели Моно.
Обратите внимание на то, что слагаемое –kex в уравнении (7.22) можно интерпретировать и как скорость гибели клеток.
Модифицированное уравнение Моно согласуется и с другими экспериментальными данными. Например, если скорость дыхания аэробной культуры пропорциональна скорости утилизации субстрата, т. е.
![]()
то из уравнений (7.8), (7.22) и (7.23) следует, что удельная скорость дыхания равна
![]()
Приведенные на рис. 7.9 экспериментальные данные хорошо согласуются с уравнением (7.24).
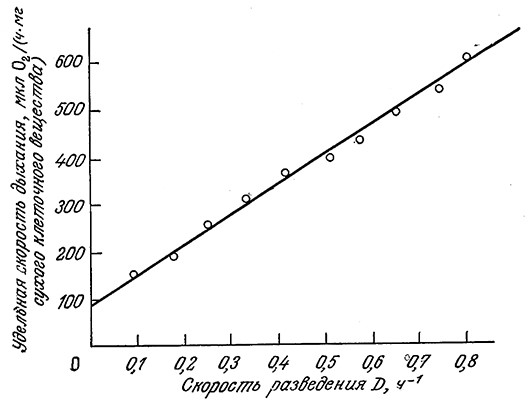
РИС. 7.9. Согласующаяся с уравнением (7.24) линейная зависимость удельной скорости дыхания бактерии A. aerogenes от скорости разведения в проточном реакторе.
Наблюдаемая зависимость экономического коэффициента Y от D также подтверждает справедливость уравнения (7.22) для скорости клеточного роста. Если скорость поглощения субстрата равна
![]()
где Y'x/s – «истинный» коэффициент, то из уравнений (7.22) и (7.25) и определения Yх/s (напомним, что Yх/s– это стехиометрический коэффициент, равный частному от деления общей массы образовавшихся клеток на общую массу поглощенного субстрата, поэтому при условии стерильности питательных веществ – rs = Dx/Yx/s) следует, что
![]()
Экспериментально показано, что для ряда микроорганизмов зависимость Yx/s от D выражается именно таким уравнением.
Другая возможность, рассмотренная вкратце при обсуждении стехиометрии клеточного роста в разд. 5.10.1, заключается в параллельной утилизации субстрата как для клеточного роста, так и для других энергетических потребностей клетки (метаболизм поддержания). В этом случае скорость утилизации субстрата определяется выражением
![]()
где m–удельная скорость потребления субстрата, расходуемого в метаболизме поддержания. Если принять, что гх равно μx, то
![]()
Таким образом мы получили точно такую же функциональную зависимость Ух/s от D, как и в случае модели эндогенного метаболизма [уравнение (7.26)].
Как показано на рис. 7.10, при высоких скоростях разведения поведение культуры клеток в проточном реакторе может существенно отклоняться от поведения, предсказываемого моделью Mono для хемостата. Здесь не только слишком велика ошибка в определении концентрации клеток вблизи точки вымывания, но и вся популяция клеток может существовать при скоростях разведения, значительно превышающих предсказываемую теорией критическую величину. Более того, по мере приближения D к критическому максимальному значению экономический коэффициент снижается. Одна из возможных причин этого несоответствия может заключаться в относительно высокой концентрации субстрата, характерной для высоких скоростей разведения. В таких условиях субстрат часто не ограничивает рост клеток, и составляющие популяцию клетки могут изменить характер метаболизма, выбрав какой-либо другой лимитирующий фактор среды. Еще одной причиной может быть недостаточно эффективное перемешивание; этот вопрос мы изучим в гл. 9.
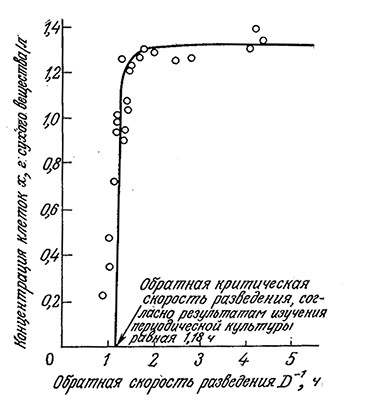
РИС. 7.10. Экспериментальные данные по росту Aerobacter cloacae
в проточном реакторе, свидетельствующие об отклонении концентрации
клеточной массы от нулевого значения при скоростях разведения,
превышающих вычисленную критическую величину.
7.2.3. Другие уравнения кинетики клеточного роста
Предлагались и другие математические выражения, определяющие удельную скорость клеточного роста; в ряде случаев эти выражения лучше соответствуют экспериментальным данным. Например, Теиссье, Мозер и Контуа предложили следующие уравнения:
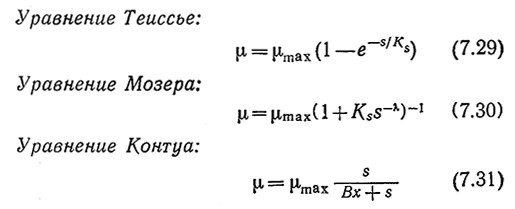
По сравнению с уравнением Моно алгебраическое решение двух первых уравнений клеточного роста затруднительно. В уравнение Контуа входит кажущаяся константа Михаэлиса, пропорциональная концентрации биомассы χ, поэтому по мере увеличения плотности популяции максимальная скорость роста должна уменьшаться и в конце концов μ станет пропорциональной х–1.
Те или иные компоненты среды, например субстрат или продукт метаболизма, могут снижать удельную скорость клеточного роста. Эндрюс предложил уравнение, учитывающее ингибирование роста клеток субстратом [11]:
![]()
Примером процесса, ингибируемого продуктом жизнедеятельности клеток, может служить спиртовое брожение; Аиба„ Шода и Нагатани для описания анаэробного брожения глюкозы в присутствии дрожжей предложили функцию роста следующего типа [9, 10]:
![]()
Возможны случаи, когда рост клеток лимитируют два (или более) субстрата одновременно. Хотя имеется очень мало данных, характеризующих такие процессы, можно предположить, что каждое из лимитирующих питательных веществ подчиняется уравнению Моно:
![]()
В отсутствие более убедительных данных, подтверждающих это уравнение, его можно рассматривать как своего рода критерий, позволяющий установить, что рост клеток действительно определяется несколькими питательными веществами.
7.2.4. Влияние других параметров среды
на кинетику клеточного роста
При сбалансированном росте для характеристики кинетики роста популяции клеток достаточно только одного параметра μ (или времени удвоения численности популяции t̅d – 1n2/μ). По этой причине параметр удельной скорости роста μ широко используется для описания влияния среды на поведение популяции. Рассмотрим прежде всего влияние температуры; известно, что живые организмы могут существовать в диапазоне температур примерно от –5 до 95 °С. Принято классифицировать прокариоты в соответствии с диапазоном температур их роста. Как показывают приведенные в табл. 7.2 данные, для каждого класса микроорганизмов характерна некоторая оптимальная температура, при которой скорость роста достигает максимума, а также верхняя и нижняя температурные границы, вне которых популяция вообще не способна к росту.
Таблица 7.2. Классификация микроорганизмов в соответствии с зависимостью скорости их роста от температурыa

Приведенные на рис. 7.11 кривые свидетельствуют об оченьсильном влиянии температуры на рост Е. coli. Обратите внимание на то, что в координатах Аррениуса классическое аррениусовское поведение наблюдается только при низких температурах, а по мере приближения температуры к той границе, при которой бактерии начинают погибать, скорость их роста резко падает. Бросается в глаза сходство зависимостей клеточного роста (рис. 7.11) и каталитической активности ферментов (рис. 3.25) от температуры. В этой связи неудивительно, что зависимость удельной скорости клеточного роста от температуры часто можно выразить в виде уравнения типа (3.73). Очевидно, в диапазоне относительно низких температур возрастание метаболической активности клетки при повышении температуры связано с повышением каталитической активности входящих в ее состав ферментов. Когда же температура достигает того предела, при котором начинается денатурация термически наиболее лабильных важных для жизнедеятельности клетки белков, то клетка погибает. В ряде случаев эта гипотеза была подтверждена генетическими методами; показано, в частности, что мутация одного гена может существенно изменить максимальную температуру, которую способен выдержать микроорганизм.
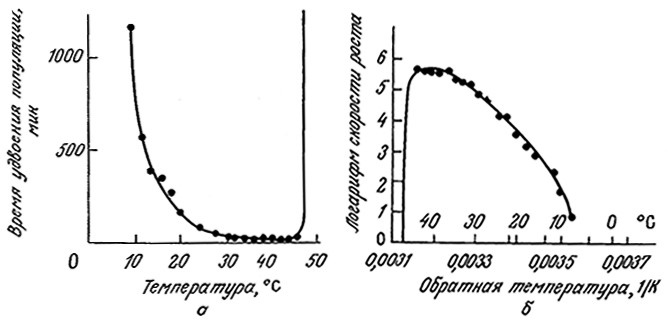
РИС. 7.11. а – при повышении температуры скорость роста клеток Е. coli до определенного
момента возрастает, но при слишком высокой температуре клетки погибают;
б – та же зависимость в аррениусовских координатах.
Поскольку конформация белка и его активность зависят от рН, мы вправе ожидать, что величина рН будет оказывать существенное влияние на процессы клеточного транспорта, скорости реакций, а следовательно, и скорость роста клеток. Обычно скорость роста бактерий максимальна в диапазоне рН от 6,5 до 7,5. В качестве примера на рис. 7.12 приведена зависимость скорости роста Е. coli от рН. Впрочем, из этого правила есть и исключения. Так, ацидофильные бактерии растут при рН 2,0. Обычно отклонение ρH на 1,5–2 единицы в любую сторону от оптимальной величины приводит к практически полному прекращению роста (рис. 7.12). Дрожжи лучше всего растут в диапазоне рН от 4 до 5, а оптимальный рН для роста плесневых грибов обычно равен 5–7. Для дрожжей и плесеней характерен довольно широкий диапазон роста – приблизительно от рН 3,0 до рН 8,5. Как показывают приведенные на рис. 7.12 данные, при повышении температуры рН максимальной скорости клеточного роста обычно возрастает.
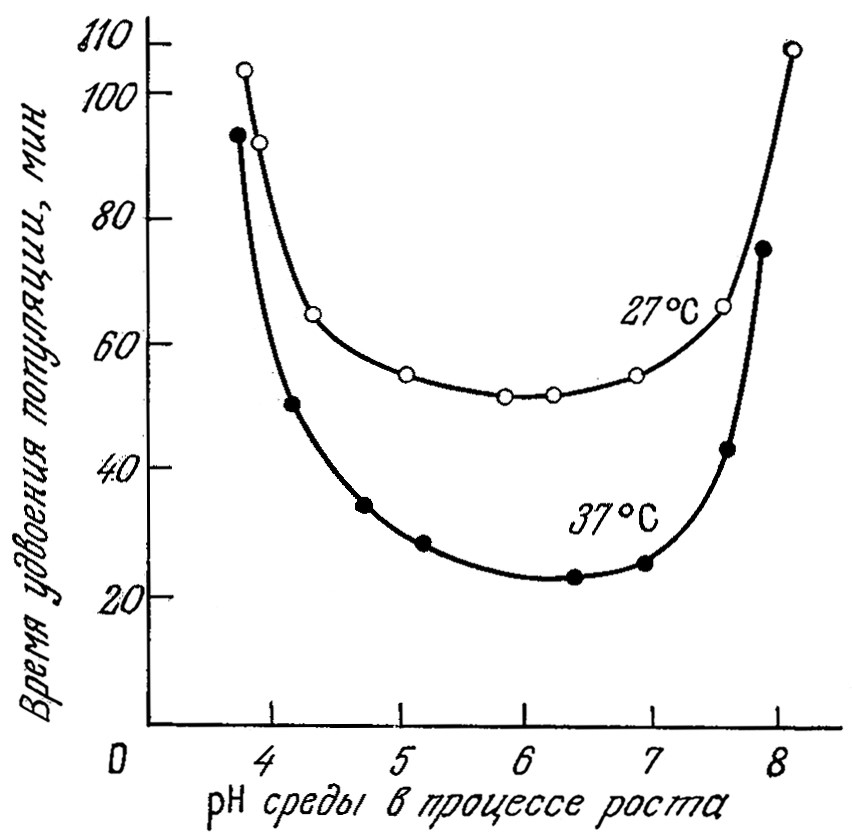
РИС. 7.12. Влияние температуры и рН на время удвоения Е. coli.
На удельную скорость роста микроорганизмов влияют также термодинамическая активность среды (зависящая в свою очередь от растворенных в ней веществ) и гидростатическое давление. Скорость роста аэробных организмов, очевидно, в существенной степени зависит от концентрации растворенного кислорода. Влияние потребляемого клетками кислорода на кинетику их роста мы рассмотрим при изучении аэрации реакторов в гл. 8.

