Физическая основа рассматриваемого в этой главе явления массообмена схематически представлена на рис. 8.1. Ограниченно растворимый газ, чаще всего кислород, переносится от его источника (например, поднимающихся воздушных пузырьков) в содержащую клетки жидкую фазу. (Аналогичная картина наблюдается и в случае любого другого ограниченно растворимого субстрата, например жидких углеводородов в микробиологических способах переработки углеводородов.) На этом пути кислород должен преодолеть ряд сопротивлений массообмену, относительные величины которых зависят от гидродинамики пузырьков (капель), температуры, клеточной активности и плотности культуры, состава раствора, ряда явлений на границе раздела фаз и от других факторов.
Общее сопротивление массообмену складывается из отдельных сопротивлений в следующих частных процессах:
1. Диффузии газа из ядра газовой фазы к границе раздела фаз газ – жидкость.
2. Переносе через границу раздела фаз газ – жидкость.
3. Диффузии растворенного вещества через примыкающий к пузырьку относительно неперемешиваемый слой жидкости в перемешиваемую жидкую фазу.
4. Переносе растворенного вещества через жидкую фазу ко второму относительно мало перемешиваемому жидкому слою, окружающему клетки.
5. Переносе через второй относительно неперемешиваемый слой, окружающий клетки.
6. Диффузии в скопления клеток, мицелий или в частицу почвы.
7. Переносе через оболочку клетки во внутриклеточное пространство (реакционный центр).
Все эти типы сопротивлений изображены на рис. 8.1. Когда организм существует в виде отдельных клеток, шестой тип сопротивления отпадает. Для клеток микроорганизмов характерна тенденция к адсорбции на границах раздела фаз. Так, клетки могут концентрироваться преимущественно вблизи границы, разделяющей газовый пузырек и жидкую фазу. Тогда диффундирующий растворенный кислород преодолевает только одну неперемешиваемую область; отпадает необходимость и в переносе через жидкую фазу, предшествующем сопротивлению пятого типа. В такой ситуации концентрация Ог, растворенного в жидкой фазе, не отражает скорость его подачи для дыхания микроорганизмов.
Точно так же в процессах микробиологических трансформаций других ограниченно растворимых субстратов, например капель углеводорода, часто наблюдалась адсорбция клеток на границе раздела (или вблизи нее), отделяющей углеводородную фазу от водной. Математическое моделирование работы реакторов в таких ситуациях мы рассмотрим в гл. 9.
На рис. 8.2 изображены различные варианты физического контакта между газовой и жидкой фазами. Все эти варианты можно разделить на две группы, в первой из которых массообмен совершается за счет свободного подъема пузырьков газа или опускания жидких или твердых частиц, а во второй – за счет движения жидкости под действием приложенных к ней внешних сил, отличных от сил гравитации (принудительная конвекция). Между этими двумя группами нет четкой границы, и, например, смешение газа с жидкостью в медленно перемешиваемой полупроточной системе может в равной степени обусловливаться как свободным подъемом пузырьков газа, так и механическим перемешиванием. Важность гидродинамики в процессах биохимической технологии требует изучения взаимосвязи между течением жидкости и массообменом. Прежде чем приступить к изучению этой проблемы, однако, необходимо сделать несколько замечаний общего характера и познакомиться с рядом терминов и определений, принятых в теории массообмена.
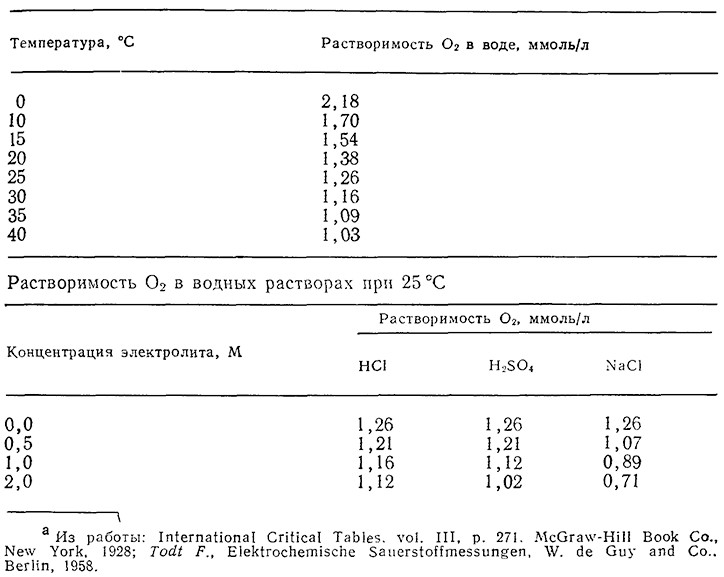
Таблица 8.1. Растворимость O2 при давлении 1 атм O2 в воде
при различных температурах и в растворах солей или кислот при 25 °Ca
8.1.1. Основные положения теории массообмена
Растворимость кислорода в водных средах при давлении воздуха 1 атм и комнатной температуре равна приблизительно 10 миллионным долям (млн–1) (табл. 8.1). Популяция дрожжевых клеток в период активного дыхания может потреблять кислород со скоростью около 0,3 г O2 в час (в расчете на 1 г сухого клеточного вещества). Максимальную скорость утилизации кислорода при; плотности популяции 109 клеток/мл можно оценить, допустив, что объем клетки составляет 10–10 мл, из которых 80% составляет вода. Тогда абсолютная потребность в кислороде составит
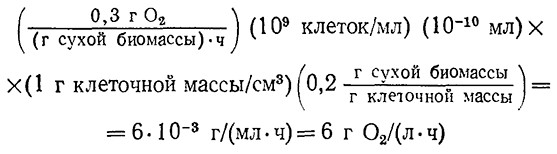
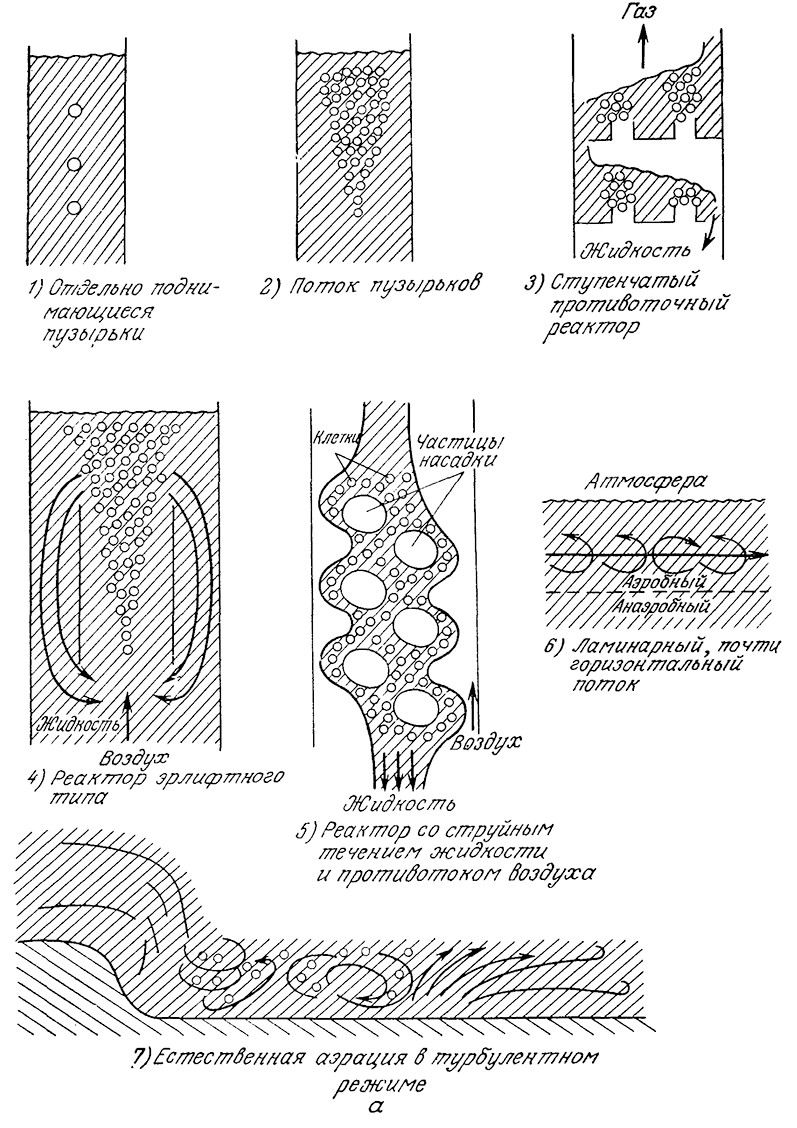
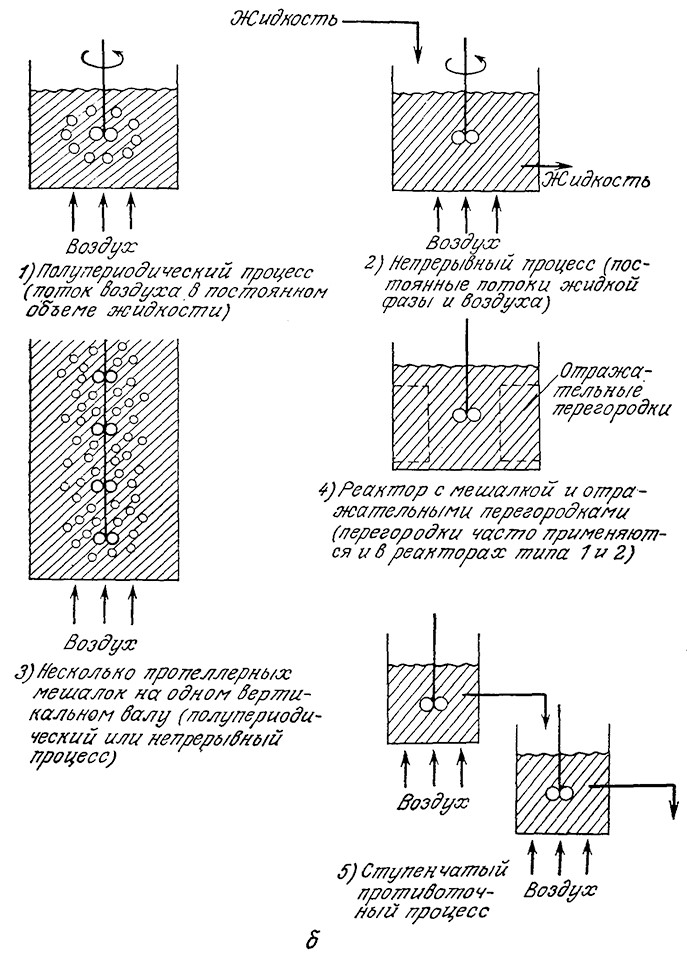
РИС. 8.2. Различные способы контакта между газовой и жидкой фазами:
а – свободно поднимающиеся пузырьки газов, свободно опускающиеся твердые частицы и капли жидкости;
б – механическое перемешивание.
Следовательно, в период активного дыхания популяция клеток потребляет кислород со скоростью, которая соответствует приблизительно 750-кратному насыщению кислородом в течение часа. Поскольку запасы растворенного кислорода довольно скудны, то популяция жизнеспособных клеток может существовать только при условии непрерывного введения кислорода в жидкую среду. Эта задача далеко не проста, так как низкая растворимость кислорода является причиной малой разности его концентраций, которая представляет собой главную движущую силу переноса кислорода из одной фазы в другую.
В случае ограниченно растворимых веществ, например кислорода и углеводородов в водных средах, зависимость между двумя равновесными концентрациями на границе раздела фаз Cli (со стороны газовой фазы) и сц (со стороны жидкой фазы) обычно можно выразить уравнением, отражающим закон линейного распределения, например закон Генри:
Mcli = Cgi (8.1)
Указанное уравнение справедливо, если скорость обмена растворенным веществом через границу раздела фаз значительно выше общей скорости массообмена; обычно это условие удовлетворяется, поскольку при давлении воздуха 1 атм и 25 °C скорость столкновений молекул О2 с поверхностью равна приблизительно 1024 на квадратный сантиметр в секунду, что намного превышает общую потребность в кислороде в приведенном выше примере типичного микробиологического процесса.
В стационарном состоянии скорость переноса кислорода к поверхности раздела фаз газ – жидкость равна скорости его транспорта через пленку со стороны жидкой фазы (рис. 8.1). Если Cg и Cl – концентрации кислорода в газовой и жидкой фазах соответственно, то мы можем записать равенство двух скоростей переноса:
Поток кислорода = число молей О2/(см2•с) =
= kg(cg – cig) = ki(cli – Cl) (8.2)
со стороны со стороны
газовой фазы жидкой фазы
Здесь kl и kg – коэффициенты массоотдачи в жидкой и газовой фазах соответственно.
Поскольку при изучении массообмена непосредственно измерить концентрации на границе раздела фаз не удается, то количественно массообмен обычно выражают через общий коэффициент массопередачи Kl и общую движущую силу (разность концентраций) сl*–cl, где cl* – концентрация растворенного вещества в жидкой фазе, находящейся в равновесии с газовой фазой:
Mcl*==cg (8.3)
С помощью этих параметров можно выразить плотность потока растворенного вещества:
Плотность потока = Kl/(cl* – сl) (8.4)
Из уравнений (8.1) – (8.4) следует хорошо известное выражение, связывающее общий коэффициент массопередачи Ki с физическими параметрами двухпленочной модели kg, ki и Μ:
В случае ограниченно растворимых веществ M намного больше единицы. Кроме того, kg обычно намного больше ki. Отсюда следует, что Ki приблизительно равно ki, и, таким образом, практически все сопротивление массопередаче сосредоточено ня стороне пленки, обращенной к жидкой фазе.
Скорость переноса кислорода в расчете на единицу объема реактора Qo2 определяется как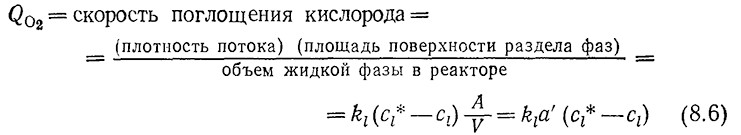
Здесь a' = A/V – отношение площади поверхности раздела фаз газ–жидкость к объему жидкой фазы; в уравнении (8.6) принято только что рассмотренное приближение Kl ≈ kl. Поскольку в этой главе основное внимание уделяется процессам аэрации, то в дальнейшем мы будем рассматривать главным образом перснос кислорода и поэтому в качестве коэффициента массопередачи вместо Kl будем применять ki. Входящим в некоторые уравнения символом α обозначают площадь поверхности раздела фаз газ – жидкость в расчете на единицу объема биологического реактора (т. е. на единицу объема дисперсной системы газ – жидкость). Находящийся над жидкой фазой газ не учитывается.
Запомните, что Qo2 представляет собой параметр, отражающий локальную объемную скорость поглощения O2; средняя объемная скорость утилизации кислорода (выраженная в молях за единицу времени в единице объема) Q̅o2 во всем объеме жидкой фазы V определяется как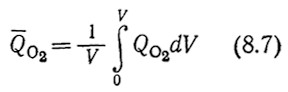
В общем случае Q̅o2 равна Qo2 тогда и только тогда, когда в любой точке объема реактора одинаковы и гидродинамические условия, и отношение площади поверхности раздела фаз к объему, и концентрация кислорода.
Наблюдаемая средняя скорость массообмена определяется целым рядом явлений и факторов, в том числе потребляемой реактором мощностью (в расчете на единицу объема), реологией жидкой фазы и дисперсной системы, характеристиками барботирующего устройства, общей структурой течений в реакторе. На рис. 8.3 изображены многочисленные связи между наблюдаемой средней скоростью переноса и обусловливающими этот перенос явлениями. Поскольку мы обычно не располагаем важнейшими фундаментальными данными о скоростях коалесценции и повторного диспергирования, о распределении газовых пузырьков по размерам и времени их пребывания в реакторе, то, как правило, мы вынуждены разрабатывать необходимые уравнения на основе соответствующих усредненных величин: среднем размере пузырьков, газосодержании (объемной доли газа, диспергированного в жидкости), среднем времени пребывания пузырьков газа и жидкой фазы в реакторе и т. д.
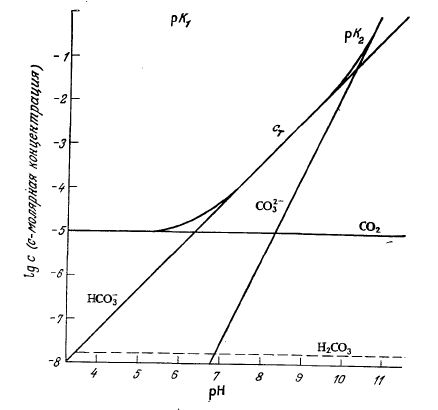
Приведенные в табл. 8.1 данные говорят о том, что с ι* зависит от температуры и состава среды. Зависимость от состава среды усложняется, если растворенный газ может реагировать с жидкой фазой. Такая ситуация типична, например, для диоксида углерода, который может существовать в жидкой фазе в любой из четырех форм: СО2, Н2СО3, HCO3– и CO32–. Соответствующие константы равновесия при 25 °C:
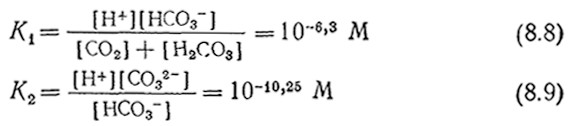
показывают, что общая концентрация Сτ растворенного в виде CO2 углерода в очень сильной степени зависит от рН:
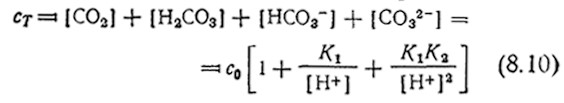
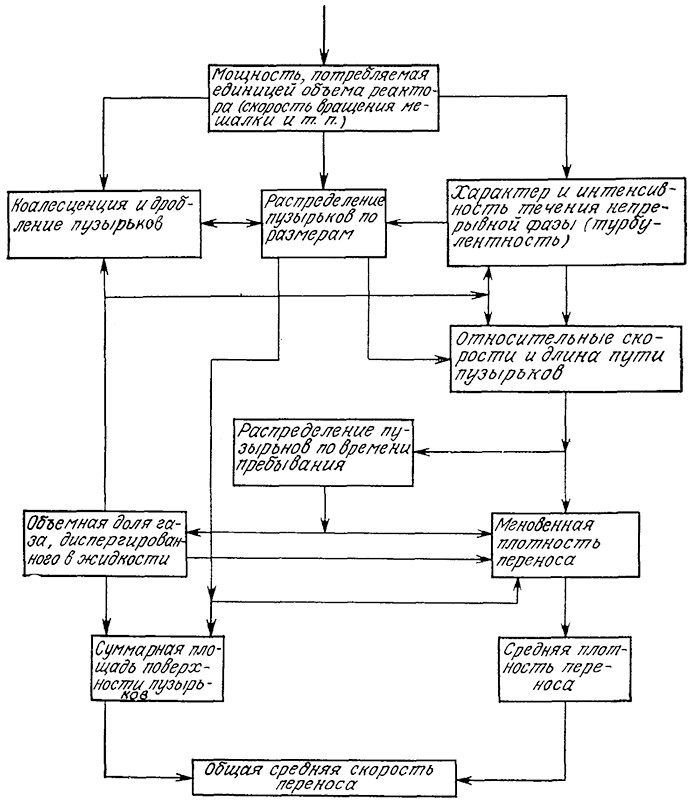
РИС. 8.3. Зависимость между интенсивностью перемешивания и скоростью переноса газа.
Эта зависимость в графической форме представлена на рис. 8.4; нетрудно видеть, что при рН<5 практически весь углерод находится в виде растворенного молекулярного СО2, бикарбонат доминирует в диапазоне 7<рН<9, а карбонат –при рН>11. Через границу раздела газ – жидкость переносится только растворенный СО2; скорость его переноса может быть описана уравнением (8.2).
РИС. 8.4. Равновесные концентрации CO2, HCO3–, СО32– и Н2СО3
в растворе (сτ – общая концентрация CO2 во всех четырех формах; рсо2 = 10–3,5 атм
(что соответствует парциальному давлению CO2 в воздухе); рН доводили
до заданного значения сильной кислотой или сильным основанием).
В нейтральной или основной среде большую роль играют как эффекты массообмена, так и химические процессы. Так, скорость обратимой реакции (8.11) очень высока: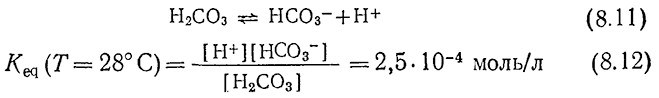
Напротив, реакция (8.13) протекает значительно медленнее k1 = 20 с–1; k–1 =0,03 с–1 при 25 °C):
![]()
Следовательно, в зависимости от условий стадией, определяющей скорость перехода CO2 в газовую фазу, может быть или химическая реакция [уравнение (8.13)], или физический процесс [СO2(раствор) → С02(газ) ].
8.1.2. Скорость утилизации кислорода в процессах клеточного метаболизма
Проектируя аэробные биологические реакторы, мы с помощью определенных математических выражений, с большим или меньшим приближением описывающих интересующую нас ситуацию, часто пытаемся выяснить, является ли самой медленной стадией процесса перепое кислорода (или другого лимитирующего клеточный рост вещества) или его утилизация клетками. Максимально возможная скорость массообмена определяется путем простой подстановки в указанные выше уравнения с; = 0; при этом условии весь поступающий в раствор кислород быстро усваивается клетками. В предыдущей главе мы установили, что максимальная скорость утилизации кислорода составляет хµmах/Yо2, где x – плотность культуры клеток, а Yo2–отношение числа грамм-атомов углерода в образующихся клеточных углеродсодержащих соединениях к числу молей усвоенного кислорода.
Если kia'cl* намного больше xµmax/Yo2, то, очевидно, основным препятствием дальнейшему повышению скорости утилизации кислорода является метаболизм микроорганизмов и скорость процесса ограничивается биохимическими факторами. В другом крайнем случае, когда kiα'Cl*<<xµimax/Yо2, кажущееся значение ci приближается к нулю и скорость процесса в реакторе должна определяться явлениями переноса.
В действительности ситуация несколько сложнее. В стационарном состоянии скорости утилизации и абсорбции кислорода должны быть равны
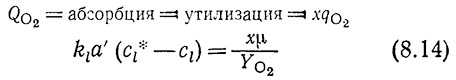
Если известна зависимость μ от cl, то с помощью уравнения (8.14) можно определить Ci и, следовательно, скорость утилизации кислорода.
В общем случае существует некоторая критическая концентрация кислорода в жидкой фазе, при достижении которой все клетки насыщаются O2 и количество последнего превышает минимум, необходимый для немедленного захвата всех электронных пар, участвующих в реакциях дыхательной цепи; в этой ситуации, следовательно, скорость процесса будет лимитировать какой-то иной биохимический механизм (гл. 5). Например, если зависимость удельной скорости роста клеток μ от концентрации кислорода подчиняется уравнению Моно, то
![]()
Общее решение уравнений такого типа было дано в разд. 4.4.1, но здесь для наглядности примем, что величина Ci значительно меньше Cl*. Для биологических реакторов такая ситуация довольно обычна. Если Cl<<Cl*, то Cl можно выразить следующим образом:
![]()
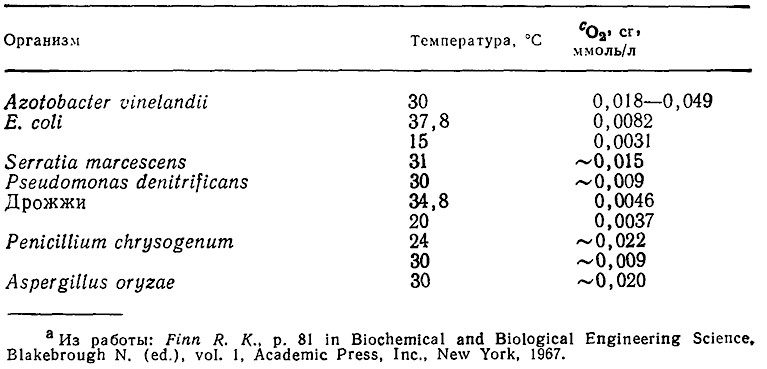
Если найденная таким путем величина Cl больше критического значения ссг (около 3/Со2), то скорость утилизации кислорода микроорганизмами лимитируется каким-либо иным фактором, например низкой концентрацией другого субстрата, даже если средняя концентрация растворенного кислорода в жидкой фазе значительно ниже уровня насыщения. Величины критических концентраций кислорода для различных организмов лежат в диапазоне от 0,003 до 0,05 ммоль/л (табл. 8.2) или от 0,1 до 10% максимальной растворимости O2 (табл. 8.1), или от 0,5 до 50% конц. насыщения кислородом воздуха. Очевидно, что массообмен кислорода особенно важен в случае организмов, для которых характерны большие значения критической концентрации кислорода, например плесеней Penicillium.
Таблица 8.2. Типичные значения со2.сг в присутствии субстратаa
Различные факторы могут влиять на общую потребность микроорганизма в кислороде xμ/Υо2, которая в свою очередь определяет необходимые в проектировочных работах минимальные значения klα' [уравнение (8.14)]. К числу наиболее важных факторов такого типа относятся вид клеток, фаза роста культуры, источники углерода, рН среды, тип изучаемого микробиологического процесса; последний фактор включает параметры утилизации субстрата, образования биомассы или выхода продукта жизнедеятельности микроорганизмов (гл. 7).
В приведенных на рис. 8.5 результатах определения скорости утилизации кислорода в периодическом процессе удельная потребность в О2 достигает максимума в начале экспоненциальной фазы, а x возрастает и на более поздних этапах роста. Произведение χμ, а, следовательно, и общая потребность в кислороде максимальны в конце экспоненциальной и в самом начале стационарной фазы; таким образом, скорость утилизации кислорода достигает максимума позднее, чем удельная скорость роста.
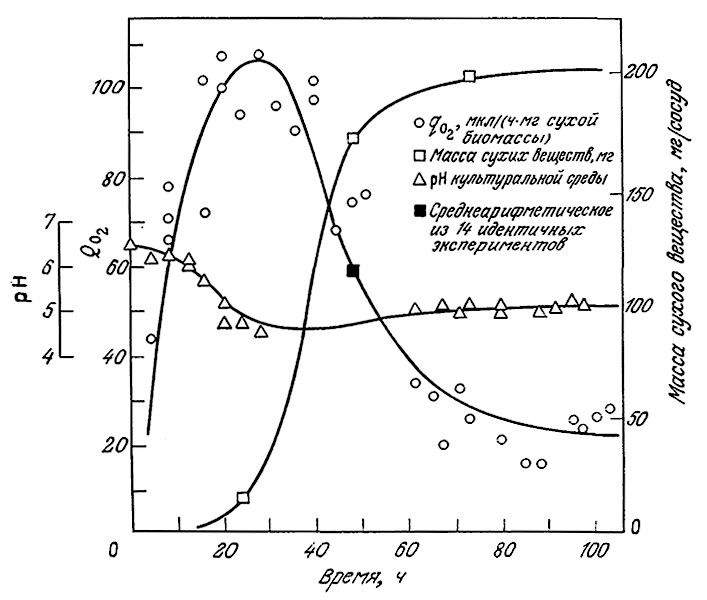
РИС. 8.5. Скорость утилизации кислорода периодической культурой Myrothecium verrucaria.
На скорость утилизации кислорода большое влияние оказывает природа углерод содержащего питательного вещества. Глюкоза, например, в общем случае метаболизируется быстрее, чем другие углеводы. Найдено, что максимальная скорость потребления кислорода Penicillium составляет 4,9, 6,7 и 13,4 моль/ (л•ч) в случае роста плесени на лактозе, сахарозе и глюкозе соответственно [2].
Суммарная потребность клетки в кислороде складывается из потребностей на поддержание жизнедеятельности клеток, окислительные реакции в процессе дыхания (используемые для роста клеток и для целей биосинтеза) и окисление субстратов в соответствующие конечные продукты метаболизма. При изучении стехиометрии метаболизма (гл. 5) мы видели, что скорость утилизации кислорода, расходуемого на клеточный рост, обычно непосредственно связана с количеством потребляемого субстрата, являющегося источником углерода. Кроме того, более восстановленные субстраты, например метан и высшие углеводороды, требуют усиленной утилизации кислорода клетками по сравнению с субстратами типа глюкозы, степень восстановленности атомов С в которых приблизительно та же, что и в компонентах клетки. Так, коэффициенты Уо2/с [т. е. отношение числа молей утилизированного кислорода к числу молей метаболизированного субстрата (в расчете на одноуглеродный субстрат)] равны 1,34, 1,0 и 0,4 для типичных микроорганизмов, растущих на метане, парафиновых углеводородах и углеводах соответственно.
Кислород может также выполнять роль реагента, участвующего в биотрансформациях. В производстве 5-кетоглюконовой кислоты из глюкозы, например, на первой стадии роста периодической культуры Acetobacter происходит окисление части содержащейся в среде глюкозы до глюконовой кислоты; при этом О2 используется как для клеточного роста, так и для синтеза продукта метаболизма. После истощения глюкозы рост клеток прекращается, а глюконовая кислота превращается в 5-кетоглюконовую кислоту по следующему уравнению реакции:
C6H12O7+1/2O2 → C6Н10О7+Н2О (8.17)
В заключительной стадии процесса осуществляется только указанная реакция, и потребление кислорода связано с образованием продукта метаболизма в соответствии со стехиометрией уравнения (8.17).