Общие понятия
Энзимы микрофлоры лактококковых заквасок являются главным фактором созревания сыров с низкими температурами II нагревания. Общее количество этих энзимов пропорционально биомассе лактококков, накопленной в сыре. Эффективность и направленность их действия зависит от физико-химических условий сырной массы, регулируемых технологией сыра, видового и штаммового состава заквасок. Физикохимические условия сырной массы во время выработки и созревания сыра меняются, а следовательно, меняются и условия для действия энзимов, что создает большие трудности в управлении процессами формирования органолептических показателей сыра.
В табл. 11.4 показана взаимосвязь между оценкой и изменениями содержания молочнокислых бактерий в Голландском сыре. В первую группу в этих исследованиях включены сыры высшего сорта, во вторую группу - первого сорта и в третью - несортовые. Отличительными чертами развития микрофлоры закваски в сырах 1 группы было сравнительно быстрое ее развитие в период выработки, достижение максимальной плотности популяции в 7-8 суточных сырах и снижение количества жизнеспособных клеток, начиная с 15-20-суточного возраста. Если в сырах первой группы содержание клеток молочнокислых бактерий в конце прессования по отношению к их содержанию в смеси возросло в 86-94 раза, то в сырах второй группы - только в 35 раз, а максимальная плотность популяции достигалась через 8-11 сут. Еще более медленно шло нарастание биомассы в сырах третьей группы. Отношение действующих биомасс молочнокислых бактерий в сырах 1, 2 и 3 групп составили примерно 2:1,5:1,1. Замедление развития микрофлоры заквасок в сырах второй и третьей групп уменьшило долю ее энзимов за счет увеличения доли энзимов посторонней микрофлоры. Следует сказать, что достаточно быстрое развитие микрофлоры закваски во время выработки и прессования сыров - необходимое, но недостаточное условие для получения продукта высокого качества. Слишком быстрое развитие микрофлоры закваски в этот период (увеличение численности молочнокислых бактерий в сырах после прессования более чем в 160 раз по сравнению с ее содержанием в смеси) также нежелательно, что будет показано ниже. По Перфильеву (1998), в мелких сырах после прессования при использовании угличских заквасок должно содержаться (0,8-1,0) ·109 КОЕ/г молочнокислых бактерий.
Протеолитические энзимы
Необходимый для биосинтеза белков материал лактобактерии получают в виде свободных аминокислот (САК) или пептидов с числом аминокислотных остатков не более 7 и молекулярной массой меньше 1500, которые способны проходить через клеточную стенку и мембрану против градиента концентрации. Затраты энергии на перенос аминокислот в составе низкомолекулярных пептидов меньше, чем на перенос свободных аминокислот, поэтому размножение лактококков в средах с низкомолекулярными пептидами идет более интенсивно. Однако есть штаммы сливочного лактококка, которые неспособны расти на средах, единственным источником азота в которых являются низкомолекулярные пептиды. Пул низкомолекулярных пептидов и свободных аминокислот в парном молоке удовлетворяет потребности лактококков менее чем на 20%, поэтому гидролиз части казеина свежего молока до этих соединений - необходимое условие для быстрого развития в нем лактококков.
Для получения источников азота в доступной форме лактококки обладают набором протеолитических энзимов - от протеиназ до амино-, кар- бокси- и дипептидаз. На рис. 3.4 показана схема протеолитической системы и транспортировки низкомолекулярных пептидов и свободных аминокислот внутрь клетки у лактобактерий. Несмотря на наличие сложной протеолитической системы, молоко, инокулированное молочнокислыми бактериями, образует сгусток, который не показывает видимых признаков протеолиза независимо от продолжительности инкубации. По-видимому, образующаяся при развитии лактобактерий кислота быстро подавляет активность их протеолитических энзимов в молоке.
Начальный этап расщепления казенное лактококками происходит при участии протеиназ, локализованных в клеточной стенке (протеиназы клеточной стенки). У лактококков обнаружено не менее трех протеиназ клеточной стенки, оптимальные температуры и pH которых равняются 30° С и 5,4; 30° С и 5,8; 40° С и 6,5. Особенно чувствительны протеиназы лактококков к pH.
Ни один из штаммов лактококков не содержит все протеиназы одновременно, что обусловливает различия между штаммами по протеолитической активности. Учитывая чувствительность к pH и температуре, протеиназы лактококков должны проявлять достаточно высокую казео- литическую активность во время выработки, но низкую - во время созревания твердых сыров. Для созревания сыра наиболее пригодны штаммы с оптимальной активностью протеиназы при pH 5,4. Показательно, что сыры с низким pH, в частности сыры типа Чеддер, созревают очень медленно. Наименее пригодны для сыроделия штаммы, оптимальные температура и pH для действия протеиназ которых равны 40° С и 6,5, поскольку высокая протеолитическая активность микрофлоры заквасок во время выработки может вызвать горечь в сыре и снизить его выход.
Изучение протеиназ клеточной стенки молочного и сливочного лактококков показало, что они расщепляют β-казеин с образованием пептидов, включающих фрагменты с горьким вкусом; изученные протеиназы этих подвидов лактококков мало отличались друг от друга. Протеиназы клеточных стенок лактококков, в отличие от лактобацилл, не действуют на а-казеин; только 20-28% штаммов Lc. cremoris, выделенных из заквасок, расщепляли β-казеин.
Исследование расщепления белков пастеризованного молока лактококками при 30° С в течение 10 сут показало, что они образуют сравнительно небольшое количество водорастворимого азота (16,5-19,8% от общего азота). Количество водорастворимого азота после 7-суточного выращивания молочного и диацетильного лактококков в пастеризованном молоке при 26° С составило 6,4-7,7%. Молочный лактококк обладал меньшей протеолитической активностью, чем сливочный и ди- ацетильный. Следует иметь в виду, что протеолитическая активность диацетильного лактококка в большой степени зависит от штамма (табл. 3.4).
Обычно штаммы Lc. cremoris с высокой кислотообразующей активностью имели также сравнительно высокую протеолитическую активность. Однако большинство авторов отрицает наличие тесной корреляции между протеолитической и кислотообразующей активностями лактококков.
Микрофлора лактококковых заквасок обладает по сравнению с молокосвертывающими энзимами более низкой активностью по отношению к казеину, поэтому основная часть водорастворимого азота в мелких сырах образуется в результате действия молокосвертывающих энзимов. В отношении образования аминокислот и пептидов с низкой молекулярной массой наблюдается обратная картина. Активность лактококков по образованию аминного азота была выше, чем по гидролизу казеина: разрушенные ультразвуком клетки молочного лактококка при pH 7,0 и 30° С через 50 ч превратили в водорастворимый белок 12% казеина молока, 65,8% которого составлял растворимый в фосфорновольфрамовой кислоте азот свободных аминокислот.
Протеиназы, связанные с клеточной стенкой, имеют также лактобациллы и лейконостоки. Лактобациллы обычно образуют нейтральные протеиназы клеточной стенки, активные по отношению к α-,β- и æ-казеинам, но специфичность их действия существенно зависит от вида и штамма продуцента. В клеточной стенке Lbc. helveticus есть одна про- теиназа с оптимальными pH 7,5-8,0 и температурой 42° С, которая не гидролизует β-казеин и только частично гидролизует а5-казеин. Протеиназы Lbc. lactis и Lbc. bulgaricus гидролизуют оба казеина. По другим данным, штаммы Lbc. helveticus, Lbc. bulgaricus, Lbc. lactis и Lbc. casei, выделенные из сывороточных заквасок для производства сыра Грана, сильно отличались по протеолитической активности. Lbc. helveticus обладала максимальной протеолитической активностью по отношению к а-казеину, но при этом слабо атаковала β казеин; Lbc. lactis атаковала только β-казеин, остальные два вида и некоторые штаммы Lbc. helveticus вообще очень слабо атаковали казеин. По результатам опытов Bottazzi, 80-90% штаммов термофильных лактобацилл, выделенные из сывороточных заквасок для производства крупных сыров, не обладали активностью к казеину. Morelli et al. показали, что низкая протеолитическая и кислотообразующая активность штаммов Lbc. helveticus связаны с потерей ими плазмиды 3,5 МД. Лактобациллы и термофильный стрептококк проявляют протеолитическую активность при температуре от 15 до 45° С.
Протеиназная активность лейконостоков низкая, что является причиной их медленного развития в молоке в чистых культурах.
Протеиназная активность термофильного стрептококка зависит от штамма. В обезжиренном молоке с мелом при выращивании штаммов термофильного стрептококка при оптимальной температуре доля as1казеина за 48 ч снизилась с 30 до 26%, содержание аминного азота за 30 сут повысилось от 0,10 до 0,16%. Однако другие штаммы термофильного стрептококка, выделенные из сывороточных заквасок для производства сыра Грана, обладали выраженной протеолитической активностью к казеину только в присутствии реннина и протеиназ молока. Это можно объяснить тем, что они гидролизовали не нативные казенны, а крупные пептиды, образуемые из нативных белков реннином и протеиназами молока.
У лактококков и лактобацилл имеются внутриклеточные протеи- назы, локализованные в цитоплазме, основной функцией которых является синтез бактериального белка (в зависимости от условий среды протеиназы катализируют расщепление или биосинтез белков). Внутриклеточные протеиназы принимают участие в созревании сыров после лизиса бактериальных клеток. Внутриклеточная протеиназа Lc. cremoris наиболее активно расщепляет а5-казеины: количество гидролизованных α- и æ-казеинов, оцениваемое по содержанию сиаловых кислот, составило соответственно: для внутриклеточной протеиназы Lc. cremoris - 69 и 9%, для реннина - 13 и 45%. Активность внутриклеточной протеиназы лактоккоков у различных штаммов может различаться в 2,5 раза. Активность протеиназ лейконостоков ниже, чем лактококков.
Лактобактерии образуют большое количество пептидаз. Отдельные пептидазы выделяются в среду для расщепления высокомолекулярных пептидов до более мелких пептидов и свободных аминокислот, которые могут быть перенесены внутрь клетки. На клеточных стенках лактококков локализованы две пептидазы, одна из них гидролизует только трилейцин, вторая - широкий спектр ди- и трипептидов. У Lc. lac- tis и Lc. cremoris обнаружены также 3 внутриклеточные пептидазы, одна из которых гидролизовала трилейцин, две имели широкий спектр действия. Образование САК лактококками было одинаковым в интервале pH от 7,0 до 5,6; при 30° С оно шло быстрее, чем при 40° С. Протеолитическая активность Lc. diacetylactis выше, чем Lc. cremoris, Lbc. helveticus - выше, чем лактококков. В сырах более полное расщепление казеина наблюдали при использовании в качестве лактококковой закваски диацетильного лактококка. Закваски из смеси подвидов лактококков обладают более сильной протеолитической активностью, чем закваски на чистых культурах Lc. cremoris.
Самой высокой аминопептидазной, дипептидазной и протеиназной активностью обладают штаммы Lbc. helveticus, самой высокой β-галакгози- дазной активностью - Lbc. bulgaricus. Включение болгарской палочки в закваски для производства крупных сыров в дозах 0,5-1000 мл/200 кг молока стимулировало образование пролина; в больших количествах она угнетала рост про пионовокислых бактерий.
Протеолитическая активность Lbc. casei по отношению к аS казеину в совместных культурах с лактококками была в 5,8 раза выше, чем в чистой культуре, по отношению к β-казеину она не изменилась. У штаммов термофильного стрептококка среди внутриклеточных энзимов обнаружены лейцинаминопептидаза, пролилдипептидазы, эндопептидаза. Внутриклеточные энзимы термофильного стрептококка гидролизовали β- и æ-казеины.
Внутриклеточные пептидазы высвобождаются в результате лизиса бактериальных клеток и участвуют в созревании сыров. Хотя оптимальный pH для пептидаз лежит в нейтральной или слабощелочной области, они сохраняют достаточную активность при pH мелких сыров.
Исследование протеолитической активности в гидролизованном молоке с реннетом лактококков, Lbc. helveticus и Prb. shermanii в соотношении 3:1:0,1 (экзоферменты) и экстрактов из разрушенных ультразвуком клеток (эндоферменты) в этом же отношении выявило низкую активность экзоферментов и отсутствие активности эццоферментов при 10° С, увеличение активности экзоферментов при повышении температуры до 22° С в 3,1 раза, активность эндоферментов при 22° С была такой же, как у экзоферментов. Повышение pH среды с 5,0 до 5,6 повысило активность экзоферментов в 10,4 раза, эндоферментов - в 9,2 раза.
Протеолитическая активность лактококков и лактобацилл в обезжиренном молоке сильно ингибируется добавлением 6% соли.
Штаммы Lc. cremoris гидролизуют пептиды с разной скоростью, хотя в бесклеточных экстрактах скорость гидролиза примерно одинакова, что объясняется неодинаковыми скоростями транспортировки пептидов в клетки у разных штаммов. Активность внутриклеточных протеиназ и пептидаз сохраняется после тепловой обработки при 50° С в течение 2,5 ч.
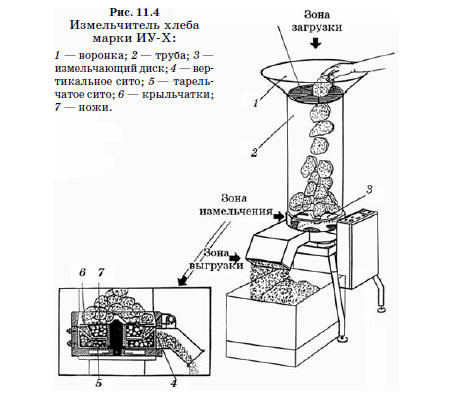
Протеолитическая активность термофильных и мезофильных молочнокислых бактерий в стерилизованном обезжиренном молоке с нейтрализацией образующейся кислоты мраморной крошкой при оптимальных температурах показана на рисунках 11.3; 11.4 и 11.5. Из изученных культур наибольшей протеолитической активностью обладали Lbc. helveticus и Lbc. casei, наименьшей - термофильный стрептококк.
Степень гидролиза казеина обезжиренного молока с мелом и сычужным порошком через 10 сут культивирования термофильного стрептококка, Lbc. lactis и Lbc. helveticus в зависимости от вида и штамма варьировала от 9 до 37%; штаммы стрептококка гидролизовали не более 20% казеина с образованием продуктов с длинной цепью, лактобациллы характеризовались более глубоким гидролизом казеина.
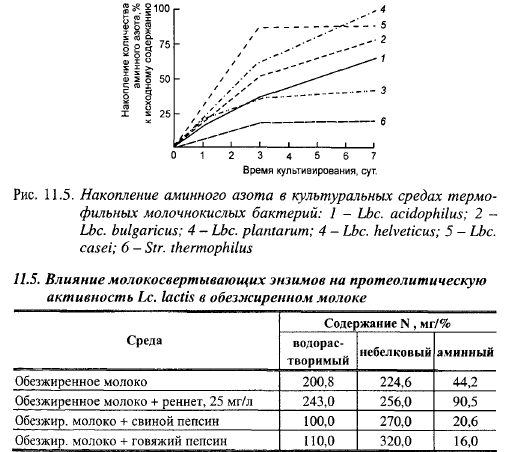
Представляет интерес влияние молокосвертывающих энзимов на протеолитическую активность лактококков. В табл. 11.5 представлены результаты опытов Вязниковой и др. по изучению влияния молокосвертывающих энзимов на протеолитическую активность Lc. lactis в обезжиренном молоке (время инкубации 10 сут, температура 30° С). Из этих данных видно, что в культурах лактококка в присутствии пепсинов, по сравнению с их культурами в молоке без добавления энзимов, произошло снижение количества водорастворимого азота на 50,2—45,2% и свободных кислот на 53,4-63,8%, а количество небелкового азота возросло на 20,2—42,4%, в то время как в присутствии реннета увеличилось содержание всех фракций: водорастворимого азота - на 21, небелкового азота - на 13,9 и аминного - на 104,8%. В варианте с реннетом увеличение количества водорастворимого и небелкового азота произошло в результате энзиматической реакции, а увеличение содержания аминного азота является результатом резкого повышения протеолитической активности лактококка в присутствии реннета. Пепсины в условиях опыта, по-видимому, не проявили или проявили незначительную казеоли- тическую активность, а снижение содержания аминного азота говорит об использовании культурой низкомолекулярных пептидов и аминокислот для синтеза собственных белков.
Сычужный порошок по-разному влияет на протеолитическую активность различных подвидов лактококков. Лактококки атакуют параказеин и в отсутствие молокосвертывающих энзимов, даже после гибели клеток, что свидетельствует об участии в этом процессе эндоферментов.
Таким образом, лактобактерии обладают достаточной протеолитической активностью для расщепления совместно с реннином казеинов до свободных аминокислот. Специфичность действия их протеолитических систем зависит от вида и штамма и значительно варьирует.
Лактобактерии обладают фосфомоноэстеразной активностью, которая является штаммовым признаком. Этот тип энзиматической активности может иметь значение при расщеплении фосфопептидов, образующихся в сырах в процессе протеолиза и, возможно, причастных к образованию горечи. Роль фосфомоноэстераз лактобактерий в сырах не изучена.
Липолитическая активность
Липиды не являются источниками энергии для микрофлоры заквасок, и наличие у нее очень слабой липолитической активности обусловлено ее биосинтетическими нуждами. Несмотря на слабую липолитическую активность микрофлоры заквасок, липолиз в созревающих сырах играет важную роль и осуществляется микрофлорой закваски в большинстве сыров. Небольшая липолитическая активность микрофлоры закваски компенсируется высокой концентрацией их клеток и продолжительным созреванием сыров, а также низким вкусовым порогом продуктов липолиза (табл. 11.15).
Исследована липолитическая активность Lbc. lactis (5 штаммов), лактобацилл (3 штамма), лейконостоков (3 штамма), пропионовокислых бактерий (3 штамма). Количество свободных жирных кислот (СЖК), образуемых в 10 %-ной эмульсии триглицерида масляной кислоты в течение часа при 37° С (мкМ/мг клеточной ДНК), у молочнокислых палочек было ниже 1,0, у других видов - от 2,3 до 33. Ни один штамм не образовывал внеклеточной липазы. Таким образом, виды и штаммы лактобактерий сильно различались по интенсивности гидролиза трибутирина. Наибольшая активность оказалась у Leuc. dextranicum, минимальная - у Lbc. acidophilus.
Содержание летучих СЖК (мл 0,01 н NaOH/50 г сгустка), образованных в стерильном восстановленном молоке при 22 и 30° С за 18 ч равнялось: у Lc. cremoris 6,0 и 8,4; у Lc. diacetylactis - 22,5 и 22,7; Lc. lactis - 6,4 и 8,2. Комбинации сливочного лактококка с диацетильным или лейконостоками образовывали больше СЖК, чем его чистая культура. Содержание летучих СЖК, образуемых культурами в обезжиренном молоке в течение 18 ч при 37 и 42° С, равнялось: для St г. thermophilus - 5,0 и 7,3; для Lbc. casei - 6,5 и 4,5; для Lbc. helveticus - 4,8 и 2,5; для Lbc. bulgaricus - 23 и 26; для Lbc. plantarum - 6,8 и 7,4.
Yu et al. и Kamaly et al. обнаружили липазы у Lbc. casei, Lbc. helveticus, Lbc. plantarum, Lbc. acidophilus, Lc. lactis, лейконостоков, но не нашли у термофильного стрептококка, Lc. cremoris, Lbc. bulgaricus-, pH оптимальный для липаз лактобактерий - около 7,0, оптимальная температура - 37° С. В то же время Гриневич и Ермаков выделили штаммы термофильного стрептококка с высокой липолитической активностью, a Kamaly et al. считают, что липолитическая активность Lc. cremoris выше, чем Lc. lactis. Следовательно, липолитическая активность является штаммовым и видовым признаком. Штаммы, культивируемые в молоке, обычно обладают более высокой липолитической активностью. Штаммы с высокой липолитической активностью отличались от штаммов с низкой активностью более высокой способностью к кислотообразованию и образованию С02, повышенными редуцирующей и протеолитической активностями.
Гобетти и др. обнаружили эстеразную и липолитическую активность у лактобацилл. Эстеразная активность термофильных палочек была выше, чем мезофильных, липолитическая активность по отношению к молочному жиру была наибольшей у Lbc. plantarum и Lbc. casei. Эстеразы у большинства видов только внутриклеточные.
Lbc. casei в присутствии Мезентерина в смесях с казеином образовывали изо- и н-валериановую, н-капроновую и н-каприловую кислоты; лактококковая закваска в этих же условиях образовывала больше уксусной, пропионовой, изо- и н-масляной кислот.
Уманский и Боровкова изучали липолитическую активность лактококков, термофильного стрептококка, термофильных лактобацилл и пропионовокислых бактерий, культивируемых в обезжиренном молоке в течение 7 сут. Липолитическую активность оценивали по увеличению содержания СЖК как высокую (прирост содержания СЖК 4%), среднюю (2,0-3,5%) и низкую (1,5%).
Образование летучих СЖК исследованными культурами в молоке коррелировало с их образованием в Советском сыре, выработанном с заквасками из этих культур; качество сыра было выше при использовании заквасок с высокой липолитической активностью.
Лактобактерии обладают фосфолипазной активностью (ФЛА). Высокой ФЛА обладали 47% исследованных штаммов лейконостоков, средней - 77% штаммов диацетильного лактококка и 62% штаммов молочного лактококка, 58% штаммов сливочного лактококка обладали низкой активностью. Фосфолипаза, гидролизуя оболочки жировых шариков, обеспечивает доступность липидов для липаз лактобактерий и интенсифицирует липолиз. В сырах, выработанных с закваской с высокой ФЛА, повышается содержание СЖК с С18, С19 и С2о- Сыр Костромской лучшего качества получен при минимальной ФЛА и максимальной липолитической активности микрофлоры. В сырах с высокой ФЛА появляется горький и посторонний вкус.
Сбраживание лактозы
Считается, что созревание сыра начинается после окончания сбраживания основной массы углеводов, которое в твердых сырах при нормальном ходе выработки соответствует окончанию посолки. При неправильном подборе микрофлоры закваски для крупных сыров, когда термофильный стрептококк и термофильные лактобациллы не сбраживают или медленно сбраживают галактозу, она может оставаться несброженной вплоть до помещения сыра в теплую камеру и служить источником энергии для посторонней микрофлоры. Задержка сбраживания галактозы приводит к тому, что pH сыра под держивается на более высоком уровне, что также способствует развитию посторонней микрофлоры. Все это приводит к ухудшению органолептических показателей продукта, при этом степень ухудшения зависит от того, какая микрофлора сбродит галактозу. Такая же ситуация может возникнуть в мелких сырах при включении в состав их заквасок штаммов термофильных стрептококков, например, при производстве Чеддера по ускоренной технологии. Особенно опасно снижение активности заквасок под действием бактериофага.
Трансформация продуктов гидролиза компонентов молока и цитратов
Главные продукты гликолиза (молочная и уксусная кислоты, С02), протеолиза (низкомолекулярные пептиды, свободные аминокислоты) и липолиза (СЖК, спирты) формируют основной вкусовой фон сыров. Кроме этого, они являются предшественниками образования других вкусовых и ароматических веществ сыров, например, карбонильных соединений, имеющих низкий вкусовой порог и играющих определенную роль в формировании вкусового букета сыров. Так, аминокислоты могут подвергаться дезаминированию, заключающемуся в отщеплении а-аминогруппы, с образованием различных кето-, окси- и карбоновых (пировиноградной, пропионовой, а-кетоглутаровой, янтарной, изомасляной, изовалерьяновой, яблочной и др.) кислот. Образующиеся при этом кетокислоты могут декарбоксилироваться до соответствующих альдегидов (изовалерьянового, изомасляного, ацетальдегида, фенилуксусного и др.). Альдегиды могут восстанавливаться в соответствующие спирты. Образующийся при дезаминировании аммиак идет на синтез амидов дикарбоновых кислот - глутамина и аспарагина. В результате декарбоксилирования аминокислот образуются соответствующие амины и СО2- Схема катаболизма аминокислот, по Hemme et al., приведена на рис. 11.6.
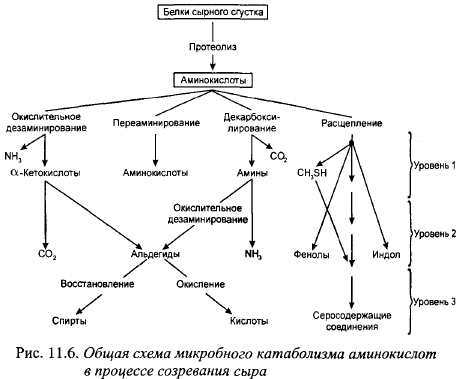
Образование вкусовых и ароматических веществ из продуктов гидролиза основных компонентов молока и цитратов происходит энзиматическим и чисто химическим путем. Способность различных видов и штаммов микрофлоры заквасок образовывать необходимые для этих реакций энзимы изучена совершенно недостаточно. Однако, тот факт, что сыры с низкими температурами II нагревания с типичным вкусом и ароматом в асептических условиях можно выработать, используя из микроорганизмов только лактококки, а крупные сыры - с использованием микрофлоры заквасок и пропионовокислых бактерий, свидетельствует о способности микрофлоры заквасок образовывать весь комплекс энзимов, необходимых для синтеза вкусовых и ароматических веществ сыра. Но часто сыры, вырабатываемые в асептических ваннах только с участием микрофлоры заквасок, имеют менее выраженный вкус, чем контрольные, вырабатываемые в открытой ванне. Это может быть следствием недостаточной способности микрофлоры заквасок или части ее штаммов образовывать вкусовые и ароматические вещества.
Определенное значение в формировании органолептических показателей сычужных сыров, особенно с низкой температурой II нагревания, а также кисломолочных сыров имеет ферментация цитратов. Основные и промежуточные продукты ферментации цитратов принимают непосредственное участие в этом процессе и могут стать компонентами или предшественниками в образовании других веществ, влияющих на качество сыров.
В мезофильных заквасках для выработки сыров с низкими температурами II нагревания цитраты сбраживают в присутствии ферментируемого углевода диацетильный лактококк или лейконостоки с образованием диацетила, ацетоина, ацетата, 2,3-бутиленгликоля, С02. Энзимы, вовлекаемые в ферментацию цитрата, у диацетильного лактококка - конституционные, у лейконостоков - индуцибельные. Возможные пути метаболизма цитратов приведены Горбатовой. Диацетильный лактококк ферментирует цитраты с образованием диацетила и ацетоина с самого начала своего роста. Большинство штаммов этого подвида образует больше ацетоина, чем диацетила, причем отношение содержания ацетоина к содержанию диацетила может достигать 43:1. Максимальное количество образуемого диацетильным лактококком в молоке ацетоина равно, по Cogan, 3 мМ (264 мг/кг), диацетила - 0,1 мМ (8,6 мг/кг). По данным Горбатовой, большинство штаммов диацетильного лактококка образует в молоке до 12 мг/кг диацетила (некоторые - до 50 мг/кг) и около 500 мг/кг ацетоина, лейконостоки - соответственно 5 и 85 мг/кг. Только штаммы с достаточно высокой способностью к синтезу ацетил-КоА и пониженной активностью ацетоиндегидразы синтезируют большие количества диацетила. Из лактозы диацетильный лактококк не образует диацетила, С02 и ацетоина.
Лейконостоки ассимилируют цитраты без образования диацетила и ацетоина при нейтральном pH и с образованием этих соединений при pH меньше 5,5. Оптимальный pH для синтеза диацетила равен 5,4. Добавление в среду небольшого количества глюкозы (5мМ) увеличивает скорость ферментации цитрата лактококками, но полностью подавляет синтез ацетоина. В отличие от диацетильного лактококка, лейконостоки образуют С02 не только из цитратов, но и из лактозы. Ферментация цитратов завершается во время выработки сыра, но если они на этом этапе не будут сброжены, то это влияет на последующее созревание сыра. Закваски с диацетильным лактококком быстрее ферментируют цитраты, чем закваски с лейконостоками, но образование первыми С02 зависят от действия бактериофага.
Промежуточным продуктом метаболизма цитратов является ацетальдегид, который в заметных количествах может накапливаться в культурах диацетильного лактококка. Лейконостоки сами утилизируют ацетальдегид. Высокое содержание ацетальдегида может быть причиной образования «зеленого» («резкого») привкуса в ферментированных молочных продуктах. В хороших заквасках отношение количества диацетила к количеству ацетальдегида должно быть не меньше 4:1. Часть ацетальдегида микрофлорой закваски трансформируется в этанол, который сам по себе не влияет на вкус и аромат сыра, но, вступая в реакции с СЖК, может вызвать пороки сыров. Больше всего спирта образуется в культурах лейконостоков.
Выделенные из заквасок штаммы лактококков образовывали неодинаковое количество карбонильных соединений (мкг/кг): Lc. cremoris - 6,7-32,8; Lc. lactis - 17,0-46,7; Lc. diacetylactis 11,8-61,5; лейконостоки - 4,6. Коллекционные штаммы cremoris образовывали 4,8-23,7, Lc. lactis - 9,5—46,7, Lc. diacetylactis 15,4—85,2 мкг/кг карбонильных соединений. Чеддер, выработанный только со штаммами Lc. cremoris, получил наивысшую оценку, на втором месте стояли сыры, выработанные на заквасках из штаммов лейконостоков, Lc. lactis и Lc. cremoris, в которых отмечен слабовыраженный «фруктовый» привкус, и минимальную оценку получили сыры, выработанные на заквасках, в которых доминировали штаммы Lc. lactis и Lc. diacetylactis, из-за выраженного порока «фруктовый» вкус и аромат. Авторы считают, что закваски для Чеддера не должны образовывать больше 20 мкг/кг карбонильных соединений.
Диацетильный лактококк образует ацетаты из аланина, глицина и серина, пропионаты из треонина, изобутираты из валина, изовалериаты из изолейцина и лейцина путем окислительного дезаминирования. Карбоновые кислоты при наличии в сыре спиртов могут образовывать эфиры, придающие различные привкусы продукту. Многочисленные минорные компоненты метаболизма диацетильного лактококка и лейконостоков в низких концентрациях усиливают выраженность сырного вкуса мелких сыров, но при высоком их содержании они вызывают пороки продукта. В связи с этим их количество в заквасках и сырах должно контролироваться.
Lbc. bulgaricus, Lbc. helveticus и термофильный стрептококк не утилизируют цитраты; пируват - промежуточный продукт метаболизма углеводов и цитратов - используется болгарской палочкой и термофильным стрептококком.
Соединения, получаемые в результате биотрансформации продуктов гликолиза, протеолиза и липолиза, могут как улучшать, так и ухудшать органолептические показатели сыров.

