ОКСИДОРЕДУКТАЗЫ
Оксидоредуктазы – это ферменты биологического окисления в организмах, участвующие в ряде важных аэробных и анаэробных процессов. Эти реакций обычно протекают так, что водородные атомы субстратов или метаболитов, активированные дегидрогеназами, окисляются до воды или перекиси водорода. В зависимости от типа акцептора водородных атомов различаются анаэробные и аэробные дегидрогеназы. Ферменты, активирующие молекулярный водород и реагирующие непосредственно с молекулярным кислородом (окисляющим некоторые вещества без активирования водородных атомов), называются оксидазами. При реакции не образуется перекись водорода. Некоторые оксидоредуктазы действуют на отдельные доноры с присоединением к ним кислорода; ферменты этого типа называются гидроксилазами, или оксигеназами. Пероксидазы для окисления некоторых веществ активируют перекись водорода.
В зависимости от коферментов различаются дегидрогеназы никотинамиднуклеотидные (или пиридиннуклеотиды) и флавиннуклеотидные (флавопротеиды).
НИКОТИНАМИДНЫЕ ДЕГИДРОГЕНАЗЫ
Дегидрогеназы этого типа активируют водоррд субстратов или метаболитов и катализируют его перенос на акцепторы или переносчики, отличные от молекулярного кислорода. Следовательно, это анаэробные дегидрогеназы, действие которых можно показать следующим образом:
субстрат+НАД(НАДФ) ⇄. окисленный субстрат + НАДН2 (НАДФН2).
Соответствующими коферментами, переносящими из субстрата водород, являются никотинамидадениндинуклеотид (НАД) и никотинамидадениндинуклеотидфосфат (НАДФ).
В зависимости от изменений свободной энергии, обусловленных различием окислительно-восстановительных потенциалов, равновесное состояние смещено либо в сторону восстановленной формы субстрата, например у реакций, катализируемых лактатдегидрогеназой (L-лактат: НАДоксидоредуктаза, 1.1.1.27), малатдегидрогеназой (L-малат: НАД-оксидоредуктаза, 1.1.1.37) или алкогольдегидрогеназой (алкоголь: НАД-оксидоредуктаза, 1.1.1.1,.) или же в сторону окисления, например при реакции гидрогенизации глюкозо-6-фосфата, катализируемой глюкозо-6-фосфатдегидрогеназой (1.1.1.49).
Никотинамиднуклеотидные дегидрогеназы характеризуются высокой специфичностью по отношению к субстрату, выбор которого определяется апоферментом.
Некоторым дегидрогеназам для проведения реакции дегидрирования необходимо присутствие тяжелых металлов. Так, например, малатдегидрогеназа (1.1.1.37) требует ионов марганца, а алкогольдегидрогеназа (1.1.1.1.) из дрожжей – ионов цинка.
В цепной реакции биологических окислений восстановленный кофермент передает атомы водорода флавопротеиду, являющемуся ближайшим звеном цепи, или же другим акцепторам, например хинонам, дисульфидам и некоторым синтетическим красителям (in vitro).
ФЛАВИННУКЛЕОТИДНЫЕ ДЕГИДРОГЕНАЗЫ
Флавиннуклеотидные дегидрогеназы (флавиннуклеотидные ферменты, флавопротеиды) чаще всего являются акцепторами восстановленных никотинамиднуклеотидных дегидрогеназ, которые при этом снова окисляются:
НАД H2 + флавопротеид (ФАД) ⇄ НАД + восстановленный флавопротеид (ФАД H2).
Переносить водород от субстратов (аминокислот, аминов, глюкозы, альдегидов и т. п.) непосредственно кислороду могут лишь некоторые из этих дегидрогеназ. По специфичности в отношении акцепторов различаются анаэробные дегидрогеназы, катализирующие перенос электронов на цитохромы или другие акцепторы (например, нитраты), и аэробные (трансдегидрогеназы), переносящие электроны непосредственно от субстратов на молекулярный кислород с образованием перекиси водорода:
ФАД H2 + O2 → ФАд + H2O2.
Перекись водорода, образующаяся при этой реакции, могла бы накапливаться в организме. Поэтому аэробные организмы должны иметь еще и другие ферменты (гидропероксидазы 1.11), катализирующие распад токсичной перекиси водорода. Если таких ферментов нет, то флавиновые ферменты действуют вместе с кислородом воздуха в качестве токсичных веществ. Поэтому, например, глюкозооксидаза (β-D-глюкоза: O2-оксидоредуктаза, 1.1.3.4) является бактерицидной для анаэробов; первоначально ее принимали за антибиотик (нотатин). Глюкозооксидазы используются в пищевой промышленности для удаления небольших количеств глюкозы, которые вместе с присутствующими аминокислотами вызывают побурение пищевых продуктов (реакция Майара). В пивоварении пытались использовать эту реакцию для удаления остаточного кислорода из бутылочного пива перед пастеризацией.
В организмах обычно присутствуют оксидазы L-аминокислот. Одна группа (1.4.3.2) катализирует окисление L-аминокислот, вторая (1.4.3.3) – D-аминокислот, Аминокислота сначала дегидрируется в присутствии кислорода или другого акцептора водорода в иминокислоту, которая после присоединения воды спонтанно переходит в а-кетокислоту.
Аналогично этому дезаминирование многих аминов катализирует аминооксидаза. Из амина сначала образуется имин, который самопроизвольно гидролизуется до альдегида и аммиака. Диаминооксидаза (гистаминаза-диамин: О2-оксидоредуктаза, 1.4.3.6) специфична по отношению к субстратам с двумя аминогруппами.
В так называемом цитратном цикле важным флавиновым ферментом является сукцинатдегидрогеназа [сукцинат: (акцептор)-оксидоредуктаза, 1.3.99.1, ранее называвшаяся дегидрогеназой янтарной кислоты], которая катализирует дегидрирование янтарной кислоты до фумаровой. Фермент представляет собой металлопротеид, содержащий наряду с флавиновой группой еще и комплексно-связанное железо. Значение этого фермента заключается в том, что он объединяет цитратный цикл с системой, переносящей электроны в аэробных процессах, через цитохром Ь2.
Анаэробные трансгидрогеназы передают водород (электроны) цитохромной системе или некоторым другим промежуточныМ Метаболитам (аминокислотам, фумаровой кислоте и т. п.). Они играют большую роль в системах переноса электронов, в которых осуществляются основные процессы дыхания, т. е. последовательный перенос водорода, отнятого у окисляемых субстратов, на конечный акцептор, которым является кислород воздуха.
Убихиноны (коферменты Q) действуют как окислительно-восстановительные" системы, образуемые окисленной формой, т. ё. хиноном, и восстановленной формой, т.е. гидрохиноном. Соответствующий флавиновый фермент, восстанавливающий кофермент Q, называется цитохром с-редуктазой (НАДН2: убихинон-оксидоредуктаза, 1.6.2.1.).
ОКСИДАЗЫ
Оксидазы катализируют окисление субстратов кислородом воздуха; они активируют молекулярный кислород. Это металлопротеиды, содержащие ионы железа и меди.
Среди оксидаз наиболее известна цитохромоксидаза (цитохром с: O2-оксидоредуктаза, 1.9.3.1), которую раньше называли «дыхательным ферментом» Варбурга. Она является последним ферментом в цепи, соединяющей кислород воздуха с водородом, отнятым ох окисленных субстратов, так как непосредственно способствует восстановлению кислорода до воды. Фермент специфичен, ой катализирует исключительно повторное окисление восстановленного цитохрома с.
В группе ферментов – купропротеидов, катализирующих окисление фенолов, в зависимости от субстратов различаются о-дифенолоксидаза (о-дифенол: O2-оксидоредуктаза, 1.10.3.1), катализирующая окисление монофенолов и о-дифенолов, и n-дифенолоксидаза (n-дифенол: Ог-оксидоредуктаза, 1.10.3.2), ранее называвшаяся лакказой, действующая на я-дифенолы и n-фенилендиамины. К ферментам этого типа относится также аскорбиноксидаза (1.10.3.3), катализирующая окисление L-аскорбиновой кислоты в присутствии кислорода.
ГИДРОПЕРОКСИДАЗЫ
Эта группа ферментов включает каталазу, катализирующую разложение перекиси водорода на воду и кислород, и пероксидазу, катализирующую перенос кислорода от перекиси водорода на акцепторы.
Каталаза (H2O2: H2O2 – оксидоредуктаз а, 1.11.1.6) – это гемопротеид, содержащий в простетической "Группе четыре железопротопорфириновых остатка, прочно связанных с белковым веществом; трехвалентное железо не изменяет свою валентность. Предполагается, что при разложении перекиси водорода на первой фазе субстрат присоединяется к железу фермента и образующийся комплекс объединяется со следующей молекулой пёрекиси водорода в качестве акцептора:
E + H2O2 → E · H2O2; E • H2O2 → E + 2Н2O + O2.
(Е – каталаза, a E • H2O2 – комплекс фермента с перекисью водорода).
Пероксидазы (1.11) cодepжaт в простетической группе феррипротопорфирин или его производные, например зеленые гемины. ПерОксидаЗа, идентифицированная в дрожжах, – это цитохром с-пероксидаза (цитохром с: H2O2 – оксидоредуктаза, 1.11.1.5). Механизм Окисления такой же, как и у каталазы:
E-+ H2O2 → E • H2O2; E • H2O2 + AH2 → Е + 2Н2О+А.
(А – субстрат, а остальные обозначения те же, что и в формуле для каталазы).
ТРАНСФЕРАЗЫ
Трансферазы (киназы) катализируют перенос определенных функциональных групп (атомных группировок) от одного соединения к другому или от донора на акцептор. Реакции, катализируемые трансферазами, можно изобразить следующим образом:
D – R + А ⇄ D + R –А,
где D – донор, А – акцептор, R – переносимый радикал.
ФЕРМЕНТЫ, ПЕРЕНОСЯЩИЕ ОДНОУГЛЕРОДНЫЕ ОСТАТКИ
Наиболее важные ферменты катализируют перенос следующих групп:·метильных (метилтрансферазы, 2.1.1, или трансметилазы), оксиметильных (оксиметилтрансферазы, 2.1.2, или трансоксиметилазы), формильных (формилтрансферазы, 2.1.2, или трансформилазы), карбамоильных и т. д.
В качестве первичного донора метальной группы у большинства метилтрансфераз служит метионин в актйвной форме в виде S-аденозил-метионина, образующегося из L-метионина под действием АТФ.
Из остальных ферментов, переносящих радикал с одним атомом углерода, можно назвать карбоксилтрансферазы и карбомоилтрансферазы (2.1.3).
ФЕРМЕНТЫ, ПЕРЕНОСЯЩИЕ ОСТАТКИ АЛЬДЕГИДОВ И КЕТОНОВ
К этой группе трансфераз относятся трансальдолазы и трацскетолазы, катализирующие расщепление и образование связи между двумя атомами углерода и влияющие на метаболизм Сахаров (пентозный цикл, фотосинтез).
Транскетолаза (О-седогептулозо-7-фосфат: D-глицеральдегид-3-фосфат-гликольальдегидтрансфераза 2.2.1.1) катализирует реакцию, аналогичную ацилоиновым конденсациям, т. е. переносит остаток с двумя атомами углерода из кетофосфатов на соответствующие альдегиды. Простетической группой этого фермента является тиаминпирофосфат.
Трансальдолаза (D-седогептулозо-7-фосфат: D-глицеральдегид-3-фосфат-диоксиацетонтрансфераза 2.2.1.2) катализирует расщепление кетоз и перенос трехуглеродного остатка диоксиацетона на другой альдегид. Перечень важнейших оксидоредуктаз приведен в табл. 1.
Таблица 1



ФЕРМЕНТЫ, ПЕРЕНОСЯЩИЕ АЦИЛЬНЫЕ ОСТАТКИ
Важный для обмена веществ перенос остатков органических кислот, чаще всего ацетила, катализируют в организмах ацетилтрансферазы (2.3.1) или трансацетилазы. Небелковым компонентом этих ферментов является кофермент A (KoA). Остаток органической кислоты связывается при. переносе с сульфгидрильной группой кофермента и образуется макроэргическая тиоэфирная связь. В данном случае кофермент А выполняет такую же функцию, как АТФ при переносе фосфатных остатков. При гидролизе тиоэфирной связи выделяется много энергии.
Для биосинтеза жирных кислот перенос ацетила имеет большое значение. Ацетилтрансферазы катализируют перенос ацетила, связанного ацетилкоферментом А, на ацилкофермент А. Реакцию катализирует ацетил-КоА-ацетилтрансфераза (ацетил-КоА: ацетил-КрА-S-ацетил-трансфераза, 2.1.9). При ацетилировании аминосахаров, например глюкозамина, проявляет свое действие глюкозамин-адетилтрансфераза (ацетил-КоА : 2-амино-2-дезокси-D-глюкозо-N-ацетилтрансфераза, 2.3.1.3), а при ацетилировании некоторых аминокислот, например глутаминовой кислоты – ацетилтрансфераза аминокислот (ацетил-КоА: L-глутамат-N-ацетилтрансфераза, 2.3.1.1.).
Фосфат-ацетилтрансфераза (ацетил-КоА: ортофосфатацетилтрансфераза, 2.3.1.8) катализирует соединение между макроэргическими связями тиоэфирного и фосфатного типа, влияющего на обмен веществ организмов:
ацетил-КоА + P → KoA + ацетилфосфат.
Липоат-ацетилтрансфераза (ацетил-КоА: дигидролипоат-S-ацетилтрансфераза, 2.3.1.12) является: компонентом системы-оксидазы пировиноградной кислоты и других α-кетокислот.
ФЕРМЕНТЫ, ПЕРЕНОСЯЩИЕ ГЛИКОЗИЛЬНЫЕ ГРУППЫ (2.4)
Эти ферменты катализируют перенос остатка сахара на другой сахар и называются гликозилтрансферазами (трансгликозилазами); они образуют две группы: гексозилтрансферазы (2.4.1) и пентозилтрансферазы (2.4.2). Ферменты этих групп играют важную роль в биосинтезе олигосахаридов и полисахаридов. При биосинтезе гликогена действует УДФ-глюкоза: гликоген-глюкозилтрансфераза (УДФ-глюкоза: гликоген-α-4-глюкозилтрансфераза, 2.4.1.11), катализирующая превращение уридиндифюсфатглюкозы (УДФГ) в гликоген и уридиндифосфат (УДФ), активируется D-глюкозо-б-фосфатом и другими гексозофосфатами.
Уридиндифосфатглюкоза участвует в образовании дисахаридов в растениях. Уридинфосфаты – это коферменты трансгликозилаз. Синтез сахарозы катализирует УДФГ-фруктозаглюкозилтрансфераза (УДФ-глюкоза: D-фруктозо-2-глюкозилтрансфераза, 2.4.1.13).
При синтезе и расщеплении крахмала важную роль играют фосфорилазы, катализирующие обратимый распад веществ под действием фосфорной кислоты.
ФЕРМЕНТЫ, ПЕРЕНОСЯЩИЕ ГРУППЫ, СОДЕРЖАЩИЕ АЗОТ (2.6)
Аминотрансферазы (2.6.1) или трансаминазы катализируют перенос аминогруппы аминокислот на кетокислоты; α-аминокислота превращается в соответствующую α-кетокислоту.
Сравнительно хорошо изучены трансаминазы, катализирующие реакцию смесей, содержащих глютаминовую. кислоту. Аланин-аминотрансфераза (L-аланин: 2-кетоглутарат-аминотрансфераза,2.6.1.2) катализирует реакцию глютаминовой кислоты с пировиноградной кислотой.
ФЕРМЕНТЫ, ПЕРЕНОСЯЩИЕ ГРУППЫ, СОДЕРЖАЩИЕ ФОСФОР (2.7)
Перенос остатка фосфорной кислоты АТФ на определенные, специфические акцепторы катализируют фосфотрансферазы (2.7.1), ранее называвшиеся фосфокиназами.
Гексокиназа (АТФ: D-гексоза-б-фосфотрансфераза, 2.7.1.1) катализирует фосфорилирование гексоз с образованием соответствующих гексоза-6-фосфатов. Остальные известные ферменты этого типа субстратно специфичны, а именно глюкокиназа (АТФ: D-глюкоза-6-фосфотрансфераза, 2.7.1.2) по отношению к глюкозе; фруктокиназа (АТФ: D-фруктоза-6-фосфотрансфераза, 2.7.1.4) по отношению к фруктозе; маннокиназа (АТФ: D-манноза-6-фосфотрансфераза, 2.7.1.7) по отношению к маннозе и т. д. Для активирования этих ферментов необходимы ионы магния.
Фосфорилирование гексозофосфатов с образованием соответствующих гексозо-1,6-дифосфатов катализируют фосфофруктокиназа (АТФ: 0-фруктозо-6-фосфат-1-фосфотранcфераза, 2.7.1.11) и фосфоглюкокиназа (АТФ: Е)-глюкозо-1-фосфат-6-фосфотрансфераза, 2.7.1.10).
Аденозинкиназа (АТФ: аденозин-5'-фосфотрансфераза, 2.7.1.20) катализирует в основном перенос остатка фосфорной кислоты с одной молекулы АДФ на другую с образованием как АМФ, так и АТФ. Аналогично протекает также перенос остатка фосфорной кислоты от 1,3-дифосфоглицериновой кислоты.
Ферментами, катализирующими перенос фосфорной кислоты с определенного места одной молекулы вещества на другое место (реакции кажущегося внутримолекулярного переноса), являются фосфомутазы (2.7.5). Фосфюглюкомутаза (α-D-глюкозо-1,6-дифосфат: α-D-глюкозо-1-фосфат-фосфотрансфераза, 2.7.5.1) катализирует обратную изомеризацию глюкозо-1-фосфата в глюкозо-6-фосфат. Этот фермент абсолютно специфичен и активируется ионами магния и марганца. Коферментом является глюкозо-1,6-дифосфат. К этому же типу относится изомеризация 3-фосфоглицериновой кислоты в 2-фосфоглицериновую кислоту, катализируемая фосфоглицеромутазой (2,3-дифосфо-D-глицерат; 2-фосфо-D-глицерат-фосфотрансфераза, 2.7.5.3); в данном случае обязательным коферментом является 2,3-фосфоглицериновая кислота.
ГИДРОЛАЗЫ (3)
Гидролазы – это большая группа, ферментов, катализирующих гидролиз самых различных субстратов. К этой группе относится много ферментов, используемых в пищевой промышленности и в производстве дрожжей, например для гидролиза крахмала, сахарозы, жиров, белковых веществ, пектиновых веществ и т. д.
Гидролазы расщепляют при участии воды различные органические соединения на более простые вещества. Действие гидролаз аналогично действию трансфераз; разница только в том, что при действии гидролаз специфическим акцептором переносимого радикала является вода:
R – R' + HOH ⇄ R – ОН -+ R' – Н.
Таблица 2



В зависимости от типа гидролизуемых субстратов гидролазы подразделяются на эстеразы, гликозидазы, пептидгидролазы (протеазы), дезамидазы и пирофосфатазы.
ЭСТЕРАЗЫ (3.1)
Они катализируют обратимый гидролиз сложных эфиров органических кислот по схеме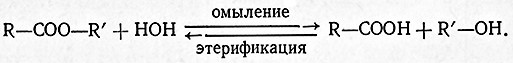
Эстеразы гидролизуют большое количество субстратов, поэтому их можно считать малоспецифичными.
К· этой группе гидролаз относятся гидролаза эфиров глицерина (липаза) (3.1.1.3) и фосфолипаза А (фосфатидацилгидролаза, 3.1.1.4).
Большое значение имеют фосфатазы, катализирующие отщепление фосфорной кислоты различных органических соединений, например нуклеотидов, фосфатидов, фосфорнокислых эфиров углеводов. В зависимости от механизма их действия различают фосфомоноэстеразы (гидролазы фосфомоноэфиров, 3.1.3) и фосфодиэстеразы (гидролазы фосфодиэфиров, 3.1.4); последние катализируют отщепление одного из двух фосфорных остатков диэфира.
Фосфатазы активируются двухвалентными ионами (главным образом ионами магния). У некоторых фоСфатаз оптимальная для их действия зона рН находится в щелочной области (при рН 7,0 – 9,5), у других же – в кислой области (при рН 4,5 – 6,0). В зависимости от этого различаются щелочные фосфатазы (3.1.3.1) и кислые фосфатазы (3.1.3.2).
ГЛИКОЗИДАЗЫ (3.2)
Группа гликозидаз включает гидролазы, играющие большую роль в пивоваренной промышленности.
α-Амилаза (α-1,4-глюкан-4-глюканогидролаза, 3.2.1.1) катализирует гидролиз крахмала (т. е. амилозы и амилопектина), гликогена и родственных полисахаридов, содержащих не менее трех глюкозных единиц, связанных расщепляемыми ими α-глюкозидными связями 1,4. Технологическое название фермента – декстринирующая (декстриногенная) амилаза; он расщепляет молекулы амилопектина на продукты, среди которых много различных декстринов, и действует как эндоамилаза.
β-Амилаза (α-1,4-глюкан-мальтогидролаза, 3.2.1.2) специфична по отношению к аналогичным субстратам, но она катализирует отщепление мальтозных единиц от свободных концов глюкозидных цепочек α-глюканов, а именно у амилопектина или гликогена, вплоть до α-глюкозидных связей 1,6, так что ядро молекулы остается нетронутым; не поддающиеся расщеплению остатки называются конечными декстринами. Технологическое название фермента – осахаривающая (сахарогенная) амилаза; в продуктах расщепления преобладает мальтоза; этот фермент действует как экзоамилаза.
Первоначально естественная смесь α-амилазы+ β-амилазы, встречающаяся в ячменном солоде, называлась диастазой.
Целлюлаза (β-1, 4-глюкан-4-глюкангидролаза, 3.2.1.4) катализирует аналогично расщепление β-глюкозидной связи. Так как она расщепляет главным образом каждую вторую глюкозидную связь, то основным продуктом гидролитического расщепления является целлобиоза.
Полигалактуроназа (полй-1,4-галактуронид-гликаногидролаза, 3.2.1.15) катализирует расщепление макромолекуЛярных полиуроновых кислот, например пектина.
α-Глюкозидаза (a-D-глюкозид-глюкогидролаза, 3.2.1.20), ранее называвшаяся мальтазой, катализирует расщепление мальтозы до глюкозы.
β-Глюкозидаза (β-D-глюκoзйд-rлюкoгидpoлаза, 3.2.1.21) катализирует расщепление β-глюкозидной связи дисахаридов, олигосахаридов и гетероглюкозидов.
β-Фруктофуранозидаза (β-D-фруктофуранозид-фруктогидролаза, 3.2.1.26), ранее называвшаяся сахаразой или инвертазой, катализирует гидролиз сахарозы на глюкозу и фруктозу.
β-Глюкуронидаза (β-D-глюкуронид-глюкуроногидролаза, 3.2.1.31) катализирует гидролиз глюкуронидов.
ПЕПТИД-ГИДРОЛАЗЫ (3.4)
Пептид-гидролазы или протеазы (протеолитические ферменты) катализируют расщепление белков вплоть до аминокислот. Это гидролазы, катализирующие гидролиз пептидных связей пептидов и белковых веществ с выделением карбоксильной и аминной группы:
H2N-R-CONH-R' + H2O → H2N-R-COOH + H2N-R'.
К пептид-гидролазам относятся ферменты, гидролизующие пептидные связи внутри молекулы белков, т. е. пептид-пептидогидролазы (3.4.4) или протеиназы или эндопептидазы, и ферменты, которые преимущественно атакуют пептидные связи и связи, соединяющие концевые остатки аминокислот с главной полипептидной связью.
Эндопептидазы катализируют расщепление пептидной связи внутри пептидной цепи, т. е. прежде всего длинные пептидные цепи и молекулы белков (отсюда и их прежнее название протеиназы).
Экзопептидазы отщепляют аминокислоты от концой пептидных цепочек, однако они не могут расщеплять пептидные связи в главной полипептидной цепи.
ДЕЗАМИДАЗЫ (3.5)
Дезамидазы образуют группу гидролаз, катализирующих гидролиз линейных или циклических амидов (аминогидролазы или амидазы), линейных и циклических амидинов (амидиназы) и некоторых других ферментов, расщепляющих различные связи С–N.
Аминогидролазы или амидазы катализируют гидролитическое расщепление непептидной связи между атомом углерода и атомом азота. При этих реакциях иногда выделяется аммиак. Из амидаз, гидролизирующих линейные амиды (3.5.1), самое большое значение имеют аспарагиназа (L-аспарагин-амидогидролаза, 3.5.1.1) и глютаминаза (L-глютамин-амидогидролаза, 3.5.1.2). При гидролизе этих веществ выделяется аммиак.
Уреаза (карбамид-амидогидролаза, 3.5.1.5) является первым ферментом, который удалось получить в кристаллическом виде (Самнер, 1926). Уреаза катализирует распад мочевины (диамида угольной кислоты или карбамида) на аммиак и угольную кислоту. Этот фермент узко специфичен и его активность определяют свободные сульфгидрильные группы.
К амидазам, действующим на циклические амиды (3.5.2), относится аллантоиназа (аллантоин-амидогидролаза, 3.5.2.5), катализирующая превращение аллантоина в аллантоиновую кислоту.
Важной линейной амидиназой (3.5.3) является аргиназа (L-аргинин-уреогидролаза, 3.5.3.1), действующая в так называемом орнитиновом цикле живых существ, являющемся одним из путей образования мочевины. Аргиназа катализирует гидролитическое разложение аргинина на орнитин и мочевину.
К циклическим амидиназам (3.5.4) относятся цитозиндезаминаза (цитозин-аминогидролаза, 3.5.4.1), адениндезаминаза (аденин-аминогидролаза, 3.5.4.2), аденозин-дезаминаза (аденозин-аминогидролаза, 3.5.4.4). Они катализируют гидролиз (дезаминирование) некоторых пиримидиновых или пуриновых оснований. Аналогично гидролизуются (дезаминируются) также соответствующие нуклеозиды, например под воздействием аденозин^ дезаминазы (аденозин-аминогидролазы, 3.5.4.4.) или же нуклеотиды, например АМФ-дезаминаза (АМФ-аминогидролаза, 3.5.4.6).
ПИРОФОСФАТАЗЫ (3.6)
Из ферментов, катализирующих расщепление ангидридной связи, наибольшее значение имеют гидролазы, расщепляющие ангидридные связи фосфорной кислоты.
К ним относится, например, неорганическая пирофосфатаза (пирофосфат-фосфогидролаза, 3.6.1.1), катализирующая гидролиз пирофосфорной кислоты, и аденозинтрифосфатаза или АТФ-аза (АТФ-фосфогидролаза, 3.6.1.3; миозин), которая высвобождает из молекулы АТФ концевой остаток фосфорной кислоты с образованием АДФ.
Перечень важнейших видов гидролаз приведен в табл.3.
Таблица 3



ЛИАЗЫ (4)
Лиазы катализируют непосредственное (негидролитическое) расщепление субстратов на несколько компонентов; при обратном ходе реакции вещество может образовываться из отдельных компонентов. В зависимости от расщепляемой или образующейся связи лиазы подразделяют на пять подклассов: С – С-лиазы (4.1), С – О-лиазы (4.2), С – N-лиазы (4.3), С – S-лиазы (4.4) и С – галоген-лиазы (4.5).
КАРБОКСИ-ЛИАЗЫ (4.1.1)
Карбокси-лиазы катализируют отщепление или фиксацию CO2 из молекулы аминокислот и оксикислот или же аминокислот: R–COOH ⇄ R – H + CO2 (прежние названия – карбоксилазы и декарбоксилазы).
Пируватдекарбоксилаза, или карбоксилаза (карбоксилиаза-2-оксокислоты, 4.1.1.1.) катализирует расщепление пировиноградной кислоты на ацетальдегид и CO2, являющееся важной реакцией при спиртовом брожении (анаэробном гликолизе). Равновесие реакции сильно сдвинуто в сторону декарбоксилирования. Коферментом этой декарбоксилазы является тиаминпирофосфат. Декарбоксилаза щевелевоуксусной кислоты (оксалоацетат-карбокси-лиаза, 4.1.1.3) катализирует декарбоксилирование щавелевоуксусной кислоты до пировиноградной кислоты или обратный процесс.
АЛЬДЕГИД-ЛИАЗЫ (4.1.2)
Наиболее известным ферментом этой группы является альдолаза (кетозо-1-фосфат-альдегид-лиаза, 4.1.2.7), катализирующая расщепление кетозо-1 -фосфата на диоксиацетонфосфат и соответствующий альдегид. Основной функцией этого фермента является обратимое расщепление фруктозо-1-6-дифосфата (эфир Гарден-Янга) на два триозофосфата.
ЛИАЗЫ КЕТОКИСЛОТ (4.1.3)
Эти лиазы действуют в цитратном цикле и сопутствующих процессах (глиоксалатный цикл).
Изоцитрат-лиаза (L-изоцитрат-глиоксилат-лиаза, 4.1.3.1) катализирует разложение изоцитрата на сукцинат и глиоксилат. Этой реакцией начинается глиоксилатный цикл. Затем его продолжает малат-синтаза (L-малатглиоксилат-лиаза, 4.1.3.2). Следующим ферментом этого подкласса является цитрат-оксалоацетат-лиаза, 4.1.3.7, прежнее название которого «цитрат-конденсирующий фермент».
ГИДРО-ЛИАЗЫ (4.2.1)
Эти ферменты катализируют отщепление или реакцию присоединения молекулы воды (прежнее их название дегидратазы и гидратазы). В данном случае протекает не гидролиз, так как субстрат не расщепляется на два компонента, как при реакциях, катализируемых гидролазами. Карбонат-дегидратаза, или угольная ангидраза (карбонат-гидро-лиаза, 4.2.1.1), катализирует расщепление угольной кислоты на воду и углекислоту. Это – металлов протеид, содержащий цинк.
В цитратном цикле действует фумаратгидратаза (Lмалат-гидро-лиаза, 4.2.1.2) и аконитатгидратаза (цитрат-(изоцитрат)-гидро-лиаза, 4.2.1.3) в гликолитическом процессе участвует енолаза (2-фосфо-D-глицерат-гидролиаза, 4.2.1.11), которая катализирует превращение 2фосфо-D-глицериновой кислоты в фосфоенолпировиноградную кислоту с отщеплением воды. При этой реакции образуются макроэргические фосфатные связи, энергия которых в дальнейшем используется для образования АТФ.
АММИАК-ЛИАЗЫ (4.3.1)
Наиболее известным из ферментов этого типа является аспартаза (L-аспартат-аммиак-лиаза, 4.3.1.1), катализирующая отщепление аммиака L-аспарагиновой кислоты с образованием фумаровой кислоты.
Перечень наиболее важных лиаз приведен в табл. 4.
Таблица 4

ИЗОМЕРАЗЫ (5)
Изомеразы катализируют обратимую изомеризацию субстратов; в организмах они поддерживают равновесие между двумя изомерами. При этом они образуют малочисленную группу, включающую четыре подкласса.
РАЦЕМАЗЫ И ЭПИМЕРАЗЫ (5.1)
Рацеvазы катализируют образований оптически активных метаболитов (оптических антиподов). Если они катализируют D-L-превращение (трансформацию) субстратов с большим числом асимметрических атомов углерода, их называют эпимеразами. Большинство из них содержат в качестве кофермента пиридоксальфосфат.
К рацемазам, действующим на аминокислоты и их производные, относятся, например аланинрацемаза (5.1.1.1.), метионинрацемаза (5.1.1.2) и глутаматрацемаза (5.1.1.3).
Примером рацемазы, действующей на оксикислоты, является лактатрацемаза (5.1.2.1), катализирующая превращение L-молочной кислоты в D-молочную кислоту.
К эпимеразам, действующим на углеводы, относится, например, рибулозофосфат-эпимераза (D-рибулозо-5-фосфат-3-эпимераза, 5.1.3.1), катализирующая взаимопревращение между D-рибулозо-5-фосфатом и D-ксилулозо-5-фосфатом, и УДФ-глюкозо-эпимераза (УДФ-глюкозо-4-эпимераза, 5.1.3.2), катализирующая превращение активированной глюкозы в галактозу путем эпимеризации до C4.
Особой эпимеразой является альдозо-мутаротаза (альдозо-1-эпимераза, 5.1.3.3), катализирующая мутаротацию D-глюкозы, D-галактозы, L-арабинозы, D-ксилозы, мальтозы и лактозы.
ЦИС-ТРАНС-ИЗОМЕРАЗЫ (5.2)
В этой группе изомераз имеется лишь несколько ферментов, например малеинат-цис-транс-изомераза (5.2.1.1), катализирующая взаимопревращение между фумаровой и малеиновой кислотами.
ВНУТРИМОЛЕКУЛЯРНЫЕ ОКСИДОРЕДУКТАЗЫ (5.3)
Основными в этой группе являются ферменты, катали' зирующие взаимопревращения альдоз и кетоз, называемые кетол-изомеразами. Из них наиболее распространены триозофосфат-изомераза (D-глицеральдегид-З-фосфаткетол-изомераза, 5.3.1.1), катализирующая взаимопревращение между D-глицеральдегид-З-фосфатом и диоксиацетонфосфатом. Кетол-изомеразой пентозного цикла является рибозофосфат-изомераза (D-рибозо-5-фосфат-кетол-изомераза, 5.3.1.6). Аналогичную реакцию катализирует глюкозо-фосфат-изомераза (D-глюкозо-6-фосфат-кетол-изомераза, 5.3.1.9), которая в комплексе гликолитических ферментов поддерживает равновесие между D-глюкозо-6-фосфатом (эфиром Робисона) и D-фруктозо-бфосфатом (эфиром Нейберга).
ВНУТРИМОЛЕКУЛЯРНЫЕ ТРАНСФЕРАЗЫ, ИЛИ МУТАЗЫ (5.4)
Эти ферменты катализируют образование изомеров путем переноса некоторых функциональных групп с одного места молекулы субстрата на другое. Наиболее важным является фосфоглицерат-фосфомутаза (D-фосфоглицерат-2,3-фосфомутаза, 5.4.2.1), которая при гликолизе обратимо переводит З-фосфо-D-глицериновую кислоту в 2фосфо-D-глицериновую.
Перечень наиболее важных изомераз приведен в табл.5.
Таблица 5

ЛИГАЗЫ (6)
Лигазы (синтетазы) катализируют синтез новых продуктов с образованием связи атома углерода с другими атомами – кислородом, серой, азотом или углеродом при одновременном разрыве макроэргической связи АТФ или другого нуклеозидфосфата.
Лигазы, образующие связи С–О (6.1), являются наиболее важными лигазами, катализирующими взаимодействие аминокислот с соответствующей транспортной рибонуклеиновой кислотой S-PHK (6.1.1). Перенос аминокислоты в данном случае очень специфичен. К этой группе лигаз относится, например, L-тирозин: s-PHK-лигаза (АМФ), 6.1.1.1, катализирующая реакции указанной аминокислоты с АТФ в присутствии растворимой s-PHK, затем L-триптофан: s-PHK-лигаза (АМФ), 6.1.1.2 и L-аланин: s-PHK-лигаза (АМФ) (6.1.1.7). Эти лигазы участвуют в синтезе белковых веществ.
Лигазы, образующие связи С–S (6.2), чаще всего катализируют синтез ацил-кофермента А из соответствующих кислот при участии АТФ и кофермента А. Это, например, ацил-КоА-синтетаза [кислота: КоА-лигаза (АМФ), 6.2.1.2].
Лигазы, образующие связи С–N (6.3), играют важную роль в превращении азотистых веществ и включают в себя амиди пептидсинтетазы. К амид-синтетазам относятся аспарагин-синтетаза [L-аспартат: аммиак-лигаза (АМФ), 6.3.1.1] и глютамин-синтетаза [L-глютамат: аммиак-лигаза (АДФ), 6.3.1.2].
К группе С–N лигаз относятся также пептид-синтетазы, катализирующие образование пептидной связи некоторых олигопептидов. Например, L-глютамат; L-цистеин- γ-лигаза (АДФ), 6.3.2.2 и γ-L-глютамил-Ь-цистеин: глицин-лигаза (АДФ), 6.3.2.3 участвуют в биогенезе глютатиона.
Лигазы, образующие связи С–С, катализируют реакции ряда веществ^ главным образом кетокислот и ацилкоферментов, с углекислотой, причем в результате реакции образуется новая карбоксильная группа. В этом случае коферментом является биотин, при участии которого образуется, например, оксалоацетат, играющий важную роль в цитратном цикле. Реакцию катализирует пируваткарбоксилаза [пируват: СO2-лигаза (АДФ), 6.4.1.1]. Большое значение имеет также возникновение малонилкофермента А – источника углерода при биосинтезе жирных кислот. Специфическим ферментом здесь является ацетил-KoA: СO2-лигаза (АДФ), 6.4.1.2. Перечень наиболее важных лигаз приведен в табл. 6.
Таблица 6


