У большинства растенйй запасным веществом является крахмал, а в животных и в дрожжевых клетках из части получаемого сахара образуется гликоген. Первоначально предполагали, что биосинтез и расщепление крахмала и гликогена катализируют глюкозидазы (амилазы), но позже (1936) Парнас и Барановский установили, что в синтезе Сахаров участвует фермент, катализирующий специфический перенос глюкозных остатков от глюкозо-1-фосфата на цепь, содержащую большее количество 1,4-глюкозидных связей.
Трансгликозилазы имеют большое физиологическое значение. Они содержат ферменты, катализирующие синтез запасных полисахаридов, синтез различных олигосахаридов и полисахаридов при участии гликозидов уридиндифосфата (УДФ) в качестве донора гликозильных остатков. Реакции, катализируемые трансгликозилазами, сопровождаются небольшими изменениями термодинамического потенциала; поэтому они обратимы. Их равновесие сильно сдвинуто в сторону расщепления. Это позволяет организму расщеплять и синтезировать запасные вещества быстро и при минимальных затратах свободной энергии.
ФОСФОРИЛИРОВАНИЕ В МЕТАБОЛИЗМЕ САХАРОВ
Энергию для физиологической деятельности и биологического синтеза живые организмы получают от расщепления Сахаров. Следовательно, сахара играют большую роль в обмене веществ (метаболизме) и они содержатся хотя и в небольшом количестве, в каждой клетке. В обмене веществ сахара всегда участвуют в виде фосфорных сложных эфиров.
Фосфорилирование гексоз катализируют фосфотрансферазы (2.7.1) в присутствии аденозинтрифосфорной (АТФ) кислоты, содержащей макроэргические. связи, и ионов Mg2+. При этих реакциях фосфорилирования фосфорная кислота чаще всего присоединяется к гидроксильной группе у шестого атома углерода и образует гексозо-6-фосфаты.
Это фосфорилирование катализирует гексокиназа (АТФ: D-гексоза-б-фосфотрансфераза, 2.7.1.1). Кроме нее были обнаружены ферменты такого же типа, субстратно специфичные по отношению к глюкозе, фруктозе, маннозе, т. е. глюкокиназа (АТФ: D-глюкозо-б-фосфотрансфераза, 2.7.1.2), фруктокиназа (АТФ: D-фруктозо-6-фосфотрансфераза, 2.7.1.4) и маннокйназа (АТФ: D-маннозо-6-фосфотрансфераза, 2.7.1.7).
Таким образом, из глюкозы возникает глюкозо-6-фосфат (сложный эфир Робисона), из фруктозы – фруктозо-6-фосфат (сложный эфир Нейберга), а из маннозы – маннозо-6-фосфат. Дрожжи, сбраживающие галактозу, содержат галактокиназу (АТФ: D-галактозо-1-фосфотрансферазу, 2.7.1.6), которая, однако, фосфорилирует галактозу в галактозо-1-фосфат.
Фосфорные сложные эфиры подвергаются β живых системах изомеризации, катализируемой специфическими изомеразами. В микроорганизмах и растительных тканях содержится глюкозофосфат-изомераза (D-глюкозо-б-фосфат-кетол-изомераза, 5.3.1.9), которая устанавливает равновесие между сложными эфирами Робисона и Нейберга, причем в смеси содержится 70% глюкозо6-фосфата и 30% фруктозо-6-фосфата. Из маннозо-6-фосфата под действием маннозофосфат-изомеразы (D-маннозо-6-фосфат-кетол-изомеразы, 5.3.1.8) образуется фруктозо-фосфат. Галактозо-1-фосфат под действием УДФ глюкозо-эпимеразы (УДФ глюкозо-4-эпимеразы, 5.1.3.2) переходит в глюкозо-1 -фосфат; коферментом при Этой изомеризации является уридинофосфат (УДФ).
Таким образом, из всех указанных гексоз образуются фосфорные сложные эфиры глюкозы или фруктозы, которые занимают центральное место в метаболизме Сахаров. В результате каталитического воздействия глюкозофосфатизомеразы (фосфоглюкомутазы) устанавливается равновесие между глюкозо-6-фосфатом (сложным эфиром Робисона) и глюкозо-1-фосфатом (сложным эфиром Кори), при котором смесь содержит приблизительно 94% глюкозо-6фосфата и 5% глюкозо-1-фосфата.
Схема взаимного превращения гексоз (по Кори) приведена ниже.

При биологическом синтезе и расщеплении полисахаридов (например, крахмала в растениях) важным промежуточным продуктом является глюкозо-1-фосфат (сложный эфир Кори). Образование полисахаридов из этого сложного эфира является обратимой реакцией. Ее катализирует система ферментов, причем в качестве кофермента участвует адениловая кислота. Разветвление глюкозных цепочек в образующемся полисахариде определяет соотношение участвующих в этом процессе ферментов.
Окисление глюкозо-6-фосфата (сложный эфир Робисона) приводит к образованию 6-фосфоглюконовой кислоты и последующему декарбоксилированию фосфорных сложных эфиров пентоз (см. схему пентозофосфатного цикла на рис. 15).
Олигосахариды участвуют в процессах метаболизма, как правило, лишь после расщепления их на моносахариды. В живых системах олигосахариды образуются либо в результате ферментативного расщепления полисахаридов, либо из фосфорных сложных эфиров моносахаридов в результате процессов фосфорилирования. В образовании некоторых олигосахаридов участвуют также трансглюкозидазы. Наряду с различными олигосахаридами под действием трансглюкозилаз образуются и некоторые сахаристые компоненты гетероглюкозидов.
ВЗАИМОСВЯЗЬ ПРОЦЕССОВ ФОСФОРИЛИРОВАНИЯ
С АЭРОБНЫМИ И АНАЭРОБНЫМИ ПРОЦЕССАМИ
Энергию, высвобождаемую в результате процессов окисления-восстановления, живые организмы могут использовать только после превращения ее в химическую энергию. В обмене веществ лучше всего используется химическая энергия, содержащаяся в макроэргической фосфатной связи(~Р) (от 41,9 • 103 до 67,04 • 103 Дж в зависимости от рода этой связи). В результате гидролиза одной, макроэргической фосфатной связи аденозинтрифосфорной кислоты (АТФ) выделяется свободная энергия ΔF0= – 39,39 • 103 Дж/моль при ρ H 7,5; при концентрациях, обычных для дрожжей, это соответствует приблизительно AF = –54,47 • 103-=-58,66 • 103 Дж/моль.
Макроэргическая фосфатная связь возникает только при процессах, сопровождаемых изменением свободной энергии более чем на 41,9 • 103 Дж. В известных до сих пор механизмах превращения химической энергии субстрата в энергию макроэргической связи аденозинтрифосфорной кислоты (АДФ) происходят не непрерывно, а скачками, соответствующими каждый примерно 41,9 • 103 Дж. Если экзэртонические реакции не сопряжены с фосфорилированием, то энергия выделяется в виде теплоты.
Макроэргические фосфатные связи возникают в результате окислительно-восстановительных аэробных и анаэробных процессов. Связь процессов окисления и фосфолирования первым установил Энгельгардт (1932), затем наличие окислительного (аэробного) фосфорилирования доказали Белицер и Цибакова. В настоящее время известны лишь немногие механизмы возникновения макроэргических связей. В анаэробных процессах макроэрги-веская связь BoaHHkaet в результате непосредственной реакции субстрата, тогда как в аэробных процессах эта связь возникает при переносе электронов окислительной цепочкой.
Взаимосвязь процессов окисления и фосфорилирования имеет значение для регулирования интенсивности обмена веществ у живых организмов. Механизм возникновения макроэргических связей при переносе электронов в окислительных системах предложил Слатер. По Слатеру, в реакции между двумя соседними членами окислительной цепочки AH2 и В участвует еще и другое вещество или активная группа С. В результате окисления и восстановления возникает макроэргическая связь:
AH2 + В + С → AC + BH2 (1)
Эта связь в результате фосфоролитической реа'кции может быть заменена на макроэргическую связь· в АТФ:
AC + АДФ + H3PO4 → А + С + АТФ (2)
или же в результате гидролиза она может необратимо расщепляться
AC + H2O → А + С. (3)
В обоих случаях, следовательно, реакциями комплекса AC регенерируются вещества А и С.
Однако если реакция (2) тормозится в результате недостатка фосфата или избытка АТФ, то вещества А и С не регенерируются; этим затормаживается основное звено процесса окисления (1). Отсюда следует, что концентрация неорганического фосфата в клетке является чувствительным регулятором интенсивности окислительных процесс сов.
ФЕРМЕНТЫ И ПУТИ МЕТАБОЛИЗМА
МЕТАБОЛИЗМ
В живой клетке непрерывно протекают многочисленные взаимосвязанные химические реакции, общее название которых – обмен веществ (метаболизм), включающий:
анаболизм (ассимиляцию), характеризующийся синтетическими реакциями, при которых расходуется энергия; ими восполняются потери веществ в результате потребления и расщепления и они служат дЛй обрй' зования новых веществ, необходимых для роста и размножения;
катаболизм (диссимиляция), т. е. совокупность реакций разложения, при которых выделяется энергия, необходимая для ассимиляции.
В обмене веществ живых клеток важную роль играют прежде всего сахара, расщепление которых дает необходимое количество энергии для физиологических процессов и для биологического синтеза многих веществ. Расщепление Сахаров, или гликолиз, является одним из основных процессов обмена веществ. Если расщепление происходит при непосредственном участии кислорода воздуха, т.е. в аэробных условиях в виде аэробного обмена веществ, то такой процесс обычно называется дыханием. В анаэробных условиях протекает брожение как анаэробный обмен веществ.
Дыхание и брожение, т. е. аэробные и анаэробные процессы, являются ферментативными процессами, сложный механизм которых на начальных стадиях аналогичен. Эти процессы протекают через ряд промежуточных ступеней, а на определенной стадии эти процессы идут различным путем до образования конечных продуктов – углекислоты и воды при дыхании, углекислоты и этилового спирта при спиртовом брожении, молочной кислоты при молочнокислом брожении и т. п. Сахара участвуют в реакциях в живой клетке всегда в виде фосфорных сложных эфиров.
БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ И ЕГО ФЕРМЕНТЫ
В живых клетках и организмах ряд реакций протекает с затратой энергии, которая восполняется в результате реакций, поставляющих эту энергию. К этим реакциям относятся прежде всего реакция окисления, а у высших организмов – окисление Сахаров и жиров до углекислоты и воды, т. е. дыхание.
По современным представлениям биологические окисления представляют, собой реакции переноса водорода или же электронов системой носителей на кислород. Носитель (Т) может реагировать с двумя различными окислительно-восстановительными системами (А) и (В). Окисленная форма T-TOK быстро окисляет восстановленную форму
A-AВОС, тогда как восстановленную форму T-TВОС быстро окисляет окисленная форма B-BОК:
АBОСT + ТОК ⇄ АOK + TВОС;
ТBОСT + ВОК ⇄ ТOK + ВВОС.
Таким образом, речь идет о переносе водорода или электронов от АBОС на ВОК.
Механизм переноса водорода (электронов) различен в зависимости от характера субстрата. При окислении отщепленного водорода выделяется энергия, которую живая клетка использует для образования макроэргических связей фосфорной кислоты. Этот процесс называется окислительным фосфорилированием.
При окислении субстрата в аэробных условиях живой организм получает намного больше энергии, чем в результате анаэробных процессов.
В производстве солода большое технологическое значение имеет процесс дыхания ячменя, перерабатываемого в солод. Для прорастания ячменя используется энергия определенной части запасных веществ, главным образом Сахаров, образующихся в результате расщепления крахмала, и небольшого количества жиров и белков. Затраты крахмала ячменя, являющегося пивоваренным сырьем, по экономическим соображениям необходимо ограничивать до минимума. Пивные дрожжи также дышат, хотя спиртовое брожение является анаэробным процессом. Аэрация сусла перед задачей дрожжей способствует процессу размножения дрожжевых клеток.
Ферментативные реакции метаболизма тканей животного и растительного происхождения принципиально не отличаются друг от друга.
Молекулярный кислород не способен окислять питательные вещества при низких температурах. Живые же клетки, наоборот, способны каталитически окислять белки, аминокислоты, жиры и сахара.
Изучением этого важного процесса занимались многие исследователи.
Бах (1897) высказал предположение, что в результате действия кислорода образуется перекись субстрата, которая окисляет его следующие молекулы (перекисная гипотеза).
С. Виланд (1912) выдвинул гипотезу об активном водороде. Согласно этой гипотезе субстрат содержит атомы водорода, которые в присутствии подходящей дегидрогеназы активируются и удаляются из субстрата. В результате этого дегидрирования субстрат как донор водорода окисляется, т. е. переходит в энергетически более бедную форму. В таких случаях водород передается с одной дегидрогеназы на другую. При окислениях в естественной среде высвобождаемый водород реагирует с кислородом с образованием воды. Иногда временно образуется перекись водорода, которая под действием каталазы разлагается на воду и кислород.
По Виланду, основным актом при биологических окислениях является мобилизация водорода. Дальнейшую роль водорода он считает второстепенной. В зависимости от обстоятельств водород присоединяется либо к подходящему акцептору (метиленовой сини, хинону и т. п.), либо к молекулярному кислороду и этим реакция заканчивается.
По Варбургу (1917), при биологических окислениях происходит активирование кислорода. При этом в качестве катализаторов действуют тяжелые металлы, прежде всего железо, содержащееся в так называемом дыхательном ферменте. В начале реакции соединение закисного железа окисляется до соединения окисного железа молекулярным кислородом. Эта окись окисляет органическое вещество и возвращается в цикл в виде закиси железа.

Из опубликованных позже работ Кейлина вытекало, что дыхательный фермент Варбурга, который удалось обнаружить почти во всех клетках, тождествен цитохромоксидазе, имеющей большое значение для активирования цитохрома с, содержащего также атом железа. Таким образом, молекулярный кислород активируется, причем двухвалентное железо окисляется до трехвалентного. При передаче активированного кислорода на субстрат или на другой фермент этот восстановленный фермент способен принять еще атом кислорода. Дыхательный фермент по этой гипотезе перемещается между восстановленной и окисленной формой.
В настоящее время окислительно-восстановительные процессы объясняют с точки зрения электронной теории.
Ё общей форме окисление – это Отнятие электроной, от соответствующего донора. Главный донор – это элементарный водород, однако такими донорами являются и соединения с первичной или вторичной спиртовой группой, с альдегидной группой и карбоновые кислоты с кетонной группой.
Иногда окисление определяют и как отнятие водорода. Однако в сущности речь идет о потере электронов в соответствующих атомах водорода; электроны отнимаются совместно с протонами. При присоединении атома кислорода к субстрату, т. е. при оксигенизации, речь идет также об отнятии электронов (водорода) от их субстрата, возникшего в результате присоединения воды, например:
![]()
При аэробных процессах конечным акцептором электронов является кислород, который с энергетической точки зрения не имеет значения для организма, но который позволяет интенсивно использовать энергию расщепленных химических связей без потерь субстрата. Это – экзоргонический процесс.
2Н+ + 1/2O2 + 2е– ⇄ H2O (∆G' = – 238,8•103 Дж).
Биологическое окисление можно представить в виде следующей простой схемы:
![]()
Однако в действительности перенос водорода на кислород осуществляется рядом сложных цепных реакций, катализируемых окислительно-восстановительными ферментами. Энергия запасается в виде АТФ и выделяется постепенно. Дегидрированный исходный субстрат подвергается последующим ферментативным реакциям (гидратированию, декарбоксилированию или же другим дегидрированиям) и таким образом может быть постепенно разложен, например до CO2 в качестве конечного продукта.
Биологические окисления субстратов (питательных веществ) тесно связаны в живых клетках с превращением энергии и они локализованы ё определенных, функционально специфических структурах клеток, содержащих многоферментные системы.
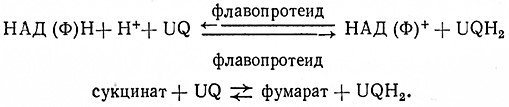
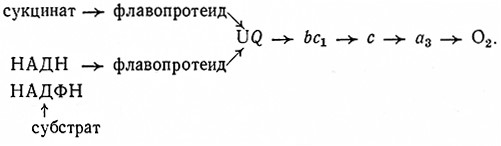
При биологических окислениях перенос электронов водорода происходит ступенчато и катализируют его оксидоредуктазы из группы пиридиновых, флавиновых и геминовых ферментов. Донором электронов (водорода) являются восстановленные пиридиновые коферменты (НАДН, НАДФН), возникающие под действием дегидрогеназ, и янтарная кислота, которая дегидрогенизируется в цитратном цикле. При участии флавиновых коферментов водород от пиридиновых коферментов и янтарной кислоты переносится сначала на кофермент Q (убихинон UQ). В этом процессе участвуют ферменты НАД ФН2: убихиноноксидоредуктаза, 1.6.5.3, и сукцинат: (акцептор) – оксидоредуктаза, 1.3.99.1 (дегидрогеназа янтарной кислоты).
Затем восстановленный убихинон UQH2 дегидрируется (реокисляется) при участии цитохромного комплекса Ьс1; при этом протоны и электроны переносятся на цитохром с:
![]()
Эту реакцию катализирует убихинон: цитохром с-оксидоредуктаза.
На последней стадии восстановленный цитохром с снова окисляется кислородом с участием цитохромоксидазы (цитохром с: О2-оксидоредуктаза 1.9.3.1):
На отдельных фазах этого переноса в дыхательной цепочке постепенно выделяется энергия, которая накапли-
BiaeTCH в виде макроэргических связей аденозинтрифосфориой кислоты (АТФ). Образование АТФ, связанное с окислением янтарной кислоты или восстановленных пиридиновых коферментов, называется окислительным фосфорилированием. В отношении НАДН или НАДФН это окисление можно выразить суммарной зависимостью
НАД (Φ) H + H+ +1/2 O2 + ЗАДФ + ЗН3РO4 = НАД (Ф)+ + ЗАТФ + 4Н2O,
в отношении сукцината:
сукцинат + 1/2 O2 + АДФ + ЗН3РO4 = фумарат + 2 ATΦ + ЗН2O.
Выход АТФ выражается отношением Р/0, т. е. числом молей фосфорной кислоты, используемых одним атомом О. Для окисления НАДФ или НАДФН Р/0 Щ 3, для окисления сукцината Р/0 = 2, для окисления ферроцитохрома Р/0 = 1.
Суммарное изменение свободной энергии (ΔG') при реокислении НАДН равно 219,6 • 103 Дж.
НАДН + H+ + 1/2 O2 НАД+ + H2O.
ПИРИДИННУКЛЕОТИДНЫЕ ДЕГИДРОГЕНАЗЫ
Пиридиновые протеиды являются оксидоредуктазами, катализирующими анаэробное дегидрирование специфических субстратов. Их коферментами являются никотина-мидадениндинуклеотид (НАД+, прежнее название ДФН+) и никотинамидадениндинуклеотидфосфат (НАДФ+, прежнее название ТФН+); соответствующими восстановленными формами являются НАДН и НАДФН. Их структурные формулы таковы:
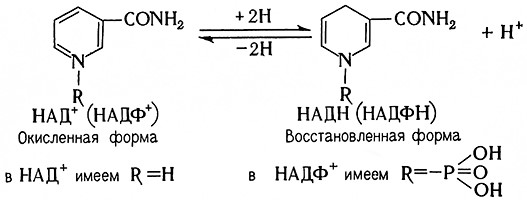
Оба кофермента являются естественными акцепторами водорода для большого числа субстратов, содержащихся в клетках, тканях и в промежуточных продуктах их метаболизма. Пиридиновое ядро восстанавливается при этом по схеме
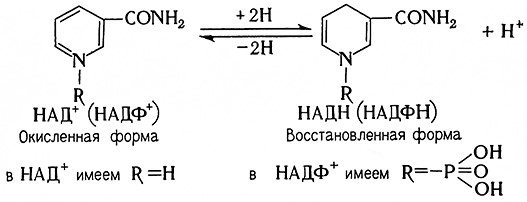
Пиридиновые ферменты обычно катализируют дегидрирование – начальную стадию аэробного расщепления субстратов. Их коферменты при этом восстанавливаются, но повторное окисление их восстановленной формы кислородом невозможно. Водород (электроны) переносится не непосредственно на молекулярный кислород, а на другие системы катализаторов (флавиновые ферменты).
Пиридиновые ферменты действуют не только в аэробных, но также и анаэробных процессах (гликолиз и брожение). В этих случаях образуется НАДН при дегидрировании глицеральдегид-3-фосфат, т. е. водород субстрата переводится на НАД+дегидрогеназой триозофосфата. При гликолизе дегидрогеназа молочной кислоты переносит водород от НАДН на пировиноградную кислоту и при этомв качестве конечного продукта гликолиза образуется молочная кислота. При спиртовом брожении пировиноградная кислота расщепляется карбоксилазой до ацетальдегида и углекислоты; водород из НАДН переносится алкогольдегидрогеназой на адетальдегид, в результате чего образуется этанол.
Действие пиридиновых коферментов объясняется легкой диссоциируемостью комплекса фермент – кофермент. НАД+ образует комплекс с ферментом белка дегидрогеназы триозофосфата, в котором он восстанавливается до НАДН. Затем НАД диссоциирует, присоединяется к белку другого фермента и отдает водород поддающемуся восстановлению субстрату. Поэтому коферменты этих ферментов считаются подвижными переносчиками водорода. Однако это определение не совсем правильно, так как доказано, что, например, кристаллическая дегидрогеназа триозофосфата содержит прочно связанный НАД+, который невозможно отделить диализом.
Пиридиновые ферменты специфичны по отношению к определенному субстрату, поэтому имеется много пиридиновых дегидрогеназ, отличающихся друг от друга только апоферментом. Менее специфичны ферменты по отношению к коферменту. Некоторые ферменты реагируют только с одним коферментом, другие – с двумя, но скорость реакции при этом различна.
Различается специфичность по отношению к донору (субстрату) и к акцептору (коферменту или косубстрату).
Пиридиновые дегидрогеназы активируют водород (электроны) субстрата и переносят его на пиридиновое ядро кофермента. Реакция протекает по следующей схеме:
2Н + НАД+ (или НАДФ+) ⇄ НАДН (или НАДФН) + H+.
Перенос водорода с донора на субстрат обеспечивается коферментами через два белковых носителя (апофермента). На одном субстрат дегидрируется, а кофермент восстанавливается, на другом же восстанавливается акцептор и реокисляется кофермент.
Пиридиновые коферменты (НАД+, НАДФ+) имеют небольшое сродство с белковым носителем, в большинстве случаев их можно отделить уже диализом.
Водород может переноситься также между обеими типами пиридиновых нуклеотидов, например:
НАДФН + НАД+ → НАДФ+ + НАДФ.
Это позволяет осуществить перенос водорода с донора на акцепторы, если соответствующие ферменты не имеют таких же пиридиновых коферментов.
ПиридиннуКлеотидные дегидрогеназы действуют в биологических системах как анаэробные трансгидрогеназы, которые катализируют окисление подходящих субстратов (доноров водорода) дегидрированием. Отщепленный атом водорода переносится тогда на другие акцепторы, например на промежуточные метаболиты. Как и анаэробные трансгидрогеназы, пиридиннуклеотидные дегидрогеназы переносят отщепленный атом водорода не непосредственно на кислород. В аэробных метаболических процессах они обычно передают водород флавиновым ферментам.
Пиридиннуклеотидные дегидрогеназы играют важную роль в конечных окислительных циклах, например в цитратном цикле.
Активность дегидрогеназ можно определить в лаборатории реакцией с метиленовой синью. Водород из дегидрированного (т. е. окисленного) субстрата переносится дегидрогеназой на краситель, который восстанавливается им в бесцветное лейкосоединение. Субстрат является донором водорода, а краситель – его акцептором. По Тюнбергу и Олгрину, время, необходимое для обесцвечивания определенного количества метиленовой сини, является критерием активности дегидрогеназ.
Финк, Хен и Ценгер изучали указанным методом дыхание ячменя при проращивании. Незначительное количество дегидрогеназы, содержащееся в ячмене, существенно повысилось при проращивании. У темного солода максимальная активность дегидрогеназы была обнаружена во второй половине стадии прорастания, а у светлого солода максимальная активность дегидрогеназы достигалась гораздо позже лишь во время сушки на верхней решетке.
Зародыш и стрелка -содержат больше дегидрогеназ, так как эти части зерна растут быстрее; процесс дыхания в них более интенсивен.
ФЛАВИННУКЛЕОТИДНЫЕ ФЕРМЕНТЫ
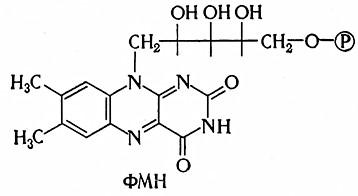
Флавиннуклеотидные, или желтые, ферменты являются флавопротендамн. Это нетипичные нуклеотиды, так как у них с изоалоксазиновым ядром гликозидно связана не пентоза, а спиртовой сахар рибит. Эти ферменты образуют важную группу оксидоредуктаз, которые в живых системах переносят водород (электроны) от пиридиновых ферментов на систему цитохромов, по-видимому, через хиноновые структуры. Они были открыты Варбургом и Кистеном в 1932 г.
Коферментами флавиновых ферментов являются нуклеотиды рибофлавина, из которых известны флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). Их структурные формулы приведены на стр. 103 и 104.
Связь флавиновых коферментов с апоферментом сравнительно прочна и в отличие от пиридиновых ферментов отделить кофермент можно лишь более эффективным воздействием, чем, например, диализом.
Отдельные желтые ферменты значительно различаются друг от друга по типу субстрата и по акцептору. Их можно классифицировать по простетическиМ группам на ферменты с ФМН и ФАД, по их специфичности по отношению к субстратам – на ферменты, дегидрирующие НАД или HАДФ, и ферменты, дегидрирующие прочие субстраты.
В последние годы было установлено, что ряд флавопротеидов содержит в качестве еще одного необходимого компонента тяжелый металл (железо, медь, молибден).
Флавопротеиды катализируют дегидрирование, своего субстрата по уравнениям:
ФМН + 2Н ⇄ ФМНН2;
Φ АД + 2Н ⇄ ΦАДН2,
При этом желтый фермент восстанавливается до бесцветного лейкосоединения, которое может реокисляться кислородом воздуха с образованием перекиси водорода:
ФМНН2 + O2 ⇄ ФМН + H2O2;
ФАДН2 + O2 ⇄ ФАД + H2O2
Таким образом, в результате этих реакций в организме образуется перекись водорода. Флавиннуклеотидные ферменты действуют, следовательно, в отличие от пиридиновых ферментов, как аэробные трансгидрогеназы (оксидазы). Для устранения токсического действия H2O2 аэробные организмы имеют другие ферменты, катализирующие ее распад. Если в организме не происходит распада H2O2, образующейся при окислении флавиновых лейкосоединений кислородом воздуха, то флавиновые ферменты и кислород действуют как токсические вещества (например, у облигатных анаэробов). В связи с этим, например, желтый фермент глюкозооксидаза (β-D-глюкоза: O2 оксидоредуктаза, 1.1.3.4), которая бактерицидна для анаэробов, раньше ошибочно считалась антибиотиком и называлась нотатином.
Глюкозооксидаза используется в пищевой технологии для удаления небольших количеств глюкозы там, где при дальнейшей переработке пищевой продукт приобретал бы бурую окраску вследствие взаимодействия глюкозы с аминокислотами (реакция Майара) или для удаления остаточных количеств кислорода из укупоренных консервов.
Из флавиннуклеотидных ферментов в организмах обычно содержатся оксидазы аминокислот, а именно: оксидаза L-аминокислот (L-аминокислота: О2-оксидоредуктаза, 1.4.3.2) и оксидаза D-аминокислот (D-аминокислота: О2-оксидоредуктаза, 1.4.3.3).
Оксидазы аминокислот катализируют реакции, при которых аминокислота сначала дегидрируется до иминокислоты в присутствии O2 (в качестве акцептора водорода), который восстанавливается до перекиси водорода. Образо-i вавшаяся аминокислота, соединяясь с водой, спонтанно переходит в а-кетокислоту.
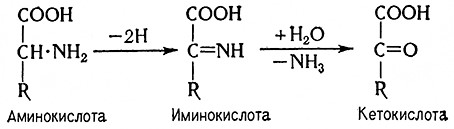
Аналогично этому дезаминирование многих аминов – первичных, вторичных и третичных – катализируют моноаминоксидаза или тираминаза (моноамин: О2-оксидоредуктаза, 1,4.3.4) и диаминоксидаза или гистаминаза (диамин: О2-оксидоредуктаза, 1.4.3.6). Расщепление пуриновых оснований нуклеиновых кислот катализирует ксантиноксидаза (ксантин: О2-оксидоредуктаза, 1.2.3.2), раньше называвшаяся ферментом Шардингера. Это – флавопротеид, содержащий молибден (молибдопротеид). Он катализирует окисление лизоксантина до ксантина и окисление ксантина до мочевой кислоты.
Важным ферментом для получения энергии в так называемом цитратном цикле является сукцинатдегидрогеназа, или дегидрогеназа янтарной кислоты (сукцинат: (акцептор)-оксидоредуктаза, 1.3.99.1). Это – флавопротеид с комплексно связанным Fe. Он катализирует гидрогенизацию янтарной кислоты до фумаровой:
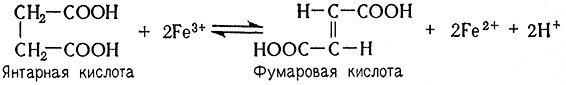
Следующей группой флавиннуклеотидных ферментов являются анаэробные трансгидрогеназы, переносящие водород (электроны) на цитохромную систему или же на другие промежуточные метаболиты, т. е. обеспечивающие в процессах дыхания постепенный перенос водорода (электронов), отщепленного дегидрированием субстратов, на конечный акцептор, т. е. кислород воздуха. Ферменты этой группы переносят водород (электроны) пиридиннуклеотидных ферментов на атом Fe, комплексно связанный в молекуле цитохрома (гем). К ним относятся цитохром с-редуктазы (НАДН2; цитохром с-оксидоредуктаза, 1.6.2.1, и НАДФН2: цитохром с-оксидоредуктаза, 1.6.2.3).

Таким образом, цитохром-с-редуктаза является важным соединительным звеном между пиридиннуклеотидными и геминовыми ферментами.
Однако в настоящее время большинство исследователей предполагают, что электроны из флавопротеидов переносятся на цитохромную систему не непосредственно, а. через хиноновые структуры. Важную роль здесь играют так называемые убихйноны (коферменты Q). Производные n-бензохинона имеют некоторое сходство с группой витамина К· Убихиноны различаются по числу изопреновых единиц, связанных с боковыми цепями молекулы. Убихиноны животных тканей и тканей высших растений имеют 10 таких единиц, низшие организмы – от 6 до 10. Так, например, обозначение кофермента Q10 означает убихинон с десятью изопреновыми единицами в боковой цепи. Они содержатся почти всегда в митохондриях.
Убихиноны действуют, по существу, как окислительно-восстановительные системы, образуемые окисленной формой, т. е. хиноном, и восстановленной формой, т. е. гидрохиноном
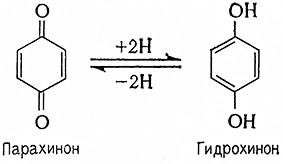
Соответствующий фермент, катализирующий восстановление кофермента Q, имеет название НАД (Ф)Н2: убихинон-оксидоредуктаза (1.6.5.3).
Восстановление цитохрома с происходит только на следующей стадии при участии цитохромного фермента, содержащего цитохромный комплекс bc1.
Эйлер и Даль изучали процесс накопления флавопротеида при прорастании злаков. Они установили, "что после пяти дней прорастания ячмень содержит в 3–7 раз больше, суммарного флавопротеида, чем овес. Синтез флавопротеида в ячмене полностью заканчивается уже на второй день прорастания, тогда как в овсе он еще продолжается. Соотношение связанного (не поддающегося диализу) флавопротеида и суммарного протеида сохраняется в течение всего прорастания неизменным на уровне 2:3.
ФЕРМЕНТЫ, СОДЕРЖАЩИЕ СВЯЗАННЫЕ МЕТАЛЛЫ
Среди ферментов, деятельность которых обусловливает связанный металл, чаще всего железо, медь и цинк, наибольшее значение имеют ферменты, содержащие железо, связанное внутри порфиринового или же другого тетрапиррольного ядра хелатной связью. Ферменты этого типа называются геминовыми, они переносят электроны в окислительных метаболических процессах; таким образом, это цитохромные ферменты, разлагающие перекись водорода, т. е. пероксидазы.
ЦИТОХРОМНАЯ СИСТЕМА
Уже в 1886 г. Мак-Мунн открыл в животных тканях геминовый краситель, участвующий в окислительно-восстановительных процессах, и назвал его михематином. Только в 1925 г. Кейлин обнаружил в нем три оксидоредуктазы, которые он назвал цитохромами, т. е. клеточными красителями (от греческого слова kytos – клетка и chroma – краска) и обозначил их цитохромами а, Ь, с. Позднее были идентифицированы и другие цитохромы, но большинство из них еще не удалось характеризовать более подробно, кроме их_спектральных свойств.
Цитохромы – это белки, содержащие металлопорфирины. Они находятся во всех аэробных организмах. По существу, это цветные коферменты, производные циклических тетрапиролей, главным образом протопорфирина IX с хелатно связанным Fe. В восстановленной форме они дают резко выраженные зоны абсорбции и по спектрам поглощения подразделяются на цитохромы а, а3, Ь, Ь5, С, C1 и др.
Цитохромы отличаются способностью обратимо изменять валентность связанного в них атома железа по уравнению
cy-Fe3+ + е ⇄ cy-Fe2+,
где Cy-Fe3+ – окисленная форма (феррицитохром):
Cy-Fe2+ – восстановленная форма (ферроцитохром).
Восстановленные цитохромы могут быть снова окислены каталитическим воздействием цитохромоксидазы, которая при этом сама восстанавливается. Окисленный цитохром восстанавливается водородом из лейкофлавинфермента (FH2):
2cy-Fe3+ + FH2 → 2cy-Fe2+ + F + 2Н+.
Цитохрома. В этом цитохроме атом железа связан в форме так называемого гема или цитогемина – этозеленый гемин, производный циклического тетрапирроля. Ненасыщенная боковая цепь образуется, по Линену, в результате реакции фарнезилфосфата с виниловой группой, первоначально связанной с пиррольным кольцом I. Цитогемин отличается от протопорфирина IX также формильной группой, связанной вместо метила с контуром IF.
Цитохром α и подобный ему цитохром а3 участвуют в конечном окислении, т. е. при переносе электронов на молекулярный кислород, а именно в виде кофермента цитохромоксидазы (цитохром с: О2-оксидоредуктаза, 1.9.3.1).
Цитохром Ь. Он содержит, как и цитохром с, железо, связанное в протопорфирине IX. С ним взаимодействуют несколько ферментов, например дегидрогеназа янтарной кислоты (сукцинат: (акцептор)-оксидоредуктаза, 1.3.99.1). В митохондриях содержится цитохромный комплекс bc1 являющийся компонентом системы, переносящей электроны. В дрожжах и бактериях имеется дегидрогеназа молочной кислоты (α-лактат: цитохром соксидореду κтε за, 1.1.2.3).
Цитохром с. Является единственным компонентом цитохромной системы, который удалось выделить. Это наиболее изученный цитохром. Атом железа связан в протопорфирине IX координационно с атомами азота двух пирольных ядер и ковалентно с атомами азота двух остальных пиррольных ядер. Гем присоединяется к белку тиоэфирными связями между виниловыми группами гема и сульфгидрильными группами двух молекул цистеина в пептидной цепочке. При этом атом железа соединяется координационно с имидазоловым азотом гистидинового остатка цепочки, свернутой в β-спираль. По Теореллу, цитохром с имеет следующую структурную формулу:
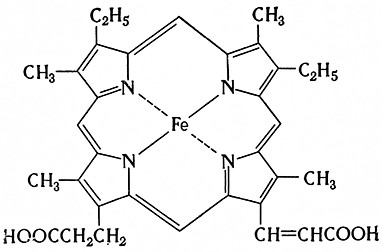
Вследствие того, что гем связан посередине белковой •молекулы, цитохром с не реагирует с СО и очень медленно реагирует с KCN, Связь гема с белком осуществляется через серу двух остатков цистеина, а также с помощью дополнительной связи между атомом железа и ядром гистидина. По-видимому, железо связано также дополнительной валентностью с одним из остатков метионина. Трехвалентное железо Fe3+ цитохрома с восстанавливается до двухвалентного Fe2+ цистеином, аскорбиновой кислотой, полифенолами и др.
Восстановленный цитохром с в нейтральной среде не окисляется молекулярным кислородом. Его быстро окисляет фермент цитохромоксидаза, феррицианид, H2O2 и т. п. Цитохром с не самоокисляется. ,
Известно, что белок цитохрома с, содержит в молекуле 104 аминокислотных остатка и сравнительно много лизина.
Хотя цитохром с является металлопротеидом, его все же считают коферментом белкового характера, приобрел тающим ферментативное действие только в присутствии подходящего фермента, для которого он является акцептором или донором переносимых электронов. Так, цитохром с является, например, акцептором электронов для фермента Q2H2: цитохром с-оксидоредуктаза, переносящего электроны с восстановленного кофермента Q (убихинона) на цитохром с с участием цитохромного комплекса bc1 Этот перенос является частью переноса электронов при реокислении пиридиновых и флавиновых коферментов дегидрогеназ многочисленных субстратов и имеет значение для получения энергии при окислительных процессах в живых клетках. В них были найдены также дегидрогеназы, переносящие электроны (водород) на цитохром с, например глицерофосфатдегидрогеназа (α-глицерол-3-фосфат: цитохром с-оксидоредуктаза, 1.1.2.1), лактатдегидрогеназа из дрожжей (α-лактат: цитохром-с-оксидоредуктаза, 1.1.2.3), ацил-КоА-дегидрогеназа (ацил-КоА: цитохром-с-оксидоредуктаза, 1.3.2.2) и др.
Цитохромоксидаза (цитохром с: О2-оксидоредуктаза, 1.9.3.1), ранее называвшаяся цитохромом α3, ферментом Варбурга, или же индофенолоксидазой, является ферментом, катализирующим перенос электронов с цитохрома с на молекулярный кислород. Таким образом, этот фермент является последним соединительным звеном системы, переносящей электроны. Цитохромоксидаза наряду с гемом содержит в молекуле также и медь, которая обусловливает деятельность фермента и при реакции временно восстанавливается. Цианиды замедляют реокисление меди. Другими ингибиторами цитохромоксидазы являются вещества, связывающие атом железа в молекуле, а именно: СО, H2S, N3Na.
Механизм действия цитохромоксидазы пока еще не выяснен.
Большинство аэробных организмов обладают полной системой цитохромов, т.е. цитохромами Ь, с, α,α3 (-цитохромоксидаза). С цитохромом с и цитохромоксидазой функционально связана, дегидрогеназа янтарной кислоты (сукцинатдегидрогеназа), катализирующая окисление янтарной кислоты до фумаровой. При этом высвобождаются атомы водорода, которые переносятся на цитохром с, а он реокисляется кислородом воздуха. Высвобожденная энергия используется для этерификации неорганического фосфата и для образования макроэргической фосфатной связи.
Цитохромная система является конечной окислитель-, ной системой, участвующей в передаче электронов от субстрата до молекулярного кислорода. При этом водород субстрата окисляется до воды.
Гидропероксидазы, т. е. ферменты, катализирующие разложение перекиси водорода в присутствии надлежащего донора водорода, представляют собой следующую группу геминовых ферментов. Их коферментом чаще всего является гем, т. е. хелатно связанное железо в протопорфирине IX, однако некоторые из них являются флавопротеидами. К ним относятся пероксидазы и каталаза.
Пероксидаза (донор: Н2О2-оксидоредуктаза, 1.11.1.7) катализирует неспецифическое разложение H2O2 в присутствии подходящих доноров водорода, например аскорбиновой кислоты, различных полифенолов и т. д. Коферментом пероксидаз является гем с трехвалентным железом.
Неспецифическую, классическую пероксидазу открыл Шенбейн в 1863 г., а несистематическое тривиальное название этого фермента предложил Линоссье (1898).
Из специфических пероксидаз известны, например, цитохромпероксидаза (цитохром с: Н2О2-оксидоредуктаза, 1.11.1.5), глютатионпероксидаза (глютатион: H2O2оксидоредуктаза, 1.11.1.а), пероксидаза жирных кислот (пальмитат: Н2О2-оксидоредуктаза, 1.11.1.3), НАД-пероксидаза (НАДН2: Н2О2-оксидоредуктаза, 1.11.1.1) и др.
Пероксидазы встречаются главным образом в растительных тканях. Их функции в процессах метаболизма пока еще не установлены. Поскольку в растениях цитохромная система наряду с аэробными флавопротеидами является важным механизмом окислительно-восстановительных процессов, то трудно объяснить, благодаря каким реакциям может возникать большое, количество перекиси водорода, соответствующее высокой концентрации и активности пероксидаз, содержащихся в растительных тканях.
Каталаза (H2O2 : Н2О2-оксидоредуктаза, 1.11.1.6) – это геминовый протеид, содержащий в простетической группе 4 феррипротопорфириновых остатка, прочно свя:занных с белком. Разложение H2O2, катализируемое каталазой, является окислительно-восстановительной реакцией, при которой с участием хелатно связанного железа H2O2 разлагается в отсутствие другого донора водорода. Разложение протекает быстро и полно.
Каталаза содержится во всех живых организмах. Это один из самых активных ферментов (TN = 5 000 000). Ингибиторами каталазы являются H2S, HCN, СО, N3Na.
АНАЭРОБНЫЕ ПРОЦЕССЫ
Микроорганизмы обладают способностью расщеплять сахара на простейшие соединения с низким содержанием энергии и в отсутствие кислорода и получать таким образом свободную энергию, необходимую для их жизнедеятельности. Эти процессы называются анаэробным гликолизом, или анаэробным брожением.
Ключевым веществом анаэробного расщепления глюкозы и метаболизма Сахаров вообще является пировиноградная ι кислота, служащая соединительным звеном между анаэробными и аэробными процессами. При спиртовом гликолизе пировиноградная кислота декарбоксилируется до ацетальдегида, из которого образуется этиловый спирт или уксусная кислота. Бактерии содержат ферментные системы, способные превращать пировиноградную кислоту в другие продукты, например молочную; масляную, пропионовую кислоты, ацетон, бутанол, пропанол, ацетоин, 2,3-бутиленгликоль и др. Некоторые из этих анаэробных бактериальных процессов имеют большое техническое значение.
СПИРТОВОЕ БРОЖЕНИЕ
Конечный результат сбраживания гексоз до этилового спирта и углекислоты выражает суммарное уравнение Гей-Люссака (1810)
C6H12O6 ⇄ 2С2Н5ОН + 2СО2.
Согласно этому уравнению при сбраживании одной молекулы гексозы образуются две молекулы этилового спирта и две молекулы углекислоты. Таким образом, теоретический выход этилового спирта равен 51,1% из гексозы или 53,8% из мальтозы или сахарозы.
Некоторые процессы спиртового брожения имеют большое значение для промышленности. Поэтому химизм этого брожения детально изучался в течение длительного времени сследования были направлены главным образом на выделение промежуточных продуктов. Они проводились не с живыми дрожжевыми клетками, а с препаратами дрожжей, которые получали различными способами – высушиванием, обработкой эталоном или ацетоном. Использовали также дрожжевой сок, который получали мацерацией (Лебедев), прессованием (Бухнер) или же вымораживанием (Линен). Дрожжевой сок часто выделяли в присутствии ингибиторов для раздельного получения лишь определенных систем ферментов, дрожжевой клетки. Принципиально большое значение имели работы Бухнера, Кори, Гардена, Лебедева, Мейергофа, Нейберга и Варбурга.
Отдельные данные, полученные в результате исследования бесклеточного брожения, были использованы для составления схем всего процесса, которые изменялись по мере получения новых данных. Постепенно было доказано, что спиртовой гликолиз протекает в цепи реакций, связанных с механизмом фосфорилирования. На первой стадии (фосфор илирования) образуются различные фосфаты гексозы. Последний из них, т.е. фруктозо-1,6-дифосфат, распадается на две молекулы триозофосфата, т. е. диоксиацетонфосфат и глицеральдегид-3-фосфат. Глицеральдегид-3-фосфат дегидрируется и одновременно фосфорилируется с образованием 1,3-фосфоглицериновой кислоты, которая при дальнейшем дегидрировании и дефосфорилировании превращается в пировиноградную кислоту. Последняя декарбоксилируется с образованием углекислоты и ацетальдегида, который на последней стадии восстанавливается до этилового спирта.
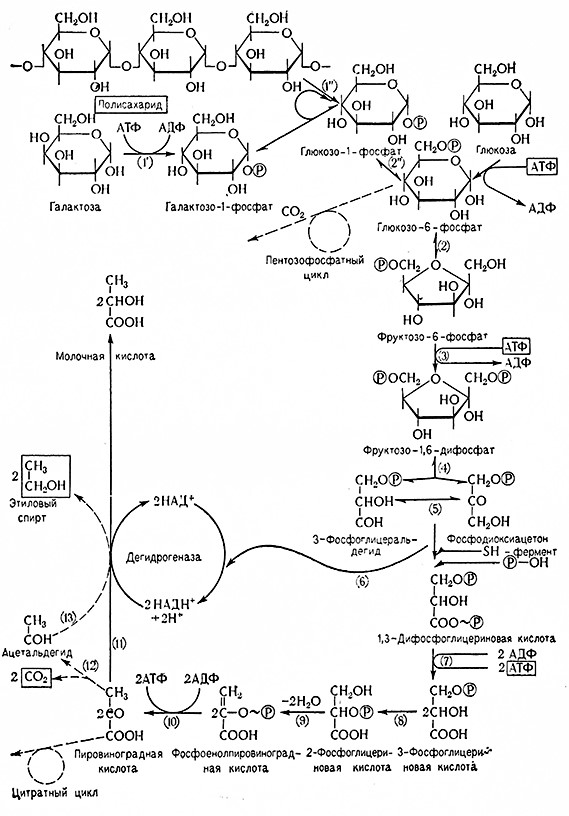
Рис. 7. Схема спиртового брожения Эмбдена–Мейергофа (позиции в скобках):
1 – гексокиназа; 1' – галзктоКиназа; 1" – фосфортлазэ; 2 – глюкозофосфатизомераза;
2" – фосфоглюкомутаза; 3 – фосфофруктокиназа; 4 – альдолаза; 5 – триозофосфпт зомераза;
6 – триозофосфатдегидогеназа; 7–фосфогл цсраткиназа; 8 – фосфоглицеромутаза;
9 – 4осфопируват-гидоатаза; 10 – пипуваткиназа; 11 – лактатдегидрогеназа;
12 – карбоксилаза; 13 – алкогольдегидрогеназа.
Весь процесс спиртового брожения представлен в Виде схемы, разработанной в 1934–1939 гг. Мейергофом и его школой. В настоящее время эта схема (схема Эмбдена и Мейергофа) имеет следующий вид (рис. 7).
Процесс спиртового брожения включает следующие стадии:
1. В начале брожения образуются фосфорные эфиры гексоз, начинается реакция глюкозы с аденозинтрифосфатом (АТФ), в результате которой образуется D-глюкозо-6-фосфат (D-глюкопиранозо-6-фосфат эфир Робисона) и аденозиндифосфат (АДФ). Реакцию катализирует гексокиназа (АТФ: D-гексозо-б-фосфотрансфераза, 2.7.1.1.) при обязательном присутствии ионов магния (Mg2+).
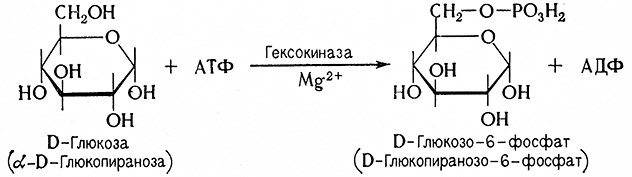
Аналогично фосфорилируются также D-фруктоза и D-манноза с образованием соответствующих D-гексозо-б-фосфатов.
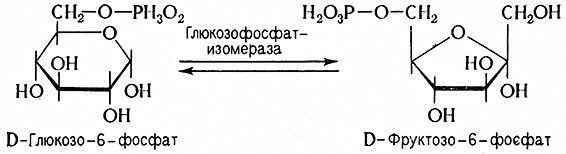
2. D-глюкозо-6-фосфат изомеризуется до D-фруктозо-6-фосфата (эфир Нейберга) под каталитическим воздействием глюкозофосфатизомеразы (D-глюкозо-6-фосфат-кетол-изомеразы, 5.3.1.9). Реакция обратима и при равновесном состоянии присутствует около 2/3 D-глюкозо-6-фосфата и 1/3 D-фруктозо-6-фосфата.
3. Сложный эфир Нейберга под действием фосфофруктокиназы (АТФ: D-фруктозо-6-фосфат-1-фосфотрансферазы, 2.7.1.11) фосфорилируется с участием АТФ с образованием D-фруктозо-1,6-дифосфата (эфир Гардена – Юнга).
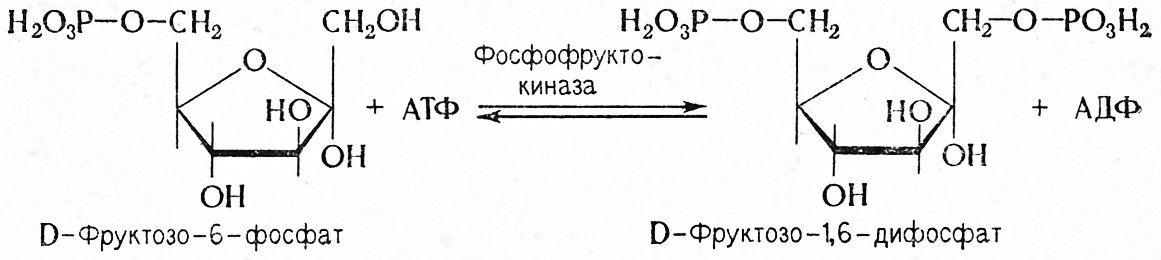
Эта реакция протекает только в присутствии ионов калия (K+) и аммония (ΝΗ4+). Она заканчивает стадию фосфорилирования.
4. Сложный эфир Гардена–Юнга затем расщепляется на две молекулы триозофосфатов, а именно 3-фосфоглицеральдегид (сложный эфир Фишер – Бауэра) и фосфодиоксиадетон. Реакцию катализирует альдолаза (фруктозо-1,6-дифосфат-Б-глицеральдегид-З-фосфатлиаза, 4.1.2.13).
119 б
Оба триозофосфата находятся в равновесии, поддерживаемом триозофосфатизомеразой (D-глицеральдегид-З-фосфат-кетол-изомераза, 5.3.1.1).
Дальнейшим превращениям подвергается только 3-фосфоглицеральдегид. По мере его использования равновесие триозофосфатов нарушается и диоксиацетон (под действием изомеразы триозофосфатов) постепенно превращается в 3-фосфоглицеральдегид.
5. З-Фосфоглицеральдегид окисляется коферментом НАД+ при одновременном фосфорилировании до 1,3-дифосфоглицериновой кислоты. Эту реакцию катализирует триозофосфатдегидрогеназа (D-глицеральдегид-З-фосфат: НАДоксидоредуктаза, 1.2.1.12).
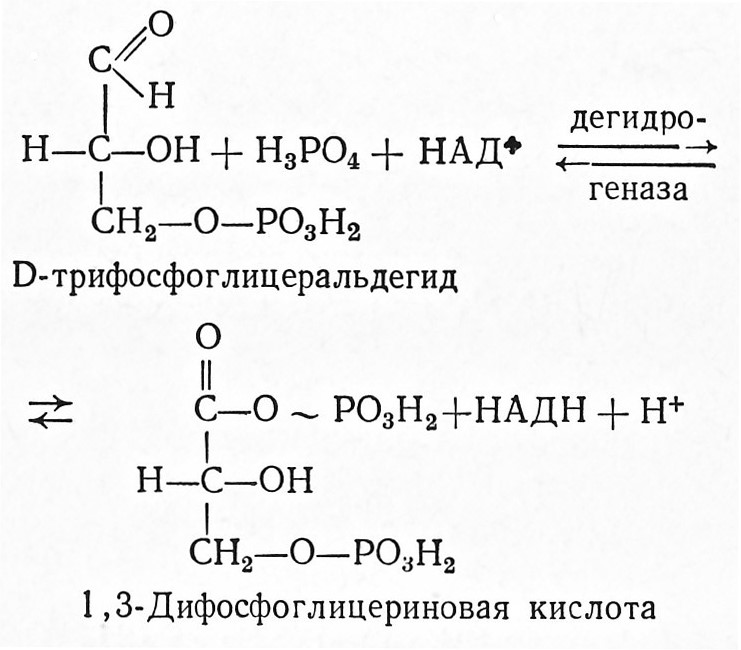
Образовавшийся в результате этой реакции НАДН передает свой водород в заключительной фазе брожения ацетальдегиду; при этом происходит регенерация НАД+.
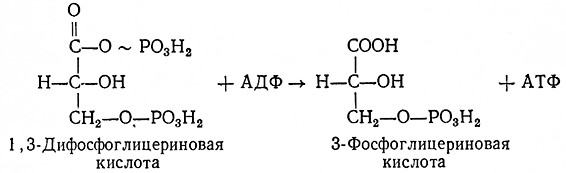
6. От 1,3-дифосфоглицериновой кислоты отщепляется фосфорная кислота, связанная в молекуле первым атомом углерода. Реакцию катализирует АТФ: З-фосфо-D-глицерат-1-фосфотрансфераза (2.7.2.3), активированная ионами магния (Mg2+). Фосфорная кислота передается на АДФ, так что образуется АТФ.
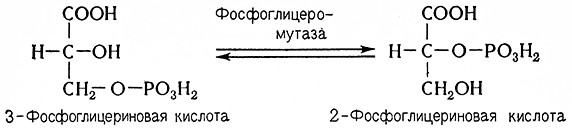
7. З-Фосфоглицериновая кислота под действием фосфоглицеромутазы (2,3-дифосфо-D-глицерат: 2-фосфоглицерат-фосфотрансферазы, 2.7.5.3) изомеризуется с образованием 2-фосфоглицериновой кислоты.
8. В результате отнятия воды, катализируемого енолазой (2-фосфо-В-глицерат-гидро-лиазой, 4.2.1.11), 2-фосфоглицериновая кислота превращается в 2-фосфоенолпировиноградную кислоту.
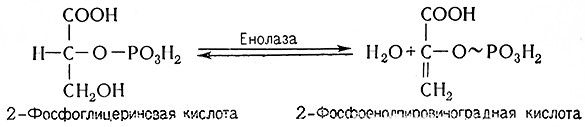
Енолазу активируют ионы магния (Mg2+), марганца(Mn2+) или цинка (Zn2+).
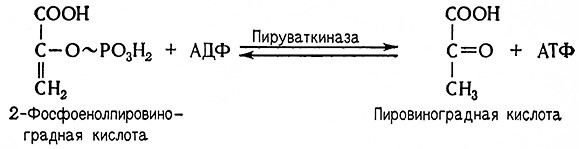
9. Из фосфоенолпировиноградной кислоты, содержащей макроэргическую связь, в результате действия пируваткиназы (АТФ: пируват-фосфотрансферазы, 2.7.1.40.), образуется пировиноградная кислота. При этом АДФ переходит в АТФ.
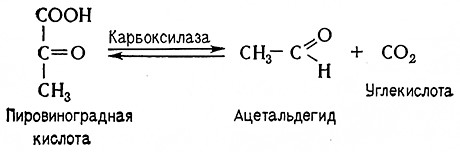
10. Пировиноградная кислота подвергается расщеплению на ацетальдегид и углекислоту; соответствующий фермент, проводящий эту реакцию, называется пируватдекарбоксилазой (карбоксилиазой 2-оксокислот, 4.1.1.1). Ее коферментом является тиаминпирофосфат.
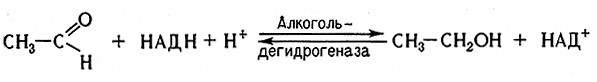
11. В заключительной фазе спиртового брожения ацетальдегид восстанавливается при взаимодействии НАДН, образовавшегося в реакции 5.
В результате происходит образование этилового спирта и регенерация молекулы НАД+. Реакцию катализирует алкогольдегидрогеназа (алкоголь: НАД-оксидоредуктаза, 1.1.1.1).
Из приведенной выше схемы и табл. 8 видно, что ни одна из реакций спиртового брожения не нуждается в кислороде. Перечень ферментов спиртового брожения приведен в табл. 8.
Таблица 8

Реакции фосфорилирования приводят (при спиртовом брожении) к образованию и накоплению макроэргических связей. Первая макроэргическая фосфатная связь возникает в реакции 5 и ее носителем является 1,3-дифосфоглицерат. Эта связь разрывается в реакции 6 при превращении карбонильной группы в карбоксильную с одновременным переходом АДФ в АТФ.
Вторая макроэргическая фосфатная связь возникает в реакции 8, где ее носителем является фосфоенолпировинОградная кислота. Она разрывается в реакции 9 тоже с одновременным образованием АТФ.
Участие АТФ (являющегося важным энергетическим источником клетки) в спиртовом брожении глюкозы можно выразить уравнениями:
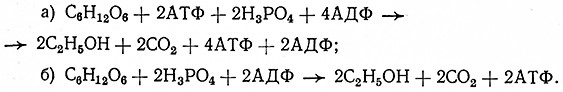
Следовательно, при сбраживании одной молекулы глюкозы до этилового спирта и углекислоты из двух молекул АДФ образуются две молекулы АТФ, т. е. возникают две макроэргические связи ~Р по 49,44 • 103 Дж/моль каждая (всего 98,88 Дж/моль). Потребление неорганических фосфатов при спиртовом брожении в действительности меньше, чем это следует из указанных уравнений, так как благодаря превращению АТФ фосфорная кислота снова выделяется и может быть· снова использована в других реакциях обмена веществ.
Описанный нормальный ход спиртового брожения, при котором акцептором водорода от НАДН является ацетальдегид, рассматривается, по Нейбергу, как первая форма брожения.
Процесс спиртового брожения можно направлять изменением внешних условий, что влечет за собой изменение и конечного результата брожения.
Вторая форма брожения наступает в случае, когда ацетальдегид выводится из обмена веществ, например, путем связывания его сернистым натрием или же (в лабораторных условиях) димедоном (-диметилдигридрорезорцином). Toгда функцию акцептора водорода принимает на себя глицеральдегид-3-фосфат, из которого образуется фосфоглицериновая кислота, превращающаяся затем в основном в глицерин.
Результат брожения выражается тогда следующим суммарным уравнением:
![]()
Таким же образом образуется глицерин и в начальной фазе нормального брожения, до накопления достаточного количества ацетальдегида. Этим объясняется наличие небольшого количества глицерина в пиве.
Третья форма брожения протекает в щелочной среде (рН 8). В этих условиях ацетальдегид превращается в этиловый спирт и уксусную кислоту; наряду с ними образуется глицерин. Реакция протекает по уравнению
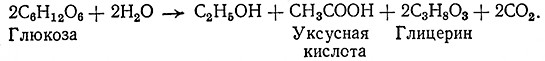
Четвертая и пятая формы спиртового брожения пока еще в промышленности не используются.
Некоторые сведения о ферментах спиртового брожения
Дрожжевая клетка обладает большим набором ферментов. Кроме ферментов, которые управляют дыханием клеток и механизмом фосфорилирования (эти ферменты описаны в специальных разделах), процесс брожения активируется группой ферментов, которые первоначально носили общее название «дрожжевая зимаза».
По современным представлениям зимаза – многоферментный комплекс, катализирующий спиртовое брожение гексоз, включающий в себя необходимые сопутствующие вещества, т. е. активаторы и кофакторы.
Реакции спиртового брожения катализируют 12 различных ферментов с участием двух коферментов (2,3-дифосфоглицериновой кислоты и тиаминпирофосфата (ТПФ), двух органических кофакторов (АТФ/АДФ и НАД/НАДН) и двух неорганических активаторов (Mg2+ и K+).
При сбраживании одной молекулы глюкозы две молекулы ортофосфата переходят в органическую форму.
Альдолаза. Альдолаза (кетозо-1-фосфатальдегид-лиаза 4.1.2.7) была обнаружена в 1934 г. Первоначальное ее название – зимогексаза. Это фермент, катализирующий обратимую реакцию расщепления фруктозо-1,6-дифосфата (сложный эфир Гардена – Юнга) на диоксиацетонфосфат и глицеральдегидфосфат.
Альдолаза является довольно распространенным ферментом. Она строго специфична по отношению к диоксиацетонфосфату, тогда как по отношению к глицеральдегид-3-фосфату она имеет только групповую специфичность. Благодаря этому свойству фермента при каталитическом воздействии альдолазы возможно проведение реакций конденсации ряда алифатических и ароматических альдегидов с диоксиацетонфосфатом. Такие реакции называют альдольной конденсацией; это – обратимые равновесные реакции.
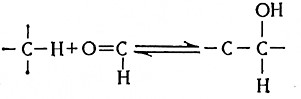
При альдольных конденсациях атомы углерода двух соединений уплотняются в одну цепочку.
Из дрожжей была получена аморфная альдолаза (Мейергоф с сотр. 1934); из мышц – альдолаза животного происхождения в кристаллическом виде (Варбург и Кристен, 1943). Альдолазы различного происхождения несколько отличаются друг от друга. Мышечный фермент не ингибируется реактивами, образующими внутренние комплексы, тогда как дрожжевую альдолазу обратимо ингибирует SH-глютатион и реактивируют ионы металлов, а именно Zn2+, Fe2+, Co2+ и Cu2+.
При одновременном присутствии тиоловых соединений, ионов железа альдолаза также обратимо инактивируетсявследствие того, что окислительно-восстановительные реакции между О2 + Fe2+ и между Fe3+ + RS– протекают очень быстро. Окисление Fe2+ до Fe3+ может быть причиной замедления спиртового брожения в присутствии кислорода.
Фермент имеет тиоловые группы, и поэтому разрушается хлоруксусными кислотами:
RS–+ Cl–CH2COOH → R-S-CH2COOH + С1–.
Триозофосфатдегидрогеназа. Эта дегидрогеназа (D-глицеральдегид-3-фосфат: НАД-оксидоредуктаза, 1.2.1.12) катализирует в присутствии неорганического фосфата и НАД+ реакцию, при которой из глицеральдегид-3-фосфата образуется 1,3-дифосфоглицериновая кислота (1,3-дифосфоглицерат).
Окисление D-глицеральдегид-З-фосфата протекает в две стадии. Сначала под действием фосфата образуется неустойчивое соединение D-глицеральдегид-1,3-дифосфорная, кислота, которая затем превращается в 1,3-дифосфоглицериновую кислоту, имеющую в молекуле макроэргические фосфатные связи.
Оптимум рН фермента – от 8,6 до 9,1. Его активность стимулируется цистеином или глютатионом. Фермент инактивируется в присутствии следов тяжелых металлов. Сильное ингибирующее действие оказывают ионы йодацетата (I – CH2OOO–).
Фосфоглицеромутаза. Фосфоглицеромутаза (2,3-дифосфо-D-глицерат: 2-фосфо-D-глицерат-фосфотрансфераза, 2.7.5.3) катализирует изомеризацию 3-фосфоглицерата в 2-фосфоглицерат. В данном случае обязательным коферментом является 2,3-дифосфоглицериновая кислота:
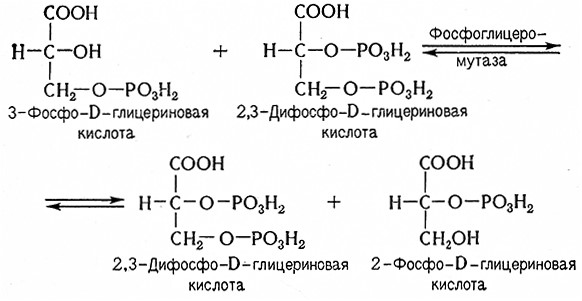
Енолаза (2-фосфо-D-глицерат-гидро-лиаза, 4.2.1.11) является важным ферментом в метаболизме Сахаров. Она катализирует обратимую дегидратацию 2-фосфоглицериновой кислоты (2-фосфоглицерата), приводящее к образованию 2-фосфоенолпировиноградной кислоты (фосфоенолпирувата).
Енолаза-Mg – зависимый фермент, но ионы Mg, вероятно, можно заменить ионами цинка (Zn2+) или марганца (Mn2+). В присутствии ионов фтора и фосфата происходит образование магний-фторфосфатного комплекса, что вызывает инактивацию енолазы, так как магний становится недоступным для фермента.
Mg-енолаза + Mg-фторфосфат = Mg-фторфосфатенодаза + Mg-соль.
Замедление спиртового брожения в присутствии фтори-. дов, которые использовались раньше в пивоварении в качестве дезинфицирующего средства, объясняется именно этим ингибированием енолазы.
Енолаза была выделена в виде кристаллической ртутной соли. При замене ртути магнием получается активный фермент.
При дегидратации 2-фосфоглицериновой кислоты, приводящей к возникновению фосфоенолпирувата, образуется макроэргическая фосфатная связь. Реакция обратима и протекает без изменения свободной энергии. По Липману, при гидролизе фосфатной связи 2-фосфоглицериновой кислоты выделяется только 12,57 Дж, тогда как гидролиз фосфатной енольной связи дает 48,19 Дж. Таким образом, отнятие воды приводит к перераспределению внутренней энергии с образованием в данном случае енольной макроэргической фосфатной связи.
Карбоксилаза (пируватдекарбоксилаза). Карбоксил аза (карбокси-лиаза 2-оксокислот, 4.1.1.1) довольно широко распространена в растительных клетках и дрожжах. Этот фермент катализирует в присутствии ионов магния (Mg2+) расщепление α-кетокислот до альдегида и углекислоты. Основной реакцией, катализируемой дрожжевой карбоксилазой, является декарбоксилирование пировинаградной кислоты до ацетальдегида и CO2. при спиртовом брожении.
Карбоксилаза – сравнительно хорошо изученный фермент. В 1937 х. удалось идентифицировать кофермент дрожжевой карбоксилазы как дифосфорный сложный эфир тиамина, т. е. тиаминпирофосфат, ТПФ. Апокарбоксилаза –это белок из группы глобулинов; таким образом, карбоксилаза представляет собой дифосфо-тиамин-магний-протеид.
Дрожжевая карбоксилаза (декарбоксилаза пировиноградной кислоты) имеет оптимум активности и стабильности при рН 6,1–6,2. При рН 8,1 она легко разлагается. Молекулярная масса фермента 141 ООО. Фермент очень чувствителен и инактивируется, например, при наличии уже следовых количеств меди.
Карбоксилазы животного происхождения катализируют аэробное декарбоксилирование пировиноградной кислоты, при котором образуется уксусная кислота и CO2. Коферментом карбоксилаз животного происхождения является, по всей вероятности, липоевая кислота в виде пирофосфата липотиамида. Этим карбоксилазы животного происхождения отличаются от дрожжевой карбоксилазы.
ПОБОЧНЫЕ ПРОДУКТЫ СПИРТОВОГО БРОЖЕНИЯ
Известными побочными продуктами спиртового брожения являются высшие спирты, янтарная кислота и некоторые карбоновые кислоты.
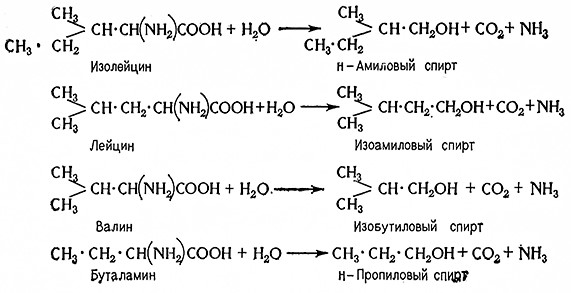
По данным Эрлиха, позднее подтвержденным Торном, некоторые дрожжи превращают аминокислоты, главным образом лейцин, изолейцин, триптофан, тирозин и т. п., в соответствующие спирты. При образовании этих спиртов одновременно протекают процессы декарбоксилирования и гидролитического дезаминирования, аминокислот по уравнению
R • CH (NH2) COOH + H2O → R • CH2OH + NH3 + CO2.
Аминокислота Спирт
Таким образом, из разных аминокислот образуются различные Еысшие спирты, например пентанол-1 (n-амиловый спирт) из изолейцина, 2-метилбутанол-4 (изоамиловый спирт) из лейцина, 2-метилпропанол-1 (изобутиловый спирт) из валина, пропанол-1 (-n-пропиловый спирт) из α-аминомасляной кислоты и т.д. Эти спирты содержатся в сивушных маслах спиртового брожения и напитках, полученных брожением.
Данные последних работ подтверждают образование высших спиртов (сивушных масел) непосредственно из сахаров через уксусную кислоту. Женевуа и Лафон при добавлении меченого ацетата натрия к бродящей среде получили меченые изопропиловый и изоамиловый спирты.
Полагают, что из ацетата образуется, по всей вероятности, через ацетил-S-KoA ацетоуксусная кислота, которая декарбоксилируется с образованием ацетона, а последний восстанавливается до изопропилового спирта. В результате конденсации ацетона с ацетальдегидом образуется β-метилкротоновый альдегид, восстанавливающийся до амилового спирта.
Содержание высших спиртов качественно и количественно зависит от состава среды, главным образом от вида сбраживаемого сахара и вида и количества имеющихся аминокислот, а также от расы использованных дрожжей и от некоторых других факторов. В присутствии солей аммония образуется меньше высших спиртов, так как дрожжи в качестве источника азота используют аммиак этих солей вместо аммиака аминокислот. Сбраживание аминокислот до соответствующих спиртов происходит лишь при наличии сбраживаемых Сахаров.
Считают, что высшие спирты оказывают значительное влияние на вкус пива и других напитков, получаемых брожением.
Янтарная кислота образуется при спиртовом брожении из глютаминовой кислоты. Ниже представлен механизм этой реакции.
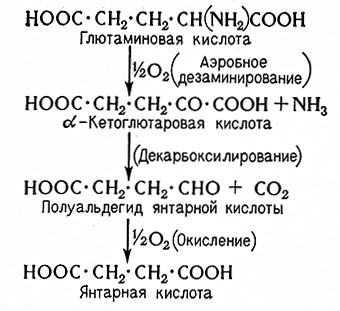
Если глютаминовая кислота не содержится в субстрате, то она может образовываться вследствие автолиза дрожжей. В отсутствие сбраживаемых Сахаров янтарная кислота не образуется.
Ацетальдегид, образовавшийся при гликолизе, частично остается в незначительных количествах непосредственно в среде и сохраняется в бродильных напитках, а частично превращается в результате реакции, катализируемой, по Блэку, альдегид-дегиДрогеназой (альдегид: НАД (Ф)-оксидоредуктазой, 1.2.1.5) в уксусную кислоту. По Зигмиллеру, свежие дрожжи содержат альдегид: НАДФ-оксидоредуктазу [1.2.1.4], которая катализирует также окисление альдегидов до соответствующих карбоновых кислот по уравнению
R • СОН + HАДФ + H2O ⇄ НАДФН2 + R • COOH.
Так окисляются ацетальдегид, гликоальдегид, пропионовый альдегид и формальдегид.
Муравьиная кислота образуется в результате так называемого фосфокластического распада пировиноградной кислоты под действием бактерий группы Коли-аэрогенез. Протекает реакция, при которой сначала переносится ацетил из пировиноградной кислоты на KoA с одновременным образованием муравьиной кислоты:
CH3-СО–СООН + HS-KoA ⇄ CH3-CO ~ SKoA + Н–СООН.
В дальнейшем под действием фосфат-ацетилтрансферазы (ацетнл-КоА: ортофосфат-ацетилтрансфераза, 2.3.1.8) образуется ацетилфосфат при отщеплении KoA:
CH3–CO ~ SKoA + H3PO4 ⇄ HS–KoA + CH3–CO–O ~ PO3H2.
Макроэргическая фосфатная связь в конечном итоге переносится от ацетилфосфата на АДФ:
CH3–CO–O ~ PO3H2 + АДФ ⇄ АТФ + CH3–COOH.
Эту реакцию катализирует ацетаткиназа (АТФ: ацетатфосфотрансфераза, 2.7.2.1).
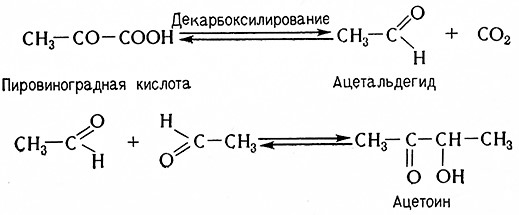
Характерными побочными продуктами спиртового брожения являются ацетоин, диацетил и 2,3-бутиленгликоль. Исходным веществом для их образования является пировиноградная кислота, декарбоксилирование которой при спиртовом брожении приводит к образованию «активного ацетальдегида» как форме тиаминпирофосфата и затем ацетальдегида и этилового спирта. Две молекулы ацетальдегида конденсируются с образованием ацетоина.
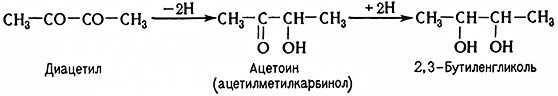
При окислении ацетоина образуется диацетил, при восстановлении – бутиленгликоль.
Связь процесса образования ацетоина с аэробными процессами показана на рис. 8.
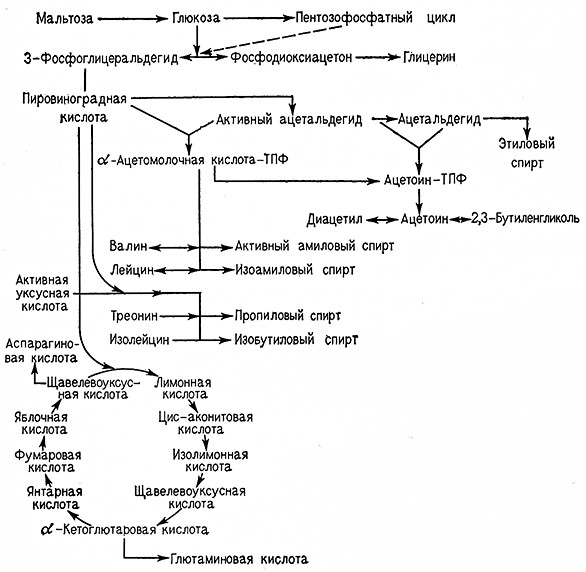
Рис. 8. Схема образования диацетила и ацетоина при анаэробных и аэробных процессах.
По схеме гликолиза Эмбдена– Мейергофа диокеиацетонфосфат частично превращается в глицерин, а 3-фосфоглицеральдегид образует в конечном итоге пировиноградную кислоту. При спиртовом брожении далее образуются «активный ацетальдегид», ацетальдегид и этиловый спирт. Из «активного ацетальдегида» и ацетальдегида может синтезироваться ацетоин-тиаминпирофосфат как побочный 1Тродукт спиртового брожения, из которого образуется ацетоин, диацетил и 2,3-бутиленгликоль (рис. 9). С другой стороны, из пировиноградной кислоты и «активного ацетальдегида» синтезируется а-ацетомолочная-тиаминпирофосфат кислота, при этом в качестве побочного продукта синтеза аминокислот валина и лейцина также образуется ацетоин-тиаминпирофосфат, дающий начало ацетоину, диацетилу и 2,3-бутиленгликолю (рис. 10).
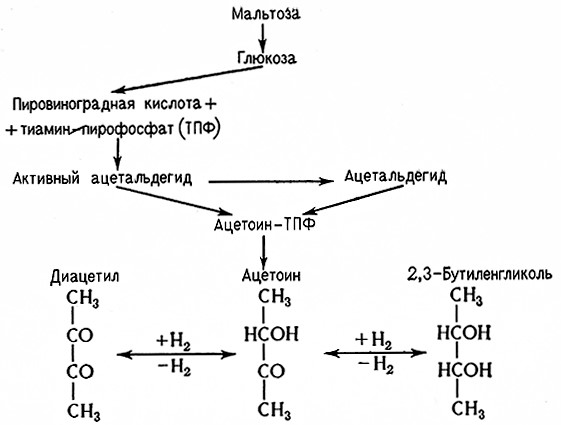
Рис. 9. Схема синтеза диацетила и ацетоина в качестве побочного продукта спиртового брожения.
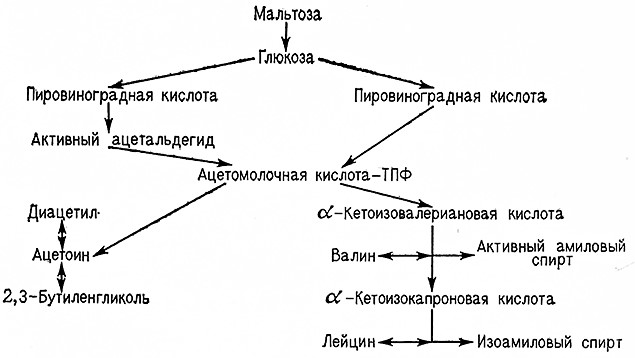
Рис. 10. Схема синтеза ацетоина как избыточного продукта метаболизма (Древе, Шпехт, Трёнель).
Из этих продуктов основную роль играет диацетил, оказывающий заметное влияние на вкус готового продукта. Диацетил, образуемый при главном брожении, при дображивании и выдержке пива восстанавливается до ацетоина, влияние которого на вкус пива значительно слабее. Следовательно, по содержанию диацетила можно судить о зрелости пива. Диацетил в качестве одного из основных продуктов жизнедеятельности образуют педиококки (пивная «сарцина»), главным образом при дображивании и выдержке пива.
ФОСФОГЛИЦЕРАТНЫЙ ЦИКЛ
Участие 2,3-дифосфоглицерата (ДФГ) в обмене веществ Сахаров связано, по Рапопорту, с особым фосфоглицератным циклом. 2,3-ДФГ образуется из 1,3-ДФГ под каталитическим воздействием 2,3-дифосфоглицеромутазы (1,3-дифосфоглицерат: З-фосфо-D-глицерат-фосфотрансфераза, 2.7.5-4). Обратное превращение 2,3-ДФГ в 3-фосфоглицерат (ФГ) катализирует 2,3-дифосфогл ицерат-фосфатаза (2,3-дифосфо-D-глицерат-2-фосфогидролаза, 3.1.3.13). Отсюда следует, что кроме пути Эмбдена – Мейергофа, в котором энергия, аккумулированная в 1,3-ДФГ, передается в результате трансфосфорилирования, катализируемого фосфоглицераткиназой (АТФ: 3-фосфо-Е)-глицерат-1-фосфотрансфераза, 2.7.2.3), аденозиндифосфату (АДФ), из которого затем образуется аденозинтрифосфат (АТФ), существует еще другой, побочный путь без образования АТФ. Превращение 2-ФГ в 3-ФГ катализирует фосфоглицератфосфомутаза (0-фосфоглицерат-2,3-фосфюмутаза, 5.4.2.1).
Фосфоглицератный цикл изображен на рис. 11.
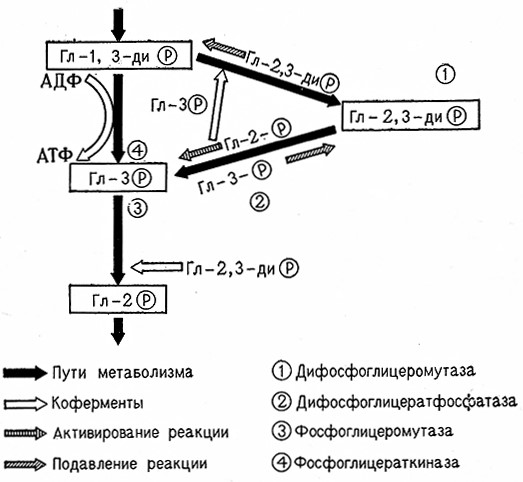
Рис. 11. Схема фосфоглицератного цикла (Рапопорт).
«Саморегенерирующий» характер фосфоглицератного цикла обусловливает при расщеплении сазсаров специфическое действие 2,3-ДФГ, 3-ФГ и 2-ФГ, при котором продукты и субстраты одновременно принимают на себя роль активаторов или же буферов. 2,3-ДФГ действует в качестве кофермента фосфоглицеромутазы, поэтому этот цикл имеет биохимическое значение для образования каталитически^ количеств 2,3-ДФГ (рис. 12).
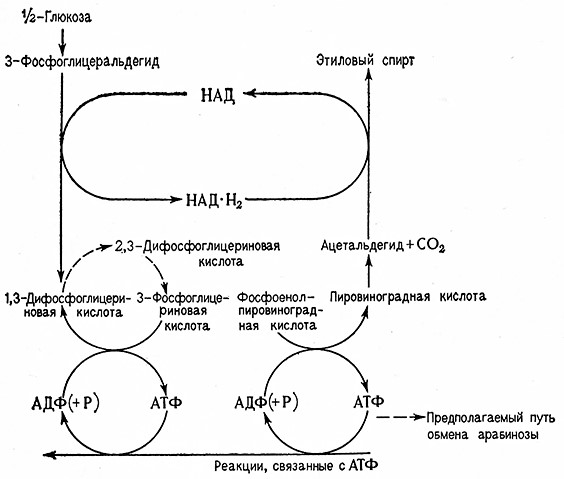
Рис. 12. Ход нормального брожения (цикла Эмбдена–Мейергофа) и расщепление Сахаров через фосфоглицератный цикл.
ИСПОЛЬЗОВАНИЕ ГЛИКОГЕНА ДРОЖЖАМИ
При хранении пивоваренных дрожжей под водой или спрессованными после промывки, т. е. без питательных веществ, они постепенно расходуют гликоген, являющийся их запасным веществом. Дрожжи либо сбраживают его, либо используют в процессе дыхания.
Расщепление гликогена до глюкозы протекает в дрожжевых клетках по схеме:
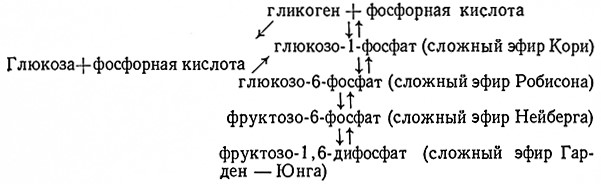
При фосфорилировании гликогена сначала образуется глюкозо-1-фосфат. В реакции, катализуемой фосфоглюкомутазой (α-D-глюкозо-1,6-дифосфат: D-глюкозо-1-фосфат-фосфотрансфераза, 2.7.5.1), глюкозо-1-фосфат превращается в глюкозо-6-фосфат, находящийся в равновесии с фруктозо6-фосфатом. На следующей стадии под действием гексокиназы (АТФ: D-гексоза-6-фосфотрансфераза, 2.7.1.1) при участии АТФ образуется фруктозо-1,6-дифосфат; далее продолжается нормальное спиртовое брожение.
Полагают, что и глюкоза может непосредственно фосфорилироваться до сложного эфира Кори.
МОЛОЧНОКИСЛОЕ БРОЖЕНИЕ
Молочнокислое брожение вызывается молочнокислыми бактериями (видами Lactobacillus из семейства Lactobacteriaceae). Большое значение имеет производство молочной кислоты (α-оксипропионовой) CH3–СНОН–СООН, которая в промышленном масштабе получается методом брожения уже с 1881 г.
Для пивоварения молочнокислые бактерии являются вредными, так как они подкисляют пиво и вызывают его помутнение.
Гомоферментативные молочные бактерии (например, Lactobacillus delbriickii, L. leichmanii, L. casei, L. bulgaricus, L. pentosus, Streptococcus lactis, Leuconostoc mesenteroides и т. д.) образуют в качестве главного продукта брожения молочную кислоту. Различные микроорганизмы вырабатывают различные стереоизомеры молочной кислоты.
Сначала гомоферментативное молочнокислое брожение протекает аналогично спиртовому брожению до стадии образования пировиноградной кислоты включительно. Однако последняя не декарбоксилируется до ацетальдегида, так как у молочнокислых бактерий нет соответствующей карбоксилазы (Меллер, 1950), а восстанавливается до молочной кислоты. Эта реакция катализируется лактатдегидрогеназой (L-лактат: НАД-оксидоредуктаза, 1.1.1.27). Электроны от глицеральдегид-3-фосфата переносит на пировиноградную кислоту никотинамиднуклеотидный кофермент:
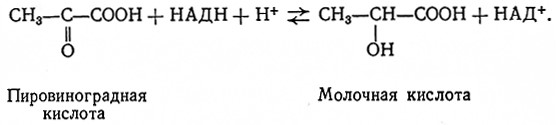
Гетероферментативные молочнокислые бактерии (Lactobacillus brevis, L, lycopersici, mannitopeus, L. pastorianus, Leuconostoc dextranicum и т. д.) при сбраживании глюкозы наряду с молочной кислотой образуют и летучие кислоты (например, уксусную кислоту), спирты (этанол, глицерин) и углекислоту; при сбраживании фруктозы синтезируется еще и маннит.
Механизм гетероферментативного молочнокислого брожения также вплоть до стадии образования пировиноградной кислоты аналогичен спиртовому брожению, но далее из пировиноградной кислоты образуется при восстановлении молочная кислота, при декарбоксилировании – ацетальдегид, а из него–этиловый спирт и уксусная кислота.
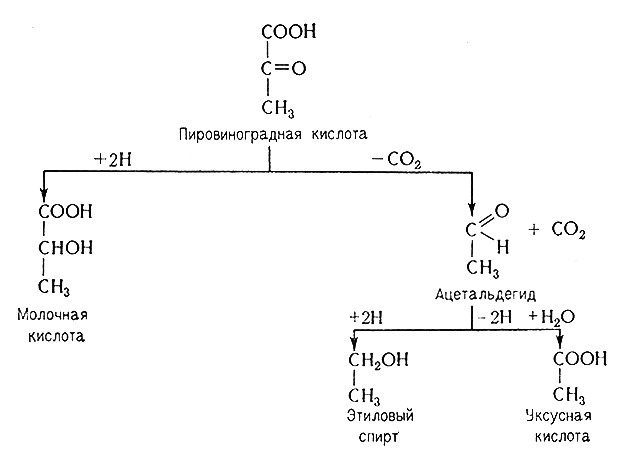
Механизм образования конечных продуктов гетероферментативного молочнокислого брожения зависит от вида микроорганизма. Так, например, L. brevis образует наряду с молочной кислотой еще и уксусную кислоту, глицерин и CO2, Leuconostoc dextranicum образует те же продукты, а фруктозу он сбраживает до маннита.
Молочная кислота может образовываться также непосредственно окислением глюкозы через глюконовую кислоту до рибулозы, которая далее расщепляется до молочной кислоты и этилового спирта.
Гетероферментативное молочнокислое брожение осуществляют также бактерии из вида Escherichia coli до следующих продуктов:
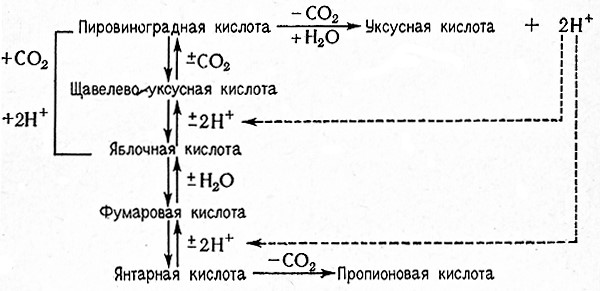
ПРОПИОНОВОКИСЛОЕ БРОЖЕНИЕ
Пропионовая кислота CH3CH2COOH образуется из харозы, мальтозы, лактозы, глюкозы, рафинозы, арабинозы (ксилозы, крахмала и т. п. под воздействием пропионовых бактерий, а именно: Propionibacterium freudenreichii, P. jensenii, P. shermanii, P. thoenii, P. petersonii, Р. rubrum» P. zeae, P raffinosaeeum, P. technicunl, P. arabinosuni) P. pentgsaceunl.
При пропионовокислом брожении указанных субстратов сначала происходит фиксация углекислоты и пировиноградная кислота превращается в щавелевоуксусную кислоту (реакция Вуда – Веркмана).
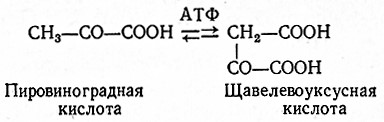
Щавелевоуксусная кислота в дальнейшем восстанавливается до яблочной кислоты; после отнятия воды образуется фумаровая кислота; ее восстановление дает янтарную кислоту, которая в свою очередь декарбоксилируется с образованием пропионовой кислоты.

Бактерии пропионовокислого брожения – это неподвижные, грамположительные палочки, не образующие спор. В анаэробных условиях они очень короткие, почти коккообразные, в аэробных условиях они удлиняются, а иногда и разветвляются. Оптимальная температура – от 14 до 30° С.
Для своего роста они нуждаются в органических азотистых веществах, причем лучше всего способствуют их росту белки.
Пропионовокислое брожение используется в сыроделии. При производстве пива этот процесс брожения не протекает.
МАСЛЯНОКИСЛОЕ БРОЖЕНИЕ
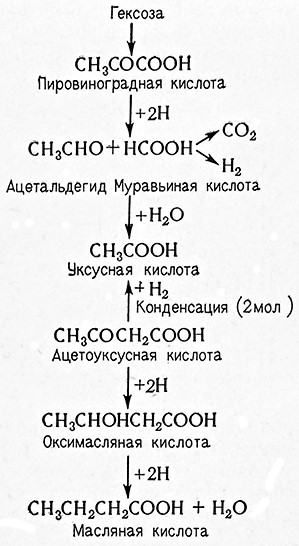
Масляная кислота СН3СН2СН2СООН образуется в качестве продукта обмена многих бактерий, главным образом рода Clostridium. Это типичный продукт анаэробного сбраживания Сахаров, целлюлозы, белков и т. д. Кроме масляной кислоты, эти бактерии накапливают бутиловый и этиловый спирты, ацетон, пропиловый спирт, уксусную, молочную, пропионовую, валериановую кислоты, углекислоту и водород.
Механизм маслянокислого брожения до стадии образования пировиноградной кислоты аналогичен механизму спиртового брожения. Затем этот процесс продолжается следующим образом:
Получение масляной кислоты методом брожения имеет лишь небольшое значение. Образование этой кислоты вредно там, где она накапливается вместо молочной кислоты, препятствующей развитию гнилостных бактерий (в силосе, квашеной капусте, соленых огурцах и т. п.). Маслянокислое брожение может также отрицательно влиять в пивоварении на процесс затирания солода. При превышении определенной концентрации масляной кислоты амилазы солода необратимо инактивируются. Для предотвращения образования масляной кислоты необходимо избегать оптимальной для этого брожения температуры (35–41 °С).
АЦЕТОНО-БУТИЛОВОЕ БРОЖЕНИЕ
Ацетоно-бутиловое брожение вызывается бактериями Clostridium acetobutylicum (Мак Кой, Петерсон и Гастинкс), Cl. butyricum (Празмовский) и др. Анаэробное расщепление глюкозы, катализируемое ферментными системами указанных бактерий, приводит к образованию уксусной и масляной кислот, бутилового спирта, ацетона, этилового спирта и ацетоина. Ацетоно-бутиловые бактерии содержат также амилазы и поэтому сбраживают не только сахара (мелассы), но и крахмалистые виды сырья.
Механизм этого брожения довольно сложен и детально еще не исследован. Главные его продукты, т. е. я-бутиловый спирт, ацетон и этиловый спирт, образуются при нормальном течении брожения из глюкозы в отношении 6:3:1. Газообразных продуктов (CO2,H2) образуется в полтора раза больше, чем главных продуктов. Наиболее продуктивные культуры образуют споры, стойкие к высоким температурам. Поэтому культуры улучшают пастеризацией при 100° C (от 30 с до 2 мин), ведущей к гибели вегетативных клеток и наименее устойчивых спор. В ацетоно-бутиловом брожении наблюдаются характерные фазы. В первой фазе – кислотной– быстро возрастает титруемая кислотность благодаря образованию уксусной и масляной кислот; максимум накопления кислот достигается за 13-17 ч. Выделяется большое количество газа, причем образуется примерно одинаковое количество углекислоты и водорода. Бактерии сильно размножаются.
Во второй фазе масляная кислота восстанавливается до бутилового спирта, а из уксусной кислоты образуется ацетон; кислотность падает примерно до половины максимального значения. Накопление газов достигает своего Максимума: соотношение СО2 : H2 = 2 : 1.
В третьей фазе выделение газов быстро прекращается, титруемая кислотность снова начинает медленно повышаться, а количество образовавшегося бутилового спирта и ацетона достигает своего максимума.
Оптимальная температура 37–42°С, поэтому необходимо принимать меры для ограничения потерь ацетона от выпаривания. Оптимальный рН процесса – от 5 до 7.
При использовании штаммов, родственных Cl. acetobutylicum и Cl. butyricum возможны разные варианты ацетоно-бутилового брожения.
Бутиловый спирт и ацетон – это ценные органические растворители, значение которых все возрастает.
ПАСТЕРОВСКАЯ РЕАКЦИЯ
Л. Пастер первый обнаружил, что кислород подавляет анаэробный гликолиз и усиливает аэробные процессы. В аэробных условиях Дрожжи сбраживают сахар (глюкозу) до этилового спирта в незначйтёльной степени и основным продуктом использования сахара является углекислота. Расход сахара меньше,.чем в анаэробных условиях. Таким образом, при доступе кислорода анаэробный гликолиз (брожение) сменяется аэробным дыханием.
Такое влияние кислорода на катаболический (диссимиляционный) процесс, характеризуемый пониженным расходом сахара и ограниченным накоплением продуктов анаэробного метаболизма, получило название пастеровской реакции (эффекта Пастера). Было установлено, что пастеровская реакция характерна не только для дрожжей, но и для многих других микроорганизмов. Она Также наблюдается при клеточном дыхании растительных и животных тканей.
Следовательно, эта реакция имеет общее значение.
Место пастеровской реакций в Механизме процессов, удовлетворяющих потребность живых_ кЛеток в энергий, ясно из схемы, изображенной йа стр. 143.
Превращение анаэробного обмена веществ в аэробный приводит к усилению во много раз синтеза аденозинтрифосфата (АТФ). В то ike время скорость распада АТФ и зависящего от него использования энергии макроэргических фосфатных связей существенно не изменяется. Необходимое равновесие между процессами фосфорилирования и дефосфорилирования поддерживается уменьшенным потреблением глюкозы.
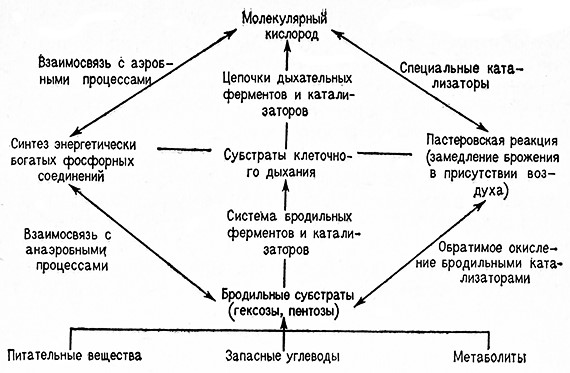
По мнению многих ученых, реакция Пастера управляется гипотетическим ферментом Пастера. Энгельгардт и Суков считают этот фермент идентичным фосфофруктокиназе.
Окисление этого фермента является причиной подавления спиртового брожения в аэробных условиях, так как окисленный фермент уже не способен катализировать образование фруктозодифосфата.
Пастеровскую реакцию подавляют некоторые яды ферментов, например 2,4-динитрофенол, азиды, некоторые антибиотики и т. п. В присутствии этих веществ в аэробных условиях дрожжи сбраживают глюкозу до этилового спирта и углекислоты.
Это объясняется тем, что эти яды разобщают окисление и фосфорилирование в дыхательной цепи, а тем самым препятствуют образованию макроэргических фосфатных связей.
По Мейергофу, пастеровская реакция характерна для всех живых организмов; различия носят только количественный характер. В растительных и животных клетках в анаэробных условиях аэробный метаболизм подавляетсяполностью. У некоторых же дрожжей и молочнокислых бактерий анаэробный метаболизм, наоборот, частично сохраняется и в аэробных условиях.
Считают, что аэробному расщеплению всегда предшествует анаэробный распад питательных веществ. Полностью ли прекращаются анаэробные превращения' при доступе кислорода или же частично сохраняются, – это зависит от способности системы окислительных ферментов клетки переносить отнятый дегидрогеназами водород на молекулярный кислород. Переход от брожения к дыханию (полное окисление) обеспечивает максимальное получение энергии. Из накопленных промежуточных продуктов анаэробного брожения при переходе на аэробный метаболизм на дыхание используется лишь часть, необходимая для получения энергии, т. е. для тех реакций, которые при этом обязательно должны протекать.
Большая же часть этих веществ (до 5/6) снова ассимилируется. Этим обеспечивается нужная экономичность и именно в этом заключается большое значение пасте-я ровской реакции.
Только нетипичные клетки, такие, например, как клетки культурных пивоваренных дрожжей, накапливают также и в присутствии кислорода продукты анаэробного метаболизма.
АЭРОБНЫЕ ПРОЦЕССЫ
Аэробные организмы расщепляют сахара в аэробных -условиях. Исходный субстрат окисляется при этом повторяющимися реакциями дегидрирования, которые чередуются с другими ферментативными реакциями, например реакциями присоединения воды, изомеризации и т. п. Отщепленные атомы водорода переносятся транспортными системами вплоть до кислорода воздуха, что сопровождается образованием аденозинтрифосфата (АТФ). При этом субстрат окисляется до конечного продукта, которым чаще всего бывает углекислота.
Многие аэробные процессы носят циклический характер, например цитратный цикл, глиоксилатный цикл, пентозный цикл, и они могут быть связаны с метаболитами анаэробного гликолиза или другими веществами.
ЦИТРАТНЫЙ ЦИКЛ
Цитратный цикл (цикл лимонной кислоты), или цикл трикарбоновых кислот, участвующих в некоторых отдельных реакциях, называемый также циклом Кребса, относится к основным процессам метаболизма. Это – общий способ, с помощью которого различные животные и растительные клетки и клетки микроорганизмов получают энергию и вещества, необходимые для их жизни. В цитратном цикле участвуют все питательные вещества, т. е. не только сахара, но и липиды и азотистые вещества.
Центральным веществом цитратного цикла является пировиноградная кислота, которая полностью окисляется до углекислоты и воды:
CH3-CO-COOH + 5О=ЗСО2 + 2Н2О.
Цитратный цикл изображен на рис. 13. Перечень ферментов цитратного цикла приведен в табл. 9.
Цикл начинается с аэробного декарбоксилирования пировиноградной кислоты с образованием активной уксусной кислоты или кофермента A (KoA). Пировиноградная кислота сначала присоединяется к тиаминпирофосфату ТПФ (коферменту пируватдекарбоксилазы), при этом образуется «активная пировиноградная кислота», иначе называемая 2(α-окси-α-карбоксиэтил)-тиаминпирофосфат. Активная пировиноградная кислота затем декарбоксилируется до «активного ацетальдегида», т. е. 2 (оксиэтил)-тиаминпирофосфата, при расщеплении которого образуется ТПФ и ацетальдегид.
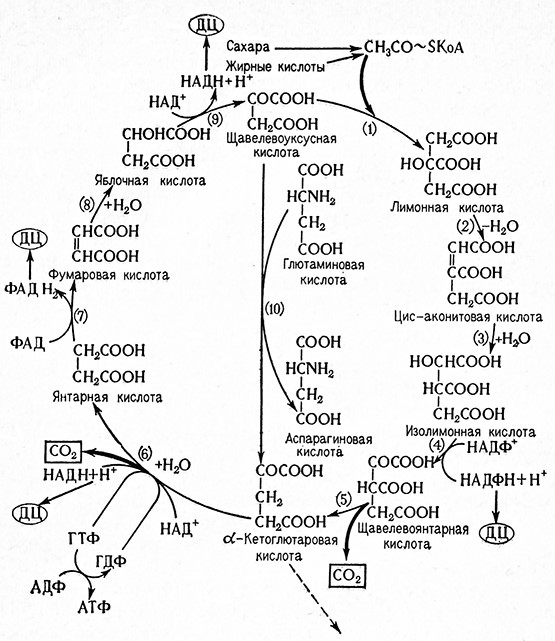
Рис. 13. Схема цитратного цикла (И. Коштир):
ДЦ – дыхательные цепи; ГДФ – гуанозиндифосфат; ГТФ – гуанозинтрифосфат; ΦАД – флавинадениндинуклеотид; ФАДН – дегидрофлавинадениннуклеотид; 1 – цитрат-синтаза; 2,3 – аконитат-гидратаза; 4,5 – озоцитратдегидрогеназа; 6 – оксоглютарат-дегидрогеназа; 7 – сукцинатдегидрогеназа; 8 – фумарат-гидратаза; 9 – малатдегидрогеназа; 10 – аспартат-аминотрансфераза.
Таблица 9

Взаимодействие активного ацетальдегида с окисленной липоевой кислотой, являющейся коферментом соответствующей пируватоксидазы, приводит к образованию S-ацетиллипоевой кислоты. При этом происходит разрыв дисуль-, фидной связи S–S в молекуле липоевой кислоты и возникновение связи –SH. Освобождающийся при этой реакции тиаминпирофосфат может дальше реагировать с другими молекулами пировиноградной кислоты, а ацетиллипоевая кислота взаимодействует с KoA с образованием ацетил-КоА (CH3CO~S–KoA) и дигидролипоевой кислоты.
Ацетил-KoA может образовываться также путем расщепления жирных кислот, путем активирования свободной уксусной кислоты под действием АТФ (по всей вероятности, через аденилацетат) из ацетилфосфата и ацетальдегида через промежуточные продукты.
После образования ацетил-KoA реакции цикла Кребса проходят в следующей последовательности:
1. Ацетил-КоА конденсируется с оксалоацетатом с образованием цитрата, являющегося первым продуктом цикла. Реакцию катализирует так называемый конденсирующий фермент трикарбоновых кислот по Штерну и Oxoa (цитратоксалоацетат-лиаза, 4.1.3.7).
2-3. Цитрат изомеризуется до изоцитрата через цисаконитовую кислоту. В результате отнятия воды от цитрата образуется сначала цис-аконитовая кислота, а из нее после присоединения молекулы воды, гидроксил которой присоединяется в другом месте, образуется изоцитрат. Катализирующим ферментом является аконитатгидратаза [цитрат (изоцитрат)-гидро-лиаза, 4.2.1.3]; одновременно ката-лизируются обратимые превращения указанных компонент тов. При установившемся равновесии 90% приходится на цитрат, 8% – на изоцитрат и 2% – на аконитовую кислоту.
4-5. Изоцитрат дегидрируется и декарбоксилируется до α-кетоглютарата. В результате дегидрирования образуется сначала нестойкий оксалосукцинат, который в присутствии ионов марганца декарбоксилируется далее в β-положении до α-кетоглютарата. Реакцию катализирует изоцитратдегидрогеназа двух типов, а именно, по Граффлину и Oxoa, трео-D-изоцитрат : НАД оксидоредуктаза, 1.1.1.41 и Tgeo-Dизоцитрат: НАДФ-оксидоредуктаза, 1.1.1.42.
6. Окислительное декарбоксилирование α-кетоглютарата, в результате которого образуется янтарная кислота, катализирует также система ферментов, а именно 2-оксоглютарат: липоатоксидоредуктаза, 1.2.4.2; ацетил-КоА: 2-амино2-дезокси-D-глюкозо-6-фосфат-N-ацетилтрансфераза,2.3.1.4; НАДН2: липоамид-оксидоредуктаза, 1.6.4.3 (диафораза); сукцинат: КоА-лигаза (ГДФ), 6.2.1.4 и АТФ: нуклеозиддифосфатфосфотрансфераза, 2.7.4.6. При этом сукцинат образуется не непосредственно, как считали раньше, а через сукцинил-КоА. Его превращение в сукцинат связано с фосфорилированием; при этом первичным акцептором фосфорной кислоты является гуанозиндифосфат (ГДФ), из которого образуется гуанозинтрифосфат (ГТФ). Последний может вторично превратиться снова в ГДФ под действием АДФ, из которого при этом образуется АТФ.
7. Окисление сукцината до фумарата катализирует дегидрогеназа янтарной кислоты, иначе называемая сукцинатдегидрогеназой [сукцинат: (акцептор)-оксидоредуктаза, 1.3.99.1], коферментом которой является ФАД, который переходит в ФАДН2.
8. Следующую реакцию – превращение фумдрата в малат – катализирует фумаратгидратаза, раньше называвшаяся фумаразой (L-малат-гидро-лиаза, 4.2.1.2).
9. L-Малат в конечном итоге дегидрируется до оксалоацетата. Реакцию катализирует малатдегидрогеназа (L-малат: НАД-оксидоредуктаза, 1.1.1.37). Эта реакция завершает цикл.
За один оборот цитратного цикла одна молекула уксусной кислоты полностью окисляется с образованием 2 молекул CO2, выделяемых в результате двух реакций декарбоксилирования; в этом заключается принцип цитратного цикла. Процесс можно выразить следующим Суммарным уравнением:
CH3COOH + 2Н2О=2СО2 + 2Н2О + энергия.
Свободная энергия этой реакции составляет 121,5 Дж. Живые организмы получают энергию в форме образовавшейся АТФ с помощью реакций дыхательной цепи (т. е. переноса водорода и электронов на кислород) и окислительного фосфорилирования. Связь между цитратным циклом и дыхательной цепью показана на рис. 13.
Из энергетического баланса следует, что цитратный цикл является важным метаболическим процессом, с помощью которого путем расщепления Сахаров, а также многих других веществ организмы получают значительную часть свободной энергии.
Существование цикла лимонной кислоты (цитратного цикла) было непосредственно доказано для метаболизма дрожжей; это дает основание полагать, что расщепление запасных веществ при прорастании ячменя проходит в соответствии с цитратным циклом.
ГЛИОКСИЛАТНЫЙ ЦИКЛ
Глиоксилатный цикл (цикл глиоксилевой кислоты, малат-изоцитратный цикл, первоначально называвшийся циклом Виланда и Тюнберга) представляет собой вариант цитратного цикла, существование которого удалось доказать, для метаболизма различных микроорганизмов и высших растений. Характерным продуктом этого цикла является глиоксилевая кислота, образующаяся при разложении Tpeo-D-изолимонной кислоты; катализирует эту реакцию изоцитрйт-лиаза (трео-О-изоцитратглиоксилат-лиаза, 4.1.3.1);
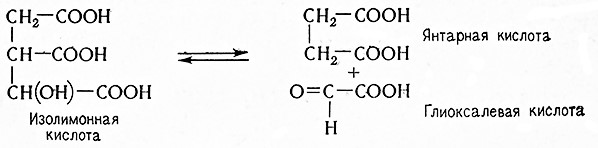
Цикл начинается с этой реакции, затем идет конденсация глиоксилевой кислоты с ацетил-КоА, катализируемая малат-синтазой (L-малат-глиоксилат-лиаза, 4.1.3.2). В результате конденсации образуется яблочная кислота:
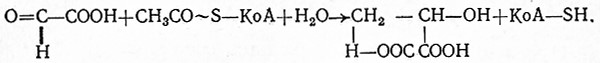
Обе указанные реакции протекают в начальной стадии цитратного цикла, но являются частью и глиоксилатного цикла, весь ход которого изображен на рис. 14. Перечень ферментов глиоксилатного цикла приведен в табл. 10.
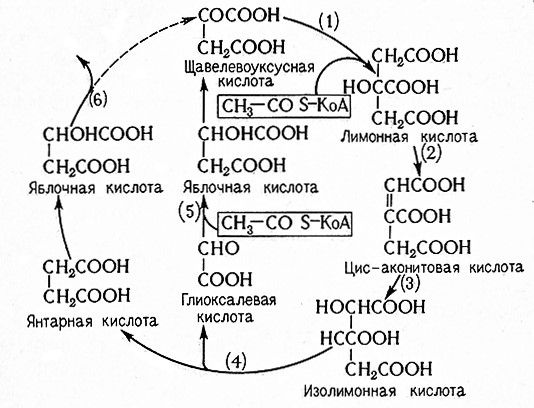
Рис. 14. Схема глиоксилатного цикла:
1– цитрат-синтаза; 2,3 – аконитат-гидратаза; 4 – изоцитрат-лиаза; 5 – малат-синтаза; 6 – малатдегидрогеназа.
Таблица 10

При одном обороте глиоксилатного цикла вступают в реакцию две молекулы ацетил-КоА и образуется молекула янтарной кислоты. Процесс можно выразить суммарным уравнением
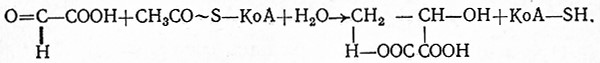
Янтарная кислота подвергается в организме дальнейшим превращениям. Например, в цитратном цикле она превращается в щавелевоуксусную кислоту и потом реагирует с ацетил-KoA.
Считают, что глиоксилатиый цикл участвует в накоплении лимонной кислоты при лимоннокислом брожении.
ПЕНТОЗОФОСФАТНЫЙ ЦИКЛ
Наряду с анаэробным гликолизом – основным способом, с помощью которого организмы получают энергию из Сахаров, – существует способ непосредственного окисления Сахаров (аэробный гликолиз). Это – циклический процесс, в котором важную роль играют пентозы, названный пентозофосфатным циклом (рис. 15). Перечень ферментов пентозофосфатного цикла приведен в табл. 11. Этот процесс подробно освещен в работах Горекера, Диккенса, Варбурга и Липмана. Глюкоза в этом цикле аэробно расщепляется до CO2. На одной из фаз цикла образуется сахар рибоза с пятью атомами углерода, имеющий существенное значение для синтеза многих коферментов, например АТФ, НАД, ФАД и т. д.
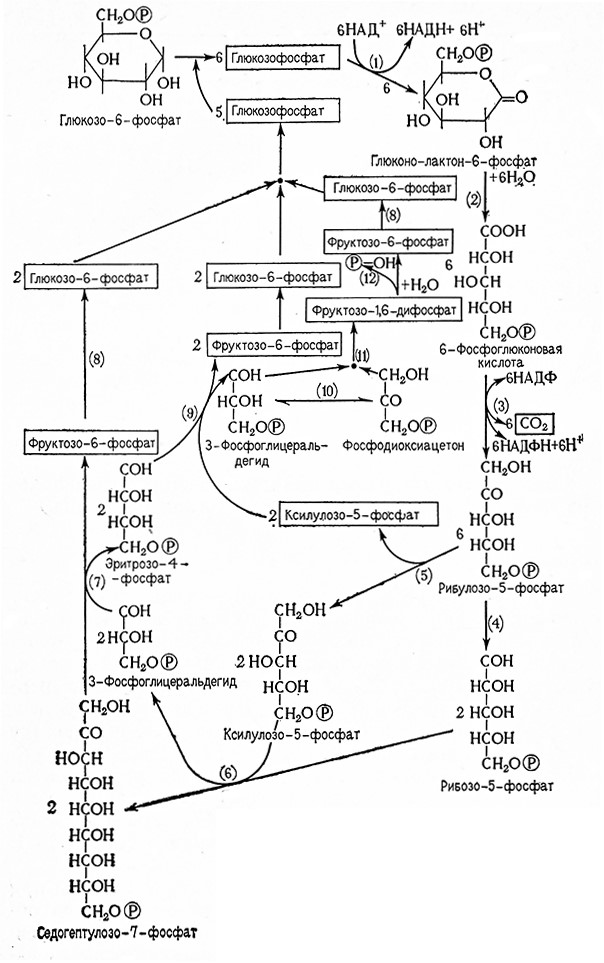
Рис. 15. Схема пентозофосфатного цикла (ферменты, позиции в скобках):
1 – глюкозо-6-фосфат-дегидрогеназа; 2 – глюконолактоназа; 3 – фосфоглюконатдегидрогеназа;
4 – рибозофосфатизомераза; 5 – рибулозофосфатэпимераза; 6 – транскетолаза;
7 – трансальдолаза; 8 – глюкозофосфатизомераза; 9 –фосфофруктокиназа;
10 – триозофосфат-изомераза; 11 – альдолаза; 12 – фосфофруктокиназа.
Таблица 11

Процесс протекает в две стадии. На первой стадии при окислении и декарбоксилировании глюкозо-6-фосфатов образуются пентозофосфаты, которые на второй стадии превращаются в гексозофосфаты (через реакции, катализируемые главным образом транскетолазой и трансальдолазой).
Дегидрирование D-глюкозофосфата протекает постепенно. В результате реакции, катализируемой глюкозо-6-фосфат-дегидрогеназой (D-глюкозо-6-фосфат: НАДФ-оксидоредуктазой, 1.1.1.49), получается при участии НАДФ+ сначала 0-глюкозо-1,4-лактон-6-фосфат (фосфоглюконолактон), который легко ферментативно гидролизуется под воздействием лактоназы (D-глюконо- δ-лактон-гидролазы, 3.1.1.17) до 6-фосфоглюконовой кислоты. Во второй реакции, катализируемой 6-фосфо-глюконат: НАДФ-оксидоредуктазой, 1.1.1.43, образуется D-рибулозо-6-фосфат; промежуточным продуктом считается З-кето-6-фосфо-D-глюконовая кислота.
Образующийся D-рибулозо-5-фосфат затем изомеризуется, причем как с помощью рибозофосфатизомеразы (D-рибозо-5-фосфат-кетол-изомеразы, 5.3.1.6.) до D-рибозо-5фосфата, так и под действием рибулозофосфат-3-эпимеразы (D-рибулозо-5-фосфат-3-эпимеразы, 5.1.3.1) до D-ксилулозо-5-фосфата.
На второй стадии при одновременном участии транскетолазы (седогептулозо-7-фосфат: D-глицеральдегид-З-фосфатгликольальдегидтрансферазы, 2.2.1.1) и трансальдолазы (седогептулозо-7-фосфат: D-глицеральдегид-З-фосфат-диоксиацетонтрансферазы, 2.2.1.2) через D-седогептулозо-7-фосфат и D-эритрозо-4-фосфат образуются гексозофосфаты. Согласно схеме из трех молекул D-рибулозо-5-фосфата образуются две молекулы D-фруктозо-6-фосфата и одна молекула D-глицеральдегид-З-фосфата. При изомеризации, катализируемой глюкозофосфатизомеразой (D-глюкозо-б-фосфат-кетол-изомеразой, 5.3,1.9), D-фруктозо-6-фосфат переходит в D-глюкозо-6-фосфат, при этом регенерируется исходный субстрат цикла. D-Глицеральдегид-З-фосфат также изомеризуется под воздействием триозофосфатизомеразы (D-глицеральдегид-З-фосфат-кетол-изомеразы, 5.3.1.1) до диоксиацетонфосфата. Благодаря действию альдолазы (фруктозо-1,6-дифосфат-D-глицеральдегид-З-фосфат-лиазы, 4.1.2.13) из этих триозофосфатов образуется D-фруктозо-1,6-дифосфат, а из него под действием гидролаз фосфодиэфиров образуется (3.1.4) D-фруктозо-6-фосфат и при последующей изомеризации – D-глюкозо-6-фосфат, т. е. опять получается исходный субстрат цикла. При этой реакции образуется эритрозо-4-фосфат, который далее реагирует с ксилулозо-5-фосфатом с образованием фруктозо-6фосфата и глицеральдегид-3-фосфата.
Зa один οбοрот цикла из шести молекул гексозофосфата одна молекула окисляется, а остальные пять молекул регенерируются для следующего оборота пентозофосфатного цикла.
В состав выделяющейся CO2 входит атом C1 глюкозы.
Установлено, что основное значение пентозофосфатного цикла заключается не в непосредственном получении энергии в форме АТФ, а в накоплении НАДФН2, который в организмах действует в качестве восстанавливающего реагента во многих синтетических процессах.
Другая функция этого цикла заключается в образовании пентоз, входящих в состав нуклеотидов и нуклеиновых кислот или рибулозо-5-фосфата, который после превращения в рибудозо-1,5-дифосфат является акцептором CO2 при фотосинтезе.
УКСУСНОКИСЛОЕ БРОЖЕНИЕ
Уксуснокислое брожение – это аэробный процесс, осуществляемый уксусными бактериями (Acetobacter из семейства Pseudomonadaceae). Эти бактерии представляют собой в большинстве случаев короткие палочки, они грамотрицательны, развиваются только в аэробных условиях.
Геннеберг подразделяет их на следующие четыре группы:
1. Бактерии солодового сусла, которые не растут в пиве, так как они не выдерживают антисептического действия веществ хмеля. Acetobacter oxidans Henneberg образуют тонкую, легкораспадающуюся пленку, поднимающуюся по стенкам сосуда; эти бактерии вырабатывают небольшое количество уксусной кислоты. Они растут при концентрации спирта не выше 7%, оптимальная температура 20°С. A. suboxidans Kluyver u Leen имеют температурный оптимум 30°С.
На агаре с глюкозой и CaCO3 эти бактерии образуют кристаллы кетоглюконата кальция.
2. Πивные бактерии, которые накапливают до 6,6% уксусной кислоты и растут при концентрации спирта 9–13%; оптимальная температура лежит в пределах 28–34°С. Образуют кожистую пленку, которая не всползает по стенкам. A. acetosum Henneberg образуют кожистую пленку, позднее становящуюся морщинистой, прочную, слабо всползающую пο стенкам. A. kutzingianuftl Hanseii образуют тонкую кожистую пленку, которая легко распадается, она всползает по стенкам. A. pasteurianum Hansen образуют толстую, шероховатую прочную пленку, которая не всползает по стенкам. A. rancens Beijerink образуют сухую, шероховатую прочную пленку, которая не всползает по стенкам. Thermobacterium aceti Leidler образуют непрочную, тонкую пленку, всползающую по стенкам.
3. Винные бактерии образуют от 7,5 до 9% уксусной кислоты, растут при концентрации спирта до 12%. Типичным представителем этой группы является A. orIeanense Henneberg, образующий тонкую, шелковистую прочную и невсползающую пленку. Эти бактерии используются при производстве винного уксуса французским (орлеанским) методом.
Другими видами винных бактерий являются, например, A. xylinoides Henneberg, A. vini acetati Henneberg, А. ascendens Henneberg.
4. Спиртовые бактерии вырабатывают 11–12% уксусной кислоты; их температурный оптимум лежит между 27 и 33°С. Их типичным представителем, который используется при спиртовом (быстром) производстве уксуса, является A. schiitzenbachii Henneberg. Эти бактерии образуют легкораспадающуюся пленку.
Пивные уксусные бактерии на пивоваренном заводе могут оказаться инфекцией лишь там, где остатки пива долго соприкасаются с воздухом. Готовое пиво в хорошо закрытых сосудах обычно не инфицируется уксуснокислыми бактериями.
Уксуснокислые бактерии окисляют этиловый спирт до уксусной кислоты. Однако они способны окислять и ряд Сахаров, спиртов и кислот либо до веществ, еще энергетически богатых, подобных промежуточным продуктам дыхания, либо вплоть до CO2 и H2O. Это биологическое окисление катализируют дыхательные ферменты, которые переносят водород последовательно до молекулярного кислорода.
При окислении этилового спирта до уксусной кислоты спирт сперва дегидрируется до ацетальдегида, который после присоединения воды переходит в. гидрат уксусного альдегида.
Дегидрирование Этого соединения приводит к образованию уксусной кислоты.
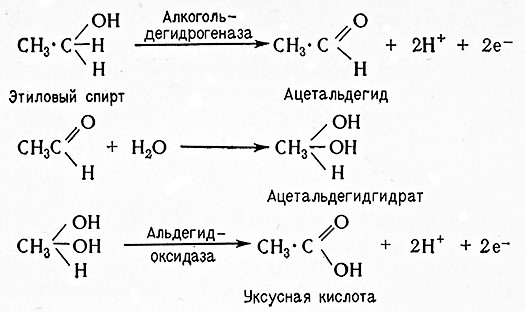
Суммарная реакция:
CH3 • CH2OH + O2=CH3COOH + H2O.
Производство уксусной кислоты (уксуса) является давно известным процессом, имеющим важное промышленное значение. Промышленное значение имеют также процессы окисления глицерина до диоксиацетона и дегидрирование сорбита до сорбозы.
ЛИМОННОКИСЛОЕ БРОЖЕНИЕ
Образование лимонной кислоты COOH–CH2–C(OH)– –COOH-CH2–COOH в качестве продукта впервые было установлено Вемером в 1893 г. В ЧССР лимонную кислоту вырабатывают в промышленном масштабе методом брожения из мелассы с 1929 г. Для проведения брожения используется штамм Aspergillusniger. Процесс протекает в кислой среде, содержащей от 15 до 20% сахара (сахарозы) и питательные соли. Оптимальная температура процесса колеблется в зависимости от используемого штамма бактерий от 25 до 35°С.
Окисление Сахаров до лимонной кислоты является довольно сложным процессом. Oxoa (1951) обнаружил, что лимонная кислота образуется в результате конденсации ацетил-КоА с щавелевоуксусной кислотой в цитратном цикле. Постепенно выяснилось, что при брожении лимонная кислота образуется благодаря реакции конденсации C4 – двухосновной кислоты с C2 – одноосновной кислотой.
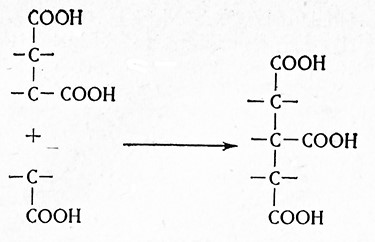
Из гексоз сначала образуются различные промежуточные продукты, из которых для проведения реакцийконденсации имеют значение из C4 – двухосновных кислот – щавелевоуксусная, яблочная и янтарная, а из C2 – одноосновных кислот – уксусная и гликолевая кислоты.
Суммарное уравнение лимоннокислого брожения имеет вид
2С6Н12О6 + ЗО2 → 2C6H8О7 + 4Н2О.
При промышленном получении лимонной кислоты лучшие результаты были достигнуты применением разных штаммов Aspergillus niger. Эти микроорганизмы дают высокий Выход основного продукта, имеют постоянные биохимические свойства, легко культивируются и образуют лишь небольшое количество нежелательных побочных продуктов.
Лимонная кислота широко используется в пищевой, фармацевтической и химической промышленности.
ФОТОСИНТЕЗ
В зеленых растениях, содержащих хлорофилл, из углекислоты, находящейся в воздухе (в среднем 0,3%), воды и минеральных веществ из почвы образуются новые вещества. Синтез Сахаров из углекислоты и воды осуществляется под воздействием солнечного света в результате анаболических (ассимиляционных) процессов. Поэтому этот процесс называют фотосинтезом. Его можно выразить следующим суммарным уравнением:
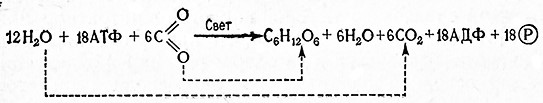
Имеет значение тот факт, что молекулярный кислород, выделяемый при фотосинтезе, образуется не из ассимилированной CO2, а из воды. Свет абсорбируется хлорофиллом, содержащимся в хлоропластах, и превращается в энергию химической связи (Р. Хилл, 1947).
Эта способность зеленых растений является основой фотосинтеза. >
При фотосинтетических процессах важную роль играет хлорофилл. Этот пигмент в растениях локализуется в хлоропластах, состоящих из зеленых гранул. Их пластинчатая (ламеллярная) структура обеспечивает быстрый перенос лучистой энергии, поглощенной молекулами в поверхностном слое. Энергию передают пластинки хлорофилла из активных центров молекулам липоевой кислоты, накапливающейся на поверхности зеленых гранул и выполняющей важную функцию переносчика атомов водорода при фотосинтезе.
По Арнону, при фотосинтезе протекают три взаимосвязанных процесса, а Именно: фотосинтетическое фосфорилирование, при котором образуются макроэргические связи фосфорной кислоты в форме АТФ, далее распад воды на водород и кислород (фотолиз – при этом распаде образуются восстановительные эквиваленты в форме НАДФ с выделением молекулярного кислорода) и связывание (фиксация) углекислоты с образованием Сахаров. Для фотосинтеза необходимо, чтобы фотофосфорилирование находилось с фотолизом в таком равновесном состоянии, чтобы соотношение АТФ: НАДФН поддерживалось равным 3:2. По Арнону, существует два типа фотосинтетического фосфорилирования – циклический и нециклический.
При циклическом фосфорилировании энергия солнечного излучения превращается в химическую энергию в форме макроэргических связей АТФ. Этот процесс цикличен и характеризуется переносом электронов, освобожденных из возбужденных молекул хлорофилла. Считают, что этот процесс протекает во всех организмах, способных к фотосинтезу. В переносе электронов участвуют ферродоксин (белок, содержащий связанное Fe), пластохинон (аналог убихинона) и цитохромная система, главным образом цитохромы f и b6. Нециклическое фосфорилирование является более сложным механизмом образования АТФ, связанным с восстановлением НАДФ и может быть выражено зависимостью
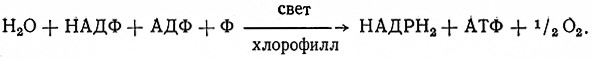
Так протекает нециклическое фосфорилирование у некоторых бактерий, которые при фотосинтезе не выделяют кислород. У высших растений донором водорода (электронов) является вода. В данном случае речь идет об окислении ионов ОН– при абсорбции световой энергии в присутствии хлорофилла 6, который отнимает с помощью системы цитохромов электроны от ионов ОН–, так что образуется вода и молекулярный кислород.
Фосфорилирование, связанное у высших растений с фотолизом, является основой так называемой «световой» фазы фотосинтеза, так как оно протекает только при одновременной абсорбции световой энергии. Следующую фазу фотосинтеза, т. е. стадию фиксации и восстановления CO2, называют «темновой» фазой; она не зависит непосредственно от абсорбции световой энергии и протекает далее и без света, если при этом не потребляется НАДФН2 и АТФ, аккумулированные в «световой» фазе.
Фиксация CO2 – это, по существу, восстановительное карбоксилирование, которое протекает в цикле Кальвина. В этом цикле CO2 присоединяется к D-рибулозо-1,5-дифосфату, из которого через пока еще неизвестные промежуточные продукты образуется З-фосфо-D-глицериновая кислота. Реакцию катализирует рибулозодифосфаткарбоксилаза (З-фосфо-D-глицерат-карбокси-лиаза, 4.1.1.39). Далее 3-фосфо-D-глицериновая кислота фосфорилируется до 1,3-дифосфо-D-глицериновой кислоты, которая затем с участием НАДФН восстанавливается до D-глицеральдегид-З-фосфата. Первую из этих реакций катализирует фосфоглицераткиназа (АТФ: 3-фосфо-D-глицерат-1-фосфотрансфераза, 2. 7.2.3), а вторую реакцию – триозофосфат дегидрогеназа (D-глицеральдегид-З-фосфат: НАДФ оксидоредуктаза, 1.2.1.13).
Остальные ферменты фотосинтетического цикла Кальвина сходны с ферментами, участвующими в анаэробном и аэробном гликолизе.
Схема образования Сахаров при фотосинтезе приведена на рис. 16. В цикле Кальвина три молекулы D-рибулозо-1,5-дифосфата фиксируют три молекулы углекислоты. Получается шесть молекул триозофосфата; при этом из пяти молекул триозофосфата всегда циклически регенерируются три молекулы D-рибулозо-1,5-дифосфата. Так при каждом обороте цикла получается одна молекула триозофосфата, как это видно из суммарного уравнения восстановления углекислоты:
ЗСО2 + 9АТФ + 6НАДФН2 + 5Н2O → триозофосфат +9АДФ + 8 Φ + 6 НАДФ.
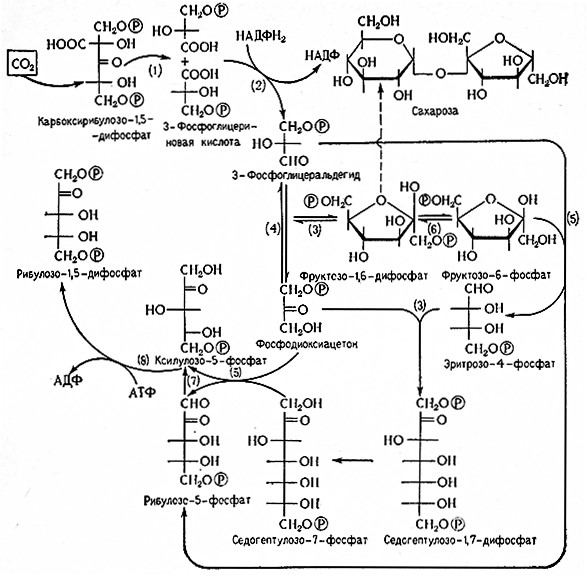
Рис. 16. Схема образования сахаров при фотосинтозе
В некоторых условиях эта молекула триозофосфата может вместе с другими молекулами участвовать в синтетических реакциях, при которых образуются моносахариды, дисахариды и полисахариды.
При одном обороте цикла расходуется всего 9 молекул АТФ и 6 молекул НАДФН + H+; это соответствует указанному выше соотношению 3:2.
технологические аспекты анаэробных и аэробных процессов
Связь между анаэробными процессами, т. е. брожением (гликолизом), и аэробными процессами, т. е. дыханием, схематически изображена на рис. 17.
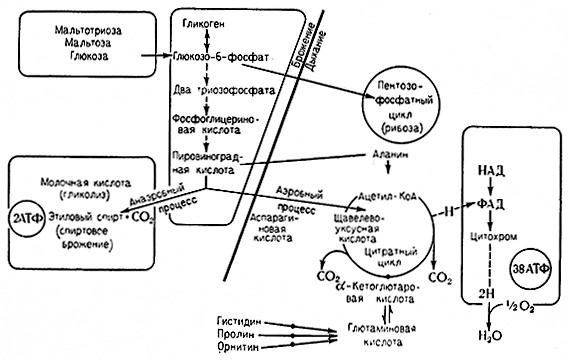
Рис. 17. Схема взаимосвязи процессов брожения и дыхания.
Существенное различие между этими процессами заключается в том, что при расщеплении одной молекулы глюкозы в анаэробных условиях брожения образуется только две молекулы АТФ, тогда как в аэробных условиях образуется 38 молекул АТФ. Кроме того, аэробное расщепление глюкозы в цитратном цикле связано с метаболизмом аминокислот через α-кетоглютаровую кислоту. Последняя связана с глютаминовой кислотой, которая в свою очередь – с аминокислотами гистидином, пролином и орнитином. Щавелевоуксусная кислота может перейти в аспарагиновую кислоту, и наоборот. Алании представляет собой соединительный мостик между пируватом и ацетил-КоА. Из самых распространенных аминокислот (9 из 18) имеют непосредственное или косвенное отношение к цитратному циклу. И наконец, глюкоза может через глюкозо-6-фосфат прямым окислением в пентозном цикле· образовывать рибозу, являющуюся важным компонентом нуклеиновых кислот и нук-леотидных коферментов. При аэробном обмене веществ, следовательно, значительно шире и многостороннее возможности обмена веществ, чем при анаэробном.
В технологическом процессе пивоварения брожение и дыхание определяют прорастание ячменя в солодовне, синтез ферментов, а также влияют в связи с аэрированием сусла на размножение дрожжей и течение процесса брожения.
Уже давно известна тесная связь между поступлением кислорода и активностью замоченного ячменя. Вейт и Клаусхофер установили, что для синтеза α-амилазы и эндопептидазы необходимы аэробные условия, тогда как синтез β-амилазы в меньшей степени зависит от поступления кислорода. Как только кислород, содержащийся в замочной воде, будет израсходован, необходимо производить искусственное продувание. В ячмене с высокой энергией прорастания и при достаточной подаче кислорода может начаться слабое спиртовое брожение, при этом внутри зерен будет накапливаться этиловый спирт, замедляющий жизнедеятельность зерна. Поэтому необходимо ускорить образование ферментов, чтобы ячмень быстрее перешел в стадию наклевывания и через открытые оболочки зерна мог выходить накопившийся этиловый спирт. При усиленном обмене веществ увеличивается также содержание углекислоты, которая тоже замедляет прорастание и поэтому должна отводиться.
Тесная взаимосвязь существует и между интенсивностью дыхания и ростом корешков. В процессе деления клеток происходит удвоение генетического материала дезоксирибонуклеиновой кислоты (ДНК) и синтез рибонуклеиновой кислоты (РНК). Морфологическую и биохимическую дифференциацию отдельных клеток обусловливают специфические синтезы белков.
Организм получает энергию для синтеза рибонуклеиновых кислот, активирования аминокислот и синтеза белков путем дыхания и окислительного фосфорилирований? Поэтому замочка ячменя является процессом, при котором должно быть обеспечено рациональное снабжение кислородом. По Чапону, для построения клеток необходим мощный аэробный обмен веществ. Расщепление путем брожения менее эффективно и для роста -клеток нерационально.
Процесс спиртового брожения при получении пива, как правило, ускоряет интенсивная аэрация сусла перед задачей дрожжей, что обеспечивает сбраживание большего количества экстракта за единицу времени. Биохимическое и технологическое влияние рационального или недостаточного аэрирования сусла проявляется количественно повышением или понижением физиологической активности дрожжей. При достаточном поступлении кислорода дрожжевая клетка имеет в своем распоряжении много энергии. Сахара сусла активно транспортируются тогда внутрь клеток. Быстрее протекает индуцирование ферментов и вовлечение веществ в обмен. Кислород как поставщик энергии весьма облегчает разбраживание. Кроме того, при аэрировании сусла, главным образом на стадии размножения дрожжей, малоактивные, постепенно оседающие дрожжевые, клетки снова поднимаются пузырьками воздуха. Дрожжи более длительное время остаются во взвешенном состоянии, что способствует тесному контакту с субстратом. Обмен веществ протекает более интенсивно, в результате чего сокращается фаза разбраживания.
Наряду с положительным влиянием на сбраживание экстракта аэрирование сусла влияет и на размножение дрожжей. Прирост дрожжей, а следовательно, и их выход возрастают. Для роста и размножения пивоваренных дрожжей кислород необходим, так как требуемую им энергию клетки получают путем дыхания и окислительного фосфорилирования. Это вызывает безусловную необходимость дыхательного обмена веществ в определенных пределах. Без энергии, получаемой дыханием, постепенно уменьшается жизнеспособность дрожжей, ослабляется их физиологическая активность и замедляются технологические процессы. Считают, что энергия, получаемая дыханием и брожением, неравноценна в физиологическом отношении; энергия, получаемая брожением, не способна обеспечить размножение клеток.
Таким образом, некоторая степень аэрации полезна для дрожжей. Она повышает их жизнеспособности размножение и бродильную энергию. Тем не менее чрезмерная, особенно запоздалая, аэрация вредна, так как она способствует образованию диацетила и ацетоина, которые в дальнейшем не могут быть расщеплены. И качество пива снижается из-за окислительных процессов. Поэтому необходимо всегда степень аэрации определять с точки зрения обеспечения нужного качества готового пива.

