Генетическая рекомбинация заключается в обмене генами между двумя хромосомами. По определению, данному Понтекорво в 1958 г., рекомбинация - это любой процесс, способный привести к возникновению клеток или организмов с двумя или более наследственными детерминантами, по которым их родители различались между собой и которые соединены новым способом. Такая рекомбинация обязательно происходит у млекопитающих при образовании половых клеток. В ходе мейоза гомологичные хромосомы обмениваются генами (так называемый кроссинговер); именно эти обмены позволяют объяснить перетасовку наследственных признаков в ряду поколений. У вирусов и бактерий генетическая рекомбинация происходит реже, чем у животных. Обмен генетическим материалом, за которым следует рекомбинация, происходит между организмами одного и того же или близких видов. Все живые организмы обладают рестрикционными эндонуклеазами, которые узнают чужеродную ДНК, проникшую в организм, и расщепляют ее, таким образом сводя на нет генетическую рекомбинацию между эволюционно удаленными геномами.
Генетическая рекомбинация in vitro
Обмен генами, равно как и введение в клетку гена, принадлежащего другому виду, можно осуществить посредством генетической рекомбинации in vitro. Этот подход был разработан на бактериях, в частности на кишечной палочке, в клетки которой вводили гены животных и человека и добивались их репликации.
Метод рекомбинации iп vitro заключается в выделении ДНК из разных видов, получении гибридных молекул ДНК и введении рекомбинантных молекул в живые клетки с тем, чтобы добиться проявления нового признака, например синтеза специфического белка (рис. 1).
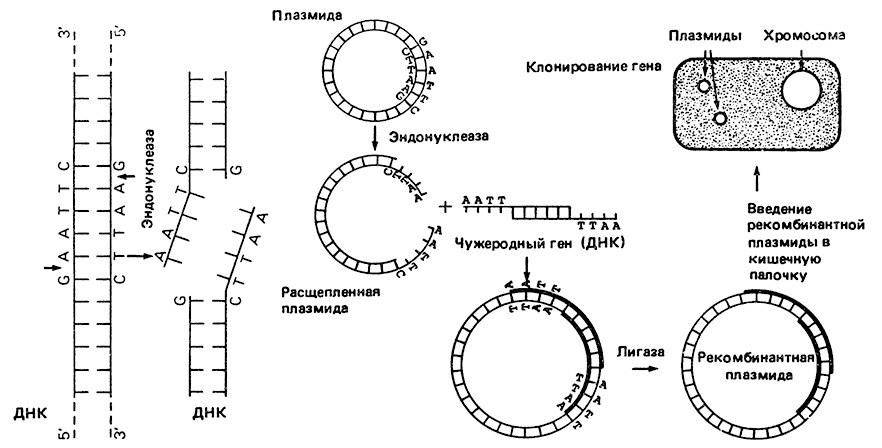
Рис. 1. Введение гена в плазмиду Escherichia coli и клонирование этого гена в клетках кишечной палочки.
Плазмида Escherichia coli расщепляется рестрикционной эндонуклеазой в специфическом участке в обеих цепях ДНК, так что на концах расщепленной плазмиды располагаются короткие неспаренные последовательности дезоксирибонуклеотидов (ТТАА или ААТТ, т. е. по четыре нуклеотида, в которых основания представлены тимином и аденином).
Ген, который нужно встроить в плазмиду, выщепляют с помощью этого же фермента рестрикции, так что его концы являются комплементарными нуклеотидными последовательностям на концах плазмиды (ААТТ и ТТАА).
Обе ДНК (гена и плазмиды) сшивают вместе с помощью лигазы. Затем гибридную, или рекомбинантную, плазмиду вводят в клетку Е. coli, которая, размножаясь, образует клон, все клетки которого содержат рекомбинантную плазмиду, а поэтому и чужеродный ген. Последний теперь клонирован в клетках кишечной палочки и индуцирует в ней синтез специфического белка.
N. В. После расщепления плазмиды на ее концы с помощью фермента полинуклеотидтрансферазы можно нарастить последовательность из идентичных нуклеотидов (например, последовательность из четырех нуклеотидов, содержащих гуанин); подобным образом на концах гена наращивается комплементарная последовательность такой же длины, т. е. четыре нуклеотида, содержащие цитозин.
Выделение генов, которые представляют собой сегменты ДНК, осуществляется на основе биохимических методов; сложность выделения зависит от величины генома. В то время как определенный ген вируса выделить относительно просто, для гена человека это очень сложная задача. Поэтому исследователи прибегают к косвенному методу, основанному на выделении информационной РНК (мРНК). В клетках животных транскрипция мРНК на ДНК осуществляется в клеточном ядре; молекулы мРНК переносят информацию из ядра в цитоплазму, где она используется при трансляции белков, аминокислотные последовательности которых закодированы в последовательностях нуклеотидов мРНК (т. е. в конечном счете в ДНК). В клетках бактерий (прокариот), которые не имеют ядра, транскрипция и трансляция происходят одновременно и сопряжены; мРНК связана с рибосомами, в которых осуществляется соединение аминокислот с образованием белков. Рибосомы играют ключевую роль в трансляции и в клетках животных.
Наряду с информацией о структуре белков (записанной с помощью генетического кода) молекула ДНК содержит ряд регуляторных сигналов, записанных в виде специфических нуклеотидных последовательностей. Эти сигналы служат точками начала транскрипции или трансляции, другие (в частности, между генами) указывают точки прекращения считывания генетической информации. Генетический код, по-видимому, универсален для всех живых организмов, иными словами, данная последовательность ДНК обязательно кодирует один и тот же белок в клетках разных организмов, тогда как регуляторные сигналы в клетках животных и в бактериальных клетках не одинаковы. В клетках животных информация о структуре белка может кодироваться не одним непрерывным участком ДНК, а несколькими сегментами, разделенными участками ДНК, носящими название нитронов. Информационная РНК, которая транскрибируется с ДНК, подвергается расщеплению, в ходе которого все интроны удаляются из ее последовательности, а остальные остающиеся фрагменты, или экзоны, сшиваются вместе с образованием молекулы мРНК, которая ·обладает последовательностью, кодирующей последовательность аминокислот белка, а также содержит ругуляторные сигналы, необходимые для начала и прекращения процесса трансляции.
Для экспрессии в бактериальной клетке гена из клетки животного необходимо, чтобы в клетку была введена молекула ДНК с последовательностью нуклеотидов, кодирующей белок, из которой интроны уже удалены; иными словами, нужна молекула ДНК, синтезированная на соответствующей мРНК обратной транскриптазой. Более того, регуляторные сигналы должны быть похожи на таковые бактериальной клетки. Наконец, для получения нужного белка в достаточных количествах бывают необходимы дополнительные изменения бактериальной клетки.
Методы введения ДНК в бактериальные клетки
Для введения ДНК (генов) в клетки бактерий используются два метода. Первый основан на применении плазмиды в качестве вектора.
В начале 1950-х гг., вскоре после открытия Ледербергом процесса конъюгации Escherichia coli, было установлено, что типы «спаривания» клеток бактерий обусловлены генетически и что генетическая информация переносится из клеток мужского типа в клетки женского типа, или реципиентные клетки. Способность служить донорными клетками (или фактор плодовитости F) передавалась при конъюгации значительно чаще, чем любой другой генетический признак. F-фактор передавался также независимо от любого другого известного гена донорной клетки. Ледерберг подметил, что F-фактор напоминает внехромосомные генетические элементы, имеющиеся в цитоплазме высших организмов. Это наблюдение позволило ему в 1952 г. присвоить подобным внехромосомным генетическим системам общее название-плазмиды.
В 1953 г. Хэйс, который в то время работал в больнице Хаммерсмита в Лондоне, установил, что в определенных условиях F-фактор может оказаться сцепленным с генетическими маркерами и индуцировать последовательный их перенос в ходе коньюгации. F-фактор присоединяется к бактериальной хромосоме в специфическом участке (сайте); именно в этой точке хромосома разрывается при конъюгации и начинается ее перенос в реципиентную клетку. F-фактор способен также отделяться от хромосомы, захватывая подчас небольшие фрагменты хромосомы; поэтому его можно рассматривать как внехромосомный элемент, который иногда интегрирует в хромосому
Жакоб и Вольман, сотрудники Института Пастера в Париже, отметили сходство в поведении F-фактора, умеренного бактериофага λ, и другой плазмиды-СоlЕ1 (которая кодирует колицин белок, убивающий клетки Е. coli). Для обозначения генетического элемента, который может реплицироваться либо в свободном состоянии, либо соединившись с бактериальной хромосомой, они предложили новый термин-«эписома».
В 1959 г. в Японии при исследовании больных бактериальной дизентерией, которые не поддавались лечению обычно эффективными антибиотиками, было сделано замечательное открытие. В клетках патогенных бактерий (Shigella dysenteriae) были найдены гены, придававшие им устойчивость одновременно к нескольким антибиотикам; такая устойчивость передавалась другим кишечным бактериям во многом подобно тому, как передается F-фактор. Эти факторы устойчивости (называемые R-факторами) обладали сходством с F-фактором; так, они были способны индуцировать передачу самил себя от клетки к клетке при конъюгации. Позже удалось показать, что некоторые из них содержат последовательности нуклеотидов, близкие к таковым F-фактора.
В начале 1960-х гг. Новик обнаружил подобные факторы устойчивости у стафилококков; они содержали ген, кодирующий фермент пенициллин-β-лактамазу, или пенициллиназу; последняя расщепляет пенициллин и таким образом обеспечивает устойчивость к этому антибиотику. R-факторы стафилококков, по-видимому, не способны обеспечивать передачу самих себя посредством конъюгации и переносятся лишь пассивно в процессе трансдукции, т. е. при их встраивании в ДНК бактериофага. Это открытие указывало на наличие нескольких R-факторов в клетках кишечных бактерий.
К середине 1960-х гг. стало очевидным, что большинство R-факторов кишечных бактерий и стафилококков (как и плазмида ColE1) отличаются от F-фактора и фага λ тем, что остаются внехромосомными элементами; их обратимого встраивания в хромосому клетки не происходит. В строгом смысле они не соответствовали определению эписомы. В 1963 г. Новик предложил пользоваться предпочтительно термином «плазмида», как более общим, а не «эписома». В настоящее время термин «плазмида» является общепринятым.
Плазмиды найдены почти у всех видов бактерий. Штамм, содержащий плазмиду, способен давать начало вариантам, у которых плазмида утрачена; в подобных случаях плазмида теряется окончательно, клетка не способна ее регенерировать и может только получить ее из другой бактериальной клетки.
Плазмиды представляют собой кольцевые молекулы ДНК, по размеру соответствующие 1-3% генома бактериальной клетки, однако даже столь малая часть наследственного аппарата кодирует важные генетические признаки, которые обычно сама бактериальная хромосома не кодирует. Например, они содержат информацию, необходимую для конъюгации бактериальных клеток, ими обусловлен ряд заболеваний растений и животных. Они позволяют клеткам использовать многие сложные соединения в качестве источников питания и обеспечивают устойчивость к разнообразным токсичным агентам, особенно к антибиотикам. Плазмиды стафилококков несут гены устойчивости к пенициллину, соединениям ртути и ряду тяжелых металлов, вызывающих летальный эффект (солям сурьмы, висмута, кадмия и свинца, ионам арсената и арсенита). Гены устойчивости к тяжелым металлам обнаружены также в составе R-плазмид Е. coli . Наличием плазмид обусловлены также некоторые заболевания с выраженной диарреей, стафилококковый импедиго, створаживание молока и превращение его в сыр молочнокислыми бактериями, а также разнообразные биохимические реакции, характерные для бактерий рода Pseudomonas. Плазмиды могут управлять синтезом инсектицида в клетках Bacillus thuringiensis. Использование плазмид в качестве векторов для введения чужеродных генов в бактериальные клетки начиная с 1975 г. послужило толчком для интенсивных исследований их структуры и характера репликации.
Количество плазмид в клетке может колебаться от одной до более сотни; в целом чем крупнее плазмида, тем меньше количество ее копий в клетке. Обычно репликация плазмиды регулируется независимо от репликации хромосомы. Поскольку плазмиды могут различаться по количеству копий в одной и той же клетке, количество копий должно определяться регуляторной системой, присущей самой плазмиде. Такая система была описана в 1972 r. датчанином Нордстрёмом из Университета Оденсе для плазмиды Rl Е. coli; сходные регуляторные системы были найдены у плазмид стафилококков. Количество копий плазмиды Rl зависит, по-видимому, от белка или белков, которые подавляют ее репликацию. Сегмент ДНК длиной не более двух тысяч пар нуклеотидов управляет репликацией плазмиды, которая более чем в 50 раз его крупнее.
Долгое время считалось, что генетическая конституция всех клеток данного вида одинакова и не изменяется в течение длительного времени, однако, как оказалось, значительная часть генетических признаков, причем не только у бактерий, но и у высших организмов, нестабильна (эти признаки имеются в одних клетках или штаммах и отсутствуют в других, клетки могут терять их и приобретать вновь) и мобильна (способна переноситься между клетками или перемещаться в одной и той же клетке из одного локуса в другой). Такая нестабильность объясняется тем, что эти признаки определяются плазмидами и другими атипичными генетическими системами.
При конъюгации бактериальных клеток может происходить обмен плазмидами между бактериями, принадлежащими к разным видам и даже родам, которые не способны обмениваться генами, находящимися в хромосомах. Наконец, такой обмен может приводить к переносу генов, находящихся в плазмиде, из одного вида в другой при совместном росте и конкуренции, в результате чего реципиентные клетки приобретают способность выживать за счет донорных клеток. Эти свойства показывают, что плазмиды способны к выживанию независимо от судьбы содержащих их клеток, они не только не снижают общей приспособленности клетки, но, напротив, снабжают ее дополнительными адаптивными функциями. В самом деле, плазмиды обладают способностью включать в себя новые гены, а уже содержащиеся в них гены «перетасовывают» так, что это, с одной стороны, не влияет на эффективность репликации самих плазмид, а с другой - наделяет клетку резервуаром генетической информации, которую она использует по мере надобности.
Второй метод, которым исследователи пользуются для введения гена в бактериальные клетки, основан на применении бактериофага в качестве вектора. Ген встраивают в геном вируса (который содержит 10-50 генов), и он реплицируется вместе с генами вируса при размножении последнего в бактериальной клетке.
Экспрессия в клетках бактерий рекомбинантных ДНК
Бактериальная хромосома длиной около 1 мм это молекула ДНК, состоящая приблизительно из 3 млн. нуклеотидов; в клетке она компактно уложена несколько тысяч раз и занимает пространство менее 1 мкм в поперечнике. В клетках человека ДНК организована в 46 хромосом, каждая из них содержит молекулу ДНК длиной около 4 см, а полное число нуклеотидов в ней приближается к 3 млрд. Рестрикционные эндонуклеазы расщепляют молекулу ДНК в определенных точках, в результате образуются фрагменты с размерами от нескольких сотен до нескольких тысяч нуклеотидов, их можно разделить по различиям в длине. Известно около 400 ферментов рестрикции (рестриктаз), и каждый расщепляет ДНК специфическим образом.
В опытах по экспрессии генов в клетках бактерий сначала из специализированных клеток животных, образующих специфический белок (например, инсулин), выделяли мРНК, кодирующую этот белок, затем с помощью обратной транскриптазы синтезировали нить ДНК, комплементарную мРНК. Вторую нить, комплементарную ДНК-копии, получаю: с использованием другого фермента-ДНК-полимеразы. На следующем этапе двунитевую ДНК-копию встраивали в плазмиду с использованием фермента концевой трансферазы, которая наращивает на концах ДНК короткую последовательность нуклеотидов (для получения инсулина Гилберт наращивал на ДНК последовательность из четырех нуклеотидов с остатками цитозина). Плазмиду расщепляли в специфическом участке рестрикционной эндонуклеазой РstI.Конкретной плазмидой, которую использовал Гилберт для получения проинсулина крысы, была pBR322: эта плазмида характерна для клеток Е. coli и содержит два гена, которые определяют устойчивость к пенициллину и тетрациклину; рестрикционная эндонуклеаза расщепляет плазмиду в средней части гена, кодирующего пенициллиназу. После расщепления плазмиды на ее концы с помощью концевой трансферазы надстраивали последовательность из четырех нуклеотидов с остатками гуанина. После этого концы двух полученных молекул ДНК могли соединяться благодаря взаимодействию комплементарных последовательностей нуклеотидов (гуанина с цитозином); с помощью бактериального фермента-ДНК-лигазы осуществили сшивку ДНК-вставки и плазмидной ДНК. Полученная новая кольцевая плазмида представляла собой уже молекулу рекомбинантной ДНК (см. рис. 1 и 2).
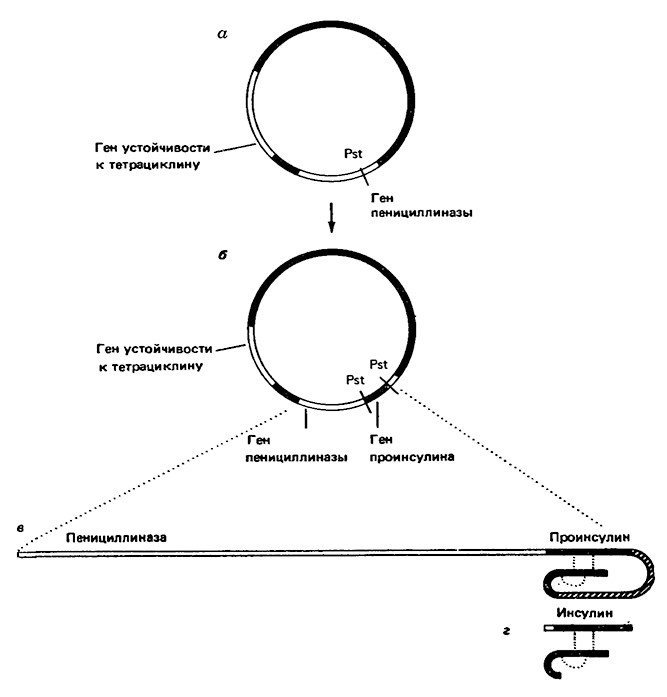
Рис. 2. Схематическое изображение биосинтеза инсулина крысы в генетически сконструированных клетках кишечной палочки (по Gilbert W., Vil/a-Komaroff L., Sci. Ат., 242, № 4, 82 (1980)).
а. Карта плазмиды рВR22, которая служила вектором для гена инсулина. Показан1J1 расположение генов двух ферментов, определяющих устройчивость к антибиотикам, и участок расщепления эндонуклеазой Pst внутри гена пенициллиназы.
б. Карта, полученная при определении последовательности ДНК рекомбинантной плазмиды в клоне кишечной палочки, который синтезирует проинсулин. Ген проинсулина располагается между двумя участками расщепления Pst.
в. Гибридный белок, синтезирующийся в клоне кишечной палочки, содержит последовательности пенициллиназь и проинсулина.
г. Биологически активный инсулин получали, отщепляя пенициллиназу и удаляя средний сегмент проинсулина (пунктирнь ми линиями показань дисульфидные связи.
Обычно такие молекулы рекомбинантных ДНК не проникают сквозь клеточную стенку бактерий, однако разбавленный раствор хлористого кальция делает клетки проницаемыми, и некоторые из них приобретают новую плазмиду. Эти клетки можно отобрать, используя генетический маркер устойчивости к антибиотику. Плазмида pBR322, использuванная в опытах для осуществления синтеза инсулина в бактериальных клетках, была разрезана в средней части гена пенициллиназы; встроенный в плазмиду фрагмент чужеродной ДНК нарушал синтез этого фермента, однако ген, обеспечивающий устойчивость к тетрациклину, оставался активным. Поэтому, если суспензию бактерий размазывали по поверхности питательного агара, содержащего тетрациклин, каждая отдельная клетка, содержащая рекомбинантную ДНК и устойчивая к тетрациклину, была способна к делению и образованию колонии, из которой можно получить клон клеток, содержащих чужеродную ДНК в составе рекомбинантной плазмиды. Бактериальные клетки этого клона синтезировали бы нужный белок, структура которого закодирована во введенной в них ДНК.
Трудности в получении молекул рекомбинантных ДНК и достижении их полной экспрессии в бактериальной клетке в первую очередь связаны с выделением из клеток животного нужного гена-необходимой последовательности ДНК. Для очень мелкого гена, который кодирует очень небольшой белок, основываясь на генетическом коде и зная последовательность аминокислот в этом белке, удается предсказать последовательность нуклеотидов, которую можно химически синтезировать. Эта задача была осуществлена в Национальном медицинском центре
«Хоуп» (Дуарте, Калифорния) Итакурой с сотр. Ученые синтезировали молекулу ДНК длиной 42 нуклеотида, способную кодировать соматостатин гормон гипоталамуса, вызывающий подавление выделения инсулина и гормона роста у человека. Молекулы соматостатина состоят из 14 аминокислот. Синтез последовательности ДНК проводили, соединяя тринуклеотиды; из 52 пар нуклеотидов синтетического гена 42 пары составляли структурный ген соматостатина, а остальные нуклеотиды служили для присоединения синтетического гена к плазмиде pBR322, а также к сегменту лактозного оперона (lac) из генома Е. coli.
Другой путь преодоления этой трудности заключается в выделении не ДНК (гена), а соответствующей мРНК, которой обычно много в клетках, специализирующихся на синтезе определенного белка; например, мРНК инсулина обнаруживается в β-клетках островков Лангерганса в поджелудочной железе, а мРНК гемоглобинав красных кровяных клетках. Эта мРНК не содержит интронов соответствующих генов-интроны вырезаются из нее при участии специальных ферментов, поэтому она может транслироваться в бактериальной клетке (гены последней не имеют интронов). Обратная транскриптаза способна копировать однонитевую РНК с образованием комплементарной цепи ДНК (этот фермент имеется у определенных РНК-содержащих вирусов, которые в цикле размножения осуществляют обратную транскрипцию своей РНК в ДНК). На однонитевой ДНК-копии при помощи ДНКполимеразы синтезируют комплементарную цепь ДНК; полученная в результате двунитевая ДНК-копия соответствует гену, который требовалось выделить, но при этом из нее удалены все нитроны. Существенно, однако, чтобы синтезированная таким способом ДНК-копия содержала регуляторные сигналы, необходимые для ее транскрипции и трансляции в бактериальной клетке; эти сигналы в бактериальных клетках и в клетках животных различаются. Один из них служит сигналом начала синтеза мРНК, другой необходим для инициации трансляции мРНК с образованием белка; имеются также сигналы о прекращении транскрипции и трансляции.
Чужеродную ДНК можно встраивать непосредственно за бактериальным геном или внутри его после расщепления ДНК рестрикционной эндонуклеазой; это делают, чтобы избежать затруднений, связанных с инициацией транскрипции и трансляции чужеродной ДНК. В результате образуется гибридный белок, в котором последовательность аминокислот чужеродного белка окружена последовательностями бактериального белка. Синтетический ген соматостатина был встроен в плазмиду pBR322 Е. coli вблизи конца гена, кодирующего β-галактозидазу; между двумя генами был помещен кодон метионина. После введения рекомбинантной плазмиды в бактериальную клетку кишечная палочка стала синтезировать гибридный белок; часть его, представляющую собой соматостатин, отщепляли затем от β-галактозидазы обработкой бромцианом, который разрывает белковую цепь по остатку метионина. Такой сложный способ получения гормона был необходим, поскольку соматостатин, синтезированный в виде свободных молекул, быстро деградирует под действием бактериальных протеаз.
Чужеродную ДНК можно встраивать также в ген бактериального белка, секретирующегося в норме сквозь клеточную стенку наружу; в этом случае необходимость экстракции белка из клетки отпадает, поскольку белок выделяется во внешнюю среду.
В ноябре 1977 г. Бойер, один из основателей фирмы «Генентек» (учрежденной годом раньше в Сан-Франциско), сообщил о первом синтезе сложной молекулы соматостатина-в бактериальных клетках с измененным геномом (выход соматостатина составил 10 000 молекул на клетку). Из 100 г биомассы Е. coli, выращенной в ферментере объемом 8 л, удалось выделить 5 мг соматостаmнастолько же, сколько Гийемен и Шэлли выделили из 100 г овечьих мозгов.
Биосинтез инсулина человека в клетках кишечной палочки
В 1979 г. из 60 млн. больных диабетом во всем мире только 4 млн. получали препарат инсулина. В США число диабетиков, нуждающихся в инъекциях инсулина, соста ляло в 1979 г. 1,8 млн. человек (из них 100 000 детей); это число ежегодно возрастает на 6%. В том же году во Франции был зарегистрирован 1 млн. больных диабетом; 150 000 из них нуждались в инсулине, 300 000-в лечебной диете, а 550 000 инсулина не требовалось. Известно несколько форм диабета. Форма, для лечения которой необходим инсулин, вызвана избирательной гибелью клеток, синтезирующих этот гормон (первым обратил внимание на роль островков Лангерганса в поджелудочной железе в этиологии диабета в 1916 г. Эдвард ШарпиШафер, который и назвал инсулином вещество, секретируемое этими островками). Формы диабета, для лечения которых инсулин не требуется, встречаются чаще, с ними удается справляться соответствующей диетой.
В 1921 г. Бантинг и Бест в Торонто выделили из поджелудочной железы собаки гормон, существование которого было предсказано Шарпи-Шафером, и продемонстрировали его антидиабетический эффект. В 1922 г. инсулин, выделенный из животного, бьm впервые введен девятилетнему мальчику, больному диабетом. Результат превзошел все ожидания. Уже через год американская компания «Эли Лилли» выпустила первый препарат животного инсулина. Поджелудочная железа крупного рогатого скота и свиней обычно не используется в мясной и консервной промышленности и поставляется бойнями. Опытный персонал по разработанной методике осуществляет извлечение желез из туш, их быстро замораживают и направляют в вагонах-рефрижераторах на фармацевтические предприятия, где производится экстракция гормона. Поджелудочная железа коровы весит 200-250 г; для получения 100 г кристаллического инсулина требуется 800-1000 кг исходного сырья.
В 1935 г. датский исследователь Хагедорн добился оптимизации действия инсулина в организме, разработав препарат инсулина пролонгированного действия. Его поглощение было замедлено добавлением протамина, а затем и цинка. В 1946 г. датские исследователи получили нейтральный кристаллический инсулин (NPH), который широко применялся в инсулинотерапии. Позднее сотрудники компании «Ново индастри» (Копенгаген) установили, что добавление протамина не является необходимым для получения препарата пролонгированного действия. С тех пор в распоряжении врачей имеются долгодействующие (поглощаются в течение 48 ч) и быстродействующие препараты инсулина.
Диабетик, нуждающийся в лечении инсулином, должен получать в среднем 40 единиц гормона в сутки. Совершенствование методов производства, особенно благодаря усилиям компании «Эли Лилли», позволило получать концентрированные препараты для инъекций (100 единиц вместо 40), т. е. производить инъекцию заданного количества гормона в меньшем объеме.
Первые кристаллы инсулина были получены в 1952 г., а развитие методов очистки гормона (иммуноэлектрофореза и жидкостной хроматографии высокого разрешения) от других гормональных веществ (например, глюкагонаантагониста инсулина и соматостатина, который подавляет выделение инсулина и глюкагона) и различных продуктов деградации инсулина позволило получить гомогенный инсулин, который называют однокомпонентным.
Инсулин построен из двух полипептидных цепей А и В длиной 20 и 30 аминокислот, последовательность которых была установлена Сэнгером в 1955 г. Синтез обеих цепей и соединение их дисульфидными связями для получения инсулина были проведены в 1963 и 1965 гг. тремя коллективами исследователей в США, Китае и ФРГ. Однако осуществить в промышленном масштабе столь дорогостоящий и сложный синтез, который включает 170 химических реакций, оказалось трудно. Тем не менее в 1980 г. датская компания «Ново индастри» разработала метод превращения инсулина свиньи в инсулин человека замещением остатка аланина, который является 30-й аминокислотой в цепи В, на остаток треонина. Этого удалось достигнуть путем ферментативного замещения с последующей хроматографической очисткой продукта; в результате был получен однокомпонентный инсулин человека 99%-ной чистоты. Исследования двух однокомпонентных инсулинов (человеческого и свиного) показали, что они не различались по активности и по времени действия. В 1982 г. инсулин производили главным образом две компании: «Эли Лилли, (85% сбыта инсулина в США и патент на его производство с 1923 г.) и «Ново индастри» (47,5% сбыта гормона в Европе). Из произведенных в мире 74 млрд. международных единиц инсулина 27 млрд. были использованы в США, 17 млрд. в Западной Европе и 13 млрд. в Восточной Европе.
В организме животного две полипептидные цепи инсулина исходно являются частями одной белковой молекулы длиной 109 аминокислот-препроинсулина. При синтезе препроинсулина в β-клетках поджелудочной железы первые 23 аминокислоты служат сигналом для прохождения молекулы сквозь мембрану клетки; эти аминокислоты отщепляются, в разультате образуется проинсулин длиной 86 аминокислот. Молекула проинсулина сворачивается таким образом, что начальный и конечный ее сегменты сближаются, а центральная часть молекулы удаляется под действием ферментов. Так образуется инсулин. Роль центральной части сводится к правильному взаимному расположению двух цепей инсулина.
Гилберт с сотр. выделили мРНК инсулина из опухоли β-клеток поджелудочной железы крысы (в то время особые ограничения исследований не позволили им работать с геном человека). ДНК-копию мРНК встроили в плазмиду pBR322 Е. coli, в среднюю часть гена пенициллиназы этот фермент в норме секретируется из клеток. Как показало определение последовательности ДНК, рекомбинантная плазмида содержала информацию о структуре проинсулина, но не препроинсулина. При трансляции мРНК в клетках кишечной палочки синтезировался гибридный белок, содержащий последовательности пенициллиназы и проинсулина; гормон из такого белка выщепляли трипсином. Позднее Набер и Чик из Исследовательской лаборатории Эллиота П. Джослинга в Бостоне показали; что полученные таким способом молекулы влияют на сахарный обмен, как гормон, выделенный из поджелудочной железы крысы.
В 1979 г. Креа, Крашевски, Хироуз и Итакура из Национального медицинского центра «Хоуп» (Дуарте, Калифорния) за три месяца работы синтезировали гены, кодирующие Аи В-цепи инсулина: каждый ген был собран соответственно из 18 и 11 олигонуклеотидов. Синтез этих генов в свою очередь был осуществлен Гёдделем с сотр. в компании «Генентек». Как и в случае гена соматостатина, каждый синтетический ген встраивали в плазмиду в конце гена β-галактозидазы Е. coli К12. Синтезированные полипептиды отщепляли от фермента, проводили их очистку, и цепи соединяли iп vitro для получения полной молекулы инсулина. Исходно в бактериях синтезировалось около 100 000 молекул инсулина на бактериальную клетку.
В клетках Е. coli осуществлен также биосинтез проинсулина, а не только ее отдельных цепей - А и В; для этого на мРНК проинсулина с помощью обратной транскриптазы синтезировали ее ДНК-копию. Биосинтез проинсулина, молекула которого сворачивается и после образования дисульфидных связей образует молекулу инсулина, имеет серьезное преимущество, поскольку различные этапы экстракции и выделения гормона сведены к минимуму.
По наблюдениям исследователей американской компании «Эли ЛиллИ», включения, содержащие проинсулин или А и В-цепи инсулина, могут занимать до 20% объема клетки Е. coli. Гилберт и его сотрудники попытались повысить выход гормона, синтезируемого в клетках бактерий, встраиванием в ДНК коротких последовательностей нуклеотидов (промоторов), которые обеспечивали более высокий уровень экспрессии ДНК в составе рекомбинантной плазмиды. Кроме того, в одну бактериальную клетку можно ввести несколько копий рекомбинантной плазмиды. В Центре прикладной микробиологии и исследований в Портон-Дауне (Великобритания) был получен высокий выход этого белка-до 200 г из 1000 л культуральной среды (это эквивалентно количеству инсулина, выделенного приблизительно из 1600 кг поджелудочной железы свиньи или коровы). Увеличить количество можно также подавлением активности бактериальных протеолитических ферментов или защитой молекулы гормона от их действия. Для этого ее помещают внутрь белковой молекулы, которая секретируется бактериями во внешнюю среду.
Исследователям из компании «Генентек» потребовалось 10 мес., чтобы в сентябре 1978 г. получить инсулин человека в специально сконструированном штамме кишечнойпалочки. Производство инсулина в бактериальных клетках не зависит от перебоев в поставках сырья с боен и позволяет получать человеческий инсулин, который при длительном применении не вызывает неприятных последствий, как инсулин животных (имеются в виду нарушение работы почек и расстройство зрения; у одного из каждых 20 больных диабетом инсулин животных вызывает аллергию). «Эли Лилли» совместно с «Генентек» вложила 40 млн. долл. в строительство завода для крупномасштабного производства инсулина в американском городе Индианаполис (шт. Индиана), намереваясь приступить к выпуску гормона в 1983 г. (По оценкам компании «Генею», рыночное производство инсулина в США к 1990 г. составит 235 млн. долл. в год.)
Согласно данным «Эберстадт и К°» (Нью-Йорк), компания «Ново индастри» совместно с «Биоген» планирует производство инсулина человека, применив технику рекомбинантных ДНК к микроорганизмам, отличным от кишечной палочки. Такого рода кооперация обусловлена стремлением начать промышленный выпуск инсулина человека в те же сроки, что и «Эли ЛиллИ». Национальный совет Канады по исследованиям и канадские лаборатории Коннаута также проявляют интерес к синтезу инсулина в генетически сконструированных штаммах дрожжей.
Начиная с июля 1980 г. имеющихся количеств синтезированного гормона оказалось достаточно, чтобы начать клинические испытания и фармакодинамические исследования в США, Франции, Японии и Великобритании. В августе того же года группа английских медиков опубликовала результаты исследований инсулина, синтезированного в сконструированном штамме кишечной палочки; после экспериментов на животных препарат был испытан на людях. Испытания проводились в отделении нарушений обмена Лондонской больницы Ги на 17 добровольцах в возрасте 24-56 лет. Изучаемый препарат инсулина был получен из лабораторий «Эли Лилли», где его синтезировали по методу, разработанному еще в 1978 г. компанией «Генентек». Вариации в степени гликемии, зарегистрированные при подкожном или внутривенном введении этого вещества, сравнивали с таковыми при введении гормона, полученного из поджелудочной железы свиньи и используемого для лечения диабета. Результаты у обеих групп были эквивалентными, а незначительные замеченные отличия объяснялись разницей в концентрациях препаратов при исuытаниях.
В марте 1982 г. японская компания «Сионоги» (Осака) провела клинические испытания инсулина человека, производимого фирмами «Эли Лилли» и «Генентек». Какихлибо побочных эффектов препарата выявлено не было.
После того как была доказана безвредность кратковременного применения гормона, синтезированного бактериальными клетками, необходимо было проверить иммунологические реакции пациентов при длительном курсе лечения, чтобы проконтролировать степень чистоты препарата, и только после этого принять решение о его использовании для терапии в широких масштабах. Это относилось и к синтетическому проинсулину человека, гомологичному нативному проинсулину; его иммуногенные свойства при длительном применении также нуждались в более подробном изучении.
Проблема имела и чисто экономический аспект. Синтетический инсулин человека мог оказаться совершенно чистым, но при этом использование и широкое распространение препарата определялись бы стоимостью его очистки, а цена неизбежно соизмерялась с ценой инсулина человека, полученного биохимической модификацией инсулина свиньи датской компанией «Ново индастри».
В октябре 1982 г. Управление по контролю за качеством пищевых продуктов, медикаментов и косметических средств (FDA) одобрило выпуск в США «хемулина» препарата синтетического инсулина человека, производимого фирмой «Эли ЛИлли», которая, по оценкам, затратила 100 млн. долл., чтобы начап, поставку продукта на рынок. Месяцем раньше подобное решение в отношении хемулина бьшо принято и в Великобритании. Эти решения были вынесены через пять месяцев после регистрации препарата в FDA на основании положительных результатов клинических испытаний в отношении безопасности применения, проведенных на здоровых добровольцах и на 1000 больных диабетом в ряде стран (400 из них в США).
Биосинтез соматотропина и других гормонов человека
Гормон роста человека (ГРЧ), или соматотропин, секретируется передней долей гипофиза. Впервые он был выделен и очищен в 1963 г. коллективом во главе с Русом из гипофиза, полученного из трупного материала. Недостаток этого гормона приводит к гипофизарной карликовости, частота встречаемости которой оценивается от 7 до 10 случаев на миллион человек (среди детей западных стран она составляет 1 на 5000 человек). Гормон обладает видовой специфичностью и является единственным средством лечения детей, страдающих от его недостатка. Как показали некоторые исследования, при внутримышечном введении соматотропина в дозах свыше 6 мг в неделю или, что предпочтителънее, в дозах 10 мг на 1 кг массы в течение года по три инъекции в неделю в течение первого года лечения наблюдается увеличение роста более чем на 6 см. Для достижения наиболее ощутимых результатов введение гормона необходимо продолжать от возраста 4-5 лет до половой зрелости и даже далее.
В 1981 г. из одного трупа удавалось получать 4-6 мг соматотропина в пересчете на конечный фармацевтический препарат. Но доступные количества гормона роста были ограничены и не удовлетворяли спроса. При участии Национального агентства гипофиза США в стране гипофиз ежегодно выделяли из 60 000 трупов. При переработке этого материала получали 650 000 международных единиц соматотропина; этого количества было достаточно для лечения 1500 детей в год. В Великобритании переработка гипофиза из 70 000 трупов позволила в 1978 г. произвести достаточно соматотропина для адекватного лечения в Медицинском исследовательском совете нескольких сотен случаев гипофизарной карликовости. Однако в 1982 г. количество собранного материала оказалось меньше, и английские больницы получили всего 336 000 международных единиц. Этого хватило для лечения всего 800 детей. Во Франции подобные низкие поставки (в среднем из 100 трупов гипофиз получали только в 1,6 случаев по сравнению с 30 случаями в Скандинавских странах) заставили медицинскую администрацию резервировать этот крайне дорогой способ лечения (30 000-60 000 франков на одного ребенка в год) лишь для четко установленных клинических случаев среди больных, которые уже получали гормон (в 1982 г. препарат получали 800 детей, а некоторые продолжали получать его в течение 5 или более лет).
Шведская компания «Каби витрум АБ» выпускала почти 60% мирового запаса соматотропина. К числу других крупных производителей гормона роста относятся фирмы «Нордиск инсулин» (Дания), «Серано» (Италия и Швейцария) и Национальное агентство гипофиза в США. Однако общего количества препарата хватало для лечения лишь одной трети случаев гипофизарной карликовости в развитых странах. Нехватка соматотропина оказывается еще более острой, если учесть другие случаи применения этого гормона, такие, как незаживающие переломы (ложные суставы), ожоги, язвы и нарушения гемопоэза. (Эффективность гормона при этих патологических случаях, когда проявляется его анаболическое действие, доказана клиническими испытаниями.)
Помимо недостатка препарата возникли и другие проблемы, связанные с гетерогенностью гормона, выделяемого из трупного материала. Он представляет собой смесь из нескольких форм, пять из которых имеют массу 22 000 дальтон, другие являются димерами нативной формы, а остальные -фрагментами, образующимися при протеолизе. Поэтому у 30% больных, получавших препарат, против гормона вырабатывались антитела, которые сводили на нет его биологическую активность, хотя совершенствование выделения и очистки гормона привело к снижению доли таких случаев до 5%. Существовала также опасность, что гипофизарный материал заражен медленно развивающимися вирусами. Такие вирусы обладают необычайно длительным инкубационным периодом, поэтому дети, получавшие препарат, нуждались в многолетнем медицинском наблюдении.
Гормон роста человека, синтезированный в специально сконструированных клетках бактерий, имеет очевидные преимущества: он доступен в больших количествах, его препараты являются биохимически чистыми и свободны от вирусных загрязнений.

Рис. 3. Схематическое изображение первичной структуры гормона роста (соматотропина) человека.
Молекула гормона построена из 191 аминокислоты. Гормон, синтезированный в генетически сконструированных клетках кишечной палочки, отличается от гормона, выделенного из гипофиза, дополнительным остатком метионина на NH2-конце молекулы.
Шведская фирма «Каби витрум», которая с 1967 г. исследует возможность производства синтетического соматотропина, в августе 1978 г. подписала соглашение с американской компанией «Генентек» относительно получения методами генной инженерии штамма бактерий, способного синтезировать этот гормон. Через восемь месяцев после начала совместного предприятия исследователи «Генентек» получили штамм Е. coli К12, обладающий этим свойством.
Биосинтез соматотропина, состоящего из 191 аминокислотного остатка (рис. 3) был осуществлен Гёдделем и его коллегами в фирме «Генентек». Поскольку при синтезе ДНК на мРНК гормона с последующим превращением ее в двунитевую форму получается ген, кодирующий предшественник соматотропина, который не расщепляется в бактериальных клетках с образованием активного гормона, исследователи избрали следующий подход. На первом этапе клонировали двунитевую ДНК-копию мРНК и расщеплением рестрикционными эндонуклеазами получили последовательность, которая кодирует всю аминокислотную последовательность гормона, за исключением первых 23 аминокислот. Затем клонировали синтетический полинуклеотид, соответствующий аминокислотам от 1-й до 23-й, со стартовым ATG кодоном в начале. Наконец, два фрагмента объединили вместе и «подстроили» к паре lас-промоторов и участку связывания рибосом. Конечный выход гормона составил 2,4 мкг на 1 мл культуры или 1% от растворимых белков клеток этого генетически сконструированного штамма Е. coli (т. е. 100 000 молекул гормона на клетку). Синтезированный в бактериях гормон обладал нужной молекулярной массой и не был связан с каким-либо бактериальным белком, от которого его необходимо было бы отщеплять.
Однако синтетический гормон содержал на N-конце полипептидной цепи дополнительный остаток метионина. Эта лишняя аминокислота могла быть удалена при длительном выращивании кишечной палочки, но получаемые при этом количества соматотропина были слишком низкими: всего несколько миллиграммов на 1 л культуральной среды за 7-10 ч роста бактериальных клеток.
В июне 1980 г. исследователи компании «Генентек» представили в FDA данные, доказывающие, что соматотропин с дополнительным остатком метионина, синтезированный в генетически сконструированных клетках бактерий, обладает биологической активностью нативного гормона. Они провели сравнение стимуляции роста крыс с удаленным гипофизом гормоном роста, синтезированным в клетках бактерий, и препаратом, полученным из гипофиза человека. Прирост массы и рост больших берцовых костей были одинаковыми как для обоих препаратов гормона по отдельности, так и для их смеси. Согласно другому тесту, бактериальный соматотропин обладал большим эффектом, чем гормон роста из гипофиза; это наблюдение объясняли большей чистотой первого препарата. Введение в кишечник крыс с удаленным гипофизом бактерий, синтезирующих соматотропин, не сопровождалось увеличением массы, хотя эти бактерии частично выживали в кишечном тракте грызунов в течение нескольких дней.
В Сан-Франциско детям, страдающим гипофизарной карликовостью, в течение трех месяцев вводили соматотропин, синтезированный в клетках бактерий и содержащий дополнительный остаток метионина. При этом было зарегистрировано увеличение роста на 2-4,5 см или прирост 8-18 см за год, что по сути не отличается от эффекта препаратов соматотропина, полученных из гипофиза. Более того, за этот период у 5% детей, получивших гормон роста, против гормона выработались антитела явление, обычно наблюдаемое при действии применяемых в клинике фармацевтических препаратов. Благодаря совершенствованию процедуры очистки были устранены такие побочные эффекты, как лихорадка и отклонения в формуле крови, которые наблюдались во время начальных клинических испытаний и объяснялись присутствием бактериальных токсинов.
Вот почему шведская фирма «Каби витрум» решила приступить к производству гормона с дополнительным остатком метионина: из 1 л бактериальной культуры при выращивании в течение 7 ч удавалось получать количество гормона, эквивалентное выделенному из гипофиза 60 трупов.
Первые полные клинические испытания с целью установить безопасность и эффективность гормона, синтезированного в клетках бактерий, были проведены с согласия FDA 12 января 1981 г. в Отделении педиатрии Медицинской школы в Пало-Альто (Калифорния) на взрослых добровольцах. В Великобритании подобные испытания проводились с февраля 1981 г. в Клинике детских заболеваний на Грейт Ормонд-стрит.
В 1981 г. клинические испытания и тесты на токсичность, проводимые «Генентек» и «Каби витрум», были завершены, и уже в следующем году в Канаде, США, Европе и Японии были начаты массовые испытания на детях, страдающих карликовостью и по возрасту близких к половой зрелости.
С августа 1982 г. «Каби витрум» приняла решение начать производство синтетического соматотропина в промышленном масштабе на своем заводе в Стренгнесе в ферментерах объемом по 1500 л, намереваясь поставить его на рынок в конце 1983 г. Более сложный процесс очистки гормона был осуществлен с использованием моноклональных антител.
Согласно заявлению президента компании «Генентек» Р. Свонсона, в 1984 г. после завершенщ заключительных клинических испытаний, должно было начаться широкомасштабное производство бактериального соматотропина. Тем самым он подчеркнул успехи компании в этой области, достигнутые с момента запуска в производство синтетического инсулина в сотрудничестве с компанией «Эли Лилли» в 1983 г.
Гормон роста человека в клетках кишечной палочки и в культуре клеток животных был получен также в 1982 г. в Институте Пастера в Париже, причем было предусмотрено его промышленное производство.
Как полагают, биосинтез соматотропина приведет к снижению стоимости лечения, поскольку, согласно оценкам американских исследователей, цена 1 международной единицы гормона к 1990 г. снизится с 15 до 5 долл., особенно если расширится область применения препарата (высказывались предположения, что соматотропин удастся использовать для стимуляции роста домашних животных и увеличения удоев молока у коров). В Великобритании стоимость ампулы, содержащей 5 единиц гормона, в 1978 г. составляла 125 ф. ст., а в 1981 г. эквивалентное количество, получаемое министерством здравоохранения и социального обеспечения от компании «Каби витрум», снизилось до 15 ф. ст. В Центре прикладной микробиологии и исследований в Портон-Дауне после получения соответствующего разрешения Консультативной группы по генной инженерии намеревались культивировать штамм, генетически сконструированный в «Генентек»; испытания, которые проводились в ферментерах объемом по 400 л, имели целью значительно повысить выпуск соматотропина, с тем чтобы снизить стоимость гормона. Центр подписал также соглашение с «Каби витрум» относительно оптимизации обработки гипофиза из трупного материала и системы выделения гормона.
С другой стороны, изменяя аминокислотную последовательность гормона, т. е. его первичную структуру посредством модификации кодирующего его гена, в бактериальных клетках можно синтезировать аналоги гормона, очень важные для изучения активных участков молекулы (например, участков, которые стимулируют рост или оказывают действие на неоглюкогенез) и этиологии карликовости на молекулярном уровне.
Используя методы рекомбинантных ДНК, можно синтезировать и другие факторы роста и факторы дифференцировки тканей, выделив сначала их мРНК, а затем получив соответствующие гены. Это относится к соматомедину А, который стимулирует фиксацию серы в хряще и образование которого индуцируется соматотропином. Это относится также к соматомедину В, стимулирующему синтез ДНК в клетках глин. В генетически сконструированных клетках можно синтезировать и другие соматомедины, которые индуцируют включение пролина в коллаген или уридина в ДНК.
В 1982 г. Гийемен с сотр. (Институт биологических исследований Солка в Ла-Джолле, Калифорния) выделили и синтезировали полипептид, обладающий полной биологической активностью гипоталамического рилизингфактора соматотропина (СТГ-РФ), убедительное выделение которого из гипоталамуса до сих пор не было проведено. Эти исследования также могут иметь важное терапевтическое значение для человека, поскольку введение этого полипептида способно компенсировать недостаток соматотропина. Ранее, в 1968 г., группа Гийемена выделила и синтезировала первый гипоталамический рилизинг-фактор рилизинг-фактор тиреотропного гормона (ТТГРФ), который регулирует работу щитовидной железы. При содействии нескольких коллективов медиков ученые выделили из опухоли поджелудочной железы человека, вызывающей акромегалию, рилизинг-фактор соматотропина (СТГ-РФ), а затем синтезировали этот полипептид, связанный с образованием опухоли и построенный из 44 аминокислотных остатков. Хотя еще не доказано, что СТГ-РФ из опухоли поджелудочной железы идентичен гипоталамическому СТГ-РФ, выделенному изгипоталамуса, допустимо проводить клинические испытания на людях, используя синтетический полипептид. По завершении таких испытаний можно было бы рекомендовать его применение не только для лечения гипофизарной карликовости, но и при некоторых формах диабета, а также для ускорения регенерации тканей у людей, получивших сильные ожоги. Наличие достаточных количеств фактора, обладающего всеми свойствами гипоталамического рилизинг-фактора гормона роста, наряду с биосинтезом соматотропина в генетически сконструированных бактериальных клетках приведет к коренному перелому в лечении заболеваний, обусловленных недостатком этого гормона, а также значительно облегчит терапию в ряде различных патологических случаев. Этот фактор, возможно, удастся использовать и для увеличения массы и роста домашних животных: поскольку структура соматотропина видоспецифична, использование фактора, действующего на уровне гипоталамуса, быть может, позволит избежать затруднений, связанных с выделением и синтезом соматотропинов разных видов животных, так как этот фактор, вероятно, стимулирует освобождение гормона роста у ряда животных.
Компания «Генентек» планировала также выпуск соматостатина, образуемого специально сконструированными штаммами бактерий. Однако, как утверждают некоторые ученые, при производстве пептидов, состоящих менее чем из 20 аминокислотных остатков, следует отдавать предпочтение химическому синтезу, а не биосинтезу в генетически сконструированных клетках микроорганизмов. Это объясняется несколькими причинами. Во-первых, с развитием методов, значительно увеличивших скорость получения пептидов, в химическом синтезе белков наблюдается явный прогресс. Во-вторых, эти методы весьма полезны для получения меченых пептидов и аналогов пептидов, содержащих модифицированные аминокислоты или D-аминокислоты. В 1979 г. Йинг и Гийемен синтезировали таким способом аналоги и антагонисты 10-членного пептида, рилизинг-фактора лютеинизирующего гормона (ЛГ-РФ), произведя в шестом положении замену на D-аминокислоту и заменив N-концевую аминокислоту. Это позволило получить вещества, обладающие активностью, в 100 раз превышающей активность природного гормона, и другие вещества, вызывающие эффект, противоположный действию гормона. С помощью химической модификации ЛГ-РФ, приводящей к образованию в первом и втором положениях остатков D-фенилаланина, и введения в шестом положении остатка триптофана Кой (Университет Тулана в Нью-Орлеане, шт. Луизиана) в 1979 г. получил антагонист ЛГ-РФ, подавляющий овуляцию у крыс; по активности антагонист в 30 раз превосходил соединения, полученные той же группой исследователей тремя годами ранее.
Гормоны тимуса также предпочтительнее получать в генетически сконструированных бактериальных клетках, чем путем химического синтеза. Тимопоэтин построен и·з 49 аминокислот, однако входящий в его состав пентапептид обладает биологической активностью, характерной для всей молекулы. Сывороточный фактор тимуса (СФТ), состоящий из 9 аминокислот, впервые был выделен из сыворотки крови свиньи, а затем из сыворотки человека; позднее он был обнаружен в эпителии тимуса (исследования Баха в парижской больнице Неккера).
β-Эндорфин - опиат мозга, состоящий из 31 аминокислоты,был синтезирован в генетически сконструированных клетках кишечной палочки. В 1980 г. австралийский ученый Шайн (Национальный университет в Канберре), американцы Феттес, Лэн и Бакстер (лаборатория Медицинского института Говарда Хьюза при Калифорнийском университете, Сан-Франциско) и Робертс (Колледж терапии и хирургии Колумбийского университета, Нью-Йорк) успешно клонировали ДНК, кодирующую β-эндорфин, в клетках Е. coli и получили этот полипептид в виде слитного белка с ферментом β-галактозидазой. На первом этапе исследователи клонировали фрагмент ДНК, полученный в результате обратной транскрипции мРНК, кодирующей более крупный белок-предшественник, который помимо последовательности β-эндорфина содержит последовательности кортикотропина (АКТГ) и β-липотропина (β-ЛТГ). Этот фрагмент ДНК кодировал аминокислоты 44-90 β-ЛТГ, которые соответствуют 15 С-концевым аминокислотам D-меланоцитстимулирующего гормона (МСГ), и полную последовательность β-эндорфина, за исключением С-концевого остатка глутамина. Поэтому перед тем, как встроить этот фрагмент ДНК в хромосому кишечной палочки за геном β-галактозидазы, необходимо было изменить его таким образом, чтобы в конце последовательности располагался кодон глутамина, а за ним следовал стоп-кодон. β-Эндорфин, полученный из гибридного белка и очищенный, обладал биологической активностью, свойственной эндорфинам, и специфически взаимодействовал с антисывороткой против β-эндорфина. Вместе с тем он отличался от β-эндорфина человека по двум аминокислотам; эти отличия можно было устранить, изменив два кодона в ДНК бактериальной плазмиды. Замены в других кодонах могли приводить к образованию производных β-эндорфинов с активностью аналогов или антагонистов.
Получение интерферонов
Использование методов генной инженерии для производства биологически активных веществ, применяемых при лечении наследственных заболеваний и отклонений от нормы, предусматривает необходимость медикобиологических исследований с акцентом на молекулярную биологию и биологию клетки как в настоящем, так и в будущем. Изучение процессов на молекулярном и клеточном уровнях имеет первостепенное значение, поскольку позволяет глубже понять биологию и физиологию человека в норме и при патологии. Лекарственные вещества могут быть получены в живых организмах (а не путем химического синтеза), в генетически сконструированных клетках бактерий или эукариотических организмов. Тем самым они являются продуктами метаболизма клеток, а не экзогенными соединениями, которые используются эмпирически и в некоторых случаях вызывают в клетке реакции, сводящие на нет цель их применения. Примером подобного рода природных соединений служат интерфероны, которые выделяются специализированными клетками и быстро блокируют заражение клеток вирусами, а также антитела, образуемые в ответ на попавшие в организм антигены.
Впервые интерферон был получен в 1957 г. Айзексом и Линденманном в Национальном институте медицинских исследований, вблизи Лондона. Это белок, который в очень низких количествах выделяется клетками животных и человека при попадании в организм вируса. Как полагают, интерферон представляет собой первую линию обороны против вирусной атаки. Первые же исследования показали, что интерферон способствует излечиванию таких заболеваний, как простуда, гепатит и опоясывающий лишай. Помимо усиливающего действия на иммунитет интерферон подавляет размножение аномальных клеток, чем и объясняется его противоопухолевое действие.
Интерферон образуется не только в организме человека, но и у многих других позвоночных, однако это вещество обладает видовой специфичностью, и интерферон животных не удается использовать для лечения человека. В организме человека вырабатывается несколько классов интерферона: лейкоцитарный (α), фибробластный β-интерферон, удобный для массового производства, поскольку фибробласты в отличие от лейкоцитов размножаются в культуре) и иммунный (ϒ) из Т-лимфоцитов.
Клиническим испытаниям эффективности интерферонов препятствовал крайне низкий выход этих веществ при получении обычными методами, т. е. преимущественно из крови. Так, в 1978 г. Кантелл и его сотрудники в Центральной лаборатории здравоохранения в Хельсинки переработали 50 000 л крови человека и выделили всего 0,1 г чистого интерферона. По оценкам специалистов, этого количества было достаточно для лечения 10 000 случаев легких вирусных инфекций, но лишь для 200 больных, страдающих хроническими вирусными заболеваниями.
Поэтому в ряде стран и лабораторий прилагались серьезные усилия к тому, чтобы получить большие количества разных классов интерферона человека с помощью обычных методов, а также методов генной инженерии, которые позволили бы провести клинические испытания эффективности этих белков для защиты от заболеваний.
Образование интерферона в клетках крови и фибробластах
Процесс получения интерферона в основных чертах одинаков для всех типов клеток, выращиваемых в культуре и образующих интерферон. Клетки заражают вирусом Сендай и через 24 ч центрифугируют; из надосадочной жидкости получают грубый препарат интерферона, который подвергают очистке. При переработке 2 л крови удается получать до 4 млн. единиц интерферона. На протяжении почти 10 лет большая часть мирового производства интерферона приходилась на Центральную лабораторию здравоохранения в Хельсинки, в которой Кантелл усовершенствовал метод получения интерферона из лейкоцитов крови здоровых доноров. Эта лаборатория была мировым лидером в получении лейкоцитарного интерферона и выпускала 400 млрд. единиц в год. Часть этой продукции в соответствии с контрактами, подписанными Национальными институтами здоровья и Американским онкологическим обществом, поставдялась в США, остальная использовалась в клинических испытаниях в Стокгольме и в университетской клинике в Хельсинки.
Начиная с 1%0 г. Шани (Национальный институт здоровья и медицинских исследований, INSERM, клиника Сент-Винсент-де-Поль, Париж) в сотрудничестве с Институтом Пастера занимался получением интерферона в полупромышленном масштабе. В марте 1980 г. проблема обсуждалась на конференции с участием исследователей из Национального центра научных исследований, IN-SERM, Института Пастера и университетов. Фирма «Инститют Пастер продюксьон» (IPP) и Национальный центр переливания крови (CNTS), который поставляет лейкоциты в IPP, усовершенствовали метод производства и добились увеличения выпуска интерферона. В течение полугода IPP получила 48 млрд. единиц интерферона из крови, взятой у 26 000 доноров, и Франция заняла второе место в Европе по производству интерферона. В конце 1980 г. между IPP и министерством здравоохранения было подписано соглашение, по которому комиссии специалистов поручалось детально разработать испытания интерферона, необходимые, чтобы по возможности более точно установить окончательную область применения этого вещества в качестве противовирусного и противоопухолевого средства. Было решено расширить производство интерферона совместными усилиями IPP, Национального центра переливания крови и Центра переливания крови в Лилле; в последнем производили грубый препарат интерферона, который подвергался очистке в IPP. Производство было увеличено до более 100 млрд. единиц в год, из которых 80 млрд. единиц (количество, достаточное для лечения 200 больных) закупалось Центральной аптекой клиник, а затем в соответствии с рекомендациями комиссии распределялось между различными исследовательскими учреждениями.
В июле 1982 г. запасы интерферона исчислялись 70 млрд. единиц, а использовано было лишь 20 млрд. IPP и центры переливания крови были вынуждены прекратить производство препарата, так как он не находил сбыта, и обратились за разрешением экспортировать часть продукции. Такое положение дел объяснялось отсрочками испытаний препарата в больницах (первый эксперимент был начат только в августе 1981 г.), многочисленными предварительными этапами и необходимостью согласования этических и научных аспектов подобной операции. Ежемесячно использовалось всего 2 млрд. единиц лейкоцитарного интерферона. Однако, по заявлению министерства здравоохранения в июле 1982 г., прекращение производства препарата было временным. Следовало разработать мероприятия по улучшению работы комиссии с тем, чтобы не просто ускорить и децентрализовать клинические испытания (распространив их на всю страну, а также объединив с испытаниями, проводящимися в других европейских странах), но сохранить оригинальный и многообещающий подход к производству и использованию интерферона, разработанный во Франции. Несмотря на это, клинические испытания интерферона были прерваны в ноябре 1982 г.
Методу получения лейкоцитарного интерферона присущи два недостатка: во-первых, нормальные (т. е. не раковые) лейкоциты не удается культивировать, в связи с чем массовое их производство затруднено; во-вторых, чистота конечного продукта неудовлетворительна, в результате чего получалась смесь а-интерферонов. Институт Мерьё в Лионе (Франция) совместно с Вейцманновским институтом в Реховоте (Израиль) разработал установку для выделения интерферона из лейкоцитов, которые были получены из крови больных, страдающих хроническим миелоидным лейкозом, и подвергались стимуляции вирусом Сендай. Несколько центров переливания крови и гематологических отделений снабжали Институт Мерьё клетками крови, необходимыми для производства; в результате был достигнут значительно более высокий выход, чем в процессе с использованием нормальных лейкоцитов. Однако, поскольку метод был основан на культивировании раковых клеток, область применения получаемого при этом лейкоцитарного интерферона была ограниченной. В Институте Мерьё накоплен запас в 1500 млрд. единиц грубого препарата интерферона, очистку которого намеревались проводить по методу, разработанному в Вейцманновском институте и основанному на использовании моноклональных антител. В результате предполагалось получить препарат, очищенный на 80%, и использовать его главным образом в качестве противовирусного средства, прежде всего против вируса герпеса.
В августе 1980 г. «Белкам фаундейшн лтд» и «Сумитомо кемикал К°» подписали соглашение, по которому японская компания получала право использовать английскую технологию производства лимфобластоидного интерферона из лимфобластоидных клеток, полученных из лимфомы Бёркитта (выход составил 50 000 единиц интерферона на 1 млрд. клеток в культуре). Метод заключался в индукции культуры лимфобласгоидных клеток вирусом Сендай и выделении интерферона на хроматографических колонках с моноклональными антителами против того класса интерферона, который требовалось получить. Производственные мощности для выработки лимфобластоидного интерферона японская компания намеревалась построить к августу 1982 г., после проведения клинических испытаний с использованием интерферона, поступающего от «Белкам фаундейшн». Стоимость оборудования, по оценкам, составляла примерно 10 млн. долл. (1980).
Шведская компания «Каби витрум АБ» и ее филиал «Кабиген АБ», специализирующийся на генной инженерии, начали производить лимфобластоидный интерферон в 1980-1981 гг. В Институте Мерьё лимфобласты выращивались в ферментерах объемом по 2000 л; интерферон очищали с помощью моноклональных антител. Западногерманская фармацевтическая фирма «Хёхст» также производила лейкоцитарный интерферон из нормальных лейкоцитов и лимфобластоидных клеток.
Американское онкологическое общество в Нью-Йорке заявило в августе 1978 г. о своем намерении выделить 2 млн. долл. на закупку интерферона для испытаний в качестве терапевтического средства против четырех типов раковых заболеваний. И хотя бюджет увеличен до 7,3 млн. долл., реальные затраты составили всего 1,2 млн. долл., поскольку интерферон был доступен в явно недостаточных количествах. По данным Американского онкологического общества, стоимость 400 г интерферона, полученного и очищенного с помощью современных методов, составляла 2,2 млрд. долл. (по ценам 1980 г.), тогда как, согласно анализу Американской инвестиционной фирмы, в 1990 г. затраты на выпуск интерферона во всем мире составят 2,96 млрд. долл. Это поразительно высокая стоимость для продукта, который до сих пор находится на стадии разработки и до промышленного выпуска которого еще далеко. Как заявил Ф. Раушер, вице-президент Американского онкологического общества, лаборатории, занимающиеся получением этого вещества, ни при каких условиях не окажутся в проигрыше: даже если испытания его как средства против рака не увенчаются успехом, интерферон останется наиболее предпочтительным противовирусным препаратом.
В 1980 г. в Хьюстоне (шт. Техас) был учрежден Фонд интерферона, цель которого состоит в сборе средств (по меньшей мере 20 млн. долл.) в течение двух лет, с привлечением прежде всего нефтяных компаний. Компания «Шелл» предоставила фонду 2 млн. долл. и 1 млн. долл. Американскому онкологическому обществу.
Национальный институт рака США выделил в 1980 г. на исследования интерферона 10 млн. долл. Фармацевтическая компания «Уорнер Лэмберт» заключила с этим институтом контракт на сумму 895 000 долл., предусматривающий поставку в течение двух лет 50 млрд. единиц лейкоцитарного интерферона для лечения 150 раковых больных. Интерферон производился отделением фармацевтических исследований компании «Уорнер Лэмберт» / «Парк Дэвис», в блоке биологического развития комплекса Паркдейл, расположенного в Рочестере (шт. Мичиган). Препарат получали с использованием пленки лейкоцитов, образующейся при центрифугировании крови, побочного продукта донорской крови, который содержит лейкоциты, а также растворимые белки крови. Переработка в течение восьми дней включала 55 стадий, для испытаний на чистоту и токсичность требовалось еще шесть недель.
Лейкоцитарный интерферон производили в США и другие лаборатории: «Генентек», «Интерферон сайенсиз», «Шеринг-Плау» (α2-интерферон), а также Институт молекулярной биологии Роша. В Японии α2-интерферон получала фармацевтическая компания «Яманоучи» (Токио), которая планировала выпуск этого препарата после клинических испытаний в 1982 г.
Фибробластный интерферон (β-интерферон) синтезируется фибробластами (клетками соединительной ткани), получаемыми из тканей плода или из материала передней плоти при обрезании младенцев. Фибробласты удается поддерживать в культуре, поэтому они пригодны для массового производства интерферона; это проще, чем получать его из лейкоцитов. Но в сосудах с культурой фибробласты образуют пленку толщиной в одну клетку, что ограничивает выход интерферона. Его удается повысить введением в культуральную среду микроскопических гранул, к которым присоединяются клетки.
Метод получения фибробластного интерферона был разработан в исследовательском отделе лаборатории «Сёрл» в Хай-Уайкоме (Великобритания); производительность установок по культивированию клеток в 60 раз превышала применявшиеся ранее.
Лаборатории «Сёрл» и японская фармацевтическая компания «Мочида» объединили усилия в целях развития производства фибробластного интерферона, планируя выпускать его в Японии после проведения в 1981 г. клинических испытаний. «Мочида» имеет богатый опыт производства ферментативных препаратов (в частности, урокиназы фермента, экстрагируемого из мочи человека), а также гормонов. Еще одна японская компания «Хаясибара» также получала β-интерферон.
Лаборатории «Сёрл» снабжали β-интерфероном клинику М. Д. Андерсона и Институт рака в Техасском университете для проведения широкомасштабных клинических испытаний в лечении запущенных опухолей молочной железы, рака костного мозга или множественной миеломы, а также рака лимфатических узлов, или лимфомы.
Национальный институт рака США заключил контракт с компанией «Флоу дженерал», медикобиологический филиал которой«Флоу лэборатриз» планировал в 1981 г. поставлять 50 млрд. единиц фибробластного интерферона (этого количества достаточно для 50 000 доз). Метод получения был запатентован Массачусетским технологическим институтом (фибробласты выращивались на поверхности микроскопических гранул, а для повышения выхода интерферона использовали ряд технических усовершенствований).
Фибробластный интерферон выпускали в США и другие лаборатории, в частности лаборатории компаний «Коллаборэйтив рисёрч» и «Ки интерферон».
В Европе помимо английских лабораторий «Сёрл» центрами получения интерферона являются Лувенский университет в Бельгии, Институт Мерьё и компания «Санофи» (Тулуза) во Франции (планируемый выпуск 50 млрд. единиц в год), компании «Хёхст» в ФРГ и «Каби витрум АБ» в Швеции. В Венгрии для получения фибро бластного интерферона планировалось построить значительные производственные мощности к 1982 г.
Израильская компания «Индер еда», созданная при участии крупной итало-швейцарской компании и опирающаяся на научно-исследовательский отдел Вейцманновского института, в 1982 г. подписала соглашение с американскими инвестиционными фирмами на строительство в Реховоте завода по производству фибробластного интерферона, планируя начать выпуск препарата в 1984 г. Вложения составляли 5 млн. долл.; к тому же министерство промышленности, желая ускорить развитие в стране биотехнологии, выделило дополнительную субсидию на такую же сумму. Исследователи из Вейцманновского института в сотрудничестве с медиками из Медицинского центра в Шебе показали, что интерферон позволяет вылечить аденовирусный кератоконъюнктивит за 7 дней вместо 25 при лечении обычными противовирусными средствами. Эти клинические испытания проводились на 50 пациентах. Применение интерферона также сильно сократило число случаев кератита, который проявляется в изъязвлении роговой оболочки глаза и является частым осложнением при кератоконъюнктивите (в одном ярко выраженном случае больного удалось вылечить за пять дней).
ϒ-Интерферон, или иммунный интерферон, синтезируется в Т-лимфоцитах человека. Его образование может быть индуцировано рядом веществ, например белком А (энтеротоксином) стафилококков (Георгиадес в Техасском университете в Галвестоне стимулировал лимфоциты из грудного канала белком А и получил выход в 1000 единиц интерферона на 1 млн. клеток), сывороткой против лимфоцитов (Фалькофф, Институт Кюри, Париж), фитогемагглютинином или конканавалином А (Кирхнер, 1981).
Английская компания «Велкам» вырабатывала ϒ-интерферон из лимфобластоидных клеток, взятых у новорожденных хомячков. Объем ферментеров для культивирования был увеличен с 1000 до 8000 л.
Американская компания «Иммунно модерейторс лэборатриз» (IML) ежемесячно получала 10 млрд. единиц ϒ-интерферона из культур лимфоцитов, стимулированных митотическим агентом. Компания «Интерферон сайенсиз, инк» (Нью-Брунсвик, шт. Нью-Джерси), в 1982 г. получавшая 1 млрд. единиц в день, заключила с японской компанией «Грин кросс корп.» контракт на сумму 2,2 млн. долл. о поставке в течение 15 мес. сверхчистых препаратов α- и ϒ-интерферона.
Лаборатории Мэлой, контролируемые компанией «Ревлон индастриз», располагаются в Спрингфилде (шт. Вирджиния). По контракту с Национальным институтом рака (США) они должны были заниматься очисткой достаточных количеств ϒ-интерферона из лимфоцитов донорской крови. Предполагалось, что к концу сентября 1982 г. они должны произвести 5 млрд. единиц ϒ-интерферона, или приблизительно 1000 доз.
В целом методы получения интерферонов трех классов синтезируемого лейкоцитами, лимфобластоидными клетками·, · фибробластами и лимфоцитами характеризуются низкими выходами; стоимость продукции велика (так, стоимость промышленного получения в лучшем случае составляет 40-50 долл. за 1 млн. единиц), а чистота препарата недостаточна (хотя в случае лимфобластного интерферона ее удалось повысить с 0,1-10 до 10-50%). Поэтому очень большие надежды возлагались на способы получения интерферонов, основанные на методах рекомбинантных ДНК.

