Суспензию клеток можно получить из каллуса, поместив его в жидкую питательную среду с автоматическим перемешиванием. Используя фермент, например пектиназу, получаем суспензионную культуру непосредственно из ткани экспланта (лист, стебель, корень и т. д.). Вначале на поверхности экспланта образуется каллусная ткань, а затем уже от нее отделяются клетки и клеточные агрегаты, в результате чего получается клеточная суспензия. Для получения 100 мл клеточной суспензии необходимо 2–3 г свежей каллусной ткани.
Необходимым условием культивирования клеточных суспензий является постоянное перемешивание или встряхивание среды. Если клеточная суспензия находится в неподвижном состоянии, то деление суспензионных клеток приводит к образованию каллусной ткани.
Деление суспензионных клеток поддерживается при наличии ауксинов и цитокининов, т. е. тех гормонов, которые необходимы для индукции и роста каллусных клеток. Таким образом, суспензионные культуры представлены типичными каллусными клетками, обладающими всеми свойствами, характерными для клеток такого рода.
Суспензии лучше образуются из рыхлого каллуса, получаемого на средах с 2,4-Д. Исключение из питательной среды ионов кальция облегчает суспендирование. Еще более облегчает этот процесс добавление в среду фермента пектиназы, который разрушает пектат кальция, склеивающий отдельные клетки.
Клеточные суспензии в биотехнологии используют для получения вторичных метаболитов, многие из которых являются ценными лекарственными препаратами, для промышленного выращивания клеточной биомассы и для клеточной селекции. Наряду с этим суспензии клеток можно применять в качестве исходного материала для получения изолированных протопластов.
При использовании суспензионных культур в качестве продуцентов вторичных веществ применяют закрытые или открытые системы ферментеров в периодическом или проточном режимах выращивания клеток. В закрытой системе клеточная суспензия лишена притока свежей питательной среды до конца выращивания, а в случае непрерывного режима выращивания в открытой системе питательная среда меняется на свежую. Как при периодическом, так и при проточном режимах выращивания в открытой системе клетки остаются в питательной среде и не удаляются даже при ее замене. Однако в открытых системах культивирования при замене питательной среды (периодическом или непрерывном) вместе со средой отбирается и часть суспензионных клеток.
Для работы с клеточными суспензиями необходимо знать их характеристики: жизнеспособность, плотность клеток в суспензионной культуре, степень агрегированности, скорость роста.
Жизнеспособность клеток определяют по их окрашиванию красителем (метиленовая синь или синь Эванса). Живые клетки не окрашиваются красителем вследствие непроницаемости для него клеточных мембран. В мертвые клетки краска легко проникает, и они окрашиваются в синий цвет.
Одним из основных показателей, характеризующих состояние клеточной суспензии, является плотность клеточной популяции. Число клеток определяют в счетной камере Фукса – Розенталя (рис. 3.3.) под микроскопом после мацерации (разделения клеток). В качестве мацерирующего вещества применяют хромовую кислоту (10–20 %-ю), которая гидролизует средние пластинки, соединяющие клетки.
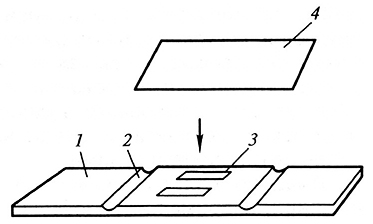
Рис. 3.3. Камера Фукса–Розенталя:
1 предметное стекло; 2 – желобок для удаления лишнего раствора;
3– область, в которой подсчитывают клетки; 4 – покровное стекло
Хорошо растущая суспензия имеет, как и каллусная культура, S-образную кривую роста. Обычно длительность пассажа составляет 14–16дней. При этом плотность возрастает от 5 • 104до 5 • 10бкл/мл. Суспензия для субкультивирования берется в конце экспоненциальной фазы. Увеличение числа клеток, их сырой и сухой массы – основные критерии роста суспензионных культур.
Качество суспензии зависит от степени агрегированности ее клеток. Агрегаты не должны содержать более 10–12 клеток. Поэтому, чтобы избавиться от крупных агрегатов, суспензии фильтруют через марлевые, найлоновые или металлические фильтры. Одновременно это позволяет освободиться от остатков экспланта или плотных кусков каллусной ткани.
Суспензионные культуры могут быть источником ценных вторичных метаболитов, и в них могут быть новые необычные соединения, например камптотецин, харрингтонин и другие антиканцерогены, пептиды (ингибитор протеаз, ингибитор фитовирусов) и др.
Следует отметить, что деление клеток, приводящее к увеличению клеточной биомассы, и синтез вторичных метаболитов разобщены во времени. Синтез вторичных метаболитов достигает максимума в стационарной фазе роста.
3.7. КУЛЬТУРА ОДИНОЧНЫХ КЛЕТОК
Для генетических и физиологических исследований, а также для практического использования в клеточной селекции очень ценным является культивирование отдельных клеток. Получение клона–потомства одиночной клетки помогает разобраться в причинах генетической неоднородности каллусных клеток, так как наблюдения в данном случае проводят на ткани, полученной не из гетерогенного экспланта, а из одной клетки.
Одиночная гибридная клетка, выделенная из культуры изолированных протопластов, при дальнейшем ее делении позволяет получить клон, состоящий из гибридных клеток. Это намного облегчает работу исследователя, так как устраняет необходимость отбора потомства в культуре изолированных протопластов от негибридных, что представляет значительные трудности. Кроме того, сам процесс соматической гибридизации лучше наблюдать, если работа ведется с одиночными протопластами.
Выделяют одиночные клетки из клеточных суспензий, из тканей растений, например из мезофилла листа после его мацерации ферментами, из культуры изолированных протопластов после восстановления клеточной стенки.
Для получения одноклеточной фракции суспензионной культуры иногда достаточно простого отстаивания в колбе в течение 15–30 мин. При этом крупные агрегаты оседают на дно колбы, а надосадочная фракция содержит только одиночные клетки или мелкие агрегаты. В том случае, когда при отстаивании не удается получить одноклеточную фракцию, применяют мацерирующие ферменты, центрифугирование в градиенте сахарозы или фильтрование через сита (найлоновые или металлические).
Трудности культивирования одиночных клеток связаны с тем, что отдельная клетка не делится в тех условиях, в которых хорошо растет каллусная ткань. Для того чтобы заставить одиночные клетки делиться, разработаны специальные методы. В 1960 г. Джонсон предложил метод «няньки», при котором функцию «няньки», стимулирующей деление одиночной клетки, выполняют кусочки каллусной ткани, отделенные от нее фильтровальной бумагой. В присутствии «няньки» одиночная клетка делится и дает индивидуальную колонию клеток – клон.
Другой метод основан на использовании очень малых объемов богатой питательной среды и представляет собой культивирование одиночных клеток в микрокапле в чашке Купрака объемом 20 мкл. Метод предложен академиком Ю.Ю. Глебой. В микрокаплях удобно наблюдать за слиянием и делением клеток при соматической гибридизации.
Для индукции клеточных делений у одиночной клетки можно использовать также «кормящий слой» (активно делящиеся клетки суспензионной культуры того же вида растений, что и одиночная клетка) (рис. 3.4). Стимулирует клеточное деление и кондиционирование среды, для чего в нее добавляют питательную среду от интенсивно делящейся культуры клеток. Кондиционирующий фактор получают при фильтровании клеточной суспензии в экспоненциальной фазе роста через бактериальный фильтр. По сути дела все перечисленные методы основаны на использовании выделений из делящихся клеток – кондиционирующего фактора.
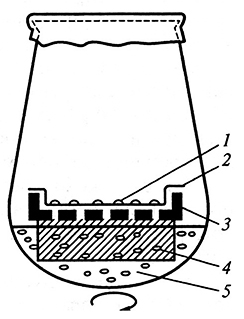
Рис. 3.4. Использование в качестве «няньки» культуры суспензионных клеток при выращивании
изолированных протопластов и одиночных клеток:
1 – колонии клеток; 2 – фильтровальная бумага; 3– алюминиевая сетка;
4 – пенополиуретан; 5– суспензия клеток (By Дык Куанг, З.Б. Шамина, 1985)
Несмотря на многочисленные попытки определить химическую природу и раскрыть механизм действия кондиционирующего фактора наделение клеток, добиться этого пока не удалось. Однако уверенно можно сказать, что этот фактор термостабилен, водорастворим, включает низкомолекулярные вещества и не заменяется фитогормонами (А.И. Павлова, Р.Г. Бутенко, 1969). К сказанному можно добавить, что вещество стабильно при рН 4–11, молекулярная масса его ~ 700 Д и этот фактор является синергистом брассиностероида (Bellmcampi, Morpurgo, 1987). Таким образом, исследования показали, что это не чисто химическое вещество, а сумма веществ, которые выделяются из клетки.
3.8. МОРФОГЕНЕЗ В КАЛЛУСНЫХ ТКАНЯХ
Существует несколько путей, по которым может идти развитие клетки после ее дедифференцировки. Первый путь – это вторичная регенерация целого растения, возможна дифференцировка на уровне клеток, тканей, органов. Второй путь – это утрата клеткой способности к вторичной дифференцировке и регенерации растения, стойкая дедифференцировка, приобретение способности расти на среде без гормонов, т. е. превращение в опухолевую. Такими свойствами часто характеризуются клетки старых пересадочных культур. Третий путь – это нормальный цикл развития каллусной клетки, заканчивающийся ее старением и гибелью. В этом случае клетка претерпевает вторичную дифференцировку и прекращает делиться (стационарная фаза роста). Однако такая дифференцировка не ведет к морфогенезу, а закрепляет за ней свойства старой каллусной клетки.
Для сельскохозяйственной биотехнологии наибольший интерес представляет регенерация в культуре тканей из отдельной клетки целого растения. Иногда этот путь лежит через образование отдельных органов.
В культуре каллусных тканей морфогенезом называют возникновение организованных структур из неорганизованной массы клеток. Существует два основных типа морфогенеза (рис. 3.5). В культуре тканей он может проявляться в виде органогенеза (образования монополярной структуры, т. е. отдельных органов): корневого, стеблевого, реже флорального (цветочного) или листового, а также в виде соматического эмбриогенеза (образования биполярных зародышеподобных структур из соматических клеток). В случае органогенеза сначала регенерируют отдельные органы, а затем уже из них – целые растения, исключение составляет корневой органогенез (рис. 3.6).
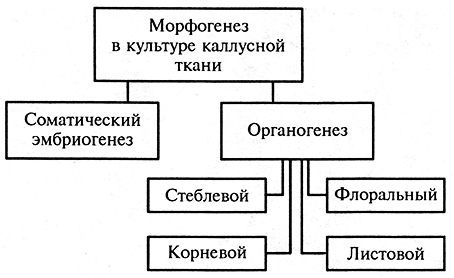
Рис. 3.5. Типы морфогенеза в культуре каллусной ткани
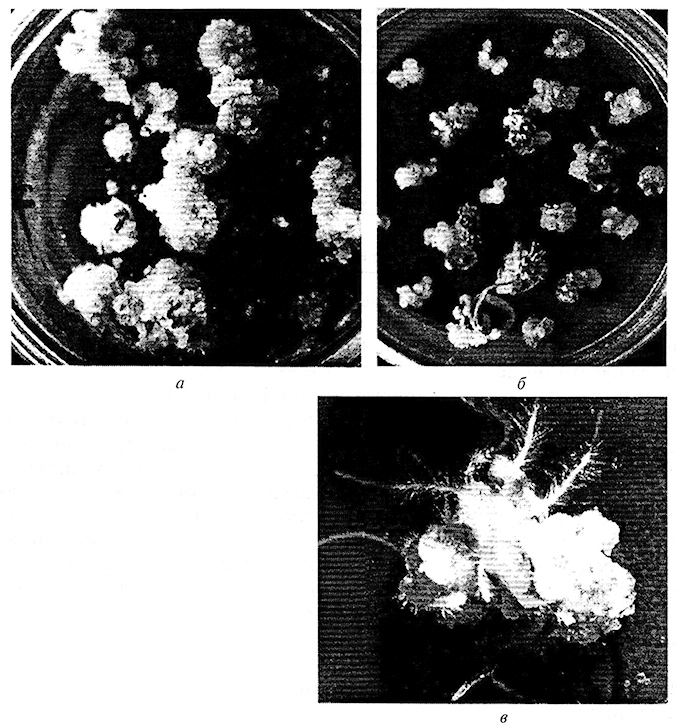
Рис. 3.6. Морфогснстические реакции каллусной ткани:
а – пролиферируюший каллус: б – образование адвентивных почек; в –образование корней (ризогенез)
В результате соматического эмбриогенеза в отличие от органогенеза сразу образуется зародыш, имеющий как меристему корня, так и меристему верхушечной почки, из которого в дальнейшем развивается целое растение.
Способность отдельной соматической клетки полностью реализовывать свою программу развития и давать начало целому растительному организму называют тотипотентностью растительной клетки. Любая растительная клетка обладает одинаковыми потенциальными возможностями, так как содержит весь набор генов и, следовательно, клетки сохраняют свойственную зиготе программу развития. Поэтому если мы получаем каллус из клеток лепестка цветка, или из клеток сердцевинной паренхемы стебля, или из клеток любой ткани, то в принципе каждая такая клетка может регенерировать целое растение. Однако свойство тотипотентности не всегда реализуется, так как потенциальные возможности клеток разных типов проявляются неодинаково. В некоторых из них гены в сильной степени репрессированы, в связи с чем проявление тотипотентности становится ограниченным.
Идея о тотипотентности растительной клетки была выдвинута Г. Хаберландтом еще в 1902 г., хотя и не получила тогда экспериментального подтверждения. Согласно определению Г. Хаберландта, любая клетка растения может дать начало новому организму, и если этого не наблюдается, то только потому, что растительный организм подавляет потенциал клетки к развитию. Изоляция клеток от растений способствует проявлению этого потенциала.
Клеточную основу морфогенеза составляет цитодифференцировка. Регенерация растения начинается со вторичной дифференцировки клеток. При этом дедифференцированные клетки вновь приобретают структуру и функции специализированных.
Вторичная дифференцировка каллусных клеток не всегда заканчивается морфогенезом и регенерацией растения. Иногда она приводит только к образованию тканей (гистодифференцировка). Таким путем каллусная клетка может превращаться во флоэмные или ксилемные элементы. Другим примером вторичной дифференцировки может служить превращение дедифференцированной активно пролиферирующей клетки в старую неделящуюся каллусную клетку (стационарная фаза роста).
Из всех видов вторичной дифференцировки наибольший интерес представляет морфогенез, так как он позволяет получать целое растение из каллусной клетки.
В основе дифференцировки и морфогенеза лежит последовательное включение различных генов, т. е. дифференцировка клеток определяется дифференциальной активностью генов. Изменение активности структурных генов может быть связано с их дерепрессией, репрессией или амплификацией (умножение). Большую роль в этом процессе играют фитогормоны.
Таким образом, различия в балансе экзогенных гормонов ауксинового и цитокининового типов определяют, с одной стороны, возможность перехода клетки в культуре к дедифференцировке и неорганизованной пролиферации, а с другой – индукцию вторичной дифференцировки того или иного типа морфогенеза, что было отмечено Ф. Скугом и Е. Миллером (1957). Следовательно, ауксины и цитокинины, вызывающие в зависимости от соотношения либо дедифференцировку и переход к каллусному росту, либо дифференцировку и морфогенез в культуре каллусных тканей, являются не только регуляторами роста, но и регуляторами дифференцировки.
Если органогенез можно индуцировать с помощью ауксинов или цитокининов, то соматический эмбриогенез фактически независим от экзогенных фитогормонов. Обычно эмбриогенные зоны возникают в каллусной ткани на той же питательной среде, которая использовалась для каллусообразования. Развитие соматических зародышей в каллусной ткани начинается тогда, когда устраняется дедифференцирующий фактор из питательной среды (2,4-Д или другие ауксины). Развивающийся зародыш не нуждается в экзогенных гормонах, так как сам обеспечивает себя ими.
Независимость соматического эмбриогенеза от гормонов является аргументом в пользу точки зрения, высказанной еще Г. Хаберландтом, а позднее Ф. Стэвардом, что сам процесс изолирования клетки стимулирует реализацию ее тотипотентности, т. е. переход к морфогенезу. Таким образом, основными стимулами морфогенеза являются изменения соотношения гормонов в питательной среде, а также сам процесс изоляции растительной клетки от организма. Дополнительными индукторами морфогенеза в культуре каллусных тканей является присутствие в питательной среде нитрата серебра, нитрата аммония, некоторых аминокислот (пролин, тирозин, иногда серин), полиаминов (путресцин и спермидин). В ряде случаев стимулируют процесс морфогенеза маннит и сорбит. Ионы NO–3 оказывают влияние на развитие возникших в каллусной ткани организованных структур, а их индукцию стимулируют ионы NH+4. Гибберелловая кислота стимулирует рост зачатков стебля, а абсцизовая ускоряет дифференцировку органов соматических зародышей.
Интересно отметить, что некоторые из перечисленных веществ, например нитрат серебра, продлевают регенерационную способность в старых пересадочных культурах.
Под влиянием того или иного индуцирующего фактора морфогенеза каллусная клетка должна стать детерминированной, однако не все клетки, а лишь одна из 400–1000 становится на путь регенерации. Следовательно, для перехода к морфогенезу недостаточно индуктора (стимула), а необходимо, чтобы клетка была готова к ответу на него. Способность воспринимать стимулы морфогенеза называют компетентностью клетки. Исследователи пришли к выводу, что компетентность клеток – событие случайное и поэтому столь редкое. В связи с этим напрашивается вопрос о судьбе тех каллусных клеток, которые в силу некомпетентности не способны воспринять стимулы морфогенеза и детерминироваться. В пересадочной культуре эти клетки продолжают делиться и скорее всего становятся на путь перехода к гормононезависимости. Однако не все каллусные ткани со временем завершают развитие возникновением гормононезависимости. Многие из них в силу генетических особенностей продолжают использовать экзогенные гормоны, но полностью утрачивают способность к регенерации. Такие ткани занимают промежуточное положение между «привыкшими» и свежими каллусными тканями.
Морфогенез в каллусной ткани начинается с того, что под влиянием соответствующих условий детерминированная клетка обособляется от окружающих ее каллусных клеток, образуя утолщенную клеточную стенку. Это явление было обнаружено в 1972 г. Н. Данилиной при изучении соматического эмбриогенеза в культуре ткани моркови.
Клетка-инициаль при соматическом эмбриогенезе дает начало зиготе, а при органогенезе – меристематическому очагу. От недетерминированных каллусных клеток инициальная отличается более крупным ядром и меньшими размерами вакуолей. Ядро обычно занимает центральное положение. В инициальных клетках содержатся большие количества запасных веществ: крахмала, иногда – липидов.
Некоторое время инициальные клетки находятся в лаг-фазе, что необходимо для их перестройки и подготовки к последующим быстрым делениям. Затем эти клетки делятся по типу дробления, образуя сферическую массу мелких изодиаметрических клеток. В случае органогенеза эту массу клеток называют меристематическим очагом, а в случае соматического эмбриогенеза – глобулярным проэмбрио. В дальнейшем в меристематическом очаге дифференцируются зачатки стебля, корня, листа или цветочной почки и соответственно происходит стеблевой, корневой, листовой, или флоральный, органогенез. В глобулярном проэмбрио развивается биполярная эмбриоидная структура. Можно выделить несколько последовательных стадий формирования соматических эмбриоидов из каллусной клетки: глобулярную, сердечка, торпедовидную, соматического зародыша (рис. 3.7). Меристематические очаги или проэмбрио могут возникать на периферии каллусной ткани или быть погруженными в нее. Обычно не наблюдается определенной закономерности в их локализации (рис. 3.8). Исключение составляет стеблевой органогенез в каллусной ткани, полученной из сердцевинной паренхимы табака сорта Висконсин-38. Меристематические очаги здесь всегда локализуются только в нижней части каллусной массы.
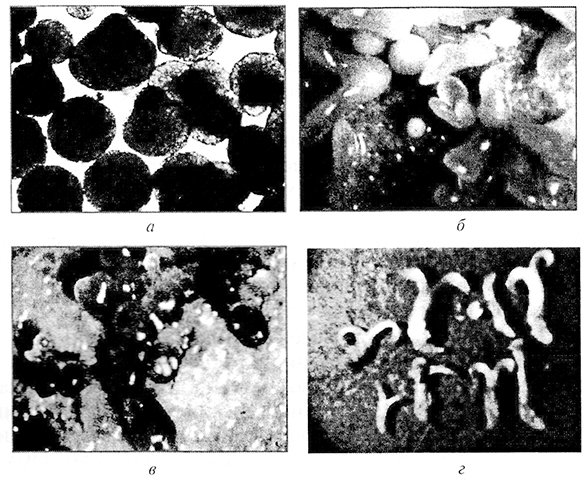
Рис. 3.7. Стадии соматического эмбриогенеза:
а – глобулярная; б– сердечко; в – торпсдовидная; г – соматический зародыш
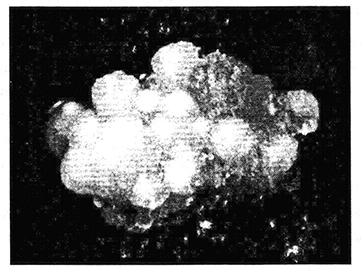
Рис. 3.8. Формирование соматических зародышей (глобулярная стадия) пересадочной ткани ячменя
При переходе каллусных клеток к морфогенезу происходит существенное изменение их метаболизма. Морфогенезу предшествует появление в клетках белков-антигенов. Работами Р.Г. Бутенко, Н.И. Володарского и Н.А. Моисеевой показано, что морфогенез в культуре каллусных тканей табака характеризуется включением и выключением синтеза определенных белков-маркеров. В меристемах обнаружено два белка-антигена, которые являются маркерами этих клеток. Одновременно показано, что индуцированная детерминация клеток каллусной ткани сопряжена с появлением в ней антигена-маркера клеток меристемы стебля.
Белок (гликопротеид), выделенный из эмбриогенных культур, можно рассматривать как кондиционирующий фактор. При частых пересадках на свежую питательную среду, где гликопротеид накапливаться не может, эмбриогенез не идет. Если белок, появляющийся в клетках при переходе к соматическому эмбриогенезу, выделить и ввести в длинные (неэмбриогенные) каллусные клетки, у которых гены морфогенеза не работают или потеряны, то в них индуцируется переход к морфогенезу.
Работы по поиску новых маркеров морфогенеза продолжаются. Клетки меристематических очагов и клетки, дающие начало эмбриоидным структурам, отличаются от каллусных интенсивным синтезом РНК и ДНК, что связано с особенностями их белкового обмена. Изменения в белковом обмене сходны с теми, которые происходят при дедифференцировке клетки, но итоги у них различны. По мнению Р.Г. Бутенко, специфика реакции определяется не общим усилением синтеза макромолекул, что необходимо для усиленной пролиферации, а теми уникальными синтезами, которые идут на этом общем фоне и обусловливают появление белков регуляторного типа. Переход к морфогенезу в культуре каллусных тканей сопровождается значительными изменениями дыхательного метаболизма. В целом дыхание (по СОг) усиливается, но изменяется его характер в направлении интенсификации пентозофосфатного пути. Возрастает активность дыхательных ферментов. Вслед за биохимической наступает структурная реорганизация клетки. Биохимическая дифференцировка клетки всегда предшествует структурной. В клетках, вступивших на путь морфогенеза, возрастает число рибосом, митохондрий, меняется их внутренняя структура.
Процессы морфогенеза в каллусных клетках происходят асинехронно и продолжительно. Одновременно в каллусной ткани могут иметься как полностью сформированные структуры, так и клетки, только что вступившие на этот путь.
Повышенная синтетическая активность клеток меристематического очага и глобулярного проэмбрио делает их аттрагирующим центром, в который устремляются питательные вещества. Окружающие каллусные клетки при этом часто разрушаются и образующиеся эмбриоиды легко выпадают из массы каллусных клеток.
Каллусные клетки не связаны между собой плазмодесмами или последние сильно редуцированы. При появлении зародышеподобных структур или меристематических очагов между клетками снова восстанавливается связь с помощью плазмодесм.
Все изменения, происходящие при морфогенезе и заканчивающиеся регерацией из каллусной клетки растения, управляются (контролируются) специальными генами. В настоящее время одни ученые считают, что признак морфогенеза полигенен и контролируется несколькими хромосомами, другие пришли к заключению, что этот признак определяется двумя ядерными генами. Тот факт, что морфогенетическая активность каллусных клеток имеет генетическую природу, объясняет, почему не удается в ряде случаев получить регенерацию из каллусной ткани тех или иных генотипов. Регенерационную способность может увеличить скрещивание генотипов, морфогенетически активных in vitro.
Факторы, влияющие на морфогенез каллусной ткани
Процесс морфогенеза in vitro зависит от ряда факторов, главные из которых следующие: физиологические, минеральный состав питательной среды, баланс экзогенных и нативных гормонов, физические, а также присутствие сигнальных белков и белков-акцепторов – условия, обязательные для получения клеток, способных к морфогенезу.
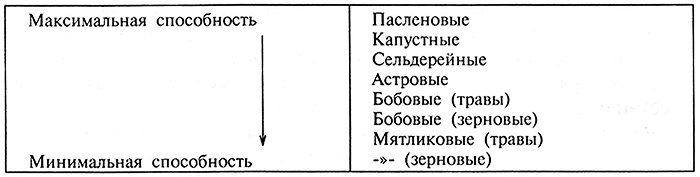
Способность каллусных клеток к формированию монополярных и/или биполярных структур главным образом зависит от видовых и сортовых особенностей исследуемых генотипов, для которых принципиально важно учитывать принадлежность его к одно- или двудольным растениям, а также тип первичного экспланта. В табл. 3.3. представлены различные семейства, растения которых способны к морфогенезу в той или иной степени.
Таблица 3.3. Перечень семейств высших растений, расположенных
по степени снижения способности к морфогенезу (по Р.Г, Бутенко, 1999)
Материнский эффект при наследовании способности к морфогенезу отмечался рядом авторов (Ж.К. Джардемалиев и др., 1994; Н.И. Орлов и др., 1994). Однако никем не уточнялось, какие именно органеллы (хлоропласты или митохондрии) несут гены, ответственные за регенерационную способность растительных тканей. В работах Ю.И. Долгих (2005) показано, что все стерильные линии кукурузы обладали пониженной по сравнению с фертильной формой способностью индуцировать морфогенный каллус. На основании полученных данных было сделано предположение о вероятном участии митохондриальных генов в регуляции процесса морфогенеза.
Физиологический возраст первичного экспланта, из которого была получена каллусная ткань, имеет несомненное значение в проявлении способности каллусных клеток к морфогенезу. Установлена прямая корреляция между возрастом первичного экспланта и морфогенезом: чем моложе эксплант, тем большей морфогенетической активностью обладают каллусные клетки. С увеличением возраста исходного материала, как правило, снижается способность каллусной ткани к морфогенезу.
Существенное влияние на реализацию морфогенетического потенциала каллусной ткани оказывает число субкультивирований ее в условиях in vitro. С увеличением числа пассажей значительно снижается степень морфогенетической активности каллусных клеток. Особо это проявляется на трудных объектах, таких как пшеница, ячмень, рис, подсолнечник и других культурах.
Применение экзогенных гормональных препаратов и изменение их соотношения и концентраций является главным фактором, влияющим на морфогенез каллусной ткани. Преобладание содержания ауксина над цитокинином приводит к дифференциации меристематических очагов корня, а преобладание цитокинина над ауксином – меристематических очагов апекса, дающих начало росту адветивным побегам.Изучению регуляции морфогенеза экзогенными факторами посвящено много работ, однако молекулярные механизмы эндогенной регуляции почти не исследованы. Учитывая большое значение баланса эндогенных гормонов в определении тотипотентности (Л.A. Лутова, 2003), можно предположить, что компетентность клеток к морфогенезу в значительной степени обусловлена количеством и соотношением эндогенных регуляторов роста. При сопоставлении уровней гормонов в морфогенных и неморфогенных тканях некоторых видов растений были обнаружены заметные различия. Экспериментально доказано, что в большинстве случаев для морфогенных тканей характерно преобладание цитокининов над ауксинами и невысокий уровень АБК, а для неморфогенных – обратное соотношение (Ю.И. Долгих, 2005).
Из трофических факторов особое внимание необходимо уделять минеральным солям, содержащих азот в нитратной или аммонийной форме. Присутствие в питательной среде NH4+ необходимо для начала морфогенеза, тогда как для роста и развития дифференцированных морфогенных структур предпочтение по концентрации отдается N0–3.
Не только минеральные соли могут регулировать морфогенетические процессы в каллусной ткани, но и добавление в питательную среду аминокислот (тирозин, аспарагин, глютамин), а также нитрата серебра (для ингибирования синтеза этилена) значительно повышает морфогенетическую активность каллусных клеток.
Особое влияние на морфогенез каллусной ткани оказывают стрессовые факторы – тяжелые металлы, хлорид или сульфат натрия, низкие положительные температуры, низкие концентрации токсинов или культурального фильтрата патогенов. Например, в конце 60-х годов XX в. в лаборатории академика РАСХН и чл.-корр. РАН Р. Г. Бутенко Института физиологии растений РАН на культуре ткани моркови показано стимулирующее действие 0,5 %-го NaCl на морфогенез и регенерацию растений in vitro, что было в дальнейшем подтверждено на каллусной культуре пшеницы. На культуре каллусных клеток риса установлена положительная роль низких положительных температур на морфогенетический потенциал дедифференцированных клеток.
Интенсивность освещения, спектральный состав света, температурный режим, а также другие физические факторы воздействия оказывают особое влияние на морфогенез каллусной ткани. Доказано, что дифференциация адвентивных почек в каллусной ткани происходит при ее культивировании на свету с белым или синим спектральным составом, в то время как при использовании света красного спектрального состава в каллусной ткани дифференцируются меристемы корня. Для большинства растений температурный оптимум составляет 23–25 °С. Однако среди исследуемых растений существуют исключения, например подсолнечник, для которого температурный режим, обеспечивающий морфогенез каллусной ткани, находится в пределах 18–22 °С.
Таким образом, для повышения морфогенетического потенциала каллусной ткани необходимо подбирать индивидуальные условия культивирования для каждого исследуемого генотипа, учитывая при этом его генотипические особенности.
3.9. КУЛЬТУРА КАЛЛУСНЫХ КЛЕТОК
В ПОЛУЧЕНИИ ВЕЩЕСТВ ВТОРИЧНОГО СИНТЕЗА
Существующие методы субкультивирования изолированных клеток в условиях in vitro, позволяют использовать их как для фундаментальных исследований, так и для практического применения. Особый интерес представляет способность изолированных клеток, тканей и органов синтезировать вещества вторичного метаболизма, которые широко используются в медицине, защите растений, ветеринарии, кормопроизводстве, пищевой промышленности, парфюмерии и др. Такой интерес исследователей к этому направлению работ неслучаен, так как клеточная биотехнология для получения физиологически активных веществ имеет ряд преимуществ по сравнению с использованием традиционного растительного сырья: 1) получение биомассы клеток не зависит от сезона, климатических и почвенных условий; 2) возможность оптимизировать условия культивирования суспензии клеток, позволяющих синтезировать в-необходимом количестве нужные вещества; 3) автоматизация процесса.
Установлено, что каллусные клетки, культивируемые in vitro, так же, как и клетки интактного растения, могут синтезировать вторичные метаболиты. Причем по качественному и количественному составу они могут быть схожи. Так, в Институте физиологии растений РАН в отделе биологии клетки и биотехнологии собрана большая коллекция клеточных культур растений из различных семейств, синтезирующих вторичные метаболиты, широко используемые в промышленности. К ним относятся: женьшень дальневосточный – источник диосгенина, диоскорея дельтовидная – стероидные гликозиды, равольфия змеиная – продуцент антиаритмического алкалоида аймалина, стевия – стевиозид и т. д. В последние годы особый интерес представляют исследования по культивированию в биореакторах изолированных клеток тиса ягодного. Установлено, что клетки данного растения синтезируют вещество – таксон, которое является антираковым препаратом.
Экспериментально доказано, что прирост клеточной биомассы в условиях in vitro и in vivo может проходить с разной скоростью. Например, за год прирост корня женьшеня в тайге составляет 1 г, на плантации – 3 г. При выращивании клеток корневого происхождеиия на агаре (in vitro) можно получать0,4 гсухой массы налитр среды вдень. Биомасса клеток женьшеня в суспензии при выращивании в 50-литровом ферментере увеличивается на 2,0 г в литре среды за сутки, что в 1000 раз больше, чем при выращивании на плантации. Учитывая высокую стоимость женьшеня (килограмм плантационного корня стоит 100–150 дол. США; цена дикорастущего корня может доходить до нескольких тысяч долларов США), биотехнологический способ получения биомассы культуры клеток женьшеня весьма привлекателен.
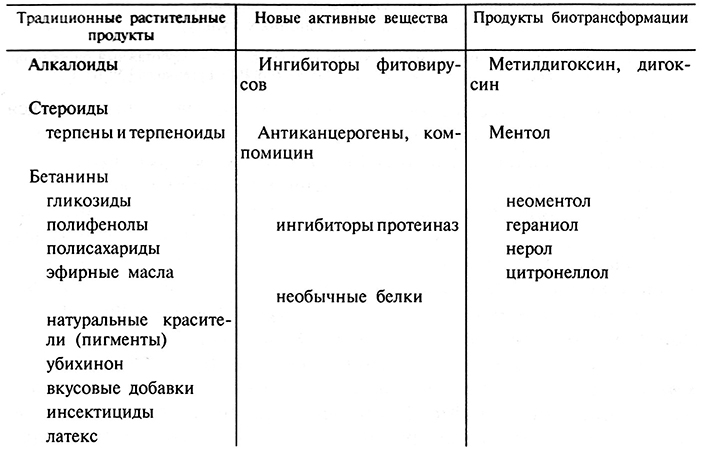
В табл. 3.4 приведены некоторые экономически важные продукты, синтез которых получен в культуре клеток высших растений.
Таблица 3.4. Экономически важные продукты,
полученные в культуре клеток высших растений (по Р.Г. Бутенко, 1999)
Вещества вторичного синтеза, как правило, получают из суспензионной культуры, которую выращивают в биореакторах. По своей конструкции биореакторы бывают барботажные, в которых перемешивание осуществляется путем аэрирования воздухом за счет поднимающихся пузырьков воздуха, и с применением механических перемешивающих устройств (рис. 3.9).
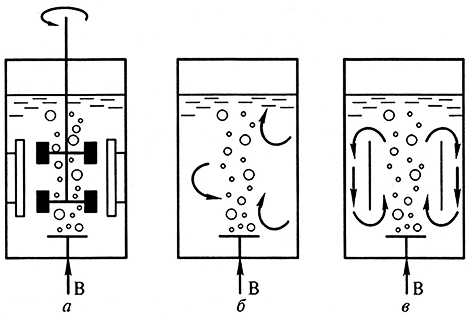
Рис. 3.9. Принципиальные схемы биореакторов, наиболее часто применяемых для выращивания суспензионных культур:
а –биореактор с механическим перемешивающим устройством;
б– барботажный биореактор; в – аэролифтный биореактор; В – воздух (по Р.Г. Бутенко, 1999)
Важной характеристикой клеток популяции является ее стабильность в отношении синтеза, транспорта и депонирования метаболитов (Р.Г. Бутенко, 1999). Стабильность может сохраняться в течение всего времени существования популяции, медленно снижаться за счет постепенного увеличения числа клеток со сниженным синтезом метаболитов и быть нестабильной в случае быстрой потери способности клеток синтезировать вторичные метаболиты.
Исследования показали, что, как правило, синтез вторичных метаболитов происходит во внутриклеточных органеллах: пластидах, хлоропластах, митохондриях, ЭПР, лейкопластах; транспорт в соседние клетки или питательную среду не происходит, а вакуоли и свободное пространство клетки часто используются для накопления (депонирования) метаболитов (И. Князьков, 1996).
Количественный и качественный состав вторичных веществ возможно менять за счет изменения состава питательной среды при выращивании клеток in vitro. Например, на культуре женьшеня было показано, что соотношение различных форм азота в питательной среде влияло на продуктивность стероидных сапонинов. Так, соотношение аммонийного и нитратного азота 1 : 3 приводило к увеличению биомассы, а соотношение 2 : 3 не оказывало влияния на продуктивность, но приводило к снижению накопления диосгенина. Повышенные концентрации сахарозы (5 %) в среде более эффективны для роста массы клеток, а пониженные концентрации (1,5 %) – на продуктивность диосгенина. Фитогормоны не оказывают существенного влияния на продуктивность культур по биомассе.Технология выращивания культур клеток в биореакторах является масштабным процессом, т. е. разрабатываются условия культивирования клеток в биореакторах большого объема. К настоящему времени накопилось много факторов об успешном масштабировании различных культур клеток в биореакторах объемом несколько кубометров. Например, специалисты немецкой фирмы DIVERSA (ныне – FYTON) осуществили выращивание ряда культур в биореакторах объемом до 75 000 л. В промышленном масштабе в России осуществлено получение биомассы женьшеня на Омутнинском биохимическом заводе в биореакторах объемом до 2,5 м3. В ТОО «Тэмбр» (г. Ярославль) осуществлено проточное культивирование клеток женьшеня в промышленных биореакторах объемом 7,5 м3 (по Р.Г. Бутенко, 1999). В Институте физиологии растений A.M. Носов с сотр. оптимизировал режимы культивирования целого ряда различных культур клеток высших растений в биореакторах объемом 630 л: женьшеня настоящего, полисциаса и других аралиевых, диоскореи дельтовидной, маральего корня и др.

