13.1. ОБЩИЕ ПОЛОЖЕНИЯ
Биотехнологические и биоинженерные методы применяются во многих областях науки и отраслях производства. Их использование, особенно генетической инженерии, может оказать колоссальное влияние на развитие агропромышленного комплекса России и мира. С учетом реальных достижений и значимости указанных приоритетных направлений науки ведущие биотехнологи и экономисты мира прогнозируют увеличение масштабов реализации биотехнологической продукции на мировом рынке в ближайшие годы до 20–25 % от общего объема товарооборота.
На первом этапе становления биотехнологии как науки ученые и практики преувеличивали возможные темпы ее развития и получения экономически значимых результатов. Сегодня уже мало кто сомневается в том, что их достижения – дело ближайшего времени. Вначале дискуссия развернулась главным образом вокруг того, в каких областях экономики могут быть достигнуты наибольшие результаты. В дальнейшем она приобрела направленность, связанную с биобезопасностью, что оказало отрицательное влияние на темпы и масштабы научного поиска и усвоения достигнутых результатов в производстве, особенно в биоинженерии. Без биотехнологии и биоинженерии мировое сообщество не сможет решить коренные проблемы развития цивилизации.
13.2. СЕЛЕКЦИЯ И РАСТЕНИЕВОДСТВО
Важнейшее место биотехнологии и биоинженерии принадлежит в современной селекции растений на устойчивость и качество продукции, создание нового поколения сортовых ресурсов страны и мира. Основные исследования биотехнологов направлены на создание улучшенных и принципиально новых генотипов сельскохозяйственных растений, обладающих единичной, групповой или комплексной устойчивостью к биотическим или абиотическим стрессовым факторам среды при сохранении и повышении их продуктивности и качества. Эпифитотийный характер распространения наиболее опасных грибковых, вирусных и бактериальных заболеваний культурных растений, уничтожающих до 30 % (и более) урожая, создали в России и ряде других стран мира ситуацию, при которой потребность в обновлении сортовых ресурсов сельскохозяйственных культур на основе сочетания традиционных и новых методов селекции и биотехнологии стала исключительно острой.
Посевы пшеницы, ячменя и других зерновых культур на огромных территориях во всех сельскохозяйственных регионах страны поражаются комплексным заболеванием – корневыми гнилями, а также ржавчинами, септориозом, гельминтоспориозом, мучнистой росой и др. Поражение посевов озимой пшеницы фузариозом колоса (Fusarium nivale) на Северном Кавказе приводит к накоплению в зерне опасных для здоровья людей и животных микотоксинов. В отдельные, влажные годы этой болезнью поражалась половина собранного урожая зерна. Поражение подсолнечника в этой зоне склеротинией и фомопсисом в годы с пониженной температурой и повышенной влажностью среды возрастает до 50 % и более. Картофель и томаты повсеместно поражаются фитофторозом, что резко снижает урожай этих ценных продовольственных культур и приводит к большим потерям при хранении. Пероноспороз почти ежегодно уничтожает на больших площадях посевы огурцов и лука.
Частые, обширные и жесточайшие засухи вызывают повреждения и гибель посевов зерновых и других культур, резко снижают валовые сборы зерна и всей продукции растениеводства. Низкие температуры и другие неблагоприятные факторы перезимовки приводят к изреживанию и гибели посевов озимых и зимующих культур на больших площадях, достигающих 50 % и более.
Недобор урожая имеет место на кислых и засоленных почвах, площади которых составляют в России соответственно 68,9 и 16,3 млн га сельскохозяйственных угодий страны. Выбросы в атмосферу промышленными предприятиями ядовитых соединений, загрязнение воздуха, воды и почв тяжелыми металлами и другими вредными продуктами техногенного происхождения приводят к повреждению посевов, накоплению ими опасных для людей веществ. Значительная часть земель в западном и центральном регионах России загрязнена радионуклидами – как следствие чернобыльской и других катастроф.
Попытки селекционеров создать комплексно устойчивые сорта и гибриды сельскохозяйственных культур только традиционными методами селекции не привели к желаемым результатам. Использование трансгрессивной селекции, основанной на отдаленной гибридизации, позволило решить ряд частных проблем устойчивости культурных растений к стрессовым факторам среды. Однако в целом эта проблема остается исключительно острой. В перспективе, в связи с прогнозируемым возможным ухудшением климата, она может стать еще более опасной.
Клеточные и генные инженеры, используя новые и новейшие, в том числе биотехнологические методы, создали ряд генотипов растений с улучшенными или принципиально новыми качествами, с одиночной, групповой реже комплексной устойчивостью к биотическим и абиотическим факторам среды.
Решающее значение для выполнения этой задачи имеют усилия генетиков, биотехнологов и селекционеров, направленные на идентификацию эффективных генов, детерминирующих важнейшие признаки устойчивости растений к биотическим и абиотическим стрессовым факторам среды. Эту сложную работу осуществляют специалисты ряда генетических центров и лабораторий мира, в том числе России, на основании сбора, изучения и использования мировых растительных ресурсов. Для этого в первую очередь используются выявленные и изученные источники и доноры устойчивости растений, созданные в ВИРе и селекционных центрах страны. Ведется работа по созданию современных банков эффективных генов во многих странах мира.
Важным этапом работы по генетической трансформации растений является выделение и клонирование генов, создание на их основе векторов для переноса чужеродных генов из клеток-доноров в клетки-реципиенты. Использование плазмидных, транспозонных, вирусных, пневмобаллистических и других векторных систем позволяет исследователям осуществлять трансформацию растительных генотипов и получать трансгенные (модифицированные) растения с заданными или близкими к ним свойствами и качественными характеристиками.
По генно-инженерной технологии в ведущих биотехнологических центрах и лабораториях мира, и прежде всего в США, Аргентине, Канаде, Китае, а также Японии, Германии, Голландии, Франции, Индии, получены формы сои, кукурузы, хлопчатника, сахарной свеклы, рапса, картофеля, томатов и других культур, устойчивых к гербицидам и насекомым; риса – к перекуляриозу, картофеля – к колорадскому жуку и фитофторе, пшеницы – к засолению, ржавчине и фузариозу колоса, септориозу, сахарной свеклы – к церкоспорозу, рнзоманн, рапса – к насекомым и грибным заболеваниям. Посевные площади, занятые под трансгенными сортами и гибридами сельскохозяйственных растений, в мире уже достигают 10S млн га и они постоянно расширяются. Существовавший ранее тотальный запрет на внедрение в производство трансгенных растений и других организмов, полученных генно-инженерными методами, постепенно ослабевает при сохраняющемся высоком уровне государственного контроля, надежности и биобезопасности их использования. Благодаря поддержке руководителей ряаа государств мира темпы развития генно-инженерных работ и расширение посевов трансгенных растений в последние годы резко возросли.
Основные площади посевов трансгенных культур сосредоточены в четырех странах – США, Аргентина, Канада и Китай. На долю сои и кукурузы приходится 80 % посевов всех трансгенных культур. Почти все площади трансгенных культур заняты сортами и гибридами, устойчивыми к гербицидам (71 %) и насекомым (22 %).
К сожалению, в России пока нет ни одного гектара производственных посевов генетически модифицированных растений отечественного и зарубежного производства. До сих пор в нашей стране не зарегистрировано ни одного отечественного трансгенного сорта или гибрида сельскохозяйственных культур. В центре «Биоинженерии» РАН созданы и проходят испытания новые отечественные линии картофеля, устойчивого к колорадскому жуку и фитофторе (КГ. Скрябин).
В биотехнологических и селекционных центрах и других научно-исследовательских учреждениях нашей страны работы по созданию генетически трансформированных сельскохозяйственных растений были развернуты, начиная с 1986 г., после принятия известного постановления директивных органов страны, утвердивших первую национальную программу по биотехнологии.
В настоящее время работы по биотехнологии и биоинженерии растений получили развитие во Всероссийском НИИ сельскохозяйственной биотехнологии РАСХН – Российском государственном аграрном университете им. К.А. Тимирязева, в Московской сельскохозяйственной академии им. Тимирязева, в НИИСХ Юго-Востока, во ВНИИ сахарной свеклы и сахара, ВНИИ кормов, ВНИИ селекции и семеноводства овощных культур, ВНИИ риса, ВНИИ картофельного хозяйства, ВНИИ генетики и селекции плодовых и ягодных культур, в НИИСХ центральных районов Нечерноземной зоны, в НИИСХ Северо-Востока РАСХН.
В Российской Академии наук (РАН) исследования потрансгенозу интенсивно проводятся в Центре «Биоинженерия», Институте физиологии растений, в Институте общей генетики им. Н.И.Вавилова, Институте молекулярной биологии им. В.А. Энгельгарда, Институте молекулярной генетики, Институте биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова, Институте биологии гена и др.
Учитывая сложность и большую наукоемкость генно-инженерных работ на первом этапе развития биотехнологии в научных учреждениях сельскохозяйственного профиля, основное внимание было уделено проблемам клеточных Технологий, позволивших создать большое разнообразие сомаклональных вариантов растений пшеницы, ячменя, клевера, люцерны, картофеля, сахарной свеклы, томатов, плодовых и других культур. Для этого целях использовались гаплоидные, автодигаплоидные варианты пыльниковой и пыльцевой культуры; регенранты из эмбриоидов, сформировавшиеся в каллусных тканях, полученных из незрелых зародышей и других органов растений.
Почти два десятилетия активной работы биотехнологов в селекционных и биотехнологических центрах страны позволили получить сотни и тысячи регенерантов растений, в том числе десятки и сотни с ценными свойствами: повышенной устойчивостью к засухе, высоким и низким температурам, засолению, опасным фибковым, бактериальным и вирусным заболеваниям, повышенной кислотности почвы. На их основе получены новые ценные сорта ярового ячменя во ВНИИ центральных районов Нечерноземной зоны и НИИ Северо-Востока; яровой пшеницы – в НИИ Юго-Востока; озимой пшеницы – в Краснодарском НИИСХ; клевера и люцены – во ВНИИ кормов, сахарной свеклы – во ВНИИСХ, картофеля – во ВНИИ картофельного хозяйства; плодовых культур – во ВНИИ генетики и селекции плодовых растений, Всероссийском селекционно-технологическом институте садоводства и питомниководства. В Государственный реестр внесены первые отечественные сорта зерновых и других культур, полученные отечественными селекционерами с использованием линий, созданных на основе биотехнологических методов гаплоидной и клеточной селекции, соматической гидрадизации и др.
В России, как и во многих странах мира, впервые создана правовая база для осуществления генно-инженерных и других биотехнологических работ с использованием в производстве новых трансформированных генотипов растений, животных и микроорганизмов. Приняты и действуют законы: «О государственном регулировании в области генно-инженерной деятельности», «О селекционных достижениях», «О племенной работе», «О семеноводстве» и др.
Широкое распространение в мире и России получили исследования по природным фитогормонам и синтетическим регуляторам рост та и развития растений как веществам, обладающим значительными биотехнологическими эффектами. Они являются составной частью питательных и селективных сред в биотехнологических исследованиях. Их использование позволяет решать практические задачи агропромышленного производства: регулирование онтогенеза растений и сроков созревания урожая, повышения его качества, устойчивости организмов к стрессовым факторам среды. Наибольшее распространение в практике АПК получили в свое время препараты ретардантного (хлорхолинхлорид) и антистрессового (картолин) действия. К сожалению, в последние годы производство регуляторов роста и развития растений и их применение в производстве резко сократилось. С учетом выявленной эффективности регуляторы роста растений в перспективе должны получить широкое распространение в науке и производстве.
13.3. БИОТЕХНОЛОГИЯ В КОРМОПРОИЗВОДСТВЕ.
КЛЕТОЧНАЯ И ТКАНЕВАЯ БИОТЕХНОЛОГИЯ
КОРМОВЫХ КУЛЬТУР
Применение биотехнологических методов интенсификации растениеводства начиналось в России с кормопроизводства как приоритетной отрасли растениеводства и животноводства.
Важнейшими задачами были и остаются повышение эффективности селекции и семеноводства кормовых культур. Определенную трудность представляют в этом отношении гетерозиготные перекрестноопыляемые кормовые культуры и в первую очередь люцерна и клевер луговой.
Селекционные сортообразцы, используемые в качестве исходного материала в клеточных биотехнологиях, представляют собой гетерозиготные, перекрестноопыляемые популяции, состоящие из совокупности генотипов с высокой степенью самостерильности. Они отличаются рядом существенных особенностей, без учета которых невозможно получить положительный результат в работе с культурой клеток и тканей. Это определяет специфичность манипуляций на всех этапах регенерации растений от экспланта до генетического анализа полученных растений-регенерантов.
Число генотипов в сортообразцах кормовых культур, способных к образованию высокоэмбриогенных клеточных линий при первичном введении в культуру in vitro, варьирует от 0,1 до 40%.
Существует несколько приемов для получения дедифференцированных клеточных культур с высокой регенерационной способностью (PC): генотипы с PC отбирают на средах, разработанных для модельных сортов клевера и люцерны; для генотипов с хозяйственно-ценными признаками, представляющими интерес для селекционеров, экспериментальным путем определяют состав гормонов и их концентрации, обеспечивающие PC; у селекционно-ценных генотипов регенерационную способность индуцируют путем скрещивания их с растениями-регенерантами того же селекционного образца.
При повторном введении в культуру in vitro исходных растений количественные показатели PC остаются на прежнем уровне, тогда как у полученных из них растений-регенерантов при введении их в культуру in vitro экспрессия признака PC возрастает в 10–15 раз. Образование морфогенных каллусов, пригодных для получения суспензий, происходит на питательных средах с уменьшенной концентрацией гормонов до 2 мг/л 2,4-Д и 2 мг/л кинетина на 9– 10-й день вместо 14–15 дней у исходного растения. Количество эмбриогенных структур, образующихся в каждом миллилитре суспензии, значительно возрастает, а время от помещения проэмбриоидов на регенерационную среду до формирования растений сокращается по сравнению с культурой проэмбриоидов, полученных от исходных растений.
Культура каллусных тканей
Листовая ткань вегетирующих растений клевера и люцерны отличается большой внутренней инфицированностью. Поэтому для получения первичных каллусов в качестве эксплантов используют листовые пластинки, черешки и отрезки стеблей асептически выращенных растений. Исходные растения на всем протяжении эксперимента сохраняют или в культуре in vitro, или в вегетационных сосудах.
Первичные каллусы клевера лугового и люцерны изменчивой с высоким морфогенным потенциалом индуцируют на питательной агаризованной среде Гамборга В5, но с увеличенной втрое концентрацией хелата железа и высоким содержанием гормонов (5–6 мг/л 2,4-Д и 8 мг/л кинетина) на свету (8–9 тыс. лк) в условиях 100 %-й относительной влажности воздуха и температуре не выше 20±2°С (А.В. Мезенцев, 1980; А.В. Мезенцев, Л.А. Любавина, 1983).
Изменение условий культивирования приводит к снижению у каллусных культур морфогенного потенциала и, как следствие, нарушению процесса редифференцировки и регенерации растений.
Культура клеточных суспензий
На реализацию морфогенного потенциала каллусными культурами в процессе получения клеточных линий клевера лугового и люцерны оказывают влияние условия освещения, встряхивания и продолжительность культивирования. Эмбриоиды и эмбриогенные структуры формируются только при непрерывном освещении. Клеточные суспензии клевера и люцерны с высокой PC получают при культивировании каллусов в жидкой питательной среде Гамборга В5 в условиях непрерывного освещения и встряхивания. Темп пролиферации и период времени, необходимый для образования первичной суспензионной клеточной культуры оптимальной плотности (500 тыс. клеток/мл суспензии), достаточной для последующего субкультивирования, сильно варьирует в зависимости от происхождения клеточной линии. Интервал времени между пересадками определяют индивидуально для каждой клеточной линии по достижении плотности до 500 тыс. клеток/мл суспензии: Исходная плотность клеток в пассируемой культуре клевера и люцерны не должна быть ниже 100 тыс. клеток/мл суспензии. В противном случае в новопересаженной культуре в 5–10 раз снижается темп пролиферации клеток и нарушается образование морфогенных структур. Увеличение же плотности клеток в суспензии клевера и люцерны (более 500 тыс. клеток/мл) без пересадки приводит к их гибели в течение 2–3 дней.
Клеточные суспензионные культуры после неоднократного субкультивирования в безгормональной среде Гамборга В5 образуют в массовом количестве проэмбриоиды и эмбриоиды (до 100 шт./мл суспензии). Проэмбриоиды после пересадки на агаризованную среду Гамборга В5 без гормонов и с уменьшенным вдвое содержанием всех входящих в нее компонентов разрастаются, образуя морфогенную каллусную ткань, в которой формируются почки, проростки и растения-регенеранты. Эмбриоиды развиваются в проростки, с семядольными листочками, с первичным одинарным, а в дальнейшем – тройчатыми листьями и корешком. У проростков, формирующихся в морфогенной каллусной ткани, образуются только тройчатые листочки.
Для изучения регенерантов по их морфогенетическим показателям в стадии 2–3 настоящих тройчатых листьев их высаживают в вегетационные сосуды, а затем выращивают или в условиях селекционно-тепличного комплекса, или в поле до созревания семян. Барьер самонесовместимости преодолевают, переопыляя регенеранты клевера лугового с исходным растением или регенерантами другой клеточной линии, но того же сортообразца. У люцерны семена получают от самоопыления регенерантов.
Регенерация растений
при генетической трансформации
Существует несколько способов регенерации растений при генетической трансформации. Большая часть из них основана на образовании дедифференцированных клеточных культур. При трансформации кормовых растений методами листовых дисков и разобщенных доминирующих центров регенерацию растений осуществляют из каллусной ткани, образующейся на поверхности срезов эксплантов, инокулированных агробактериями с целевыми и маркерными генами. Растения-трансформанты, регенерированные из морфогенных культур одной и той же клеточной линии, характеризуются нежелательной гетерогенностью и отличаются от исходного генотипа по ряду морфологических и физиолого-биохимических признаков. Морфогенные культуры к 5–8 пассажу полностью теряют регенерационную способность как на безгормональных, так и на средах, содержащих фитогормоны в различных концентрациях.
Для направленного создания методом генетической трансформации форм клевера лугового с одним из признаков (устойчивость к болезням, вредителям и т. д.) разработан способ прямой регенерации растений, сохраняющих высокий морфогенетический потенциал и ценные селекционные признаки исходных генотипов при длительном культивировании на канамицинсодержащих питательных средах (Л.А. Солодкая и др., 2005).
Указанная цель достигается тем, что растения клевера лугового получают способом прямой регенерации (без образования дедифференцированной ткани – каллуса) из морфогенных культур, индуцированных из гипокотильных эксплантов на питательной среде Гамборга В5 с 4,0 мг/л 6-бензиламинопурина (БАП), 1,0 мг/л кинетина и 0,05 мг/л α-нафгилуксусной кислоты (НУК). Эпикотильную часть проростков для сохранения и поддержания в культуре in vitro и in vivo растений исходного генотипа отделяют и культивируют на модифицированной среде Гамборга В5 без гормонов или для микроразмножения на среде того же состава с добавлением 2 мг/л БАП. Побеги и растения клевера лугового, полученные в процессе трансформации, укореняют на средах Гамборга В5 с 40 мг/л канамицина и 0,05 мг/л НУК без добавления цефотаксима. Полученные из гипокотильных эксплантов способом прямой регенерации растения по генетическим и морфологическим признакам не отличаются от исходных генотипов и сохраняют способность к активной пролиферации и массовому образованию зеленых побегов до 24-го пассажа на питательной среде с 50 мг/л канамицина.
В течение одного пассажа (1 месяц) из морфогенной ткани с одной чашки Петри получают в среднем более 100 зеленых побегов, и общее число их составляет 1000 шт. и более и ограничивается только потребностями практической селекции и площадью в фитотроне.
Для контроля изменчивости определяют количество хромосомных и хроматидных перестроек в клетках растений-регенерантов, полученных методом прямой регенерации из гипокотилей, и исходных растений. Подсчитывают число хроматидных перестроек с фрагментами и мостами, общий процент аберраций, митотический индекс, плоидность.
Сравнительную оценку по морфологическим и хозяйственно-ценным признакам растений исходных генотипов и растений-регенерантов, полученных методом прямой регенерации, проводят в вегетационных и полевых условиях.
Таким образом, новый способ прямой регенерации позволяет в процессе генетической трансформации на основе одного и того же генотипа, используя конструкции, несущие различные целевые гены, направленно создавать генетические аналоги, полностью сохраняющие все ценные признаки исходного образца; получать и поддерживать in vitro морфогенные культуры, способные к длительной пролиферации на селективных средах и массовой регенерации канамицинустойчивых растений; контролировать сомаклональную изменчивость и проводить сравнительный генетический анализ полученных селекционных номеров в процессе генетической трансформации.
Клеточная селекция
Для получения интактных растений клевера лугового и люцерны из культуры клеток и тканей разработаны надежные системы регенерации и методы повышения гетерогенности исходных клеточных популяций. Они являются основой для создания исходного материала люцерны и клевера лугового с повышенной устойчивостью к биотическим и абиотическим стрессам (рис. 13.1).
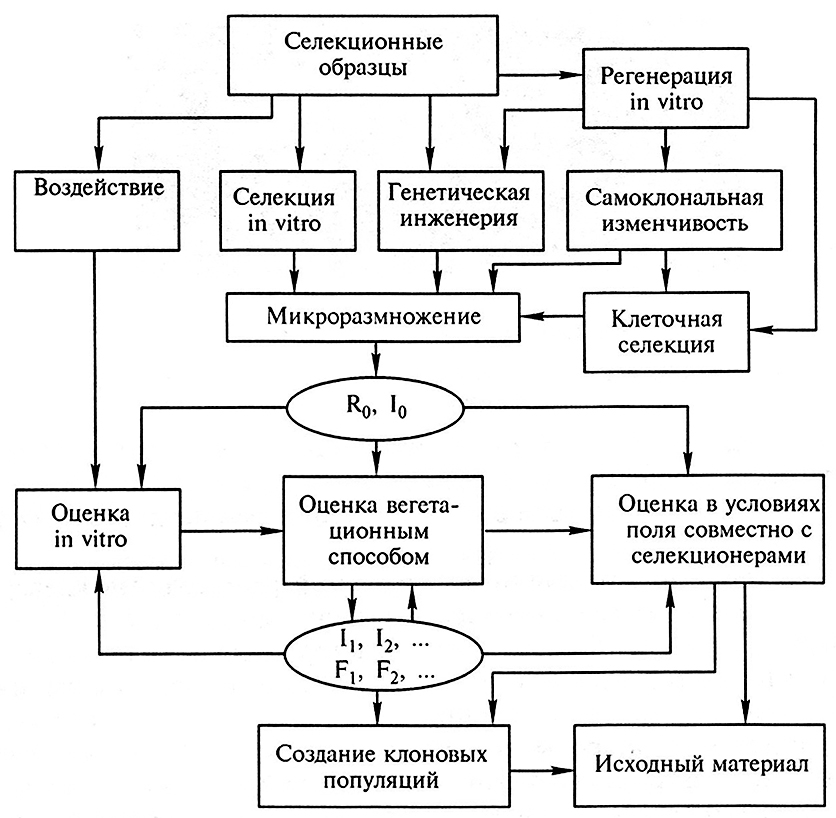
Рис. 13.1. Схема создания исходного материала для селекции кормовых растений методами биотехнологии
Основным источником гетерогенности исходных клеточных популяций клевера лугового и люцерны служит сомаклонал ьная изменчивость, возникающая в процессе культивирования in vitro.
Сомаклональная изменчивость
Исследования показали, что часть растений-регенерантов клевера и люцерны, полученных из каллусных и суспензионных культур, отличаются от исходных растений по ряду морфологических (открытый тип цветения, укороченная цветочная трубочка и др.) (рис. 13.2,13.3) и физиологических признаков устойчивости к биотическим и абиотическим стрессам.
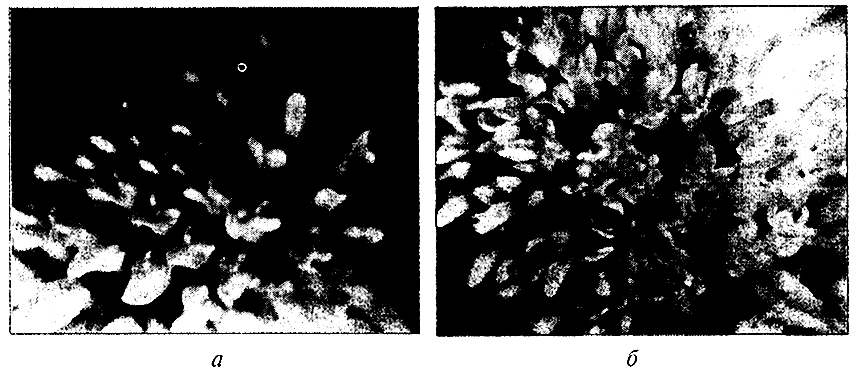
Рис. 13.2. Соцветие регенерантов клевера лугового:
а – открытый цветок; б – закрытый цветок
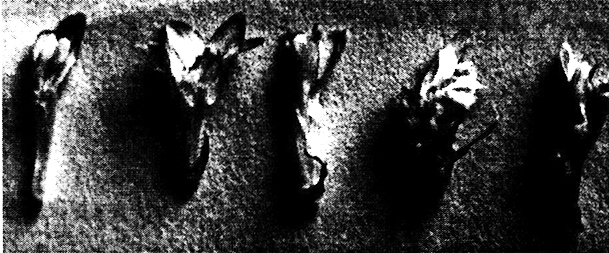
Рис. 13.3. Цветки клевера лугового:
а – нормальный цветок; б – цветок с укороченной цветочной трубочкой; в, г, д – измененные цветки
Установлено, что характер и количество сомаклональных измененных растений зависят от генотипа исходного растения, его происхождения и длительности культивирования клеточных линий.
Среди регенерантов клеточных линий, полученных от исходных растений гибридного происхождения, наблюдается наибольшее число измененных растений. С увеличением числа пассажей клеточных культур растет процент измененных форм, тогда как общее количество выживших после высадки в почву растений-регенерантов снижается.
Сомаклональная изменчивость растений-регенерантов клевера лугового и люцерны имеет физиологическую, эпигенетическую и генетическую природу. Хлороз, гофрированность листьев исчезают в процессе вегетации растений и при отрастании после скашивания. Часть морфологических изменений является результатом мутаций. Для определения природы сомаклональных изменений проводят скрещивания с исходной формой. Генетический анализ показал, что растения-регенеранты Р0 имеют сомаклональные изменения, обусловленные рецессивными генами как в гомозиготном, так и гетерозиготном состояниях (фенотип регенеранта идентичен исходному растению). Например, в Р2 потомстве диплоидных растений количество генотипов с признаком «открытый тип цветения» составляет приблизительно четвертую часть всех изученных в Р2 растений каждого регенеранта. При этом совпадение фактически и теоретически ожидаемой численности растений с названным выше признаком с вероятностью 0,16–0,34 согласовывается с гипотезой, что в Р2 расщепление по фенотипу происходит в соотношении 3:1 [в Р1 все полученные растения идентичны исходному (рис. 13.4)].
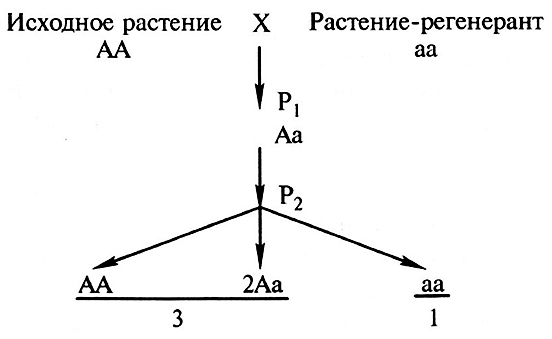
Рис. 13.4. Скрещивание исходного растения и растения-регенеранта клевера лугового (2n = 14)
В зависимости от генотипа исходного растения (Аа) и растений-регенерантов (Аа) в соответствии с законом Менделя наблюдаются и другие соотношения в расщеплении (Л.А. Солодкая, 1987).
Использование селективных систем
В качестве селективного фактора для отбора пролиферирующих, не теряющих способностей к эмбриогенезу клеточных суспензий используется NaCl в концентрации 0,98% (Agafodorova et.al., 1999).
Растения-регенеранты и их потомство I1, I2,..., In, полученные из эмбриоидов, сформировавшихся в селективных условиях, и показавших устойчивость в песчаной культуре при засолении 1,53–1,95 % NaCl, а затем в поле на естественном засолении, использованы совместно с селекционерами для создания сорта люцерны Солеустойчивая, районированного в двух регионах страны. В условиях хлоридно-сульфатно-натриевого засоления при общей концентрации солей 0,6 % сорт имел 100 %-ю всхожесть, в то время как у местных сортов она не превышала 10–20 %. Урожайность зеленой массы сорта Солеустойчивая составила 80–85 т/га, сухой массы –15–18 т/га, семян – 1,6–3,4 ц/га, сбор протеина 2,8–3,5 т/га, а у стандартного сорта Ленинская местная соответственно 65–78; 13,6–16; 2,5–2,8; 2,5-3,0.
Для получения форм люцерны с повышенной устойчивостью к комплексу солей используют сложные селективные системы, в которые наряду с солевым компонентом включают аналог пролина – гидроксипролин (М.Н. Агафодорова, Л.А. Солодкая, С.И. Ивашута, 1997).
При клеточной селекции клевера лугового и люцерны, изменчивой на устойчивость к фитопатогенным грибам, разрабатывают различные подходы. В качестве селективного фактора используют культуральные фильтраты гриба (Л.А. Солодкая, 1987).
Селекция in vitro кислотоустойчивых форм
Использование метода суспензионных культур в селекции клевера лугового на устойчивость к высоким концентрациям трехвалентного алюминия и низкому рН среды вследствие высокой сомаклональной изменчивости длительно культивируемых клеточных популяций приводило к негативным изменениям полученных кислотоустойчивых растений-регенерантов. Они были низкорослы и полностью стерильны, что делало невозможным включение их в селекционный процесс. В связи с этим дальнейшую работу по созданию селекционного материала с повышенной устойчивостью к токсическим факторам почв с повышенной кислотностью проводят методом отбора in vitro (JI.А. Солодкая, М.Н. Агафодорова, 2002).
Способ основан на скрининге и микроклональном размножении кислотоустойчивых генотипов, выделенных из районированных сортов и селекционных образцов клевера лугового и люцерны, полностью сохраняющих другие показатели исходных форм.
В селекции in vitro используют генотипы клевера лугового, отобранные в жестких селективных условиях (рН 2,6–3,2 и 500 м г/л А13+) и отличающиеся хорошим ростом побегов и корней в селективных условиях в течение 30-дневного культивирования на агаризованной среде Гамборга Bj с 100 мг/л трехвалентного иона алюминия
Однократный отбор in vitro повышает частоту устойчивых генотипов в популяции в 3–5 раз.
В качестве исходного селекционного материала используют Fi, F2,–, F„ растений-регенерантов клевера лугового, прошедших предварительный отбор в культуре in vitro и показавших устойчивость к действию токсических факторов почв с повышенной кислотностью (рН 4,2, обменного алюминия 15 мг/100 г воздушно-сухой почвы) в вегетационных и полевых опытах. На основе 2000 растений-регенерантов клевера лугового ультрараннеспелых селекционных образцов, отобранных в культуре in vitro на устойчивость к трехвалентному иону алюминия, в условиях Фаленской селекционной станции на почвах с кислой реакцией почвенной среды и высоким содержанием подвижного алюминия создан исходный селекционный материал. Выделенные номера превышают по кислотоустойчивости исходные формы и стандарты по основным хозяйственно ценным признакам в условиях эдафического стресса. В опыте (почвы с рН 3,8–4,0 и обменного алюминия 10–12 мг/100 г воздушно-сухой почвы) на второй год жизни их зимостойкость составляла 115,6 % к стандарту и 123,5 % к исходной форме. При этом растения-регенеранты характеризовались дружным цветением и на две недели более ранним созреванием по сравнению с контролем. По семенной продуктивности они превышали стандарт в 1,4 раза. Растения-регенеранты отличались повышенным содержанием сырого протеина (20,2–20,8 %) при 18,6 % у стандарта. Существенные различия (на 39,8–98,0 %) выявлены также между кислотоустойчивыми клонами и их исходными образцами по урожайности зеленой массы.
Таким образом, растения-регенеранты клевера лугового, полученные из кислоточувствительных форм методом селекции in vitro и показавшие высокую устойчивость на агаризованных селективных средах с 100 мг/л трехвалентного алюминия и рН 3,2, в полевых условиях имели также высокую устойчивость к токсическим факторам почв с повышенной кислотностью (15 мг обменного алюминия/100 г воздушно-сухой почвы, рН 4,5).
Созданный исходный материал включен в селекционный процесс ВНИИСХ Северо-Востока и ВНИИ кормов РАСХН.
Воздействие на гаметофит люцерны
физиологически активными веществами
Селекционно-ценные формы растений можно также создавать, воздействуя на половые клетки физиологически активными веществами. В отделе биотехнологии ВНИИ кормов разработан способ воздействия физиологически активными веществами на генеративную сферу люцерны с помощью вакуумной инфильтрации. Такой прием обеспечивает проникновение раствора ФАВ в межклеточное пространство тканей-генеративных органов, создавая тем самым условия для непосредственного контакта половых клеток с действующим веществом. Генеративные органы растения в момент обработки находятся на начальных этапах развития и до окончания в них микро- и макрогаметогенеза. После образования из обработанных бутонов зрелых цветков проводят искусственное самоопыление или перекрестное опыление нескольких обработанных растений (у самонесовместимых форм). Способ позволяет в зависимости от используемых веществ добиваться различных результатов.
Обработка фитогормонами
(2,4-Д, кинетин, НУК) тетраплоидной люцерны изменчивой позволяет получать растения разного уровня плоидности, в частности, дигаплоидные и триплоидные формы. Фитогормоны вызывают дополнительное редукционное деление половых клеток, в результате чего наряду с дигаплоидными образуются жизнеспособные гаметы с моногаплоидным набором хромосом. Слияние при оплодотворении гамет с моногаплоидным и д и гаплоидным набором хромосом приводит к образованию триплоидной зиготы, формированию из нее триплоидного зародыша, а затем и растения. Вероятность слияния при оплодотворении гамет с моногаплоидным набором хромосом и образование дигаплоидного зародыша значительно ниже, чем для триплоидного (соответственно в пределах 1 и 10 %). В результате мутагенного действия фитогормонов получены источники мужской и женской стерильности с соцветием «сложная кисть», имеющие в своем геноме в гетерозиготном состоянии два неаллельных рецессивных гена, которые в гомозиготном состоянии определяют полную мужскую и женскую стерильность (тип соцветия «цветная капуста»). Данный признак может использоваться как фенотипический маркер. Созданы гибридные популяции, показано наличие в каждой из них с частотой около 1 % растений с соцветием типа «цветная капуста». На основе сорта Полава создан перспективный селекционный образец с данным маркерным признаком.
Использование культурапьного фильтрата (КФ) грибов рода Fusarium позволило разработать метод гаметной селекции, основанный на избирательной элиминации как микро- , так и макроспор в незрелых соцветиях в селективных условиях. Одновременный отбор микро- и макроспор очень важен для перекрестноопыляющихся растений, поскольку зигота, образованная из таких гамет, имеет гомозиготный по селектируемым признакам генотип и сохраняет свойство устойчивости у семенного потомства в последующих поколениях.
С использованием метода гаметной селекции во ВНИИ кормов созданы образцы и на их основе перспективный селекционный материал люцерны с повышенной на 20–40 % устойчивостью к возбудителям фузариоза (М.Н. Агафодорова и др., 2002).
13.4. ЖИВОТНОВОДСТВО
Наиболее продвинутыми в области животноводства в мире являются работы по трансплантации оплодотворенных яйцеклеток и эмбрионов в целях ускоренного размножения высокопродуктивных, высокоценных генотипов животных (по материнской линии). Этот метод сегодня используется для создания высокопродуктивных стад крупного рогатого скота, овец, свиней и птицы. Тщательно отработаны и используются в производстве технологии стимулирования процессов овуляции, образования и вымывания зигот, их оплодотворения in vitro, трансплантации оплодотворенных яйцеклеток и эмбрионов в половые органы животных-реципиентов, деления гаструл для получения однояйцовых двоен. Многие фирмы и научные учреждения США, Англии, Германии, Франции, Австралии и других развитых стран проводят эту работу не только в своих государствах, но и во многих развивающихся странах, обеспечивая по договорам и контрактам выполнение наукоемких проектов и заказов по развитию животноводства. В России методы трансплантации животных разработаны и усовершенствованы во ВНИИ животноводства, в научно-производственном биотехнологическом центре животноводства ВИЛАР, в племцентре Министерства сельского хозяйства РФ. Масштабы трансплантации эмбрионов высокопродуктивных животных в нашей стране значительно отстают от объемов работ, которые выполняются в ведущих зарубежных государствах. Главными причинами такого отставания является резкое ухудшение положения дел в животноводстве: сокращение поголовья всех видов скота в 1,5–3,0 раза, рост падежа, снижение производства кормов и ухудшение их качества, значительное ухудшение племенной работы, быстрая деградация животноводческой отрасли в целом.
В этих условиях общественные, индивидуальные и частные сельскохозяйственные предприятия, абсолютное большинство которых в условиях проводимых в стране реформ оказались банкротами, не располагают необходимыми средствами для применения достижений современной биотехнологии и рекомендаций науки.
Работая на перспективу, ученые-биотехнологи России совместно с селекционерами, ветврачами и другими специалистами решают приоритетные проблемы животноводства. Важнейшими из них являются получение трансгенных животных: крупного рогатого скота, овец, свиней, кроликов и птицы, отличающихся устойчивостью к опасным вирусным и другим инфекциям. На очереди получение трансгенных животных, устойчивых к лейкозу, туберкулезу, бруцеллезу и другим болезням.
Принципиально новым биотехнологическим направлением в животноводстве является получение трансгенных особей – доноров органов и тканей, используемых для лечения человека. Для этих целей в настоящее время имеются соответствующие генные конструкции и проводятся эксперименты по получению трансгенных свиней, органы которых в наибольшей степени подходят для трансплантации в организм человека.
Созданы и совершенствуются генные конструкции для интеграции в геном сельскохозяйственных животных – генов эритропоэтина, инсулиноподобного фактора, инсулина человека и др.
Во ВНИТИ птицеводства впервые были получены трансгенные куры и перепелки с различными генными конструкциями. Открываются широкие возможности создания новых линий и пород кур с повышенной продуктивностью и устойчивостью к болезням в условиях промышленного и индивидуального производства.
Важнейшим результатом эффективного использования биотехнологии в животноводстве является разработка и получение принципиально новых биостимуляторов рекомбинантного бычьего гормона роста – соматотропина и других веществ для повышения продуктивности животных, а также для иммунокоррекции соматостатина при помощи спектра препаратов химерных белков, показывающих высокую эффективность на крупном рогатом скоте, свиньях и пушных зверях.
Разработаны и применяются на практике основные принципы генетического клонирования животных, в том числе путем хирургического разделения ранних эмбрионов.
Большой вклад в развитие биотехнологии в животноводстве вносят коллективы ученых ВНИИ животноводства, ВНИТИ птицеводства, ВНИИ сельскохозяйственной биотехнологии, ВНИИ генетики и разведения сельскохозяйственных животных, ВНИИ физиологии, биохмии и питания сельскохозяйственных животных, научно-производственного биотехнологического центра животноводства ВИЛАР, ВНИИ свиноводства, Краснодарского НИИ животноводства, ВНИИ кролиководства и звероводства, ВНИИ экспериментальной ветеринарии.
В реализации биотехнологических программ в области животноводства активно участвуют также коллективы ученых институтов РАН – Центра «Биоинженерия», Института молекулярной биологии им. В.А. Энгельгарда, Института молекулярной генетики, Института биологии гена, Института физико-химической биологии им. А.Н. Белозерского, Института питания АМН, Института биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова, ВНИИ генетики промышленных микроорганизмов, Института экспериментальной медицины Министерства здравоохранения Российской Федерации, а также институтов других стран, бывших республик СССР: Института микробиологии и вирусологии им. А.Г. Кирхенштейна (Латвия), Института гематологии и переливания крови республики Беларусь.
По отдельным направлениям ведется сотрудничество со странами дальнего зарубежья, в том числе США, Германии, Индии, Японии, Польши, Австралии, Чехии, Словакии и Бельгии. Создана система научной координации, способствующая объединению усилий ученых биотехнологов стран СНГ и мира по решению важнейших проблем животноводства.
13.5. ВЕТЕРИНАРНАЯ МЕДИЦИНА
Наибольших результатов в ветеринарной биотехнологии и медицине ученые добились в микробиологии при решении профилактических и терапевтических задач по защите различных видов скота и птицы от болезней, обеспечении условий для ветеринарной безопасности животноводства. Совместно с ветеринарными специалистами разработаны методы получения и организовано промышленное производство одно- и поливалентных сывороток профилактического и препаратов терапевтического действия, полученных генно-инженерными методами.
Разработаны также способы массового культивирования клеток и вирусов на биофабриках, что позволяет выпускать более 40 вирус-вакцин против наиболее опасных вирусных инфекций – бешенства, инфекционного ринотрахеита, чумы и других заболеваний, в том числе вызываемых бактериальными и грибковыми возбудителями.
Созданы и применяются в производстве высокочувствительные диагностические препараты на основе метода ИФА (иммуноферментного анализа), ДНК-зондов, внедрения полимеразной цепной реакции (ПЦР). Используются моноклональные антитела, полученные методом гибридомной технологии. Получены генетически трансформированные кролики с геном асРНК, устойчивые к вирусам лейкоза, а также трансгенные кролики с геном альфа-2 интерферона. Разработана рекомбинантная вакцина против лейкоза крупного рогатого скота на основе оспенного вектора. На культуре клеток нарабатывается антиген и производится даигностика лейкоза крупного рогатого скота. Генно-инженерные вакцины против ящура и сибирской язвы производятся в объемах, обеспечивающих потребности в них России, стран СНГ и ряда других государств мира.
13.6. СЕЛЬСКОХОЗЯЙСТВЕННАЯ МИКРОБИОЛОГИЯ
В биотехнологии и биоинженерии наметилось четыре наиболее существенных направления:
1) изучение генетических основ повышения эффективности использования клубеньковых и свободно живущих в почве азотфиксирующих микроорганизмов;
2) создание новых высокоэффективных и экологически безопасных микробиологических препаратов для защиты растений и животных от вредителей и болезней;
3) создание новых ветеринарных препаратов на генноинженерной основе;
4) получение новых штаммов азотсодержащих и продуцирующих белок и биологически активные и иммуномодулирующие вещества в кишечном тракте животных микроорганизмов.
ВНИИ сельскохозяйственной микробиологии РАСХ активно развивает направление о сопряженной селекции растений-хозяев и ризобильных штаммов бактерий – азотфиксаторов. Получены эффективные «пары» – сорт-штамм, обеспечивающие увеличение накопления биологического азота в 1,5–2,0 раза и более по сравнению с их природными аналогами. Созданные в институте штаммы свободно живущих и ризобиальных азотфиксирующих микроорганизмов по заключенному контракту используется во Вьетнаме (СРВ) на посевах риса.
По второму направлению наиболее эффективно работают ВНИИ защиты растений, ВНИИ сельскохозяйственной микробиологии, ВНИИ фитопатологии РАСХН, где созданы новые микробиологические препараты по борьбе с колорадским жуком, а также фузариозами и другими болезнями растений. Это направление развивается очень медленно и требует большой финансовой подцержки и внимания со стороны Министерства сельского хозяйства РФ и Россельхозакадемии.
13.7. ПЕРЕРАБОТКА И ХРАНЕНИЕ
СЕЛЬСКОХОЗЯЙСТВЕННОЙ ПРОДУКЦИИ
Биотехнологические методы и приемы направлены на сохранение и улучшение вкусовых и других качеств продукции, основанных на применении биологических компонентов-добавок – консервантов и пищевкусовых соединений растительного и синтетического происхождения; мембранной технологии, трансгенных микроорганизмов, обеспечивающих надежную и длительную сохранность продукции. Современная промышленность, производящая витамины, аминокислоты, кормовые и пищевые добавки, почти полностью основана на современных методах биотехнологии. Объем их производства пока не удовлетворяет потребности заинтересованных отраслей и предприятий. В целом перерабатывающие отрасли находятся в депрессивном состоянии: не проводится своевременное обновление технологического оборудования; в два раза сокращено поступление сельскохозяйственного сырья.
Предстоит большая работа по восстановлению и развитию перерабатывающих предприятий – заводов по переработке продукции растениеводства и животноводства, широкому применению на них современных биотехнологических методов.
Наиболее существенный вклад в разработку и совершенствование биотехнологических методов переработки и хранения животноводческой продукции вносит Биотехнологический университет по переработке продукции животноводства.
13.8. БИОКОНВЕРСИЯ И БИОЭНЕРГЕТИКА
Около половины валовой продукции растениеводства – солома и ботва сельскохозяйственных растений, около 300 млн т навоза составляют органические отходы сельскохозяйственного производства. Только половина соломы и не более 30 % ботвы используется на корм скоту. Остальная солома и ботва практически не используется, сжигается или сгнивает на полях, в местах временного хранения.
Около половины навоза используется на удобрения, вторая половина – попадает в овраги, лесополосы, водостоки и загрязняет окружаюшую среду. Главная задача по использованию органических отходов состоит в том, чтобы они вносились в почву для повышения их плодородия.
Одновременно биотехнологи и инженеры предложили способы их биоконверсии – преобразования в биогаз. Из одной тонны сухого вещества навоза можно получить в специальных конверсионных установках до 400 м3 метана. Каждый кубометр метана при сжигании дает 8 тыс. мгДж энергии. Оставшиеся после биоконверсии навоза органические отходы содержат углерод, фосфор, калий, кальций, микроэлементы и могут быть использованы в виде органического удобрения. Биоконверсия навоза и других органических отходов может быть постоянным возобновляемым источником энергии и давать до 5 % от общего количества потребляемой энергии в сельском хозяйстве. Экспериментальные биоконверсионные установки в нашей стране созданы во Всероссийском институте электрификации сельского хозяйства и используются в ряде сельскохозяйственных предприятий, а также предприятий коммунального хозяйства.
Массовое производство биогаза из навоза и других органических отходов на мелких биоконверсионных установках имеет место в кооперативных и индивидуальных сельскохозяйственных предприятиях Китая. Получаемый биогаз (метан) используется на бытовые и производственные нужды. В России этот возобновленный источник энергии практически не используется.
Биотехнологи и растениеводы предложили оценивать технологии, сорта, получаемую продукцию в сельском хозяйстве по коэффициенту энергетической эффективности. Разработаны и применяются методы такой оценки на основе учета энергозатрат на производство единицы продукции и фактического содержания энергии в единице полученного урожая. Энергетическая эффективность выражается в относительно абстрактных единицах по уравнению
![]()
где Kф – коэффициент энергетической эффективности;
Ес – количество энергии в единице произведенной продукции;
Е3 – количество затраченной энергии на единицу произведенной продукции.
Сорта, технологии, системы производства считаются эффективными, если Хэф составляет 2–3 и более единиц.
При Kэф < 1 сорта, технологии и системы производства не могут быть аттестованы, так как при этом затраты энергии на производство единицы продукции превышают ее выход с единицы полученной продукции.
Рациональное использование всех ресурсов на основе научно-обоснованных оптимальных технологий и применяемых сортов-гибридов сельскохозяйственных культур, пород животных и птиц обеспечивает высокий коэффициент использования солнечной энергии (до 3 %) в растениеводстве и повышение конверсии кормов в животноводстве, что в конечном итоге обеспечивает высокий коэффициент энергетической эффективности производства сельскохозяйственной продукции. Применение биотехнологических методов оценки энергетической эффективности использования всех ресурсов в сельскохозяйственном производстве – важнейшая задача в возрождении отечественного продовольственного цеха.

