Группу соединительных тканей принято разделять на собственно соединительную ткань, хрящевую и костную. Жировая ткань является разновидностью соединительной ткани.
В организме животных соединительная ткань выполняет опорную, связующую, питательную и защитную функции.
Соединительная ткань является важным сырьем, которое используется в колбасном, кулинарном, желатиновом, клееварочном и других производствах.
Строение. Соединительная ткань представляет систему, состоящую из клеток и сильно развитого межклеточного вещества. Межклеточное вещество состоит из однородного, аморфного основного вещества и тончайших волоконец. Основное вещество у собственно соединительной ткани полужидкое, слизеподобное, у хрящевой — плотное, у костной в результате накопления минеральных солей — наиболее прочное.
В соединительной ткани различают три вида волокон: коллагеновые, эластиновые и ретикулиновые. В зависимости от преобладания тех или иных волокон и от соотношения основного вещества и волокон различают рыхлую, плотную и эластическую ткань.
В межклеточном веществе рыхлой соединительной ткани преобладает аморфное вещество, волоконец сравнительно мало, основную часть составляют эластиновые волокна (рис. 5.7).
Плотная соединительная ткань имеет сильно развитые коллагеновые волокна, расположенные параллельными пучками, что обеспечивает ее высокую прочность (рис. 5.8). Она устойчива к тепловой и механической обработке, входит в состав сухожилий, связок, фасций, шкур.
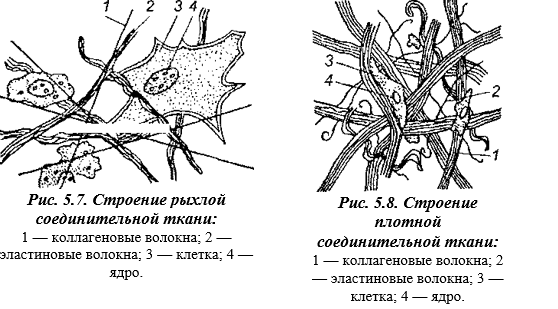
Эластическая соединительная ткань состоит из большого количества сравнительно толстых эластиновых, коллагеновых волокон, аморфного вещества в ней мало. В чистом виде эта ткань образует выйную связку, брюшную фасцию и стенку аорты. Соединительная ткань, органически входящая в состав мяса, снижает его пищевую ценность, усвояемость и кулинарные свойства. Содержание соединительной ткани в мясе и мясных продуктах лежит в основе определения их сортности. При этом в высших сортах мяса содержание соединительной ткани минимально.
Количество соединительной ткани в мясе зависит от вида, возраста, упитанности животного. Чем больше возраст животного, чем ниже его упитанность, тем сильнее развита соединительная ткань. По мере старения организма соединительная ткань уплотняется, коллагеновые и эластиновые волокна утолщаются, в результате мясо становится более жестким. Соединительная ткань в туше распределена неравномерно. В передней части туши она составляет 18-25 %, тогда как в задней — 9-13 %.
Химический состав. Наиболее важными компонентами соединительной ткани являются структурные белки — склеропротеины: коллаген, эластин, ретикулин. Они входят в состав волоконец. В состав основного вещества соединительной ткани входят белки мукопротеиды и в незначительных количествах альбумины, глобулины, нуклеопротеиды и некоторые другие.
Коллаген. На долю коллагена приходится треть всех белков животного организма. Он содержится в сухожилиях, хрящах, связках, фасциях. Коллаген, по сравнению с другими белками, обладает специфическим составом. Он содержит около 35 % остатков глицина и приблизительно 11 % остатков аланина, что необычно много для большинства известных белков. Еще более характерным отличительным признаком коллагена является высокое содержание пролина и оксипролина, на сумму которых приходится около 21 %. Коллаген относится к неполноценным белкам из-за отсутствия триптофана и метионина.
Коллаген является основой коллагеновых волокон, которые собраны в пучки различной толщины и образуют в соединительной ткани единую сетчатую структуру — вязь. Коллагеновые волокна состоят из мельчайших фибрилл с высокой механической прочностью.
Фибриллы коллагеновых нитей состоят из субъединиц, называемых тропоколлагеном. Молекулы тропоколлагена построены из трех полипептидных цепочек, скрученных вместе вокруг одной общей оси (рис. 5.9). Они образуют третичную структуру коллагена. В результате агрегации молекул тропоколлагена в продольном и поперечном направлениях происходит образование четвертичной структуры коллагена — фибрилл. Нативный коллаген устойчив к воздействию различных веществ; он нерастворим в воде, органических растворителях, на него в очень слабой степени воздействуют кислоты, щелочи.
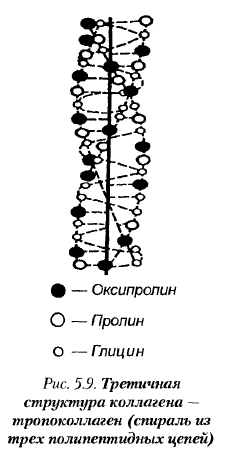
Нерастворимые нити коллагена — наиболее прочные из всех других волокон.
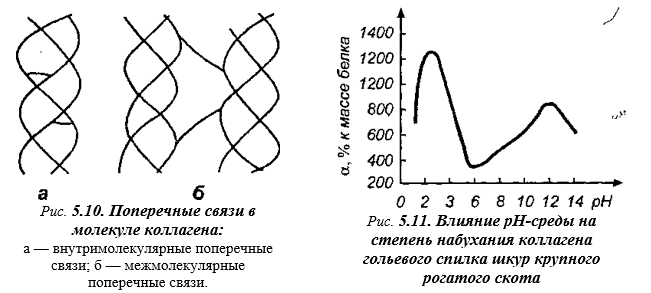
Молекулы гликопротеидов, находящиеся на поверхности фибрилл, защищают коллаген от действия протеолитических ферментов, что делает этот белок плохо усвояемым в организме. Нерастворимость и устойчивость коллагена, а также в известной мере консистенция мяса, зависят от вида и возраста животных, а также от ткани, в которой он содержится. Это связано с тем, что с увеличением возраста животного количество поперечных связей в коллагене возрастает, что делает фибриллы коллагена в соединительной ткани более жесткими и хрупкими (рис. 5.10). Коллаген способен сильно набухать в водных растворах, причем масса его увеличивается в 1,5-2 раза. По этому свойству он уступает только миозину.
Отличительные
особенности коллагена:
- высокая механическая прочность-,
- устойчивость к действию кислот, щелочей, пищеварительных ферментов;
- способность к набуханию;
- сваривание и гидротермический распад при температуре 58 62 "С;
- переход в водорастворимый желатин (глютин) при температуре 65-90 °С — гелеобразование глютина.
Высокая гидратация коллагена связана с содержанием в его структуре большого числа боковых полярных групп молекулы. При смещении pH в кислую или щелочную сторону от изоэлектрической точки (pH 7,0 — для шкуры крупного рогатого скота), набухаемость коллагена резко увеличивается, при этом масса белка в состоянии полного набухания может колебаться от 400 до 1000 % к массе сухого белка (рис.5.11.).
При нагреве с водой коллаген расщепляется. Вследствие теплового воздействия происходит его денатурация и частичный гидролитический распад по месту пептидных связей с образованием высоко- и низкомолекулярных продуктов. Степень дезагрегации макромолекул коллагена зависит от температуры и продолжительности нагрева.
При умеренном тепловом воздействии (58-62 °С) происходит сваривание и гидротермический распад коллагена. Это обусловлено частичным нарушением водородных связей в структуре тропоколлагена. В результате сваривания длина коллагеновых волокон уменьшается примерно на 60 % от первоначальной, но их толщина возрастает, поэтому объем волокон в целом увеличивается, их структура разрыхляется.
Сваренный коллаген или желатин становится доступным для ферментативного воздействия и легко переваривается.
Повышение температуры до 90 °С и увеличение продолжительности нагревания приводят к разрыву большинства поперечных связей, удерживающих полипептидные цепочки в структуре коллагена, в результате чего он переходит в водорастворимое вещество — глютин. При снижении температуры глютин образует студни, что широко используется в колбасном производстве при выработке ливерных колбас, студней и зельцев.
Длительное нагревание при высокой температуре приводит к дальнейшему гидролитическому распаду молекулы белка и образованию более мелких продуктов распада — желатоз. Такой продукт называется клеем. Раствор желатоз обладает плохой желатинизируещей способностью, поэтому для получения хорошего студня процесс варки коллагенсодержащего сырья не следует вести при высокой температуре и очень длительное время.
Способность коллагена к набуханию и дезагрегации под действием высоких температур имеет большое значение для мясного, желатинового и кожевенного производств, а также для производства искусственной колбасной оболочки типа «белкозин».
Эластин. Это основной компонент связок, соединяющий кости между собой. Фибриллярный белок эластин входит в состав эластиновых волокон, легко растяжимых и эластичных. Длина их при растяжении может увеличиваться вдвое. Ткани, богатые эластином, имеют желтоватый цвет. Эластин, как и коллаген, относится к склеропротеинам, но значительно устойчивее. Эластин нерастворим в холодной и горячей воде, в солевых растворах, разведенных кислотах и щелочах. Даже крепкая серная кислота оказывает на него слабое действие. В противоположность коллагену из эластина нельзя получить желатин. Нити нативного эластина не перевариваются трипсином или химотрипсином, очень медленно гидролизуется пепсином при pH 2, однако некоторые ферменты растений — фицин, папаин, бромелин, а также продуцируемая поджелудочной железой эластаза вызывают протеолиз эластина.
Аминокислотный состав эластина отличается высоким содержанием глицина, аланина, лизина, отсутствием триптофана и цистина, малым количеством метионина. Содержащиеся только в эластине специфические аминокислоты — десмозин и изодесмозин — участвуют в образовании поперечных связей.
Ретикулин входит в состав тонких ретикулиновых волокон. Ретикулин неполноценный белок, который характеризуется высоким содержанием про- лина и оксипролина. Ретикулин плохо усваивается, почти не набухает в воде, не растворяется в растворах кислот и щелочей.
Кроме коллагена и эластина, главными химическими компонентами основного вещества соединительной ткани являются белок и полисахариды, образующие между собой комплексные соединения различной молекулярной структуры и прочности. Их делят на две группы: протеогликаны и гликопротеины.
Протеогликаны представляют собой белковый стержень, ковалентно связанный с глюкозоаминогликанами, содержащими гексозаамин и гексоуроновую кислоту. Сахар составляет 93 % молекулы, а белок — 7 %.
Функциональное значение протеогликанов состоит в том, что они обеспечивают транспорт воды и низкомолекулярных продуктов питания, а также обмен в соединительной ткани.
Гликопротеины состоят из белковой молекулы, к полипептидной цепи которой в разных участках присоеденены олигосахариды. Гликопротеины выполняют роль матриц, регулирующих ориентированное расположение коллагеновых структур, стабилизируют фибриллы коллагена и их агрегацию с протеогликанами, образуют основу для формирования эластиновых структур, принимают участие в минерализации тканей. Они образуют в воде вязкие растворы.
Компоненты основного вещества ткани, клетки и минеральные соли постоянно находятся во взаимодействии с волокнистыми элементами, влияют на тип и структуру их надмолекулярных образований, что в итоге обусловливает механические, физико-химические и другие свойства соединительных тканей.

