Клеточная инженерия – один из основных разделов современной биотехнологии – позволяет выделять и культивировать ткани и клетки высших многоклеточных организмов. Культивирование тканей и клеток происходит вне организма – in vitro (в пробирке, колбе, стеклянной посуде), в специально подобранных условиях.
Клеточная инженерия основана на использовании принципиально нового объекта — изолированной культуры клеток или тканей эукариотических организмов, а также на таком уникальном свойстве растительных клеток, как тоти-потентность, т. е, способность каждой растительной клетки давать начало целому организму (рис. 3.1).
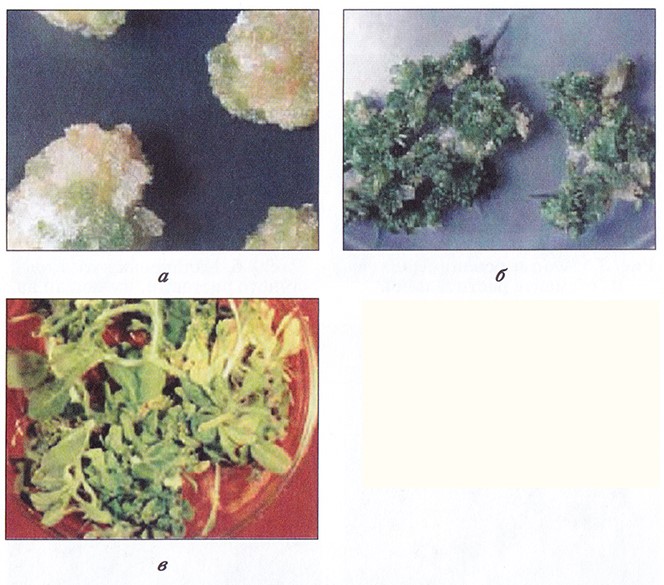
Рис. 3.1. Культуры высших растений in vitro:
а – каллусная культура;
б – морфогенная культура;
в – регенерация листовых побегов
Применение этого объекта открывает большие возможности в решении глобальных теоретических и практических задач (рис. 3.2).
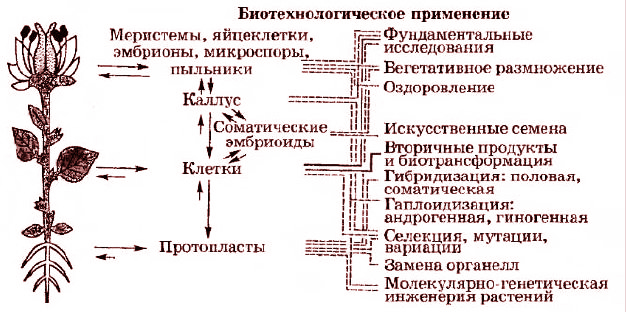
Рис. 3.2. Использование культуры клеток к тканей растений в биотехнологии
В области фундаментальных наук это касается исследования таких сложных проблем, как взаимодействие клеток в тканях, клеточная дифференцировка, морфогенез, механизмы появления раковых клеток, реализация тотипотентности клеток.
При решении практических задач основное внимание уделяется селекции, получению значительных количеств биологически ценных метаболитов растительного происхождения (в частности, более дешевых лекарств), а также выращиванию оздоровленных безвирусных растений, их клональному размножению.
3.1. История развития метода клеточной
и тканевой инженерии растений
Бурное развитие клеточной инженерии приходится на 1950-е гг., хотя первые попытки выращивания изолированных кусочков ткани были сделаны гораздо раньше. В настоящее время предлагается рассматривать следующие этапы становления и развития биотехнологии.
I этап (1892-1902 гг.).
В конце XIX – начале XX в. немецкие ученые X. Фёхтинг (1892), К. Рехингер (1893) и Г. Хаберландт (1902) предприняли первую попытку стимуляции роста растительных тканей и органов, помещенных на фильтровальную бумагу, пропитанную сахарозой. Несмотря на то что положительный результат не был получен, эти работы представляют большой интерес. Авторами были высказаны идеи, которые намного опередили развитие науки того времени и нашли свое подтверждение лишь несколько десятилетий спустя. Так, Фехтинг предположил, что полярность присуща не только организму или органу растения, но и самой клетке. Рехингер определил минимальный размер сегмента, образующего каллус (рис. 3.3). Согласно его исследованиям, в кусочках ткани тоньше 1,5-2,0 мм клетки не делились. Хаберландт впервые четко сформулировал идеи о возможности культивирования in vitro (в стекле) изолированных клеток растений и о тотипотентности клеток, т. е. способности любой соматической клетки полностью реализовывать свой потенциал развития.
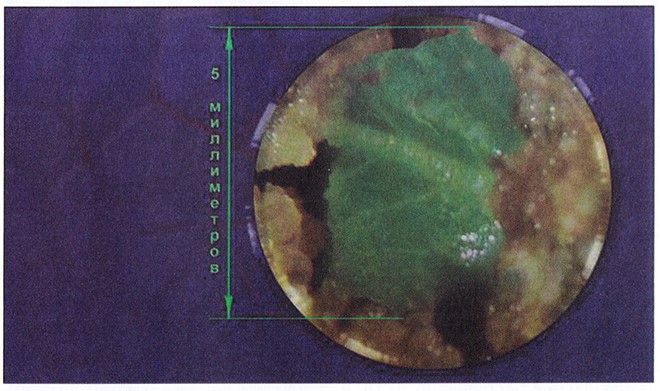
Рис. 3.3. Инициация каллусных клеток на растительном экспланте
II этап (1902–1922 гг.)
Ознаменовался созданием первых питательных сред для культивирования тканей животных. Эти среды были природного происхождения и содержали, как правило, плазму крови и зародышевую жидкость. Попытки вырастить изолированные растительные ткани на искусственных питательных средах, содержащих растительные экстракты, оказались неудачными, так как в экспериментах использовались мало подходящие для проявления ростовой активности клетки и ткани высших растений.
III этап (1922–1932 гг.)
Можно считать становлением метода культуры изолированных корней растения. В 1922 г. американский ученый В. Роббинс и немецкий ученый В. Котте – независимо друг от друга – показали возможность выращивания меристем кончиков корней томатов и кукурузы на синтетической питательной среде. Однако через определенное время растительные ткани бурели и погибали.
IV этап (1932–1940 гг.)
Связан с именами французского ученого Р. Готре и американского исследователя Ф. Уайта. В 1932 г. они показали, что при периодической пересадке на свежую питательную среду кончики корней могут расти неограниченно долго. Именно тогда началось подлинное развитие метода культуры растительных тканей. Эти ученые разработали методы культивирования новых объектов: тканей древесных растений камбиального происхождения, каллусных тканей запасающей паренхимы (Р. Готре), а также тканей растительных опухолей (Ф. Уайт).
Начинаются массовые исследования по разработке новых питательных сред, включающих даже такие неконтролируемые компоненты, как березовый сок или эндосперм кокоса. Работы по культуре ткани быстро развиваются, было успешно введено в культуру много новых объектов.
V этап (1940-1960 гг.).
В 1955 г., после открытия Ф. Скугом и С. Миллером нового класса фитогормонов – цитокининов (и в частности, кинетина), оказалось, что при их совместном воздействии с другим классом фитогормонов – ауксинами – можно стимулировать деление клеток ткани сердцевинной паренхимы табака, лишенной проводящих пучков и камбия. В зависимости от концентрации и соотношения фитогормонов, можно усиливать деление клеток экспланта, поддерживать рост каллусной ткани, индуцировать морфогенез. На этом этапе было оценено положительное воздействие натуральных экстрактов типа эндосперма кокосового ореха, каштана, кукурузы и других растений на поддержание неорганизованного клеточного роста и стимуляцию процессов морфогенеза в культуре каллусных тканей и клеточных суспензий. В 1959 г. был предложен метод выращивания больших масс клеточных суспензий.
VI этап (1960–1975 гг.).
Наиболее важное событие этого этапа – разработка профессором Ноттингемского университета (Англия) Э. Коккингом метода получения ферментативным путем изолированных протопластов из корней и плодов томата и культивирования их в контролируемых условиях. Позже, в 1970 г., в той же лаборатории С. Пауэром и сотрудниками было осуществлено искусственное слияние протопластов, что открыло новый путь к созданию соматических гибридов. В этот же период был разработан метод клонального микроразмножения растений в условиях in vitro с использованием меристемной культуры. Основоположником данного направления исследований является французский ученый Ж. Морель, который получил оздоровленный посадочный материал орхидей и картофеля. Весьма важным достижением в развитии технологий культивирования изолированных тканей и клеток стало культивирование одиночной клетки с помощью ткани-«няньки» (рис. 3.4). Этот метод был разработан в России в 1969 г. в Институте физиологии растений им. К.А. Тимирязева РАН под руководством Р.Г. Бутенко.
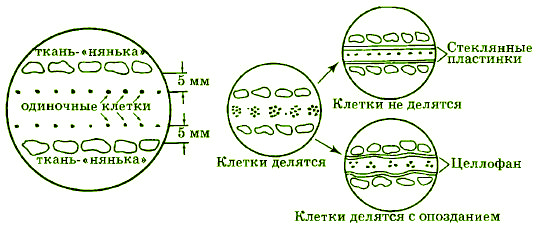
Рис. 3.4. Культивирование одиночных клеток высших растений с помощью ткани-«няньки»
VII этап (1975 г. – по настоящее время).
Продолжается быстрое развитие технологии in vitro и изучение биологии культивируемых объектов. Разрабатываются методы электрослияния изолированных протопластов, мутагенеза и клеточной селекции, получения гаплоидных растений. Совершенствуется метод глубинного культивирования клеток с использованием изолированных протопластов и векторов, созданных на основе Tiи Ri-плазмид Agrobacterium turner faciens и A. rhizogenes. С помощью методов генетической инженерии разработан эффективный метод переноса генов для двудольных растений.
Таким образом, за последние десятилетия сделан значительный шаг вперед в развитии технических приемов работы с изолированными тканями и клетками растений. Объектом исследования, как правило, служили однодольные и двудольные травянистые растения, в редких случаях – древесные.
3.2. Основные направления клеточной инженерии растений
Культуры изолированных клеток и тканей применяют в биотехнологических работах по трем направлениям.
Первое направление – использование изолированных клеток в селекции растений in vitro на устойчивость к различным неблагоприятным факторам среды: засухе, засолению, низким и высоким температурам, фитопатогенам, тяжелым металлам и др. Также в рамках этого направления предусматриваются создание новых растений путем слияния изолированных протопластов и получение неполовых (соматических) гибридов; перенос в изолированные протопласты чужеродных генов методами генетической инженерии; культивирование изолированных пыльников и семяпочек на искусственных питательных средах (создание гаплоидных растений); культивирование изолированных зародышей и оплодотворение в условиях in vitro (преодоление прогамной и постгамной несовместимости растений).
Второе направление – использование культуры изолированных тканей для размножения и оздоровления посадочного материала. Этот метод, названный клональным микроразмножением растений, позволяет получать от одной меристемы сотни тысяч растений в год. За последнее десятилетие данная технология становится уже коммерческим производством.
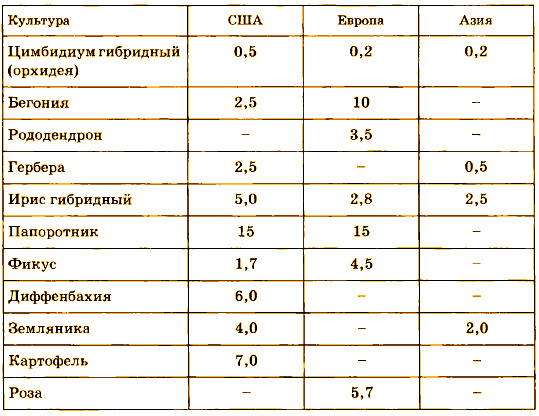
Наибольшее распространение метод клонального микроразмножения получил при культивировании декоративных, тропических и цветочных растений (табл. 2). Для картофеля, аспарагуса, земляники, некоторых подвоев яблони и персика он начинает заменять традиционные способы размножения и селекции.
Таблица 2. Промышленные культуры, выращенные in vitro в США,
странах Азии и Европы в 2000 г. (млн шт.)
Третье направление – получение ценных для медицины, парфюмерии, косметики и других отраслей промышленности веществ вторичного синтеза (алкалоиды, стероиды, гликозиды, гормоны, эфирные масла и др.) на основе клеточных культур растений. Как правило, вторичные вещества получают из каллусной ткани, культивируемой на твердой (агаризованной) или жидкой (суспензионная культура) питательной среде.
На основе клеточных технологий получают такие медицинские препараты, как диосгенин – из клеток диоскореи, аймалин – из клеток раувольфии змеиной, тонизирующие вещества – из клеток женьшеня. Продуктивность культивируемых клеток в результате их селекции in vitro может значительно превышать продуктивность целых растений. Преимущества данного способа заключаются также в возможности использовать для этой цели растения, не произрастающие в наших природных условиях, и получать продукцию круглый год.
3.3. Клетка как основа жизни биологических объектов
Основной формой существования жизни является клетка. В ней протекают все физиологические процессы как у одноклеточных, так и у многоклеточных организмов. Рост и размножение организмов также связаны с образованием новых клеток, которое зависит от происходящих в них биохимических процессов, называемых обменом веществ или метаболизмом.
Клетка является элементарной единицей жизни: в ней имеется все необходимое для поддержания обмена веществ и размножения. Соматические и половые клетки многоклеточных животных и растений, а также одноклеточные организмы в основном сходны по строению.
Среди живых организмов встречаются два типа организации клеток – это клетки, относящиеся к прокариотической и эукариотической группам. Переход от маленьких клеток – прокариот – со сравнительно простой внутренней структурой (клетки бактерий и синезеленых водорослей) к большим по размеру и значительно более сложно устроенным эукариотическим клеткам, подобным клеткам высших животных и растений, произошел приблизительно 1,5 млрд лет назад.
Основные структурные различия прои эукариот:
- наличие или отсутствие ядра, содержащего хромосомную ДНК;
- строение и химический состав клеточной стенки;
- наличие или отсутствие цитоплазматических органелл.
Наиболее простое строение имеют клетки прокариотических организмов. В них нет морфологически выраженного ядра, хромосомная ДНК находится непосредственно в цитоплазме и нет субклеточных цитоплазматических органелл. Клетка окружена ригидной клеточной стенкой. В оптимальных условиях прокариотическая клетка может делиться каждые 20 мин и таким образом менее чем за сутки давать жизнь более 10 млрд клеток.
Клетки всех остальных представителей живого мира относятся к эукариотической группе, потому что их обязательной структурой является клеточное ядро, отделенное от цитоплазмы ядерной оболочкой. Кроме ядра и вакуолей, в цитоплазме существует целый набор специальных структур, или органелл, выполняющих специфические жизненно важные функции.
Ядро – центр, управляющий и координирующий жизнедеятельность всей эукариотической клетки. Оно имеет сложное строение, изменяющееся на разных этапах жизненного цикла клетки. Ядро окружено ядерной оболочкой (с двумя мембранами), пронизанной порами, через которые осуществляется обмен веществ между ядром и цитоплазмой. Внутри ядра находятся хроматин, одно или несколько ядрышек и ядерный сок – кариолимфа, или нуклеоплазма. Ядрышки – тельца, связанные с хромосомами. Они содержат большое количество рибонуклеиновой кислоты (РНК), в них происходит синтез рибосомной РНК.
Энергия в клетке вырабатывается митохондриями – особыми сферическими или палочковидными образованиями разнообразной величины и сложной структуры.
При исследовании цитоплазмы с помощью электронной микроскопии была открыта система мембран и канальцев, служащих продолжением клеточной мембраны и связанных с внешней мембраной ядерной оболочки. Эта система получила название эндоплазматической сети или ретикулума. По эндоплазматической сети канальцев, образуемых мембранами, передвигаются вещества внутри клетки. Здесь же имеются субмикроскопические частицы – рибосомы, состоящие из белков и РНК.
Важнейшими структурными элементами клетки являются пластиды – хлоропласты, лейкопласты, хромопласты и др., которые характерны для цитоплазмы растительных клеток. Хлоропласты содержат пигмент хлорофилл и участвуют в процессе фотосинтеза; бесцветные пластиды – лейкопласты – накапливают крахмал; хромопласты содержат пигменты каротиноиды, эу π ласты – жиры и пластидные нуклеиновые кислоты.
В цитоплазме клетки имеются также специфические органоиды: комплекс Голъджи (производное эндоплазматической сети), обеспечивающий выделительную и секреторную функции клетки; лизосомы – тела, содержащие ряд ферментов и выполняющие функцию внутренного пищеварения клетки; центросомы, клеточный центр которых состоит из небольших телец (центриолей) и центросферы – особым образом дифференцированного участка цитоплазмы.
Клеточная мембрана имеет сложное строение, приспособленное к выполнению определенных функций: защитной, избирательной проницаемости и активного транспорта частиц и молекул. Активный транспорт молекул через клеточную мембрану происходит с помощью ионных каналов.
Передача наследственных признаков потомству как при вегетативном, так и при половом размножении осуществляется делением клеток. Изучение процессов деления эукариотических клеток показало, что из всех клеточных компонентов только хромосомы распределяются поровну между дочерними клетками. Это указывает на участие хромосом в передаче наследственных признаков. В результате деления ядра каждая дочерняя клетка получает точно такой же набор хромосом, как у исходной родительской клетки. В этом «уравнительном» распределении хромосом ядра заключается генетическое значение митоза. Пластиды и митохондрии также размножаются путем деления, но их распределение по дочерним клеткам не подчиняется строгой закономерности.
Деление клетки состоит из двух основных этапов: первый – деление ядра – митоз (кариокинез), второй – деление цитоплазмы (цитокинез). Ядро клетки при делении проходит последовательные стадии: профазу, метафазу, анафазу и телофазу. Между двумя последовательными делениями клетки ядро находится в стадии интерфазы. Хотя интерфазу и называют стадией покоящегося ядра, метаболические процессы в ядре в этот период протекают наиболее активно. В синтетический период интерфазы происходит репликация ДНК.
Продолжительность всего митотического цикла (от 30 мин до 3 ч) зависит от вида и физиологического состояния организма, типа ткани, внешних факторов – температуры, света и др. Скорость прохождения отдельных фаз митоза также различна.
Новый организм при половом размножении возникает из зиготы – оплодотворенной яйцеклетки, которая образуется при слиянии гамет, т. е. мужской и женской половых клеток. Если бы каждая гамета вносила в зиготу полный набор хромосом родительского организма, тогда их число увеличивалось бы вдвое за каждое поколение. Мейоз, предшествующий образованию как женских, так и мужских половых клеток, является регулирующим механизмом, позволяющим сохранять постоянное число хромосом.
Мейоз – процесс деления ядра клетки, при котором наблюдаются конъюгация (слияние) гомологичных хромосом попарно и редукция (уменьшение) их числа в дочерних клетках. При мейозе ядро делится дважды. В результате первого мейотического деления образуются два ядра с половинным (гаплоидным) числом хромосом. Во втором делении каждое вновь образовавшееся ядро делится еще раз, но уже митотическим путем: расходятся сестринские хроматиды. Таким образом, из каждой клетки, вступившей в мейоз, после двух последовательных делений образуются четыре клетки с гаплоидным набором хромосом.
При мейозе не только уменьшается вдвое число хромосом, но и происходит перераспределение компонентов парных гомологичных хромосом по разным клеткам. При этом каждая пара ведет себя независимо. Редукции хромосом в мейозе предшествует слияние (конъюгация) гомологов, которое позволяет каждой паре гомологичных хромосом обмениваться участками. Это создает дополнительный резерв наследственных комбинаций при половом размножении организмов. Процесс обмена гомологичных хромосом своими частями получил название кроссинговера.
Таким образом, через комбинаторику гомологов из разных пар и кроссинговер мейоз резко увеличивает наследственную изменчивость нового поколения диплоидных организмов, возникающих после слияния гамет.
Возникшая после слияния отцовского и материнского ядер зигота содержит программу развития будущего организма, записанную в структурах молекул ДНК. Дочерние клетки развивающейся зиготы получают информацию, которая позволяет им во взаимодействии с условиями внешней среды формировать новый организм.
Вопрос о том, как возникла эукариотическая клетка, до сих пор является предметом многочисленных дискуссий. Отметим, что и прокариотическим, и эукариотическим клеткам растений присуще деление. Они также реагируют на раздражение и способны видоизменяться.
Первые прокариоты, по-видимому, были гетеротрофными организмами и использовали энергию восстановленных соединений, накопившихся в «добиологический» период. После того как запасы экзогенных восстановленных соединений были исчерпаны, для них наступил серьезный «энергетический кризис», который был преодолен с возникновением фотосинтеза и первых фотосинтезирующих бактерий (вероятно, это были цианобактерии).
В результате фотосинтеза на Земле существенно увеличилось содержание кислорода, появился озоновый слой и возникли аэробные формы прокариот (табл. 3).
Таблица 3. Эволюция живых организмов на Земле

В настоящее время нет единой теории возникновения эукариотической клетки; существует несколько гипотез на этот счет.
Первая гипотеза – симбиотическая – принадлежит Л. Маргулис. Согласно этой гипотезе, эукариотические клетки возникли в результате симбиоза двух (гетеротрофные эукариоты) или трех (фототрофные эукариоты) различных клеток. При этом произошел захват (слияние) большой ядерной клеткой одной или нескольких прокариотических клеток с дыхательной или фотосинтетической системами* Из этих прокариотических клеток в дальнейшем образовались соответственно митохондрии и хлоропласты. Ядро клетки-хозяина делится митозом и мейозом, тогда как митохондрии и хлоропласты размножаются простым делением.
Вторая гипотеза – мембранная, или инвагинационная. Согласно этой гипотезе, эволюция одной из аэробных прокариотических клеток и превращение ее в эукариотическую происходили путем инвагинации мембран. Такая клетка должна была иметь многочисленные геномы, каждый из которых был прикреплен к наружной мембране. При инвагинации мембран геномы сегрегировались, и в процессе эволюции их функции разделились. Ядро эволюционировало и становилось все более сложным, тогда как органеллы сохраняли свои первичные функции, а некоторые из них либо передавали их ядру, либо теряли.
Третья гипотеза заключается в том, что прокариотические клетки образовывали скопления отдельных элементов генома. В ходе эволюции эти скопления клонировались, в результате чего функции некоторых клонов генома разделились. Отдельные клоны генома приняли участие в образовании и регуляции деятельности как органелл, так и ядра. Отбор будущих эукариот происходил при наиболее усложненной роли ядра.
Все эти гипотезы говорят о том, что процесс возникновения эукариотических клеток происходил разными путями и что на разных этапах естественного отбора эукариотические клетки получали возможность для эволюционных изменений ядра, митохондрий и хлоропластов. Есть также сведения о том, что почти 93 % всех ферментов, характерных для клеток эукариот, найдены и играют существенную роль и в жизни прокариот.
Симбиотическая гипотеза возникновения эукариот представляется наиболее простой и эффективной, недаром симбиоз у эукариотических и прокариотических растительных организмов существует и в наши дни. При этом митохондрии сохранили свою изначальную функцию – обеспечение аэробного дыхания. Хлоропласты хотя и подверглись изменениям пигментных систем, но также сохранили свою изначальную функцию – процесс фотосинтеза. Ядро сохранило двойную мембрану, как хлоропласты и митохондрии.
Представляет интерес сравнение культивируемых эукариотических клеток высших растений, существующих в условиях in vitro, с прокариотическими и эукариотическими клетками-организмами, существующими в природе. Это может оказаться полезным для выяснения происхождения и эволюции эукариотических клеток.
В эукариотической клетке in vitro возможно изменение состояния пластидного генома. В отдельных экспериментах можно получить фотосинтезирующие клетки и автотрофные суспензии, что позволит изучать развитие фотосинтетического аппарата. Представляет интерес изучение митохондрий в суспензионных культурах клеток. Установлено, что они могут сильно изменяться морфологически (менять форму). Существенно варьирует и геном митохондрий. Например, в культуре клеток Vicia faba изменялась популяция кольцевых ДНК митохондрий, в частности появлялись специфичные мини-кольцевые ДНК, по сравнению с проростками.
Выход растений на сушу был связан с приобретением ими многих новых функций, например появлением комплекса защитных покровов (эпидермис, кутикула), возникновением транспортных систем воды и веществ, а также синтезом специфических защитных веществ, в том числе и веществ вторичного метаболизма. В случае же культивируемых in vitro клеток растений рядом авторов отмечалось снижение их «эволюционного» уровня и проявление черт, свойственных более ранним ступеням развития. Так, в каллусной культуре чайного растения Camellia sinensis L. состав лигнина – основного компонента вторичных клеточных стенок – значительно отличался от такового исходных тканей и был близок к лигнину травянистых растений.
3.4. Дедифференциация –
основа формирования клеточных культур растений
Возникновение каллуса связано с неорганизованным делением – пролиферацией – недифференцированных клеток, поэтому дедифференцировка лежит в основе формирования каллусной ткани.
У интактных растений дедифференцировка и индукция каллусогенеза происходят при механическом повреждении вследствие образования раневых гормонов (травматиновая кислота). В случае клеточных культур обязательным условием дедифференцировки тканей экспланта интактного растения и формирования на них каллусных клеток является не только повреждение (поранение), но и присутствие ауксинов и цитокининов в питательной среде. Функции этих двух групп гормонов в каллусогенезе разные, но они тесно связаны между собой. Ауксины вызывают процессы дедифференцировки клетки, подготавливают ее к делению, тогда как цитокинины инициируют деление клеток. Новейшие исследования свидетельствуют о том, что ауксины индуцируют синтез протеинкиназ клеточного деления, а цитокинины – циклинов. Таким образом, действие этих гормонов проявляется только при последовательном или одновременном внесении их в среду. Кроме того, оно будет зависеть от физиологического состояния клеток экспланта, от их компетентности к действию тех или иных внешних факторов. Результаты исследований показали, что полисахариды и какие-то неизвестные индукторы тоже могут вызывать деление клеток, приводящее к образованию каллуса.
Во время процесса дедифференциации, который у всех клеток сходен, клетки должны утратить характерные черты исходной ткани. В первую очередь они теряют запасные вещества: крахмал, белки, липиды. В них не образуются специализированные клеточные органеллы, в частности хлоропласты, но возрастает число амилопластов. Кроме того, разрушается комплекс Гольджи, перестраиваются эндоплазматический ретикулум и элементы цитоскелета. Через несколько часов после перенесения экспланта в условия in vitro начинается новый синтез белка. Он связан, вероятно, с механическим повреждением тканей и действием гормонов, сохранившихся в экспланте при его изоляции из растения. Когда данные гормоны израсходуются, синтез белка прекращается. Если в это время клетки будут культивироваться на питательной среде, содержащей ауксины и цитокинины, то начнется каллусогенез, т. е. в результате дедифференцировки и деления клеток будет образовываться первичный каллус. Таким образом, специализированная клетка растительной ткани становится каллусной в результате дедифференцировки, т. е. восстановления у нее способности к делению.
3.5. Каллусные культуры растений
Существует несколько типов культур клеток и тканей растений, в зависимости от способа их получения, условий культивирования и происхождения. Если культивирование происходит на плотной поверхности питательной среды, содержащей агар, то образуется каллусная ткань (рис. 3.5.)

Рис. 3.5. Формирование каллуса
на сегменте растительной ткани тиса
Каллус («мозоль») может образовываться как на изолированных кусочках ткани (эксплантах) в условиях in Vitroy так и на растении при поранении.
Каллусная культура – это неорганизованная пролиферирующая ткань, состоящая из дедифференцированных клеток.
Известный ученый-ботаник Н. Кренке более 50 лет назад посвятил часть своих работ изучению роли каллусной ткани в целом растении. Он установил, что в интактном растении каллусная ткань выполняет следующие функции:
- защитные (защищает места повреждений);
- запасные (запасание питательных веществ, синтез вторичных соединений);
- регенерационные (регенерация утраченных органов – корней, побегов).
Каллусную ткань в условиях in vitro можно получить практически из любой живой ткани растений, используя для этого определенные методические подходы.
В основном каллусы имеют белый или желтоватый цвет. Реже отмечается их светло-зеленая окраска и очень редко – интенсивно-зеленая, как это наблюдалось у каллуса мандрагоры. Темно-коричневая окраска чаще возникает при старении каллусных клеток и связана с накоплением в них окисленных фенольных соединений (рис. 3.6). Для предотвращения этого процесса или его снижения в питательные среды вносят антиоксид анты.

Рис. 3.6. Каллусная культура чайного
растения, имеющая на поверхности
темноокрашенные некротические участки
Каллусная ткань обычно аморфна и не имеет конкретной анатомической структуры, хотя она может быть разной плотности, в зависимости от происхождения и условий выращивания (рис. 3.7).
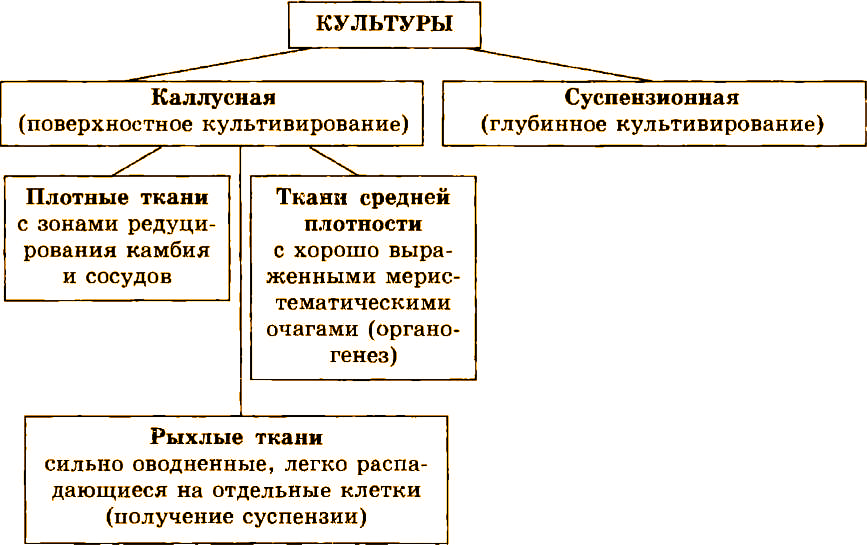
Рис. 3.7. Тины каллусных тканей высших растений
По классификации Р.Г. Бутенко, существует три типа каллусной ткани:
- рыхлая, легко распадающаяся на отдельные мелкие агрегаты и состоящая из сильно оводненных клеток;
- средней плотности, с хорошо выраженными меристематическими очагами;
- плотная, в которой дифференцируются элементы камбия и проводящей системы.
Любой тип плотности каллусной ткани можно превратить в другой, используя для этого следующие приемы:
- заменяя один ауксин на другой (например, ИУК – на 2,4-дихлорфеноксиуксусную кислоту (2,4-Д));
- изменяя концентрацию ауксина в питательной среде;
- увеличивая или уменьшая концентрацию соли хлорида кальция в питательной среде;
- добавляя в питательную среду ферменты (если необходимо получить каллусную ткань рыхлого типа).
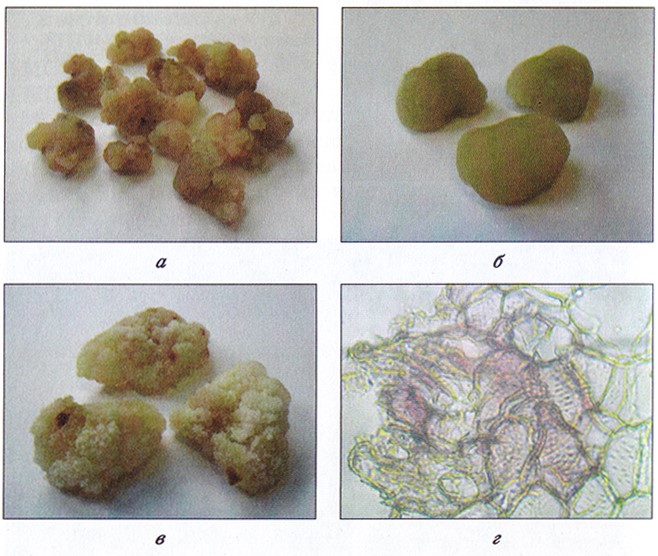
Рис. 3.8. Различная морфология каллусных культур высших растений:
а – рыхлая каллусная ткань чайного растения;
б – каллусная ткань рододендрона средней плотности;
в – плотная каллусная ткань чайного растения,
в структуре которой формируются трахеидальные элементы – г
Обязательным условием дедифференцировки растительной клетки и превращения ее в каллусную является присутствие в питательной среде представителей двух групп фитогормонов: ауксинов и цитокининов. Ауксины вызывают процесс дедифференцировки клетки, подготавливающий ее к делению, а цитокинины – пролиферацию (деление) дедифференцированных клеток.
Если в питательную среду без гормонов поместить кусочек стебля, листа, корня (без верхушки) или любой другой растительный эксплант, состоящий из специализированных (дифференцированных) клеток, то деления клеток не произойдет и каллусная ткань не образуется. Это связано с неспособностью дифференцированных клеток к делению.
Каждая клетка проходит три фазы роста: деление, растяжение, дифференцировку. Характерные особенности заключительной фазы роста – утолщение вторичной клеточной оболочки и потеря клеткой способности к делению. Для того чтобы дифференцированные клетки вновь приобрели способность к делению, необходимо, чтобы произошла их дедифференцировка, т. е. чтобы клетки как бы возвратились в меристематическое состояние. Размножение дедифференцированных клеток приводит к неорганизованному росту, в результате чего образуется каллусная ткань.
Таким образом, превращение специализированной клетки в каллусную связано с индукцией клеточного деления, способность к которому она потеряла в процессе дифференцировки.
Эффект, вызываемый воздействием одних и тех же фитогормонов, может быть различным, в зависимости от физиологической характеристики ткани-мишени. Компетентность ее определяется степенью дифференцировки клеток.
Ростовая кривая каллусных клеток имеет S-образную форму. Она включает пять фаз. Во время первой, латентной, или лаг-фазы, не происходит увеличения числа или массы клеток. Они в этот период подготавливаются к делениям. Вторая фаза – логарифмическая, или экпоненциального роста, – характеризуется наибольшей митотической активностью и увеличением массы каллусной культуры; кроме того, рост происходит с ускорением. Третья фаза – линейная, в которой скорость роста клеток постоянна. Далее наступает четвертая фаза – замедленного роста, когда митотическая активность клеток резко снижается. В пятой – стационарной – фазе ростовая кривая выходит на плато, число поделившихся клеток равно числу отмерших. В этот период начинается деградация клеток, однако она еще уравновешивается возрастанием числа клеток за счет их деления; в целом же скорость нарастания клеточной массы равна нулю. После стационарной наступает фаза отмирания (деградации) клеток, во время которой число и масса живых клеток уменьшаются.
Культивируемые каллусные клетки и ткани сохраняют многие физиологические особенности, свойственные клеткам растения, из которого они были получены. Сохраняются, например, такие свойства, как морозостойкость, устойчивость к абиотическим факторам (температура, засоление, фотопериодическая реакция), а главное, хотя и в разной степени, – способность к синтезу вторичных метаболитов. Наряду с этими общими чертами, у каллусных клеток появляются свои, характерные только для них особенности. Например, длительно культивируемые in vitro клетки высших растений образуют специфическую популяцию соматических клеток, относящуюся к типу неполовых. Наиболее характерные свойства этой популяции – физиологическая асинхронность и генетическая гетерогенность.
Физиологическая асинхронность – важнейшее свойство неполовой популяции – заключается в том, что в каждый данный момент времени клетки находятся в разных фазах роста: одни делятся, другие растут, а третьи уже стареют. Поэтому общее физиологическое состояние такой популяции принято оценивать по состоянию большинства клеток. Причины возникающей асинхронности весьма разнообразны, в их числе:
- особенности вида, сорта, генотипа индивидуального растения, а также особенности экспланта;
- стрессы культивирования, например неоптимальная для данного вида клеток среда;
- изменение баланса эндогенных гормонов и концентрации в среде экзогенных гормонов в течение выращивания;
- генетическая гетерогенность клеток и клонов;
- аномалия митотического цикла клеток in vitro;
- физические факторы (температура, свет, аэрация).
Асинхронность – устойчивое свойство популяции каллусных клеток. Если с помощью специфических воздействий синхронизировать пролиферацию клеток популяции, то уже через три-четыре деления она вновь становится асинхронной.
Генетическая гетерогенность – свойство клеток соматической популяции (нестабильность генома и их генетическая гетерогенность).
Генетически стабильными считаются только клетки меристематических тканей. В клетках остальных тканей при культивировании могут возникать полиплоидия, анеуплоидия, хромосомные аберрации, генные мутации. Однако генетическую гетерогенность нельзя рассматривать как недостаток, поскольку она является необходимым условием существования популяции клеток и служит основой для их адаптации.
В качестве причин появления генетической гетерогенности можно назвать следующие:
- генетическая гетерогенность исходного материала. В растениях клетки характеризуются различной плоидностью, диплоидны только активно делящиеся меристематические клетки;
- нарушение коррелятивных связей при выделении первичного экспланта из растения;
- действие компонентов среды. Экзогенные гормоны и стимуляторы могут оказывать мутагенное воздействие. Ауксины (особенно 2,4-Д), входящие в состав питательных сред, являются мутагенами; цитокинины способствуют полиплоидизации клеток;
- длительное субкультивирование, при котором накапливаются генетически измененные каллусные клетки.
После пяти-шести пересадок новый кариотип клеточной популяции, как правило, стабилизируется, если условия культивирования остаются постоянными. В противном случае изменение физических или трофических факторов приведет к новым генетическим изменениям.
Генетическая нестабильность каллусных клеток имеет большое значение для селекционной работы, так как позволяет отбирать штаммы клеток с измененным генотипом. Эти клетки могут обладать уникальными свойствами: повышенной устойчивостью к неблагоприятным факторам, повышенной продуктивностью и т. д. Однако генетическая гетерогенность популяций каллусных клеток в культуре не влияет на сохранение в их геноме основных качеств вида и растения-донора.
Гормоннезависимость. Хотя гормоны и вызывают мутации, каллуеные ткани большинства растений образуются только в присутствии в питательной среде и ауксинов, и цитокининов. Исключение составляют, например, незрелые зародыши пшеницы и семядоли подсолнечника. Первые образуют каллусную ткань на питательной среде с 2,4-Д, но без цитокининов, вторые, напротив, – на среде, содержащей цитокинины, но без ауксинов. По-видимому, такая специфика связана с эндогенным содержанием фитогормонов и с компетентностью клеток.
При длительном культивировании у каллусных тканей может возникать специфическое свойство гормоннезависимости, т. е. автономности, по отношению к ауксинам и цитокининам. Эти ткани могут расти на среде без гормонов, что делает их похожими на опухолевые клетки и резко отличает от нормальных каллусных тканей. Внешне же такие гормоннезависимые ткани ничем не отличаются от каллусных.
Клетки, которые в процессе культивирования приобрели свойство автономности от присутствия в среде гормонов, называют «привыкшими». Ткани, образованные такими «привыкшими» клетками, называют «химическими опухолями», в отличие от растительных или генетических опухолей.
Генетические опухоли возникают на межвидовых гибридах растений. Растительные опухоли имеют бактериальное или вирусное происхождение, чаще всего они возникают при попадании в растения агробактерий. Так, Agrobacteriит tumefaciens вызывает образование корончатых галлов, A. rhizogenes – бородатого корня, А. rubi – стеблевого галла. Превращение растительных клеток в опухолевые связано с проникновением в них ДНК бактериальной клетки, так называемой Т-ДНК, которая значительно изменяет свойства клетки, в том числе экспрессирует гены, контролирующие синтез ауксинов и цитокининов.
Гормоннезависимость «привыкших» клеток связана с изменением активности собственных генов, ответственных за синтез белков-ферментов, участвующих в синтезе гормонов. Таким образом, «привыкшим» тканям и растительным опухолям в равной степени свойственна гормоннезависимость, но у растительных опухолей она носит генетический характер. У «привыкших» клеток это свойство достигается главным образом за счет эпигеномных изменений.
Существует еще одна особенность, позволяющая отличить «привыкшие» и опухолевые клетки от обычных каллусных. Так, ни опухолевые, ни «привыкшие» ткани не способны к нормальной регенерации. Они могут образовывать уродливые органоподобные структуры, так называемые тератомы. В отдельных случаях у длительно культивируемых тканей удается отодвинуть порог «привыкания» путем изменения состава питательных сред и добиться регенерации нормального растения.
В заключение следует сказать, что, как бы долго ни выращивались клетки в изолированной культуре, они «помнят» свое происхождение. Так, клетки моркови образуют зародыш целого растения моркови, клетки катарантуса розового – соответствующее растение и т. д.
Культивируемые клетки высших растений – это уникальная клеточная популяция, в которой каждая клетка представляет собой отдельный организм, способный к автономному развитию. При регулярном пассировании способность клеток к делению и росту может сохраняться очень долго. Известны ткани, которые поддерживаются в культуре in vitro по 60-70 лет.
3.6. Суспензионные культуры растений
Суспензионные культуры – это отдельные клетки или группы клеток, выращиваемые во взвешенном состоянии в жидкой среде (рис. 3.9). Они представляют собой относительно гомогенную популяцию клеток, которую легко подвергнуть воздействию химических веществ.
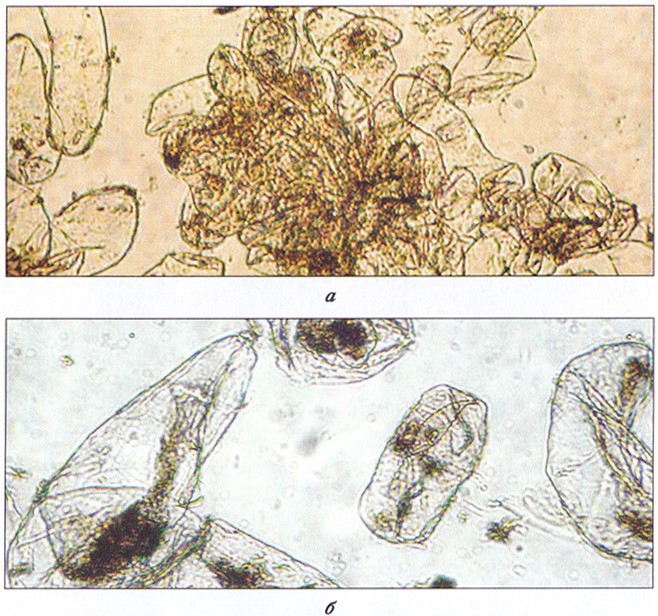
Рис. 3.9. Суспензионные культуры льна в условиях in vitro:
а – крупноагрегиро ванная; б – мелкоагрегироваитя (одиночные клетки)
Суспензию клеток получают путем перенесения в жидкую среду каллусной ткани, предварительно выросшей на твердой агаризованной питательной среде. Поэтому первичная каллусная ткань, используемая в качестве посевного материала, должна быть рыхлой и легко распадаться на отдельные клетки. Для отделения крупных агрегатов клеточную массу перед пересевом фильтруют или отстаивают, а затем помещают в жидкую среду с автоматическим перемешиванием.
В лабораторных условиях клетки суспензии выращивают в колбах на качалке. Скорость вращения 100-120 об/мин. В таких условиях обеспечивается аэрация тканей и нарастающая масса клеточных агрегатов распадается на отдельные фрагменты.
Необходимо отметить, что растительные клетки растут и размножаются значительно медленнее, чем клетки животных или микроорганизмов: время их удвоения составляет от одних до трех суток. Поэтому даже при суспензионном культивировании стационарная фаза роста клеток, при которой культура достигает максимума сухой биомассы, наблюдается обычно через две-три недели. Истощение питательной среды и накопление продуктов жизнедеятельности клеток определяют необходимость обновления культуральной среды или пересева культуры на свежую питательную среду.
Суспензионную культуру можно получать и непосредственно из первичного экспланта (лист, стебель, корень и т. д.). Для этого применяют ферменты, например пектиназу. Вначале на поверхности экспланта образуется каллусная ткань, а затем уже от нее отделяются клетки и клеточные агрегаты, в результате чего получается клеточная суспензия.
Для получения 100 мл клеточной суспензии требуется 2-3 г свежей каллусной ткани.
Обязательным условием культивирования клеточных суспензий является постоянное перемешивание или встряхивание среды. Если клеточная суспензия находится в неподвижном состоянии, то деление суспензионных клеток приводит к образованию каллусной ткани.
Деление суспензионных клеток поддерживается наличием в среде ауксинов и цитокининов, т. е. тех гормонов, которые необходимы для индукции и роста каллусных клеток. Суспензионные культуры представлены типичными каллусными клетками, обладающими всеми свойствами, характерными для клеток такого рода.
Таким образом, как уже было отмечено выше, суспензии лучше образуются из рыхлого каллуса, получаемого на питательных средах с 2,4-Д. Исключение из питательной среды ионов кальция облегчает суспензирование. Еще более облегчает этот процесс добавление в питательную среду фермента пектиназы, которая разрушает пектат кальция, склеивающий отдельные клетки.
При промышленном культивировании суспензионных культур применяют закрытые или открытые системы с периодическим или проточным режимом выращивания клеток.
В закрытой системе клеточная суспензия лишена притока свежей питательной среды до конца выращивания (периодическая культура), а в случае непрерывного режима выращивания в открытой системе питательную среду частично меняют на свежую.
Как при периодическом, так и при проточном режиме выращивания в открытой системе клетки остаются в питательной среде и не удаляются даже при ее замене. Однако в открытых системах культивирования при замене питательной среды вместе со средой отбирается и часть суспензионных клеток.
Для работы с клеточными суспензиями необходимо знать их характеристики: жизнеспособность, плотность клеток в суспензионной культуре, степень агрегированности, скорость роста.
Жизнеспособность клеток определяют по их окрашиванию красителем (метиленовая синь, или синька Эванса). Живые клетки не окрашиваются красителем вследствие непроницаемости для него клеточных мембран. В мертвые клетки краска легко проникает, и они окрашиваются в синий цвет.
Одним из основных показателей, характеризующих состояние клеточной суспензии, является плотность клеточной популяции. Число клеток определяют в счетных камерах Фукса – Розенталя или Горяева под микроскопом после мацерации (разделения клеток) культуры. В качестве мацерирующего вещества применяют 10-20%-ю хромовую кислоту, которая гидролизует срединные пластинки, соединяющие клетки.
Хорошо растущая суспензия имеет, как и каллусная культура, S-образную кривую роста. Обычно длительность пассажа составляет 14-16 дней. При этом плотность возрастает от 5 X 104 до 5 X 106 кл/мл. Суспензия для субкультивирования берется в конце экспоненциальной фазы. Увеличение числа клеток, их сырой и сухой массы – основные критерии роста суспензионных культур.
Качество суспензии зависит от степени агрегированноети ее клеток. По степени агрегированности выделяют:
мелкоагрегированную суспензионную культуру; состоит из одиночных клеток (40 %) и мелких агрегатов (60 %, агрегаты не должны содержать более 10-12 клеток);
среднеагрегированную суспензионную культуру; состоит из одиночных клеток (40 %), мелких агрегатов (40 %) и крупных агрегатов (20 %, агрегаты содержат более 12 клеток);
крупноагрегированную суспензионную культуру; состоит из мелких (40 %) и крупных (60 %) агрегатов. Чтобы избавиться от крупных агрегатов, суспензии фильтруют (фракционируют) через марлевые, нейлоновые или металлические фильтры. Одновременно это позволяет освободиться от остатков экспланта или плотных кусочков каллусной ткани.
Основными признаками хорошей суспензионной культуры служат ее высокая степень дезагрегации (5-10 клеток в группе), морфологическая однородность клеток (небольшие размеры, сферическая или овальная форма, плотная цитоплазма) и отсутствие дифференциации (в частности, трахеидоподобных элементов).
3.7. Изолированные протопласты
Изолированный протопласт – это содержимое растительной клетки, окруженное плазмалеммой (рис. 3.10). Целлюлозная стенка у данного образования отсутствует.Протопласт в целой клетке можно наблюдать во время плазмолиза.
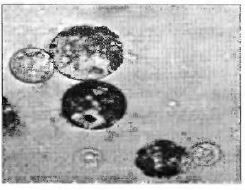
Рис. 3.10. Изолированные протопласты
высших растений в условиях in vitro
Изолированные протопласты относятся к одним из наиболее ценных объектов в биотехнологии. Они позволяют исследовать различные свойства мембран, а также транспорт веществ через плазмалемму (рис 3.11). Главное преимущество изолированных протопластов состоит в том, что в них достаточно легко вводить генетическую информацию из органелл и клеток других растений, прокариотических организмов и из клеток животных. Впервые термин «изолированные протопласты был предложен в 1880 г. Д. Ханстейном.

Рис. 3.11. Использование изолированных
протопластов при изучении различных
физиологических процессов
Э. Коккинг установил, что изолированный протопласт, благодаря механизму пиноцитоза, способен поглощать из окружающей среды не только низкомолекулярные вещества, но и крупные молекулы, частицы (вирусы) и даже изолированные органеллы.
Большое значение в создании новых форм растений для изучения взаимодействия ядерного генома и геномов органелл имеет способность изолированных протопластов сливаться, образуя гибридные клетки. Таким способомможно добиваться получения гибридов от растений с разной степенью таксономической удаленности, но обладающих ценными хозяйственными качествами.
Впервые протопласты были выделены Дж. Клернером в 1892 г. при изучении плазмолиза в клетках листа телореза (Stratiotes aloides) во время механического повреждения ткани. Поэтому данный метод назван механическим. Это длительный и трудоемкий метод, позволяющий выделять лишь небольшое количество протопластов (выделение возможно не из всех видов тканей).
Современный метод выделения протопластов, получивший название ферментативного, заключается в удалении клеточной стенки с помощью поэтапного использования для ее разрушения ферментов: целлюлазы, гемицеллюлазы, пектиназы.
Первое успешное выделение протопластов из клеток высших растений ферментативным методом было осуществлено Э. Коккингом в I960 г. По сравнению с механическим, этот метод имеет ряд преимуществ. Он позволяет сравнительно легко и быстро выделять большое число протопластов, причем они не испытывают сильного осмотического шока. После воздействия ферментов смесь протопластов пропускают через фильтр и центрифугируют для удаления неразрушенных клеток и их осколков.
Выделить протопласты можно из клеток растительных тканей, культуры каллусов и суспензионной культуры. Оптимальные условия для изоляции протопластов индивидуальны применительно к разным объектам, что требует кропотливой предварительной работы по подбору концентраций ферментов, их соотношения, времени обработки. Очень важным фактором, позволяющим выделять целые жизнеспособные протопласты, является подбор осмотического стабилизатора. В качестве стабилизаторов обычно используют различные сахара, иногда ионные осмотики (растворы солей CaCl2, MgHPO4, KCl). Концентрация осмотиков должна быть несколько гипертоничной, чтобы протопласты находились в состоянии слабого плазмолиза. В этом случае тормозятся метаболизм и регенерация клеточной стенки.
Изолированные протопласты можно культивировать. Обычно для этого используют те же питательные среды, на которых растут изолированные клетки и ткани. Сразу же после удаления ферментов у протопластов в культуре начинается образование клеточной стенки. Протопласт, регенерировавший стенку, ведет себя как изолированная клетка, способен делиться и формировать клон клеток. Регенерация целых растений из изолированных протопластов сопряжена с рядом трудностей. Получить регенерацию через эмбриогенез удалось пока только у растений моркови. Стимуляцией последовательного образования корней и побегов (органогенез) добились регенерации растений табака, петунии и некоторых других растений. Следует отметить, что протопласты, изолированные из генетически стабильной клеточной культуры, чаще регенерируют растения, их с большим успехом применяют при исследованиях генетической модификации протопластов.
3.8. Морфогенез в клеточных культурах растений
Как уже говорилось, характерной особенностью растительных клеток является их тотипотентность, т. е. способность отдельной соматической клетки полностью реализовывать свою программу развития и давать начало целому растительному организму.
Развитие многоклеточных организмов – одна из наиболее интересных, но сложных проблем в биологии. Большое распространение получило моделирование процессов онтогенеза на более простых системах: изолированных тканях, клетках и протопластах, культивируемых в стерильных условиях. Их преимущество состоит в том, что нет необходимости постоянно учитывать результаты взаимодействия органов в целостной системе растительного организма. Кроме того, экспериментатор сам имеет возможность выбирать, изменять и повторять условия опыта в соответствии с поставленной задачей.
После завершения дедифференцировки дальнейшее развитие каллусной клетки может идти разными путями.
Первый путь – это вторичная регенерация целого растения; возможна дифференцировка на уровне клеток, тканей, органов.
Второй путь – это утрата клеткой способности к вторичной дифференцировке и регенерации растения, стойкая дедифференцировка, приобретение способности расти на среде без гормонов, т. е. превращение в опухолевую. Такими свойствами часто характеризуются клетки старых пересадочных культур.
Третий путь – это нормальный цикл развития каллусной клетки, заканчивающийся ее старением и отмиранием. В этом случае клетка претерпевает вторичную дифференцировку и прекращает делиться (стационарная фаза роста). Однако такая дифференцировка не ведет к морфогенезу, а закрепляет за клеткой свойства старой каллусной клетки.
Наибольший интерес вызывает первый путь, фактически представляющий морфогенные процессы. В культуре каллусных тканей морфогенезом называют возникновение организованных структур из неорганизованной массы клеток.
Вторичная дифференцировка каллусной клетки может завершиться образованием в каллусной ткани отдельных дифференцированных клеток. Они имеют определенное строение и выполняют специфические функции. Примером служит образование эпибластов – клеток, в которых запасаются вторичные метаболиты (рис. 3.12). Это наиболее простой тип дифференцировки каллусной клетки. Более сложная гистологическая дифференцировка завершается образованием в каллусе различных тканей: млечников, волокон, трихом, элементов ксилемы (трахеи и трахеиды) и флоэмы (ситовидные трубки и клетки-спутницы). К самым сложным видам вторичной дифференцировки относятся органогенез (образование органов) и соматический эмбриогенез (образование из соматических клеток эмбриоидов – биполярных зародышеподобных структур).
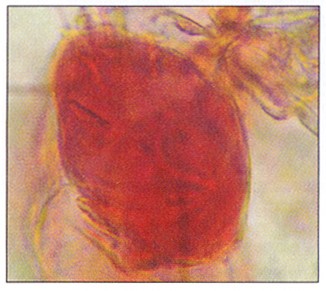
Рис. З.12. Клетка – вместилище (эпибласт)
сфенольными соединениями из каллуснон
культуры чайного растения
Все эти типы дифференцировки возможны только благодаря свойству тотипотентности, поскольку любая растительная клетка содержит полный набор генов, характерный для того организма, из которого она была выделена. Потенциальные возможности всех клеток растения одинаковы. Каждая из них в определенных условиях может дать начало целому организму. Однако выяснено, что реально детерминируется только одна из 400-1000 клеток, что, вероятно, связано с физиологическим состоянием клетки, с ее компетентностью. Так, у эксплантов стеблевого происхождения компетентность к действию экзогенных фитогормонов (и, следовательно, способность к морфогенезу) проявляют только клетки эпидермальных и субэпидермальных тканей. Клетки могут приобретать ее в процессе культивирования каллусной ткани, в условиях, индуцирующих морфогенез. Время, в течение которого в каллусных клетках возникает это свойство, изменяется в широких пределах. Кроме того, существенную роль в дифференциации играют генотип растения-донора, условия и физические факторы культивирования.
Все каллусные клетки, готовые к вторичной дифференцировке, т. е. детерминированные, характеризуются общими чертами. Эти клетки (клетки-инициали) образуют утолщенную клеточную стенку, обособляясь от остальных каллусных клеток. Для них характерны более крупное ядро, высокое накопление запасных веществ, меньшие размеры вакуолей. В клетках-инициалях начинается синтез определенных белков, интенсифицируется пентозофосфатный путь расщепления гексоз. Очень важно, что между этими клетками, формирующими меристематические очаги, восстанавливаются плазмодесмы, которые практически отсутствуют в массе каллусных клеток.
Интересное предположение было высказано Л. Саксом и С. Тойвоненом (1963). Оно сводится к тому, что существует минимальная масса каллусных клеток, которая определяет способность уже детерминированных клеток к дальнейшему морфогенезу. Это подтвердилось в опытах с культурой семядолей ели, где детерминация адвентивных побегов происходила в клеточных комплексах из пяти-шести клеток. В случае развития соматических зародышей требовалось шесть – десять клеточных агрегатов.
Гистогенез. Главную роль в преобразовании каллусных клеток в сосудистые элементы играют фитогормоны, в основном ауксины. Опыты по изучению влияния апикальной меристемы побега (место синтеза ауксинов) на гистогенез в каллусной ткани показали, что ниже места прививки апекса в каллусной ткани начинали образовываться сосудистые элементы. Тот же эффект наблюдался при нанесении на каллус ауксина с сахарозой. Интересно, что повышение концентрации сахарозы способствовало образованию элементов флоэмы, а понижение – образованию ксилемных элементов. Причем такое воздействие оказывала совместно с ауксином только сахароза, что позволяет говорить о ее возможной регуляторной роли. Добавление к гормону других Сахаров гистогенеза не вызывало. В некоторых случаях стимуляторами гистогенеза, помимо ауксинов, могут быть и другие фитогормоны. Так, было отмечено, что в каллусных тканях сои этот процесс начинается под воздействием гибберелловой кислоты и этилена.
Как уже отмечалось выше, в культурах in vitro существует два основных типа морфогенеза. Это органогенез, т. е. образование монополярной структуры (отдельных органов) – корневой, стеблевой, реже флоральной (цветочной) или листовой (рис. 3.13), и соматический эмбриогенез. При органогенезе сначала регенерируют отдельные органы, а затем уже из них – целые растения (исключение составляет корневой органогенез).

Pис. 3.13. Морфогенез в условиях in vitro:
а – корневой; б – стеблевой
При соматическом эмбриогенезе происходит образование биполярных зародышеподобных структур из соматических клеток (рис. 3.14). В этом случае, в отличие от органогенеза, сразу образуется зародыш, имеющий как меристему корня, так и меристему верхушечной почки, из которой в дальнейшем развивается целое растение.

Рис. 3.14. Соматический эмбриогенез
у культур in vitro
Любая растительная клетка обладает одинаковыми потенциальными возможностями, так как содержит весь набор генов; следовательно, клетки сохраняют свойственную зиготе программу развития. Поэтому если получен каллус из клеток лепестка цветка, или из клеток сердцевинной паренхимы стебля, или из клеток любой ткани, то в принципе каждая такая клетка может регенерировать целое растение. Однако свойство тотипотентности не всегда реализуется, так как потенциальные возможности клеток разных типов проявляются неодинаково. В некоторых из них гены в большей степени репрессированы, в связи с чем проявление тотипотентности становится ограниченным.
Клеточную основу морфогенеза составляет цитодифференцировка. При этом дедифференцированные клетки вновь приобретают структуру и специализированные функции. Регенерация растения начинается с вторичной дифференцировки клеток.
Первые работы Ф. Скуга и С. Миллера показали прямую зависимость органогенеза в каллусах от соотношения фитогормонов – ауксина и открытого этими исследователями кинетина. Преобладание концентрации ауксина над цитокинином вызывает дифференцировку клеток, приводящую к образованию корневой системы. В этом случае регенерации целого растения не происходит. При увеличении концентрации цитокинина и уменьшении концентрации ауксина начинаются стеблевой органогенез и образование побега. Если его пересадить на свежую питательную среду с преобладанием ауксина, то наблюдаются образование корней и регенерация целого растения.
В настоящее время доказано, что для прохождения органогенеза очень большое значение имеют принадлежность растения-донора к классу двудольных или однодольных, его генотип, а также тип экспланта. Кроме того, морфогенез можно получить только при условии подбора оптимальной питательной среды, определенных физических факторов, при балансе фитогормонов, присутствии сигнальных белков и наличии белков-акцепторов в клетках.
Среди компонентов, входящих в состав питательных сред, существенную роль играют ионы NH4+ и NO3–. Присутствие аммонийного азота важно для начала морфогенеза, а добавление нитратного азота способствует росту и развитию образовавшихся структур. Фитогормоны, используемые для стимуляции органогенеза, не ограничиваются теперь только ауксинами и цитокининами. С этой целью в питательную среду вводят другие классы фитогормонов: абсцизины, гиббереллины, этилен.
Установлено также влияние типа экспланта на морфогенез. Например, экспланты, выделенные из верхних междоузлий растений, могут образовывать каллус, способный к флоральному морфогенезу, тогда как экспланты из нижних междоузлий давали начало только вегетативным органам.
Вопрос о механизме запуска вторичной дифференцировки у каллусных клеток остается открытым. В настоящее время самое раннее событие, связанное с морфогенезом, – это появление тканеспецифичных белков. Установлено, что все морфогенетические изменения активируются и/или контролируются специальными генами.
Соматический эмбриогенез. При соматическом эмбриогенезе клетка-инициаль дает начало зиготе. Регенерант, образующийся из соматического зародыша, полностью сформирован, что делает липшими затраты на укоренение полученных при органогенезе побегов. Кроме того, соматические эмбриоиды точнее воспроизводят генотип исходного растения, по сравнению с растениями-регенерантами, полученными в результате органогенеза. Соматические зародыши представляют и чисто практический интерес, так как их можно использовать для получения искусственных семян.
Соматический эмбриогенез очень важен для развития фундаментальных наук. Он позволяет изучать механизмы эмбриогенеза, так как почти все его фазы, за исключением первой, в растении и в культуре тканей совпадают. Наиболее ранняя из изученных фаз детерминации клетки по эмбриональному пути развития состоит в приобретении ею свойств полярности. Так, при определении плотности биоэлектрического потенциала для четырех морфогенных клеток оказалось, что максимальная плотность электрического тока была на полярных полюсах этой группы клеток. Переход клеток в следующую фазу эмбриогенеза сопровождался значительным повышением плотности тока. Предполагается, что морфогенные клетки могут поддерживать полярность за счет активного базипетального транспорта эндогенного ауксина, градиента биоэлектрических потенциалов и ионов кальция. Было также установлено, что слабый постоянный электрический ток (2 мкА) может быть индуктором эмбриогенеза.
Если органогенез можно индуцировать с помощью ауксинов или цитокининов, то соматический эмбриогенез фактически независим от экзогенных фитогормонов. Обычно эмбриогенные зоны возникают в каллусной ткани на той же питательной среде, которая использовалась для каллусообразования. Развитие соматических зародышей в каллусной ткани начинается тогда, когда устраняется дедифференцирующий фактор из питательной среды (2,4-Д или другие ауксины). Развивающийся зародыш не нуждается в экзогенных гормонах, так как сам обеспечивает себя ими.
Независимость соматического эмбриогенеза от экзогенных гормонов является аргументом в пользу точки зрения, высказанной еще Г. Хаберландтом, а позднее Ф. Стэвардом: сам процесс изолирования клетки стимулирует реализацию ее тотипотентности, т. е. переход к морфогенезу.
Таким образом, основными стимулами морфогенеза в культуре каллусных тканей являются изменения соотношения гормонов в питательной среде и сам процесс изоляции растительной клетки от организма, а дополнительным стимулом – присутствие в питательной среде нитрата серебра, нитрата аммония, некоторых аминокислот (пролин, тирозин, иногда серин), полиаминов (путресцин и спермидин). В ряде случаев маннит и сорбит стимулируют процесс морфогенеза. Ионы NO3оказывают влияние на развитие возникших в каллусной ткани организованных структур, а их индукцию стимулируют ионы NH4+. Гибберелловая кислота способствует росту зачатков стебля, а абсцизовая – ускоряет дифференцировку органов соматических зародышей.
На регуляцию морфогенеза оказывает существенное влияние качество света. Показано, что морфогенный каллус чаще образуется на синем свету, чем на белом или красном.
Изменения на уровне индивидуальных белков во время реализации морфогенетической программы в культуре тканей позволили говорить о существовании белков развития. Однако отсутствие специфических тестов на эти белки делает их определение проблематичным. Вместе с тем при использовании гибридов, продуцирующих моноклональные антитела на мембранные белки соматических зародышей, удалось выявить полипептид с молекулярной массой 45 к Да, который встречается в ядре нескольких видов растений и, возможно, участвует в регуляции клеточного деления.
В настоящее время большое внимание уделяется генетическому аспекту морфогенеза – изучению соматического эмбриогенеза как генетически наследуемого признака. Роль основного двигателя процесса развития отводится дифференциальной активности генов. Предполагается, что гены, контролирующие соматический эмбриогенез, начинают экспрессироваться в критические периоды развития эмбриоидов.
Для перестройки и подготовки инициальных клеток к последующим быстрым делениям, которые происходят при морфогенезе, требуется лаг-фаза, после которой клетки делятся по типу дробления, образуя сферическую массу мелких изодиаметрических клеток.
В случае органогенеза эту массу клеток называют меристематическими очагами, а в случае соматического эмбриогенеза – глобулярным проэмбрио.
В дальнейшем в меристематическом очаге дифференцируются зачатки стебля, корня, листа или цветочной почки и происходит соответственно стеблевой, корневой, листовой или флоральный органогенез.
В глобулярном проэмбрио развивается биполярная эмбриоидная структура.
Можно выделить несколько последовательных стадий формирования соматических эмбриоидов из каллусной клетки: глобулярную, сердечка, торпедовидную, соматического зародыша (рис. 3.15).
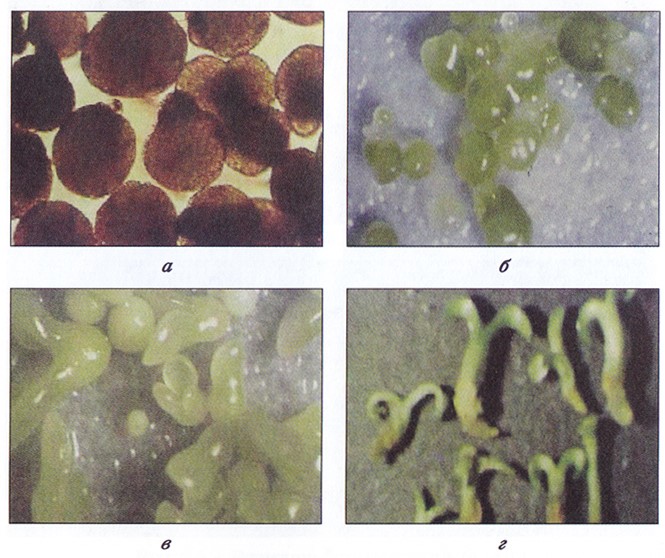
Рис. 3.15. Стадии соматического эмбриогенеза:
а – глобулярная; б – сердечко; в – торпедовидная; г – соматический зародыш
Меристематические очаги или проэмбрио могут возникать на периферии каллусной ткани или быть погруженными в нее. Определенной закономерности в их локализации обычно не наблюдается.
3.9. Клональное микроразмножение растений
и его практическое применение
Достижения в области культуры клеток и тканей привели к созданию принципиально нового метода вегетативного размножения – клонального микроразмножения: получения в условиях in vitro неполовым путем растений, генетически идентичных исходному экземпляру. В основе метода лежит уникальная способность растительной клетки реализовывать присущую ей тотипотентность, т. е. под влиянием экзогенных воздействий давать начало целому растительному организму.
По сравнению с традиционными способами размножения, метод клонального микроразмножения, несомненно, имеет ряд преимуществ. Так, он обеспечивает:
- получение генетически однородного посадочного материала;
- получение безвирусных растений;
- высокий коэффициент размножения (105-106 – для травянистых и цветочных растений, 104-105 – для кустарниковых древесных, 104 – для хвойных);
- сокращение продолжительности селекционного процесса;
- ускорение перехода растений от ювенильной к репродуктивной фазе развития;
- размножение растений, трудно размножаемых традиционными способами;
- возможность проведения работ в течение года и экономия площадей, необходимых для выращивания посадочного материала;
- автоматизацию процесса выращивания.
Начало успешному применению метода клонального микроразмножения было положено в конце 1950-х гг. французским ученым Ж. Море л ем, которому удалось получить первые растения-регенеранты орхидей. Достижению успеха способствовала уже разработанная к тому времени техника культивирования апикальной меристемы растений в условиях in vitro.
В нашей стране работы по клональному микроразмножению были начаты в 1960-х гг. в лаборатории культуры тканей и морфогенеза Института физиологии растений им. К.А. Тимирязева РАН под руководством профессора Р.Г. Бутенко. Были изучены условия микроразмножения картофеля, сахарной свеклы, гвоздики, герберы, фрезии и некоторых других растений и предложены промышленные технологии.
Области применения клонального микроразмножения разнообразны, и имеются тенденции к их постоянному расширению. Это в первую очередь относится к размножению in vitro взрослых древесных пород, особенно хвойных, и использованию техники in vitro для сохранения редких и исчезающих видов лекарственных растений.
Процесс кл опального микроразмножения можно разделить на четыре этапа (рис. 3.16):
1) выбор растения-донора, изолирование эксплантов и получение хорошо растущей стерильной культуры;
2) собственно микроразмножение, когда достигается получение максимального количества микропобегов;
3) укоренение размноженных побегов с последующей адаптацией их к почвенным условиям, а при необходимости депонирование растений-регенерантов при пониженной температуре (+2 °С, +10 °С);
4) выращивание растений в условиях теплицы и подготовка их к реализации или посадке в поле.
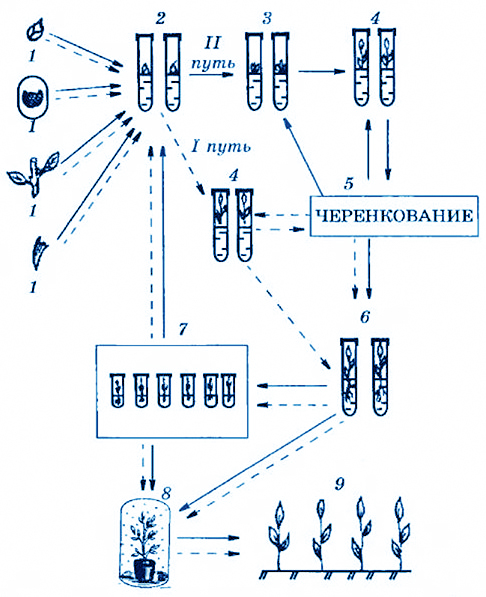
Рис. 3.16. Схема клонального микроразмножения растений методом
активации развития существующих мористом (I путь)
и индукция образования адвентивных почек на первичном экспланте (II путь)
1 — выбор исходного эксиланта; 2 — получение стерильной культуры;
3 — образование адвентивных почек непосредственно на первичном экспланте;
4 — рост почек и формирование микропобегов;
5 — размножение микроиобегов (микрочеренкование);
6 — укоренение микропобегов;
7 — депонирование растений-регенераятов при пониженной температуре (+2 °С);
8 — перевод растений в тепличные условия;
9 — высадка растений-регснерантов в поле
Микроразмножение растений можно осуществлять следующими методами:
- активацией развития уже существующих в растении меристем (апекс стебля, пазушные и спящие почки и интеркалярные зоны стебля);
- индукцией возникновения адвентивных почек непосредственно тканями экспланта;
- индукцией соматического эмбриогенеза;
- дифференциацией адвентивных почек в первичной и пересадочной каллусной тканях.
Из перечисленных методов клонального микроразмножения растений основным является метод активации развития уже существующих в растении меристем, основывающийся на снятии апикального доминирования (рис. 3.17). Это может быть достигнуто двумя путями:
- удалением верхушечной меристемы стебля и последующим микрочеренкованием побега in vitro на безгормональной среде;
- добавлением в питательную среду веществ цитокининового типа действия, индуцирующих развитие многочисленных пазушных побегов.
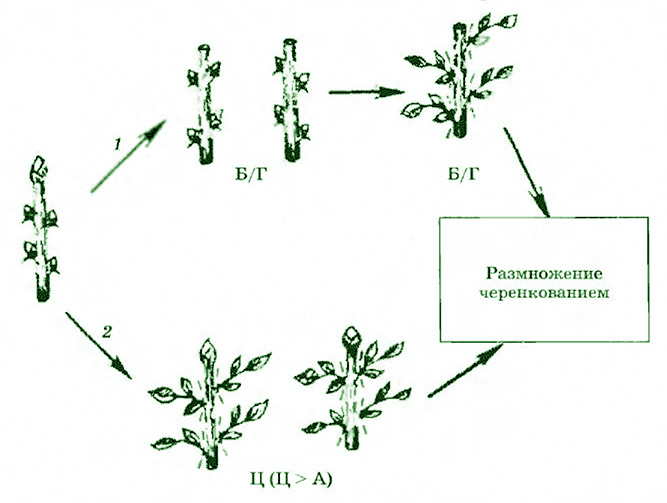
Рис. 3.17. Схема размножения растений методом активации развития существующих меристем:
1 – удаление верхушечной меристемы;
2 – добавление в питательную среду цитокинннов (Б/Г – без гормональная среда;
Ц – цитокинины; А – ауксины)
Как правило, в качестве цитокининов используют 6-бензиламинопурин (БАЛ) или 6-фурфуриламинопурин (кинетин), а также 2-изопентениладенин (2ip) и зеатин. Полученные таким образом побеги отделяют от первичного материнского экспланта и вновь культивируют на свежеприготовленной питательной среде, стимулирующей пролиферацию пазушных меристем и возникновение побегов более высоких порядков.
В настоящее время этот метод широко применяют в производстве безвирусного посадочного материала различных растений (рис. 3.18). Это сельскохозяйственные культуры – технические (сахарная свекла, хмель, табак, топинамбур, стахис), овощные (томаты, картофель, огурец, перец, тыква, спаржа и др.); культуры промышленного цветоводства (гвоздика, хризантема, роза, гербера); тропические и субтропические растения (рододендрон, азалия, камелия, чай и др.); плодовые и ягодные культуры (яблоня, слива, вишня, груша, виноград, малина, смородина, крыжовник и др.); древесные растения (тополь, ива, ольха, береза, рябина, секвойя, туя, можжевельник и др.)·Для некоторых сельскохозяйственных культур (таких, как картофель) технология клонального микроразмиолсения поставлена на промышленную основу. Применение метода активации развития уже существующих в растении меристем позволяет получать из одной меристемы картофеля более 105 растений в год, причем технология предусматривает получение в пробирках микроклубней – ценного безвирусного семенного материала.

Рис. 3.18. Размножение растений in vitro методом активации
развития существующих меристем:
а – фуксии; б – роза; в – картофель
Второй из перечисленных методов – индукция возникновения адвентивных почек непосредственно тканями экспланта – основан на способности изолированных частей растения при благоприятных условиях питательной среды восстанавливать недостающие органы и таким образом регенерировать целые растения (рис. 3.19). Образования адвентивных почек можно добиться почти из любых органов и тканей растения {изолированного зародыша, листа, стебля, семядолей, чешуек и донца луковицы, сегментов корней и зачатков соцветий), если их удается получить свободными от инфекции. Этот процесс, как правило, происходит на питательных средах, содержащих один цитокинин или в его сочетании с ауксином (в соотношении 10 : 1 или 100 : 1). В качестве ауксина в этом случае наиболее часто используют β-индолил-З-уксусную кислоту (ИУК) или α-нафтилуксусную кислоту (НУК).

Рис. 3.19. Размножение растений in vitro методом индукции образования
адвентивных почек непосредственно на первичном экспланте:
а – сенполии; 6 – гиацинты; в – фритилярии; г – лилии
Индукция возникновения адвентивных почек – наиболее распространенный метод микроразмножения высших растений; многие луков и чные цветочные растения (нарциссы, лилии, гиацинты, гладиолусы, тюльпаны) были размножены из луковичных чешуек, сегментов базалькой части донца луковиц, эксплантов листьев; представители рода Brassica (капуста цветная, кочанная, брюссельская, листовал, брокколи) – из сегментов гипокотиля, семядолей, листьев; лук, чеснок – из верхушечной меристемы, ткани донца луковиц; томаты – из апикальных или пазушных меристем; салат цикорный – из гегментов листовых пластинок; петуния из сегментов корней; глоксиния, фиалки – из сегментов листовых пластинок; некоторые представители древесных растений – из изолированных зрелых и незрелых зародышей (рис3.20).

Рис. 3.20. Микроразмножеиие сосны из изолированных
зародышей в условиях in vitro
Третий метод, практикуемый при клопальном микроразмножении, основывается на дифференциации из соматических клеток зародышеподобных структур, которые по своему внешнему виду напоминают зиготические зародыши. Этот метод получилназвание соматического эмбриогенеза. Основное отличие образования зародышей in vitro от in vivo (в естественных условиях) заключается в том, что соматические зародыши развиваются асексуально вне зародышевого мешка и по своему внешнему виду напоминают биополярные структуры, у которых одновременно наблюдается развитие апикальных меристем стебля и корня. В настоящее время этот метод используется для размножения большинства растений из семейства Orchidaceae и Rutaceaet некоторых представителей злаковых (пшеница, ячмень), люцерны, редиса, винограда, а также некоторых видов древесных пород (осина, эвкалипт, дуб, ель обыкновенная).
Формирование эмбриоидов в культуре тканей происходит в две стадии. На первой стадии клетки экспланта дифференцируются за счет добавления в питательную среду ауксинов (как правило, 2,4-Д) и превращаются в эмбриональные. На второй стадии клетки должны развиться в эмбриоиды, что достигается уменьшением концентрации ауксина или полным его исключением из состава питательной среды. Соматический эмбриогенез можно наблюдать непосредственно в тканях первичного экспланта, а также в каллусной культуре. Причем последний способ считается менее пригодным при клональном микроразмножении, так как посадочный материал, полученный таким методом, будет генетически нестабилен по отношению к растению-донору. Как правило, соматический эмбриогенез происходит при культивировании каллусных клеток в жидкой питательной среде (суспензии) и является наиболее трудоемким, так как не всегда удается реализовывать свойственную клеткам тотипотентность.
Однако данный метод размножения имеет свои преимущества, поскольку не требуется подбора специальных условий укоренения и адаптации пробирочных растений, так как соматические зародыши представляют собой полностью сформированные растеньица. При использовании соответствующей техники их капсулирования из этих эмбриоидов возможно получать искусственные семена.
Четвертый метод клонального микроразмножения – дифференциация адвентивных почек в первичной и пересадочной каллусной ткани – мало используется для получения посадочного материала in vitro. Это связано с тем, что при периодическом пересаживании каллусной ткани на свежую питательную среду часто наблюдаются явления, нежелательные при микроразмножении: изменение плоидности культивируемых клеток, структурные перестройки хромосом и накопление генных мутаций, потеря морфогенетического потенциала культивируемыми клетками. Наряду с генетическими изменениями растений наблюдаются и морфологические: низкорослость, неправильное жилкование листьев и их расположение по стеблю, образование укороченных, утолщенных междоузлий, уродливость, пониженная устойчивость к болезням и вредителям. Причем длительное культивирование каллусных клеток усугубляет эти изменения, поэтому период неорганизованного роста при микроразмножении должен быть сведен к минимуму.
Несмотря на некоторые недостатки, метод дифференциации адвентивных почек в первичной и пересадочной каллусной ткани имеет положительные стороны:
- во-первых, он эффективен и экономически выгоден, так как в процессе размножения из каждой индивидуальной каллусной клетки при благоприятных условиях культивирования может сформироваться адвентивная почка, дающая начало новому растению;
- во-вторых, в ряде случаев он является единственно возможным методом размножения растений в культуре тканей;
- в-третьих, он представляет большой интерес для селекционеров, так как растения, полученные методом дифференциации адвентивных почек в первичной и пересадочной каллусной ткани, различаются генетически и морфофизиологически. Это дает возможность селекционерам проводить отбор растений по хозяйственно важным признакам и оценивать их интродукцию в полевых условиях.
Метод дифференциации адвентивных почек в первичной и пересадочной каллусной ткани целесообразно применять лишь к тем растениям, для которых показана генетическая стабильность каллусной ткани, а вариабельность между растениями-регенерантами не превышает уровня естественной изменчивости. К таким растениям можно отнести амариллис, томаты, спаржу, некоторые древесные породы и другие культуры. Через каллусную культуру были размножены сахарная свекла, некоторые представители рода Brassica, кукуруза, рис, пшеница и другие злаковые, подсолнечник, лен; разработаны условия, способствующие регенерации растений из каллуса огурца, картофеля, томатов.
Основное преимущество клонального микроразмножения заключается в возможности получения генетически однородного, безвирусного посадочного материала. Этого достигают, используя меристематические ткани апексов и пазушных почек органов стеблевого происхождения. Как правило, меристема состоит из конуса нарастания, а также одного или двух листовых зачатков (примордиев) и является свободной от инфекции.
Предположение о возможности отсутствия вирусов в меристематических тканях больных растений впервые высказано Ф. Уайтом (1943). Начиная с 1950-х гг. были предприняты первые успешные опыты по получению свободных от вирусов растений георгина из точки роста. Авторы этого метода Ж. Морель и С. Мартин полагали, что в больном растении вирус распространяется с отставанием от быстро растущих молодых органов, особенно в молодых недифференцированных тканях, где концентрация вируса может снижаться, вплоть до полного отсутствия. Теоретические концепции, положенные в основу этого метода, нашли свое подтверждение в последнее время.
Структурной основой используемого на практике явления служит специфика строения точки роста растений; дистальная ее часть, представленная апикальной меристемой, у разных растений имеет средний диаметр до 200 мкм и высоту от 20 до 150 мкм. В более нижних слоях дифференцирующиеся клетки меристемы образуют прокамбий, дающий начало пучкам проводящей системы.
Известно, что успех клонального микроразмножения зависит от размера меристематического экспланта: чем больше листовых зачатков и тканей стебля, тем легче идет процесс морфогенеза, заканчивающийся получением целого нормального пробирочного растения.
Вместе с тем зона, свободная от вирусных частиц, существенно различается для разных видов и сортов растений, а также зависит от вида вирусов. В колеоптиле злаков, например, размеры участка верхушки, не содержащей сосуды, могут достигать до 250 мкм. Такая особенность строения апикальной меристемы исключает проникновение в нее вируса путем быстрого транспортирования по проводящей системе, но допускает возможность его медленного распространения через плазмодезмы, соединяющие меристематические клетки.
При культивировании апикальной меристемы картофеля величиной 200 мкм на питательной среде и дальнейшем получении из нее растений-регенерантов было показано, что среди полученных растений только 10 % были свободны от Х-вируса, но 70 % – от Y-вируса.
Применение электронной микроскопии часто обнаруживает наличие вирусов в меристеме пораженных ими растений, что, впрочем, подтверждает общеизвестный факт: число лишенных вируса растений после подобной операции чрезвычайно мало и многие меристемы пораженных растений инфекционны.
Таким образом, эффективность применения апикальной меристемы в качестве метода оздоровления зараженных вирусами растений оказывается низкой. Это было доказано результатами, полученными рядом меристемных лабораторий Российской Федерации и Крыма, а именно: из апикальных меристем растений гвоздики, цимбидиума, пораженных вирусами CarMV и CarVMV, в условиях in vitro получают инфицированные мериклоны.
В принципе возможно получение безвирусной апикальной меристемы от больного растения, но при этом риск попадания вирусов в здоровые ткани должен быть снижен до нуля. Этого можно достичь путем применения методов предварительной термоили хемотерапии исходных растений.
Метод термотерапии – использование сухого горячего воздуха – применяют как в условиях in vivo, так и в условиях in vitro. Для объяснения механизма освобождения растений от вирусов в процессе термотерапии существуют различные гипотезы.
Согласно одной из них, высокие температуры воздействуют непосредственно на вирусные частицы через их рибонуклеиновую кислоту и белковую оболочку, вызывая физическое разрушение и лишая вирусные частицы вирулентности.
Вторая гипотеза состоит в том, что высокая температура воздействует на вирусы через метаболизм растений. Под влиянием высоких температур нарушается равновесие между синтезом и деградацией вирусных частиц. Если преобладает синтез, то концентрация вируса в зараженных тканях растет, и наоборот.
Растения, подвергающиеся термотерапии, помещают в специальные термокамеры (термостат), где в течение первой недели повышают температуру от 25 до 37 °C путем ежедневного увеличения параметров температур на 2 °С. Не менее важно при термотерапии создавать и поддерживать на протяжении всего процесса оптимальные режимы: температуру – 37 °С; освещенность лампами дневного света – 5 тыс. лк; фотопериод, в зависимости от культуры, – 1416 ч в сутки при относительной влажности воздуха в термокамере 90 %.
Продолжительность термотерапии всецело зависит от состава вирусов и их термостойкости. Если, например, для гвоздики достаточно 10-12-недельного воздействия теплом, то для освобождения хризантемы от Б-вируса этот период длится 12 и более недель. Однако существуют растения (например, луковичные культуры, цимбидиум, розы и др.), рост которых угнетается в результате длительной термотерапии in vivo. Для таких растений целесообразно проводить термотерапию растений-регенерантов in vitro.
Помимо положительного воздействия термотерапии на освобождение растений от вирусов, выявлен положительный эффект высоких температур на точку роста и процессы морфогенеза некоторых цветочных культур (гвоздика, хризантема, фрезия) в условиях in vitro. Применение термотерапии позволяет увеличить коэффициент размножения на 50-60 %, повысить адаптацию пробирочных растений-регенерантов к почвенным условиям, а также получить более высокий процент безвирусных маточных растений.
Применение термотерапии в сочетании с меристемной культурой позволяет оздоровить от вирусного хлороза более 70 % растений-регенерантов хмеля, 90 % – земляники, 25 % – черной и красной смородины, 50 % – малины, более 80 % – картофеля.
Проверку растений на наличие вирусов, как правило, проводят с помощью иммуноферментного анализа, электронной микроскопии и травянистых растений-индикаторов.
Второй метод освобождения растений от вирусов – хемотерапия – заключается в добавлении в питательную среду, на которой культивируют апикальные меристемы, аналога гуанозина – 1β-Д-рибофуранозил-1,2,4-триазол-3карбоскимида (коммерческое название – вирозол) в концентрации 20-50 мг/л. Это противовирусный препарат широкого спектра действия. При использовании вирозола в культуральной среде процент безвирусных меристемных растений увеличивался до 80-100 %. Положительные результаты хемотерапии были получены для сливы, черешни, малины, некоторых цветочных и других растений.
Термои хемотерапевтические методы оздоровления посадочного материала от вирусов экономически малоэффективны. Поэтому в настоящее время с помощью методов трансгеноза создают формы растений с генетической устойчивостью к вирусам.
3.10. Методы клеточной инженерии растений
в ускорении селекционного процесса
Одно из направлений клеточных технологий – использование их в селекции для облегчения и ускорения традиционного селекционного процесса по созданию новых форм и сортов растений. Существующие методы культивирования изолированных клеток и тканей in vitro условно можно подразделить на две группы.
Первую группу составляют вспомогательные технологии, которые не подменяют обычную селекцию, а служат ей. К ним можно отнести: оплодотворение in vitro (преодоление прогамной несовместимости); культивирование семяпочек и незрелых гибридных зародышей (преодоление постгамной несовместимости); получение гаплоидных растений путем культивирования пыльников и микроспор; клональное микроразмножение отдаленных гибридов.
Вторую группу составляют основные методы, которые ведут к самостоятельному, независимому от традиционных методов селекции получению новых форм и сортов растений на основе соматической гибридизации, слияния изолированных протопластов, клеточной селекции и других методических подходов.
Вспомогательные методы in vitro в селекции растений
Оплодотворение in vitro (преодоление прогамной несовместимости) проводят при невозможности осуществить оплодотворение между выбранными парами растений в естественных условиях. Необходимость применения может быть вызвана как физиологическими (несоответствие во времени созревания пыльцы и т. п.), так и морфологическими (короткая пыльцевая трубка или блокирование ее роста на разных этапах развития и т. п.) причинами.
Оплодотворение in vitro можно осуществить культивированием завязи с нанесенной на нее готовой пыльцой на искусственной агаризованной питательной среде.
Визуально определить, прошло оплодотворение in vitro или нет, можно по быстро увеличивающимся в размерах семяпочкам. Сформировавшийся зародыш, как правило, не переходит в состояние покоя, а сразу прорастает и дает начало гибридному поколению.
Плацентарное оплодотворение in vitro позволило преодолеть несовместимость в скрещивании сортов культурного табака N. tabacum с дикими видами N. rosulata и N. debneyi и сделало возможным получение межвидовых гибридов табака.
Преодоление постгамной несовместимости. Постгамная несовместимость при отдаленной гибридизации возникает после оплодотворения. Часто при этом образуются щуплые невсхожие семена. Причиной может быть расхождение во времени развития зародыша и эндосперма. Из-за слабого развития эндосперма зародыш становится неспособным к нормальному прорастанию. В таких случаях из зерновки изолируют зародыш и выращивают его в питательной среде. Данный способ выращивания называется эмбриокультурой. Питательная среда для выращивания может быть простой, без добавок физиологически активных веществ (например, среда Уайта) или любой другой, содержащей минеральные соли и сахарозу.
При отдаленных скрещиваниях уже на ранних этапах могут наблюдаться нарушения в развитии зародыша, что выражается в отсутствии дифференцировки, замедленном росте. В этом случае рост культур зародыша состоит из двух этапов – эмбрионального роста зародыша, во время которого продолжается его дифференцировка, и прорастания подросшего зародыша. Для первого этапа требуется более сложная по составу питательная среда: с повышенным содержанием сахарозы, с добавками различных аминокислот, витаминов и гормонов.
Применение метода эмбриокультуры в селекции приобретает в последнее время большое значение для получения отдаленных гибридов зерновых, злаковых и других сельскохозяйственных культур. Показана возможность увеличения выхода пшенично-ржаных гибридов путем доращивания незрелых зародышей, а также использования эмбриокультуры для преодоления постгамной несовместимости при гибридизации пшеницы с колосняком.
Метод эмбриокультуры находит все более широкое применение в межвидовой гибридизации овощных растений. Для лука разработаны приемы выращивания in vitro абортивных зародышей из гибридных семян с разных этапов эмбриогенеза, а также приемы выращивания зародышей от частично фертильных межвидовых гибридов. Культуру изолированных зародышей используют в селекции томатов и других овощных растений.
Этот вспомогательный метод применяют не только при отдаленной гибридизации, но и для преодоления постгамной несовместимости, а также с целью микроразмножения ценных гибридов. В этом случае микроразмножение идет путем каллусогенеза, индукции морфогенеза и получения растений-регенерантов из каллусной ткани. Техника клонирования незрелых зародышей позволяет размножать ценные генотипы растений на ранних стадиях жизненного цикла. Еще одна возможность применения культуры зародышей – использование ее в клеточной селекции.
Клональное микроразмножение отдаленных гибридов. Эмбриокультура дает возможность вырастить гибридные растения из неполноценных зародышей. Однако выход гибридных растений мал и гибриды часто бывают стерильны. Иногда, например при селекции гречихи, трудно воспроизвести в потомстве уникальные генотипы из-за перекрестного опыления культуры. Поэтому перед исследователями часто встает задача размножить и сохранить полученные растения. В этом помогает метод клонального микроразмножения. Размножают гибриды путем активации развития меристемы пазушных почек (черенкованием стерильных побегов), адвентивными почками или регенерацией растений из каллусной ткани, в частности полученной при культивировании зародышей.
Получение гаплоидных растений in vitro и использование их в селекции. Роль гаплоидных растений в селекции очень велика. Их применение позволяет быстрее найти нужную комбинацию, сокращает время для создания сорта. Гаплоидные растения используют для получения стабильных гомозиготных линий. Для мутагенеза также удобнее использовать гаплоиды, поскольку на гаплоидном уровне облегчается отбор рецессивных мутаций.
В диплоидных растениях мутации редко затрагивают оба аллельных гена в гомологичных хромосомах. Особь обычно гетерозиготна (два гена различаются), при этом проявляется действие только доминантного (но не рецессивного) гена. Поскольку мутации чаще рецессивны, чем доминантны, их довольно сложно выявить. В гаплоидных же растениях, которые содержат только одну из каждой пары гомологичных хромосом, мутации проявляются немедленно. Селекция на гаплоидном уровне позволяет вести прямой отбор не только доминантных, но и рецессивных признаков.
Гаплоидные особи стерильны, но можно искусственно удвоить набор их хромосом с помощью колхицина и получить диплоидные гомозиготные растения.
Гаплоиды могут возникать спонтанно, но частота их спонтанного возникновения очень мала. Искусственным путем с использованием методов in vitro удается получить большие количества гаплоидных растений.
Существует три способа получения гаплоидов с использованием метода культуры изолированных тканей:
- андрогенез – получение гаплоидных растений на искусственной питательной среде из изолированных пыльников и микроспор;
- гиногенез – получение гаплоидных растений на искусственной питательной среде из изолированных семяпочек;
- партеногенез – получение гаплоидов из гибридного зародыша, у которого из-за несовместимости хромосом родителей потеряны отцовские хромосомы.
Гаплоидные эмбриоиды, образовавшиеся в результате элиминации хромосом отцовского генома, культивируют на искусственных питательных средах и получают гаплоидные растения.
Возможны два пути образования гаплоидных растений в культуре пыльников:
- образование растений путем эмбриогенеза в пыльцевых зернах. При этом внутри пыльников из отдельных пыльцевых зерен возникают эмбриоиды. Они прорастают и дают гаплоидные растения;
- образование каллуса из клеток пыльника. В дальнейшем в результате морфогенеза из каллусных клеток регенерируют растения. В этом случае образовавшиеся растения не всегда бывают гаплоидными и часто отличаются по плоидности. До конца не выяснено, образуются ли они от полиплоидизированных гаплоидных клеток или от слившихся клеток.
Гаплоиды, полученные in vitro, можно применять не только в практической селекции, но и в генетической инженерии, в клеточной селекции. Пыльцевые зерна являются в некоторых случаях более удобными, чем протопласты, объектами для опытов по генетической трансформации.
Основные методы in vitro в селекции растений
Соматическая гибридизация – создание неполовых гибридов путем слияния изолированных протопластов, полученных из соматических клеток. Этот метод позволяет скрещивать филогенетически отдаленные виды растений, которые невозможно скрестить обычным половым путем; вызывать слияние трех и более родительских клеток; получать асимметричные гибриды, несущие весь генный набор одного из родителей, наряду или с несколькими хромосомами или генами, или только с органеллами и цитоплазмой другого родителя. Гибридизация соматических клеток дает возможность не только соединить в одном ядре гены далеких видов растений, но и сочетать в гибридной клетке цитоплазматические гены партнеров.
Выделение, культивирование и слияние изолированных протопластов. Для применения методов соматической гибридизации необходима разработка соответствующих технологий получения протопластов, способных делиться и регенерировать растения.
Для культивирования протопластов применяют те же питательные среды, что и для культуры изолированных клеток и тканей. Отличительной чертой питательных сред для протопластов является повышенное осмотическое давление на начальных этапах культивирования, которое обеспечивается высокой концентрацией маннита или CaCl2. В процессе культивирования изолированные протопласты регенерируют новую клеточную стенку (через 48 ч с момента выделения протопластов) и превращаются в клетки, способные делиться и давать начало образованию каллусной ткани. Протопласты выделяют из каллусных, суспензионных клеток или из клеток листьев, меристем, стеблей. При выделении протопластов из листьев сначала удаляют эпидермис, лист нарезают на сегменты и затем подвергают энзиматической обработке пектиназой и целлюлозой.
Слияние изолированных протопластов может происходить спонтанно, но это случается довольно редко. Индуцированное слияние изолированных протопластов впервые было получено в лаборатории Э. Коккинга в 1970 г. В качестве индуктора служил нитрат натрия. Но этот метод оказался малоэффективным, и сейчас найдены другие фьюзогены (индукторы слияния). Наиболее эффективными из них оказались растворы с высоким рН (9-11) и высокой концентрацией ионов кальция (100-300 мМ). Протопласты предварительно агглютинируют с помощью концентрированных растворов полиэтиленгликоля с молекулярной массой 1500-6000. У. Циммерман с сотрудниками разработали физический метод слияния протопластов животных клеток, липосом, в котором в качестве индуктора использовались импульсы электрического тока.
Слияние протопластов приводит к образованию либо цибрида, либо гибрида. Цибридная клетка содержит цитоплазму обоих партнеров, а ядро – одного. Это возможно, если после слияния протопластов не происходит соединения ядер и одно ядро дегенерирует. Образование цибрида возможно и в том случае, если один из протопластов лишен ядра или оно инактивировано путем облучения. Цибридизация позволяет ввести цитоплазматические гены, несущие признаки ЦМС (цитоплазматической мужской стерильности), устойчивости к некоторым гербицидам и патогенам.
Гибриды были получены при слиянии протопластов эритроцитов крысы и протопластов дрожжевых клеток, протопластов моркови и человека, табака и человека и др.
Первый неполовой межвидовой гибрид высших растений был получен в 1972 г. путем слияния изолированных протопластов двух видов табака: Nicotiana glauca и N. Iangsdorfii.
В настоящее время получено большое число межвидовых, межсемейственных и межтрибных гибридов методом парасексуальной гибридизации. Однако во многих случаях гибридные растения, полученные этим методом, в той или иной степени анормальны. Примером может служить соматический гибрид арабидопсиса и турнепса, который является растением-монстром. Аномалии возникают как результат хромосомной несбалансированности.
Для идентификации гибридов могут быть использованы пластиды (протопласты). Например, при слиянии протопластов табака и моркови в качестве селективных маркеров использовали зеленые хлоропласты табака и красно-оранжевые хромопласты моркови.
Применение изолированных протопластов в селекции растений не ограничивается возможностью их индуцированного слияния и получения соматических гибридов. Изолированные протопласты способны поглощать из окружающей среды макромолекулы и органеллы; следовательно, в них можно вводить чужеродную информацию, не пересаживая ДНК или органеллы других клеток. Уже проведена успешная трансплантация изолированных ядер в протопласты петунии и табака. Вместе с тем поглощение протопластами чужеродных ядер не всегда ведет к образованию гибридов. Кроме ядер, в изолированные протопласты удалось трансплантировать чужеродные хлоропласты и получить растения-регенеранты.
Однако работы по переносу чужеродных органелл и ДНК только начинают развиваться. В целом использование изолированных протопластов в генетической реконструкции клетки открывает новые перспективы перед клеточной селекцией.
Одна из наиболее сильных сторон культуры in vitro – создание технологий для сельского хозяйства на основе следующих методов клеточной селекции:
- прямая (позитивная) селекция, при которой выживает лишь определенный искомый мутантный тип клеток;
- непрямая (негативная) селекция, основанная на избирательной гибели неустойчивых делящихся клеток, но требующая дополнительной идентификации у них мутационных изменений;
- тотальная селекция, при которой индивидуально тестируются все клеточные клоны;
- визуальная селекция и неселективный отбор, когда вариантная линия может быть идентифицирована среди всей популяции клеток визуально или при использовании биохимических методов (тонкослойная или жидкостная хроматография, радиоиммунный анализ, микроспектрофотометрия и др.).
Наиболее распространен метод прямой селекции. Он применяется главным образом для выделения растений-регенерантов, устойчивых, например, к гербицидам, антибиотикам, токсинам, тяжелым металлам, солям и другим антиметаболитам.
Для проведения работ по клеточной селекции растений в условиях in vitro в качестве объекта исследования могут быть использованы каллусные, суспензионные культуры или изолированные протопласты. Выбор объекта зависит от наличия разработанных технологий применительно к различным видам растений, а также от конечных целей исследования.
Каллусная ткань представляет собой легко доступный материал, который наиболее часто используют для клеточной селекции. Как правило, работу проводят на первичной или пересадочной каллусной ткани, которая не утрачивает способности к регенерации на протяжении ряда субкультивирований.
Вместе с тем многие исследователи, работающие с каллус ными культурами, отмечают существенные недостатки данного объекта: медленный рост ткани; неравноценное для всех клеток воздействие токсических веществ, применяемых в качестве селективного фактора; потеря регенерационной способности в процессе культивирования каллусных клеток.
Несомненно, проводить селекцию целесообразно на уровне одиночных клеток (суспензионная культура или протопласты). Однако для многих видов растений не разработаны эффективные технологии и способы культивирования одиночных клеток. Поэтому, несмотря на перечисленные недостатки, с которыми сталкиваются исследователи при использовании каллусных культур, этот способ селекции остается для некоторых видов растений пока единственным.
Получение стабильно устойчивых линий – процесс длительный. Как правило, селекция начинается с получения из изолированных растительных эксплантов достаточного количества каллусной массы, которая в дальнейшем используется для определения такой концентрации селективного фактора (построение дозовой кривой), при которой наблюдается рост каллусной ткани и одновременно погибает часть каллусных колоний. Выбранная концентрация селективного фактора признается оптимальной и используется в дальнейших экспериментах.
Так как первично полученные на средах с селективными факторами колонии клеток могли возникнуть вследствие физиологической адаптации или определенного состояния дифференцировки клеток и могут быть генетически неустойчивыми, то в течение последующих четырех – шести субкультивирований на селективной среде проверяется стабильность устойчивости полученных клонов. Затем их переносят на питательную среду без селективного фактора и субкультивируют еще два-три пассажа. И только после повторного возвращения в селективные условия отбирают стабильные клоны, из которых пытаются получить растения-регенеранты.
Однако работы, проведенные с получением растений, устойчивых к повышенным концентрациям солей, а также к токсинам, выделенным из грибов – возбудителей болезней, показали, что устойчивость клетки и растения к исследуемому селективному фактору может совпадать и не совпадать. Прямая корреляция между устойчивостью растений и клеток in vitro отмечена лишь для низких температур, для устойчивости к гербицидам, к высоким концентрациям алюминия и другим факторам.
Большое число работ по культивированию каллуса с целью получения нового селекционного материала проведено на пшенице, ячмене, рисе, сорго, а также на картофеле, томатах, люцерне. Уже достигнуты первые положительные результаты по получению растений пшеницы, риса, картофеля, устойчивых к NaCl. Получены клетки моркови, а из них – растения, которые, благодаря добавлению в питательную среду токсичных аналогов аминокислот, синтезируют в 20 раз больше метионина, в 30 раз больше – триптофана, в пять раз больше – лизина. Для картофеля получены растения, устойчивые к кольцевой гнили. Что касается древесных растений, то работы в этом направлении крайне редки и часто носят поисковый характер.
Дальнейшее использование каллусной культуры в селекционных целях открывает огромные возможности в создании новых форм растений, несущих ценные для человечества признаки.
Наряду с перечисленными выше объектами (каллусные и суспензионные культуры, изолированные протопласты), в качестве исходного материала для селекции могут быть использованы культуры соматических или андрогенных эмбриоидов, такие органогенные экспланты, как сегменты листьев или различные меристематические и стеблевые части растений, а также культура изолированных зародышей. Например, путем культивирования и селекции in vitro зародышей из семян получены растения ячменя, устойчивые к аналогам аминокислот и с улучшенным содержанием белка. Для картофеля разработан эффективный метод обработки побегов и черенков мутагеном, приводивший к получению химерных мутантов хлорофиллдефектности и антибиотикоустойчивости. При культивировании пыльников яровой пшеницы сортов Саратовская 29 и Московская 35 на питательных средах с повышенным содержанием солей хлорида натрия получены соматические эмбриоиды, а в дальнейшем – растения-регенеранты, проявившие повышенную солеустойчивость.
Таким образом, проведение селекции на клеточном уровне позволяет создавать новые формы растений в два – четыре раза быстрее по сравнению с традиционными способами.

