10.1. Введение
В начале XX в. А. Пуанкаре писал, что в области научных исследований «любое правовое вмешательство будет неуместно и несколько нелепо». Однако последующие события доказали, что самые «нелепые» проекты способны стать реальностью. Поэтому сегодня стоит вопрос о создании свода законов, определяющих безопасность и этику научных исследований.
Во всех государствах в настоящее время приняты законы и другие государственные акты, создающие нормативно-правовую базу для современной биотехнологии и биоинженерии. В большинстве своем они адаптированы к международным требованиям и правилам, зафиксированным в документах ООН, ВОЗ, ЮНЕСКО и других международных организаций.
Приняты такие международные документы, как Всеобщая декларация по геному человека и правам человека, международная Конвенция о биологическом разнообразии, Конвенция по правам человека и биомедицине, Конвенция по защите прав и достоинства человека в связи с использованием достижений биологии и медицины.
Сегодня одним из важнейших является вопрос о генетически модифицированных организмах (ГМО) и использовании продуктов, полученных из них. Эксперты считают, что в связи с их бесконтрольным распространением мировое сообщество может вскоре столкнуться с совершенно новым видом терроризма. Призывы к жесткому контролю ГМпродуктов звучат все чаще.
Различные требования, предъявляемые в разных странах к ГМ-продуктам, и колоссальная разница между посевными площадями, занимаемыми генетически модифицированными растениями в различных регионах (рис. 10.1) свидетельствуют о том, что проблема очень далека от окончательного решения. Мировая динамика роста площадей возделывания трансгенных культур поражает своим размахом: с 1996 по 2003 г. они выросли в 40 раз (с 1,7 до 67,7 млн гектаров). Лидерами являются США, Аргентина, Канада. Мировые продажи трансгенных растений (в основном сои, хлопка, кукурузы, рапса) увеличились с 75 млн долларов в 1995 г. до примерно 8 млрд долларов в 2005 г. (табл. 5).
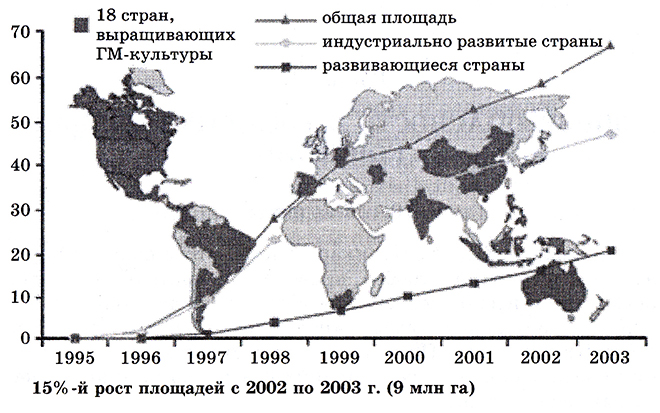
Рис. 10.1. Карта мира с общими площадями под трапсгснными культурами, млн га
Таблица 5. Посевные площади в некоторых странах мира, занятые трансгенными культурами в 2006 г., млн га

В 2004 г. в Аргентине было произведено 34,5 млн тонн генетически модифицированной сои, т. е. 49,5 % всех выращенных здесь зерновых, а под ее посевами было занято 14 млн га, т. е. 54 % всех посевных площадей страны. Таким образом, генетически модифицированная соя стала основной сельскохозяйственной культурой Аргентины. При этом если в США только 40 % выращиваемой сои является трансгенной, то в Аргентине этот показатель равен 99 %.
По данным российского Федерального реестра пищевой продукции, на 26 февраля 2001 г. в нашей стране был зарегистрирован и допущен к использованию на внутреннем рынке 81 вид трансгенного пищевого сырья. Практически все из них являются производными сои. В 2004 г. службами Госсанэпиднадзора Российской Федерации были обнаружены трансгенные соевые добавки в 17,7 % исследованных мясных продуктов и в 16,7 % хлебобулочных и крупяных изделий.
Хлынувший в Россию поток продуктов, содержащих трансгенные компоненты, в условиях неоднозначности результатов исследований в области их медицинской и экологической безопасности ставит ряд задач. Во-первых, необходимы анализ и оценка мотивов разработки, производства и использования генетически модифицированных продуктов питания. Во-вторых, не проработана российская правовая база, регламентирующая использование таких продуктов.
10.2. Международная законодательная база
по биобезопасности и ее реализация
Международное сообщество приняло ряд документов, определяющих правила безопасности при работе с генетически измененными организмами. Это Картахенский протокол по биобезопасности к Конвенции о биологическом разнообразии (регулирует перемещение ГМО), Декларация Рио (определяет, что доказательства безвредности ГМ-продуктов лежат на производителе продукции), документы Кодекса Алиментариус и Комиссии ООН по пищевым стандартам (определяют стандарты для ГМ-продуктов), а также Директивы Европейского Парламента и Совета (определяют методы оценки угрозы, правила мониторинга, а также условия, при которых выдаются разрешения на выпуск ГМО). Разработка и принятие этих документов сопровождаются ожесточенной борьбой между производителями ГМ-продуктов и экологами.
Международная Конвенция о биологическом разнообразии, подписанная 13 июня 1992 г. в Рио-де-Жанейро, указывает на недопустимость как запрещения, так и полного отказа от регулирования производства и использования генетически модифицированных организмов. В Конвенции (ст. 19, п. 3) отмечается необходимость применения мер предосторожности при использовании живых измененных организмов, однако сами меры не конкретизируются. Таким образом, в этом международном документе предусмотрена, хотя и в «свернутой» форме, правовая защита двух сторон – как производителей, так и потребителей ГМ-продуктов.
Различные страны при этом по-разному воплощают в свое законодательство положения о мерах предосторожности и формах контроля за ГМ-продуктами. В США, например, нет особых законов, определяющих критерии безопасности трансгенных продуктов. Для всех продуктов питания они являются общими («Закон о пищевых продуктах и косметических препаратах»).
Одним из наиболее жестких законодательств в области ГМ-продуктов является законодательство Евросоюза. Так, Директива Европейского Парламента и Совета от 23.04.1990 № 220/90 по выпуску в природу генетически модифицированных организмов (ГМО) требует разрешения Государственного секретаря ЕС по вопросам окружающей среды, транспорта и регионов на любое высвобождение в окружающую среду ГМО – от одного растения в горшке до крупномасштабного промышленного производства. Процедура обращения за разрешением включает в себя:
- оценку возможного риска окружающей среде;
- описание природы измененного организма;
- описание происхождения и типов переносимых генных последовательностей;
- описание методики переноса.
То есть этим документом предусмотрена защита двух групп интересов – как производителей, так и потребителей (оценка экологического риска).
Директива Европейского Парламента и Совета от 27.01.1997 № 258/97 дополняется подробной регламентацией оценки медико-биологической безопасности ГМО (модели потребления, исследование пищевой ценности, аллергические и токсикологические исследования, способность изменять микробиоценоз кишечника человека) и критериев их технологической оценки (параметры производства, оценка физических, химических и органолептических свойств).
Исследовательская группа Кодекс Алиментариус, первое заседание которой прошло в 2000 г., отметила необходимость дополнительной оценки медико-биологической безопасности ГМ-продуктов с учетом метаболических особенностей различных потребительских групп (дети, беременные, кормящие матери, пожилые люди, пациенты, страдающие сахарным диабетом), а также необходимость долговременных « хронических исследований ».
Директива Европейского Парламента и Совета от 12.03.2001 № 18/2001 расширила критерии оценки экологической безопасности ГМ-растений прежде всего для защиты потребителей, включив в число критериев оценку влияния на естественных обитателей сельскохозяйственных земель; оценку возможных воздействий на фермеров и рабочих, занятых в сельском хозяйстве; оценку влияния на биогеохимические процессы и др.
Наконец, Директива Европейского Парламента и Совета от 22.09.2003 № 1829/2003 о генетически модифицированных продуктах и кормах ввела с апреля 2004 г. новые правила маркировки ГМ-продуктов в странах Евросоюза. Маркировке подлежит вся пищевая продукция, полученная с использованием ГМ-продуктов при их содержании более 0,9 %.
Всемирная торговая организация (ВТО) 7 февраля 2006 г. заявила, что Евросоюз, в нарушение торговых норм, наложил мораторий на использование ГМ-растений и ГМ-продуктов. BTO также постановила, что шесть отдельных стран, среди которых Франция и Австрия, нарушили правила, введя свои собственные запреты на торговлю и импорт ГМ-продуктов. Жалобу в BTO на Евросоюз подали США, Канада и Аргентина.
10.3. Законодательная база России
по биобезопасности и ее реализация
В Российской Федерации действует около полутора десятков документов, имеющих отношение к ГМ-продуктам.
После принятия международной Конвенции о биологическом разнообразии, ратифицированной РФ в 1995 г. (Федеральный закон от 17.02. 1995 № 16-ФЗ «О ратификации Конвенции о биологическом разнообразии»), в России принимаются Федеральные законы от 05.07.1996 № 86-ФЗ «О государственном регулировании в области генно-инженерной деятельности» и от 12.07.2000 № 96-ФЗ «О внесении изменений и дополнений в Федеральный закон «О Государственном регулировании в области генно-инженерной деятельности"». Статья 5 этого закона гласит: Основными направлениями государственного регулирования в области генно-инженерной деятельности в России являются:
- улучшение условий жизни человека и охрана здоровья; охрана и восстановление окружающей среды, сохранение биологического разнообразия;
- повышение эффективности сельского хозяйства» и др. При этом указывается: «Генно-инженерная деятельность должна основываться на следующих принципах:
- безопасности граждан (физических лиц) и окружающей среды;
- <...>
- общедоступности сведений о безопасности генно-инженерной деятельности;
- сертификации продукции, содержащей результаты генно-инженерной деятельности, с указанием полной информации о методах получения и свойствах данного продукта».
Таким образом, законы регулируют отношения в сфере природопользования, охраны окружающей среды и обеспечения экологической безопасности, возникающей при осуществлении генно-инженерной деятельности с биологическими объектами, за исключением человека, его клеток и тканей, что регулируется специальным законодательством.
По этим законам государство обязано устанавливать основные направления деятельности федеральных органов государственной власти, органов государственной власти субъектов Российской Федерации, органов местного самоуправления, юридических лиц и граждан (физических лиц) в области генно-инженерной деятельности; устанавливать основные положения правового регулирования отношений, возникающих в области генно-инженерной деятельности; определять механизмы, обеспечивающие безопасность граждан и окружающей среды в процессе осуществления генно-инженерной деятельности и использования ее результатов; устанавливать правовые основы международного сотрудничества Российской Федерации в области генно-инженерной деятельности; создавать условия для развития приоритетных направлений в этой области.
Для реализации указанных задач закон предусматривает принятие федеральных и региональных программ в области развития генно-инженерной деятельности.
В этой связи Правительство РФ принимает Постановление от 22.04.1997 № 464 «О межведомственной комиссии по проблемам генно-инженерной деятельности». Комиссия разработала Временные правила безопасного получения, использования и передачи генетически модифицированных (трансгенных) растений и их фрагментов, содержащих рекомбинантную ДНК. Полный цикл предполагает испытание биологической безопасности, экологическую экспертизу, широкомасштабный выпуск. Постановлением Правительства РФ от 16.02.2001 № 120 «О государственной регистрации генно-инженерно-модифицированных организмов» утверждено Положение о государственной регистрации генно-инженерно-модифицированных организмов. Установлено, что генно-инженерно-модифицированные организмы, предназначенные для первого на территории Российской Федерации выпуска в окружающую среду, промышленного использования или импорта, подлежат обязательной государственной регистрации. Регистрация таких организмов и ведение сводного государственного реестра зарегистрированных генно-ииженерно-модифицированных организмов возложены на Министерство промышленности, науки и технологий РФ.
Биобезопасность, применительно к указанному Положению, означает отсутствие фактического или прогнозируемого нежелательного воздействия модифицированного организма (в сравнении с исходными ^модифицированными организмами) на окружающую среду.
Положением утвержден также срок действия свидетельства о государственной регистрации модифицированного организма – до пяти лет с момента включения его в реестр. Срок действия свидетельства может быть продлен – по заявлению его владельца – на следующие пять лет. При появлении в период срока действия свидетельства о государственной регистрации модифицированного организма новых научно обоснованных данных о биобезопасности модифицированного организма (в сравнении с исходным немодифицированным организмом) Министерство промышленности, науки и технологий РФ может – по представлению экспертного совета – принять решение о его перерегистрации без проведения экспертизы. В случае выявления негативного воздействия модифицированного организма на окружающую среду, подтвержденного экспертизой, проведенной в соответствии с указанным выше Положением, по инициативе федеральных органов исполнительной власти, органов местного самоуправления, заинтересованных организаций и граждан государственная регистрация модифицированного организма может быть аннулирована.
В соответствии с законодательством РФ (Федеральные законы от 30.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» и от 02.01.2000 № 29-ФЗ «О качестве и безопасности пищевых продуктов») пищевая продукция из ГМО относится к категории «новой пищи» и подлежит обязательной оценке на безопасность и последующему мониторингу за ее оборотом.
В 1999 г. принято постановление Главного государственного санитарного врача РФ от 26.09.1999 № 12 «О совершенствовании системы контроля за реализацией сельскохозяйственной продукции и медицинских препаратов, полученных на основе генетически модифицированных источников». Этим постановлением запрещено с 1 июля 2000 г. реализовать населению пищевую продукцию и медицинские препараты, полученные из ГМО, без соответствующей маркировки. Указанное постановление рассматривается как подзаконный акт Федеральных законов «О санитарно-эпидемиологическом благополучии населения» и «О защите прав потребителей», но федеральный закон, регулирующий производство и использование ГМИП, до настоящего времени не принят.
В 2000 г. постановлением Главного государственного санитарного врача РФ от 08.11.2000 № 14 введены Положение о порядке проведения санитарно-эпидемиологической экспертизы пищевых продуктов, полученных из генетически модифицированных источников, а также Методические указания «Медико-биологическая оценка пищевых продуктов, полученных из генетически модифицированных источников». В соответствии с этими документами экспертиза осуществляется по трем направлениям: медико-генетическая оценка (Центр «Биоинженерия» РАН), медико-биологическая оценка (ГУ НИИ питания РАМН) и оценка технологических параметров продукта (МГУ прикладной биотехнологии Минобразования России). Результаты проведенной экспертизы представляются в Минздрав России, который выдает разрешение на использование ГМИ в пищевой промышленности и реализацию населению или мотивированный отказ.
В соответствии с Постановлением Правительства РФ от 16.02.2001 № 120 «О государственной регистрации генно-инженерно-модифицированных организмов» Министерство промышленности, науки и технологий РФ своим приказом от 10.07.2001 № 264 создало Экспертный совет Минпромнауки России по вопросам биобезопасности и утвердило Положение о нем. Совет является постоянно действующим органом, обеспечивающим объективность и надлежащий уровень проверки предоставляемых заявителями сведений о биобезопасности генно-инженерно-модифицированных организмов.
Значительным шагом вперед в области оценки биобезопасности ГМО и полученных из них продуктов в России стало создание в 2002 г. совместным решением РАН и Госстандарта РФ Технического комитета «Биологическая безопасность пищевых продуктов, кормов и товаров народного потребления и методы ее контроля» Госстандарта России (Приказ Госстандарта России от 01.08.2002 № 175) на базе Института физиологии растений им. К.А. Тимирязева РАН.
Указанным Техническим комитетом была инициирована и успешно осуществлена разработка (силами ученых Института физиологии растений им. К.А. Тимирязева РАН и Института молекулярной биологии им. В.А. Энгельгардта РАН) принципиально нового метода идентификации ГМИ в сырье и продуктах питания для оценки их биобезопасности. Метод основан на новейшей технологии микрочипов. На основе этого метода был разработан ГОСТ P 52174– 2003 «Биологическая безопасность. Сырье и продукты пищевые. Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения с применением биологического микрочипа», который в 2003 г. принят Госстандартом России в качестве национального стандарта.
В дополнение к этому постановлением Главного государственного санитарного врача РФ от 16.09.2003 № 149 введена санитарно-эпидемиологическая, микробиологическая и молекулярно-генетическая экспертиза генетически модифицированных микроорганизмов, используемых в производстве пищевых продуктов. Разработаны и утверждены соответствующие методические указания.
Полный цикл всех необходимых исследований в настоящее время прошли 14 видов продовольственного сырья, продукты переработки которого разрешены для использования в пищевой промышленности и реализации населению без ограничений:
- 3 линии сои, устойчивые к пестицидам (40-3-2, устойчивая к глифосату; А 2704-12 и А5547-127, устойчивые к глюфосинату аммония);
- 3 линии кукурузы, устойчивые к пестицидам (GA 21 и NK 603, устойчивые к глифосату, и Т-25, устойчивая к глюфосинату аммония);
- 3 линии кукурузы, устойчивые к вредителям (MON 810 и Bt-I, устойчивые к стеблевому мотыльку, и MON 863, устойчивая к жуку диабротика);
- 3 сорта картофеля, устойчивые к колорадскому жуку (Рассеет, Бурбанк Ньюлив и Супериор Ньюлив);
- 1 линия сахарной свеклы, устойчивая к глифосату;
- 1 линия риса, устойчивая к глюфосинату аммония;
- 5 видов генетически модифицированных микроорганизмов.
В этой связи уместно остановиться на проблеме маркировки продуктов, содержащих ГМИ. В мире существуют различные подходы к маркировке пищевых продуктов. Так, в США, Канаде и Аргентине такие продукты не маркируются каким-либо особым образом; в Японии и Австралии принят 5%-й уровень содержания ГМИ в продуктах, обязательный для маркировки, в странах Евросоюза – 0,9 %-й.
Система маркировки пищевой продукции из ГМИ существует в России с 1999 г. Однако она носила рекомендательный характер. В соответствии с санитарно-эпидемиологическими правилами и нормами СанПиН 2.3.2.1078-01
«Гигиенические требования безопасности и пищевой ценности пищевых продуктов», с 1 сентября 2002 г. была введена обязательная маркировка пищевых продуктов, полученных с применением ГМО. Маркировке подлежала вся пищевая продукция, содержащая в своем составе более 5 % трансгенных компонентов.
В 2004 г. санитарно-эпидемиологическими правилами и нормами СанПиН 2.3.2.1842-04 введены Дополнения и изменения № 3 к СанПиН 2.3.2.1078-01, которые, вслед за принятием Директивы Европейского Парламента и Совета от 22.09.2003 № 1829/2003, снижают в России пороговый уровень маркировки пищевых продуктов, содержащих ГМИ, с 5 % до 0,9 %.
Минздрав России считает целесообразным ввести в Российской Федерации обязательную маркировку всей пищевой продукции, содержащей более 0,9 % компонентов из ГМИ, а пищевую продукцию, содержащую 0,9 % и менее компонентов из ГМИ, считать генетически ^модифицированной и не подлежащей маркировке.
Пищевые продукты, полученные из ГМО, прошедшие медико-биологическую оценку и не отличающиеся по изученным свойствам от своих аналогов, полученных традиционными методами, являются безопасными для здоровья человека, разрешены для реализации населению и использования в пищевой промышленности без ограничений.
В соответствии с рекомендациями международных организаций и с законодательством РФ, в нашей стране пищевая продукция из ГМИ подлежит обязательной оценке на безопасность. Однако необходимо дальнейшее проведение обязательного широкомасштабного и длительного исследования безопасности ГМО, а также и экологических последствий использования ГМ-продуктов.
Несмотря на распоряжения Госсанэпиднадзора, как показали проверки в супермаркетах и магазинах, маркируется только ничтожная часть ГМ-продуктов. При этом уровень ГМИ в них превышает не только 0,9 % (установленную норму), но даже 50 % и выше. Даже если товар маркирован, не каждый рядовой потребитель знает, что значок «ARDEX F» означает присутствие изолята (концентрата) соевого белка. Россияне лишены еще одной подсказки на наличие ГМ-продуктов: во всем мире продукты из ГМ-сырья дешевле натуральных, а в России они продаются по цене натуральных.
В 2006 г. вышло Письмо Главного государственного санитарного врача Российской Федерации от 03.04.2006 № 0100/3572-06-32 «О совершенствовании надзора за пищевыми продуктами, содержащими ГМО», в котором отмечено, что в России «имеется необходимая нормативнометодическая база, включая методы лабораторных исследований, необходимые для организации и проведения эффективного надзора за пищевыми продуктами, содержащими компоненты, полученные с применением ГМО».
Особенно часто в 2005 г. ГМИ встречались в мясных продуктах – 15,8 % (2004 г. – 20,5 %; 2003 г. – 14,8 %), в группе продуктов «прочие» (в основном растительные белки) – 10,8 % (2004 г. – 16,7 %; 2003 г. – 16,4 %), в птицеводческих продуктах – 9,1 % (2004 г. – 15,4 %; 2003 г. – 29,5 %).
В 2005 г. наибольший удельный вес пищевых продуктов, содержащих компоненты ГМИ, приходился на Северо-Западный (11,7 %), Уральский (11,2 %), Приволжский (8,4 %), Центральный (8,2 %) и Сибирский (8 %) федеральные округа.
Наибольшее количество исследований пищевых продуктов на наличие ГМИ в 2005 г. проведено в Центральном (5506), Приволжском (3579), Южном (2952) и Сибирском (2925) федеральных округах, наименьшее – в Уральском федеральном округе (631). Вместе с тем в территориальных управлениях Роспотребнадзора по республикам Ингушетия и Саха (Якутия), Ненецкому, Ханты-Мансийскому, Таймырскому, Эвенкийскому, Усть-Ордынскому, Чукотскому, Корякскому автономным округам по-прежнему не проводится исследование пищевых продуктов на наличие ГМИ.
Одной из основных задач в области предупреждения и ликвидации последствий чрезвычайных ситуаций в результате воздействия биологических факторов является обеспечение безопасности продуктов питания, производимых из генетически модифицированных источников, а также безопасности экологической системы от проникновения чужеродных биологических видов организмов; прогнозирование генетических аспектов биологической безопасности и создание системы государственного контроля за оборотом генетически модифицированных материалов.

