Спектр продуктов, получаемых методами биотехнологии, необычайно широк и разнообразен. Целевыми продуктами биотехнологических производств могут быть интактные клетки. Одноклеточные организмы используют для получения биомассы, являющейся источником кормового белка. Клетки, особенно в иммобилизованном состоянии, выступают в роли биологических катализаторов для процессов биотрансформации.
Процессами биотрансформации называют реакции превращения исходных органических соединений (предшественников) в целевой продукт с помощью клеток живых организмов или ферментов, выделенных из них. В последние годы высокая специфичность процессов биотрансформации и эффективность иммобилизованных ферментов нашли широкое применение для крупномасштабного производства аминокислот, антибиотиков, стероидов и других промышленно важных продуктов.
Продуктами биотехнологических производств являются природные макромолекулы – белки, ферменты, полисахариды, полиэфиры (поли-β-гидроксибутират), выделенные из клеток микроорганизмов, тканей и органов растений и животных.
По отношению к процессу роста низкомолекулярные продукты метаболизма живых клеток делятся на первичные и вторичные метаболиты (рис. 3.1). Первичные метаболиты необходимы для роста клеток. К ним относятся структурные единицы биополимеров – аминокислоты, нуклеотиды, моносахариды, а также витамины, коферменты, органические кислоты и другие соединения. Вторичные метаболиты (антибиотики, пигменты, токсины) – низкомолекулярные соединения, не требующиеся для выживания клеток и образующиеся по завершении фазы их роста.
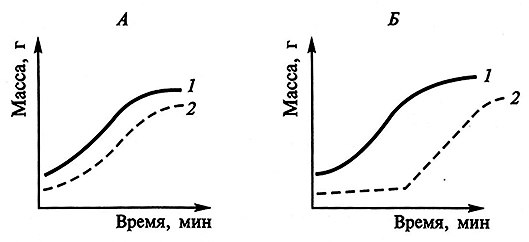
Рис. 3.1. Динамика изменения биомассы и образования первичных (А)
и вторичных (В) метаболитов в процессе роста организма: 1 – биомасса; 2 – продукт
3.1. МЕХАНИЗМЫ ИНТЕНСИФИКАЦИИ
ПРОЦЕССОВ ПОЛУЧЕНИЯ ПРОДУКТОВ
КЛЕТОЧНОГО МЕТАБОЛИЗМА
Центральное звено биотехнологического процесса – живая клетка, в которой одномоментно синтезируется великое множество разнообразных соединений. В норме обмен веществ в клетке осуществляется по принципам строжайшей экономии, что обеспечивается сложнейшей системой регуляции обмена веществ. Задача биотехнолога состоит в обеспечении сверхсинтеза одного из продуктов метаболизма, что достигается как путем изменения генетической программы организма, так и посредством нарушения регуляторных систем метаболизма в нем.
Спонтанные изменения генетической природы организма – продуцента – основаны на процессах рекомбинации генетического материала in vivo. Для выделения из природных популяций высокопродуктивных штаммов микроорганизмов используют методы селекции, т.е. направленного отбора организмов со скачкообразным изменением геномов. Методы слепого многоступенчатого отбора случайных мутаций чрезвычайно длительны и могут занимать целые годы. Для возникновения мутаций интересующий ген должен удвоиться 106–108 раз. Более эффективен метод искусственного повреждения генома. Таким методом является индуцированный мутагенез, основанный на использовании мутагенного действия ряда химических соединений (гидроксиламин, нитрозамины, азотистая кислота, бромурацил, 2-аминопурин, алкилирующие агенты и др.), рентгеновских и ультрафиолетовых лучей. Мутагены вызывают замены и делеции оснований в составе ДНК, а также индуцируют мутации, приводящие к сдвигу рамки считывания информации.
Методы классической селекции и рекомбинации, называемые в настоящее время эволюционной инженерией (G. N. Stefanopoulos et al., 1998), несмотря на их трудоемкость, не потеряли своего значения для создания высокоэффективных штаммов микроорганизмов – продуцентов. Они оказались перспективными для получения практически всех современных штаммов-продуцентов антибиотиков и аминокислот и для оценки влияния на объекты различных факторов среды – ионов тяжелых металлов, кислот, щелочей и др. В 1983 г. С. Браун и С. Оливер использовали методы селекции для отбора мутантных штаммов дрожжей, устойчивых к высоким концентрациям конечного продукта (10 %-го этанола), при культивировании их в непрерывном режиме (650 ч). Многолетняя селекция штаммов-продуцентов пенициллина позволила увеличить удельную активность антибиотика в культуральной среде в 400 раз, а штаммов бактерий, синтезирующих кобаламин, – в 10 раз. Методами мутагенеза и селекции получены штаммы Eremothecium ashbyii, способные выделять до 1,8 мг рибофлавина в 1 мл среды, и штаммы Brevibacterium ammoniegenes, продуцирующие до 1 г HSKoA на 1 л среды. Большой вклад в развитие метода эволюционной инженерии внесли отечественные селекционеры, особенно ученые школы С. И. Алиханяна.
Достижения в области молекулярной биологии и молекулярной генетики позволили биотехнологам начиная с 70-х годов XX в. перейти от слепого отбора штаммов мутантов к сознательному конструированию геномов, используя для этой цели прогрессивную методологию генетической инженерии, которая позволяет выделить любой ген и интегрировать его в заданное положение бактериальной хромосомы через системы рекомбинации.
Большие возможности в отношении отбора нужных генов предоставляет обширная база секвенированных геномов, в которой на сегодняшний день находится более 200 полных нуклеотидных последовательностей микроорганизмов. Практически неисчерпаемым источником генов являются некультивируемые микроорганизмы, составляющие до 99% фонда микроорганизмов окружающей среды. В настоящее время разработаны методы получения препаратов ДНК микроорганизмов без их культивирования из разных объектов окружающей среды (почвы, пресной и соленой воды и др.). Такая ДНК, представляющая собой суммарный геном всех микроорганизмов данной экологической ниши, называется метагеномом (metagenome).
Обширными исследованиями, выполненными группой Дж. Вентера (J. С. Venter), была установлена последовательность нуклеотидов ДНК метагенома бактерий Саргассова моря. Выявлено 1800 геномных видов, в том числе 148 до настоящего времени не известных филотипов бактерий. В итоге база данных Swiss Pot пополнилась 1 214 207 белковыми последовательностями микроорганизмов, т.е. увеличилась почти в 10 раз.
Для поиска мутаций, определяющих фенотип микроорганизмов, наряду с методами, базирующимися на создании библиотеки генов ДНК мутанта, в настоящее время применяются методы использования ДНК-микрочипов и тотального секвенирования генов этого микроорганизма. Успехи селекции в значительной мере определяются уровнем автоматизации техники выявления биологической активности колоний. По сообщению вице-президента фирмы «Novozyme» (Дания), сотрудники компании способны тестировать сегодня до 10 000 энзимов в день против 1–2 ферментов в 1990 г. Однако интерпретация данных функционального скрининга, особенно метагенных библиотек, вызывает большие затруднения и нуждается в дальнейшем совершенствовании.
Фенотип клетки определяется динамическими процессами взаимодействия многих молекул. Каждое из множества разнообразных веществ создается в клетке в строго необходимых для роста пропорциях в результате ферментативных реакций. Координация химических превращений, обеспечивающая экономность метаболизма, осуществляется у микроорганизмов тремя основными механизмами: регуляцией активности ферментов, в том числе путем ретроингибирования; регуляцией объема синтеза ферментов (индукция и репрессия биосинтеза ферментов); катаболитной репрессией.
В процессе ретроингибирования (ингибирование по принципу обратной связи) активность фермента, стоящего в начале многоступенчатого превращения субстрата, тормозится конечным метаболитом, что детально разработано при изучении регуляции биосинтеза пиримидиновых нуклеотидов и новообразования ряда аминокислот:
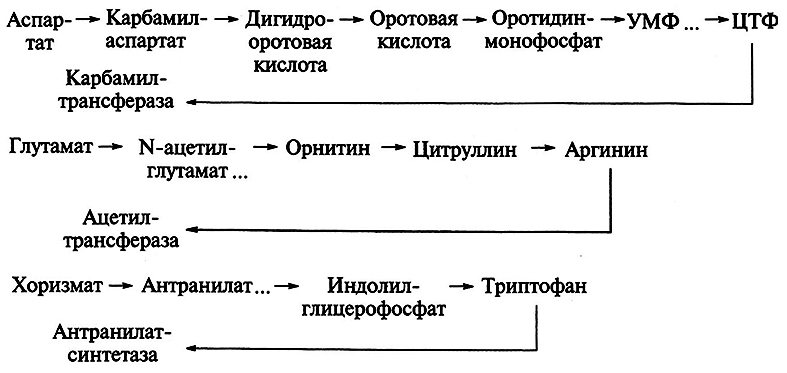
Таким способом низкомолекулярные метаболиты передают информацию об уровне своей концентрации и состоянии обмена веществ ключевым ферментам метаболизма. Ключевые ферменты – это регуляторы периодичности в процессе функционирования энзима и соответственно образования продукта. Эти ферменты представлены в клетке аллостерическими белками, а конечные метаболиты – аллостерическими эффекторами (активаторами и ингибиторами) ключевых энзимов. С помощью описанного механизма конечные продукты саморегулируют свой биосинтез. Ретроингибирование – способ точного и быстрого регулирования образования продукта.
На обмен веществ эффект, аналогичный конечным метаболитам, оказывают их аналоги (табл. 3.1). Указанное обстоятельство используется для селекции организмов с нарушением механизма обратной связи. Обход механизма ретроингибирования делает объект биотехнологического процесса нечувствительным к концентрации конечного продукта.
Таблица 3.1. Аналоги конечных метаболитов

Для отбора объектов продуценты выращивают на селективной среде , содержащей подходящий аналог или антиметаболит, которые не включаются в обмен веществ (в частности, аналоги аминокислот не включаются в состав белков), что ведет к подавлению роста организма. Выжившие мутанты обладают дефектами в механизме регуляции активности фермента по принципу обратной связи и поэтому служат важными объектами в обеспечении сверхсинтеза целевого продукта.
Среди тысяч энзимов, присущих микроорганизмам, одни, например ферменты гликолиза, синтезируются постоянно, и их образование не зависит от состава питательной среды. Такие ферменты называют конститутивными. Другие энзимы, адаптивные или индуцибелъные, возникают только в ответ на появление в питательной среде индукторов – субстратов или их структурных аналогов. Так, добавление β-галактозида – лактозы к питательной среде, на которой культивируются клетки кишечной палочки Е. coll, вызывает мгновенное появление β-галактозидазы в них, биосинтез которой в последующий период времени возрастает в 10 000 раз. Установлено, что регуляция объема биосинтеза ферментов осуществляется на оперонном уровне (Ф. Жакоб и Ж. Моно, 1961) путем изменения количества иРНК, образующихся в процессе транскрипции.
Упорядоченная совокупность координированно экспрессирующихся генов, контролирующих родственные биохимическиефункции, называется опероном. Координация экспрессии структурных генов в оперонах достигается одновременным включением или выключением транскрипции этих генов. Они транскрибируются с одного промотора (место присоединения РНК-полимеразы), находящегося на 5'-конце такой группы генов, в виде единственной молекулы полицистронной мРНК. На ней одновременно синтезируются все белки. К промотору примыкает регуляторный участок – оператор, к которому присоединяются белки-репрессоры и другие регуляторы транскрипции, что ведет к прекращению экспрессии всех генов. В процессе индукции низкомолекулярный метаболит-индуктор (например, лактоза), соединяясь с репрессорным белком (продукт гена-регулятора), инактивирует его и тем самым препятствует взаимодействию белка-репрессора с зоной оператора, что обеспечивает возможность присоединения к промотору РНК-полимеразы и начало синтеза иРНК.
Изучение механизма регуляции новообразования аминокислот у микроорганизмов показало, что конечные продукты метаболических путей не только ингибируют активность ферментов первых стадий процесса, но и тормозят биосинтез ферментов последних его этапов. Таким образом у микроорганизмов помимо аминокислот регулируется новообразование многих первичных метаболитов (пуриновых и пиримидиновых нуклеотидов, витаминов и других соединений). Обнаруженный феномен был назван репрессией, а ферменты, биосинтез которых стопорится под влиянием низкомолекулярных метаболитов, переводящих репрессорный белок в активную форму, способную оккупировать зону первоначального связывания РНК-полимеразы (промотор), называются репрессибельными. К их числу относятся глутаминсинтетаза, триптофансинтетаза, орнитинкарбамилтрансфераза, уреаза и ряд других энзимов. Специально поставленные опыты продемонстрировали, что репрессия биосинтеза ферментов обеспечивает более грубую в сравнении с ретроингибированием регуляцию образования анаболических энзимов.
Если концентрация конечного продукта уменьшается до определенного очень низкого уровня, то происходит дерепрессия фермента, т.е. скорость их биосинтеза возрастает до необходимых величин.
Бактериальные клетки продуцируют множество низкомолекулярных эффекторов в ответ на изменение окружающей среды (стресс, голодание, действие фагов и пр.). Каждый из эффекторов, взаимодействуя по аллостерическому механизму с определенными регуляторными белками, моделирует промоторную специфичность РНК-полимеразы, запуская тем самым экспрессию определенного набора генов.
Таким образом, ведущими механизмами, обеспечивающими экономность образования продуктов в клетках микроорганизмов, являются ретроингибирование и репрессия, базирующиеся на принципе обратной связи.
Если в питательной среде присутствуют несколько различных источников углерода, клетка микроорганизма вырабатывает ферменты для усвоения лишь одного, наиболее предпочтительного субстрата. Так, когда клетки выращивают на смеси глюкозы и лактозы, утилизируется в первую очередь глюкоза. После полного исчерпания глюкозы происходит экспрессия ферментов метаболизмалактозы (экспрессия структурных генов лактозного оперона). Это явление получило название катаболитной репрессии, так как ранее полагали, что причина его состоит в подавлении биосинтеза ферментов обмена лактозы продуктами катаболизма глюкозы.
Следовательно, сущность катаболитной репрессии заключается в подавлении биосинтеза ферментов, обеспечивающих метаболизм одного источника углерода другим источником углерода.
Лактозный оперон (lac-оперон) включает структурные гены трех ферментов: X, Y и А (отвечают за взаимозависимый синтез β-галактозидазы, галактозилпермеазы и ацетилтрансферазы), контролирующих метаболизм лактозы в клетке (рис. 3.2). Экспрессия ферментов регулируется белком-репрессором – продуктом гена-регулятора (R), пространственно удаленного от гена-оператора (О). Субъединицы репрессора (38кДа х 4) возникают с постоянной скоростью. Репрессор обладает высоким сродством к соответствующему оператору (К ≈ 10-12 моль/л). Именно белок-репрессор, будучи присоединен к гену-оператору, препятствует транскрипции структурных генов X, Y и А.
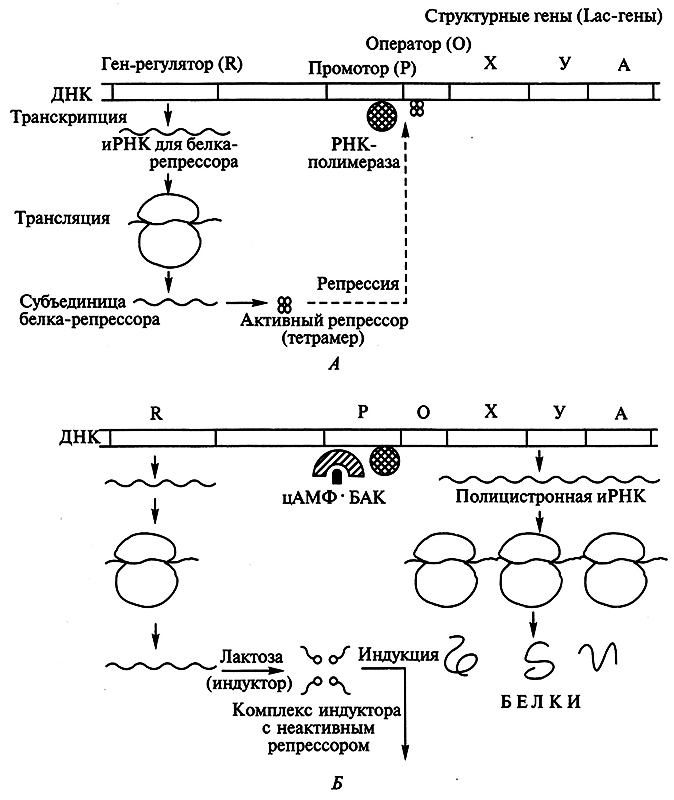
Рис. 3.2. Структура и механизм индукции и репрессии 1ас-оперона (пояснения см. в тексте):
А – в отсутствие индуктора; Б – в присутствии индуктора и при дефиците глюкозы
Установлено, что катаболитная репрессия опосредуется действием специального белка-активатора катаболитных генов (БАК). Об отсутствии глюкозы в среде сигнализирует цАМФ. Лишь при дефиците глюкозы формируется комплекс цАМФ и БАК, абсолютно необходимый для связывания РНК-полимеразы с зоной промотора и начала транскрипции генов. В присутствии глюкозы концентрация цАМФ недостаточна для образования комплекса. Уровень цАМФ в клетке является функцией активности аденилатциклазы, синтез которой подавляется в присутствии глюкозы:
![]()
3.2. МЕТОДОЛОГИЯ СЕЛЕКЦИИ МУТАНТОВ
С ДЕФЕКТАМИ ЭКСПРЕССИИ ГЕНОВ
И РЕГУЛЯЦИИ ОБМЕНА ВЕЩЕСТВ
Уровень экспрессии структурных генов в той или иной степени может быть изменен в результате мутаций, осуществляемых по различным участкам оперона. Целенаправленная селекция перспективных мутантов для создания высокопродуктивных организмов – важнейшая задача биотехнологии, ибо лишь дефекты регуляции обмена веществ обеспечивают синтез целевых продуктов метаболизма.
Так, мутации по участкам цистрона, детерминирующим структуру аллостерического центра фермента, могут привести к изменениям в конформации белка, которые делают молекулу энзима нечувствительной к концентрации конечного продукта. Это обеспечивает возможность образования в клетке избыточного количества целевого продукта.
Мутации в гене-регуляторе проводят таким образом, чтобы его продукт – белок-репрессор – утрачивал способность связываться либо с индуктором, либо с оператором. В результате мутаций исчезает эффект катаболитной экспрессии, а индуцибельные ферменты становятся конститутивными, т. е. их экспрессия не зависит от присутствия в среде субстрата. Мутантные организмы, у которых изменены нуклеотидные последовательности в зоне гена-оператора, не могут связывать нормальный репрессор и также приобретают способность к конститутивной экспрессии структурных генов.
Мутанты с дефектами регуляторной области оперона называются регуляторными, их функция – биосинтез конститутивных ферментов.
Выключение механизма ретроингибирования возможно, если мутации у микроорганизмов вызывают дефект (разрыв) в последовательности биохимических реакций образования конечного продукта. Из-за отсутствия или выключения фермента (Ф), катализирующего промежуточную стадию процесса, в среде накапливается не конечный продукт, а промежуточный целевой метаболит.
Мутанты с ограниченной способностью к образованию конечных продуктов называются ауксотрофными. Благодаря отсутствию ингибитора (конечного продукта) использование субстрата и рост микроорганизма продолжаются, но лишь при условии добавления в среду в лимитирующих количествах вещества – продукта блокированной реакции:
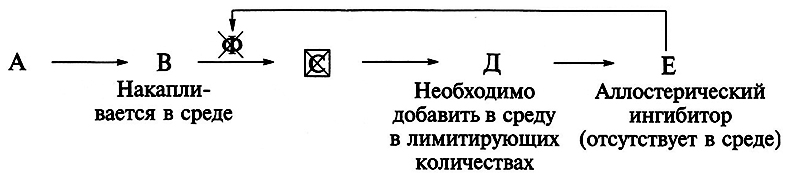
На практике высокопродуктивные организмы часто обладают двумя видами мутаций и являются ауксотрофно-регуляторными мутантами.
Для отбора мутантов с дефектами экспрессии генов и регуляции обмена веществ используют эффективные методы селекции. Один из них состоит в получении мутантов, устойчивых к структурным аналогам целевого продукта. В основе другого метода лежит выделение ревертантов из ауксотрофных мутантов. У таких мутантов восстановлена способность к синтезу конечного продукта, однако механизм ретроингибирования у них не функционирует вследствие изменения пространственной структуры ключевого фермента. Современные методы введения в состав ДНК сайт-специфичных мутаций рассмотрены в гл. 6.
Впрочем, генно-инженерные подходы конструирования штаммов микроорганизмов – продуцентов первичных и вторичных метаболитов – не столь просты, а их результаты не так впечатляющи. Это объясняется большим количеством ферментов, обычно участвующих в биосинтезе метаболитов, и сложнейшими и не до конца расшифрованными механизмами регуляции их активности, формирующими метаболические сети. Фенотип клетки определяется динамическими процессами взаимодействия молекул. В настоящее время разрабатываются подходы учета динамики метаболических потоков, что представляет собой важнейшую часть современной стратегии создания промышленных штаммов микроорганизмов, получившую название «метаболическая инженерия».
Метаболическая инженерия –многоступенчатый циклический процесс, включающий стадии анализа, интерпретации аналитических данных и стадии генетического конструирования (В.Г. Дебабов, 2005). Таким образом, основой для метаболического конструирования штаммов микроорганизмов являются как результаты генетического анализа штаммов методами классической селекции, так и детальные биохимические данные о метаболических путях, структуре и свойствах ферментов и механизмах регуляции их активности (карты метаболических путей, электронные базы данных).
Знание механизмов регуляции обмена веществ в клетке необходимо для сознательного управления процессами биосинтеза целевых продуктов и создания организмов-сверхпродуцентов. В последующих разделах эти положения проиллюстрированы на примере технологии получения конкретных соединений.
3.3. БИОТЕХНОЛОГИЯ ПОЛУЧЕНИЯ ПЕРВИЧНЫХ МЕТАБОЛИТОВ
3.3.1. Производство аминокислот
Среди соединений, получаемых биотехнологическими методами, аминокислоты занимают первое место по объему производства и второе место по стоимости, уступая по последнему параметру лишь антибиотикам. Объем мирового производства аминокислот составляет 800 тыс. т в год стоимостью более 5 млрд долларов. Больше половины общего объема производства приходится на долю L-глутаминовой кислоты, которую используют для получения широко известного усилителя вкуса и аромата – глутамата натрия. Однако указанный объем – лишь небольшая доля от требуемого количества аминокислот. По данным ВОЗ, потребность человечества всего лишь в четырех незаменимых аминокислотах составляет, млн т: лизин – 5, метионин – 4, треонин – 3,7 и триптофан – 2.
Аминокислоты – структурные единицы белков. Природные аминокислоты вовлечены в биосинтез ферментов, ряда гормонов, витаминов, антибиотиков, алкалоидов, токсинов и других азотсодержащих соединений (пурины, пиримидины, гем и пр.). В организме животного практически половина белковых аминокислот не синтезируется. Они называются незаменимыми аминокислотами и должны поступать в организм с пищей. Недостаток каждой из этих аминокислот в пищевом или кормовом рационе приводит к нарушению обмена веществ, замедлению роста и развития. Сведения о ежедневной потребности человека в незаменимых аминокислотах представлены в табл. 3.2.
Таблица 3.2. Потребность человека в незаменимых аминокислотах
(мг/кг массы тела в сутки)
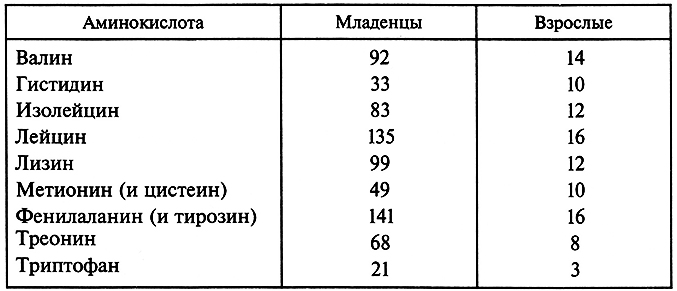
Пищевая ценность белка определяется сравнением доли незаменимых аминокислот в пище с этим же показателем при адекватном питании. Чем ближе обе величины, тем выше качество белка. Белки яйца и молока обладают высокой пищевой ценностью и используются в качестве эталона при оценке других белков. Многие белки растительного происхождения характеризуются дефицитом некоторых незаменимых аминокислот. Так, белки пшеницы и риса обеднены лизином и треонином, а белки кукурузы – лизином и триптофаном.
Введение синтетических незаменимых аминокислот в кормовые концентраты позволяет сбалансировать корма сельскохозяйственных животных по уровню белка. При добавлении 2–4 дефицитных аминокислот к 1 т комбикорма общий расход кормов уменьшается на 15–20%, выход продукции увеличивается на 20 %. Добавление к кормам аминокислот способствует переводу животноводства на промышленную основу. Данные о потребности некоторых сельскохозяйственных животных в незаменимых аминокислотах приведены в табл. 3.3.
Таблица 3.3. Потребность ряда сельскохозяйственных животных
в незаменимых аминокислотах (% к сырому протеину)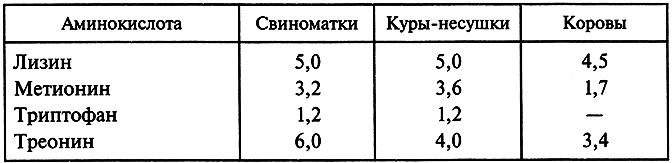
Помимо применения в качестве пищевых добавок, приправ и усилителей вкуса аминокислоты используют как сырье в химической, парфюмерной и фармацевтической промышленности и при производстве ряда других веществ:
- глицин – подсластитель, антиоксидант, бактериостатик; аспарагиновая кислота – усилитель вкуса, сырье для синтеза аспартама;
- глутаминовая кислота – усилитель вкуса, препарат для лечения психических заболеваний;
- гистидин – противовоспалительное средство; метионин – пищевая и кормовая добавки; цистеин – фармацевтический препарат; треонин и триптофан – пищевые и кормовые добавки;
- фенилаланин – сырье для получения аспартама; лизин – пищевая и кормовая добавки, сырье для получения искусственных волокон и пленок.
В промышленных масштабах белковые аминокислоты получают:
1) гидролизом природного белоксодержащего сырья;
2) химическим синтезом;
3) микробиологическим синтезом;
4) биотрансформацией предшественников аминокислот с помощью микроорганизмов или выделенных из них ферментов (химико-микробиологический метод).
При гидролизе белоксодержащее сырье (отходы пищевой и молочной промышленности) нагревают с растворами кислот или щелочей при температуре 100 –105 °С в течение 20–48 ч. Чаще всего используют 20 %-й раствор соляной кислоты, обеспечивающий глубокий гидролиз белка. Кроме того, для ускорения реакции гидролиза белков используют иммобилизованные протеолитические ферменты и ионообменные смолы. В ходе кислотного гидролиза белков происходят рацемизация и разрушение некоторых составляющих их аминокислот. При кислотном гидролизе полностью разрушается триптофан и достаточно значительны потери цистеина, метионина и тирозина (10–30 %). Лучшим способом уменьшения потерь аминокислот при гидролизе являются проведение его в вакууме или в атмосфере инертного газа, а также соблюдение высокого соотношения количества кислоты, взятой для гидролиза, и массы белка (200:1). Рациональное использование сырья при гидролизе, характерное для многих других биотехнологических производств, обеспечивает создание безотходных технологий и способствует оздоровлению окружающей среды. Ранее методом гидролиза получали аминокислоты исключительно для фармацевтических и научных целей. В последнее время сфера использования белковых гидролизатов существенно расширилась. Их применяют в медицине, животноводстве, пищевой и микробиологической промышленности.
Существенный недостаток методов химического синтеза аминокислот состоит в получении целевых препаратов в виде рацемической смеси D- и L-стереоизомерных форм. Подавляющее большинство природных аминокислот относится к L-ряду. D-α- аминокислоты обнаружены лишь в составе гликопротеинов клеточных стенок бактерий, антибиотиков и некоторых токсинов. Проницаемость L-аминокислот в клетке в 500 раз превышает таковую ее антипода. Стереоспецифичны также транспорт и метаболизм аминокислот. Исключением в этом отношении является лишь метионин, метаболизм которого нестереоизбирателен, благодаря чему данная аминокислота получается преимущественно путем химического синтеза. Разделение рацематов других аминокислот – дорогая и чрезвычайно трудоемкая процедура.
Наиболее перспективен и экономически выгоден микробиологический синтез аминокислот. Более 60 % всех производимых в настоящее время промышленностью высокоочищенных препаратов белковых аминокислот получают именно этим способом, главное преимущество которого в сравнении с методами химического синтеза состоит в возможности получения L-аминокислот на основе возобновляемого сырья.
В последние годы при производстве аминокислот все шире используют биотрансформацию предшественников аминокислот, особенно с помощью иммобилизованных ферментов или клеток микроорганизмов, предварительно получаемых химическим путем.
Промышленное производство аминокислот стало возможным после открытия способности у некоторых микроорганизмов выделять в культуральную среду значительные количества какой-либо одной аминокислоты (С. Киносита, 1955). При этом было подмечено, что большинство из нескольких тысяч проанализированных диких штаммов микроорганизмов продуцировали аминокислоты во внешнюю среду, но в очень незначительных количествах. Не зафиксировано никакой связи между таксономическим положением микроорганизма и способностью к продуцированию той или иной аминокислоты. Так, среди возможных продуцентов глутаминовой кислоты отмечены организмы, из которых 30 % – дрожжи, 30 % – стрептомицеты, 20 % – бактерии и 10 % – микроскопические грибы. И лишь один из обследованных штаммов микроорганизмов – Corynebacterium glutamicum был способен к сверхсинтезу глутамата. Этот штамм использовали при организации первого в мире крупномасштабного производства глутаминовой кислоты микробиологическим методом в Токио (1956). В России изыскания в области промышленного синтеза аминокислот были начаты в 50-х годах XX в. по инициативе академика А. А. Александрова.
Перспективные штаммы продуцентов постоянно улучшают посредством селекции мутантов с измененной генетической программой и регуляторными свойствами. Распространенные объекты селекции продуцентов – микроорганизмы, относящиеся к родам Brevibacterium, Micrococcus, Corynebacterium, Arthrobacter (табл. 3.4).
Таблица 3.4. Микроорганизмы – продуценты аминокислот
(по Н. Б. Градовой и О. А. Решетник, 1987)
Разработка технологической схемы получения отдельной аминокислоты полностью базируется на знании путей и механизмов регуляции биосинтеза конкретной аминокислоты. Необходимого дисбаланса метаболизма, обеспечивающего сверхсинтез целевого продукта, добиваются путем строго контролируемых изменений состава и условий среды.
Микробиологические методы производства аминокислот
Производство лизина
По содержанию лизина наименее сбалансированы белки злаковых культур, у которых его дефицит составляет от 20 до 50%. На территории России недостаток лизина в кормах не может быть восполнен за счет сои, поэтому в нашей стране производство этой аминокислоты было организовано первым. Для удовлетворения потребностей животноводства в лизине крупнотоннажное производство налажено в Японии, США, Германии, странах Южной Америки. Среди ведущих компаний на мировом рынке L-лизина бесспорное первенство принадлежит японской компании «Ajinomoto» и американской «Archer Daniels and Midlands», контролирующим по 40 % мирового производства лизина каждая. Особенностью этого рынка является постоянное превышение спроса над предложением. Российский рынок чистого лизина оценивается сегодня в 8–8,5 тыс.т. Более 95 % производимого в мире лизина используется в свиноводстве и птицеводстве для добавления к кормам.
В клетках микроорганизмов лизин синтезируется из аспарагиновой кислоты и служит конечным продуктом разветвленного метаболического пути биосинтеза, общего для трех аминокислот – лизина, метионина и треонина (рис. 3.3).
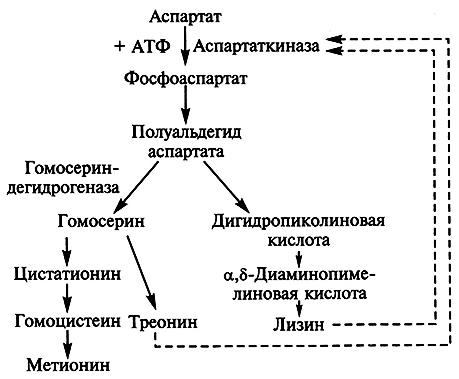
Рис. 3.3. Схема биосинтеза лизина, метионина и треонина в клетках Corynebacterium glutamicum
и Brevibacterium flavum. Ингибирование по принципу обратной связи обозначено
Таким образом, в процессе новообразования аминокислот из общего предшественника одновременно с лизином возникают две другие аминокислоты – метионин и треонин. В этом случае эффекта накопления в среде всего одной целевой аминокислоты добиваются путем блокирования процессов, ведущих к синтезу побочных аминокислот, возникающих в связи с разветвлением метаболического пути.
Образование лизина в клетке бактерии находится под строгим метаболическим контролем. У типичных продуцентов L-лизина – Brevibacterium flavum и Corynebacterium glutamicum – фермент аспартаткиназа, открывающий метаболический путь, является аллостерическим белком, чувствительным к ингибированию по принципу обратной связи при совместном и согласованном действии побочных продуктов L-треонина и L-лизина. При накоплении треонина и лизина в избыточной концентрации ингибируется аспартаткиназа и их синтез останавливается, при пониженной концентрации любой из двух аминокислот процесс активизируется .
Чтобы добиться образования лизина в больших количествах, получают мутанты двух типов. У мутантов первого типа не синтезируется или не функционирует гомосериндегидрогеназа, в результате чего блокируется синтез метионина и треонина. Такие мутанты являются ауксотрофами по гомосерину или треонину (метионину); внутриклеточная концентрация треонина у них существенно снижена, что снимает блокаду с аспартаткиназы. Поэтому при выращивании мутантных штаммов в среде, где присутствуют лимитирующие концентрации метионина и треонина, они способны образовывать избыточные количества лизина. Мутанты второго типа дефектны по структурному гену, детерминирующему конформацию аспартаткиназы. В итоге фермент теряет чувствительность к высоким концентрациям аллостерического ингибитора – лизина.
Важный фактор, обеспечивающий в культуральной среде высокие концентрации аминокислоты, синтезированной внутри клетки, – проницаемость клеточных мембран. Проницаемость клеточной мембраны увеличивают либо с помощью мутаций, либо путем изменения состава питательной среды. В последнем случае в культуральной среде создают дефицит биотина (1–5 мкл/л), добавляют пенициллин (2–4 мкг/л), детергенты (твин-40 и твин-60) или производные высших жирных кислот (пальмитаты, стеараты). Биотин контролирует содержание в клеточной мембране фосфолипидов, а пенициллин нарушает биосинтез клеточных стенок бактерий, что повышает выделение аминокислот в среду.
Для культивирования штаммов микроорганизмов при производстве аминокислот как источники углерода наиболее доступны углеводы – глюкоза, сахароза и реже фруктоза и мальтоза. Для снижения стоимости питательной среды в качестве источников углерода используют вторичное сырье: свекловичную мелассу, молочную сыворотку, гидролизаты крахмала, сульфитные щелока. Технология этого процесса совершенствуется в направлении разработки дешевых синтетических питательных сред на основе уксусной кислоты (до 1,5 %), пропионовой кислоты, метанола, этанола (до 1 %) и н-парафинов. В качестве источников азота применяют мочевину и соли аммония (сульфаты и фосфаты). Для успешного развития микроорганизмы нуждаются в стимуляторах роста, в качестве которых выступают экстракты кукурузы, дрожжей и солодовых ростков, гидролизаты отрубей и дрожжей, витамины группы В. Кроме того, в питательную среду добавляют необходимые для жизнедеятельности макро- и микроэлементы (Р, Са, Mg, Mn, Fe и др.). На процесс биосинтеза аминокислот существенное влияние оказывает снабжение воздухом, при этом степень аэрации индивидуальна для производства каждой конкретной аминокислоты. Стерильный воздух подается специальными турбинными мешалками (рис. 3.4). Опыты показали, что лизин появляется в культуральной среде начиная с середины экспотенциальной фазы роста культуры клеток микроорганизма и достигает максимума к ее концу. Поэтому на первой стадии технологического процесса формируют биомассу продуцента, которую выращивают в специальных посевных аппаратах в течение суток (рН 7,0–7,2; температура 28–30 °С), а затем подают в производственный ферментер, заполненный питательной средой. Лизин начинает поступать в культуральную жидкость через 25–30 ч после начала ферментации. По завершении процесса ферментации (через 55–72 ч) жидкую фазу отделяют от культуры клеток микроорганизма фильтрованием и используют для выделения из нее лизина.
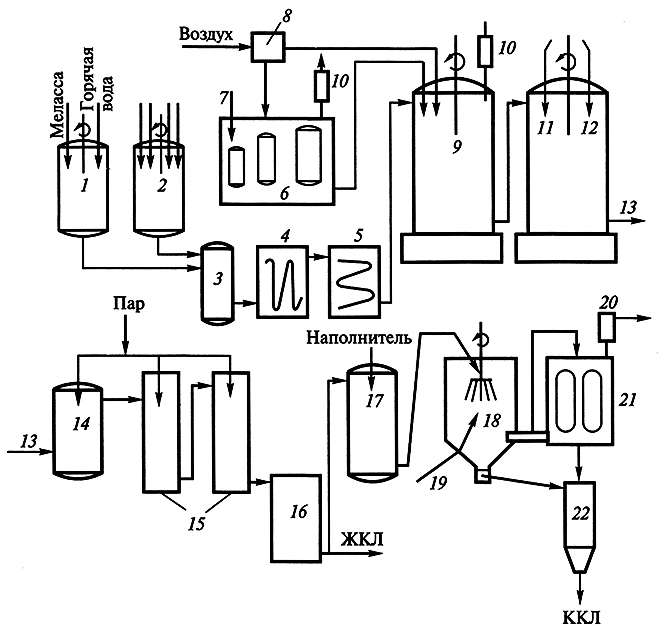
Рис. 3.4. Технологическая схема получения кормовых препаратов лизина (по B.C. Шевелухе и др., 1998):
1 – подача свекловичной мелассы; 2 – водная суспензия кукурузного экстракта и питательных солей;
3 – нагревательная колонка; 4, 5 – теплообменники; 6 – посевные аппараты; 7 – подача посевного материала;
8 – система фильтров для очистки и стерилизации воздуха; 9 – ферментер; 10 – фильтры для очистки отходящих газов;
11 – получение монохлоридгидрата лизина; 12 – подача соляной кислоты;
13, 14 – выход и подогрев монохлоридгидрата лизина;
15 – выпаривательная установка; 16 – сборник ЖКЛ; 17 – смешивание ЖКЛ с наполнителем;
18 – распылитель; 19 – подача горячего воздуха; 20 – очиститель воздуха;
21 – отделение сухого препарата лизина от воздуха; 22 – приемник ККЛ
Высокоочищенные препараты лизина получают после фракционирования фильтрата культуральной жидкости методом ионообменной хроматографии на катионите. С этой целью лизин переводят в форму катиона:
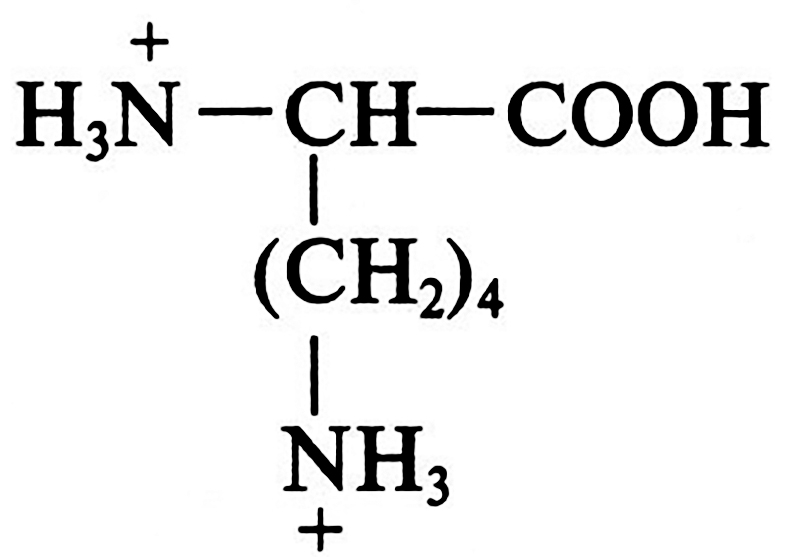
Для данного процесса фильтрат обрабатывают соляной кислотой до рН 1,6 – 2,0 (рН < рК1). Обладая двумя положительно заряженными ионогенными группировками, лизин прочно сорбируется на смоле и элюируется с нее в виде индивидуального соединения 0,5 –5 %-м раствором гидроксида аммония после выхода всех других катионов. Элюат концентрируют в вакууме при температуре 60 °С, переводят в форму монохлоргидрата, после чего высушивают и дополнительно чистят с помощью перекристаллизации. В результате получают препараты кристаллического лизина 98–99%-й чистоты, которые используют для повышения питательной ценности пищевых продуктов и в медицинской промышленности.
Кроме высокоочищенных препаратов лизина получают иные виды его товарной формы: жидкий концентрат лизина (ЖКЛ), сухой кормовой концентрат лизина (KKЛ) и высококонцентрированные кормовые препараты, характеризующиеся относительно меньшей степенью очистки в сравнении с первым препаратом.
Второй по значимости незаменимой аминокислотой для питания человека и животных является метионин, который получают преимущественно путем химического синтеза, что экономически более выгодно в сравнении с микробиологическим способом.
Производство триптофана
Триптофан достаточно часто является лимитирующим фактором питания, так как его содержание в традиционных продуктах (рыба, молоко, кормовые дрожжи) в три раза ниже, чем в стандартном белке.
Подобно лизину триптофан образуется в ходе разветвленного метаболического пути, поэтому для его производства используют ауксотрофных мутантов, у которых блокированы реакции, ведущие к синтезу фенилаланина и тирозина. Однако при выращивании мутантных штаммов в среде с минимальной концентрацией этих аминокислот, не вызывающей регуляторных эффектов, избыточное накопление триптофана в среде не наблюдается, что объясняется особенностью процессов регуляции биосинтеза триптофана у микроорганизмов.
Наряду с другими ароматическими аминокислотами у микроорганизмов (подобно большинству организмов) триптофан образуется из метаболитов углеводного обмена – эритрозо-4-фосфата и фосфоенолпирувата.
Процесс новообразования ароматических аминокислот идет через шикимовую и хоризмовую кислоты. Метаболическим предшественником триптофана служит антраниловая кислота, которая возникает из хоризмовой кислоты под действием антранилатсинтазы. Триптофан оказывает ингибирующее действие на антранилатсинтетазу, поэтому для обхода метаболического контроля синтез фермента индуцируют ступенчатым введением предшественника – антраниловой кислоты (0,1–0,3 %):
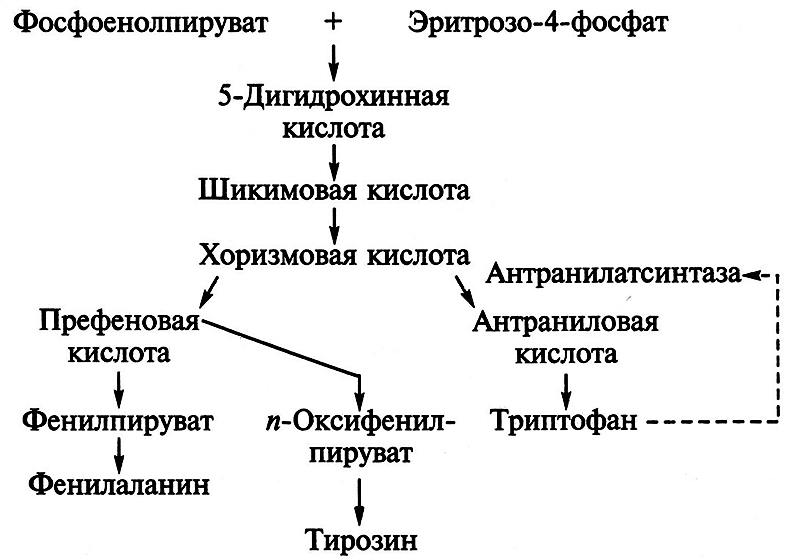
В связи с этой особенностью промышленное производство триптофана организовано преимущественно по двухступенчатой схеме. На первом этапе химическим способом синтезируют антраниловую кислоту, которую с помощью энзиматической системы мутантных штаммов дрожжей Candida utilis переводят в триптофан.
Биомассу дрожжей выращивают при температуре 30 °С в среде, содержащей свекловичную мелассу, мочевину и минеральные компоненты. Через сутки в ферментер вводят 5%-й спиртовой раствор антраниловой кислоты и 50%-й раствор мочевины, а через 3–4 ч после введения предшественника дополнительно добавляют источник углерода (25%-й раствор мелассы). Антраниловую кислоту и мочевину подают через каждые 6 ч, а мелассу – через каждые 12 ч. Процесс двухступенчатой ферментации завершается через 144 ч и обеспечивает содержание триптофана в культуральной среде до 6 г/л.
Кроме триптофана микробиологическим способом с использованием предшественников получают гистидин, изолейцин, метионин, серин и треонин.
Менее распространены одноступенчатые технологии получения триптофана на основе ауксотрофных мутантов бактерии Bacillus subtilis, осуществляемые по схеме, близкой к способу получения лизина. Длительность одноступенчатого процесса 48 ч, а концентрация триптофана в культуральной среде составляет 10 г/л.
После сушки культуральной жидкости получают кормовой концентрат триптофана (ККТ), который включает белки, свободный триптофан, витамины В1 В2и PP. Высокоочищенные кристаллические препараты триптофана образуются после дополнительной очистки культуральной жидкости методом ионообменной хроматографии на колонке, заполненной катионитом (сорбция при рН 1,0; элюция 5р%-м раствором гидроксида аммония в смеси с пропанолом-2). Элюаты кристаллизуют; кристаллы отмывают и высушивают. Кристаллический препарат содержит до 99 % триптофана.
Получены положительные результаты в увеличении выхода (до 13%) триптофана, синтезируемого Corynebacterium glutamicum. Для этого в клетки С. glutamicum дикого типа введена вторая копия гена, кодирующего антранилатсинтазу – фермента, лимитирующего синтез триптофана. Еще более высокий уровень синтеза триптофана достигается при введении в клетки бактерий модифицированных генов трех ключевых ферментов: З-дезокси-D-арабиногептулозонат-7-фосфатсинтазы, антранилатсинтазы и антранилатфосфорибозилтрансферазы, в итоге энзимы теряют чувствительность к концентрации конечного продукта (ретроингибирование).
Характерная особенность процессов получения аминокислот микробиологическим способом, равно как и других биотехнологических производств, – полное использование побочных продуктов, что превращает большинство из них в безотходные и экологически чистые технологии. Например, осадок микроорганизмов-продуцентов и промывные воды, содержащие ценные ингредиенты, такие, как белки, остатки аминокислот, витаминов, минеральных солей и микроэлементов, высушивают и используют в качестве кормовых препаратов.
Получение аргинина, глутаминовой кислоты, глутамина,
треонина и пролина микробиологическим способом
Для получения аминокислот – конечных продуктов неразветвленных метаболических путей, например аргинина, ауксотрофные мутанты не используют. В этом случае применяют мутанты с дефектами регуляции биосинтеза аминокислоты, т.е. регуляторные мутанты. Помимо аргинина регуляторные мутанты используют для получения серина и цитруллина:

Успешное производство с участием микроорганизмов таких аминокислот, как глутаминовая кислота, глутамин и пролин, обеспечивает стимуляция образования аминокислот в ответ на изменение условий внешней среды. Метаболическим предшественником при биосинтезе глутаминовой кислоты служит а-кетоглутаровая кислота, возникающая в цикле Кребса из изолимонной кислоты под действием изоцитратдегидрогеназы. При выращивании бактерий родов Corynebacterium или Brevibacterium на углеводном сырье (гидролизат крахмала, тростниковая или свекловичная меласса), на этаноле или ацетате и при дефиците биотина в культуральной среде накапливается глутаминовая кислота с концентрацией 30 г/л. Важнейшее условие для образования этой аминокислоты – подавление активности глутаматдегидрогеназы. При высоком содержании в среде биотина и солей аммония обеспечиваются условия для образования пролина, а при значительных концентрациях ионов аммония и ионов цинка в слабокислой среде – для синтеза глутамина.
Генетическая инженерия – важнейший прогрессивный способ изменения генетической программы организма в целях создания высокопродуктивных штаммов промышленных микроорганизмов. Успехи современной генетической инженерии существенно влияют на промышленную биотехнологию. Яркий пример больших возможностей генетической инженерии – создание во ВНИИ генетики и селекции промышленных микроорганизмов штамма Е. coli для получения треонина (В.Г.Дебабов с сотр., 1980). В результате были изменены не только регуляторные свойства фермента аспартаткиназы, но и питательные потребности штамма. Введение в геном бактерии нового гена обеспечило бактерии возможность использования в качестве источника углерода сахарозу, основного дисахарида традиционного промышленного сырья – свекловичной мелассы. Перечисленные манипуляции наряду с амплификацией плазмид, содержащих часть оперона треонина (промотор, гены, кодирующие аспартаткиназу, гомосериндегидрогеназу и гомосеринкиназу), позволили значительно увеличить производительность штамма бактерии и получить за 40 ч ферментации 100 г L-треонина на 1 л культуральной жидкости. Учитывая исключительные способности штамма Е. coli к сверхсинтезу L-треонина, японская фирма «Ajinomoto» приобрела в 1982 г. лицензию на использование российского штамма – продуцента треонина – для организации собственного производства.
Химико-ферментативные способы получения аминокислот
При получении ряда аминокислот химико-ферментативными способами используют энзимы, принадлежащие к разным классам. Эти процессы могут быть одностадийными (конверсии), и многостадийными. Источником ферментов для большинства процессов служат энзимы микроорганизмов – как индивидуальные, так и их природные смеси, содержащиеся в интактных (не растущих), высушенных и лизированных клетках, клеточных экстрактах и, наконец, в препаратах иммобилизованных клеток и ферментов.
Использование иммобилизованных ферментов в биотехнологии рассмотрено в гл. 4.
Применение ферментов в производстве аминокислот обеспечивает стереоспецифичность процессов их синтеза, что выгодно отличает биотехнологические производства от химических. Рассмотрим примеры, иллюстрирующие эти положения.
Получение L-лизина
Процесс получения лизина основан на стереоспецифическом ферментативном гидролизе (конверсии) D-,L-α-амино-ε-капролактама, который сначала получают химическим путем из циклогексена:
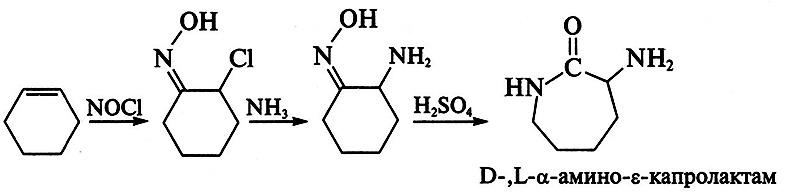
Рацемат используют в качестве субстрата, который под действием фермента L-α-амино-ε-капролактамгидролазы (лактамаза) превращается в L-лизин, а оставшаяся непрореагировавшая его часть (D-форма) переводится при воздействии рацемазы в смесь антиподов:
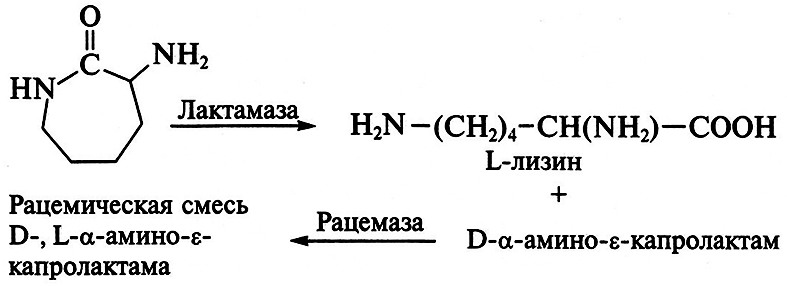
Лактамаза найдена у некоторых видов дрожжей, в частности у Candida laurentii; у них синтез фермента индуцируется добавлением субстрата (рацемической смеси), а активность энзима поддерживается при добавлении в среду ионов Mg2+, Мп2+ и Zn2+. Рацемаза обнаружена у ряда бактерий, например у Alcaligenes obae. Для получения неочищенных ферментов целые клетки микроорганизмов обрабатывают поверхностно-активными веществами, вызывающими изменение проницаемости стенки клеток микроорганизмов-продуцентов. Разработаны иммобилизованные формы обоих ферментов. При производстве лизина в водный раствор D-,L-α-амино-ε-капролактама одновременно вводят источники лактамазы и рацемазы, содержащиеся в дрожжевых и бактериальных клетках. Процесс осуществляется при температуре 30–50 °С, рН 8,0–8,5 и оптимальном режиме аэрации. На выходе из реактора образуется преимущественно один продукт – лизин, который выделяют из смеси, очищают и сушат. Описанная технология получения лизина, распространенная в США и Японии, по завершении процесса обеспечивает содержание аминокислоты в реакционной среде свыше 150 г/л. Кроме того, созданы мутанты, у которых целевой продукт – лизин далее не вовлекается в обмен веществ, что увеличивает выход искомого продукта.
Получение триптофана
Химико-ферментативный способ получения триптофана состоит в прямой конденсации индола, аммиака и пировиноградной кислоты:
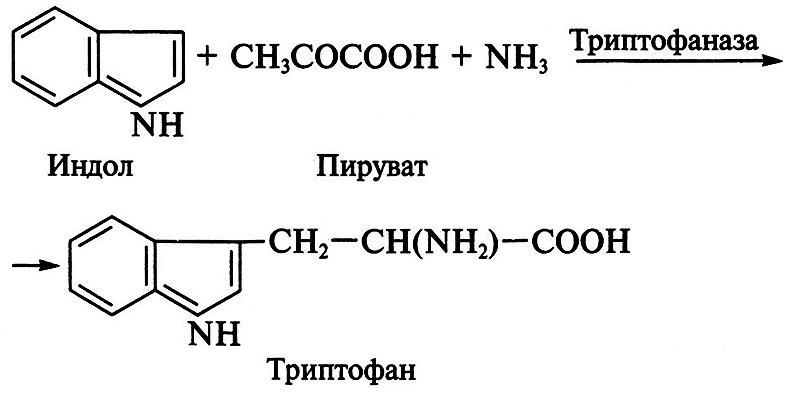
Реакцию катализирует пиридоксальзависимая триптофан-индоллиаза (триптофаназа). Фермент широко распространен в природе. Он найден у бактерий Е. coli, Bacillus albei, Proteus rettgeri и характеризуется широкой субстратной специфичностью. Кроме L-триптофана его субстратами служат L-цистеин, S-метил-цистеин, β-хлор-L-аланин, L-серин. Триптофаназа ускоряет реакции α,β-элиминирования и β-замещения, но ее действие может быть обращено и в сторону реакции конденсации. Добавление триптофана индуцирует образование фермента, а добавление индола ингибирует его синтез у бактерий, поэтому процесс получения триптофана ведут при избытке аммиака и пирувата.
Выход аминокислоты при реализации химико-энзиматического способа получения триптофана составляет 63 г/л.
Набор энзимов, использующихся для получения аминокислот, достаточно разнообразен. К их числу относятся гидролазы, дегидрогеназы, лиазы, лигазы, изомеразы. Столь же разнообразен и перечень целевых аминокислот, производимых химико-ферментативным способом (L-аспарагиновая кислота, L-аланин, L-глутамин, L-лизин, L-тирозин, L-триптофан, L-цистеин, L-фенилаланин, L-метионин). Химико-энзиматический способ в сравнении с микробиологическим более специфичен, не требует процедуры очистки аминокислот от побочных продуктов и сточных потоков. Однако по стоимости сырья и ферментативных препаратов он еще уступает микробиологическому способу.
3.3.2. Производство витаминов
Витамины представляют собой группу незаменимых органических соединений различной химической природы, необходимых любому организму в ничтожных концентрациях и выполняющих в нем каталитические и регуляторные функции. Недостаток того или иного витамина нарушает обмен веществ и нормальные процессы жизнедеятельности организма, приводя к развитию патологических состояний. Витамины не образуются у гетеротрофов. Способностью к синтезу витаминов обладают лишь автотрофы, в частности растения. Многие микроорганизмы также образуют целый ряд витаминов, поэтому синтез витаминов с помощью микроорганизмов стал основой для разработки технологий промышленного производства этих биологически активных соединений.
Благодаря изучению физиологии и генетики микроорганизмов–продуцентов витаминов и выяснению путей биосинтеза каждого из них создана теоретическая основа для получения микробиологическим способом практически всех известных в настоящее время витаминов. Однако с помощью энзимов целесообразнее производить лишь особо сложные по строению витамины: В2, В12, β-каротин (провитамин А) и предшественники витамина D. Остальные витамины либо выделяют из природных источников, либо синтезируют химическим путем. Витамины используются в качестве лечебных препаратов, для создания сбалансированных пищевых и кормовых рационов и для интенсификации биотехнологических процессов.
Получение витамина В2 (рибофлавин)
Вплоть до 30-х годов прошлого столетия рибофлавин выделяли из природного сырья. В наибольшей концентрации он присутствует в моркови и печени трески. Из 1 т моркови можно изолировать лишь 1 г рибофлавина, а из 1 т печени – 6 г. В 1935 г. обнаружен активный продуцент рибофлавина – гриб Eremothecium ashbyii, способный При выращивании на 1 т питательной смеси синтезировать 25 кг витамина В2. Сверхсинтеза рибофлавина добиваются действием на дикие штаммы мутагенов, нарушающих механизм ретроингибирования синтеза витамина В2, флавиновыми нуклеотидами, а также изменением состава культуральной среды. Отбор мутантов ведут по устойчивости к аналогу витамина В2 – розеофлавину. Вопросы биосинтеза рибофлавина и его регуляции детально изучены в работах Г. М. Шавловского.
В состав среды для роста продуцентов витамина В2 входят достаточно сложные органические вещества – соевая мука, кукурузный экстракт, сахароза, карбонат кальция, хлорид натрия, гидрофосфат калия, витамины, технический жир. Грибы весьма чувствительны к изменению состава среды и подвержены инфицированию. Перед подачей в ферментер среду подвергают стерилизации, добавляя к ней антибиотики и антисептики. Подготавливают жидкую питательную среду и посевной материал культуры дрожжей в разных емкостях – ферментере и посевном аппарате.
В качестве посевного материала используют споры Е. ashbyii, выращенные на пшене (7–8 дней при 29–30 °С). После стерилизации жидкий посевной материал подается в ферментер. Процесс ферментации грибов для получения кормового рибофлавина длится 3 суток при температуре 28–30 °С. Концентрация рибофлавина в культуральной жидкости может достигать 1,4 мг/мл. По завершении процесса ферментации культуральную жидкость концентрируют в вакууме, высушивают на распылительной сушилке (влажность 5–10 %) и смешивают с наполнителями.
В 1983 г. во ВНИИ генетики и селекции промышленных микроорганизмов сконструирован рекомбинантный штамм продуцента Bacillus subtilis, характеризующийся увеличенной дозой оперонов, которые контролируют синтез рибофлавина. Клонированием генов рибофлавинового оперона в одной из созданных плазмид был получен производственный штамм-продуцент витамина В2, способный синтезировать втрое больше по сравнению с Е. ashbyii количество рибофлавина всего за 40 ч ферментации.
Получение витамина В12 (Соα[α-(5,6-диметилбензимидазолил)]-Соβ – цианокобамид)
Витамин В12 открыт в 1948 г. одновременно в США и Англии. В 1972 г. в Гарвардском университете был осуществлен химический синтез корриноидного предшественника витамина В12. Химический синтез корнестерона – структурного элемента корринового кольца витамина, включающий 37 стадий, в крупных масштабах не воспроизведен из-за сложности процесса.
Витамин В12 регулирует углеводный и липидный обмен, участвует в метаболизме незаменимых аминокислот, пуриновых и пиримидиновых оснований, стимулирует образование предшественников гемоглобина в костном мозге; применяется в медицине для лечения злокачественной анемии, лучевой болезни, заболеваний печени, полиневрита и т. п. Добавление витамина к кормам способствует более полноценному усвоению растительных белков и повышает продуктивность сельскохозяйственных животных на 10–15 %.
Первоначально витамин В12 получали исключительно из природного сырья, но из 1 т печени можно было выделить всего лишь 15 мг витамина. Единственный способ его получения в настоящее время – микробиологический синтез. Обнаружение витамина в качестве побочного продукта при производстве антибиотиков в значительной степени стимулировало поиск организмов-продуцентов витамина и изучение путей его образования. Однако механизмы регуляции биосинтеза витамина В12 до сих пор полностью не расшифрованы. Известно, что при высоких концентрациях витамин полностью репрессирует синтез ключевых ферментов своего новообразования.
Продуцентами витамина В12 при его промышленном получении служат актиномицеты, метанообразующие и фотосинтезирующие бактерии, одноклеточные водоросли. В 70-х годах XX в. интерес ученых привлекли пропионовокислые бактерии, известные еще с 1906 г. и широко использующиеся для приготовления препаратов животноводства. Выделено 14 видов пропионовокислых бактерий, продуцирующих витамин В12; их физиолого-биохимическая характеристика дана JI. И. Воробьевой. Для получения высокоочищенных препаратов витамина В12 пропионовокислые бактерии культивируют периодическим способом на средах, содержащих глюкозу, казеиновый гидролизат, витамины, неорганические соли, хлорид кобальта. Добавление в среду предшественника 5,6-диметилбензимидазола (способствует переводу неактивных форм в природный продукт) по окончании первой ростовой фазы (5–6 суток) стимулирует быстрый (18–24 ч) синтез витамина с выходом последнего 5,6–8,7 мг/л. Путем селекции, оптимизации состава среды и условий культивирования выход витамина В12 в промышленных условиях был значительно повышен. Так, выход витамина на среде с кукурузным экстрактом и глюкозой при поддержании стабильного значения рН близ нейтральных зон достигает 21–23 мг/л. Мутант пропионовокислых бактерий продуцирует до 30 мг/л витамина. Бактерии плохо переносят перемешивание. Применение уплотняющих агентов (агар, крахмал), предотвращающих оседание бактерий, а также использование высокоанаэробных условий и автоматического поддержания рН позволяет получить наиболее высокий выход витамина – 58 мг/л.
Из культуральной жидкости витамин В12 выделяют экстракцией органическими растворителями, ионообменной хроматографией с последующим осаждением из фракций в виде труднорастворимых соединений. В процессе получения витамина В12 с помощью пропионовокислых бактерий применяют дорогостоящую антикоррозийную аппаратуру, сложные и дорогие питательные среды. Усовершенствование технологического процесса идет в направлении удешевления компонентов питательных сред (замена глюкозы сульфитными щелоками) и перехода с периодического культивирования на непрерывный процесс. В последние годы исследуется возможность получения витамина с использованием иммобилизованных клеток пропионовокислых бактерий.
Для нужд животноводства сотрудниками Института биохимии им. А. Н. Баха РАН была разработана более простая и дешевая технология получения витамина В12, в создание которой большой вклад внесли работы В.Н.Букина, В.Я.Быховского, И.С.Логоткина, Е. С. Панцхавы и др.
По указанной технологии ферментацию осуществляет сложный биоценоз термофильных микроорганизмов, производящих метановое брожение. Комплекс микроорганизмов включает целлюлозоразлагающие, углеводсбраживающие, аммонифицирующие, сульфитвосстанавливающие и метанообразующие бактерии. На первой фазе процесса (10–12 дней) развиваются термофильные углеводсбраживающие и аммонифицирующие бактерии. При этом в слабокислой среде (рН 5,0–7,0) органические соединения превращаются в жирные кислоты и аммиак. На второй фазе, когда среду подщелачивают до рН 8,5, в биоценозе преобладают метанообразующие бактерии, которые сбраживают возникающие на первой фазе продукты до метана и диоксида углерода. Именно метанообразующие бактерии – главные продуценты витамина. Обогащение сред очищенными культурами метанообразующих бактерий увеличивает выход активных форм витамина В12.
Источником углерода в питательной среде служит ацетонобутиловая и спиртовая барда, которую представляют заводы, перерабатывающие зерно и мелассу. Для оптимизации питательной среды в нее добавляют соединения кобальта (хлорид кобальта – 4 г/м3), который входит в состав молекулы витамина В12, и субстраты для роста метанообразующих бактерий – низшие жирные кислоты и низшие спирты, что позволяет значительно повысить выход витамина.
Подготовленное сырье освобождают в декантаторе от взвешенных частиц и непрерывно подают в нижнюю часть ферментера (метантенка) вместимостью 4200 м3. Одновременно в ферментер поступает посевной материал культуры микроорганизмов, предварительно выращенный в специальных аппаратах. Для выращивания продуцента требуются облигатно анаэробные условия, ибо даже следы кислорода подавляют рост бактерий. При создании анаэробных условий в среду подают диоксид углерода или газы, выделяющиеся в процессе ферментации. Ежедневно из метантенка отбирают 25–30 % объема среды. Продукт ферментации стабилизируют, подкисляя соляной или фосфорной кислотой до рН 6,3–6,5 и добавляя 0,2–0,25 % сульфита натрия, что предотвращает разрушение витамина при тепловой обработке, особенно существенное в щелочной среде. В дальнейшем отобранная часть культуральной жидкости дегазируется, упаривается в вакууме; концентрат высушивается в распылительной сушилке до влажности 10–15 % и смешивается с наполнителями. Готовый кормовой препарат, имеющий коммерческое название КМВ-12 (концентратмикробный витамин), содержит, кроме витамина В12 (2,5 %) витамины В1 В2, В6, пантотеновую кислоту, фолиевую кислоту, биотин, незаменимые аминокислоты.
Процесс промышленного получения витамина В12 – пример безотходной и экологически чистой технологии. Сырьем для ее реализации служат массовые отходы, а конечными продуктами – биогаз (65 % метана, 30 % диоксида углерода), использующийся как топливо, и биомасса метановых бактерий – источник биологически активных соединений, активирующих, например, рост молочнокислых бактерий.
Витамины – объекты международной торговли. Так, витамин В12 российского производства экспортируется в Польшу, Германию, Чехию, Словакию и другие страны.
Получение β-каротина и витамина D2
Важное место в обмене веществ у животных занимает β-каротин, который в печени превращается в витамин А (ретинол). В организме человека и животных каротины не образуются. Основные источники β-каротина для животных – растительные корма; человек получает β-каротин также из продуктов животного происхождения. β-Каротин можно выделить из ряда растительных объектов – моркови, тыквы, облепихи, люцерны. В начале 60-х годов XX в. разработана схема микробиологического синтеза β-каротина, которая стала основой промышленного способа его получения. Установлено, что многие микроорганизмы – фототрофные бактерии, актиномицеты, плесневые грибы, дрожжи – синтезируют каротин. Характерно, что содержание β-каротина у микроорганизмов во много раз превышает содержание этого провитамина у растений. Так, в 1 г моркови присутствует всего 60 мкг β-каротина, в то время как в 1 г биомассы гриба Blaneslea trispora – 3–8 тыс. мкг. Разработаны опытные установки как периодического, так и непрерывного действия для синтеза β-каротина, основной недостаток которых – высокая стоимость сырья и большая длительность процесса.
Микробиологическим способом получают и витамин D2 (эргокальциферол), при производстве которого освоено дешевое сырье (углеводороды) и установлен стимулирующий эффект ультрафиолетовых лучей на синтез эргостерина культурой дрожжей.
В ближайшие годы ожидается расширение набора витаминов, получаемых методами биотехнологии. Для решения проблемы промышленного получения витаминов требуется внедрение непищевого малодефицитного сырья, разработка специальных режимов культивирования сверхпродуцентов, перевод процессов на непрерывные технологии, использование перспективных химико-ферментативных способов синтеза витаминов.
3.3.3. Производство органических кислот
В настоящее время биотехнологическими способами в промышленных масштабах синтезируют ряд органических кислот. Из них лимонную, глюконовую, кетоглюконовую и итаконовую кислоты получают лишь микробиологическим способом, молочную, салициловую и уксусную – как химическим, так и микробиологическим способами, а яблочную – химическим и энзиматическим путем.
Получение уксусной кислоты
Уксусная кислота имеет наиболее важное значение среди всех органических кислот. Ее используют при выработке многих химических веществ, включая каучук, пластмассы, волокна, инсектициды. Микробиологический способ получения уксусной кислоты состоит в конверсии этанола в уксусную кислоту при участии бактерий штаммов Acetobacter и Gluconobacter:
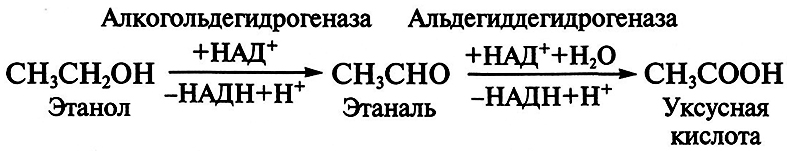
Процесс идет в анаэробных условиях в режиме непрерывного культивирования продуцента. Для роста бактерии Acetobacter aceti используют питательные среды, содержащие 6–12% этилового спирта, 1 % бактериального гидролизата, 0,05 % дигидрофосфата калия, 0,1 % гидрофосфата аммония и 0,05 % сульфата магния. Максимальная удельная активность непрерывной культуры A. aceti (количество микрограммов субстрата, подвергшегося окислению 1 мкг биомассы за 1 мин) достигается к 20-м суткам культивирования при концентрации спирта 7 % и составляет 3,0 ед./мг.
Получение лимонной кислоты
Лимонную кислоту широко используют в пищевой, фармацевтической и косметической промышленности. Ею заменяют фосфаты в составе детергентов, так как она полностью метаболизируется живыми организмами. Лимонная кислота образует хелаты с металлами, поэтому ее применяют для их очистки. Объем мирового производства цитрата составляет 400 тыс. т/год. Самый крупный производитель лимонной кислоты – США. Производство лимонной кислоты принадлежит к числу старейших промышленных микробиологических процессов: оно было организовано в 1893 г. С этого момента параллельно развитию фундаментальной микробиологии велись изыскания оптимальных продуцентов и технологических вариантов процесса ферментации.
Для промышленного производства лимонной кислоты используют главным образом культуру гриба Aspergillus niger, а также A. went и.
Метаболическим источником лимонной кислоты в организме служит цикл трикарбоновых кислот – составная часть цикла Кребса. Суммарное уравнение химических процессов этого цикла следующее:
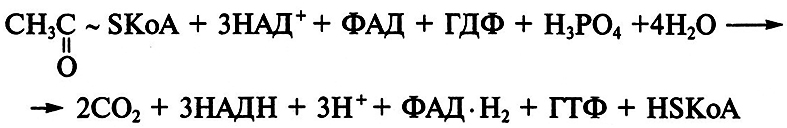
Реакция образования лимонной кислоты, катализируемая цитратсинтазой, открывает цикл Кребса, в котором цитрат постепенно окисляется до щавелево-уксусной кислоты (ЩУК). ЩУК снова конденсируется с ацетил-КоА, так что вновь образуется лимонная кислота (рис. 3.5). Цитратсинтаза определяет скорость реакций, составляющих цикл Кребса. Активность фермента зависит от концентрации ЩУК, содержание которой может поддерживаться за счет функционирования конститутивной пируваткарбоксилазы, обеспечивающей переключение в аэробных условиях процессов гликолиза и глиоксилевого цикла. Активность цитратсинтазы тормозится НАДН и сукцинил-КоА. Скорость оборота цикла Кребса определяется поддержанием необходимого уровня окисленных форм коферментов дегидрогеназ (НАД+ и ФАД; см. уравнение реакции), поэтому высокий выход цитрата получается лишь при условии хорошей аэрации. Накопление в культуральной среде существенных количеств цитрата – промежуточного соединения цикла Кребса – невыгодно для организма и является следствием дисбаланса метаболизма или нарушения его генетической природы. Рост культуры грибов обычно регулируют путем изменения содержания фосфата, ионов марганца, железа и цинка в среде. Дефицит фосфата ведет к сверхпродукции цитрата. Роль ионов металлов не до конца установлена. Считают, что дефицит ионов металлов влияет на свойства клеточных мембран и морфологию гиф.
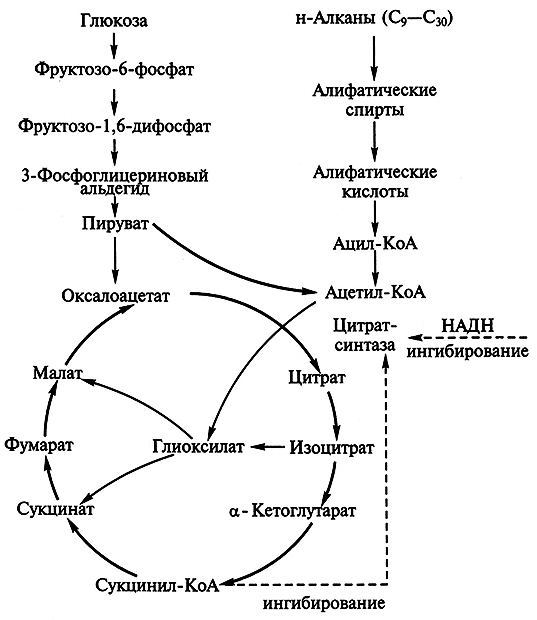
Рис. 3.5. Схема биосинтеза лимонной кислоты
Процесс ферментации, ведущий к образованию лимонной кислоты, проводят при низких значениях рН (3–4), что облегчает поддержание стерильных условий ферментации и уменьшает возможность образования побочных продуктов. В более щелочной среде происходит накопление щавелевой и глюконовой кислот. Предполагают, что в кислой среде стимулируется гликолиз, что обеспечивает направление потока углерода в цикл Кребса.
Питательные среды для культивирования продуцентов лимонной кислоты в качестве источника углерода содержат дешевое углеводное сырье: мелассу, крахмал и глюкозный сироп. Гриб A niger чаще всего выращивают на мелассе. Гриб Trichoderma viride синтезирует значительные количества цитрата из глюкозы, что позволяет использовать для этого процесса целлюлозу. Предложены штаммы бактерий (Corynebacterium, Arthrobacterium и Brevibacterium) и дрожжей рода Candida, осуществляющие процесс на основе «-парафинов (С9–С30), которые пока широко не внедрены в промышленность.
Существует несколько технологических вариантов промышленного производства лимонной кислоты. Первоначально был разработан вариант процесса, основывающийся на поверхностной ферментации, позднее – на глубинном культивировании. Последнее ведется в две стадии: на первой стадии идет рост мицелия, а на второй, после выхода культуры в стационарную фазу – интенсивный синтез лимонной кислоты. В конце ферментации массу мицелия отделяют путем фильтрования и промывают. Затем при рН < 3,0 в виде кальциевой соли осаждают щавелевую кислоту, а из маточного раствора выделяют лимонную кислоту в форме средней соли, кристаллизующейся в комплексе с четырьмя молекулами воды. Свободную кислоту выделяют из промытых кристаллов соли после их обработки сульфатом кальция. Высокоочищенные препараты лимонной кислоты получают после дополнительной процедуры очистки методом ионообменной хроматографии. Выход продукта составляет 85 %.
С 20-х годов XX в. налажено промышленное производство D-глюконовой кислоты из глюкозы при участии А. niger. При этом за 48 ч ферментации культуры гриба степень превращения субстрата составляет 90%. Глюконат натрия, в виде которого обычно выделяют глюконовую кислоту, используют для извлечения металлов, борьбы со ржавчиной, как моющее средство и в качестве медицинского препарата. С участием культуры грибов из рода Aspergillus путем ферментации глюкозы получают с высоким выходом итаконовую кислоту, использующуюся для производства пластмасс и красителей.
Новые возможности для интенсификации производственных процессов получения органических кислот открывает применение иммобилизованных ферментов и клеток микроорганизмов.
3.4. БИОТЕХНОЛОГИЯ ПОЛУЧЕНИЯ ВТОРИЧНЫХ МЕТАБОЛИТОВ
34.1. Получение антибиотиков
Принципы получения вторичных метаболитов основаны на особенностях их образования клетками микроорганизмов. Биосинтез вторичных метаболитов фазоспецифичен и происходит по завершении стадии роста, в идиофазе, благодаря чему их еще называют идиолитами (см. с. 32). Среди вторичных метаболитов ведущее место по объему производства занимают антибиотики.
В мире ежегодно производится 100 000 т антибиотиков на сумму примерно 20 млрд долларов. К числу антибиотиков относятся важнейшие противомикробные и противоопухолевые препараты. Открытие антибиотиков произвело переворот в лечении инфекционных заболеваний. Ушли в прошлое представления о неизлечимости многих бактериальных инфекций (туберкулез, сепсис, сифилис и др.). Антибиотики применяют в ряде отраслей народного хозяйства (растениеводство, животноводство, ветеринария, пищевая промышленность и др.), где они используются более широко, чем в медицине. Организация крупномасштабного производства антибиотиков сыграла решающую роль в становлении промышленной биотехнологии.
К антибиотикам относятся низкомолекулярные эффекторы изначально природного происхождения, способные подавлять рост живых клеток. Антибиотики, продуцируемые растительными объектами, называют фитонцидами. Вопрос о физиологических функциях антибиотиков, их месте в метаболизме и процессах эволюции окончательно не решен. Ряд исследователей полагают, что с помощью антибиотиков продуценты преодолевают «стрессовые» ситуации. Некоторые авторы связывают способность организмов к образованию антибиотиков с активацией ранее «молчащих» генов в новых условиях обитания микроорганизмов. Антибиотики возникли в борьбе за существование почвенных биоценозов, поэтому многие из них служат средствами нападения и защиты, т.е. представляют собой своеобразное химическое «оружие» клетки. Однако эти функции у антибиотиков не единственны. Известно, что они могут участвовать в процессах детоксикации вредных метаболитов, контролировать некоторые стороны обмена веществ и целые процессы развития, например дифференцировку клеток, служить запасными питательными веществами. Некоторые исследователи рассматривают антибиотики как случайные вещества, обладающие полезными свойствами, другие считают их реликтовыми молекулами, вытесненными в ходе эволюции продуктами рибосомального синтеза, но и до сих пор сохранившими способность вмешиваться в биохимические процессы.
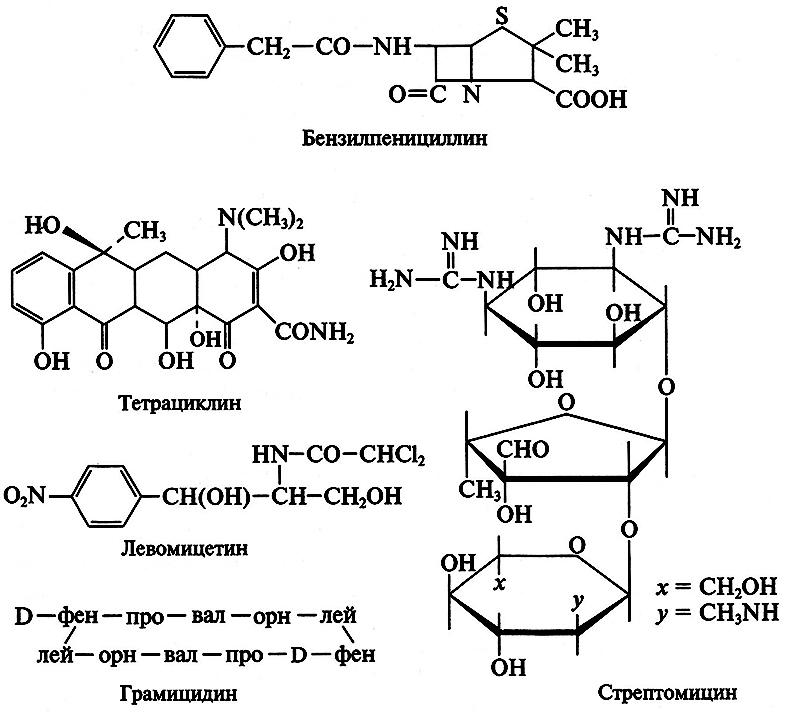
Способность нитчатого гриба зеленой плесени Penicillium notatum вызывать гибель микроорганизмов впервые была установлена в 1928 г. английским микробиологом А. Флеммингом. Однако лечебные свойства этой плесени были описаны еще в 1871 г. русским дерматологом А. Г. Полотебновым. Количество открываемых антибиотиков постоянно растет. В 1940 г. было известно всего 6 антибиотиков, а в настоящее время описано более 14 000 аналогичных соединений, из которых в клинике применяют около 200 препаратов. 98 % известных антибиотиков токсичны, поэтому в практике не используются. В химическом отношении они представляют сборную группу органических веществ. В зависимости от химической природы и ряда других свойств известные антибиотики делят на ряд классов:
1. β-Лактамные (пенициллины, цефалоспорины; составляют более 50 % рынка антибиотиков).
2. Тетрациклины (тетрациклин, морфоциклин, метациклин).
3. Макролиды (эритромицин, олеандомицин).
4. Аминогликозиды (гентамицин, амикацин).
5. Гликопептиды (ванкомицин, ристомицин).
6. Амфениколы (левомицетин).
7. Линкосамиды (линкомицин).
8. Полиеновые [противогрибковые (нистатин, леворин)].
9. Противоопухолевые (блеомицин) и др.
Большой вклад в установление структуры ряда антибиотиков внесли М. М. Шемякин, Ю. А. Овчинников, В. Т. Иванов, А. С. Хохлов, Г.Б.Локшин, М.Н.Колосов, Ю.А.Берлин, Е.С.Есипов, А.Д.Кузовнов.
Химические формулы наиболее распространенных антибиотиков следующие:
По типу действия антибиотики делят на бактерицидные (лактимные, аминогликозиды), вызывающие гибель микроорганизмов, и бактериостатические (макролиды, тетрациклины, левомицетин), нарушающие способность микроорганизмов делиться. По спектру действия различают антибиотики узкого и широкого действия. К последним относят тетрациклины, макролиды, аминогликозиды, которые особенно полезны в случае неидентифицированных возбудителей болезни, однако при длительном применении они вызывают у пациентов дисбактериоз.
В последние годы достигнуты большие успехи в расшифровке молекулярного механизма действия антибиотиков. Наиболее яркая особенность антибиотиков – исключительная специфичность их действия. По выражению П. Эрлиха, антибиотики – это магические Пули. Специфика действия их состоит в избирательном подавлении этими эффекторами одного или нескольких процессов лишь у некоторых микроорганизмов. Таким образом, антибиотики блокируют метаболические мишени в клетках-мишенях. В зависимости от специфики действия антибиотиков на молекулярном уровне различают следующие группы соединений, вызывающие у бактерий:
1) нарушение биосинтеза пептидогликанов клеточной стенки (пенициллины, ванкомицин, цефалоспорины);
2) нарушение отдельных этапов процессов трансляции (амфениколы, аминогликозиды, тетрациклины, макролиды, линкосамиды);
3) повреждения цитоплазматической мембраны (грамицидин, полимиксины);
4) нарушение биосинтеза нуклеиновых кислот (рифамицины, нктиномицин D, противоопухолевые антибиотики);
5) нарушение энергетического обмена (олигомицин, хлоргексидин).
Антибиотики широко используют в качестве молекулярных инструментов при исследовании фундаментальных проблем биологии, таких, как расшифровка тончайших механизмов биосинтеза белка, нуклеиновых кислот и структуры клеточных стенок бактерий, создание моделей транспорта ионов через биологические мембраны и др.
Изыскание новых антибиотиков обусловлено потребностями практики, а также накоплением резистентных форм микроорганизмов по отношению ко многим антибиотикам. Резистентность микроорганизмов может быть обусловлена снижением проницаемости оболочек клеток для антибиотиков, изменением пространственной структуры внутриклеточной мишени для них и деструкцией молекул антибиотиков под воздействием энзиматических систем организма. Устойчивость бактерий к пенициллинам и цефалоспоринам создает присутствующий в их клетках энзим лактамаза (пенициллиназа). Фермент гидролизует амидную связь β-лактамного цикла в молекуле антибиотика с образованием пенициллиновой кислоты, которая полностью лишена антимикробнои активности:
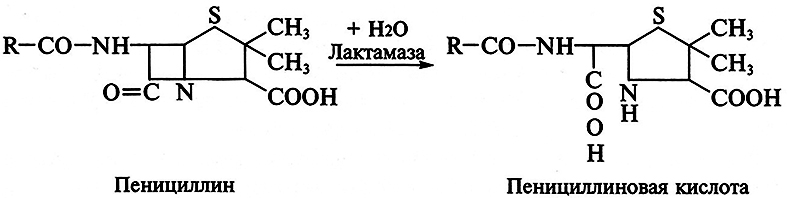
Специальное изучение объема и потенциала защитных свойств микроорганизмов показало, что их резистентность к антибиотикам имеет глобальный характер и обеспечивается как разнообразием фенотипов резистентности, так и разнообразием и стабильностью систем горизонтального генного транспорта. Поэтому главное направление получения новых антибиотиков состоит не в открытии новых соединений, а в химической трансформации природных молекул для создания полусинтетических антибиотиков, характеризующихся значительно меньшей резистентностью и токсичностью, но более широким спектром действия, большим временем жизни, химической и биологической устойчивостью. Важный подход на пути получения устойчивых аналогов антибиотиков – использование природных ингибиторов β-лактамаз – клавулановой и оливановой кислот. Стратегия борьбы с резистентностью к антибиотикам включает также последовательную замену одних препаратов другими с возобновлением применения через ограниченный срок «старых» препаратов антибиотиков. Удаление антибиотика из среды применения приводит к уменьшению распространенности генов резистентности к нему. После восстановления эффективности действия антибиотика его вновь вводят в клиническую практику.
Методы получения антибиотиков путем химического синтеза чрезвычайно сложны и не могут конкурировать с их биосинтезом методами биотехнологии. Существует несколько способов получения как природных, так и полусинтетических антибиотиков. Направленный биосинтез антибиотиков осуществляется путем прямой ферментации микроорганизма – продуцента с подходящим предшественником, что индуцирует синтез ферментов вторичного метаболизма в идиофазе. Точный механизм индуцирования первичными метаболитами генов, кодирующих синтез ферментов вторичного метаболизма, не расшифрован, однако выявлено, что молекулы предшественника необходимо добавлять в среду в период фазы роста микроорганизма. Установлено, что вводимый предшественник должен лимитировать скорость биосинтеза антибиотика. Например, производство бензилпенициллина в значительной степени стимулируется добавками его метаболического предшественника – фенилуксусной кислоты; пропионовая кислота и пропиловый спирт инициируют биосинтез макролидов через метилмалонилКоА; L-фенилаланин – предшественник фенилаланина – ускоряет образование грамицидина S. Аналогичный эффект вызывает использование ингибиторов метаболизма. Так, при подавлении процесса введения хлора микроорганизм S. aureofaciens образует тетрациклин, а не хлортетрациклин, а при ингибировании реакции метилирования им синтезируется деметилированное производное хлортетрациклина.
Другой способ получения антибиотиков состоит в использовании для их биосинтеза блокированных мутантов, у которых отсутствует (блокировано) определенное звено в цепи реакций, ведущих к синтезу антибиотика. Блокированные мутанты не способны образовывать нужный антибиотик. Используя низкую субстратную специфичность ферментов вторичного метаболизма и вводя аналоги предшественников антибиотика, последние переводят в аналоги самого антибиотика в ходе процесса, известного как мутационный биосинтез, или мутасинтез:
Так, мутанты Nocardia mediterranei, у которых нарушена способность к ацилированию, образуют аналог предшественника рифамицина В-рифамицин SV, который служит исходным веществом для получения многих синтетических рифамицинов (препараты для лечения туберкулеза и проказы).
Особенно успешны разработки в области биосинтеза полусинтетических пенициллинов и цефалоспоринов. Получение новых более эффективных аналогов пенициллина основано на изменении природы его ацильной группировки при сохранении в неизменном виде ядра пенициллина – 6-аминопенициллановой кислоты (6-АПК). В промышленности 6-АПК получают путем гидролиза природных пенициллинов с помощью специфического фермента – пенициллинацилазы, образующейся с высоким выходом в процессе ферментации ряда штаммов микроорганизмов. Ацилазы различают по их субстратной специфичности. Некоторые из ацилаз способны катализировать и обратные реакции – процессы ацилирования аминогруппы 6-АПК с образованием модифицированного пенициллина. Таким путем было получено более 40 000 полусинтетических пенициллинов. Существенно, что во многих случаях 6-АПК не выделяют из культуральной жидкости, например при превращении бензилпенициллина в ампициллин:
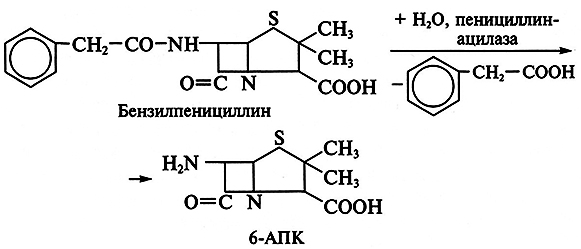
Бензилпенициллин гидролизуют ацилазой мутанта Kluyvera citrophila при рН 7,8–8,0 и температуре 40–50 °С. Затем в ферментер вносят мутант Pseudomonas melanogenum и фенилглицин. Условия ферментации изменяют таким образом (рН 5,0–5,5), чтобы ацилаза второго мутантного организма осуществляла синтез ампициллина:
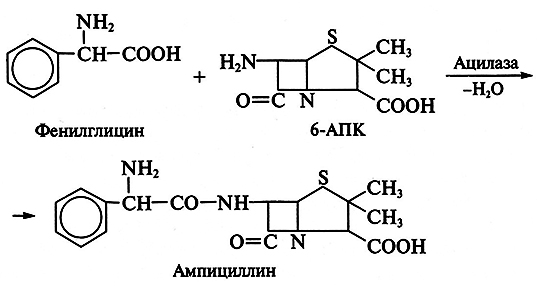
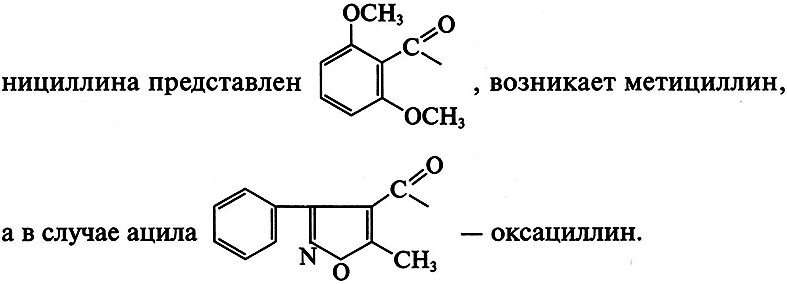
Замена ацильного остатка приводит к синтезу других полусинтетических антибиотиков.

Антибиотики продуцируются плесневыми грибами, актиномицетами, эубактериями и другими микроорганизмами. Некоторые из этих организмов способны продуцировать большое количество антибиотиков. Так, 6 родов филаментозных грибов производят около 1 000 различных антибиотиков, в том числе пенициллин и цефалоспорин, а три рода актиномицетов – 3 000 антибиотиков. Среди актиномицетов наибольший вклад вносит род Streptomyces, один из видов которого – S. griseus синтезирует более 50 антибиотиков. В процессе образования антибиотиков задействовано значительное число генов. Массовая расшифровка первичной структуры геномов микроорганизмов показала, что эта величина равна 1–2%. Так, у Bacillus subtilis число таких генов достигает 2 %, что обеспечивает микроорганизму большие возможности для защиты и адаптации. С другой стороны, это обстоятельство затрудняет анализ путей биосинтеза антибиотиков и идентификацию отдельных мутаций, способных увеличить выход продукта. Тем не менее большинство известных в настоящее время высокопродуктивных штаммов продуцентов антибиотиков получено традиционными методами мутагенеза и селекции.
Биосинтез антибиотиков, как и любых других вторичных метаболитов, возрастает в фазе замедленного роста клеточной популяции (конец трофофазы) и достигает максимума в стационарной фазе (идиофазе). Считают, что в конце трофофазы изменяется энзиматический статус клеток, появляются индукторы вторичного метаболизма, освобождающие гены вторичного метаболизма из-под влияния катаболитной репрессии. Поэтому любые механизмы, тормозящие клеточную пролиферацию и активный рост, стрессовые ситуации, активируют процесс образования антибиотиков.
Процесс культивирования идиолитов проходит две фазы (двустепенчатое культивирование). На первой фазе происходит накопление достаточного количества биомассы, которая выращивается на среде для роста микроорганизма. Эта фаза должна быть быстрой, а питательная среда дешевой. На второй фазе осуществляются запуск и активный синтез антибиотика. На этой фазе ферментацию ведут на продуктивной среде.
Образование антибиотиков регулируется условиями культивирования микроорганизмов. Поэтому оптимизация питательной среды является главным фактором в повышении выхода продукта.
Интенсивному биосинтезу антибиотика способствует уменьшение в культуральной среде легкоусвояемых источников углерода и азота (глюкозы, фруктозы, сахарозы, солей аммония). Использование в качестве компонентов питательных сред медленно утилизирующихся углеводов и белков (крахмала, лактозы, соевой и хлопковой муки, белково-витаминных концентратов и др.) повышает выход антибиотиков.
Специальные опыты показали, что выход цефалоспорина С уменьшается при переходе от использования в качестве источника углерода сахарозы к быстро усвояемому углеводу глюкозе. Наиболее оптимальной средой для образования антибиотика культурой Streptomyces antibioticus оказалась смесь 0,1 % глюкозы и 1 % галактозы. При таком соотношении моносахаридов глюкоза быстро утилизируется и микроорганизм переключается на усвоение галактозы, что и инициирует идиофазу. Высокая концентрация в среде фосфатов также непригодна для биосинтеза антибиотиков. Этот факт объясняется возрастанием в клетке содержания макроэргических соединений, что способствует повышению скорости роста продуцентов.
Многие антибиотики берут свое начало от промежуточных соединений обмена первичных метаболитов, поэтому их биосинтез регулируется путем ретроингибирования. Так, биосинтез пенициллина культурой гриба Penicillium chrysogenum контролируется по принципу обратной связи L-лизином. Этот эффект объясняется тем, что биосинтез как пенициллина, так и лизина осуществляется через общий предшественник – а-аминоадипцновую кислоту (см. схему). Торможение лизином первого фермента биосинтеза – гомоцитратсинтазы – приводит к недостатку α-аминоадипиновой кислоты, что снижает выход антибиотика.
Добавление в питательную среду α-аминоадипиновой кислоты предотвращает ингибирующий эффект лизина и активирует биосинтез пенициллина в отсутствие лизина. Кроме ретроингибирования биосинтез многих антибиотиков тормозится высокими концентрациями своих же антибиотиков. Следует отметить, что в процессе эволюции микроорганизмы выработали механизмы защиты от действия собственных антибиотиков. Эта проблема успешно решается в результате использования иммобилизованных ферментов.
Большинство антибиотиков получают при глубинной аэробной ферментации периодического действия в асептических условиях. Период ферментации длится 7–10 суток. В последние годы внедряются полунепрерывные и непрерывные процессы ферментации. С помощью методов генетической инженерии удалось решить проблему увеличения эффективности использования кислорода культурой Streptomyces. В клетки микроорганизма был введен ген гемсодержащего белка аэробной бактерии Vitreoscilla. В результате трансформированные клетки S. coelicolor, растущие на среде с низким содержанием кислорода, синтезировали в 10 раз больше антибиотика актинородина в сравнении с нетрансформированными клетками. Технология завершающих стадий процесса определяется природой антибиотика, характером производства и целями дальнейшего использования антибиотиков. Для медицинских целей технология выделения и очистки имеет особое значение. Обычно она включает сложные многоступенчатые комбинации различных операций: экстракцию антибиотиков подходящими растворителями, осаждение и перекристаллизацию их из разных сред, фракционирование на ионообменных смолах, лиофильную и распылительную сушку готовых препаратов (рис. 3.6). Антибиотики выделяют или в виде сравнительно неочищенных препаратов (натриевая соль пенициллина), или в виде высокоочищенных веществ (прокаиновая соль пенициллина), предназначенных для клинического использования. Выход антибиотиков обычно составляет несколько десятков граммов на 1 л.
Рис. 3.6. Технологическая схема производства пенициллина (по B.Atkinson, F.Mavituna, 1983)
В последние годы, несмотря на трудности, связанные с необходимостью одновременного клонирования группы генов, которые обычно задействованы в биосинтезе одного антибиотика, достигнуты определенные успехи в получении новых антибиотиков генно-инженерными методами. Например, разработаны технологии переноса в клетки Е. coli кластеров генов биосинтеза антибиотиков турбомицина А и В из некультивированных клеток. Перемещая те или иные участки ДНК и манипулируя таким образом доменами одного фермента (поликетидсинтазы), получены два новых ароматических поликетидных антибиотика.
3.4.2. Получение промышленно важных стероидов
Способность клеток микроорганизмов к сложнейшим процессам биотрансформации наиболее полно реализовалась при получении промышленно важных стероидов. Использование абсолютной субстратной специфичности и стереоспецифичности биологических катализаторов, присущих целым клеткам микроорганизмов, позволило разработать условия осуществления множества химических реакций для структурных перестроек стероидов. В результате были получены новые соединения с лучшими фармакологическими свойствами. Биотрансформация стероидов обычно заключается в селективном воздействии на одно из положений стероидного скелета. Первый промышленный процесс микробной биотрансформации стероидов основывался на технологии направленного гидроксилирования (11-α-гидроксилирование) прогестерона:
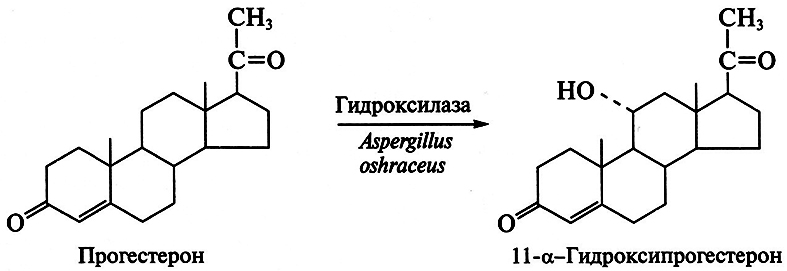
Значимость разработанной микробной трансформации определяется тем, что процессы гидроксилирования кортикостерона и его производных лежат в основе промышленного получения многих ценных продуктов: противовоспалительных и противоопухолевых препаратов, транквилизаторов, анестизирующих средств, половых гормонов и пр.
Так, производство в промышленном масштабе важнейшего противовоспалительного препарата – преднизолона – осуществляется путем микробного гидроксилирования кортикостерона (см. схему).
Правильность преобразования стероидного субстрата контролируют, сочетая химический подход со специфичностью биологической системы. Например, образование уксуснокислого эфира по С-17 субстрата стереохимически препятствует другим побочным реакциям.
Важнейший источник стероидных гормонов – культура клеток растений. Так, культура клеток диоскореи дельтовидной (Dioscorea deltoidea) корневого происхождения продуцирует фитостерин диосгенин и его гликозидные производные (сапонины).
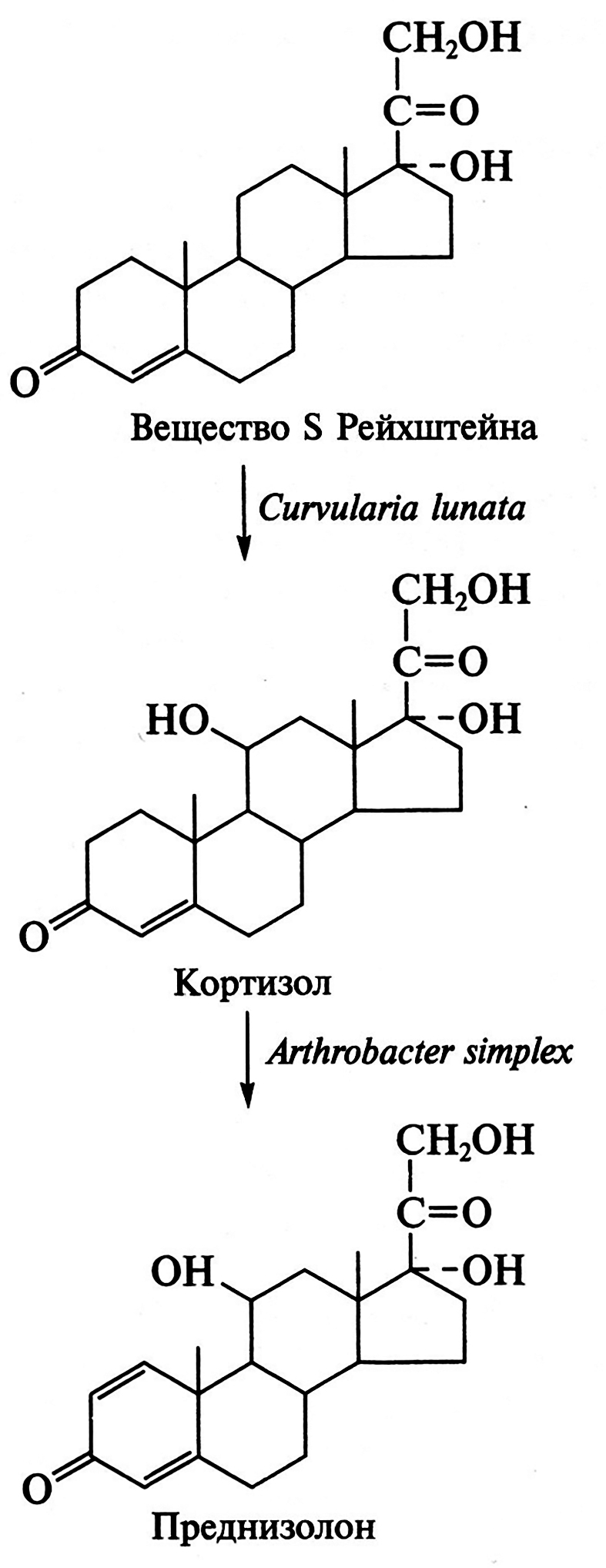
Существенно, что способность к сверхсинтезу фуростаноловых гликозидов ряда штаммов диоскореи, например штамма ДМ-ОГ, стабильно поддерживалась в течение 27 лет (Р. Г. Бутенко, 1999). Таким образом, культивирование клеток растений in vitro представляет собой новое решение проблемы промышленного получения вторичных метаболитов.
Дальнейшие успехи в производстве стероидных препаратов связывают с применением иммобилизованных клеток, использованием оптимального сочетания биологических и химических превращений, а также с совершенствованием технологии очистки получаемых соединений. Среды для биотрансформации имеют достаточно сложный состав, а реакция требует строгого контроля за каждым ее параметром (рН, время и т.д.). Так, среда для осуществления реакции окисления кортизола в преднизолон культурой клеток Arthrobacter simplex включает пептон, глюкозу и кукурузный экстракт. Через сутки к смеси добавляют вещество S Рейхштейна. Процесс ведут строго в нейтральной среде при температуре 28 °С в течение 120 ч. Выход преднизолона составляет 93 %.
Разработка крупномасштабного производства преднизолона путем биотрансформации стероидов позволила снизить стоимость этого препарата в 200 раз.
Применение генно-инженерных подходов позволило оптимизировать процесс получения стероидов. Создан штамм Saccharomyces cerevisiae, способный синтезировать гидрокортизон при росте на глюкозе. В процессе конструирования штамма в клетки дрожжей были перенесены 6 генов животных, 2 гена человека и 2 гена растений. Созданный штамм дрожжей способен синтезировать до 17 г/л стероидов, из которых 70 % составляет гидрокортизон. Разработанный способ представляет собой пример одного из наиболее сложных случаев метаболической инженерии, организованной в микроорганизме de novo.

