Генетическая инженерия – ветвь молекулярной генетики, исследующая возможности и способы создания лабораторным путем (in vitro) генетических структур и наследственно измененных организмов, т.е. создания искусственных генетических программ, с помощью которых направленно конструируются молекулярные генетические системы вне организма с последующим их введением в живой организм. Обычно употребляют два названия данного научного направления – генетическая инженерия и генная инженерия, являющиеся как бы синонимами. Однако их смысловое содержание неодинаково: генетическую инженерию связывают с генетикой, а генная имеет отношение только к генам. Кроме того, генетическая инженерия точнее раскрывает содержание дисциплины – создание генетических программ, основная задача которых – создание in vitro молекул ДНК посредством соединения фрагментов ДНК, которые в естественных условиях чаще не сочетаются благодаря межвидовым барьерам (рекомбинантные ДНК). Молекула реюомбинантной ДНК представляет собой соединенные в бесклеточной системе два компонента: вектор, обеспечивающий механизм репликации и экспрессии, и фрагмент клонируемой (чужеродной) ДНК, содержащий интересующие исследователя генетические элементы.
Согласно определению национальных институтов здоровья США, рекомбинантными ДНК называют молекулы ДНК, полученные вне живой клетки путем соединения природных или синтетических фрагментов ДНК с молекулами, способными реплицироваться в клетке.
5.1. ИСТОРИЯ РАЗВИТИЯ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ
Генетическая инженерия возникла на стыке многих биологических дисциплин: молекулярной генетики, энзимологии, биохимии нуклеиновых кислот и др. Первая рекомбинантная ДНК получена в 1972 г. (П. Бергом с сотр.) и была составлена из фрагмента ДНК обезьяньего вируса ОВ40 и бактериофага l dvgal с галактозным опероном Е. coli. Формально 1972 г. следует считать датой рождения генетической инженерии.
Таблица 5.1. Основные этапы развития генетической инженерии
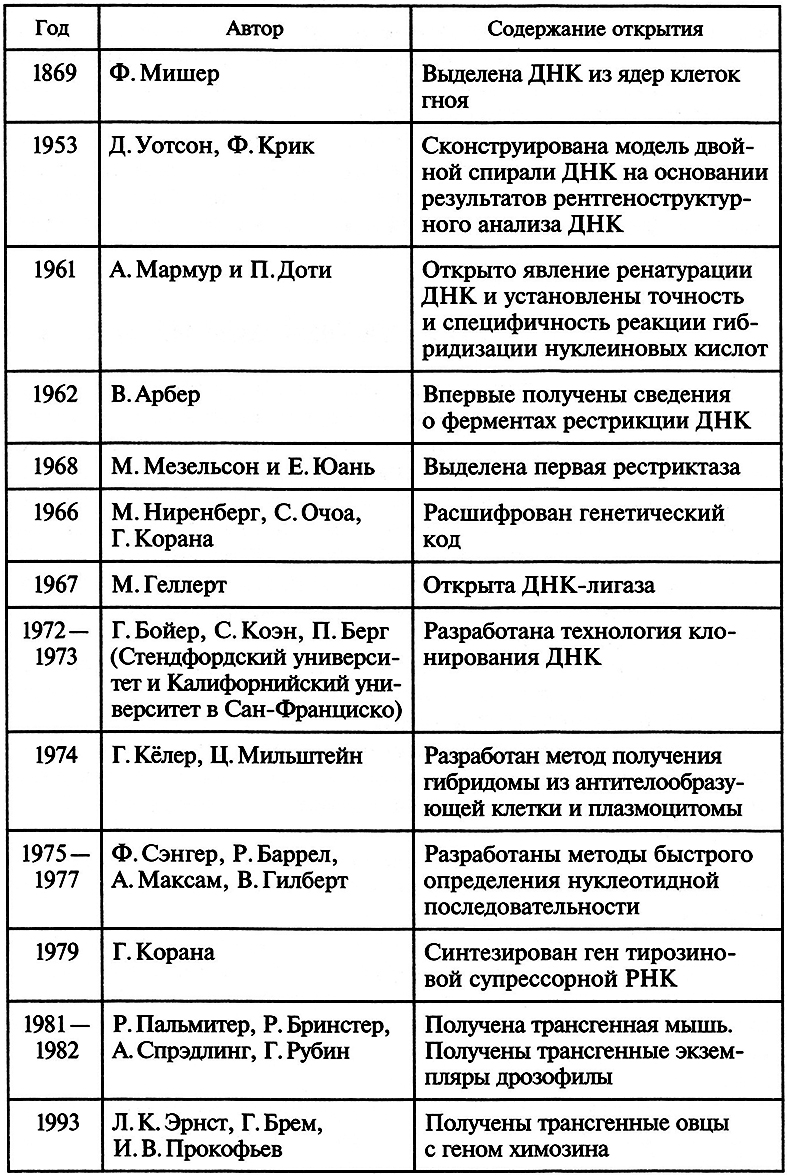
Генетическая инженерия имеет яркую историю благодаря тому общественному резонансу, который она вызвала с самых первых своих шагов. Начало этим событиям положило послание участников Гордоновской конференции (1973) президиуму АН США, в котором говорилось о возможной опасности технологий рекомбинантных ДНК для здоровья человека. Возможные блага генетической инженерии признавались с самого начала, но разногласия по данной проблеме не затихли и сейчас. В табл. 5.1 перечислены основные этапы становления и развития генетической инженерии.
5.2. БИОТЕХНОЛОГИЯ РЕКОМБИНАНТНЫХ ДНК
Технология рекомбинантных ДНК включает набор как новых методов, так и заимствованных из других дисциплин, в частности из генетики микроорганизмов. Эти методы существенно расширяют возможности генетических исследований. Используя технологию рекомбинантных ДНК, получают даже минорные клеточные белки в больших количествах и проводят тонкие биохимические исследования структуры и функций белков, а также осуществляют детальный химический анализ генетического материала. К наиболее важным методам биотехнологии рекомбинантных ДНК относят следующие:
1. Специфическое расщепление ДНК рестрикцирующими нуклеазами, что в значительной степени ускоряет выделение различных генов и манипуляции с ними.
2. Быстрое секвенирование всех нуклеотидов в очищенном фрагменте ДНК, позволяющее определить точные границы гена и кодируемую им аминокислотную последовательность полипептида.
3. Гибридизация нуклеиновых кислот, позволяющая с большой точностью выявить специфические нуклеотидные последовательности на основе их способности связывать комплементарные основания.
4. Клонирование ДНК, суть которого сводится к введению ДНК-фрагмента в самореплицирующийся генетический аппарат (плазмиду или вирус), который используют для трансформации бактерий. Бактериальная клетка после трансформации способна воспроизводить этот фрагмент во многих миллионах идентичных копий.
5. Генетическая инженерия, позволяющая получать модифицированные версии генов и затем внедрять их в клетки или организмы.
Технология рекомбинантных ДНК оказала существенное воздействие на всю клеточную биологию, позволяя решать такие задачи, как определение строения и функций не только белков, но и индивидуальных доменов, а также расшифровывать механизмы регуляции экспрессии генов, получать многие белки, участвующие в регуляции обменных процессов, клеточной пролиферации и развитии организма.
Расщепление ДНК в специфических участках нуклеотидных последовательностей осуществляется особыми ферментами рестрикцирующими нуклеазами, способными разрушить чужеродную ДНК. Все ферменты условно можно разделить на следующие группы:
1) используемые для получения фрагментов ДНК;
2) синтезирующие фрагменты ДНК на матрице РНК;
3) соединяющие фрагменты ДНК;
4) позволяющие осуществить изменение структуры концов фрагментов ДНК;
5) применяемые для приготовления гибридизационных проб.
Каждый фермент, способный разрушить чужеродную ДНК, опознает в ней специфическую последовательность из 4–6 нуклеотидов. Соответствующие последовательности в геноме бактерий замаскированы метилированием остатков с помощью метилаз.
Согласно номенклатуре, предложенной X. Смитом и Д. Натансоном, название рестриктазы складывается из трех букв: первая обозначает родовое название, две последующие – первые буквы вида. Например, фермент из Е. coli обозначают как Есо или из Haemophilus influenzae – Hin и т.д. Типовая или штаммовар идентификация следует за родовидовой, например, EcoRI или Hindlll и т. д. В настоящее время различные фирмы выпускают более 100 разнообразных ферментов, опознающих различные последовательности нуклеотидов. Для каждого конкретного фермента они различаются по длине, первичной структуре и способу разрыва молекулы ДНК. Подавляющее большинство ферментов разрывает только двунитевую ДНК с образованием серии фрагментов, называемых рестрикционными (или рестриктами,) с тупыми либо липкими концами (рис. 5.1).
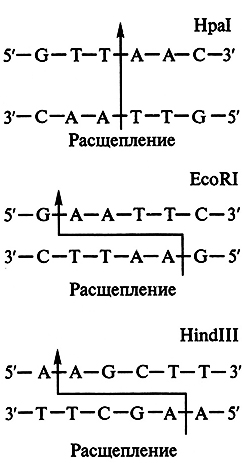
Рис. 5.1. Участки узнавания ДНК тремя рестриктазами из Haemophilus parainfluenzae (Hpal);
Escherichia coli (EcoRI) и Haemophilus influenzae (Hindlll)
Многие рестриктазы вносят разрывы в две цепи ДНК со смещением на несколько нуклеотидов и образованием на концах фрагментов коротких одноцепочечных участков. Они способны образовывать комплементарные пары оснований с любым другим одноцепочечным участком, полученным с помощью того же фермента («липкие» концы). Липкие концы позволяют легко соединить два любых фрагмента ДНК в одно целое. Полученный фрагмент ДНК (любого происхождения) можно встроить в очищенную ДНК плазмиды или бактериального вируса.
Сравнение размеров фрагментов ДНК после обработки соответствующего участка генома набором рестриктаз позволяет построить рестрикционную карту, отражающую расположение определенной последовательности нуклеотидов в данном участке. Сравнением таких карт можно оценить степень гомологии между отдельными генами (участками) без определения их нуклеотидной последовательности. Рестрикционные карты важны для клонирования ДНК, решения эволюционных и филогенетических задач.
Для успешного решения задач генетической инженерии очень важно быстро секвенировать (определить последовательность нуклеотидов) любые очищенные фрагменты ДНК. В настоящее время объем информации о последовательностях ДНК столь велик, что для хранения и анализа данных о фрагментах, целых геномах необходимы новые технологии и компьютерная техника.
В биотехнологии рекомбинантных ДНК обычно используют два различных метода секвенирования ДНК: химический и ферментативный. Оба метода чрезвычайно надежны, быстры в исполнении и результативны. Результаты секвенирования позволяют также на основе генетического кода определить аминокислотную последовательность белка в соответствии с нуклеотидной последовательностью в соответствующем гене.
На рис. 5.2 представлена схема химического метода секвенирования ДНК. Исходный фрагмент ДНК, меченный 32Р по 5'-концу, подвергается специфическому расщеплению по определенному нуклеотиду (например, А), в результате чего образуются радиоактивные фрагменты разной длины, которые разделяются по размерам при гель-электрофорезе, а радиоактивные из них выявляются с помощью радиоавтографии.
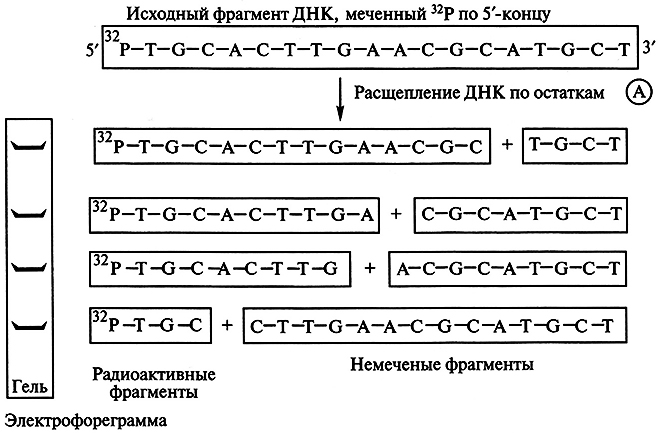
Рис. 5.2. Схема получения семейства меченных по 5'-концу фрагментов ДНК
в результате расщепления по определенному нуклеотиду (X)
Обычно химическая процедура расщепления ДНК выполняется одновременно для четырех одинаковых проб ДНК с использованием химических агентов, расщепляющих ДНК по отдельным нуклеотидам (Т, С, G и А). Полученные образцы подвергают элекгрофорезу на параллельных дорожках одного геля, и по его результатам можно определить нуклеотидную последовательность ДНК (рис. 5.3).
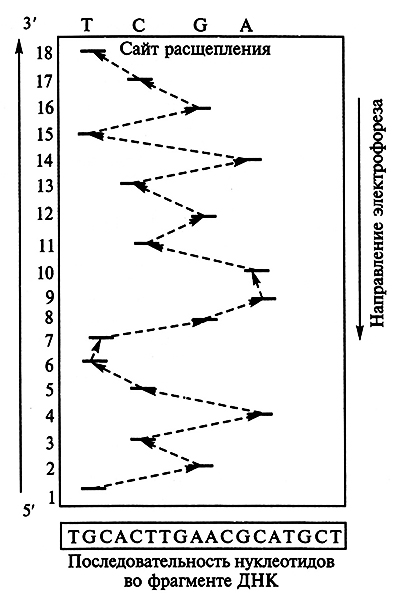
Рис. 5.3. Схема электрофореграммы, полученной с помощью химического метода секвенирования ДНК
(первая снизу строка соответствует нуклеотиду на 5'-конце и является нуклеотидом Т
на уровне первой дорожки. Для определения полной последовательности
(отмечено пунктиром) проводят анализ послойно всех дорожек)
Ферментативный метод секвенирования основан на энзиматическом введении нуклеотида, терминирующего полинуклеогидную цепь (рис. 5.4). В этом случае обычно используют дидезоксирибонуклеозидтрифосфаты, в которых дезоксирибоза-З'-ОН, представленная в нормальных нуклеотидах, отсутствует. Такой модифицированный нуклеотид, внедряясь в цепь ДНК с помощью ДНК-полимеразы, блокирует присоединение следующего нуклеотида. Синтез in vitro молекулы ДНК в присутствии затравки (праймера) и небольшого количества одного из таких модифицированных нуклеотидов приводит к образованию фрагментов ДНК в виде «лесенки». Если для получения таких фрагментов применять меченую ДНК (обычно проводят четыре реакции синтеза с использованием различных нуклеотидов, терминирующих цепь), а электрофоретический анализ проводить на четырех дорожках геля, то можно определить последовательность нуклеотидов. В настоящее время используют модифицированный метод, сводящийся к флуоресцентному анализу наборов фрагментов ДНК в процессе движения по одной дорожке геля.
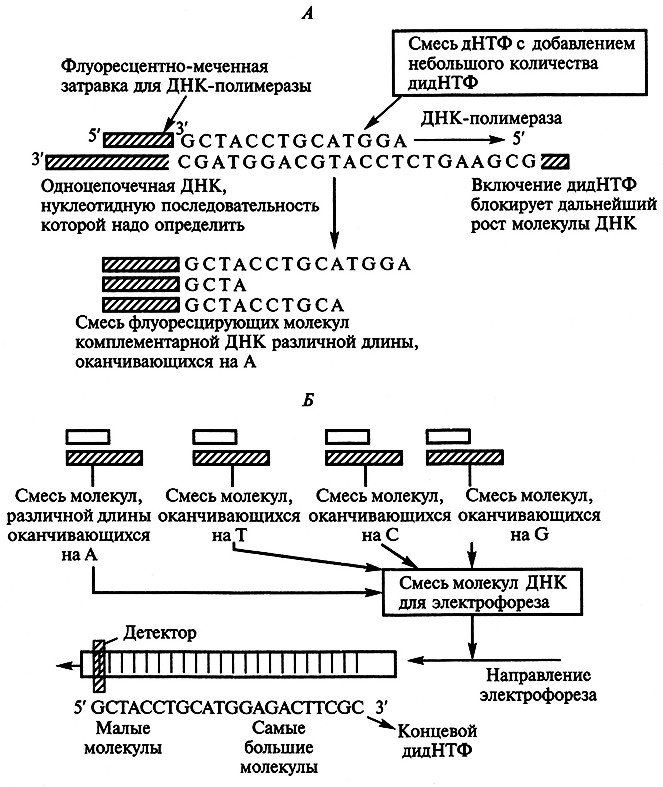
Рис. 5.4. Схема энзиматического метода секвенирования нуклеиновых кислот,
основанного на энзиматическом введении нуклеотида, терминирующего цепь:
А – синтез in vitro в присутствии затравки с образованием «лесенки» фрагментов;
Б – инкубация четырех различно окрашенных флуоресцирующих затравок в смеси нуклеотидов
с добавлением различных дидНТФ, прекращающих рост цепи (A,T,C,G)
Важнейший метод получения рекомбинантных ДНК основан на способности нуклеиновых кислот быстро восстанавливать свою структуру после нагревания до 100 °С в сильно щелочной среде (рН 13). При нагревании до 100 °С комплементарные пары оснований разрушаются и ДНК диссоциирует на две раздельные цепи. Этот процесс назван денатурацией ДНК («плавлением»). Выдерживание комплементарных цепей при температуре 65 °С приводит к их спариванию и восстановлению структуры двойной спирали (гибридизация, ренатурация, или «отжиг»). Это свойство ДНК широко используют в химической систематике, а также для решения эволюционных и филогенетических проблем.
Скорость восстановления (ренатурации) двойной спирали зависит от вероятности столкновения двух комплементарных нуклеотидных последовательностей и их концентрации в растворе. Скорость реакции гибридизации можно использовать для определения концентрации любых последовательностей РНК или ДНК в смеси, содержащей и другие фрагменты нуклеиновых кислот. Для этого необходимо иметь чистый одноцепочечный фрагмент ДНК, комплементарный к тому фрагменту, который надлежит выявить. Обычно фрагмент ДНК, полученный клонированием либо химическим путем, метят по 32Р в целях прослеживания включения фрагмента в состав дуплексов при гибридизации. Одноцепочечную молекулу ДНК, используемую в данном методе в качестве меченого индикатора, называют ДНК-зондом. Размеры его варьируют от нескольких десятков до нескольких сотен и тысяч нуклеотидов. Реакция гибридизации с использованием ДНК-зондов позволяет идентифицировать нуклеотидные последовательности в очень низкой концентрации и тем самым определять, какое количество копий последовательности ДНК, комплементарной ДНК-зонду, присутствует в геноме клетки.
ДНК-зонды применяют для поиска родственных генов; в реакциях гибридизации с РНК – для выявления экспрессии данного гена в различных клетках. Для выявления молекул нуклеиновых кислот, комплементарных всему зонду (или его участку), ДНК-зонды часто сочетают с методом гель-электрофореза, что позволяет получать информацию о размерах гибридизируемых молекул ДНК. Эффективное использование современных приборов, способных автоматически синтезировать любые нуклеотидные последовательности за короткий промежуток времени, дало возможность перестраивать гены, что представляет собой один из важных аспектов генной инженерии. Обмен генами, а также введение в клетку гена другого вида организма осуществляют посредством генетической рекомбинации in vitro. Этот подход был разработан на бактериях, в частности на Е. coli. Он основан на важном свойстве ДНК – способности к перестройкам, изменяющим комбинацию генов в геноме и их экспрессию. Такая уникальная способность ДНК позволяет приспосабливаться данному виду к изменяющейся среде. Генетическую рекомбинацию подразделяют на два больших класса: общую рекомбинацию и сайт-специфическую рекомбинацию. В процессе общей рекомбинации генетический обмен в ДНК происходит между гомологичными нуклеотидными последовательностями, например между двумя копиями одной и той же хромосомы в процессе мейоза (кроссинговера), или при скрещивании и перегруппировке генов у бактерий.
В процессе сайт-специфической рекомбинации в обмен вступают короткие специфические нуклеотидные последовательности одной и той же или обеих спиралей ДНК, распознаваемые особым сайт-специфическим ферментом, что приводит к трансформации распределения нуклеотидных последовательностей в геноме. Любые комплементарные взаимодействия между двумя гомологичными спиралями ДНК возможны лишь тогда, когда в одной из двух цепей происходит разрыв. К числу факторов, вызывающих такие одноцепочечные разрывы, относят химические агенты, некоторые виды излучения, специфические белки. Например, у Е. coli обнаружен белок гес BCD, который вызывает в молекулах ДНК одноцепочечные разрывы. Белок гес BCD представляет собой ДНК-зависимую АТРазу, которая действует как ДНК-хеликаза, перемещающаяся по спирали ДНК и вызывающая ее расплетение. Под влиянием этого белка, обладающего нуклеазной и хеликазной активностью, на двойной спирали ДНК возникает разрыв с образованием одноцепочечного участка «ус» (whisker) (рис. 5.5).
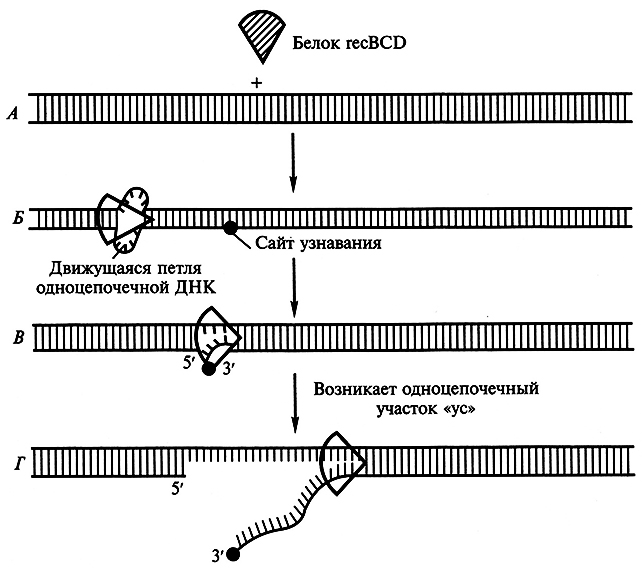
Рис. 5.5. Схема процесса общей рекомбинации с участием белка recBCD у Е. coli:
А – двойная спираль ДНК; Б – присоединение к двойной спирали белка гее BCD
с последующим его перемещением;
В – возникновение разрыва в сайте узнавания; Г – образование одноцепочечного участка «ус»
Белок гес BCD присоединяется к двойной спирали ДНК с одного конца (5') и со скоростью около 300 нуклеотидов в секунду движется вдоль спирали ДНК за счет гидролиза АТР. Одновременно с белком движется и возникшая петля ДНК. Когда петля на спирали достигает участка, называемого сайтом узнавания (recognition site), одна из цепей разрывается с освобождением небольшого одноцепочечного участка «ус». Возникший «ус» инициирует дальнейшую генетическую рекомбинацию.
В процессе общей генетической рекомбинации центральная роль отводится комплементарным взаимодействиям нуклеотидных последовательностей. Кроме того, этот процесс требует участия особого белка гесА с Mr, равной 38 кДа. Белок гесА прочно свяывается в виде крупных кластеров с одиночными цепями ДНК, одновременно удерживая и двойную спираль. За счет двух сайтов данный белок имеет еще один участок – для связывания и гидролиза АТР, т.е. он представляет собой ДНК-зависимую АТРазу. Благодаря особенностям белка гесА осуществляются одноцепочечный обмен между двумя двойными спиралями (рис. 5.6) с удалением некоторого количества нуклеотидов и локальный ресинтез ДНК.
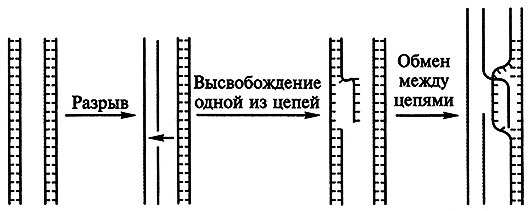
Рис. 5.6. Схема начального одноцепочечного обмена между двумя гомологичными
двойными спиралями ДНК в процессе общей рекомбинации
Разрыв в одной из цепей ДНК высвобождает эту цепь, и она внедряется во вторую спираль, образуя короткий спаренный участок. После начального обмена гомологичные нуклеотидные последовательности двух взаимодействующих спиралей устанавливаются в строгом соответствии одна с другой, в связи с чем происходит расширение области спаривания и быстрый обмен между спиралями. Для этого процесса разные организмы используют неодинаковые механизмы, большинство из которых включает в качестве промежуточного этапа обмен с перекрещиванием цепей между двумя спиралями ДНК (рис. 5.7).
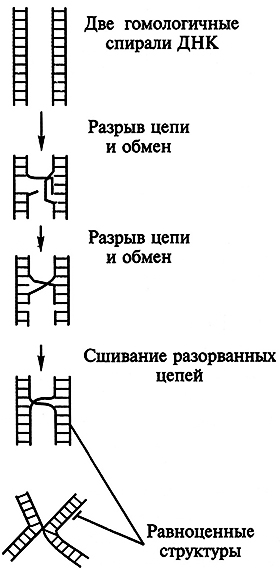
Рис. 5.7. Схема образования структуры с перекрещиванием цепей между двумя спиралями ДНК
Структура, образующаяся при обмене с перекрещиванием цепей, содержит две перекрещенные и две неперекрещенные цепи. Она способна существовать в различных изомерных формах. Изомеризация меняет положение двух пар цепей: две ранее перекрещивающиеся цепи становятся неперекрещивающимися и наоборот.
Для того чтобы восстановились две отдельные спирали ДНК и тем самым прекратился процесс спаривания, в каждой из двух перекрещенных цепей должен произойти разрыв (рис. 5.8).
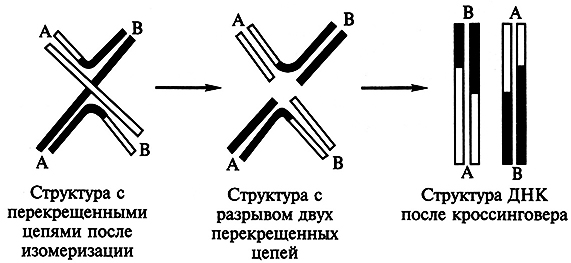
Рис. 5.8. Схема генетического обмена между двумя гомологичными спиралями ДНК без кроссинговера
В случае изомеризации одной из цепей (поворота на 180°) разрыв перекрещенных цепей дает две кроссоверные хромосомы (рис. 5.9).
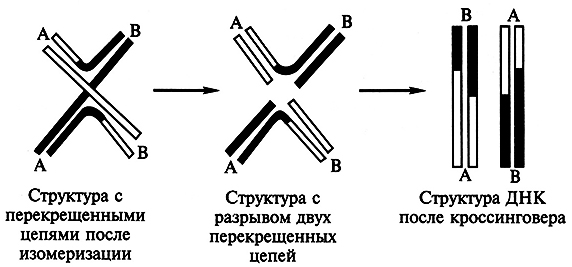
Рис. 5.9. Схема образования молекулы ДНК после изомеризации перекрещенных цепей и кроссинговера
5.3. КОНСТРУИРОВАНИЕ РЕКОМБИНАНТНОЙ ДНК
Сущность генетической инженерии сводится к целенаправленному конструированию генетических систем вне организма с последующим введением их в живой организм. При этом рекомбинантные ДНК становятся составной частью генетического аппарата реципиентного организма и, кроме того, они привносят в него новые генетические и физиолого-биохимические свойства, полезные для человека. К числу таких свойств можно отнести синтез аминокислот и белков, гормонов, ферментов, витаминов и др.
Один из важных этапов конструирования молекулы ДНК – лигирование (или сшивание) генов с помощью фермента ДНК-лигазы. Сшивание фрагментов ДНК, содержащих нужные гены, осуществляют двумя основными методами: а) по «липким» концам; б) с помощью искусственно достроенных «липких» концов.
Сшивание генов (фрагментов) ДНК по «липким» концам, т.е. взаимнокомплементарным участкам, длиной из 4 –6 пар нуклеотидов, достаточно легко осуществляется ферментом ДНК-лигазой с образованием ковалентной фосфодиэфирной связи между соседними нуклеотидами:
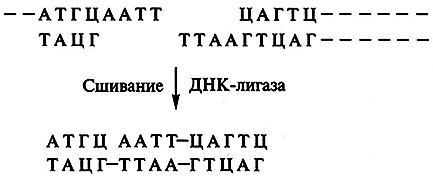
При отсутствии комплементарных «липких» концов у сшиваемых фрагментов их достраивают, т. е. синтезируют искусственно ферментативным путем. Для этой цели применяют так называемые линкеры (или «переходники») – короткие участки ДНК, имеющие разные «липкие» концы:

Линкерные фрагменты не только обеспечивают объединение генов, но и обусловливают их экспрессию, в связи с чем часто в середину линкера помещают какой-либо регуляторный генетический элемент, например промотор, или участок связывания с рибосомой.
Возможно сшивание фрагментов и по тупым концам, когда концы фрагментов двунитевые:
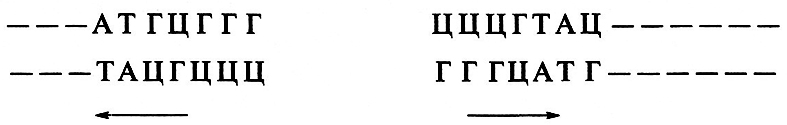
В этом случае реакция лигирования имеет биохимические особенности и ее эффективность ниже, чем при сшивке по «липким» концам.
После того как рекомбинантная ДНК сшита, ее вводят в живые клетки. Но поскольку она не способна к самовоспроизведению, ее разрушают внутриклеточные нуклеазы. Для того чтобы рекомбинантная ДНК стала составной частью генетического аппарата клетки, она должна либо встроиться (интегрироваться) в ее геном и реплицироваться за его счет, либо быть способной к автономной репликации. Принято молекулы ДНК, способные акцептировать чужеродную ДНК и автономно реплицироваться, называть векторными молекулами. К числу векторов относят плазмиды, бактериофаги, вирусы животных. Векторы должны обладать следующими особенностями:
1) иметь субстратные участки для определенных эндонуклеаз рестрикции;
2) иметь свойства репликона;
3) содержать один или несколько маркерных генов, которые после проникновения вектора в клетку придают ей фенотип, свидетельствующий о присутствии вектора.
В частности, для бактериальных векторов в качестве маркерных генов чаще всего используются гены, вызывающие устойчивость клеток к некоторым антибиотикам.
Таким образом, все векторы обеспечивают репликацию встроенных генов, их экспрессию, интеграцию в хромосому клетки и т.д. Чаще других в генетической инженерии в качестве векторов используют плазмиды. Плазмидами называют бактериальные репликоны (внехромосомные элементы наследственности), стабильно наследуемые. Они представляют собой двуцепочечные кольцевые молекулы ДНК с вариабельными молекулярными массами. По размеру они соответствуют 1–3 % генома бактериальной клетки. Так, молекулярная масса одной из самых мелких плазмид, найденных у Е. coli, составляет 1,5 МДа, а клетки псевдомонад содержат плазмиды с Мг около 300 МДа, что составляет 15 % от Mr хромосом этих бактерий. Плазмиды разделяют на конъюгативные, способные сами перенестись в реципиентные клетки с помощью конъюгации, и неконъюгативные, не обладающие этим свойством. Они детерминируют разные свойства: резистентность к антибиотикам (R-плазмиды); биодеградацию (D-плазмиды) и др. Например, плазмиды стафилококков несут гены устойчивости к пенициллину, соединениям ртути и др. Гены устойчивости к тяжелым металлам обнаружены также в составе R-плазмид Е. coli. Плазмиды могут управлять синтезом инсектицида в клетках Bacillus thuringiensis. F-плазмида Е. coli или FP-плазмиды псевдомонад являются половыми факторами. Плазмида pS101 с Мг 5,8 МДа несет ген устойчивости к тетрациклину (селективный маркер). У различных микроорганизмов – Е. coli, Salmonella, Bacillus, Saccharomyces обнаружены Col-плазмиды, обеспечивающие синтез разных колицинов – высокоспецифических антибиотиков, подавляющих жизнедеятельность других штаммов микроорганизмов того же вида или родственных видов. Количество плазмид в клетке может колебаться от одной до более ста. В целом чем крупнее плазмида, тем меньше количество ее копий в клетке.
Первый плазмидный вектор был получен С.Коэном (1973). Его источником была плазмида Е. coli R.6–5 с Мг 65 кДа. Плазмида стала родоначальником серии векторов и других структур. Особое место в генетическом манипулировании занимает плазмида, относящаяся к группе колициногенных плазмид Е. coli. ColEl реплицируется независимо от хромосомы и присутствует в количестве примерно 24 копий на клетку. Ее широко используют благодаря селективному маркеру в качестве вектора для клонирования фрагментов про- и эукариотической ДНК в Е. coli.
Плазмида Co1E1 (Mr 4,2 МДа) применяется для клонирования EcoRI-фрагментов. При этом интеграция чужеродного фрагмента в участок узнавания EcoRI ведет к фенотипическому изменению клетки, прекращению синтеза колицина с сохранением иммунности к нему. Этот признак используют при отборе рекомбинантных трансформантов.
Плазмида pBR313 содержит уникальные участки расщеплений нескольких рестриктаз: EcoRI, Hindlll, BamHI, Sail, Xmal и Hpal. Конструируя рекомбинантную ДНК, в эти участки можно встраивать фрагменты чужеродной ДНК, полученные с помощью соответствующих рестриктаз. На рис. 5.10 изображена схема расположения генов в плазмиде pBR322. Плазмида pBR322 содержит два гена, программирующих устойчивость к двум различным антибиотикам – тетрациклину (ген tet) и ампициллину (ген Ыа). В гене tet находятся уникальные участки расщепления рестриктазами Hindlll, BamHI и Sail, а в гене Ыа – участок расщепления Pstl. Если разрезать плазмиду любой из рестриктаз, участок расщепления которой находится в гене tet, и соединить ее методом «липких» концов с чужеродным фрагментом ДНК, то в полученной рекомбинантной молекуле останется нетронутым только ген Ыа, а ген tet утрачивает свою активность, так как его целостность нарушается вставкой. Напротив, при разрезании плазмиды рестриктазой PstI и внедрении в этот участок фрагмента ДНК инактивируется ген Ыа, тогда как ген tet продолжает кодировать белок, обеспечивающий устойчивость Е. coli к тетрациклину. Плазмидные векторы в настоящее время чрезвычайно разнообразны за счет следующих свойств:
- уменьшения размеров плазмиды вследствие изъятия участков, не обязательных для репликации (чем больше плазмида содержит уникальных участков узнавания для рестриктаз, тем она универсальнее);
- гибридизации векторов одного рода с другими векторами или природными плазмидами (например, получены гибридные векторы комбинацией плазмиды и фага l; при этом вновь сконструированная рекомбинантная ДНК должна сохранить репликационные свойства исходной плазмиды;
- использования новых плазмид; применения транспозонов;
- создания векторов с генетическими маркерами, позволяющими вести отбор рекомбинантных клонов.
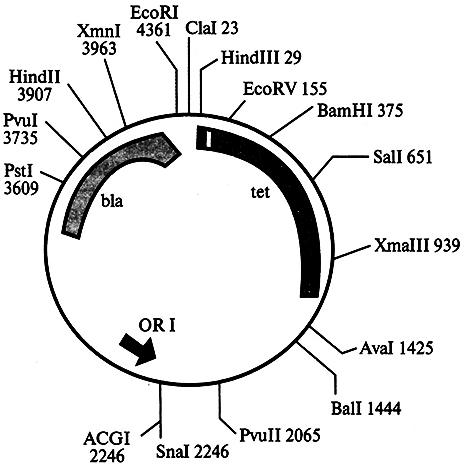
Рис. 5.10. Схема строения плазмиды pBR322
Эукариотические вирусы до сих пор нашли более скромное применение в качестве векторов. Практически используются только онкогенный вирус SV 40 и его производные. Все эти векторы – дефектные вирусы, не способные давать полноценные вирусные частицы в клетке хозяина. Анализируемую ДНК можно вводить и в другие репликоны, способные размножаться в клетках, например бактериофаги. Чаще всего из известных фагов в качестве векторов применяют сконструированные производные фага l и фагов М13 и fd. В векторах на основе бактериофага X используется его особенность, состоящая в том, что большая часть его ДНК не участвует в размножении фага в клетке. Это позволяет вводить чужеродную ДНК в ДНК фага l в качестве вектора.
Фаг М13 – это одноцепочечная циклическая ДНК длиной около 6 500 нуклеотидов. После инфицирования бактериальной клетки одноцепочечная ДНК фага превращается в двуцепочечную репликативную форму (RF), которая подобна плазмиде. Фаговая ДНК содержит, кроме того, короткий участок из 500 нуклеотидов, названный как МП (межгенная последовательность), не существенный для ее жизнедеятельности. Именно в этот участок МП репликативной формы ДНК после расщепления ее с помощью лигазы вставляют чужеродную ДНК. Введение рекомбинантной двуцепочечной молекулы в клетку Е. coli приводит к ее репликации, синтезу (+) цепи, упаковке последней в белковый чехол и выделению фага в среду. Инфицированная нитевидным фагом клетка продолжает делиться, выделяя в окружающую среду большое количество фага. Этот фаг содержит в вирионе одноцепочечную циклическую ДНК, в которую встроена одна из цепей чужеродной ДНК.
Векторные плазмиды и векторные вирусы со встроенными чужеродными генами часто называют гибридными (или химерными) плазм и дам и (или фагами).
Одним из типов гибридных векторов служат космиды (Cos-сайт), которые, используя плазмидный тип репликации, обладают способностью упаковываться in vitro в оболочки частиц фага. Космида содержит принадлежащие плазмидной ДНК уникальные эндонуклеазные сайты и селективные маркеры, объединенные с сегментом ДНК фага за счет «липких» концов. Примером может служить космида, сконструированная на основе фага l и плазмиды EcoRI. Cos-сегменты фага l получают путем расщепления конкатемерной ДНК фага (конкатемер – предшественник упаковки вирусной ДНК в зрелые фаговые частицы) соответствующими эндонуклеазами. Эти сегменты включают в плазмидный вектор. Большинство космидных векторов для клонирования способны включать вставки ДНК размером до 45 тыс. п.н. Реципиентные клетки-хозяева более эффективно инфицируются космидами, чем при использовании плазмидной ДНК. Ha 1 мкг ДНК с Cos-сайтами можно получить от 1 • 104 до 5 • 105 колоний трансформированных клеток. В клетке-хозяине старая ДНК трансформируется и сохраняется в виде плазмиды.
Другой представитель гибридных векторов – фазмиды. Это дуплексные молекулы ДНК, у которых концы представляют собой сайты фага l, содержащие гены, необходимые для осуществления лизиса клетки, а средняя часть является линеаризованной плазмидой. В фазмидах полностью сохранены функции репликации как фага, так и плазмиды. Фазмида содержит несколько тандемных повторов сегмента плазмиды для обеспечивания успешной упаковки ДНК и замены в ней вставок в процессе конструирования рек-молекул. Фазмидные ДНК упаковываются in vitro перед инфекцией. В клетке-хозяине фазмида реплицируется как фаговая ДНК. При наличии в векторной молекуле гена, кодирующего репрессор фага l, фазмида реплицируется как плазмида. Примечательно, если ген кодирует мутантный белок cl, инактивирующийся при повышенной температуре, то фазмида способна реплицироваться как плазмида при низкой температуре и как фаг при повышении температуры до 42 °С.
Векторы на основе плазмид и фагов способны реплицироваться в клетках разных хозяев в отличие от обычных плазм ид и бактериофагов, эволюционирующих синхронно с природными «хозяевами». Реплицирование с использованием гибридного вектора осуществить значительно проще в клетках как природного, так и альтернативного хозяина. Челночные векторы содержат две области ДНК, соответствующие каждому из двух видов хозяев, а также гены, необходимые для репликации и не поставляемые клетками хозяина. Число векторов, сконструированных с помощью технологии рекомбинантных ДНК, довольно велико. Одни из таких векторов способны действовать попеременно в клетках двух разных видов прокариот, другие – как в прокариотической (чаще E.coli), так и в эукариотической клетке (дрожжевых, растительных, животных).
После конструирования рекомбинантные ДНК с помощью трансформации вводят в реципиентный организм: бактериальную, грибную, растительную или животную клетку. Трансформация предусматривает предварительную обработку клеток соединениями, обусловливающими проникновение ДНК внутрь клеток с последующим их помещением в среду, в которой способны существовать только клетки, получившие векторную молекулу, например в среду с определенным антибиотиком.
Процесс инфицирования клеток с помощью чужеродных ДНК, приводящий к образованию зрелого фагового потомства, назван трансфекцией.
Практически общий способ трансформации и трансфекции основан на том, что при обработке клеток бактерий СаС12 их мембрана становится проницаемой для ДНК. Однако эффективность проникновения экзогенной ДНК в клетку довольно низка. Поэтому среди бактерий, подвергшихся трансформации, только небольшая часть оказывается трансфррмированной. Отделение ее от общей массы осуществляется в процессе клонирования. Для клонирования бактериальную суспензию определенной концентрации выливают на твердую питательную среду, например на агар с питательными добавками, в чашки Петри из расчета 5–10 бактерий на 1 см2 поверхности. Бактериальная клетка на поверхности агара начинает делиться с образованием в итоге маленькой колонии, похожей на шляпку гриба. Эта колония называется клоном, причем из каждой клетки образуется свой клон, все клетки которого имеют свойства бактерии-родоначальника.
Отбор бактерий-трансформантов можно продемонстрировать, используя плазмиду pBR322 (см. рис. 5.10), содержащую два гена устойчивости к тетрациклину и ампициллину. Для отбора этих бактерий в агар добавляют антибиотик – или ампициллин, или тетрациклин в зависимости от того, какой из генов (Ыа или tet) остался интактным после введения чужеродной ДНК. На такой среде клоны образуют клетки только с плазмидами. Для отделения рекомбинантных бактерий часть материала каждого клона переносят на другую чашку Петри, содержащую антибиотик, ген устойчивости к которому был разрушен при создании рекомбинантов. На этих чашках Петри дают клоны только те бактерии, которые содержат исходную плазмиду, а рекомбинантные бактерии их не образуют. Такая тщательная селекция клонов по устойчивости к антибиотику позволяет идентифицировать рекомбинантные клоны. При поиске рекомбинантных клонов успешно применяют метод авторадиографии.
Рекомбинантные клоны могут быть идентифицированы и по синтезируемому ими продукту. Но чаще приходится идентифицировать непосредственно нуклеотидную вставку с использованием методов гибридизации. С этой целью бактериальные колонии выращивают на нитроцеллюлозных фильтрах, помещенных на чашку Петри с питательной средой. Далее приготовляют реплики: к фильтру с исходными колониями прижимают свежий нитроцеллюлозный фильтр, который затем переносят на чашку Петри с плотной питательной средой, где образуются колонии, идентичные первым.
Затем фильтр-реплику подвергают щелочной обработке, при этом клетки в колониях лизируют и денатурированная ДНК из клеток связывается с нитроцеллюлозой в том участке, где была расположена соответствующая колония. При радиоактивной ДНК или РНК (меченной 32Р или 125J) выдерживание фильтра в растворе, содержащем радиоактивный полинуклеотид, приводит к гибридизации с комплементарными последовательностями. В итоге те участки фильтра, в которых находились рекомбинантные клоны с требуемой вставкой, оказываются радиоактивными и идентифицируются радиоавтографически.
5.4. ЭКСПРЕССИЯ ЧУЖЕРОДНЫХ ГЕНОВ
Эффективность функционирования бактериальных генов неодинакова, что обусловливает вариабельность концентрации отдельных белков в зависимости от их функций. Такие вариации белков, например у Е. coli, обусловлены системой контроля генной экспрессии, осуществляемой в основном на уровне транскрипции ДНК, и зависят от количества синтезируемой на данном гене мРНК и активности фермента РНК-полимеразы. Порядок в чередовании нуклеотидных последовательностей в промоторном участке структурного гена определяет степень активности РНК-полимеразы и инициацию процесса транскрипции. Бактериальные гены, включенные в геном, как правило, экспрессируются достаточно легко, давая мРНК и белок в силу того, что в сигнальных последовательностях, управляющих процессами транскрипции и трансляции у различных прокариотических организмов, много общих черт. Что касается экспрессии генов эукариот в бактериях, то она происходит крайне редко, если не создавать специальные условия, поскольку регуляторные участки эукариот отличны от таковых у бактерий. Регуляторные (сигнальные) участки не узнаются бактериальными РНК-полимеразами, что приводит к замедлению транскрипции. При клонировании геномной ДНК эукариотической клетки экспрессия генов не происходит из-за отсутствия у бактерий системы сплайсинга. Следовательно, для экспрессии эукариотических генов в клетках прокариот необходимо, чтобы данные гены находились под контролем прокариотических регуляторных элементов. В связи с этим для осуществления экспрессии эукариотического гена соответствующая кДНК (или синтетическая ДНК), содержащая кодирующую последовательность, в составе векторной молекулы (например, плазмиды) присоединяется к регуляторным элементам бактерии-промотора, оператору и рибосом-связывающему участку.
Таким образом, в сконструированных промежуточных рекомбинантных ДНК эукариотический ген будет находиться под контролем бактериальных регуляторных элементов. Целесообразнее встраивать ген в подходящий вектор для экспрессии, который уже содержит регуляторные элементы, способствующие активной экспрессии встроенного гена после введения рекомбинантной плазмиды в бактериальную клетку. Например, к таким эффективным регуляторным участкам принадлежит промотор гена Р-лактамазы (ген устойчивости к ампициллину, входящий в состав плазмиды pBR322). Промотор гена Р-лактамазы нерегулируемый, а использование таких промоторов не всегда удобно, так как синтезированные белки в большом количестве могут блокировать рост бактерий. В связи с этим целесообразнее использовать регулируемые сильные промоторы, включить которые для синтеза чужеродного белка можно и в том случае, когда получена большая бактериальная масса. В частности, к числу регулируемых сильных промоторов следует отнести термочувствительный промотор pL, который ответствен за экспрессию нескольких генов бактериофага. Белок-репрессор, блокирующий данный промотор, активен при 31 °С, но неактивен при 38 °С, следовательно, при инкубировании бактерий при 31 °С чужеродный ген не экспрессируется и, наоборот, повышение температуры вызывает инактивацию репрессора и высокий уровень синтеза нужного белка.
Последовательность оснований длиной 6–8 нуклеотидов, расположенная непосредственно перед инициирующим кодоном АУГ у Е. coli, определяет эффективность процесса трансляции. Эта последовательность представляет собой участок связывания мРНК с рибосомой, и его сдвиг в ту или иную сторону способен уменьшать эффективность трансляции мРНК. По имени исследователей, идентифицировавших этот участок, он был назван последовательностью Шайн–Дальгарно. Обычно эту последовательность включают в состав самого вектора вместе с инициирующим кодоном на нужном расстоянии. При экспрессии векторов такого типа образуется гибридный белок, в котором несколько N-концевых аминокислотных остатков происходят от источника регуляторных элементов и инициирующего кодона прокариотического гена. Такие гибридные белки часто более стабильны; обработка их химическим или ферментативным способом приводит к выделению эукариотической части белка.
Суммарная активность экспрессируемого гена возрастает с ростом числа копий рекомбинантной ДНК в расчете на клетку. Используя многокопийные плазмиды, можно получить сверхсинтез нужных белковых продуктов. Получены температурно-чувствительные мутантные плазмиды, способные накопить до 1–2 тыс. копий на клетку без нарушения жизненно важных функций бактерий. Обычно же используемые плазмидные векторы поддерживаются в клетке в количестве 20–50 копий. Получение бактериальных штаммов-сверхпродуцентов плазмидных генов – одна из важнейших задач современной биотехнологии в экономическом, медицинском и социальном аспектах.
5.5. КЛОНИРОВАНИЕ И ЭКСПРЕССИЯ ГЕНОВ
В РАЗЛИЧНЫХ ОРГАНИЗМАХ
В настоящее время разработаны системы клонирования в бактериях, дрожжах, грибах, растениях и млекопитающих. Особый интерес с экономической точки зрения представляют системы клонирования генов в грамположительных бактериях, многие из которых являются сверхпродуцентами важнейших химических соединений. Значительных успехов в биоиндустрии удалось достичь с клетками Bacillus subtilis, стрептомицетами и Saccharomyces cerevisiae.
Векторы для клонирования в таких системах представляют собой двойные репликоны, способные существовать ив Е. coli, и в той клетке хозяина, для которой они предназначены. С этой целью создают гибридные векторы, содержащие репликон какой-либо из плазмид Е. coli и требуемый репликон (из бактерий, дрожжей и др.), и первоначально клонируют с последующим отбором требуемых генов в хорошо изученной системе. Затем выделенные рекомбинантные плазмиды вводят в новый организм. Такие векторы должны содержать ген (или гены), придающий клетке-хозяину легко тестируемый признак.
В. subtilis – непатогенный почвенный микроорганизм. Клеточная стенка бактерии имеет простую структуру, позволяющую секретировать многие белки в культуральную жидкость. В частности, 20 различных видов бактерий синтезируют более 40 ферментов с внеклеточной локализацией. В этих бациллах обнаружены плазмиды и фаги, генетика которых хорошо изучена. Клонирование осуществляется с помощью так называемых челночных векторов, которые способны реплицироваться в клетках нескольких хозяев: В. subtilis, Е. coli, Staphylococcus aureus. Векторы были получены комбинацией in vitro фрагментов плазмид St. aureus, Е. coli и хромосомных фрагментов В. subtilis. Полученные рекомбинантные штаммы несут признаки устойчивости к антибиотикам.
Стрептомицеты широко применяют в биотехнологии в качестве продуцентов антибиотиков. Конструирование векторов для клонирования в них началось с выделения плазмиды Scp2 из Streptomyces coelicolor. На основе этой плазмиды были сконструированы векторы, придающие стрептомицетам устойчивость к антибиотикам, например к метиленомицину А.
Клонирование в дрожжах
Среди дрожжей наиболее полно изучен вид S. cerevisiae. У этого вида в гаплоидных клетках содержится 17 хромосом, в их составе идентифицировано несколько сотен генов. Большинство штаммов дрожжей содержат автономно реплицирующуюся кольцевую ДНК длиной 2 мкм. Плазмида Scpl S. cerevisiae содержит около 6300 пар оснований и имеет 50–100 копий на клетку. Ее гибриды с плазмидами обычно и используют в качестве векторов. Работа с дрожжами облегчается тем, что подобно бактериям они могут расти в жидкой среде и давать колонии на твердой среде, а также имеют сравнительно короткое время регенерации (несколько часов) вследствие малого размера генома.
Процедура выделения ДНК в клетки дрожжей довольно проста. Обычно целлюлозную клеточную стенку удаляют обработкой ферментами, получая так называемые сферопласты. Их инкубируют с ДНК в присутствии СаС12и полиэтиленгликоля. Мембрана при этом становится проницаемой для ДНК. Дальнейшая инкубация сферопластов в среде с агаром восстанавливает клеточную стенку. Селекция дрожжевых клонов, трансформированных рекомбинантными плазмидами, основана на применении в качестве клеток-хозяев определенных мутантов, не способных расти на среде, в которой отсутствует тот или иной питательный компонент. Векторная плазмида содержит гены, которые при попадании в клетку-хозяина придают ей этот недостающий признак. Трансформанты легко отбираются по их способности давать колонии на обедненной среде. Применяя приемы, аналогичные использовавшимся при клонировании в бактериях, удается достичь синтеза чужеродных белков в дрожжевых клетках. Эти клетки подобно В. subtilis секретируют большое количество белка во внеклеточную среду, что используется также для секреции чужеродных белков, например интерферона человека.
Клонирование в клетках животных
Проблема введения генов в клетки млекопитающих очень важна для исследования функционирования генов высших эукариот.
Предварительно клонированные гены вводят в клетку животных различными путями. Суть одного из них состоит в трансформации клеток требуемым геном, соединенным с одним из генов, для которых осуществляется селекция. Для идентификации и последующего размножения клеток, содержащих интегрированную ДНК, был разработан метод, получивший название метода маркера. Примером может служить метод получения клеток, дефектных по синтезу фермента тимидинкиназы (ТК–-клетки). Такие клетки трансформировались фрагментами ДНК вируса герпеса (HSV), содержащего ген фермента ТК, и после трансформации они приобретали способность к синтезу фермента на селективной среде, т.е. становились ТК+-клетками. Клетки ТК+ легко отличаются от клеток ТК–, поскольку способны расти на средах с аминоптерином (ингибитор, блокирующий определенные стадии биосинтеза нуклеотидов), гипоксантином и тимидином. Следовательно, в данном случае для трансформации клеток животных были использованы гибриды бактериальных плазмид с геном ТК из вируса герпеса. Для этого предварительно проводили клонирование и идентификацию генов в клетках Е. coli и затем полученная рекомбинантная плазмида вводилась в ТК–-клетки. Анализ методом блот-гибридизации подтвердил, что выжившие клетки содержали интегрированный в геном ТК-ген вируса герпеса.
Селективные маркеры дают возможность вводить в клетки млекопитающих любой ген, заранее лигированный с клонированным селективным маркером.
В последние годы сконструировано большое количество так называемых челночных векторов и их рекомбинантных производных, способных к репликации в животной и бактериальной клетках, экспрессирующие клонируемый ген в животной клетке. К числу таких векторов можно отнести векторы из плазмиды pBR322 и интактного района транскрипции ДНК SW-40. Геном SW-40 представляет собой циклическую ДНК длиной 5243 п.о. Однако в вирусах животных размеры несущественных областей малы и в них нельзя внедрить большие фрагменты чужеродной ДНК, например ген дигидрофолатредуктазы мыши размером 42 kb. В большинстве случаев чужеродная ДНК замещает существенные гены, в результате чего рекомбинантные вирусы утрачивают способность к репликации. Для ее функционирования используют «вирусы-помощники», синтезирующие продукты недостающих генов, за счет которых и существует рекомбинантный вирус. Обычно опухолевые вирусы (в том числе SV-40) внедряют свою ДНК в хромосому клетки-хозяина и тем самым убивают ее при своем размножении. Обычно вирус бычьей папилломы в трансформированных клетках существует в виде эписомы (≈100 копий на клетку) и используется в качестве основы для конструирования эписомных векторов. Одна из важнейших задач генетической инженерии – разработка технологий по созданию векторов, подобных плазмидам, не убивающим клетку-хозяина и эффективно экспрессирующим клонируемый ген в животной клетке.
Представляют немаловажный интерес микроинъекции ДНК непосредственно в ядро клетки. Так, плазмиды, содержащие фрагмент вируса герпеса с геном тимидинкиназы, и плазмиды pBR322 были инъецированы в ТК–-клетки, при этом ТК-ген проник в ядра и нормально в них реплицировался.
Трансформация соматических клеток млекопитающих открывает возможность для изучения механизмов регуляции экспрессии генов и целенаправленно модифицировать генетический аппарат клетки животных, в том числе и человека. Культуры клеток млекопитающих могут быть эффективным источником выделения ряда вирусных антигенов с целью получения вакцин для животных и человека.
В настоящее время разработаны способы введения генов в эмбриональные клетки млекопитающих, мух и некоторых растений с целью изменения свойств организма, таких, как скорость роста, устойчивость к заболеваниям и внешним воздействиям. Подобного рода работы были начаты с довольно крупными яйцами амфибий, а затем продолжены с яйцеклетками и эмбрионами мыши. Микроинъекцию клонированных генов проводят в один или оба пронуклеуса только что оплодотворенной яйцеклетки мыши. После инъекции яйцеклетку немедленно имплантируют в яйцевод приемной матери или дают возможность развиваться в культуре до стадии бластоцисты, после чего имплантируют в матку. Таким образом были инъецированы гены интерферона и инсулина человека, ген глобина кролика, ген тимидинкиназного вируса герпеса и кДНК вируса лейкемии мышей. Выживает обычно от 10 до 30 % яйцеклеток, а доля мышей, родившихся из трансформированных яйцеклеток, составляет от нескольких до 40 %.
Выяснено, что уровень экспрессии чужеродного гена зависит от места интеграции ДНК с хромосомами, от дифференцировки тканей.
Несмотря на определенные успехи в области интеграции чужеродных генов в эмбриональные клетки животных, до сих пор не удалось встроить чужеродную ДНК в заданный участок хромосомы, вытеснить ген и заменить его новой нуклеотидной последовательностью, подчинить новый ген системе регуляции организма. Преодоление этих трудностей позволит успешно осуществлять генотерапию человека – лечение нескольких десятков генетических заболеваний, обусловленных отсутствием или дефектами генов.
5.6. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ
В ЖИВОТНОВОДСТВЕ
Применение методов генетической инженерии в животноводстве открывает перспективу изменения ряда свойств организма: повышение продуктивности, резистентности к заболеваниям, увеличение скорости роста, улучшение качества продукции и др. Животных, несущих в своем геноме рекомбинантный (чужеродный) ген, принято называть трансгенными, а ген, интегрированный в геном реципиента, – трансгеном. Продукт этого гена (белок) является трансгенным. Благодаря переносу генов у трансгенных животных возникают новые качества, а дальнейшая селекция позволяет закрепить их в потомстве и создавать трансгенные линии.
Получение трансгенных животных предусматривает ряд этапов: приготовление раствора ДНК для микроинъекции; извлечение эмбрионов из донорных организмов; микроинъекция ДНК и пересадка инъецированных эмбрионов в яйцеводы или после культивирования в матку синхронизированных реципиентов. У родившихся потомков исследуют экспрессию трансгена на уровне транскрипции и трансляции. Трансгенное потомство получают путем использования традиционных методов разведения животных. Следует отметить, что от приготовления инъекционного раствора ДНК (его чистоты, концентрации) во многом зависит эффективность получения трансгенных животных. Обычно гены транспортируют на ранних стадиях развития животного (в большинстве случаев на стадии зиготы и двухклеточных эмбрионов). Для трансформации генов в геном животного используют следующие приемы: микроинъекцию ДНК в пронуклеус зигот или в каждый бластомер у двухклеточного эмбриона; введение ДНК с помощью ретровирусных векторов; получение трансгенных химер из генетически трансформированных клеток и эмбрионов. В настоящее время наиболее распространенный метод – микроинъекция ДНК. Ее осуществляют с помощью специальной пипетки (внутренний диаметр ее около 1 мкм), а количество инъецированного раствора ДНК составляет 1–2 пкл. После инъекции ДНК эмбрионы культивируют до момента пересадки реципиентам. Следует отметить, что микроинъекция эмбрионов сельскохозяйственных животных значительно сложнее, чем микроинъекция эмбрионов мышей и кроликов.
После небольшого культивирования in vitro проинъецированные эмбрионы переносят в яйцеводы (хирургическим путем) реципиентов. Каждому реципиенту мыши, кролика и свиньи обычно пересаживают 20–30 инъецированных зигот, причем у свиней все эмбрионы трансплантируют в один яйцевод; у мышей и кроликов – раздельно по яйцеводам, а у овец, коз и крупного рогатого скота – по 2–4 эмбриона каждому реципиенту. Используя методы блот-анализа, дот-блот-анализа и полимеразную цепную реакцию (ПЦР), можно получить вполне надежные доказательства интеграции и экспрессии ДНК у трансгенных животных. С этой целью используют ядросодержащие клетки тканей или внутренних жидкостей реципиента, из которых выделяют ДНК.
Для исследования у трансгенных животных выделяют РНК из тех тканей, в которых предполагается наиболее высокий уровень экспрессии. Качественный и количественный анализы экзогенных белков позволяют судить об уровне трансляции инъецированного генного материала.
Генетический анализ родившихся трансгенных животных и полученного от них потомства показал, что, несмотря на инъекцию ДНК на ранних стадиях, в трансгенных линиях могут появляться так называемые мозаики. К мозаикам относят животных, происходящих из одной' зиготы, но имеющих разные генотипы. Помимо клеточных линий, содержащих трансген, они имеют еще и нетрансгенные клеточные линии. Подсчитано, что около 30 % первичных трансгенных животных, полученных методом микроинъекции ДНК, – мозаики, что затрудняет создание чистых трансгенных линий животных. Этим объясняется тот факт, что трансген не передается потомству с ожидаемой в соответствии с законами Менделя частотой 50 %. Часть мозаиков вообще не может дать начало трансгенным линиям, так как у них отсутствует передача трансгена по наследству.
Одна из важнейших задач сельскохозяйственной биотехнологии – выведение трансгенных животных с улучшенной продуктивностью и более высоким качеством продукции, резистентностью к болезням, а также создание так называемых животныхбиореакторов – продуцентов ценных биологически активных веществ. Каковы же успехи биотехнологии в этом направлении? С генетической точки зрения особый интерес представляют гены, кодирующие белки каскада гормона роста: непосредственно гормон роста (ГР), рилизинг-фактор (РФ) и инсулинподобный фактор (ИФ) гормона роста.
В конце 70-х годов XX в. на основе технологии рекомбинантной ДНК получили гормон роста микробного происхождения. Было показано, что этот ГР оказывает такое же стимулирующее действие на лактацию и рост животного, как и гипофизарный ГР. Гормон роста, полученный с помощью методов генетической инженерии, при крупномасштабном применении вызывал увеличение удоев на 23–31 % при дозе 13 мг в день. Разработаны формы препарата пролонгированного действия, позволяющие использовать его один раз в две недели и даже в месяц. При ежедневной инъекции ГР молодняку крупного рогатого скота, свиней и овец удалось увеличить суточные привесы на 20–30 % при значительном сокращении расхода кормов на единицу прироста. У молодняка свиней с ускорением роста увеличивалось содержание белка и уменьшалось содержание жира в тканях, что повышало качество мясопродуктов.
Первые трансгенные мыши с геном ГР были получены в 1982 г. У них отмечалось повышение скорости роста и увеличение конечной живой массы.
По данным Л.К. Эрнста (1996), у трансгенных свиней с геном рилизинг-фактора гормона роста (РФ ГР) конечная живая масса была на 15,7 % выше по сравнению с контрольными животными. У потомства трансгенных свиней, получавших модифицированный кормовой рацион с повышенным содержанием белка (18 % сырого протеина) и с дополнительным количеством лизина, отмечались более высокие среднесуточные привесы (на 16,5 %).
У трансгенных овец с генами ГР и РФ ГР, несмотря на повышенный уровень ГР, скорость роста не увеличивалась. Вместе с тем, по данным большинства исследователей, у трансгенных свиней наряду с повышением содержания белка наблюдалось двукратное уменьшение толщины шпика (7–8 мм у трансгенных против 18 – 20 мм у контрольных животных); аналогичные показатели отмечены у трансгенных овец (25–30 % жира у контрольных животных против 5–7% у трансгенных овец).
Рассматривается возможность уменьшения лактозы в молоке путем создания животных, у которых присутствует специфический для молочной железы промотор, соединенный с геном фермента р-галактозидазы, катализирующей распад лактозы. Молоко таких животных, не содержащее лактозы, могут использовать люди, у которых не синтезируется β-галактозидаза. Ведутся работы по введению генных конструкций в организм трансгенных животных, вырабатывающих антитела, предотвращающие маститы.
Другая важная задача – выведение трансгенных животных, устойчивых к заболеваниям. Потери в животноводстве, вызванные различными болезнями, достаточно велики, поэтому все более важное значение приобретает селекция животных по резистентности к болезням, вызываемых микроорганизмами, вирусами, паразитами и токсинами. Пока результаты селекции на устойчивость животных к различным заболеваниям невелики, но обнадеживающи. В частности, созданы популяции крупного рогатого скота с примесью крови зебу, устойчивые к некоторым кровепаразитарным заболеваниям. Установлено, что защитные механизмы от инфекционных заболеваний обусловлены либо препятствием вторжению возбудителя, либо изменением рецепторов. Вторжению возбудителей, равно как и их размножению, препятствуют в основном иммунная система организма и экспрессия генов главного комплекса гистосовместимости. Одним из примеров гена резистентности у мышей служит ген Мх. Этот ген, обнаруженный в модифицированной форме у всех видов млекопитающих, вырабатывает у Мх+-мышей иммунитет к вирусу гриппа А. Ген Мх+ был выделен, клонирован и использован для получения трансгенных свиней, экспрессирующих ген Мх на уровне РНК. Однако данные о трансляции Мх-протеина, обусловливающего устойчивость трансгенных свиней к вирусу гриппа А, пока не получены. Ведутся исследования в целях получения трансгенных животных, резистентных к маститу за счет повышения содержания белка лактоферина в тканях молочной железы. На культуре клеток из почек трансгенных кроликов было показано, что клеточные линии, содержащие трансгенную антисмысловую РНК, имели резистентность против аденовируса Н5 (Ad5) более высокую на 90–98 % по сравнению с контрольными линиями клеток. Л.К. Эрнст продемонстрировал также устойчивость трансгенных животных с геном антисмысловой РНК к лейкозу крупного рогатого скота, к заражению вирусом лейкоза.
Показана возможность конструирования системы внутриклеточной иммунизации против инфекционных вирусов с участием мутационных форм эндогенных вирусных белков, защищающих от соответствующих вирусов. Так, получены трансгенные куры, устойчивые к лейкозу, у которых в клетках присутствовал белок вирусной оболочки.
Одна из важнейших задач стратегии использования трансгенных животных в медицине – получение биологически активных соединений за счет включения в клетки организма генов, вызывающих у них синтез новых белков.
Трансгенные животные как продуценты ценных биологически активных белков и гормонов имеют ряд преимуществ перед микроорганизмами и клеточными системами. Важно, что новые белки, получаемые в линиях клеток трансгенных животных, могут быть модифицированы, их активность сравнима с активностью протеинов. Для молочного производства представляет большой интерес получение целенаправленной трансгенной экспрессии в эпителиальные клетки молочной железы с целью выхода белков с молоком. Один из основных этапов получения трансгенных животных, продуцирующих гетерогенный белок с молоком, – идентификация промотора, направляющего экспрессию структурных генов в секреторный эпителий молочной железы.
В настоящее время выделены гены и промоторы αS1-казеина, β-казеина, α-лактоальбумина, β-лактоглобулина и сывороточного кислого протеина (WAP). Молочная железа – великолепный продуцент чужеродных белков, которые можно получать из молока и использовать в фармацевтической промышленности. Из молока трансгенных животных извлекают следующие рекомбинантные белки: человеческий белок С, антигемофильный фактор IX, α-1-антитрипсин, тканевой плазменный активатор, лактоферин, сывороточный альбумин, интерлейкин-2, урокиназу и химозин. В большинстве проектов, за исключением α-1-антитрипсина и химозина, эти исследования пока еще на стадии разработки и ведутся в основном на трансгенных мышах, поэтому оценивать их с точки зрения коммерческого интереса еще рано.
Вышесказанное можно проиллюстрировать следующими примерами. В США осуществлен метод микроинъекции ДНК, отвечающий за экспрессию β-лактоглобулина, который способен продуцироваться только в молочных железах животных. В Эдинбурге в 1992 г. были выведены трансгенные овцы с геном α-1-антитрипсина человека и β-глобулиновым промотором. Содержание этого белка у разных трансгенных овец составляло от 1 до 35 г/л, что соответствует половине всех белков в молоке. При таком уровне продукции белка может быть получено около 10 кг трансгенного белка от одного животного в год, что достаточно для 50 пациентов при лечении эмфиземы легких. Обычно выход рекомбинантных белков в системах с использованием культуры клеток составляет около 200 мг/л, а у трансгенных животных он может повышаться до 1 л. Следует заметить, что создание клеточных культур и их выращивание в промышленных реакторах, а также выведение трансгенных животных и их обслуживание – дорогие и сложные процедуры. Однако трансгенные животные легко размножаются, содержание их сравнительно дешево, что делает этих животных хорошими продуцентами разнообразных белков с низкой стоимостью. В России группой ученых под руководством Л.К. Эрнста получены трансгенные овцы с геном химозина, в 1 л молока которых содержится 200–300 мг химозина – основного компонента для производства сыра. Стоимость его будет в несколько раз ниже продукта, получаемого традиционным способом из сычугов молочных телят и ягнят. Приведены данные, свидетельствующие о высокой эффективности производства сыра с использованием химозина молока трансгенных овец. Так, из 3 л молока трансгенной овцы можно получить достаточное количество химозина для производства 1 т сыра из коровьего молока.
5.7. ПОЛУЧЕНИЕ ИНСУЛИНА
НА ОСНОВЕ МЕТОДОВ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ
Инсулин – гормон поджелудочной железы, регулирующий углеводный обмен и поддерживающий нормальный уровень сахара в крови. Недостаток этого гормона в организме приводит к одному из тяжелейших заболеваний – сахарному диабету, который как причина смерти стоит на третьем месте после сердечнососудистых заболеваний и рака. Инсулин – небольшой глобулярный белок, содержащий 51 аминокислотный остаток и состоящий из двух полипептидных цепей, связанных между собой двумя дисульфид ными мостиками. Синтезируется он в виде одноцепочечного предшественника – препроинсулина, содержащего концевой сигнальный пептид (23 аминокислотных остатка) и 35-звенный соединительный пептид (С-пептид). При удалении сигнального пептида в клетке образуется проинсулин из 86 аминокислотных остатков, в котором А и В-цепи инсулина соединены С-пептидом, обеспечивающим им необходимую ориентацию при замыкании дисульфидных связей. После протеолитического отщепления С-пептида образуется инсулин.
Известно несколько форм сахарного диабета. Самая тяжелая форма, для лечения которой больному необходим инсулин (инсулинзависимая форма заболевания), вызвана избирательной гибелью клеток, синтезирующих этот гормон (клетки островков Лангерганса в поджелудочной железе). Форма сахарного диабета, для лечения которой инсулин не требуется, распространена чаще, с ней удается справляться с помощью соответствующих диет и режима. Обычно поджелудочная железа крупного рогатого скота и свиней не используется в мясной и консервной промышленности и поставляется в вагонах-рефрижераторах на фармацевтические предприятия, где проводят экстракцию гормона. Для получения 100 г кристаллического инсулина необходимо 800–1 000 кг исходного сырья.
Синтез обеих цепей и соединение их дисульфидными связями для получения инсулина были проведены в 1963 и 1965 гг. тремя коллективами исследователей в США, Китае и ФРГ. В 1980 г. датская компания «Ново индастри» разработала метод превращения инсулина свиньи в инсулин человека путем замещения 30-го остатка аланина в цепи В на остаток треонина. Оба инсулина не различались по активности и времени действия.
Работы по генно-инженерному получению инсулина начались около 20 лет назад. В 1978 г. появилось сообщение о получении штамма кишечной палочки, продуцирующего крысиный проинсулин (США). В этом же году были синтезированы отдельные цепи человеческого инсулина посредством экспрессии их синтетических генов в клетках Е. coli (рис. 5.11). Каждый из полученных синтетических генов подстраивался к 3'-концу гена фермента β-галакгозидазы и ввоился в векторную плазмиду (pBR322). Клетки Е. coli, трансформированные такими рекомбинантными плазм идами, производили гибридные (химерные) белки, состоящие из фрагмента β-галактозидазы и А или В пептида инсулина, присоединенного к ней через остаток метионина. При обработке химерного белка бромцианом пептид освобождается. Однако замыкание дисульфидных мостиков между образованными цепями инсулина происходило с трудом.
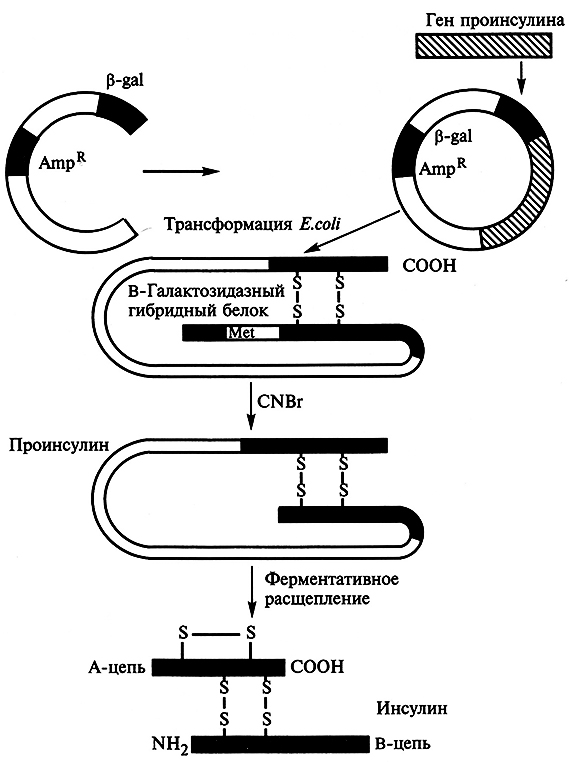
Рис. 5.11. Схема синтеза инсулина
В 1981 г. синтезирован ген-аналог проинсулина – мини-С-проинсулин, в котором 35-звенный С-пептид был заменен на сегмент из шести аминокислот: арг-арг-гли-сер-лиз-арг и показана его экспрессия в Е. coli.
В 1980 г. У.Гилберт с сотрудниками выделили мРНК инсулина из опухоли β-клеток поджелудочной железы крысы и с помощью обратной транскриптазы получили с нее кДНК Полученную кДНК встроили в плазмиду pBR322 Е. coli, в среднюю часть гена пенициллиназы. Рекомбинантная плазмида содержала информацию о структуре проинсулина. В результате трансляции мРНК в клетках синтезировался гибридный белок, содержащий последовательности пенициллиназы и проинсулина, который выщепляли из такого белка трипсином.
В 1978 г. сотрудниками Института биоорганической химии под руководством академика Ю.А. Овчинникова был осуществлен синтез двух структурных генов, кодирующих синтез нейропептидов: лейцин-энкефалина и брадикинина. Синтезированный ген лейцин-энкефалина имел два «липких» конца:

Полученный синтетический ген был встроен вместе с фрагментом природной ДНК, содержащим промотор и проксимальную часть гена белка β-галактозидазы кишечной палочки Е. coli, в плазмиду-вектор pBR322 и обработан смесью рестриктаз – EcoRI и BamHI. Полученная рекомбинантная плазмида рЕк была трансформирована в клетки Е. coli. В результате экспрессии встроенного гена бактерия начала продуцировать гибридный (химерный) белок, содержащий на N-конце участок β-галактозидазы, а на С-конце – последовательность нейропептида. С помощью бромциана химерный белок расщепляли in vitro и получали активный лейцин-энкефалин. На рис. 5.12 представлены схема клонирования синтетического гена лейцин-энкефалина и его экспрессия в клетках кишечной палочки.
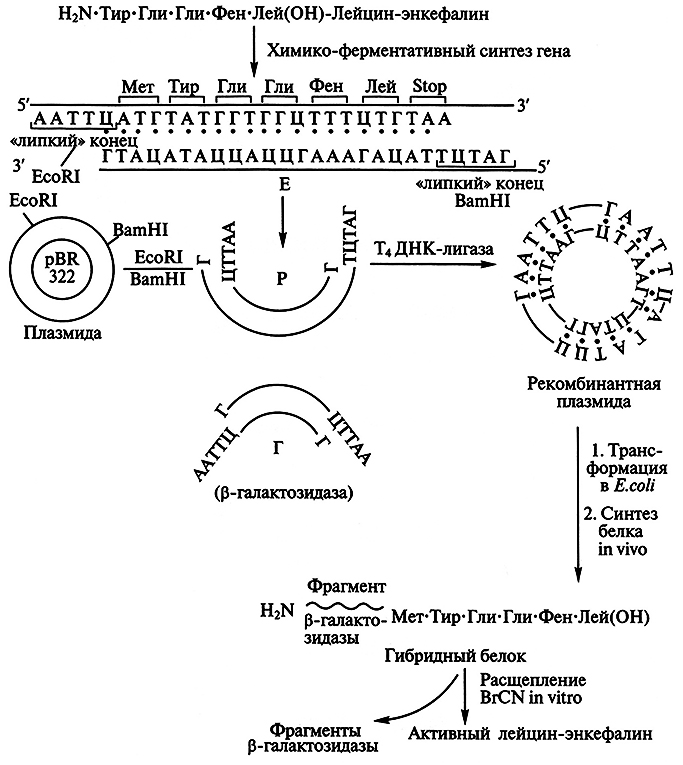
Рис. 5.12. Схема синтеза гибридного и активного лейцин-энкефалина
Аналогичным путем был синтезирован соматостатин – гормон гипоталамуса (рис. 5.13). Молекула соматостатина состоит из 14 аминокислотных остатков. Соматостатин подавляет выделение инсулина и гормона роста человека. В Национальном медицинском центре «Хоуп» (Калифорния) был осуществлен химико-ферментативный синтез гена длиной в 42 нуклеотида, способного кодировать соматостатин. Участок ДНК, кодирующий гормон соматостатин, получен путем соединения тринуклеотидов. Из 52 п.н. синтетического гена 42 пары составляли структурный ген гормона, а остальные служили для присоединения синтетического гена к плазмиде pBR322, а также к сегменту лакгозного оперона (lac) из генома Е. coli или к β-галактозидазному гену. Такую синтетическую чужеродную ДНК встраивали непосредственно за бактериальным геномом (или внутри его) после расщепления ДНК рестрикционными эндонуклеазами с образованием в результате трансляции гибридного белка.
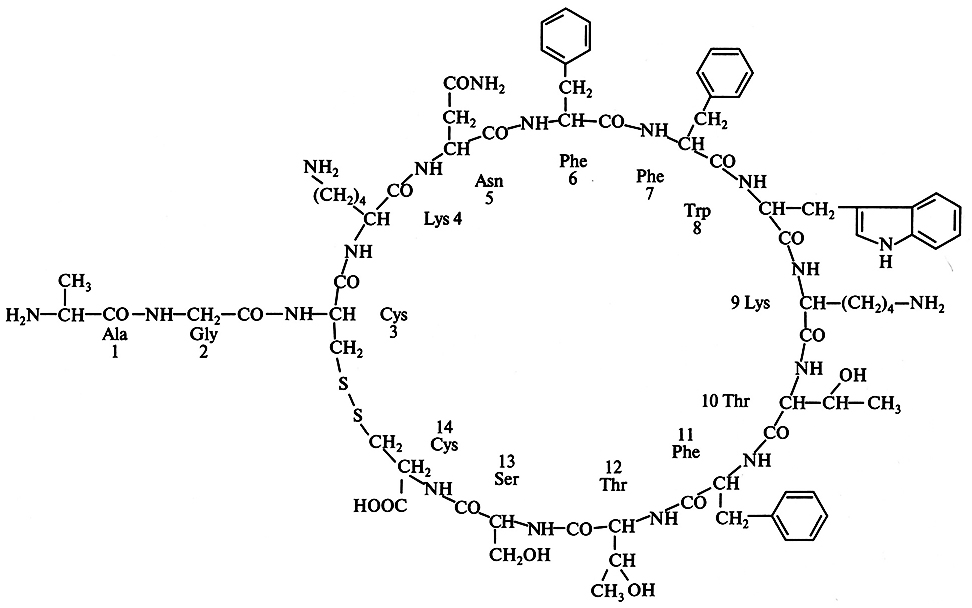
Рис. 5.13. Первичная структура молекулы соматостатина
Основные этапы генно-инженерного синтеза соматостатина показаны на рис. 5.14. Синтетический ген соматостатина был встроен в плазмиду pBR322 Е. coli вблизи конца гена, кодирующего фермент β- галактозидазу. Между двумя генами был помещен кодон метионина. После выделения рекомбинантной плазмиды в бактериальную клетку кишечная палочка стала синтезировать гибридный белок. Часть его (соматостатин) затем отщепляли от β-галактозидазы BrCN. Такой сложный способ получения гормона был необходим, поскольку соматостатин, синтезированный в виде свободных молекул, быстро деградирует под действием бактериальных протеаз. Первый синтез соматостатина генно-инженерным способом был осуществлен в 1977 г. А. Бойером. Выход гормона составил 10 000 молекул на одну клетку. Из 100 г биомассы Е. coli, выращенной в ферментере объемом 8 л, удалось выделить 5 мг соматостатина, т.е. столько, сколько можно его выделить из 100 г овечьих мозгов.
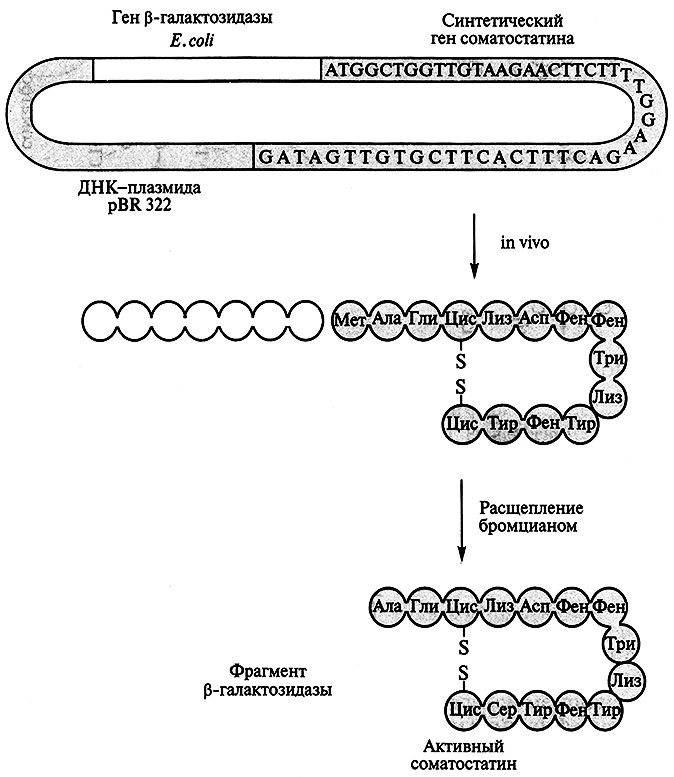
Рис. 5.14. Схема синтеза соматостатина в бактериальной системе
5.8. СИНТЕЗ СОМАТОТРОПИНА
Соматотропин (или гормон роста человека ГРЧ) секретируется передней долей гипофиза. Впервые он был выделен и очищен в 1963 г. из гипофиза. Его недостаток приводит к заболеванию – гипофизарной карликовости (1 случай на 5 000 человек). Гормон обладает видовой специфичностью. Обычно его получают из гипофиза трупов, но в недостаточном количестве. Гормона хватает лишь для лечения 1/3 случаев гипофизарной карликовости в развитых странах. Основные производители – Швеция, Италия, Швейцария и США. Молекула ГРЧ состоит из 191 аминокислотного остатка.
Препарат из трупного материала представляет собой смесь из нескольких форм, из которых пять имеют 22 кДа, другие являются димерами, а остальные – фрагментами, образующимися при протеолизе. Это приводило к тому, что у 30 % больных, получавших препарат, против гормона вырабатывались антитела, сводившие на нет его биологическую активность.
Принимая во внимание это обстоятельство, в настоящее время ГРЧ синтезируют методами генетической инженерии в специально сконструированных клетках бактерий. Будучи синтезированным в клетках Е. coli, ГРЧ содержит дополнительный остаток метионина на H2N-Komi;e молекулы. Биосинтез ГРЧ из 191 аминокислотного остатка был осуществлен в 1979 г. Д. Гедделем с сотрудниками. Сначала клонировали двунитевую кДНК; далее путем расщепления получали последовательность, кодирующую аминокислотный порядок гормона, за исключением первых 23 аминокислот – от фен (–NH2) до лей (23), и синтетический полинуклеотид, соответствующий аминокислотам от первой до двадцать третьей со стартовым ATG-кодоном в начале. Затем два фрагмента объединяли и подстраивали к паре lac-промоторов и участку связывания рибосом. Конечный выход гормона составил 2,4 мкг на 1 мл культуры, что составляет 100 000 молекул гормона на клетку. Полученный гормон на конце полипептидной цепи содержал дополнительный остаток метионина и обладал значительной биологической активностью. С 1984 г. после серьезных клинических испытаний на токсичность компанией «Генетек» (Сан-Франциско) было начато широкомасштабное производство бактериального соматотропина.
ГРЧ в клетках Е. coli и в культуре клеток животных был получен в 1982 г. одновременно в Институте Пастера (Париж) и Институте молекулярной биологии (Москва). Оказалось, что в бактериальных клетках возможен синтез аналогов ГРЧ, с помощью которых изучались участки молекулы, важные для стимулирования роста и процесса неоглюкогенеза на молекулярном уровне.
Огромный интерес представляют выделение и синтез полипептида, обладающего полной биологической активностью гипоталаминеского рилизинг-фактор а соматотропина (СТГ-РФ). Введение этого фактора способно компенсировать недостаток соматотропина. Таким образом, наличие СТГ-РФ и самого гормона, полученных в генетически сконструированных бактериальных клетках, очень важно для успешного лечения заболеваний, обусловленных недостатком этого гормона, и ряда патологических заболеваний, таких, как некоторые формы диабета, регенерация тканей после ожогов и др. Предполагаем, что СТГ-РФ можно использовать и для увеличения массы и роста домашних животных, так как он, не обладая видовой специфичностью, способен стимулировать освобождение гормона роста у ряда животных.
β-Эндорфин – опиат мозга, состоящий из 31 аминокислотного остатка, был синтезирован в генетически сконструированных клетках в 1980 г. группой ученых из Австралии и США. β-Эндорфин получен в клетках Е. coli в виде гибридного белка с β-галактоз идазой. Процедура синтеза β-эндорфина включала получение путем обратной транскрипции мРНК – кДНК, кодирующей белок-предшественник, содержащий помимо последовательности β-эндорфина последовательность АКТГ и β-липотропина (β-ЛТГ), в дальнейшем удаляемые. β-Эндорфин, полученный из гибридного белка и тщательно очищенный, обладал значительной биологической активностью. Он специфически взаимодействовал с антисывороткой против β-эндорфина. От β-эндорфина человека генно-инженерный β-эндорфин отличался по двум аминокислотам, и эти отличия можно было легко устранить на нуклеотидном уровне путем замены двух кодонов в ДНК бактериальной плазмиды.
5.9. ПОЛУЧЕНИЕ ИНТЕРФЕРОНОВ
Интерфероны были открыты в 1957 г. в Национальном институте медицинских исследований в Лондоне как факторы устойчивости к вирусной инфекции. Было установлено, что клетки животных, подвергнутые воздействию вируса, выделяют в среду фактор, способный придавать свежим клеткам устойчивость к вирусной инфекции: он как бы препятствовал (интерферировал) размножению вирусов в клетке и в силу этой способности был назван интерфероном.
Известны три группы интерферонов: а-интерфероны (α-И), образующиеся при воздействии вирусов на лейкоциты; β-интерфероны (β-И), появляющиеся при воздействии вирусов на фибробласты; γ-интерфероны, продуцируемые Т-лимфоцитами в ответ на воздействие бактериальными и вирусйыми антигенами или антисыворотками против поверхностных детерминант лимфоцитов.
Все интерфероны (кроме α-И) гликопротеины; они представляют собой типичные глобулярные белки, причем на долю α-спиральных структур приходится от 40 до 75 %. В α-И обнаружены две дисульфидные связи. Интерфероны – низкомолекулярные белки из 146–166 аминокислотных остатков; видоспецифичны.
К числу наиболее хорошо исследованных интерферонов человека следует отнести α-интерфероны; число генов, их кодирующих, примерно 20. γ-Интерферон в отличие от гетерогенного класса α- интерферонов представлен всего одним индивидуальным белком, который кодируется одним геном. Менее ясна ситуация в отношении β-интерферонов. Выделен только один белок, соответствующий β-интерферону человека, – интерферон β1 ему соответствует практически вся противовирусная активность, обнаруживаемая после индукции фибробластов. Не исключено, что в геноме существует ряд генов, кодирующих различные β-интерфероны. Интерфероны – это как бы первая линия обороны против инфекции.
Интерфероны широко используются для лечения различных тяжелых заболеваний – острого вирусного гепатита, рассеянного склероза, остеосаркомы, миеломы и некоторых видов лимфом. Их применяют и для лечения меланом, ряда опухолей гортани, легких и мозга.
С учетом видоспецифичности интерферонов, предназначенных для лечения, необходимы такие препараты, которые получены из клеток человека. Традиционно их извлекают из крови человека (из 1 л крови можно выделить всего 1 мкг интерферона, т.е. примерно одну дозу для инъекции). Долгое время большая часть мирового производства интерферонов осуществлялась в Финляндии (Хельсинки), а позже – во Франции. С 1980 г. одна из японских компаний наладила производство лимфобластоидного интерферона из лимфобластоидных клеток. С этой целью культура данных клеток индуцировалась вирусом сендай, после чего интерферон выделяли с помощью хроматографических колонок, заполненных моноклональными антителами против получаемого интерферона. В Швеции лимфобласты выращивали в ферментерах объемом 2 000 л; полученные интерфероны очищали с помощью моноклональных антител.
Из всех видов интерферонов для мирового производства наиболее пригоден Р-И. Фибробласты, получаемые из тканей плода, можно поддерживать в культуре клеток, что дает возможность массового производства. Метод получения Р-интерферона был разработан в Англии.
В целом вышеперечисленные методы получения интерферонов характеризуются низким выходом, высокой стоимостью и недостаточной чистотой препарата. На современном этапе наиболее перспективный метод – биосинтез интерферонов с помощью генетически сконструированных микроорганизмов. Однако использование генно-инженерных технологий для получения интерферонов человека сопряжено с рядом трудностей. Во-первых, в смеси мРНК, кодирующих различные белки, содержание кодирующих интерферон чрезвычайно мало – всего около 0,1%. Тем не менее кДНК, полученные обратным транскрибированием, были клонированы в Е. coli, что явилось революционным событием в теоретических и прикладных исследованиях интерферонов. Ген интерферона был встроен в векторную ДНК, и к нему были присоединены бактериальные регуляторные элементы, программирующие его транскрипцию и трансляцию в бактериальной клетке (рис. 5.15).
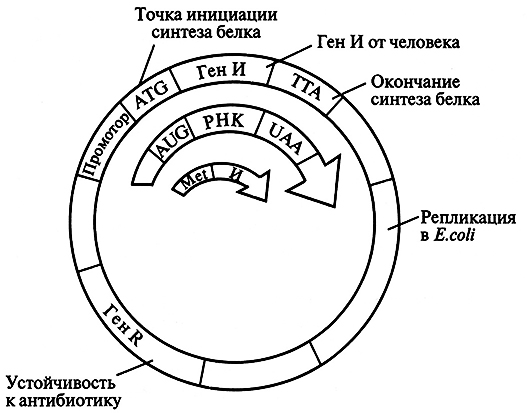
Рис. 5.15. Схема рекомбинантной плазмиды, обусловливающей синтез интерферона человека в Е. coli
Установлено, что интерфероны синтезируются в клетке сначала в виде предшественников, содержащих на N-конце полипептидной цепи сигнальный пептид, который затем отщепляется, и в результате образуется зрелый интерферон, обладающий полной биологической активностью. Бактерии не содержат ферментов, способных отщепить сигнальный пептид с образованием зрелого белка. Поэтому для того чтобы бактерии синтезировали зрелый интерферон, следует ввести в плазмиду только ту часть гена, которая его кодирует, и удалить часть гена, кодирующую сигнальный пептид. Данная процедура осуществлялась следующим образом. Ген интерферона содержит три участка расщепления рестриктазой Sau ЗА1, из которых один находится рядом с сигнальной частью. Неполное расщепление гена этим ферментом позволяет выделить фрагмент гена, содержащий нуклеотидную последовательность, кодирующую зрелый интерферон, но без первого цистеина. Триплет ATG, кодирующий цистеин, отщепляется ферментом вместе с сигнальной частью. Для восстановления полинуклеотидной последовательности полного гена химически был синтезирован небольшой фрагмент ДНК, содержащий данный триплет, а также примыкающий к нему триплет ATG – точка инициации синтеза белка. Этот фрагмент присоединили к изолированной части зрелого гена, и в результате был восстановлен полный ген зрелого интерферона. Реконструированный ген ввели в плазмиду таким образом, что с ним оказался рядом участок ДНК-промотор, обеспечивающий начало синтеза мРНК. Экстракты из Е. coli, содержащие такую плазмиду, обладали противовирусной активностью.
Синтезированный генно-инженерным способом интерферон был выделен, очищен, и его физико-химические свойства оказались близкими свойствам интерферона, полученного из крови доноров. Удалось получить бактерии, способные синтезировать до 5 мг интерферона на 1 л бактериальной суспензии, содержащей примерно 1011 бактериальных клеток, что в 5 000 раз превосходит то количество интерферона, которое можно извлечь из 1 л крови доноров. При использовании генно-инженерных технологий в разных лабораториях были получены штаммы бактерий, продуцирующих различные интерфероны: α -, β- и γ-типов. Недостаток использования Е. coli для получения β- и γ-интерферонов – отсутствие в бактерии аппарата гликозилирования эукариотических белков, что приводит к синтезу негликозилированных молекул. И хотя роль гликозилирования неясна и негликозилированные β- и γ-интерфероны практически полностью сохраняют противовирусную активность, эта особенность диктует осторожный подход к использованию генно-инженерных препаратов в медицинской практике.
В настоящее время гены интерферонов клонированы в дрожжи и клетки высших эукариот, способных осуществлять гликозилирование.
В 1981 г. в США впервые для синтеза лейкоцитарного интерферона человека были употреблены генетически сконструированные клетки дрожжей Saccharomyces cerevisiae. Полученная эффективная экспрессия гена LeIF и замена бактерий клетками дрожжей позволили увеличить производство интерферона в 10 раз.
Большое количество исследований было посвящено химическому синтезу гена, кодирующего ЛИЧ из 166 аминокислот. Соответственно, данный ген из 514 п. н. оказался самым крупным геном, синтезированным в 1982 г. группой английских ученых. В России в 1984 г. был осуществлен полный синтез гена α-И размером примерно 600 п.н. (Институт биоорганической химии).
Несмотря на успехи, достигнутые в области получения интерферонов с помощью генно-инженерных технологий и их применения для лечения различных вирусных заболеваний, в том числе онкологических, предстоит еще решить многие вопросы. На современном этапе не все гены интерферонов идентифицированы: обнаружены новые гены αL; мало известно о генах фибробластного интерферона (кроме гена β1); до конца не расшифрованы механизмы их биосинтеза и взаимодействия с другими веществами. Выяснение многих явлений, связанных с интерферонами, приведет к созданию новых средств для лечения ряда тяжелых заболеваний.
Схема биологического действия интерферона представлена на рис. 5.16.
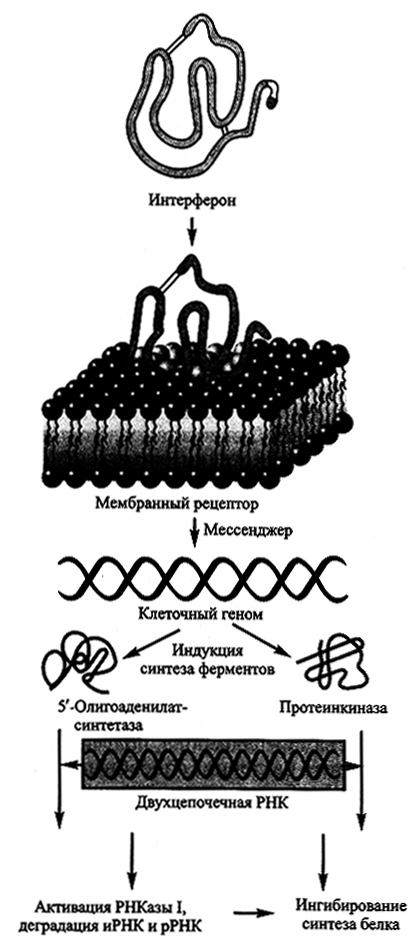
Рис. 5.16. Механизм действия интерферона
Механизм действия интерферона мЬжно свести к следующим основным этапам. Связываясь с клеточными рецепторами, интерфероны инициируют синтез двух ферментов: 2',5'-олигоаденилатсинтетазы и протеинкиназы за счет инициации транскрипции соответствующих генов. Оба фермента проявляют свою активность в присутствии двухцепочечных ДНК, являющихся продуктами репликации многих вирусов или содержащихся в их вирионах. Фермент 2',5'-олигоаденилатсинтетаза катализирует синтез 2',5'-олигоаденилатов (из АТР), которые активируют клеточную рибонуклеазу I; протеинкиназа фосфорилирует (и тем самым активирует) фактор инициации трансляции IF2. В результате этих событий ингибируются биосинтез белка и размножение вируса (деградация иРНК и рРНК) в инфицированной клетке, что вызывает ее лизис. Вероятны и другие механизмы действия интерферонов, например, инактивация тРНК, нарушение процессов метилирования и др.
5.10. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ РАСТЕНИЙ
5.10.1. Проблемы биобезопасности
Генно-инженерные методы, в частности технология рекомбинантных ДНК, позволяют создавать новые генотипы и, следовательно, новые формы растений гораздо быстрее, чем классические методы селекции. Кроме того, появляется возможность целенаправленного изменения генотипа – трансформации – благодаря введению определенных генов.
Считается, что трансгенные растения более безопасны, чем сорта, полученные методами традиционной селекции, но с применением мутагенеза (В. Ф. Федоренко и др., 2005). Есть мнение, что риск использования трансгенных растений в мирных биотехнологиях намного ниже, чем в случае применения других трансгенных организмов (Я. И. Бурьянов, 1999). Генетическая инженерия растений развивается очень быстрыми темпами. Она позволяет решать проблемы фундаментальной науки, а также многочисленные практические задачи. Намечается тенденция разделения прикладных генно-инженерных исследований на три направления:
1. Решение проблем сельскохозяйственного комплекса, таких, как повышение продуктивности сельскохозяйственных растений, их защита от различных биотических и абиотических факторов. Это особенно важно в связи с быстрым ростом населения Земли. Считается, что генетически модифицированные (ГМ) растения помогут решить проблему увеличения производства продуктов питания, поэтому сейчас наблюдается весьма значительное расширение сельскохозяйственных угодий, занятых посевами ГМ-растений. Если в 1996 г. эти посевы занимали 1,7 млн га, то в 2001 г. – 52,6 млн га, а в 2003 г. – почти 70 млн га.
2. Создание трансгенных растений – продуцентов новых веществ для использования в области медицины и технической промышленности, приспособленных для роста в полевых условиях. Так, на основе трансгенных растений возможно получение «съедобных» вакцин, антител (например, иммуноглобулиновых комплексов).
3. Развитие и совершенствование культуры трансгенных клеток и тканей растений, синтезирующих ценные биологически активные соединения. Довольно часто продуцентами важных пищевых, лекарственных или технически важных веществ служат уникальные тропические и эндемические растения, не доступные для выращивания в других климатических зонах или занесенные в «Красную книгу». Перенос генов, отвечающих за синтез специфических соединений, из редких растений в более доступные превращает последние в биологические фабрики необходимых веществ.
Генетическая трансформация может принести большую пользу для сельского хозяйства, медицины, промышленности, фундаментальной науки.
Однако биотехнология и, в частности, генетическая инженерия подошли к той ступени развития, когда приходится прежде всего думать о возможных последствиях эксперимента, об использовании полученных знаний. «Генетическая инженерия – это мощный способ изменить жизнь, но ее потенциал может представлять собой опасность» (Р. Доукинс, цит.: Современная биотехнология. Мифы и реальность, 2004). В связи с этим первостепенными становятся вопросы биологической безопасности.
Под биологической безопасностью понимается защищенность человека, общества, цивилизации и окружающей среды от вредного воздействия, опасного для жизни и здоровья людей, от токсичных и аллергенных биологических веществ и соединений, содержащихся в природных или генетически модифицированных биологических объектах и полученных из них продуктах (О. С. Машкина, А. К. Буторина, 2005). В настоящее время выделяют три группы риска, возникающие при возделывании и потреблении генетически модифицированных организмов (ГМО): пищевые, экологические, агротехнические. Причины возникновения этих рисков состоят в непредсказуемости встраивания дополнительной ДНК в геном организма, возможности плейотропного эффекта встроенного гена, нарушении стабильности генома трансгенных растений, присутствии во встраиваемой конструкции «лишних» векторных генов, аллергических и токсических эффектах чужеродного белка, возможности горизонтального переноса трансгенных конструкций в геном симбионтных для человека и животных бактерий (В. В. Кузнецов и др., 2004). По-видимому, есть закономерность между увеличением числа аллергических заболеваний и потреблением ГМ-продуктов в странах, где это потребление разрешено. Так, в США и Скандинавии был проведен сравнительный анализ количества пищевых заболеваний. Эти страны были выбраны в связи с тем, что единственным существенным различием в качестве питания были потребление генетически модифицированных продуктов в США и их отсутствие в рационе народов Скандинавии. Оказалось, что в США частота пищевых заболеваний в 3–5 раз выше, чем в странах Скандинавии (В. В. Кузнецов и др., 2004). Нельзя исключить, что генетическая инженерия может привести к результатам, опасным для человека и природы. Поэтому несомненно, что биологическая безопасность должна стать одной из приоритетных задач человечества в целом и каждой цивилизованной страны в отдельности (А.С.Спирин, 1997, цит.: В.В.Кузнецов и др., 2004).
5.10.2. Получение трансгенных растений
Технологии получения трансгенных растений практически совпадают с теми технологиями, которые обсуждались в учебном пособии, когда речь шла о передаче генетической информации у микроорганизмов и животных. Поэтому в данном разделе рассмотрим только те системы, которые специфичны для растительных организмов.
Векторы на основе Ti-плазмид
Перенос генов и их встраивание в геном двудольных растений (трансформация) осуществляются главным образом благодаря конструированию векторов, характерных для растений. Эти векторы создаются на основе Ti-плазмид, находящихся в клетках бактерий Agrobacterium tumefaciens.
Среди многочисленных почвенных бактерий существуют бактерии рода Agrobacteria, которые могут передавать часть своих генов в геном растительной клетки, вызывая коренные изменения в ее свойствах. Так, бактерия A. tumefaciens вызывает образование опухолей – корончатых галлов. Способность этой бактерии к образованию опухоли связана с геномом большой внехромосомной плазмиды –Ti-плазмиды (от англ. tumor inducing – индуцирующие опухоль). Другие бактерии (A. rhizogenes) вызывают усиленное образование корней при заражении растений. За этот процесс ответственны содержащиеся в бактериальных клетках Ri-плазмиды (от англ. root inducing – индуцирующий корни). Ti- и Ri-плазмиды – естественные векторы для дополнительных генов, обладающие свойствами, которые необходимы для трансформации растительных клеток. Они имеют широкий круг хозяев, а в бактериальных клетках реплицируются автономно. Ri-плазмиды выгодно отличаются от Ti-плазмид тем, что они не онкогенны. Клетки растений, трансформированные с помощью Ri-плазмид, сохраняют способность к морфогенезу и регенерации растений. В связи с этим Ri-плазмиды в данный момент рассматриваются как более перспективные для создания векторов. Однако Ti-плазмиды изучены лучше, поэтому их, как правило, используют при работе с растениями.
Доказательством того, что именно Ti-плазмиды отвечают за трансформацию растительных клеток в опухолевые, служит тот факт, что клетки агробактерий, лишенные Ti-плазмид, не могут вызвать в инфицированном растении ни образования корончатых галлов, ни синтеза опинов. Опины – это уникальные продукты конденсации амино- и кетокислот или аминокислот и Сахаров, которые используются бактериями в качестве источников азота, углерода и энергии.
После заражения часть Ti-плазмиды встречается в хромосомах клеток растения-хозяина. Следовательно, А. tumefaciens встраивает часть своего генома в ДНК растительной клетки и заставляет ее таким способом изменять метаболизм, синтезируя вещества, необходимые для бактерий. Сама бактерия в растительную клетку не проникает. Она остается в межклеточном пространстве, используя трансформированные клетки растений в качестве биологической «фабрики» по производству опинов.
Участок Ti-плазмиды, который встраивается в геном растительных клеток, называется Т-ДНК – трансформирующая ДНК (transferred DNA). Величина Т-ДНК составляет примерно 10% от размера всей Ti-плазмиды, т.е. 12–22 тыс. п.н. Т-ДНК содержит гены, отвечающие за индукцию образования опухоли, синтез опинов и фитогормонов (ауксинов и цитокининов), подавляющих дифференцировку клеток растения-хозяина. Гены, отвечающие за вырезание Т-ДНК и ее перенос в растительную клетку, расположены в области вирулентности (vir-область) той же самой плазмиды. Кроме того, в состав Ti-плазмиды входят гены tra-области, контролирующие конъюгацию бактерий, и гены ori-области, продукты которых обеспечивают репликацию Ti-плазмиды (рис. 5.17).
Рис. 5.17. Схема расположения некоторых областей генов в Ti-плазмиде:
Т-ДНК – трансформирующая ДНК, являющаяся опухолеобразующим агентом плазмиды
и содержащая гены, которые транскрибируются и транслируются только в растительных клетках;
vir-область – область, содержащая гены, которые отвечают за вырезание и перенос Т-ДНК
в растительную клетку; ori-o6ласть – область, контролирующая репликацию Ti-плазмиды;
tra-область – область, содержащая гены, продукты которых контролируют
конъюгацию бактерий; 1 и 2 – соответственно левая и правая
фланкирующие последовательности, ограничивающие Т-ДНК
Молекулярно-генетический механизм естественной трансформации растительных клеток с помощью Ti-плазмид изучен достаточно хорошо. В этом процессе можно выделить несколько этапов:
1) восприятие раневых сигналор растительной клетки хеморецепторами бактерии и прикрепление агробактерии к стенке клетки растения;
2) вырезание Т-ДНК из Ti-плазмиды;
3) проникновение Т-ДНК внутрь клетки растения;
4) интеграция Т-ДНК в геном растения и ее экспрессия.
Трансформация начинается только там, где есть поврежденные клетки. Весь процесс «узнавания» нужной растительной клетки, вырезания, транспорта и встраивания Т-ДНК в растительный геном осуществляют белки – продукты генов, локализованных в vir-области Ti-плазмиды. Продукты гидролиза поврежденной клеточной стенки (ацетосирингон и гидроксиацетосирингон) воспринимают хеморецепторы, встроенные в плазматическую мембрану агробактерии. Среди них одна из главных ролей принадлежит продукту деятельности генов vir-области – гистидиновой протеинкиназе, которая активирует транскрипцию остальных vir-генов. Индукция этих генов обратима, что очень важно для бактерий. Если растительный организм ослаблен или вообще нежизнеспособен, процесс останавливается и Т-ДНК не переносится в такую клетку. Другой продукт генов vir-области – эндонуклеаза, которая отвечает за вырезание Т-ДНК. Белки virB и virE транспортируют Т-ДНК в одноцепочечной форме из бактерии в цитоплазму растительной клетки. Механизм переноса Т-ДНК, по-видимому, аналогичен переносу плазмидной ДНК в процессе конъюгации. Встраивание Т-ДНК в геном клетки растения становится возможным благодаря наличию гомологичных участков между растительной и плазмидной ДНК в местах встраивания. После внедрения Т-ДНК становится обычной частью генома растения и наследуется как доминантный признак в соответствии с законами Менделя (рис. 5.18).
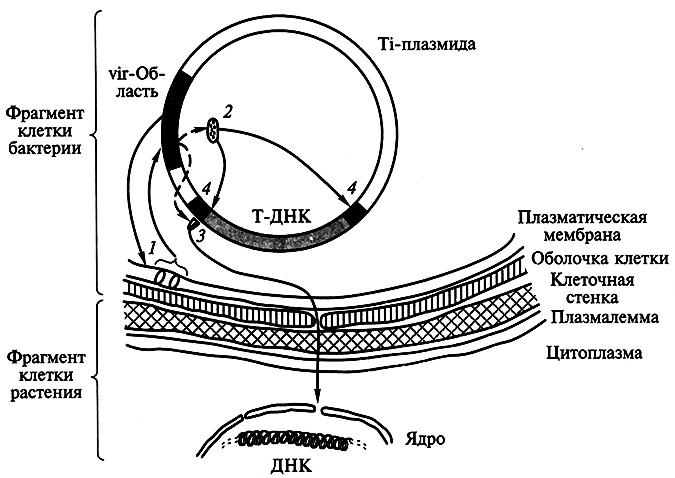
Рис. 5.18. Схема внедрения Т-ДНК в растительную клетку:
1 – гистидиновая протеинкиназа; 2 – эндонуклеаза; 3 – белки, транспортирующие Т-ДНК
из бактерии в растение; 4 – повторяющиеся последовательности, ограничивающие Т-ДНК
(фланкирующие последовательности). Пунктирные линии означают,
что данный белок является продуктом деятельности генов vir-области;
сплошные линии показывают направление действия соответствующих белков
Именно способность участка Ti-плазмиды A. tumefaciens встраиваться и экспрессироваться в геноме растительной клетки послужила поводом для попытки создания на основе этой плазмиды вектора, доставляющего дополнительные гены в клетку. Т-ДНК ограничена с двух сторон повторяющимися последовательностями (фланкирующими последовательностями), по которым и происходит вырезание этого участка ДНК из плазмиды. Казалось бы, что любая ДНК, встроенная между этими последовательностями, будет принята за Т-ДНК и перенесена в растительную клетку любых двудольных растений.
Однако,Ti-плазмида как вектор обладает некоторыми недостатками: большие размеры Ti-плазмиды (от 200 до 800 тыс. п. н.); отсутствие способности реплицироваться в клетках Е. coli, что необходимо для клонирования рекомбинантных плазмид; неспособность трансформированных с помощью Ti-плазмид клеток к регенерации целого растения; неспособность к трансформации клеток почти всех однодольных растений. Основной недостаток – слишком большие размеры Ti-плазмиды, которые делают весьма затруднительными манипуляции с ней во время конструирования вектора. Для решения этой проблемы разработана технология создания промежуточного вектора с применением классического объекта генетической инженерии – Е. coli.
Процесс начинается с создания рекомбинантной структуры, которую можно достаточно просто клонировать, т.е. многократно увеличивать число ее копий. Т-ДНК вырезают с помощью рестриктаз из Ti-плазмиды и встраивают в небольшую плазмиду pBR322, способную реплицироваться в клетках E.coli. В этих клетках рекомбинантную ДНК клонируют, после чего встраивают в Т-ДНК дополнительные гены и повторяют клонирование. Полученные многочисленные копии промежуточной векторной ДНК вводят в клетки A. tumefaciens, содержащие обычные Ti-плазмиды. В результате гомологичной рекомбинации Т-ДНК с встроенными в нее дополнительными генами замещает нормальную Т-ДНК в Ti-плазмидах. После этого отбирают с помощью генов-маркеров трансформированные агробактерии и заражают ими растительные клетки. Дополнительные гены вместе с Т-ДНК встраиваются в геном растения, и в конце концов образуется генетически модифицированный организм с заданными свойствами (рис. 5.19). Эту довольно сложную технологию можно упростить, если использовать бинарные векторы.
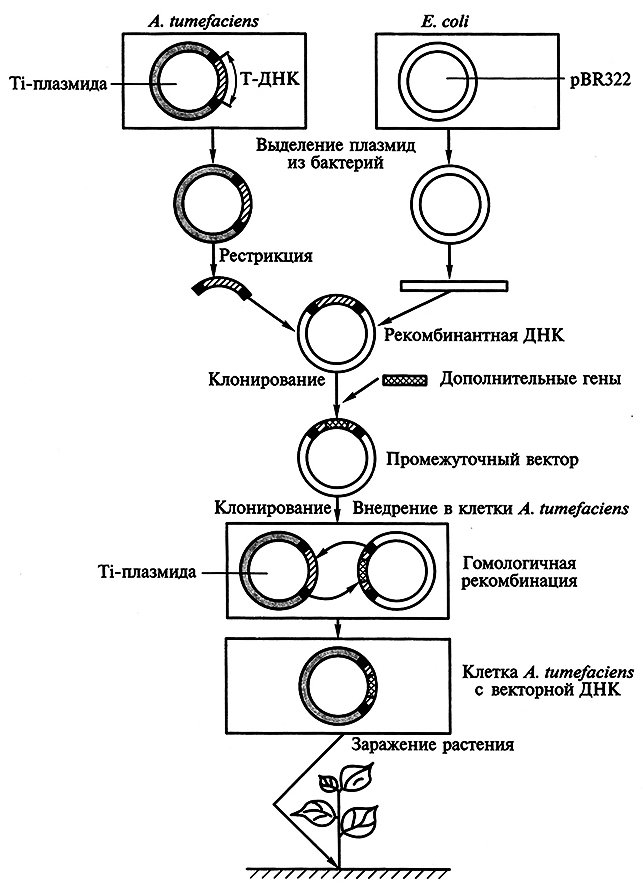
Рис. 5.19. Схема получения трансгенного растения с помощью вектора, созданного на основе Ti-плазмиды (пояснения см. в тексте)
Бинарные векторы представляют собой бактерии, содержащие две разные Ti-плазмиды. Одна из них несет vir-область и обеспечивает интеграцию в геном растительной клетки Т-области, содержащей любые гены другой плазмиды. В этом случае двойной кроссинговер не требуется.
Векторы на основе ДНК-содержащих вирусов растений
Вирусы можно рассматривать как разновидности чужеродной нуклеиновой кислоты, которые реплицируются и экспрессируются в клетках растений. Подавляющее большинство фитовирусов в качестве носителя генетической информации содержат РНК. Только 1–2% вирусов, инфицирующих растения, относятся к ДНК-содержащим. Именно эти вирусы удобны для использования в технологии рекомбинантных ДНК, а также в качестве векторов.
ДНК-содержащие вирусы могут включать одноцепочечную или двухцепочечную ДНК. В качестве представителей первой группы можно назвать вирус золотистой мозаики фасоли (ВЗМФ) или вирус полосатости кукурузы. Наиболее изученный представитель группы вирусов с двухцепочечной ДНК – вирус мозаики цветной капусты (ВМЦК), поражающий в основном растения семейства крестоцветные.
Обычно фитовирусы реплицируются с образованием большого числа копий молекул нуклеиновых кислот – 106 и более молекул на зараженную клетку. Поэтому фитовирусы представляют собой очень эффективные средства для получения хорошей экспрессии чужеродного гена. Кроме высокой копийности вирусной нуклеиновой кислоты вирусные векторные системы имеют еще ряд преимуществ: малый размер генома (возможность легкой мани пуляции вирусной ДНК) и сильные промоторы, обеспечивающие эффективную экспрессию чужеродных генов.
Однако вирусы в качестве векторов обладают и существенными недостатками: имеют небольшую емкость, патогенны и неспособны встраиваться в хромосомы хозяина. Небольшую емкость можно увеличить, если инфицировать вирусом (например, ВМЦК) растительные протопласты, а не клетки. В этом случае инфекция не передается от клетки к клетке, нет необходимости в упаковке ДНК в вирусные частицы. Следовательно, часть вирусного генома, ответственная за упаковку в вирусные частицы, может быть удалена и замещена дополнительной чужеродной ДНК. Другой недостаток – отсутствие способности встраиваться в геном растительной клетки – удается обойти (по крайней мере для ВМЦК) благодаря специальному методическому приему – агроинфекции. Для этого геном ВМЦК встраивают в Т-область Ti-плазмиды и в ее составе интегрируют в ядерный геном различных растений.
Методы прямого переноса генов в растение
Эти методы стали использоваться для растений благодаря появлению специфического объекта – изолированных протопластов, т.е. клеток, лишенных целлюлозной стенки.
Методы прямого переноса генов довольно многочисленны:
1. Трансформация растительных протопластов. Метод осуществляется благодаря комбинации методик кальциевой преципитации ДНК и слияния протопластов. Для трансформации может быть использован практически любой ДНК-вектор. Донорная ДНК может не содержать специальных биологических сигналов (vir-областей, пограничных областей Т-ДНК).
2. Заражение культуры протопластов на начальной стадии ее роста агробактериями, которые используют в качестве векторов.
3. Микроинъекции ДНК. Этот метод аналогичен методу микроинъекций животных клеток. Его можно рассматривать как наиболее универсальный. Эффективность трансформации растительных клеток – 10–20 % независимо от типа вектора. Трансформация не видоспецифична, возможен перенос генов в любое растение.
4. Электропорация. Метод основан на повышении проницаемости биомембран за счет действия импульсов высокого напряжения. В результате молекулы ДНК проникают в клетки через поры в клеточной мембране.
5. Упаковка в липосомы. Это один из методов, позволяющих защитить экзогенный генетический материал от разрушения нуклеазами растительной клетки. Липосомы – сферические тельца, оболочки которых образованы фосфолипидами.
6. Метод биологической баллистики. Это один из самых эффективных методов трансформации однодольных растений. Исходный материал для трансформации – суспензионная культура, каллусная ткань или 4–5-дневные культивируемые незрелые зародыши однодольных.
Метод основан на напылении ДНК-вектора на мельчайшие частички вольфрама, которыми затем бомбардируют клетки. Бомбардировка осуществляется с помощью биолистической пушки за счет перепада давления. Часть клеток гибнет, а выжившие клетки трансформируются, затем их культивируют и используют для регенерации растений.
5.10.3. Применение методов генетической инженерии
для улучшения аминокислотного состава
запасных белков растений
Решение проблемы создания новых форм растений подразумевает в первую очередь повышение качества синтезируемых растением продуктов, которые определяют его питательную и техническую ценность. В основном это касается запасных белков.
В большинстве случаев запасные белки растений имеют несбалансированный для питания человека и животных аминокислотный состав. Так, запасные белки злаков – проламины – бедны лизином, триптофаном и треонином, что снижает их питательную и кормовую ценность. Улучшение аминокислотного состава белка путем традиционной селекции не дает желательных результатов, поскольку необходимые гены часто сцеплены с нежелательными признаками и наследуются вместе. Например, у мутантов кукурузы и ячменя повышение содержания лизина коррелировало с уменьшением синтеза основных запасных белков – зеина и гордеина, а также с уменьшением урожайности.
Операции по получению трансгенных растений с улучшенным аминокислотным составом белка разделены на ряд этапов:
1) клонирование генов запасных белков;
2) изучение механизмов тканеспецифичной и временной экспрессии белков и выявление последовательностей ДНК, определяющих данный механизм;
3) целенаправленное изменение последовательностей генов запасных белков для улучшения аминокислотного состава;
4) создание векторов, содержащих измененный ген;
5) введение модифицированных генов в растения.
В настоящее время клонированы 10 генов гордеинов ячменя, гены α- и β-глиадинов и глютенина пшеницы, зеинов кукурузы, легумина бобовых, пататина картофеля и ряд других. Имеются практические результаты трансформации растений. Так, введение в геном пшеницы модифицированного гена проламина привело к активному синтезу модифицированного белка, а также повлияло на состав и уровень соответствующих запасных белков. В итоге улучшилось хлебопекарное качество пшеничной муки.
5.10.4. Повышение эффективности
процесса фотосинтеза
Один из возможных способов увеличения фотосинтеза и, следовательно, продуктивности растений состоит в клонировании хлоропластных генов в клетках бактерий и их переносе в растения. Известно, что хлоропласты и прокариотические клетки сходны по ряду признаков. На основании этого возникла симбиотическая гипотеза происхождения хлоропластов, впервые выдвинутая А. С. Фаминциным (1886). Согласно этой гипотезе, клетки прокариот и хлоропласты сходны. В них присутствуют кольцевые ДНК, 70S-рибосомы; синтез белков начинается с одной и той же аминокислоты – N-формилметионина, а синтез белка подавляется хлорамфениколом, а не циклогексимидом, как у эукариот. Позже было показано, что ДНК-зависимая РНК-полимераза Е. coli связывается с определенными участками ДНК хлоропластов шпината.
В клетках Е. coli инициация белкового синтеза частично регулируется доступностью участка связывания рибосом (УСР). Его структура до конца еще не выяснена, но расшифрован участок, известный под названием «последовательность Шайн–Дальгарно» (ШД). Она комплементарна З'-концу 16S-рибосомальной РНК, и инициация белкового синтеза начинается с образования комплементарной пары между этой последовательностью и 3'-концом 168-рибосомальной РНК. Анализ последовательности ДНК хлоропластного гена большой субъединицы основного фермента фотосинтеза – рибулозобисфосфаткарбоксилазы – оксигеназы (Рубиско) кукурузы – выявил значительные гомологии с известными промоторами и последовательностями ШД клеток Е. coli. Все это привело к попытке клонирования генов хлоропластов в клетках Е. coli, наиболее часто используемой в генно-инженерных исследованиях.
Транскрипционные конструкции могут создаваться двумя путями: во-первых, это установка промотора рядом с УСР, который узнается полимеразой Е. coli, во-вторых, это формирование гибридного УСР, состоящего из прокариотической последовательности ШД и эукариотического или синтетического инициирующего кодона. Первый путь широко применяется для увеличения экспрессии генов Е. coli и хлоропластных генов в клетках Е. coli.
В настоящее время уже клонировано несколько хлоропластных генов: гены синтеза субъединиц Рубиско, белка хлорофилл-белкового комплекса, АТФсинтетазы, цитохрома и др.
5.10.5. Генно-инженерные подходы
к решению проблемы усвоения азота
Азот – один из самых необходимых элементов для растений. Его недостаток в почве или питательном субстрате часто приводит растение к гибели, поэтому в первую очередь необходимо внесение в почву азотных удобрений. Однако их производство требует очень больших энергетических затрат, поэтому оно дорогостояще. Стоимость азотных удобрений в 6 раз выше стоимости фосфорных удобрений и в 16 раз выше стоимости калийных удобрений. При этом растения используют только от 30 до 70 % внесенных в почву доступных форм азота, остальное просто вымывается из почвы, загрязняя окружающую среду. Гораздо более естественно и доступно снабжение растений азотом путем его биологической фиксации.
Фиксация атмосферного азота (диазотрофность) – свойство прокариотических организмов. Азотфиксирующие организмы делятся на симбиотические (90 %) и свободноживущие (10 %). Фиксация атмосферного азота связана преимущественно с симбиотическими микроорганизмами. В настоящее время известны четыре основные системы симбиоза, имеющие большое значение не только для естественных сообществ, но и для сельского хозяйства, лесоводства. Это Rhizobia – бобовые растения, Azolla-Anabaeпа – рис, Actinomyces – деревья, Spirillum – травы. Атмосферный азот фиксируется благодаря уникальному ферменту – нитрогеназе.
В 1960 г. американские исследователи показали, что нитрогеназа сохраняет свою активность в бесклеточных экстрактах Clostridium pasteurianum. Это послужило толчком для начала активных исследований биохимии азотфиксации, структуры и механизма действия нитрогеназы. К 1981 г. нитрогеназа была выделена из 36 видов микроорганизмов. Она считается одним из наиболее сложных ферментов, использующих простые субстраты. Кроме азота нитрогеназа может восстанавливать ацетилен, цианистый водород, закись азота и некоторые другие соединения. Восстановление ацетилена в этилен позволило разработать надежный тест для обнаружения азотфиксирующей активности. Непременное условие работы нитрогеназы – ее защита от кислорода, который ингибирует не только активность нитрогеназы, но и ее биосинтез.
Начиная с 1970 г. стали появляться серьезные работы по изучению генов азотфиксации и их переносу в клетки Klebsiella pneumoniae и Е. coli. С помощью техники рекомбинантных ДНК были составлены генетические карты генов азотфиксации (nif-тенов), которые показали сходную организацию генов у большей части азотфиксирующих организмов. Было установлено, что nif-гены расположены между генами, кодирующими биосинтез гистидина (his) и генами, ответственными за усвоение шикимовой кислоты (shiA). Гены, кодирующие синтез белковых субъединиц компонентов нитрогеназы, образуют единый оперон (рис. 5.20). В клетках симбиотических бактерий Rhizobium leguminosarum, R. meliloti, R. trifolii плазмиды, кроме структурных генов нитрогеназы, содержат гены, отвечающие за развитие корневых клубеньков у определенных видов бобовых.
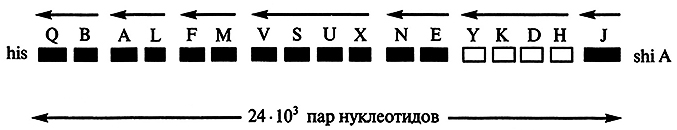
Рис. 5.20. Генетическая карта области nif-генов хромосомы Klebsiella pneumoniae
(по А. Сассон, 1987). Оперон HDKY кодирует белки нитрогеназы; стрелки обозначают направление транскрипции
Конструирование плазмид, несущих nif-гены, позволяет передавать способность к фиксации азота организмам, не обладающим этим свойством. Среди бактерий, кроме Е. coli, такой перенос осуществлен для бактерий Salmonella typhimurium, Erwinia herbicola и других. Однако подобные манипуляции могут приводить к нежелательным эффектам. Так, перенос генов в штамм Erwinia (бактерии, вызывающие гниение растений) может усилить его патогенное действие. Кроме того, существует вероятность случайного переноса вместе с nif-генами каких-то нежелательных генов.
В настоящее время внимание ученых привлекают проблемы введения генов азотфиксации в клетки растений, создания ризоценозов между небобовыми растениями (особенно злаками) и азотфиксирующими организмами, повышения мощности корневой системы бобовых растений для увеличения на ней количества клубеньков. Кроме того, предполагается создание новых азотфиксирующих систем путем введения азотфиксирующих микроорганизмов в каллусные ткани растений с последущим образованием из них растений-регенерантов, а также повышение эффективности фиксации азота путем воздействия на гены, контролирующие этот процесс.
Наиболее интересна первая проблема – введение nif-тенов в клетки растений. Однако ее решение сопряжено с рядом трудностей. Основная – разрушение нитрогеназы под воздействием кислорода. У азотфиксирующих микроорганизмов существует ряд приспособлений, защищающих бактерии от свободного кислорода. Среди них присутствие в клетках клубеньков легоглобина – гем-содержащего белка, который встраивается в мембрану бактероида (увеличенной в размере бактериальной клетки, характеризующейся наибольшей способностью к фиксации азота) и регулирует поступление кислорода. Легоглобин кодируется в геноме растительной клетки-хозяина, но его синтез начинается только после проникновения бактерий в эту клетку. У цианобактерий механизм защиты нитрогеназы от кислорода иной. Азотфиксация идет в гетероцистах, а фотосинтез – в обычных клетках. Поэтому кислород, выделяющийся в процессе фотосинтеза, не ингибирует фиксацию азота. Введение только nif-генов в какую-то растительную клетку не решает проблемы. Если нитрогеназа будет синтезироваться в этой клетке, в частности в клетках злаков, то она разрушится под действием кислорода, присутствующего в клетке. Кроме того, сама клетка, в которую переносят гены азотфиксации, может быть не приспособлена к синтезу и расходованию большого количества энергии, которое требуется для фиксации азота.
Таким образом, более перспективно повышение эффективности фиксации азота в уже существующих природных системах за счет воздействия на гены, контролирующие этот процесс, а также увеличение мощности корневой системы бобовых растений и создание новых азотфиксирующих систем с помощью методов клеточной инженерии.
5.10.6. Изменение качества плодов
В настоящее время найдены способы регулирования сроков созревания плодов с помощью методов генетической инженерии. Для этого используют метод создания антисмысловой РНК, который позволяет управлять работой интересующего гена. В растениях ген PG контролирует синтез полигалактуроназы – фермента, который участвует в разрушении пектина. Данный фермент синтезируется в период созревания плодов томата, они становятся мягкими, что значительно сокращает срок их хранения. Отключение гена PG позволяет получить растения с новыми свойствами – увеличенным сроком хранения и более высокой устойчивостью к грибным заболеваниям. Эту же технологию можно применить для регулирования активности другого гена – гена EFE, продуктом которого является фермент, участвующий в биосинтезе этилена – фитогормона, одной из функций которого служит ускорение созревания плодов. Отключение данного гена также может увеличить срок хранения плодов.
5.10.7. Устойчивость растений к гербицидам
В сельском хозяйстве широко используют гербициды – химические соединения, применяемые для уничтожения сорной растительности. Гербициды широкого спектра действия могут не только уничтожать сорняки, но и угнетать рост культурных растений. В связи с этим возникает необходимость в создании растений, устойчивых к данным веществам. Существует два подхода к решению этой проблемы: прямая селекция устойчивых к гербицидам мутантных форм растений, или мутантных клеточных штаммов (клеточная селекция), и генно-инженерный метод, который состоит во введении в растения генов гербицид-резистентности растительного или бактериального происхождения.
Изучение механизмов устойчивости служит основой для создания трансгенных растений. Оно включает четыре основных этапа: выявление мишеней действия гербицидов в клетке растений; отбор растений, устойчивых к данному гербициду в качестве источника генов резистентности; идентификация и клонирование этих генов; изучение их экспрессии для использования в трансгенных конструкциях.
Благодаря использованию методов генетической инженерии были созданы новые, устойчивые к различным гербицидам сельскохозяйственные культуры. В геном этих культур вводились мутантные гены, кодирующие синтез ферментов, на которые гербициды (атразин, бромоксилин, имидазол) не оказывают негативного действия. Например, растения лядвенца рогатого (Lotus corniculatus) были трансформированы с помощью штамма А281/рСВЕ21. Эта бактерия содержит плазмиду с встроенным геном bar, кодирующим фермент, придающий устойчивость к гербициду биалофосу. Трансгенные растения содержали ген bar и были невосприимчивы к гербициду (А. М. Стефанович, Г. Н. Ралдугина, 1999). Однако в тканях таких растений наблюдается накопление гербицидов, и использовать эти растения можно только в технических целях. Вместе с тем было показано, что введение генов, кодирующих другие ферменты, позволяет проводить детоксикацию гербицидов, создавая таким образом растения, пригодные в пищу. Так, детоксикация действующего вещества гербицида 2,4-D осуществляется при переносе в растение гена монооксигеназы, глифосата – при введении гена фосфонатазы, бромоксилина – гена нитрилазы.
5.10.8. Устойчивость растенийк фитопатогенам и насекомым
Необходимость создания растений, устойчивых к фитопатогенам, связана с тем, что насекомые-вредители, вирусные и другие заболевания служат причиной значительного снижения урожайности сельскохозяйственных культур.
Наибольший урон растениям наносят грибные, бактериальные и вирусные патогены, насекомые-вредители. В растении существуют защитные механизмы, которые в большей или меньшей степени (в зависимости от устойчивости растений) начинают действовать в ответ на проникновение фитопатогенов в клетку. Во-первых, начинается синтез соединений, вызывающих гибель патогенов. Примером могут служить специфические белки PRP (pathogen related proteins). Из них наиболее изучены ферменты хитиназы и β-1,3-глюконазы, которые угнетают рост грибов и некоторых видов бактерий, разрушая их клеточные стенки. Во-вторых, могут создаваться структурные барьеры, препятствующие распространению инфекции. Это достигается благодаря лигнификации клеточных стенок. Той же цели – защите клеток – служит присутствие в клеточных стенках белков-экстенсинов и олигосахаридов.
Применение методов генетической инженерии, использующих естественные защитные механизмы, позволяет получать трансгенные растения, устойчивые к грибной, бактериальной и вирусной инфекции. Так, гены хитиназы и глюконазы кодируются одиночными генами. Благодаря этому были получены трансгенные растения табака и турнепса, в состав генома которых ввели ген хитиназы. Лабораторные и полевые испытания выявили большую устойчивость трансгенных растений. В растения томатов был введен ген защитных пептидов редьки (дефензинов) rs, отвечающих за устойчивость к фитопатогенным грибам. Наконец, перспективны клонирование и перенос генов, кодирующих специфические белки (small antibiotic-like proteins), содержащиеся в семенах многих растений. Эти белки защищают семена в период покоя и во время прорастания от грибных и бактериальных инфекций.
Другой подход к получению трансгенных растений, устойчивых к вирусной инфекции, состоит во введении в геном исходных растений гена оболочки вируса. Это приводит к ингибированию размножения вируса и снижению инфицированности. Благодаря такому подходу был получен стойкий антивирусный эффект у растений табака, трансформированных геном оболочки вируса табачной мозаики (ВТМ).
Еще одна группа методов получения трансгенных растений, устойчивых к действию фитовирусов, включает введение и экспрессию генов антивирусных антител, вирусных сателлитных РНК. Интересный эффект дало введение в геном растений гена человеческого интерферона JFN – одного из ключевых белков индукции иммунитета у млекопитающих. С помощью вируса мозаики цветной капусты геном интерферона были трансформированы растения турнепса, табака, картофеля, что повысило устойчивость этих растений к вирусным заболеваниям.
Вполне традиционным для придания устойчивости к насекомым-вредителям стало внесение в растения гена Bt бактерий Bacillus thurengiensis. Этот ген отвечает за синтез белка протоксина, который при попадании в кишечник личинок насекомых разрушается. Продукт данного ферментативного расщепления –δ-эндотоксин – вызывает гибель насекомых. Интерес к этой группе белков вызван их широким спектром действия. Найдены новые классы эндотоксинов, которые токсичны к клещам, нематодам, одноклеточным паразитирующим микроорганизмам и т.д. Более того, в настоящее время сконструирован искусственный ген bt, более эффективный, с более широким спектром устойчивости по сравнению с природным геном.
Другой путь повышения устойчивости растений к вредителям, в частности к фитопатогенным грибам, – это экспрессия в клетках растений генов – ингибиторов протеиназ. Для данной цели перспективно использование гетерологичных генов растений, так как многие ткани и органы растений содержат ингибиторы, специфически настроенные против протеиназ насекомых и грибов, но безвредных для человека и животных.
Еще одно направление создания трансгенных устойчивых растений связано с повышением их иммунитета. У устойчивых растений в ответ на атаку патогенов происходит изменение метаболизма: накапливаются перекись водорода, салициловая кислота, фитоалексины – соединения, выполняющие защитную роль в растении. Поэтому существенное увеличение с помощью изменения генома уровня салициловой кислоты и других соединений в ответ на проникновение фитопатогена может стать перспективным для получения устойчивых растительных организмов.
5.10.9. Устойчивость растений к абиотическим стрессам
Адаптация растений в природе и, следовательно, их способность к выживанию при неблагоприятных условиях среды обеспечиваются тремя способами. Во-первых, физиологические механизмы, позволяющие растениям избежать неблагоприятные воздействия (например, период покоя). Во-вторых, адаптация осуществляется благодаря морфологическим приспособлениям: толстому слою кутикулы на листьях, уменьшению листовой поверхности, ее опушению, которые предотвращают излишнюю потерю влаги растениями. В-третьих, негативное влияние внешней среды может быть преодолено с помощью изменений метаболизма. Именно этот последний адаптационный механизм наиболее доступен для генно-инженерных исследований. Например, известно, что при водном стрессе у высших растений основным защитным механизмом, связанным с изменением метаболизма, является накопление в клетках пролина, глицинбеатина и других осмопротекторов.
Экспериментально было показано, что стрессовый ответ у бактерий и высших растений выражается сходно. И у растений, и у бактерий начинается усиленный синтез молекул осмопротекторов, механизм действия которых состоит в установлении осмотического баланса между цитоплазмой и окружающей средой, а также стабилизации белковых молекул. В бактериях биосинтез пролина хорошо изучен, известны гены, кодирующие ферменты этого процесса. Избирательная экспрессия генов осмопротекторов может привести к увеличению адаптационных качеств растения и, следовательно, к увеличению его продуктивности. Поэтому следующим шагом на пути создания устойчивых к стрессам растений было клонирование бактериальных генов, получение векторных конструкций на основе Ti-плазмиды и введение их в растения. Полученные трансгены синтезировали и накапливали пролин в 4–6 раз интенсивнее, чем обычные растения. Трансгенные побеги могли укореняться и расти при концентрации соли в среде 20 г/л (350 мМ).
У растений адаптация к низким температурам сопряжена с многочисленными физиологическими изменениями. При этом накапливаются растворимые вещества, понижающие осмотический потенциал клеток и уменьшающие вероятность образования крупных кристаллов льда. Кроме того, синтезируется большое количество белков с повышенным содержанием сульфгидрильных групп (-SH), которые обладают особо высокой способностью к гидратации, а гидратационная вода, как известно, практически не замерзает. Однако повышение устойчивости растений к замерзанию с помощью методов генной инженерии началось с изменения генома не растений, а бактерий. Исследователи Колорадского университета (США) выяснили, что повреждению растений при замерзании способствуют бактерии эпифитной (поверхностной) микрофлоры Pseudomonas syringae и Erwinia herbicola, белки которых служат центрами кристаллизации. Если обезвредить бактерии стрептомицином, то растения не замерзают при температуре -8 °С. Но стрептомицин дорог и вреден, поэтому выгоднее было изменить генетику данного штамма бактерий, вырезав из генома определенный ген. Растения, инфицированные мутантным штаммом P. syringae, росли при отрицательной температуре. Однако оказалось, что бактерии мутантного штамма более живучи и способны вытеснить природный штамм, который, попадая в верхние слои атмосферы, способствует кристаллизации атмосферной влаги. Вероятно, уничтожение природного штамма могло бы привести к экологической катастрофе.
Следует отметить, что работы по генетической инженерии, возможности манипулирования генами растений представляют огромный интерес для фундаментальных исследований. Эти работы позволяют изучать основы молекулярной и клеточной биологии растительной клетки, глубинные механизмы процессов, происходящих в ней. Вместе с тем нельзя не задуматься о своевременности прикладного применения результатов генно-инженерных исследований.
5.11. ИММУНОБИОТЕХНОЛОГИЯ
Иммунобиотехнология – это отдельная, самостоятельная область современной биотехнологической промышленности, направленная на разработку иммунодиагностикумов, терапевтических приемов, методов и технологий производства лекарственных средств для защиты от воздействия различного рода биологических агентов.
Человек обладает высокоспециализированной и организованной системой защиты от микроорганизмов, вирусов, белков, нуклеиновых кислот, антибиотиков, пестицидов, обозначенных как антигены, которая способна вызвать специфический иммунный ответ с образованием антитела.
Различают две системы иммунитета. Защитная реакция организма в случае инфицирования бактериями осуществляется В-системой иммунитета. Её состав: костный мозг – основной источник В-лимфоцитов (от англ. Bone marrow – костный мозг) и основной набор различных классов антител, нейтрализующих бактерии и их токсины. В случае вирусной инфекции функционирует Т-система иммунитета, включающая тимус (вилочковая железа), различные популяции Т-лимфоцитов, антиген-рас познающие рецепторы, находящиеся на поверхности этих клеток, группу регуляторных молекул – цитокинов (гликопротеинов, передающих сигналы от клетки к клетке).
Тесное взаимодействие компонентов обеих систем с участием фагоцитирующих клеток (иммунокомпетентные клетки – ИКК) обеспечивает иммунный ответ организма. Макрофаги поглощают, перерабатывают антиген в иммуногенной, доступной для Т- и В-лимфоцитов форме.
Т-клетки после распознавания антигена продуцируют цитокины, направляющие свое действие на В-клетки, которые далее приступают к выработке антител. Чужеродные и аномальные белки подвергаются протеолизу 26S иммунными протеасомами по АТФ-убквитинзависимому пути с образованием антигенных олигопептидов длиной 8-11 аминокислот с С-концом, содержащим остатки гидрофобных аминокислот. Эти белки называют эпитопами. Они соединяются в цитоплазме с белками-транспортерами и переносятся в эндоплазматический ретикулум, где связываются с молекулами главного комплекса гистосовместимости I (ГКГ I) и выносятся вместе с ними на поверхность клетки в составе трансмембранных пузырьков. Данная структура является сигналом для Т-лимфоцитов (Т-киллеров) для уничтожения дефектной клетки.
Иммунный ответ – сложный процесс межклеточного взаимодействия лимфоидных клеток разных типов с участием специфических гормонов, в результате чего В-клетки синтезируют специфические антитела против определенного антигена. Функция каждого клеточного типа в антителопродукции строго определена: макрофаги поглощают, перерабатывают и экспрессируют антиген в иммуногенной, доступной для Т- и В-лимфоцитов форме. Т-клетки (Т-хелперы) после распознавания антигена продуцируют цитокины, помогающие В-клеткам синтезировать антитела. В ходе эволюции молекулы антител превратились в структуры, обладающие необычной конформацией и динамическими свойствами (рис. 5.21).
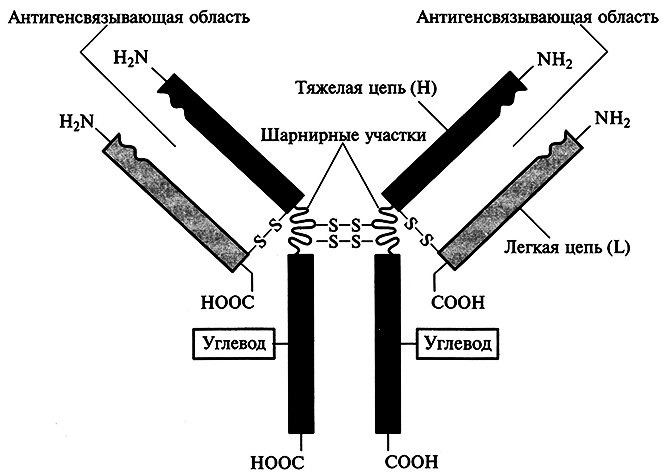
Рис. 5.21. Схема строения типичной молекулы антитела
Все антитела имеют общий тип пространственной организации пептидных цепей. Прототипом структуры всех антител можно считать иммуноглобулин G (IgG). Молекула IgG состоит из четырех цепей – двух тяжелых (Н) (Mr = 440 ак) и двух легких (L) цепей (220 ак), удерживаемых вместе посредством сильных межмолекулярных взаимодействий и дисульфидных связей. Для этой структуры характерны доменная организация молекулы и выполнение специфических функций отдельными доменами: Fab (антигенсвязывающие области), Fc (константные области), СН2, СНЗ (центры связывания комплемента). Все четыре цепи соединены между собой и достаточно подвижны.
Существует 5 разных классов антител: IgA, IgD, IgE, IgG и IgM в соответствии с типом тяжелых цепей α, δ, ɛ, γ и µ. Разные Н-цепи придают «хвостовым» областям антител различную конформацию и определяют характерные свойства каждого класса антител (рис. 5.22).
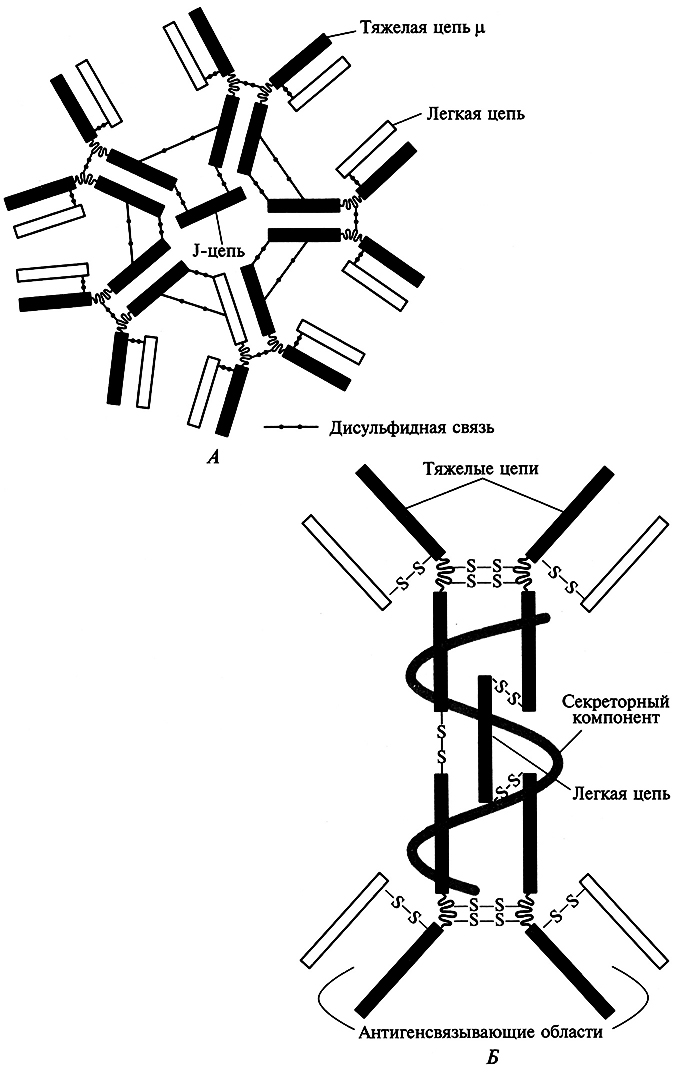
Рис. 5.22. Строение пентамерной молекулы IgM (А) и двумерной молекулы IgA (Б):
А – пять субъединиц, соединенные дисульфидными связями.
Единственная J-цепь (мол. масса около 15 000 Да) связана с двумя тяжелыми цепями и замыкается в кольцевую структуру;
Б – комплекс содержит J-цепь и добавочную полипептидную цепь, называемую секретным компонентом (мол. массой 70 000 Да),
в дополнение к двум мономерам IgA
Система комплемента (СК) дополняет (комплементирует) и усиливает действие антител. СК-система состоит примерно из 20 взаимосвязанных компонентов – белков с Mr от 24 до 400 кДа. Они образуются в печени и циркулируют в крови и тканевой жидкости. Активация СК-комплексами образований «антиген–антитело» происходит за счет каскада протеолитических реакций, вызывающих гибель микроорганизмов и повышение способности фагоцитирующих клеток связывать и разрушать микроорганизмы.
Для антитела характерна необыкновенная, уникальная специфичность. Каждое антитело узнает только свой антиген (чужеродные макромолекулярные вещества – белки или полисахариды). Известно, что иммунизация низкомолекулярными веществами (например, лекарственными препаратами) не может вызывать иммунный ответ, поэтому для образования антител необходимо предварительно их ковалентно связать с иммуногенным высокомолекулярным носителем. Сначала в лекарственное вещество для увеличения его функциональной активности вводят определенные функциональные группы, которые взаимодействуют с соответствующими функциональными группами биополимера, образуя так называемый синтетический конъюгированный антиген. При иммунизации животного таким антигеном образуются поликлональные антитела, специфичные как к самому антигену, так и к антигенным детерминантам лекарственного препарата.
Установлено, что антитело, специфичное к своему антигену, узнает только одну его детерминантную группу (эпитоп). Каждая такая детерминантная группа состоит из небольшого количества аминокислот, обычно из 6-8, образующих пространственную структуру, характерную для данного антигена (белка). В зависимости от размера молекулы белка в нем содержится несколько (от 5 до 15) детерминантных групп, у полисахаридов – от 3 до 6 остатков моносахаридов, что обусловливает образование к одному данному белку (или полисахариду) целого семейства антител с разной специфичностью (табл. 5.2). Даже к одному эпитопу могут образовываться различные антитела, в результате чего в сыворотке крови иммунизированных животных появляется большое и уникальное по составу семейство антител с абсолютной специфичностью в распознавании этого антигена. Такие семейства антител давно применяют для нейтрализации бактериальных токсинов (дифтерийного, столбнячного, бутулизма), змеиных ядов (кобры, гадюки), вирусов, попадающих в кровь, для идентификации индивидуальных белков в клетке или тканевых экстрактах.
Таблица 5.2. Основные классы антител и их свойства
Однако при лечении многих заболеваний, а также при трансплантации органов и тканей целесообразно использовать не поликомпонентные смеси антител, образующиеся в организме в ответ на действие антигена, а отдельные составляющие их компоненты, специфичные к одной определенной детерминантной группе. Такие антигены, специфичные лишь к одной определенной детерминантной группе антигена, однородные по структуре и составу и производимые в неограниченном количестве принято называть моноклональными антителами (МКА).
Получение моноклональных антител
Несмотря на существенные достижения в области применения моноклональных антител в диагностике и терапии различных заболеваний, получение этих антител связано с разного рода трудностями, что ограничивает их использование. Для получения антител обычно используют мышей, морских свинок, кроликов, кур, овец, коз, лошадей, которым делают инъекции антигена. В присутствии стимуляторов иммунного ответа в крови накапливаются специфические антитела. Антитела выделяют с помощью сульфата аммония, спирта или полиэтиленгликоля. Очистку антител от примесей белков осуществляют путем ионно-обменной и аффинной хроматографии на соответствующих иммуносорбентах.
Для организации масштабного биотехнологического производства моноклональных антител (МКА) в настоящее время используют метод гибридомной технологии.
Важнейшая задача метода гибридомной технологии – получение однородных антител со строгой специфичностью действия. Известно, что путем иммунизации животного (введения определенного антигена или только одной детерминанты) этого сделать нельзя ввиду образования большого количества генетически однородных семейств антителобразующих клеток АОК-клонов, каждый из которых синтезирует только один вариант антител к его детерминантам. Таких клонов очень много, что обусловливает большое разнообразие антител, индуцируемых одним антигеном. Если определенную линию В-лимфоцитов можно было бы выделить и вырастить в культуре тканей (в пробирке) in vitro, то полученный клон продуцировал бы только один тип антител – МКА. Но это сделать невозможно, так как нормальные клетки, будучи высаженными в культуру, вскоре погибают («смертность клетки»).
Метод гибридомной технологии, используемый для получения MICA, предусматривает получение гибридных клеток за счет слияния соматических клеток. Разрушение оболочек клеток и их слияние осуществляются при использовании вируса или полиэтил енгликоля. Из разнородных клеток после такой обработки можно получить двуядерные гибриды, сохранившие способность к клеточному делению. В процессе клеточного деления хромосомы обоих ядер перемешивались и образовывали общее ядро. В результате возникал потомок двух соматических клеток или гибридома. Однако гибридомы нормальных соматических клеток, синтезирующих антитела со строго определенной специфичностью, также не могут быть использованы для получения МКА, так как после пересаживания в культуру они вскоре погибают.
Данная проблема была решена в результате использования опухолевых клеток человека – плазмоцитом, вырабатывающих иммуноглобулины, чрезвычайно похожие по структуре на антитела, продуцируемые нормальными клетками. Плазмоцитомные антитела также образовывали смесь различных гибридных комбинаций с антителами крови, среди которых обнаруживались и специфически реагирующие пары «антиген–антитело».
Плазмоцитомы обладают рядом особенностей, позволяющих их использовать для получения МКА заданной специфичности. Плазмоцитомы возникают из одной (мутантной) генетически измененной клетки, вследствие чего она зарождается и развивается как клон иммуноглобулинобразующих клеток со строгой специфичностью действия.
Плазмоцитомы возникают непредсказуемо, спонтанно, и можно их легко индуцировать и получить таким образом неограниченно растущий клон клеток, продуцирующих иммуноглобулины, нередко обладающие специфичностью MICA.
Плазмоцитома, как опухоль, бессмертна в отличие от нормальных предшественников, что позволяет культивировать ее в пробирке и пересаживать многократно от одного животного другому. В силу автономии организм-хозяин не способен прекратить безудержный рост опухоли. Плазмоцитома сохраняет свойства и функции плазматической клетки, синтезирующей антитела, из которой она произошла.
Двумя исследователями Г. Кёлером (немецкий иммунолог) и Ц. Милыптейном (английский биолог) был разработан метод получения гибрида нормальной антителообразующей плазматической клетки и опухолевой клетки плазмоцитомы. Полученная гибридома от нормальной клетки унаследовала способность к синтезу антител, а от опухолевой – бессмертие и способность к неограниченному росту.
Отделение гибридомы с требуемой специфичностью от присутствующих в системе отдельных неслившихся клеток, а также гибридов иного состава и специфичности осуществляют по специальной схеме, включающей отбор клеток в селективной среде. Гибридизацию клеток проводят с применением особого мутанта мышиной плазмоцитомы, рост которого можно контролировать составом питательной среды, влияющим на направленность синтеза предшественников нуклеиновых кислот (нуклеотидов). Основной путь биосинтеза нуклеиновых кислот (из нуклеотидов) блокируется добавлением противоопухолевого препарата – аминоптерина. Однако, клетки могут не гибнуть при наличии в среде аминоптерина, поскольку они способны синтезировать нуклеотиды и нуклеиновые кислоты по так называемому резервному пути за счет реутилизации продуктов распада ранее синтезированных молекул – гипоксантина и тимидина. Добавление в питательную среду этих соединений снижает токсический эффект аминоптерина.
Для селекции гибридом получают мутант плазмоцитомы, не способный пользоваться резервным путем и погибающий в среде, которая содержит аминоптерин (А) и токсичные аналоги гипоксантина (Г) и тимидина (Т). Выживают лишь редкие мутанты, не способные усваивать токсичные Г и Т и тем самым утратившие способность к синтезу собственных иммуноглобулинов.
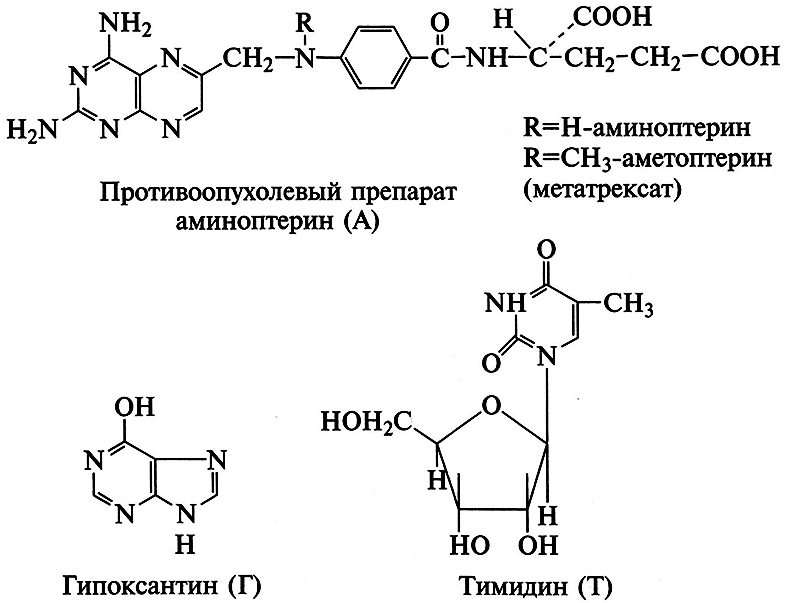
Получение гибридом сводится к определенным операциям (рис. 5.23). Гибридомы получают путем смешивания взвеси антителообразующих клеток (АОК) и клеток мутантной плазмоцитомы с добавлением полиэтиленгликоля. После инкубации, необходимой для слияния клеток, они отмываются от полиэтиленгликоля и помещаются в среду, содержащую А, Г и Т (ГАТ-среда). В среде находятся оставшиеся свободными гибриды АОК х АОК, ПК х ПК и АОК х ПК. После недолгого культивирования одиночные АОК и гибриды АОК х АОК погибают, так как нормальные клетки смертны в культуре. Плазмоцитомные клетки и их гибриды погибают в присутствии аминоптерина, который блокирует основной путь синтеза нуклеотидов, а токсичные Г и Т «не включают» резервный путь. Выживают только гибриды АОК х ПК, так как они сохраняют способность к антителообразованию по основному пути, а бессмертие от плазмоцитомы.
Рис. 5.23. Схема получения гибридом:
АОК – антителообразующие клетки;
ПК – клетки плазмоцитомы, образующие Ig за счет резервного пути;
Пл – клетки плазмоцитомы, не растущие в ГАТ-среде и лишенные способности продуцировать Ig;
АОК х Пл – гибридомы со способностью к специфическому образованию антител и «бессмертию»;
ГАТ – среда, содержащая аминоптерин (А), токсичные гипоксантин (Г)
и тимидин (Т) и моноклональные антитела
Выжившие в ГАТ-среде клетки гибридом рассеиваются в специальные пластиковые планшеты с 96 лунками вместимостью по 0,2 см3. В каждую лунку помещается около 10 гибридомных клеток, в присутствии некоторых клеток способствующих их росту. Обнаружение антител нужной специфичности проводят с помощью специальных микрометодов. Клетки с нужными антителами клонируют и повторно рассеивают по таким же лункам (из расчета одна клетка на лунку), вновь культивируют и анализируют на присутствие МКА. Полученные клоны можно заморозить при -70 °С и хранить длительное время. При их культивировании или прививке животным можно накапливать моноклональные антитела в культурной среде в больших количествах. МКА можно считать чистыми химическими реактивами вследствие однородности их физико-химических свойств.
Применение моноклональных антител
MICA в силу своей высочайшей специфичности, стандартности и технологичности получения вытесняют и заменяют обычные поликлональные иммунные сыворотки, применяемые для определения биологически активных соединений. Гибридомную технологию с успехом применяют в аналитических целях. С помощью гибридом можно получить огромное количество антител к уникальному антигену (или к одному из его эпитопов), вывести линию одного клона, в то время как в крови иммунизированного животного среди множества других антител он не может проявиться ввиду чисто количественных соотношений.
Благодаря гибридомам разработаны новые методы диагностики многих заболеваний, в том числе онкологических. С их помощью можно обнаружить антигены, характерные для злокачественных опухолей определенных тканей, получить к ним моноклональные антитела и использовать их для диагностики и тестирования опухолей. Во всем мире ведутся интенсивные исследования по использованию МКА в качестве специфических переносчиков токсических веществ в опухолевые клетки. В опухоль и ее метастазы с помощью МКА добавляют радиоактивные вещества, позволяющие обнаружить локализацию небольших узелков опухоли по накоплению в них радиоактивности. МКА с успехом применяют для диагностики многих инфекционных заболеваний, стандартизации определения групп крови, идентификации специализированных клеток, например таких, как нейроны.
Очень важно использование МКА для изучения клеточных мембран. Мембранные белки, присутствующие в клетках в малых количествах, трудно выделить в чистом виде и измерить их биологическую активность. Были получены гибридомы, продуцирующие антитела против тимоцитов крысы, а затем изолированы ряд клонов с активностью антител, специфичных для отдельных антигенов (белков) клеточной поверхности.
Использование MICA позволяет эффективно осуществлять лекарственный мониторинг, разработку иммунодиагностических тест-систем, открывает перспективу получения высокоспецифичных вакцин и сывороток против определенных вирусных штаммов и паразитов.

