Получение белков методами генетической инженерии остается важнейшей задачей биотехнологии третьего тысячелетия. К настоящему времени методами генетической инженерии в мире получено более 100 различных протеинов. Однако особенности природных свойств многих из них (нестабильность, ограниченные пределы субстратной специфичности, потребность в кофакторе, биодеградируемость, наличие механизмов регуляции активности и др.) ограничивают возможности промышленного применения получаемых белков. Необходимость преодоления указанных ограничений привела к возникновению в недрах современной биотехнологии такого перспективного направления, как белковая инженерия.
Цель белковой инженерии состоит в конструировании in vitro новых белков с заданными свойствами. Изучение направленного изменения свойств белков имеет помимо прикладного принципиальное значение для понимания на молекулярном уровне структурно-функциональных отношений в биополимерах, ибо они составляют сущность жизненных процессов.
Наиболее реальным способом создания нового белка считается внесение специфических изменений в клонированный ген известного белка, что обеспечивает получение определенных изменений в первичной структуре последнего. Методической основой для введения в состав нуклеотидных последовательностей клонированной ДНК заранее запланированных изменений является олигонуклеотид-направленный (сайт-специфический) мутагенез.
Направленным, или сайт-специфическим, мутагенезом называется совокупность методов получения мутаций, основанных на использовании генно-инженерных подходов.
Для осуществления направленного мутагенеза клонированных генов используют два типа связанных друг с другом экспериментальных подходов: рациональный дизайн (rational design) и направленную эволюцию.
Стратегия получения нового белка, согласно первому подходу, базируется на теоретических представлениях о будущей пространственной структуре белка. Используя принципы биоинформатики и методы компьютерного моделирования, строят трехмерную модель протеина, на основе которой выводят первичную структуру полипептидной цепи желаемого белка. В этих работах часто применяют известные аминокислотные последовательности, совершенствование биологических функций которых проводят методами направленного мутагенеза. Успех экспериментов в области рационального дизайна ограничивается в настоящее время неполнотой наших знаний о фолдинге белков и недостаточностью мощностей современной компьютерной техники.
При осуществлении ускоренной эволюции белков создают большие (репрезентативные) библиотеки генов, совокупность нуклеотидных последовательностей которых перекрывает все пространство или определенную часть генома организма. После процедуры первоначального клонирования генов получают набор случайных аминокислотных последовательностей, среди которых отбирают варианты, близкие по биологической активности. Далее на базе отобранных вариантов аминокислотных последовательностей с помощью методов молекулярного клонирования генов и направленного мутагенеза конструируют новые наборы мутантных белков, которые подвергаются следующему раунду скрининга и т. д. Для сокращения объема экспериментальной работы в процессе реализации данного экспериментального подхода, как и в первом случае, обычно используют известную аминокислотную последовательность.
Направленный мутагенез позволяет получать мутации любого размера – единичные или множественные замены, делеции, вставки.
6.1. НАПРАВЛЕННЫЙ МУТАГЕНЕЗ
Простейшим способом внесения точковых мутаций в клонированный ген является олигонуклеотиднаправленный мутагенез с использованием ДНК бактерий М13. Ген-мишень, кодирующий измененную аминокислотную последовательность белка, обычно встраивают в двухцепочечную форму вектора на основе фага М13. С этой целью одноцепочечную форму вектора [(+)-цепь ДНК] гибридизуют с синтетическим олигонуклеотидным праймером, содержащим в нужном кодоне один некомплементарный нуклеотид (рис. 6.1). Например, триплету АТТ в составе ДНК фага (кодирует изолейцин) будет соответствовать триплет ГАА в составе олигонуклеотида. Олигонуклеотид используется в качестве праймера, З'-конец которого служит для инициации, а ДНК плюсцепи фага М13 – матрицей для синтеза второй цепи, комплементарной матричной цепи по всей длине, за исключением областимутации. Репликацию осуществляют с помощью фрагмента Кленова ДНК-полимеразы I E.coli (для предотвращения выщепления праймера в конце синтеза) при наличии в среде четырех дезоксирибонуклеозидтрифосфатов, а соединение концов обеспечивают посредством использования ДНК-лигазы фага Т4. Полученные двухцепочечные молекулы, содержащие некомплементарные нуклеотиды, клонируют в клетках E.coli. В соответствии с полуконсервативным механизмом репликации одна половина популяции фагового потомства содержит ДНК дикого типа, а другая – мутантную ДНК с нуклеотидной заменой. Мутагенный ген вырезают и клонируют в экспрессирующем векторе. В полученном таким способом мутантном белке остаток изолейцина будет заменен на остаток лейцина.
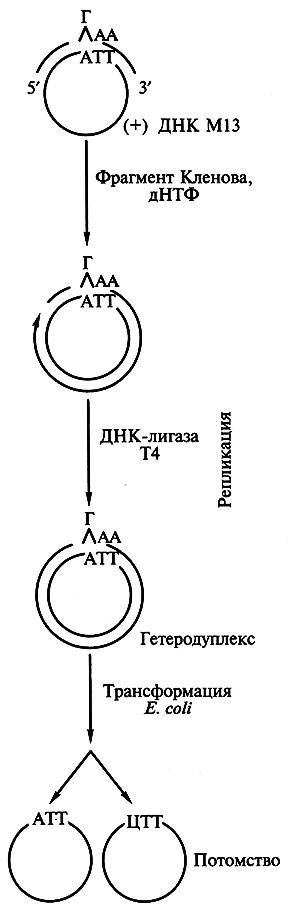
Рис. 6.1. Получение точковой мутации в клонированном гене методом олигонуклеотиднаправленного
мутагенеза с использованием бактериофага М13 (пояснения см. в тексте)
Недостатком олигонуклеотиднаправленного мутагенеза с использованием фага М13 является его трудоемкость. В качестве альтернативы системе с использованием фага М13 разработаны подходы с применением плазмидных ДНК, в которые встраивают двухцепочечные мутантные гены-мишени.
В настоящее время разработаны различные методы образования делений практически любого размера. Так, эффективный метод создания делеций с использованием экзонуклеазы Ва131 (из Alteromonus expejina) позволяет последовательно удалять нуклеотиды с 3' и 5'-концов сайтов рестрикции. Для этого целевой ген, клонированный в плазмиде, расщепляют по уникальному сайту рестрикции. Обра-зовавшиеся линейные молекулы ДНК инкубируют в присутствии экзонуклеазы Ва131. Фермент отщепляет нуклеотиды с обоих концов молекулы прямо пропорционально времени инкубации ее с экзонуклеазой. В результате возникает набор полинуклеотидных фрагментов разной длины, несущий делеции разного размера по обе стороны сайта рестрикции. В полученные фрагменты вводят уникальные сайты рестрикции, а затем каждый из фрагментов клонируют в реципиентных клетках (рис. 6.2).
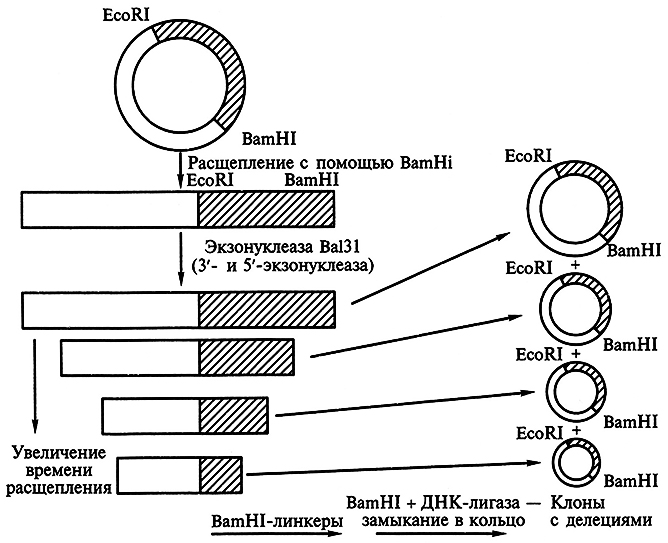
Рис. 6.2. Получение делеции с помощью нуклеазы Ва131 (Л.И.Патрушев, 2004)
Достижения в области белковой инженерии напрямую связаны с применением прогрессивной технологии ПЦР-амплификации. Сочетание сайт-специфического мутагенеза с полимеразной цепной реакцией оказалось незаменимым подходом к простому и быстрому получению больших количеств мутантных генов. Один из вариантов введения сайт-специфических мутаций в амплифицируемый фрагмент ДНК состоит в применении наряду с внешними праймерами (а + d) внутренних праймеров (Ь + с), имеющих измененную нуклеотидную последовательность и комплементарных друг другу (рис. 6.3).
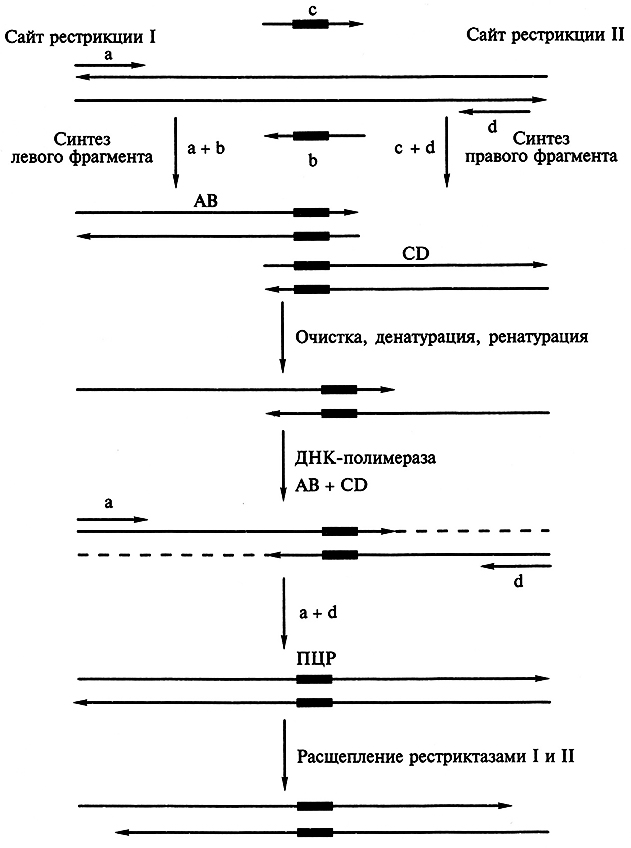
Рис. 6.3. Применение олигонуклеотиднаправленного мутагенеза с использованием ПЦР для получения мутаций:
АВ и CD – фрагменты ДНК. Мутационный сайт обозначен темным прямоугольником (пояснения см. в тексте)
Ген-мишень встраивают в плазмиду между двумя уникальными сайтами рестрикции и проводят амплификацию его левого и правого перекрывающихся между собой фрагментов с помощью нескольких раундов ПЦР. В первом раунде ПЦР в отдельных пробирках амплифицируют левый (праймеры а + Ь) и правый (праймеры с + d) фрагменты гена, являющегося мишенью мутаций. В результате образуются два перекрывающихся фрагмента. Продукты ПЦР-амплификации очищают от праймеров, объединяют в эквивалентных количествах, а затем подвергают тепловой денатурации. В итоге образуется некоторое количество частично двухцепочечных молекул ДНК, спаренных в области гена-мишени. Их достраивают до полностью двухцепочечных молекул с помощью ДНК-полимеразы (отмечены пунктирными линиями на рисунке), и образовавшаяся молекула ДНК, содержащая требуемую мутацию, служит матрицей в следующем раунде ПЦР-амплификации с парой праймеров (а + d), комплементарных противоположным концам молекулы. Амплифицированные молекулы обрабатывают двумя рестриктазами (I и II), сайты расщепления которых находятся на концах фрагмента, и клонируют в соответствующем векторе. Этот подход позволяет получить измененные гены с случайными мутациями.
6.2. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ БЕЛКОВ
Направленное конструирование модифицированных белков – один из наиболее эффективных путей создания протеинов, удовлетворяющих требованиям высокоспециализированных жестких процессов, протекающих in vitro. В первую очередь методы белковой инженерии позволяют повысить стабильность белков, их устойчивость к воздействию повышенных температур, окисляющих агентов, органических растворителей, ингибиторов, протеаз. Для таких белков, как ферменты, важными в практическом отношении свойствами, которые желательно улучшить, являются кинетические параметры и субстратная специфичность. В табл. 6.1 приведены примеры использования сайт-направленного мутагенеза для изменения конкретных свойств ряда белков.
Таблица 6.1. Использование сайт-направленного мутагенеза для создания модифицированных белков
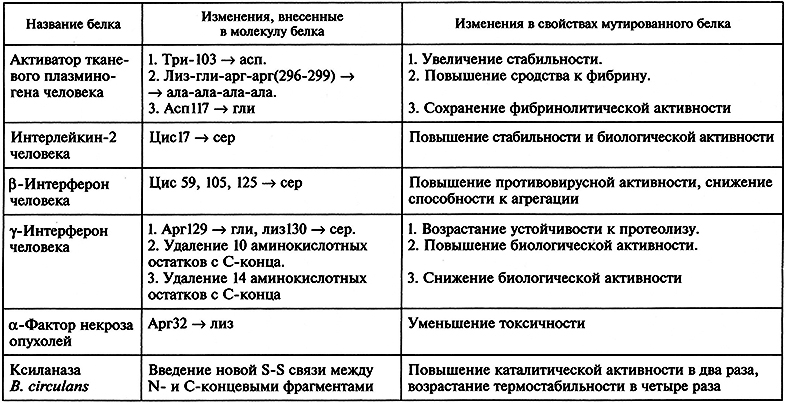
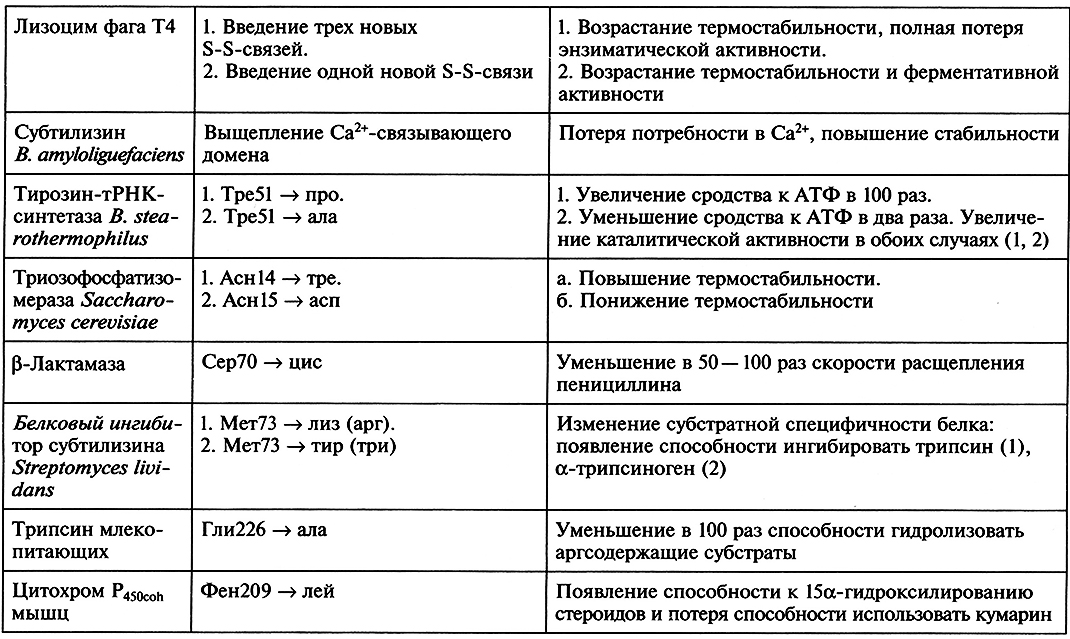
Так, к значительному возрастанию стабильности белковой молекулы приводит возникновение в ней дополнительных дисульфидных связей. В серии экспериментов с помощью олигонуклеотиднаправленного мутагенеза были сконструированы шесть вариантов лизоцима фага Т4 с новыми внутримолекулярными дисульфидными связями. С этой целью два, четыре или шесть определенных аминокислотных остатков в полипептидной цепи белка были заменены на остатки цистеина, в результате чего стало возможным образование в его молекуле одной, двух или трех S-S-мостиков соответственно. Мутантные белки клонировали в клетках E.coli, рекомбинантные белки очищали и устанавливали их термостабильность. Результаты эксперимента показали, что с увеличением числа дисульфидных связей в молекуле фермента его термостабильность закономерно возрастает. Однако вариант, обладающий тремя S-S-мостиками и характеризующийся наибольшей термостабильностью, полностью терял энзиматическую активность. Этот эффект объясняется тем, что некоторые дисульфидные связи препятствуют нормальному функционированию белка в результате нарушения пространственной структуры его молекулы.
Другой аспект исследования в области белковой инженерии ферментов связан с направленными изменениями их субстратной специфичности путем замены отдельных аминокислотных остатков, участвующих в формировании активных центров энзимов. Такой подход был использован группой И. Сигала, сотрудники которой заменили остаток сер70 в активном центре β-лактамазы на остаток цистеина. В результате данной замены способность расщепления субстрата – пенициллина – мутантным энзимом уменьшалась в 50–100 раз. Одновременно с этим мутантная β-лактамаза была более активна к цефалоспоринам – представителям β-лактамных антибиотиков третьего поколения.
Названные исследования позволяют уточнить функциональную значимость отдельных аминокислот в белках, механизмах действия конкретных ферментов и молекулярных основах регуляции их активности.
Особый интерес представляют исследования в области белковой инженерии, направленные на снижение нежелательных для человека и животных свойств генно-инженерных природных биорегуляторов – интерлейкинов, интерферонов, цитокинов, гормонов. Большую заинтересованность в практических возможностях белковой инженерии проявляют фирмы, производящие ферментные препараты для моющих и косметических средств, кожевенной, текстильной и пищевой промышленности.
Методами белковой инженерии конструируют белки, соединяющие в себе различные полезные функции (так называемые гибридные, слитные или составные белки). Гибридными белками называют полипептиды, искусственно составленные из природных доменов разного происхождения. Это возможно благодаря модульному принципу строения белков. Домены (модули), выполняющие сходные биологические функции у разнообразных по физико-химическим свойствам белков разных организмов, построены однотипно. Функциональные домены полифункциональных белков складываются и действуют независимо друг от друга.
Гибридные белки получают с помощью метода ПЦР. С этой целью синтезируют праймеры, З'-концы которых комплементарны границам переносимого домена гена А, а 5'-концы замещаемого домена гена В (рис. 6.4). Ген В клонируют в однонитевом векторе [(+)-нить] и гибридизуют с одной из нитей дуплекса, образующегося в результате амплификации переносимого домен-кодирующего участка. Нить дуплекса служит праймером для копирования (+)-нити вектора. В результате возникает комплементарная полинуклеотидная цепочка, ген В которой будет содержать участок, кодирующий домен гена А.
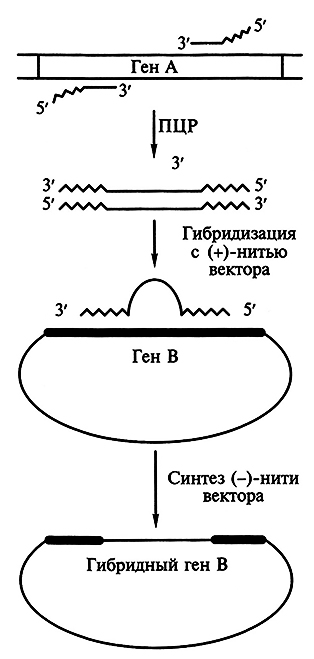
Рис. 6.4. Конструирование гибридного белка с помощью метода ПЦР (В. Н. Рыбчин, 2002).
Волнистыми линиями обозначены нуклеотидные последовательности
в праймерах, комплементарные концам замещаемого домена в гене В
Получение гибридных белков – необходимая часть экспериментов в области генетической инженерии, при осуществлении которой часто требуется оценить скорость биосинтеза целевых белков, проследить за их перемещением и концентрацией. Для этого соединяют фрагменты ДНК, содержащие открытые рамки считывания, с генами белков – репортеров β-галактозидазы, люциферазы, хлорамфеникол-ацетилтрансферазы, зеленого флуоресцентного белка и др.).
В 80-е годы XX в. получены гибридные белки, объединяющие в одной полипептидной цепи два различных белка – человеческий γ-интерферон и интерлейкин-2 – и сохранившие в ней обе биологические активности. Шведским исследователям удалось создать гибридный белок, содержащий тканевый активатор плазминогена и фрагмент урокиназ, при этом время полужизни каждого из них значительно возросло. Полученные результаты поставили вопрос о возможности получения лекарственных препаратов комбинированного действия.
Идея слияния генов разных белков оказалось плодотворной для конструирования искусственных цитотоксинов направленного действия (рецепторопосредованных токсинов). Большинство природ ных токсинов белковой природы включают не менее двух доменов. Один из них обладает действенным эффектом, а другой (лиганд) распознает рецептор на поверхности клетки-мишени, помогая токсину проникнуть в нее. При замене второго домена на какой-нибудь другой пептидный лиганд токсин приобретает другую специфичность действия. Так; соединение в пределах одной полипептидной цепи домена дифтерийного токсина и фактора роста клеток или меланоцитостимулирующего гормона а человека позволило создать лекарственный препарат направленной доставки токсина к опухолевым клеткам.
В процессе дальнейшего усовершенствования системы адресной доставки цитотоксических пептидов были сконструированы гибридные белки на основе экзотоксина A Pseudomonos aeruginosa. В качестве адресной части (лиганда) в гибридном токсине использовали фрагмент полипептидной цепи СД4 – гликопротеина поверхности Т-клеток. СД4 является рецептором ВИЧ и в процессе вирусной инфекции взаимодействует с поверхностным гликопротеином ретровируса gpl20. Созданные молекулы гибридного токсина позволяют избирательно поражать Т-клетки, инфицированные ВИЧ и несущие на своей поверхности белок gpl20. Высокоспецифичными токсичными средствами по отношению к лейкозным клеткам человека оказались также гибридные токсины, содержащие вариабельные домены моноклональных антител к части (р55) рецептора интерлейкина-2 человека.
Таким образом, несмотря на короткий срок развития, итоги и перспективы белковой инженерии настолько впечатляющи, что по праву позволяют считать ее точкой роста современной науки и производства.

