Клеточная инженерия – одно из наиболее важных направлений в биотехнологии. Она основана на использовании принципиально нового объекта – изолированной культуры клеток или тканей эукариотических организмов, а также на тотипотентности – уникальном свойстве растительных клеток. Применение этого объекта раскрыло большие возможности в решении глобальных теоретических и практических задач. В области фундаментальных наук стало осуществимым исследование таких сложных проблем, как взаимодействие клеток в тканях, клеточная дифференцировка, морфогенез, реализация тотипотентности растительных клеток, механизмы появления раковых клеток и др. При решении практических задач основное внимание уделяется вопросам селекции, получения значительных количеств биологически ценных метаболитов растительного происхождения, в частности более дешевых лекарств, а также выращивания оздоровленных безвирусных растений, клонального размножения и др.
7.1. КЛЕТОЧНАЯ ИНЖЕНЕРИЯ РАСТЕНИЙ
Бурное развитие клеточной инженерии растений приходится на 50-е годы XX в., хотя первые попытки выращивания изолированных кусочков ткани были сделаны гораздо раньше. В конце XIX – начале XX в. немецкие ученые X. Фехтинг (1892), С. Рехингер (1893), Дж.Хаберландт (1902) сделали первую неудачную попытку стимуляции роста растительных тканей и органов, помещенных на фильтровальную бумагу, пропитанную сахарозой. Несмотря на отсутствие положительного результата, их работы представляют большой интерес. В них были высказаны идеи, которые намного опередили развитие науки того времени и которые нашли свое подтверждение несколько десятилетий спустя. Так, Фехтинг предположил, что полярность присуща не только организму или органу растения, но и самой клетке. Рехингер определил минимальный размер сегмента, образующего каллус. Согласно его исследованиям, в кусочках ткани тоньше 1,5–2,0 мм клетки не делились. Хаберландт впервые четко сформулировал идеи о возможности культивирования in vitro изолированных клеток растений и о тотипотентности клеток, т.е. способности любой соматической клетки полностью реализовывать свой потенциал развития. Иначе говоря, о способности каждой растительной клетки давать начало целому организму.
Первые успехи были получены в 1922 г. американским ученым В.Роббинсом и немецким ученым В.Котте. Независимо друг от друга они показали возможность выращивания меристем кончиков корней томатов и кукурузы на синтетической питательной среде. Считается, что их работы легли в основу метода культуры изолированных корней растения.
Настоящее развитие метода культуры тканей и клеток высших растений началось в 1932 г. с работ французского ученого Р. Готре и американского исследователя Ф.Уайта. Они показали, что при периодической пересадке на свежую питательную среду кончики корней могут расти неограниченно долго. Кроме того, ими были разработаны методы культивирования новых объектов: тканей древесных растений камбиального происхождения, каллус ных тканей запасающей паренхимы (Р. Готре), а также тканей растительных опухолей (Ф. Уайт). С этого момента начинаются массовые исследования по разработке новых питательных сред, включающих даже такие неконтролируемые компоненты, как березовый сок или эндосперм кокоса, и по введению в культуру новых объектов. К 1959 г. насчитывалось уже 142 вида высших растений, выращиваемых в стерильной культуре.
В 1955 г. после открытия Ф.Скугом и С.Миллером нового класса фитогормонов – цитокининов – оказалось, что при совместном их действии с другим классом фитогормонов – ауксинами – появилась возможность инициировать деление дифференцированных клеток, поддерживать рост каллусной ткани, индуцировать морфогенез в контролируемых условиях.
В 1959 г. был предложен метод выращивания больших масс клеточных суспензий. Важным событием стала разработка Е. Кокки нгом (Ноттингемский университет, Великобритания) в 1960 г. метода получения изолированных протопластов. Это послужило толчком к получению соматических гибридов, введению в протопласты вирусных РНК, клеточных органелл, клеток прокариот. В это же время Дж. Морелом и Р. Г. Бутенко был предложен метод клонального микроразмножения, который сразу же нашел широкое практическое применение. Весьма важным достижением в развитии технологий культивирования изолированных тканей и клеток стало культивирование одиночной клетки с помощью ткани-«няньки». Этот метод был разработан в России в 1969 г. в Институте физиологии растений им. К.А.Тимирязева РАН под руководством Р. Г. Бутенко. В последние десятилетия продолжается быстрый прогресс технологий клеточной инженерии, позволяющих значительно облегчить селекционную работу. Большие успехи достигнуты в развитии методов получения трансгенных растений, технологий использования изолированных тканей и клеток травянистых растений, начато культивирование тканей древесных растений.
7.1.2. Методы и условия культивирования
изолированных тканей и клеток растений
Выращивание изолированных клеток и тканей на искусственных питательных средах в стерильных условиях (in vitro) получило название метода культуры изолированных тканей.
В связи с тем что в жизни человека наибольшее значение имеют семенные растения, методы и условия для их культивирования разработаны лучше, чем для голосеменных растений или водорослей, выращивание которых в стерильных условиях вызывает определенные затруднения. Однако независимо от принадлежности растений к той или иной таксономической группе существуют общие требования к выращиванию объектов в культуре in vitro.
Асептика
Прежде всего культивирование фрагментов ткани или органа растения – эксплантов, а тем более отдельных клеток требует соблюдения полной асептики. Микроорганизмы, которые могут попасть в питательную среду, выделяют токсины, ингибирующие рост клеток и приводящие культуру к гибели. Поэтому при всех манипуляциях с клетками и тканями при культивировании in vitro соблюдают определенные правила асептики в ламинар-боксе или в асептических комнатах. В первом случае асептика достигается подачей профильтрованного стерильного воздуха, направленного из ламинкар-бокса наружу, на работающего. Асептические комнаты стерилизуют с помощью ультрафиолетовых ламп, а работают в таких помещениях в стерильной одежде. Рабочую поверхность столов в асептических комнатах и инструменты перед работой дополнительно стерилизуют спиртом.
Чистую посуду, предварительно завернутую в бумагу или в фольгу, инструменты, бумагу, вату стерилизуют сухим жаром в сушильном шкафу при температуре 160 °С в течение 1,5–2 ч. Питательные среды стерилизуют в автоклаве при температуре 120 °С и повышенном давлении в течение 15–20 мин. Если в состав питательных сред входят вещества, разрушающиеся при автоклавировании, их следует стерилизовать путем фильтрации через бактериальный фильтр. Затем стерильные профильтрованные компоненты добавляют в проавтоклавированную среду, охлажденную до температуры 40 °С.
Растительные ткани сами по себе могут служить серьезным источником заражения, так как на их поверхности всегда находится эпифитная микрофлора. Поэтому необходима поверхностная стерилизация, которую проводят следующим образом. Предварительно часть растения, из которой будет извлечен эксплант, промывают водой с мылом и споласкивают чистой водой. Затем растительный материал стерилизуют в растворах дезинфицирующих веществ. Некоторые из этих веществ, а также время стерилизации представлены в табл. 7.1.
Таблица 7.1. Стерилизация исходного растительного материала (по Р. Г. Бутенко, 1999)
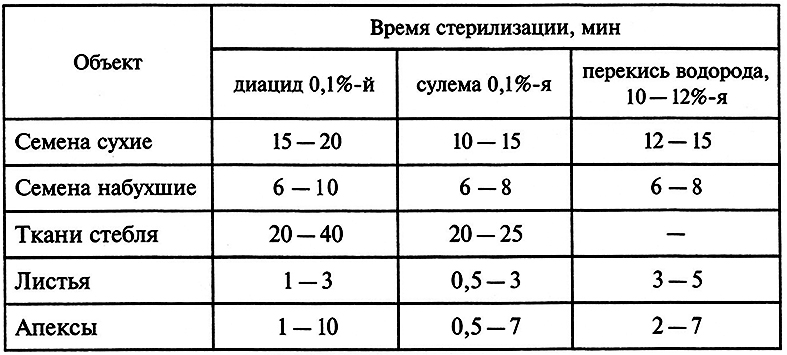
После выдерживания эксплантов в дезинфицирующем растворе их несколько раз промывают в дистиллированной воде и скальпелем удаляют наружный слой клеток на срезах эксплантов, так как он может быть поврежден при стерилизации.
Микроорганизмы могут находиться и внутри растительной ткани. Наиболее часто внутреннее инфицирование встречается у тропических и субтропических растений. Поэтому кроме поверхностной стерилизации иногда приходится применять антибиотики, которые и убивают микробную флору внутри ткани. Следует заметить, что подобная обработка не всегда приводит к стерилизации внутренних тканей, так как трудно выбрать направленно действующий антибиотик.
Питательные среды
Изолированные клетки и ткани культивируют на многокомпонентных питательных средах. Они могут существенно различаться по своему составу, однако в состав всех сред обязательно входят необходимые растениям макро- и микроэлементы, углеводы, витамины, фитогормоны и их синтетические аналоги. Углеводы (обычно это сахароза или глюкоза) входят в состав любой питательной смеси в концентрации 2–3 %. Они необходимы в качестве питательного компонента, так как большинство каллусных тканей лишено хлорофилла и не способно к автотрофному питанию. Поэтому их выращивают в условиях рассеянного освещения или в темноте. Исключение составляет каллусная ткань мандрагоры, амаранта и некоторых других растений.
Обязательными компонентами питательных сред должны быть ауксины, вызывающие дедифференцировку клеток экспланта, и цитокинины, индуцирующие клеточные деления. При изменении соотношения между этими фитогормонами или при добавлении других фитогормонов могут быть вызваны разные типы морфогенеза.
Высокое содержание нитратов, ионов аммония, калия, фосфата способствует быстрому росту клеток. Истощение среды значительно снижает рост и процессы вторичного метаболизма. Однако изначально низкое содержание фосфатов в питательной среде способно стимулировать синтез вторичных метаболитов. Установлено, что культивирование каллусов солодки голой на среде с половинной концентрацией азота и фосфора в темноте увеличивает содержание фенольных соединений в 1,6 раза по сравнению с каллусами, растущими на полной среде. В среду могут быть добавлены эндоспермы незрелых зародышей (кокосовый орех, конский каштан и др.), пасока некоторых деревьев, различные экстракты (солодовый, дрожжевой, томатный сок). Введение их в среду дает интересные результаты, но такие эксперименты трудно воспроизводимы, так как действующий компонент, как правило, точно неизвестен. Например, добавление в питательную среду отдельных фракций кокосового молока не давало никаких результатов, в то время как нефракционированный эндосперм вызывал деление клеток.
При приготовлении твердых питательных сред для поверхностного выращивания каллусных тканей используют очищенный агар-агар – полисахарид, получаемый из морских водорослей. В качестве примеров в табл. 7.2 приведены составы наиболее распространенных питательных сред.
Таблица 7.2. Состав питательных сред, применяемых
при культивировании клеток и тканей (по Р. Г. Бутенко, 1999)
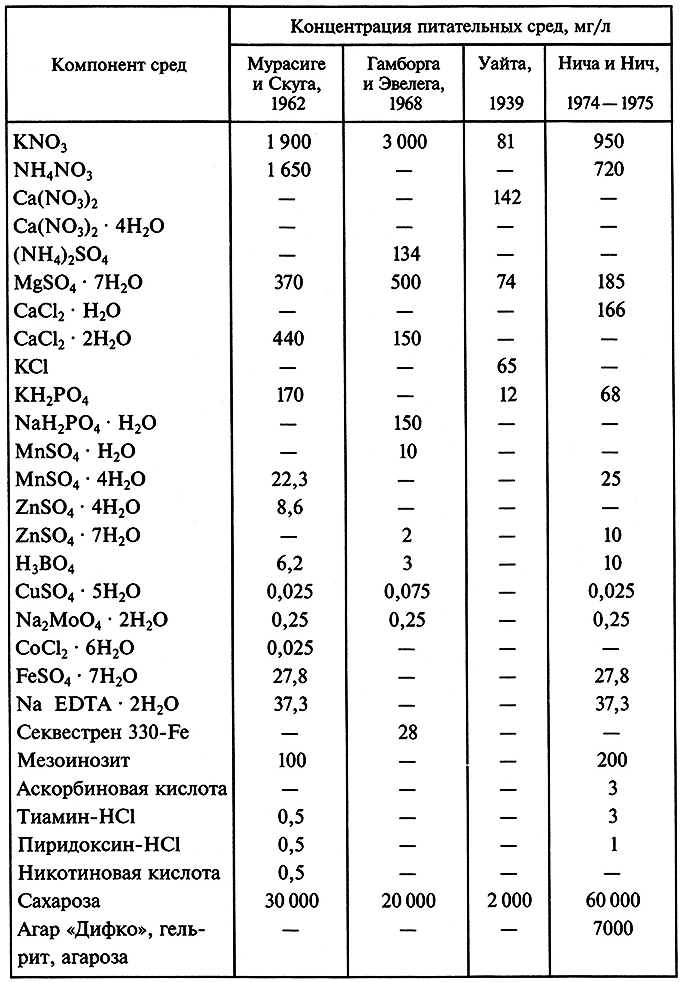
Среда Мурасиге и Скуга – самая универсальная. Она пригодна для образования каллусов, поддержания неорганизованного каллусного роста, индукции морфогенеза у большинства двудольных растений. Так, изменение соотношения ауксина и кинетина приводит к образованию либо корней (преобладание ауксина), либо стеблевых культур (преобладание кинетина).
Среда Гамборга и Эвелега хорошо подходит для культивирования клеток и тканей бобовых растений и злаков, среда Уайта обеспечивает укоренение побегов и нормальный рост стебля после регенерации, а среда Нича и Нич пригодна для индукции андрогенеза в культуре пыльников.
Физические факторы
На рост и развитие растительных тканей in vitro большое влияние оказывают физические факторы – свет, температура, аэрация, влажность.
Свет. Большинство каллусных тканей могут расти в условиях слабого освещения или в темноте, так как они не способны фотосинтезировать. Вместе с тем свет может выступать как фактор, обеспечивающий морфогенез и активирующий процессы вторичного синтеза. В качестве источника света используют люминесцентные лампы. Для большинства травянистых растений оптимум освещенности составляет примерно 1 000 люкс. Слишком низкая (300 люкс) или высокая (3 000 –10 000 люкс) освещенность подавляет рост. Освещение может влиять на метаболизм каллусных клеток. Так, в культурах чайного растения под действием света увеличивался биосинтез полифенолов. Напротив, в культуре клеток Scopolia paruiflora свет подавлял образование алкалоидов. Кроме интенсивности освещенности на культуру ткани и ее физиологические особенности влияет качество света. Так, более 20 флавонов и флавоноловых гликозидов образуется в культурах клеток петрушки после освещения ее непрерывным люминесцентным светом «холодный белый». Вместе с тем синтез флавоновых гликозидов активируется при последовательном облучении ультрафиолетовым светом, а затем светом, лежащим в области «красный–длинноволновый красный».
Температура. Для большинства каллусных культур оптимальна температура 26 °С. В то же время каллусы и культуры клеток диоскореи дельтовидной хорошо растут даже при температуре 32 °С. В отличие от роста культур клеток и тканей индукция их морфогенеза требует более низких температур (18–20 °С). Влияние температуры на метаболизм клеток in vitro изучено слабо. Есть данные, что в каллусных культурах максимальное образование алкалоидов наблюдалось при температуре 25 °С, а при повышении температуры резко снижалось. В суспензионных культурах клеток Ipomoea содержание жирных кислот значительно увеличивалось, если их выращивали при субоптимальных температурах роста (15 °С). Поэтому при выращивании культуры in vitro необходимо тщательно изучать влияние всех абиотических факторов, в том числе температурного, на рост и метаболизм клеток.
Аэрация. Для выращивания суспензионных культур большое значение имеет аэрация. Особенно важно снабжение воздухом культивируемых клеток в больших объемах ферментеров.
При сравнении разных типов ферментеров было показано, что синтез вторичных метаболитов в суспензионной культуре был наибольшим при подаче воздуха снизу. При выращивании клеток в малых объемах (в колбах) нормальная аэрация достигается при постоянном перемешивании суспензии.
Влажность. Оптимальная влажность в помещении, где растут культуры, должна составлять 60–70%.
Таким образом, культивирование клеток и тканей зависит от многих факторов внешней среды, и действие их не всегда хорошо известно. Поэтому при введении в культуру нового вида растений необходимо прежде всего тщательно изучить влияние физических факторов на рост и физиологические характеристики этой культуры.
7.1.3. Дедифференцировка как основа каллусогенеза
Культура изолированных клеток и тканей обычно представлена каллусными и гораздо реже опухолевыми тканями. Каллусная ткань образуется в результате повреждения на целых растениях, а также в стерильной культуре на эксплантах – фрагментах ткани или органа, используемых для получения первичного каллуса. Возникновение каллуса связано с неорганизованным делением (пролиферацией) дедифференцированных клеток. Дедифференцировка – основа создания культуры каллусных клеток. В процессе дифференцировки клетки теряют способность делиться. Дедифференцировка – это возвращение клеток в меристематическое состояние, при котором они сохраняют способность к делению. У интактных растений дедифференцировка и индукция каллусогенеза возникают вследствие образования раневых гормонов (травматиновая кислота) при механическом повреждении. Обязательное условие дедифференцировки тканей экспланта и превращения их в каллусные клетки, помимо повреждения, – присутствие ауксинов и цитокининов. Среди ауксинов чаще всего используют 2,4-D (2,4-дихлорфеноксиуксусную кислоту), ИУК (индолил-3-уксусную кислоту), НУК (α-нафтилуксусную кислоту), причем наибольшую активность проявляет 2,4-D. Из цитокининов в искусственные питательные среды обычно вносят кинетин, 6-БАП (6-бензиламинопурин), зеатин. Наиболее активны 6-БАП и зеатин. Функции этих двух групп гормонов в каллусогенезе разные, но они тесно связаны между собой. Ауксины вызывают процессы дедифференцировки клетки, подготавливают ее к делению. Затем цитокинины инициируют деление клеток. Последние исследования свидетельствуют, что ауксины индуцируют синтез главной протеинкиназы клеточного деления P34cdc2, а цитокинины – циклинов. Таким образом, действие этих гормонов проявляется только при последовательном или одновременном внесении их в среду. Кроме того, оно будет зависеть от физиологического состояния клеток экспланта, от их компетентности к действию тех или иных внешних факторов. Результаты исследований показали, что полисахариды и какие-то неизвестные индукторы тоже могут вызывать деление клеток, приводящее к образованию каллуса.
Во время процесса дедифференцировки, который у всех клеток сходен, клетки должны утратить характерные черты исходной ткани. В первую очередь они теряют запасные вещества – крахмал, белки, липиды. В них разрушаются специализированные клеточные органеллы, в частности хлоропласты, но возрастает число амилопластов. Кроме того, разрушается аппарат Гольджи, перестраиваются эндоплазматический ретикулюм и элементы цитоскелета.
Через несколько часов после перенесения экспланта в условия in vitro начинается новый синтез белка. Он связан, вероятно, с механическим повреждением и действием гормонов, сохранившихся в экспланте с момента его изоляции из растения. Когда данные гормоны израсходуются, синтез белка прекращается. Если в это время клетки будут культивироваться на питательной среде, содержащей ауксины и цитокинины, то начнется каллусогенез, т. е. в результате дедифференцировки и деления клеток будет образовываться первичный каллус. Таким образом, специализированная клетка растительной ткани становится каллусной в результате дедифференцировки, т.е. восстановления у нее способности к делению.
7.1.4. Типы культур клеток и тканей
В зависимости от способа, условий культивирования и происхождения можно выделить несколько типов культур клеток и тканей. Если культивирование происходит поверхностно на агаризованной питательной среде, то образуется культура каллусных клеток. Она не имеет четко выраженной структуры, но может различаться по плотности. Происхождение и условия выращивания определят, будет ли каллусная культура рыхлой, средней плотности или плотной. Рыхлая культура каллусных клеток имеет сильно оводненные клетки, легко распадается на небольшие группы клеток и кластеры и поэтому может быть использована для получения суспензионной культуры. Культура каллусных клеток средней плотности характеризуется хорошо выраженными меристематическими очагами. В ней легко инициируются процессы органогенеза. Наконец, у плотных каллусных культур различают зоны редуцированного камбия и трахеидоподобных элементов:
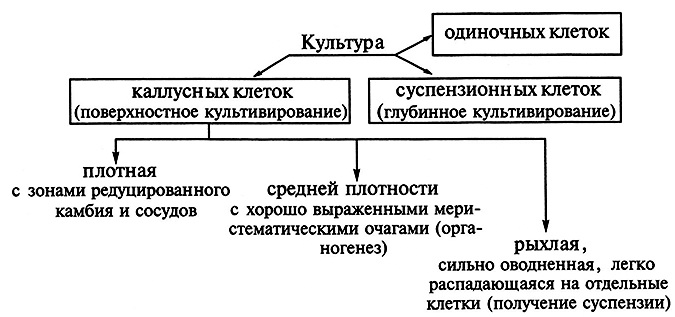
Существует также суспензионная культура клеток, которую выращивают в жидкой питательной среде, так называемое глубинное культивирование. Клеточные суспензии образуются как из каллусных клеток, так и непосредственно из экспланта. Для получения суспензионных культур предпочтительнее брать каллусы рыхлого типа. Если для этой цели необходимо использовать плотный каллус, то его можно разрыхлить, исключив из питательной среды соли Са2+. С этой же целью можно культивировать каллус на среде, содержащей ауксин 2,4-D или ферменты – пектиназу (0,2 мг/л) и целлюлазу (0,01 мг/л). Наилучший эффект достигается при добавлении ферментов. Суспензионные культуры клеток можно получить и непосредственно из экспланта по методу Ф. Стюарда. Для этого эксплант помещают в жидкую среду при постоянном автоматическом перемешивании. Дедифференцированные клетки отрываются от экспланта, образуя суспензию в питательной среде. Постоянное встряхивание – необходимое условие культивирования клеточных суспензий. Суспензионные клетки делятся в присутствии тех же двух групп гормонов (ауксинов и цитокининов), которые индуцируют деление клеток в каллусных тканях. Следовательно, можно сказать, что суспензионные культуры представлены разными агрегатами каллусных клеток.
Клеточные суспензии играют значительную роль в биотехнологии. Они могут быть использованы для получения изолированных протопластов, которые применяют для клеточной селекции, при введении чужеродных ДНК и других процессах. Клеточные суспензии культивируют в больших количествах для получения вторичных метаболитов, выявления новых веществ, для выращивания клеточной биомассы. Однако увеличение клеточной биомассы в результате деления клеток и синтез вторичных метаболитов разобщены во времени. Поэтому необходимо хорошо знать физиологию, свойства клеток в суспензионных культурах, чтобы получить максимальный выход продукта. Состояние клеточных суспензий характеризуется плотностью клеточной популяции. За 14–16 дней (средняя длительность пассажа) плотность обычно повышается от 5 • 104 до 5 • 106 кл/мл. Качество суспензии определяется степенью агрегированности. Агрегаты должны содержать не более 10–12 клеток.
Большой интерес представляет культура одиночных клеток. Ее применяют в клеточной селекции для отбора гибридных клеток и их клонирования, а также для генетических и физиологических исследований. Например, вопрос о причинах генетической неоднородности легче решать, используя клон-потомство одной клетки, а не гетерогенную ткань исходного экспланта.
Однако культивирование одной или нескольких клеток связано с определенными трудностями, состоящими в том, что одиночная клетка живет, но не делится в тех условиях, которые разработаны для нормального роста и размножения клеток каллусной ткани. Поэтому при культивировании одиночных клеток потребовалась выработка специальных методов. Все они основаны на использовании так называемого «кондиционирующего фактора» – метаболитов, выделяемых в среду делящимися клетками. Когда на питательную среду высаживается одна клетка или небольшое их количество, они не делятся, так как выделяемого кондиционирующего фактора не хватает для индукции деления. Следовательно, необходимо повысить концентрацию фактора в питательной среде. Этой цели служат следующие методы:
1. Метод «ткань-«нянька». Кондиционирующий фактор выделяется находящимися рядом с одиночной клеткой кусочками ткани-«няньки» (рис. 7.1).
2. Метод «кормящий слой». Кондиционирующий фактор выделяют активно делящиеся клетки суспензионной культуры того же вида растений, что и одиночная клетка (рис. 7.2).
3. Кондиционирование среды. Метод осуществляется путем добавления в нее питательной среды, отфильтрованной от интенсивно делящихся клеток.
4. Культивирование одиночных клеток. Метод осуществляется в микрокапле, т.е. в очень малом объеме (≈ 20 мкл) богатой питательной среды (Ю.Ю. Глеба).
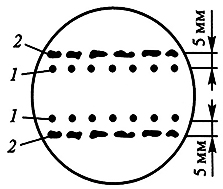
Рис. 7.1. Выращивание отдельных клеток с помощью метода «ткань-«нянька» (по Р.Г. Бутенко, 1999):
1 – одиночные клетки; 2 – каллусная культура-«нянька»
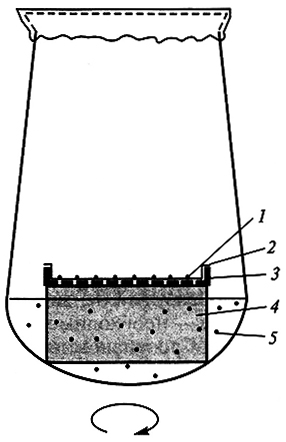
Рис. 7.2. Использование культуры суспензионных клеток в качестве «кормящего слоя»
для выращивания изолированных протопластов и одиночных клеток кукурузы (By Дык Куанг, 3.Б. Шамина, 1985):
1 – колонии клеток; 2 – фильтровальная бумага; 3 – алюминиевая сетка; 4 – пенополиуретан; 5 – суспензия клеток
Точно сказать, что представляет собой кондиционирующий фактор, пока невозможно. Согласно исследованиям А.И. Павловой и Р.Г. Бутенко (1969), этот фактор водорастворим, термостабилен, не заменяется фитогормонами, включает низкомолекулярные вещества. Химическая природа кондиционирующего фактора доказывается с помощью довольно простого эксперимента. Если разделить одиночные клетки и ткань-«няньку» стеклянной пластиной, то деления клеток не наступает. Если вместо пластин поместить целлофан, то хотя и с задержкой начинается деление одиночных клеток (рис. 7.3).
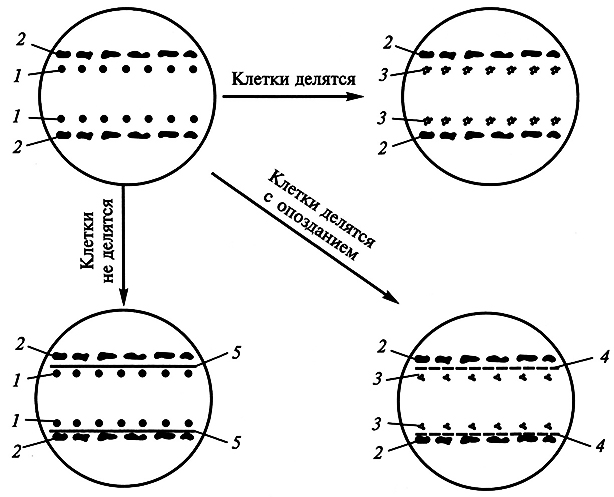
Рис. 7.3. Доказательство химической природы фактора кондиционирования:
1 – одиночные клетки; 2 – ткань-«нянька»; 3 – делящиеся клетки; 4 – целлофан; 5 – стеклянные пластинки
7.1.5. Общая характеристика каллусных клеток
Каллусная клетка имеет свой цикл развития, аналогичный циклу всех других клеток: деление, растяжение, дифференцировка, старение и отмирание. Дифференцировку каллусных клеток принято называть вторичной. Однако ее не следует путать с вторичной дифференцировкой, на которой основан морфогенез. Рост каллусных тканей подчиняется общим закономерностям. Кривая роста каллусных тканей также имеет характер ^-образной кривой (ростовая кривая Сакса) и включает пять фаз, длительность которых неодинакова у разных видов растений (рис. 7.4).
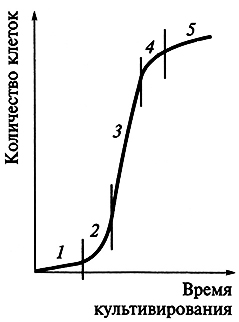
Рис. 7.4. Ростовая кривая при периодическом выращивании каллусных клеток.
Фазы роста: 1 – латентная; 2 – логарифмическая; 3 – линейная; 4 – замедленного роста; 5 – стационарного роста
Первая фаза – латентная, или лаг-фаза, заключается в подготовке клеток к делениям.
Вторая – фаза экспоненциального роста (логарифмическая). В это время митотическая активность наибольшая, рост идет с ускорением, масса каллуса увеличивается.
Третья фаза – линейная, характеризуется постоянной скоростью роста каллусной массы.
Четвертая – фаза замедленного роста, во время которой интенсивность деления клеток резко снижается. Во время пятой фазы – стационарной – масса каллуса не увеличивается, так как начавшееся отмирание клеток еще компенсируется за счет их деления. Далее следует отмирание каллуса.
Культивируемые каллусные клетки сохраняют многие физиологические особенности, свойственные клеткам растения, из которого они были получены. Сохраняются, например, такие свойства, как морозостойкость, устойчивость к абиотическим факторам (температура, засоление, фотопериодическая реакция), а главное, хотя и в разной степени, способность к синтезу вторичных метаболитов. Наряду с общими у каллусных клеток появляются свои, характерные только для них особенности.
Например, длительно культивируемые in vitro клетки высших растений, как каллусные, так и суспензионные, образуют специфическую популяцию, относящуюся к типу неполовых, – популяцию соматических клеток. Наиболее характерные свойства этой популяции – физиологическая асинхронность и генетическая гетерогенность.
Физиологическая асинхронность – наиболее важное свойство неполовой популяции. Оно заключается в том, что в каждый данный момент времени клетки находятся в разных фазах роста: одни делятся, другие растут, а третьи уже стареют. Поэтому общее физиологическое состояние такой популяции принято оценивать по состоянию большинства клеток.
Причины возникающей асинхронности весьма разнообразны:
1. Особенности вида, сорта, генотипа индивидуального растения, а также особенности экспланта.
2. Стрессы культивирования, например неоптимальная для данного вида клеток среда.
3. Изменение баланса эндогенных гормонов и концентрации в среде экзогенных гормонов в течение выращивания.
4. Генетическая гетерогенность клеток и клонов.
5. Аномалия митотического цикла клеток in vitro.
6. Физические факторы (температура, свет, аэрация).
Асинхронность – устойчивое свойство популяции каллусных клеток. Если с помощью специфических воздействий синхронизировать пролиферацию клеток популяции, то уже через 3–4 деления она вновь становится асинхронной.
Генетическая гетерогенность – свойство клеток соматической популяции. Генетически стабильными считаются только клетки меристематических тканей. В клетках остальных тканей при культивировании могут возникать полиплоидия, анеуплоидия, хромосомные аберрации, генные мутации. Однако генетическую гетерогенность нельзя рассматривать как недостаток, поскольку она является необходимым условием существования популяции клеток и служит основой для их адаптации.
В качестве причин появления генетической гетерогенности можно назвать следующие:
1. Генетическая гетерогенность исходного материала. В растениях клетки характеризуются различной плоидностью, диплоидны только активно делящиеся меристематические клетки.
2. Нарушение коррелятивных связей при выделении первичного экспланта из растения.
3. Действие компонентов среды. Экзогенные гормоны и стимуляторы могут оказывать мутагенное действие. Ауксины, особенно 2,4-D, входящие в состав питательных сред, – мутагены; цитокинины способствуют полиплоидизации клеток.
4. Длительное субкультивирование, при котором накапливаются генетически измененные каллусные клетки.
После 5–6 пересадок новый кариотип клеточной популяции, как правило, стабилизируется, если условия культивирования остаются постоянными. В противном случае изменение физических или трофических факторов приведет к новым генетическим изменениям.
Генетическая нестабильность каллусных клеток имеет большое значение для селекционной работы, так как позволяет отбирать штаммы клеток с измененным генотипом. Эти клетки могут обладать уникальными свойствами: повышенной устойчивостью к неблагоприятным факторам, повышенной продуктивностью и т.д. Однако генетическая гетерогенность популяций каллусных клеток в культуре не влияет на сохранение в их геноме основных качеств вида и растения-донора.
Гормоннезависимостъ. Каллусные ткани от большинства растений in vitro образуются только в присутствии в питательной среде и ауксинов, и цитокининов. Исключение составляют, например, незрелые зародыши пшеницы и семядоли подсолнечника. Первые образуют каллусную ткань на питательной среде с 2,4-D, но без цитокининов. Вторые, напротив, – на среде, содержащей цитокинины, но без ауксинов. Вероятно, такая специфика связана с эндогенным содержанием фитогормонов и с компетентностью клеток. Однако при длительном культивировании практически у всех культур может возникать специфическое свойство гормоннезависимости, т. е. автономности по отношению к ауксинам и цитокининам. Эти культуры могут расти на среде без гормонов, что делает их похожими на опухолевые клетки и резко отличает от нормальных каллусных клеток. Внешне же такие гормоннезависимые клетки ничем не отличаются от каллусных.
Клетки, которые в процессе культивирования приобрели свойство автономности от присутствия в среде гормонов, называются «привыкшими». Ткани, образованные такими «привыкшими» клетками, называют «химическими опухолями» в отличие от растительных или генетических опухолей. Генетические опухоли возникают на межвидовых гибридах растений. Растительные опухоли имеют бактериальное или вирусное происхождение. Чаще всего растительные опухоли возникают при попадании в растения агробактерий. Так, Agrobacterium tumefaciens вызывает образование корончатых галлов, A. rhizodenes – бородатого корня, A. rubi – стеблевого галла. Превращение растительных клеток в опухолевые связано с проникновением в них ДНК бактериальной клетки, так называемой Ti-плазмиды, которая значительно изменяет свойства клетки, в том числе экспрессирует гены, контролирующие синтез ауксинов и цитокининов. Гормоннезависимость «привыкших» клеток связана с изменением активности собственных генов, ответственных за синтез белков-ферментов, участвующих в синтезе гормонов. Таким образом, «привыкшим» тканям и растительным опухолям в равной степени свойственна гормоннезависимость, но у растительных опухолей она носит генетический характер. У «привыкших» клеток это свойство достигается главным образом за счет эпигеномных изменений. Существует еще одна особенность, позволяющая отличить «привыкшие» и опухолевые клетки от обычных каллусных. Обычно ни опухолевые, ни «привыкшие» ткани не способны к нормальной регенерации. Они могут образовывать уродливые органоподобные структуры, так называемые тератомы. В отдельных случаях у длительно культивируемых тканей удается отодвинуть порог «привыкания» благодаря изменению состава питательных сред и добиться регенерации нормального растения.
7.1.6. Морфогенез в культуре каллусных клеток
как проявление тотипотентности растительной клетки
Дифференцировка каллусных клеток
Одна из наиболее интересных, но сложных проблем в биологии – развитие многоклеточных организмов. Изучение данного вопроса возможно несколькими путями. Так, большое распространение получило моделирование процессов онтогенеза на более простых системах. При этом используют изолированные ткани, клетки, протопласты, культивируемые в стерильных условиях. Преимущество этого процесса состоит в том, что нет необходимости постоянно учитывать результаты взаимодействия органов в целостной системе растительного организма. Кроме того, экспериментатор сам имеет возможность выбирать, изменять и повторять условия опыта в соответствии с поставленной задачей. После завершения дедифференцировки дальнейшее развитие каллусной клетки может идти в нескольких направлениях. Во-первых, это вторичная дифференцировка разной степени сложности. Во-вторых, в клетке может сформироваться состояние стойкой дедифференцировки («привыкание»), а следовательно, способность расти на безгормональной среде. В-третьих, каллусная клетка проходит свой цикл развития, завершающийся ее старением и отмиранием.
Наибольший интерес вызывает первый путь, фактически представляющий морфогенные процессы. В культуре каллусных тканей морфогенезом называют возникновение организованных структур из неорганизованной массы клеток.
Вторичная дифференцировка каллусной клетки может завершиться образованием в каллусной ткани отдельных дифференцированных клеток. Они имеют определенное строение и выполняют специфические функции. Примером служит образование эпибластов – клеток, в которых запасаются вторичные метаболиты. Это наиболее простой тип дифференцировки каллусной клетки. Более сложная гистологическая дифференцировка завершается образованием в каллусе различных тканей: млечников, волокон, трихом, элементов ксилемы (трахеи и трахеиды) и флоэмы (ситовидные трубки и клетки-спутницы). К самым сложным видам вторичной дифференцировки относятся органогенез – образование органов и соматический эмбриогенез – образование из соматических клеток эмбриоидов, биполярных зародышеподобных структур. Все эти типы дифференцировки возможны только благодаря тотипотентности: любая растительная клетка содержит полный набор генов, характерный для того организма, из которого она была выделена. Потенциальные возможности всех клеток этого растения одинаковы; каждая из них в определенных условиях может дать начало целому организму. Однако выяснено, что реально детерминируется только одна из 400–1 000 клеток, что, вероятно, связано с физиологическим состоянием клетки, с ее компетентностью. Так, у эксплантов стеблевого происхождения компетентны к действию экзогенных фитогормонов и, следовательно, способны к морфогенезу только клетки эпидермальных и субэпидермальных тканей (Тран Тан Ван, 1981). Однако компетентность клеток может приобретаться ими в процессе культивирования каллусной ткани, в условиях, индуцирующих морфогенез. Время, в течение которого в каллусных клетках возникает это свойство, изменяется в широких пределах. Кроме того, существенную роль в дифференциации играют генотип растения-донора, условия и физические факторы культивирования.
Все каллусные клетки, готовые к вторичной дифференцировке, т. е. детерминированные, характеризуются общими чертами. Эти клетки – «клетки-инициали»– образуют утолщенную клеточную стенку, обособляясь от остальных каллусных клеток. Для них характерно более крупное ядро, большее количество запасных веществ, меньшие размеры вакуолей. В «клетках-инициалях» начинается синтез определенных белков, интенсифицируется пентозофосфатный путь расщепления гексоз. Очень важно, что между этими клетками, формирующими меристематические очаги, восстанавливаются плазмодесмы, которые практически отсутствуют в массе каллусных клеток.
Интересное предположение было высказано Л. Саксом и С.Тойвоненом (1963). Оно сводится к тому, что существует минимальная масса каллусных клеток, которая определяет способность уже детерминированных клеток к дальнейшему морфогенезу. Это подтвердилось в опытах с культурой семядолей ели: детерминация адвентивных побегов происходила в клеточных комплексах из 5–6 клеток (Б.С.Флинн и др., 1988). В исследованиях С. Номура и А. Комамине (1989) было показано, что развитие соматических зародышей детерминируется в 6–10-клеточном агрегате.
На регуляцию морфогенеза существенно влияет качество света. Показано (Л.Коппель, 1992), что морфогенный каллус образуется чаще на синем свету, чем на белом или красном. Изменения на уровне индивидуальных белков во время реализации морфогенетической программы в культуре тканей позволили говорить о существовании белков развития. Однако отсутствие специфических тестов на эти белки не позволяет их выявить. Вместе с тем при использовании гибридов, продуцирующих моноклональные антитела на мембранные белки соматических зародышей, удалось выявить полипептид с молекулярной массой 45 кДа, который встречается в ядре нескольких видов растений и возможно участвует в регуляции клеточного деления (Г. Смит и др., 1988). В настоящее время большое внимание уделяется генетическому аспекту морфогенеза, изучению соматического эмбриогенеза как генетически наследуемого признака. Роль основного двигателя процесса развития отводится дифференциальной активности генов. Предполагается, что гены, контролирующие соматический эмбриогенез, начинают экспрессироваться в критические периоды развития эмбриоидов (Н.А.Моисеева, 1991).
Гистогенез
Главную роль в преобразовании каллусных клеток в сосудистые элементы играют фитогормоны, в основном ауксины. Опыты по влиянию апикальной меристемы побега (место синтеза ауксинов) на гистогенез в каллусной ткани показали, что ниже места прививки апекса в каллусной ткани начинали образовываться сосудистые элементы. Тот же эффект наблюдался при нанесении на каллус ауксина с сахарозой. Интересно, что повышение концентрации сахарозы способствовало образованию элементов флоэмы, а понижение – образованию ксилемных элементов. Причем такое действие оказывала совместно с ауксином только сахароза, что позволяет говорить о ее регуляторной роли. Добавление к гормону других сахаров гистогенеза не вызывало. В некоторых случаях стимуляторами гистогенеза помимо ауксинов могут быть и остальные фитогормоны. Так, было отмечено, что в каллусных тканях сои этот процесс начинается под действием гибберелловой кислоты и этилена.
Органогенез
Первые работы Ф. Скуга и С. Миллера по влиянию ауксинов и открытого ими кинетина на органогенез в каллусах растений показали прямую зависимость этого процесса от соотношения фитогормонов. Преобладание концентрации ауксина над цитокинином вызывает дифференцировку клеток, приводящую к образованию корневой системы. В этом случае регенерации целого растения не происходит. При увеличении концентрации цитокинина и уменьшении ауксина начинаются стеблевой органогенез и образование побега. Если его пересадить на свежую питательную среду с преобладанием ауксина, то наблюдается образование корней и регенерация целого растения. В настоящее время доказано, что для прохождения органогенеза очень большое значение имеют принадлежность растения-донора к классу двудольных или однодольных, его генотип, а также тип экспланта. Кроме того, морфогенез можно получить только при условии подбора оптимальной питательной среды, определенных физических факторов, балансе фитогормонов, присутствии сигнальных белков и белков-акцепторов в клетках.
Среди компонентов, входящих в состав питательных сред, важную роль играют ионы NH4+ и N03–. Присутствие аммонийного азота важно для начала морфогенеза, а добавление нитратного азота способствует росту и развитию образовавшихся структур. Фитогормоны, используемые для стимуляции органогенеза, не ограничиваются теперь только ауксинами и цитокининами. С этой целью в питательную среду вводят другие классы фитогормонов: абсцизины, гиббереллины, этилен.
Влияние типа экспланта на морфогенез было четко показано в работах Н.П.Аксеновой, Т.В. Бавриной, Т.Н. Константиновой. Они установили, что только экспланты, выделенные из верхних междоузлий, могут образовывать каллус, способный к флоральному морфогенезу. Каллусы, полученные на эксплантах из нижних междоузлий, давали начало только вегетативным органам.
Вопрос о механизме запуска вторичной дифференцировки у каллусных клеток остается открытым. В настоящее время самое раннее событие, связанное с морфогенезом, – это появление тканеспецифичных белков. Установлено, что все морфогенетические изменения активируются и (или) контролируются специальными генами.
Соматический эмбриогенез
При соматическом эмбриогенезе клетка-инициаль дает начало зиготе. Регенерант, образующийся из соматического зародыша, полностью сформирован, что устраняет лишние затраты по укоренению полученных при органогенезе побегов. Кроме того, соматические эмбриоиды точнее воспроизводят генотип исходного растения по сравнению с растениями-регенерантами, полученными в результате органогенеза. Соматические зародыши представляют и чисто практический интерес, так как могут быть использованы для получения искусственных семян.
Соматический эмбриогенез очень важен для фундаментальных наук. Он позволяет изучать механизмы эмбриогенеза, так как почти все его фазы, за исключением первой, в растении и в культуре тканей совпадают. Наиболее ранняя из изученных фаз детерминации клетки по эмбриональному пути развития состоит в приобретении ею свойств полярности. Так, при определении плотности биоэлектрического потенциала для четырех морфогенных клеток оказалось, что максимальная плотность электрического тока была на полярных полюсах этой группы клеток. Переход клеток в следующую фазу эмбриогенеза сопровождался значительным повышением плотности тока. Предполагается, что морфогенные клетки могут поддерживать полярность за счет активного базипетального транспорта эндогенного ауксина, градиента биоэлектрических потенциалов, градиента ионов кальция.
В связи с этим особый интерес представляют работы Ю.Б.Долгих (1994), в которых было установлено, что слабый постоянный электрический ток (2 мкА) может быть индуктором эмбриогенеза. Соматический эмбриогенез фактически не зависит от экзогенных фитогормонов, только развитие сформировавшихся соматических зародышей начинается в отсутствие ауксинов в среде. Однако содержание эндогенных фитогормонов имеет решающее значение для индукции эмбриогенеза.
7.1.7. Изолированные протопласты,
их получение и культивирование
Впервые термин «изолированные протопласты» был предложен Д. Ханстейном в 1880 г. Протопласт в целой клетке можно наблюдать во время плазмолиза. Изолированный протопласт – это содержимое растительной клетки, окруженное плазмалеммой. Целлюлозная стенка у данного образования отсутствует. Изолированные протопласты – одни из наиболее ценных объектов в биотехнологии. Они позволяют исследовать различные свойства мембран, а также транспорт веществ через плазмалемму. Главное их преимущество состоит в том, что в изолированные протопласты достаточно легко вводить генетическую информацию из органелл и клеток других растений, прокариотических организмов и из клеток животных. Е. Коккинг установил, что изолированный протопласт благодаря механизму пиноцитоза способен поглощать из окружающей среды не только низкомолекулярные вещества, но и крупные молекулы, частицы (вирусы) и даже изолированные органеллы.
Большое значение в создании новых форм растений для изучения взаимодействия ядерного генома и геномов органелл имеет способность изолированных протопластов сливаться, образуя гибридные клетки. Таким способом можно добиться получения гибридов от растений с разной степенью таксономической удаленности, но обладающих ценными хозяйственными качествами.
Впервые протопласты были выделены Дж. Клеркером в 1892 г. при изучении плазмолиза в клетках листа телореза (Stratiotes abides) во время механического повреждения ткани. Поэтому этот метод назван механическим. Он позволяет выделить лишь небольшое количество протопластов (выделение возможно не из всех видов тканей); сам метод длительный и трудоемкий. Современный метод выделения протопластов заключается в удалении клеточной стенки с помощью поэтапного использования ферментов для ее разрушения: целлюлазы, гемицеллюлазы, пектиназы. Этот метод получил название ферментативного.
Первое успешное выделение протопластов из клеток высших растений данным методом сделано Е. Коккингом в 1960 г. По сравнению с механическим ферментативный метод имеет ряд преимуществ. Он позволяет сравнительно легко и быстро выделять большое количество протопластов, причем они не испытывают сильного осмотического шока. После действия ферментов смесь протопластов пропускают через фильтр и центрифугируют для удаления неразрушенных клеток и их осколков.
Выделить протопласты можно из клеток растительных тканей, культуры каллусов и суспензионной культуры. Оптимальные условия для изоляции протопластов для разных объектов индивидуальны, что требует кропотливой предварительной работы по подбору концентраций ферментов, их соотношения, времени обработки. Очень важным фактором, позволяющим выделять целые жизнеспособные протопласты, является подбор осмотического стабилизатора. В качестве стабилизаторов обычно используют различные сахара, иногда ионные осмотики (растворы солей СаС12, Na2HPО4, КС1). Концентрация осмотиков должна быть немного гипертонична, чтобы протопласты находились в состоянии слабого плазмолиза. В этом случае тормозятся метаболизм и регенерация клеточной стенки.
Изолированные протопласты можно культивировать. Обычно для этого используют те же среды, на которых растут изолированные клетки и ткани. Сразу же после удаления ферментов у протопластов в культуре начинается образование клеточной стенки. Протопласт, регенерировавший стенку, ведет себя как изолированная клетка, способен делиться и формировать клон клеток. Регенерация целых растений из изолированных протопластов сопряжена с рядом трудностей. Получить регенерацию через эмбриогенез удалось пока только у растений моркови. Стимуляцией последовательного образования корней и побегов (органогенез) добились регенерации растений табака, петунии и некоторых других растений. Следует отметить, что протопласты, изолированные из генетически стабильной клеточной культуры, чаще регенерируют растения и с большим успехом используются при исследованиях генетической модификации протопластов.
7.1.8. Использование культур изолированных клеток и тканей
7.1.8.1. Синтез вторичных метаболитов
Помимо фундаментальных исследований метод культуры изолированных тканей широко используется в сельском хозяйстве и промышленном производстве (рис. 7.5). Примером может служить массовое клональное микроразмножение плодовоовощных и декоративных растений, а также их оздоровление от вирусных и других инфекций. С помощью культуры in vitro можно расширить возможности селекционной работы: получать клоны клеток, а затем и растения с запрограммированными свойствами. Благодаря способности клеток синтезировать в культуре вторичные метаболиты возникла отрасль промышленности, осуществляющая биологический синтез веществ, необходимых человеку.
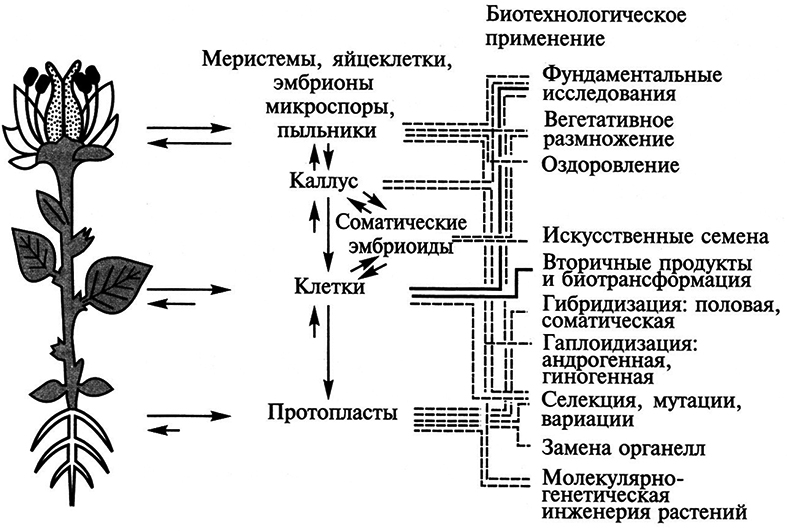
Рис. 7.5. Использование культуры клеток и тканей растений в биотехнологии (по X. Борнман, 1991)
В настоящее время известно примерно 2-104 синтезируемых растениями веществ, которые используются человеком, и их количество постоянно увеличивается. Растения всегда служили источником пищи, эфирных масел, красителей и конечно же лекарственных соединений. Так, мак снотворный (Papaver somniferum) является источником болеутоляющего вещества – кодеина; из наперстянки (Digitalis lanata) получают дигоксин, тонизирующий сердечную деятельность; из хинного дерева (Cinchona ledgeriапа) – антималярийное средство хинидин. Особое место занимают наркотики и стимулирующие вещества. В небольших, строго контролируемых количествах их используют в медицине. Однако при систематическом употреблении низких концентраций наркотиков возникают наркозависимость и стремление к увеличению употребляемой дозы. Применение высоких концентраций наркотика убивает человека. Наиболее известны опиум и героин из Papaver somniferum, кокаин из Erythroxylon, никотин из различных сортов табака. Наиболее известный стимулятор – кофеин, содержащийся в растениях чая и кофе. Стимуляторы не токсичны в концентрациях, рекомендуемых к применению. Однако высокие их концентрации негативно влияют на сердечно-сосудистую и нервную систему человека.
Большой интерес вызвало открытие пиретринов, выделенных из цветков Chrysanthemum cinerariaefolium. Эти вещества – мощные инсектициды. Особая их ценность заключается в том, что пиретрины не вызывают привыкания у насекомых, а также не проявляют кумулятивного токсического эффекта.
Способность интактных растений синтезировать различные соединения привела к предположению, что тем же свойством будут обладать клетки и ткани этих растений, выращиваемые в стерильных условиях. Для некоторых культур это оказалось справедливым. Но в отдельных случаях клетки либо не проявляли способности к синтезу необходимых веществ, либо синтезировали их в минимальных количествах. Понадобились долгие эксперименты по подбору питательных сред, условий культивирования, исследованию новых штаммов, полученных благодаря генетической гетерогенности каллусных клеток или применению мутагенных факторов, чтобы добиться серьезных успехов в этой области.
В настоящее время промышленный синтез вторичных метаболитов – очень перспективное направление. Синтез вторичныхметаболитов происходит главным образом в суспензионной культуре клеток, в регулируемых условиях, поэтому он не зависит от климатических факторов, от повреждения насекомыми. Культуры выращивают на малых площадях в отличие от больших массивов плантаций с необходимыми растениями. Культуры клеток растений могут синтезировать практически все классы соединений вторичного обмена, причем довольно часто в количествах, в несколько раз превышающих их синтез в целых растениях. Например, выход аймалицина и серпентина в культуре клеток Catharanthus rose us составляет 1,3 % сухой массы, а в целом растении – 0,26 %. В культуре клеток Dioscorea deltoidea диосгенин синтезируется в количестве 26 мг на 1 г сухой массы, а в клубнях растений его содержание составляет 20 мг на 1 г сухой массы. Кроме того, в культурах клеток может начаться синтез веществ, не характерных для исходного растения, либо расширяется набор синтезируемых соединений. В ряде случаев в клеточной культуре образуются вещества, которые синтезировались интактным растением на ювенильной фазе развития, либо вещества, содержавшиеся в клетках филогенетически более ранних групп растений. Так, в культуре клеток Papaver bracteatum содержится сангвирин, характерный для ювенильных растений, и отсутствует тебаин, синтезируемый взрослыми растениями. А в культуре клеток живокости (Delphinium) синтезируются ∆7-стерины, присутствующие у архаичных групп растений.
Синтез вторичных соединений может коррелировать с процессом дифференцировки в культуре клеток. Например, в суспензионной культуре Papaver somniferum максимальный синтез алкалоидов начинается после того, как в ней дифференцируется достаточно большое количество специализированных клеток млечников, предназначенных для депонирования метаболитов. С другой стороны, культуры клеток табака и моркови синтезируют большое количество никотина и антоцианина соответственно, хотя их клетки слабо дифференцированы. Не существует также однозначного ответа на вопрос, как связан синтез вторичных метаболитов с ростовыми процессами. У большого числа культур вторичные метаболиты синтезируются и накапливаются в значительных количествах либо во время экспоненциальной фазы, когда ростовые процессы особенно активны, либо в период стационарной фазы роста культуры клеток, когда прирост клеточной массы прекращается. Однако есть культуры, например культура клеток Catharanthus roseus, у которых синтез вторичных метаболитов сопровождает весь период роста.
Важная особенность культивируемой популяции клеток – ее стабильность в отношении синтеза и накопления продуктов вторичного синтеза. Так, в отделе биологии клетки и биотехнологии ИФР РАН под руководством Р. Г. Бутенко были получены разные штаммы клеток Dioscorea deltoidea, в том числе штамм-сверхпродуцент ИФР ДМ-0,5. Все эти штаммы сохраняли стабильность в отношении синтеза фуростаноловых гликозидов около 26 лет. Интересная особенность большинства клеток в культуре состоит в том, что обычно эти клетки не транспортируют синтезируемые метаболиты в питательную среду или другие клетки, хотя некоторые культуры составляют исключение, в частности культура клеток мака, которые депонируют алкалоиды в млечники. Синтез вторичных метаболитов в культивируемых клетках связан с внутриклеточными органеллами, в основном с пластидами и эндоплазматическим ретикулумом. В клетках, не способных к транспорту метаболитов, продукты вторичного синтеза обычно накапливаются в вакуолях и свободном пространстве (СП) клеток (табл. 7.3).
Таблица 7.3. Внутриклеточная локализация синтеза
и накопления вторичных метаболитов (по Р. Г. Бутенко, 1999)
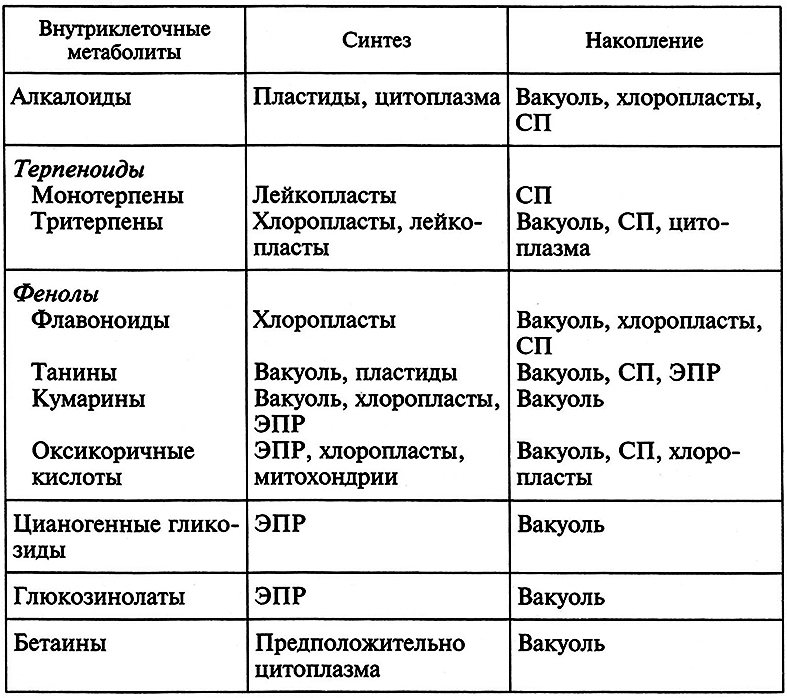
На синтез вторичных метаболитов влияет целый ряд факторов. Прежде всего выход продукта зависит от генотипа растения-донора. Показано, что культуры клеток, полученных от высокопродуктивных растений, продуцировали большее число метаболитов. Другой важный фактор – состав питательной среды и концентрация ее компонентов, которые должны, с одной стороны, обеспечивать увеличение количества клеток-продуцентов, с другой – усиливать сам процесс синтеза. На рост, т.е. на увеличение биомассы, существенно влияет природа и количество углеводов, соединений азота и фосфора, на синтез метаболитов – природа и концентрация фитогормонов. Так, при замене одного ауксина на другой, например нафтилуксусной кислоты на 2,4-D, трехкратно увеличился синтез антрахинона суспензионной культурой Morinda citrifolia.
Очень большое влияние на рост суспензионной среды оказывает ее непрерывное перемешивание, которое обеспечивает хорошую аэрацию и предотвращает осаждение клеток. В лабораторных условиях перемешивание достигается благодаря использованию качалок или роллерных установок. При промышленном выращивании суспензионных культур применяют специальные системы, в которых идут увеличение биомассы и синтез вторичных соединений, – биореакторы. Эти системы обладают важными преимуществами: возможностью управлять процессом культивирования на основе показаний датчиков; кроме того, большой объем культивируемого материала позволяет забирать значительные пробы, при этом стрессовые реакции у культуры клеток не возникают. В зависимости от способа перемешивания культуральной жидкости биореакторы делят на две группы.
Первая группа включает биореакторы, в которых суспензионная культура перемешивается только за счет подачи воздуха; во второй группе биореакторов культура перемешивается механическим способом (рис. 7.6).
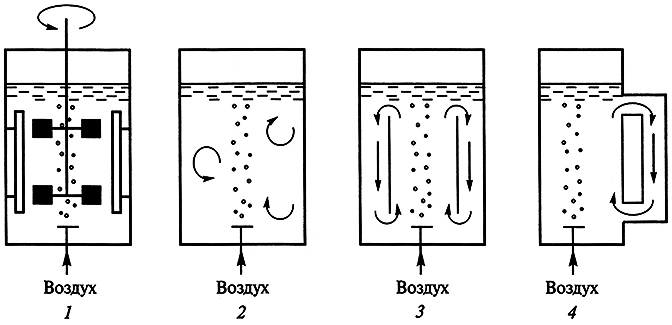
Рис. 7.6. Схема работы основных типов биореакторов:
1 – биореактор с механическим перемешивающим устройством; 2 барботажный биореактор;
3 – аэролифтный биореактор; 4 – биореактор с вынесенной циркуляционной петлей
Выращивание культур растительных клеток в биореакторах проводят в двух режимах. Первый режим – периодическое культивирование – заключается в том, что по окончании процесса откачивают и используют всю суспензию клеток. При втором режиме – проточном культивировании – в биореактор постоянно добавляют свежую питательную среду и одновременно отбирают тот же объем либо суспензии (открытое проточное культивирование), либо одной отработанной питательной среды, оставляя клетки в реакторе (закрытое проточное культивирование).
Существуют две разновидности открытого культивирования. Первая – турбидостат – подразумевает измерение и автоматическое поддержание концентрации клеточной биомассы в реакторе на одном уровне путем изменения скорости протока. Вторая разновидность – хемостат – заключается в подаче в биореакгор с постоянной скоростью питательного раствора при одновременном откачивании с той же скоростью клеточной суспензии.
Существует еще одна современная технология получения вторичных метаболитов с помощью иммобилизованных клеток культуры, т. е. помещение их в определенный носитель или адсорбция в нем. Носитель с клетками помещают в питательную среду. Клетки остаются живыми. Они прекращают рост, но продолжают синтез метаболитов, выделяя их в среду.
Довольно часто синтез вторичных метаболитов в суспензионной культуре останавливается на промежуточных этапах, не доходя до необходимого продукта. Получение продукта возможно благодаря процессу биотрансформации. Сущность его состоит в изменении промежуточных метаболитов с помощью культур других растений или клеток бактерий. Биотрансформация очень эффективна в бактериальных клетках, поэтому растительные клетки используют, когда процесс не осуществляется в клетках микроорганизмов. Вводимые в эти культуры вещества могут подвергаться гидроксилированию, эпоксидированию, глюкозилированию, этерификации, а также присоединяться к аминокислотам. Например, культура клеток женьшеня корневого происхождения способна трансформировать (гликозилировать) фенольные соединения – продукты деятельности суспензионной культуры клеток корня Panax ginseng. Культуры клеток лебеды и картофеля могут биотрансформировать индолил-3-уксусную кислоту в индолил-3-ацетил-L-аспарагиновую кислоту (Н.И. Рекославская и др., 1991).
Еще один пример – биотрансформация карденолидов, гликозиды которых используют в медицине для лечения болезней сердца. Растения наперстянки (.Digitalis lanata) в большом количестве синтезируют дигитоксин вместо необходимого дигоксина. Для соответствующей биотрансформации с успехом используют недифференцированную суспензионную культуру наперстянки. Иммобилизованные клетки этой культуры способны долгое время с постоянной скоростью трансформировать β-метилдигитоксин в β-метилдигоксин (А. В. Альферманн и др., 1987).
Таким образом, использование суспензионных культур для синтеза вторичных метаболитов в промышленных масштабах имеет большие перспективы, и не только с точки зрения экономической выгоды получения более дешевой продукции в запланированных количествах. Важно, что использование культуры клеток спасет от уничтожения тысячи дикорастущих растений, ставших уже редкими, которые синтезируют необходимые человеку вещества. Увеличение выхода продукта может быть достигнуто благодаря дальнейшей исследовательской работе по селекции специализированных популяций клеток и оптимизации условий культивирования. Большой интерес представляет также дальнейшее развитие методов биотрансформации метаболитов и иммобилизации культивируемых клеток.
7.1.8.2. Биотехнологии в сельском хозяйстве
Ускорение и облегчение селекционного процесса, а также создание растений с новыми качествами – это направления, которые достаточно успешно развиваются с помощью технологий клеточной инженерии, культуры клеток и тканей.
Две группы методов, благодаря которым развиваются данные направления, представлены в табл. 7.4.
Таблица 7.4. Клеточные технологии в селекции растений (по Р. Г. Бутенко, 1999)
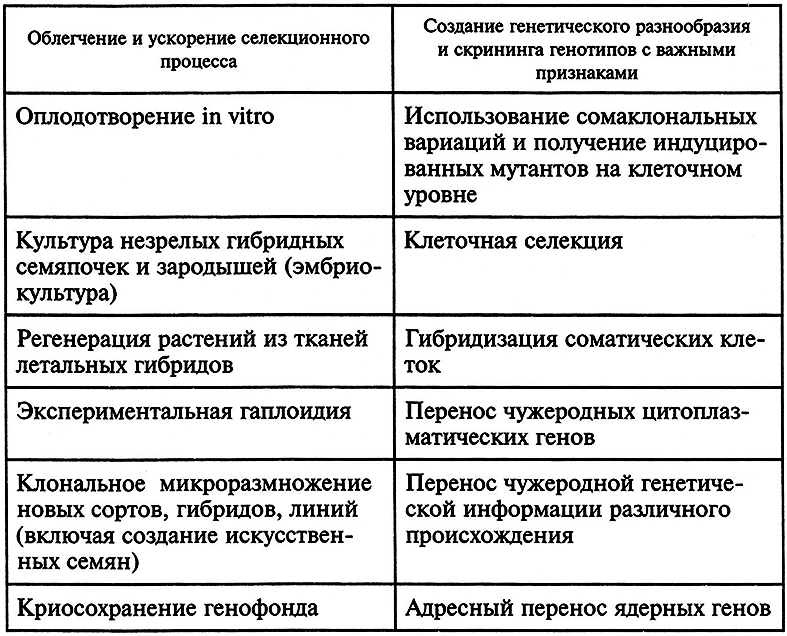
Некоторые из указанных технологий стали традиционными, другие находятся на начальных этапах разработки. Наконец, есть такие методы, которые явно вышли из ранга вспомогательных, ускоряющих селекцию технологий. К ним можно отнести криосохранение генофонда – технологию, в настоящий момент приобретшую экологическую направленность; или клональное микроразмножение растений, тесно связанное с проблемой их оздоровления от вирусных и других инфекций. Поэтому обзор этих технологий вынесен за рамки данного раздела.
Технологии, облегчающие селекционный процесс
Одна из наиболее важных технологий этой группы – оплодотворение in vitro, помогающее предотвратить прогамную несовместимость, которая может быть вызвана следующими причинами:
1) генетически детерминированное (определенное) несоответствие секрета рыльца материнского растения и пыльцы отцовского, которое тормозит рост пыльцевых трубок на рыльце пестика;
2) несоответствие длины столбика пестика и пыльцевой трубки, в результате чего пыльцевая трубка не достигает семяпочки (гетеростилия);
3) тканевая несовместимость партнеров, приводящая к остановке роста пыльцевой трубки в любой момент ее прорастания от рыльца пестика до микропиле семяпочки (гаметофитный тип несовместимости).
Преодоление прогамной несовместимости возможно благодаря выращиванию в стерильных условиях изолированной завязи с нанесенной на нее пыльцой или изолированных кусочков плаценты с семяпочками, рядом с которыми или непосредственно на ткани которых культивируется пыльца.
Значительным препятствием для селекции служит также постгамная несовместимость, вызванная разновременным развитием зародыша и эндосперма при отдаленной гибридизации. В результате образуются невсхожие щуплые семена. Получить растение из таких семян можно только при использовании метода эмбриокулътуры, т. е. выращивания изолированного зародыша на искусственной питательной среде in vitro. Метод эмбриокультуры широко применяют при межвидовой гибридизации овощных растений, для микроразмножения ценных гибридов, для клеточной селекции.
Большое значение имеет создание гаплоидов, позволяющее ускорить процесс селекции в 2 – 3 раза. Использование гаплоидных клеток и гаплоидных растений способствует обнаружению экспрессии введенного в клетку генома, редких рекомбинаций, рецессивных мутаций, которые в диплоидных растениях, как правило, маскируются доминантными генами. Из гаплоидных клеток можно выделить протопласты; сливаясь, они образуют гибридные клетки и растения с диплоидным числом хромосом. Обрабатывая гаплоидные клетки колхицином, можно добиться удвоения числа хромосом и получить диплоидные гомозиготные растения. Все это значительно облегчает выявление и стабилизацию необходимых признаков. Кроме селекции гаплоиды применяются также в генно-инженерных исследованиях. Впервые возможность получения спонтанных гаплоидов при аномальном развитии пыльников, пыльцы и других объектов была показана в 1964 г. С. Гуха и С. Магешвари. В настоящее время в культуре гаплоидные растения получают из изолированных пыльников (андрогенез), изолированных семяпочек (гиногенез), из гибридного зародыша, у которого в результате несовместимости потеряны отцовские хромосомы (партеногенез). Новые сорта ячменя – Исток и Одесский-15 – были выведены благодаря комбинации партеногенетического метода с культурой изолированных зародышей за 4 года вместо 10–12 лет, необходимых для обычной селекции.
Создание генетического разнообразия
исходных форм растений и скрининга генотипов
Сомаклональная изменчивость – прекрасный источник генетического разнообразия (сомаклональных вариаций), которое может быть реализовано в создании генетически измененных растений-регенерантов с новыми свойствами (сомаклоналъные варианты, или сомаклоны). Помимо повышения генетического разнообразия использование сомаклональных вариантов в два раза может ускорить процесс выведения нового сорта даже для размножаемых семенами растений. Первые сомаклональные варианты табака были получены в Институте физиологии растений им. К. А. Тимирязева (Н. А. Загорина, З.П.Шамина, 1970).
Сомаклональные вариации нельзя рассматривать как случайные спонтанно возникающие мутации. Генетические изменения, характерные для сомаклональных вариаций, сложны и носят комплексный характер. Частота таких генетических изменений на три порядка превышает частоту спонтанных мутаций. Кроме того, сомаклональные варианты отличаются от исходного растения не только качественными моногенными признаками, но и количественными – полигенными (интенсивность роста, продуктивность, устойчивость к неблагоприятным факторам внешней среды).
Отмечены случаи появления сомаклональных вариантов, сочетающих признаки, которые невозможно или трудно соединить в одном генотипе традиционным селекционным путем. Так, Л.А.Кучеренко (1986) выделила из сомаклональных вариантов, возникших в каллусной культуре риса, растения, сочетавшие скороспелость и длиннозерность. На их основе за короткий срок был создан новый сорт риса.
По-разному сказываются на генетических изменениях и, следовательно, на появлении сомаклональных вариаций различные типы морфогенеза. Экспериментально установлено, что при соматическом эмбриогенезе цикл «клетка –растение» совершается значительно быстрее, чем при органогенезе. Поэтому степень различия между полученным и исходным родительским генотипом в случае органогенеза может быть значительно выше, чем при эмбриогенезе.
Источником генетического разнообразия растительного материала могут быть не только сомаклональные вариации, но и мутагенез, в несколько раз повышающий образование стабильно устойчивых по искомым признакам клонов клеток.
После получения различных сомаклональных вариаций от исходного растения наступает следующий этап – отбор необходимых сочетаний признаков. Данный вопрос решается с помощью клеточной селекции, которую проводят практически на любом объекте, введенном в культуру in vitro. Однако удобнее использовать суспензионную культуру или изолированные протопласты. Преимущество этих объектов состоит в быстром росте культуры и равномерном действии селективного фактора на все клетки. Для отбора сомаклональных вариаций соответствующие селективные факторы (соли в высоких концентрациях, гербициды и др.) добавляют в питательную среду для выращивания культуры клеток либо растущие культуры помещают в селективные условия (низкая или высокая температура, освещенность и т.д.). Существует несколько методов клеточной селекции:
1. Прямая (позитивная) селекция, при которой выживает только заданный тип мутантных клеток.
2. Непрямая (негативная) селекция, которая ведет к гибели делящихся клеток дикого типа и выживанию метаболически неактивных клеток. Этот прием требует дополнительной идентификации мутационных изменений у выживших клеток.
3. Тотальная селекция, при которой индивидуально тестируются все клеточные клоны.
4. Визуальная селекция и неселективный отбор, когда необходимая вариантная линия выбирается среди прочих визуально или с помощью биохимических методов.
Для отбора клеток, устойчивых к неблагоприятным или стрессовым факторам, наиболее часто применяют прямую селекцию. После выбора нужной популяции необходимо проверить стабильность устойчивости к неблагоприятному фактору. Это длительный процесс, включающий многочисленные циклы выращивания и пересадки клеток на среды, содержащие селективный фактор или без него. Из стабильных клонов необходимо попытаться регенерировать растения. Получение растений-регенерантов, а также гибридологический анализ подтверждают генетическую природу признака, а не адаптационный его характер. Следует, однако, отметить, что кропотливая работа по клеточной селекции не всегда приводит к нужному результату. Это связано с различием механизмов клеточной устойчивости и устойчивости растений. Либо клеточная устойчивость может быть только частью общего механизма, работающего в целом растении, как это наблюдается при создании устойчивости к засолению. Вместе с тем механизмы устойчивости к низким температурам, гербицидам, высоким концентрациям алюминия имеют, по-видимому, сходный характер у клеток и у целых растений. В последнем случае есть возможность получить из устойчивых клеточных популяций растение-регенерант, устойчивое к тому же фактору. Затем из большого числа сомаклонов отбирают и проверяют в полевых условиях на стабильность те, которые имеют хозяйственно важные признаки, восполняющие отдельные недостатки исходного сорта. Так, после трехлетних полевых испытаний сомаклонов сорта Любимец удалось выделить линии, превосходящие сорт по урожайности, устойчивости к фитофторе и степени зараженности вирусами.
Метод негативной селекции используется главным образом для выявления мутантов, ауксотрофных в отношении аминокислот, пуриновых и пиримидиновых оснований, витаминов и других важных метаболитов (Ю.Б.Долгих, 3.П.Шамина, 1982). Ауксотрофные мутанты очень ценны для фундаментальных исследований механизмов генной регуляции синтеза этих веществ в клетке и в растении.
Гибридизация соматических клеток
Данный процесс осуществляется благодаря слиянию протопластов, изолированных из соматических клеток растений, и служит для создания новых генотипов, новых форм растений. Использование изолированных протопластов позволяет решать множество теоретических и практических задач. С их помощью можно вести селекцию на клеточном уровне, работать в малом объеме с большим числом индивидуальных клеток, осуществлять прямой перенос генов, изучать мембраны, выделять пластиды. Протопласты непременно участвуют в соматической гибридизации. Термин «соматическая гибридизация», означающий процесс слияния протопластов соматических клеток, был введен Дж. Мельхерсом в 1974 г.
Соматическая гибридизация имеет важные особенности. Во-первых, этому процессу доступны практически любые скрещивания, перенос генов на далекие таксономические расстояния. Во-вторых, слияние протопластов способствует объединению цитоплазматических генов родительских клеток, чего не бывает при скрещивании половых клеток.
Самопроизвольное слияние протопластов происходит достаточно редко. Механизм этого процесса до конца не выяснен. Однако известно, что протопласты имеют отрицательный поверхностный заряд, который вызывает их взаимное отталкивание. Для слияния это отталкивание необходимо преодолеть специальными приемами, способствующими снятию или перераспределению поверхностного заряда мембран. Впервые искусственное слияние протопластов с помощью индуктора слияния (фьюзогена) было осуществлено в 1970 г. Э. Коккингом и его сотрудниками. В настоящее время в качестве эффективных фьюзогенов используют полиэтиленгликоль (ПЭГ) и растворы с рН 9 –11 и высокой концентрацией ионов кальция. Согласно одной из гипотез, объясняющих слияние протопластов при использовании ПЭГ, высокая концентрация этого вещества (20–30%) способствует поглощению всей свободной воды между протопластами, вызывая их слипание в результате дегидратации. Кроме того, поглощение свободной воды индуцирует образование пор в мембране, через которые перетекает внутриклеточное содержимое. Если повреждения мембран обратимы, слипшиеся протопласты регенерируют клеточную стенку (рис. 7.7).
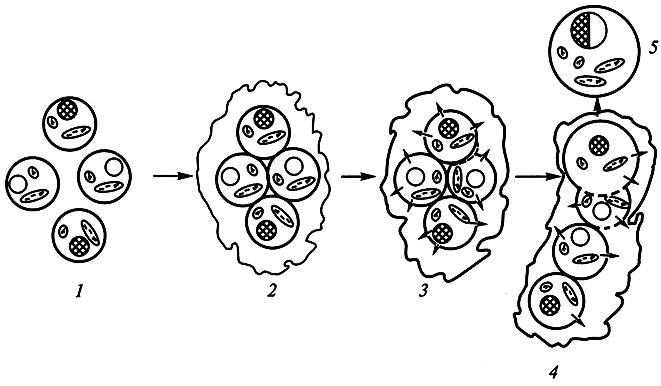
Рис. 7.7. Схема слияния протопластов под действием полиэтиленгликоля (по X. Борнман, 1991):
1 – изолированные протопласты; 2 – слипание протопластов в результате дегидратации;
3 – образование пор в мембране протопласта; 4 – перетекание через поры внутриклеточного материала;
5 – гибридный протопласт
Кроме того, существует физический фактор – импульсы электрического тока, который также заставляет протопласты сливаться. Обработка электрическими импульсами, как и обработка ПЭГ, приводит к обратимому повреждению мембран. Применение переменного тока вызывает диэлектрофорез, и протопласты, находящиеся между электродами, выстраиваются в ряд, примыкая друг к другу своими полярными поверхностями. Импульс постоянного тока приводит к образованию пор, через которые происходит слияние (рис. 7.8).
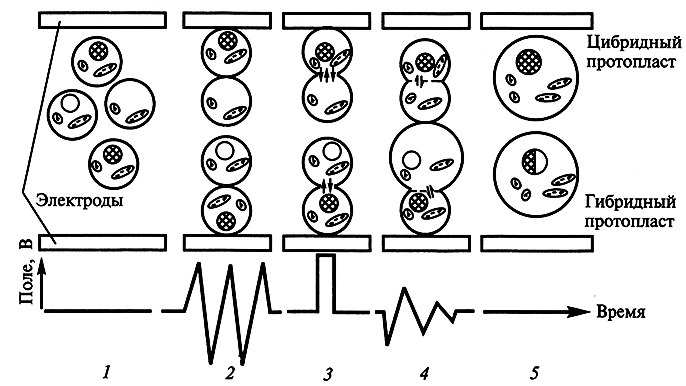
Рис. 7.8. Схема слипания протопластов под действием электрического поля (по X. Борнман, 1991):
1 – изолированные протопласты; 2 – слипание протопластов полярными поверхностями;
3 – образование пор в мембранах под действием сильного импульса постоянного тока;
4 –смешивание цитоплазмы; 5 – образование цибридных (гибридных) протопластов
При соматической гибридизации развиваются клетки двух типов: гибриды и цибриды. При образовании гибридов объединяется ядерный геном обеих клеток. Цибридная клетка содержит цитоплазму обоих партнеров, а ядро – одного. Такой результат достигается при деградации одного из ядер после слияния или в том случае, если один из протопластов был лишен ядра.
Первый неполовой гибрид высших растений был получен в 1972 г. при слиянии изолированных протопластов двух видов табака: Nicotiana glauca и Nicotiana langsdorfii. В настоящее время получено много межвидовых, межсемейственных и межтрибных гибридов, значительную часть которых нельзя считать нормальными растениями, а некоторые гибриды (гибрид арабидопсиса и турнепса) представляют собой растения-монстры. Возникающие аномалии – результат хромосомной несбалансированности. Описаны случаи возникновения гибридов между протопластами эритроцитов крысы и дрожжевых клеток, моркови и человека и др. Любые исследования, любые манипуляции в области создания новых генотипов должны быть тщательно и всесторонне продуманы, а ученые должны помнить об ответственности и научной этике. Профессор Колумбийского университета Э.Чаргафф предупреждал о том, что «в тысяче опытов, вероятно, ничего не случится, но затем в одном каком-то случае произойдет нечто очень неприятное...». Он был «убежден, что именно попытка преобразовать или перехитрить природу почти привела к ее гибели...».
Введение в протопласты макромолекул,
клеточных органелл и бактериальных клеток
Чужеродный генетический материал можно переносить в клетку не только при соматической гибридизации, но и при непосредственном введении ДНК или органелл, содержащих ДНК, в изолированные протопласты. Работы в этом направлении начаты не так давно, но уже получены интересные результаты. Так, поглощение экзогенных макромолекул ДНК показано у протопластов петунии, сои, моркови. Проведена трансплантация органелл (ядер, митохондрий, хлоропластов) в протопласты растений. Наибольшую важность представляют опыты по трансплантации хлоропластов одних растений в клетки других. П.Карлсон провел опыты по введению хлоропластов нормального зеленого растения Nicotiana suaveolens в протопласты пестролистного мутанта N. tabacum. В результате культивирования протопластов были получены зеленые каллусы, из которых регенерировали растение, оказавшееся пестролистным. Для того чтобы понять, содержит растение-регенерант элементы геномов двух видов табаков или только одного, проанализировали белковую фракцию I, в которую входит ключевой фермент цикла Кальвина – рибулозобисфосфаткарбоксилаза. Этот фермент состоит из двух больших субъединиц и двух малых. Большие субъединицы кодируются геномом хлоропластов, малые – ядерными генами. Анализ состава белковой фракции I растения-регенеранта показал присутствие полипептидов, характерных и для пластид N. tabacum, и для пластид N. suaveolens. Перспективность работ по трансплантации хлоропластов заключается в том, что введение высокоэффективных хлоропластов может способствовать активации фотосинтеза и повышению продуктивности других растений.
Среди бактериальных клеток к созданию искусственных ассоциаций с растительными клетками наиболее способны цианобактерии. Это может быть связано с тем, что они часто вступают в симбиотические отношения с другими организмами; что древние цианобактерии, вероятно, участвовали в формировании растительных клеток в процессе эволюции; что цианобактерии способны выделять в среду разнообразные вещества: углеводы, аминокислоты, вещества гормональной природы и другие, которые могут быть использованы культивируемыми клетками растений. Растительные клетки способны потреблять кислород, образующийся в процессе фотосинтеза цианобактерий, а цианобактерии потребляют диоксид углерода, выделяемый растительными клетками при дыхании. Кроме того, азотфиксирующие цианобактерии могут накапливать азот в почве и обеспечивать до 15 % потребностей растений в нем. Например, симбиоз папоротника Azolla с Апаbaena azollae применяют в сельском хозяйстве в качестве источника связанного азота на рисовых полях.
Большой интерес вызывает тот факт, что цианобактерии могут выступать в качестве фототрофного компонента ассоциаций с растительными клетками. Использование питательных сред, в которых не хватает источника углерода, показало, что прирост растительных клеток может быть обеспечен за счет усвоения ими продуктов фотосинтеза цианобактерий или их лизиса. Однако не все сочетания растений и цианобактерий оказывают взаимное благотворное влияние. Выявлена видовая специфичность взаимодействия партнеров. Так, клетки культуры мака и Anabaena variabilis взаимно подавляли рост друг друга. В то же время на рост культивируемых клеток табака, женьшеня, диоскореи цианобактерии оказывали стимулирующее влияние. В большинстве случаев существенное влияние одного партнера на ростовые процессы другого не выявлялось.
Совместное выращивание растительных клеток и цианобактерий имеет еще одну важную особенность. На дефицитной среде оно может приводить к увеличению синтеза вторичных метаболитов по сравнению с их накоплением в монокультуре на полной среде.
Введение азотфиксирующих цианобактерий в культуру растительных клеток могло бы наряду с применением методов генной инженерии решить проблему азотфиксации. Показано, что в смешанных культурах каллуса табака и цианобактерий на среде Мурасиге и Скуга формировались побеги регенерантов табака с участками сине-зеленого цвета, где локализовались цианобактерии. Вероятно, большие межклетники в каллусах табака способствуют проникновению цианобактерий сначала в межклетники каллусной ткани и в область меристемоидов, а затем – в формирующиеся побеги. Цианобактерии сохранялись на поверхности и в тканях стебля и листьев при многочисленных пересадках, образовании вторичных каллусов и последующей регенерации из них побегов, т. е. образовывалась устойчивая ассоциация растительной и бактериальной клетки. Азотфиксирующие цианобактерии обеспечивали рост растительных клеток в суспензионных и каллусных смешанных культурах на питательных средах, дефицитных по азоту, а в ассоциациях с растениями – и в песчаной культуре, не содержащей связанного азота. Это действие обеспечивается, по-видимому, за счет продуктов азотфиксации, выделяющихся в среду. В свою очередь, цианобактерии могут получать от растений углеводы. Причем цианобактерии, предварительно культивируемые с растительными клетками, получают от побегов в 2,5 раза больше меченых соединений углерода по сравнению с цианобактериями, взятыми из чистой культуры. В результате такого потребления растение-хозяин может значительно снизить интенсивность собственных ростовых процессов. Поэтому прежде чем приступить к практическому использованию искусственных ассоциаций, необходимо решить проблему обеспечения азотфиксирующего симбионта органическими веществами без нанесения существенного ущерба растению.
7.1.8.3. Клональное микроразмножение и оздоровление растений
Клональным микроразмножением называют неполовое размножение растений с помощью метода культуры тканей, позволяющее получать растения идентичные исходному. В основе получения таких растений лежит способность соматических клеток растений полностью реализовывать свой потенциал развития, т. е. свойство тотипотентности. Метод клонального микроразмножения получает все более широкое распространение во всем мире. В большинстве стран эта технология приобрела коммерческий характер.
В России первые работы по клональному микроразмножению были проведены в 60-х годах XX в. в лаборатории Р.Г. Бутенко (Институт физиологии растений им. К.А.Тимирязева). В настоящее время созданы и развиваются лаборатории клонального микроразмножения, связанные с нуждами селекции, размножением декоративных, лекарственных и других растений. Кроме того, технология используется для размножения лучших экземпляров взрослых лесных деревьев, особенно хвойных, для сохранения редких и исчезающих видов растений.
Свое название эта технология размножения получила от термина «клон» (от греч. clon – отпрыск), который предложил Веббер в 1903 г. Клональное микроразмножение имеет существенные преимущества перед традиционными способами размножения:
1. Высокий коэффициент размножения. Одно растение герберы за год при микроклональном размножении дает до 1 млн новых растений, тогда как при обычных способах размножения – только 50–100 растений. Большинство культивируемых в настоящее время сортов лилий размножается только вегетативно. Луковички возникают на материнских луковицах или на побеге в небольших количествах. Технология микроклонального размножения позволяет получить из одной чешуи луковицы за 6 месяцев 105 новых растений (сорт Red Carpet).
2. Получение генетически однородного посадочного материала.
3. Возможность оздоровления растений, освобождения их от вирусов благодаря клонированию меристематических тканей.
4. Возможность размножения растений, которые в естественных условиях репродуцируются с большим трудом.
5. Воспроизведение посадочного материала круглый год, что значительно экономит площади, занимаемые маточными и размножаемыми растениями.
6. Сокращение продолжительности селекционного периода, ускорение перехода растений от ювенильной фазы развития к репродуктивной.
Технология микроклонального размножения
Обязательное условие клонального микроразмножения – использование объектов, полностью сохраняющих генетическую стабильность на всех этапах процесса, от экспланта до растений в поле. Такому требованию удовлетворяют апексы и пазушные почки органов стеблевого происхождения, т.е. меристематические ткани. Их устойчивость к генетическим изменениям, вероятно, связана с высокой активностью систем репарации ДНК, а также с негативной селекцией измененных клеток.
Процесс клонального микроразмножения можно подразделить на три этапа:
1. Получение хорошо растущей стерильной культуры. На этом этапе необходимо правильно выбрать растение-донор, получить свободную от инфекции культуру, добиться ее выживания и быстрого роста на питательной среде.
2. Собственно размножение, осуществляемое несколькими способами:
- активизация пазушных меристем;
- индукция образования адвентивных почек тканями листа, стебля, чешуйками и донцем луковиц, корневищем и зачатками соцветий без первоначального образования каллусной ткани;
- микрочеренкование побега, сохраняющего апикальное доминирование;
- стимуляция образования микроклубней и микролуковичек;
- индукция соматического эмбриогенеза.
3. Подготовка к высадке в поле или к реализации. Это очень важный этап, во время которого в теплице укорененные растения, полученные in vitro, адаптируют к новым условиям внешней среды: проводят закаливание растений, повышают их устойчивость к патогенным микроорганизмам и различным неблагоприятным факторам внешней среды. Существует много различных способов адаптирования растений к пересадке in vivo. Это подбор почвенного субстрата, создание определенной влажности, обработка химическими веществами (глицерин, парафин) для предотвращения обезвоживания листьев. Некоторые древесные растения лучше приживаются, если их заразить in vitro микоризообразующими грибами (Е.А.Калашникова, 1993). Упрощенный способ адаптации пробирочных растений винограда был разработан в Институте физиологии растений им. К.А.Тимирязева РАН. Адаптацию проводят прямо в пробирках, снимая с них пробки, когда растения винограда дорастают до верха пробирки. Через 1,5 –2 недели, когда верхушки побега с двумя развитыми листьями появляются над пробиркой, растение готово к пересадке в почву. Для предотвращения механических повреждений корневой системы растение пересаживают в почву вместе с агаром, заглубляя его так, что над поверхностью почвы остаются только 2 развитых листа, которые выросли из пробирки и уже адаптировались к внешним условиям. Такая методика позволяет значительно упростить, ускорить и удешевить этап акклиматизации растений.
Клональное микроразмножение растений проводят разными способами.
Первый, основной, способ – активизация пазушных меристем. Он состоит в снятии апикального доминирования и активизации развития меристем, существующих в растении. Этот способ основной и в обычном вегетативном размножении. И на интактном растении, и в случае клонирования снятие апикального доминирования достигается или удалением апикальной меристемы побега, или благодаря действию цитокинина. При клонировании цитокинины (6-бензиламинопурин, 6-фурфуриламинопурин, зеатин) добавляют в питательную среду, что приводит к развитию многочисленных пазушных побегов. Эти побеги отделяют от первичного экспланта и культивируют на свежей питательной среде. Активизацию пазушных меристем широко используют в промышленном размножении овощных сельскохозяйственных культур (картофель, томаты, огурцы, сахарная свекла, топинамбур и др.), цветов (гвоздика, роза, гербера), плодовых и ягодных культур (яблоня, вишня, малина, крыжовник и др.), древесных растений (туя, можжевельник и др.). Однако бесконечно размножать таким способом растения нельзя, поскольку длительное воздействие цитокининов, входящих в состав питательных сред, вызывает аномалии в морфологии стебля, потерю способности побегов к укоренению, иногда – гибель растений. В опытах с размножением земляники было показано, что при клонировании необходимо чередовать 2–3 цикла получения побегов с их укоренением.
Второй способ – индукция развития адвентивных почек, т. е. почек, возникающих из растительных клеток и тканей, которые их обычно не образуют. Этот метод в значительной мере обусловлен тотипотентностью клеток. Почти любой орган или ткань растения, свободные от инфекции, могут быть использованы в качестве экспланта и в определенных условиях образуют адвентивные почки. Данный процесс вызывают внесением в питательную среду определенных концентраций цитокининов и ауксинов, причем цитокинина должно быть гораздо больше, чем ауксина. Это наиболее распространенный способ микроразмножения высших растений. Развивая адвентивные почки на апикальных и пазушных меристемах, размножают растения томата, лука, чеснока; на сегментах листовых пластинок – салат, глоксинию, фиалки; на тканях донца луковиц – лук, чеснок, гладиолусы, тюльпаны и другие луковичные растения.
Третий способ – микрочеренкование побега, сохраняющего апикальное доминирование. Растения-регенеранты, полученные любым другим способом, можно черенковать в стерильных условиях, высаживать на свежую питательную среду, укоренять и адаптировать к полевым условиям либо снова подвергать микрочеренкованию для того, чтобы увеличить количество посадочного материала.
Четвертый способ – размножение в биореакторах микроклубнями. Это один из способов ускоренного размножения оздоровленного материала. О. Мелик-Саркисов (1984) сконструировал гидропонную установку, позволяющую получать около 7 000 микроклубней с 1 м2 при массе одного клубня 5 г. Предусмотрена последующая механизированная посадка их в грунт. В отделе биологии клетки и биотехнологии Института физиологии растений им. К.А. Тимирязева РАН создана эффективная полупромышленная замкнутая система пневмоимпульсного биореактора для получения микроклубней картофеля, в которой предусмотрена возможность воздействия на направление и скорость процессов клубнеобразования. Технологии клонального микроразмножения в биореакгорах разработаны не только для сельскохозяйственных, но и для декоративных растений (лилии, гладиолусы, гиацинты, филодендроны и т.д.). Однако созданные установки пока носят лабораторный, модельный характер.
Пятый способ – образование соматических зародышей – основан на морфогенных изменениях – соматическом эмбриогенезе. Впервые это явление было отмечено в середине 50-х годов XX в. в культуре клеток моркови. Формирование эмбриоидов в культуре осуществляется в два этапа. На первом этапе соматические клетки дифференцируются в эмбриональные в присутствии в питательной среде ауксинов, обычно это 2,4-дихлорфеноксиуксусная кислота (2,4-D). На втором этапе развиваются эмбриоиды. Этот процесс идет только при значительном снижении концентрации ауксина или полном отсутствии его в питательной среде. Соматический эмбриогенез может происходить в тканях первичного экспланта, в каллусной и суспензионной культурах.
Поскольку соматические зародыши представляют собой полностью сформированные растения, данный метод позволяет сократить затраты, связанные с подбором условий укоренения и адаптации растений-регенерантов. Кроме того, преимущество получения соматических эмбриоидов состоит в том, что при использовании соответствующей техники капсулирования из них можно получать искусственные семена.
Соматический эмбриогенез в настоящее время применяют для размножения пшеницы, ячменя, моркови, редиса, винограда, некоторых древесных растений (дуб, ель, эвкалипт).
Факторы, влияющие на клональное микроразмножение
Питательная среда. Состав питательной среды – один из наиболее важных факторов при микроразмножении. Обычно используют стандартные среды: Мурасиге и Скуга, Нича и другие, но с добавлением на каждом этапе различных веществ. На первом этапе в питательную среду часто вносят антиоксиданты, чтобы предотвратить гибель клеток из-за активизации гидролитических ферментов. Особое значение имеют концентрация и соотношение фитогормонов в среде. Например, на втором этапе для усиления морфогенеза обычно добавляют цитокинины. Напротив, на третьем этапе при укоренении в питательной среде должно быть только небольшое количество ауксинов (либо используется безгормональная среда). Иногда в среду добавляют гиббереллин (ГК), который стимулирует рост сформировавшихся почек. Важным регуляторным фактором служит сахароза. Обычная концентрация ее в среде составляет 3 %. На растениях каперса было показано, что более высокая концентрация сахарозы в среде приводила к образованию пурпурных, содержащих антоциан, почек возобновления. При концентрациях сахарозы менее 3 % наблюдалось формирование зеленых почек, способных к размножению.
Кроме того, существенное значение имеет состояние среды. Например, культивирование меристем земляники, вишни, черной смородины лучше происходит в жидкой питательной среде, чем в агаризованной.
Состояние экспланта. Морфогенез в значительной мере определяется возрастом и размером экспланта. Так, у эхеверии экспланты из молодых листьев образуют корни, из старых листьев – побеги. И только у листьев среднего возраста возникают и побеги, и корни, т. е. появляется возможность регенерации целого растения. Размер экспланта прямо пропорционально связан с регенерационной способностью: чем крупнее эксплант, тем выше эта способность. Большие экспланты могут самопроизвольно независимо от соотношения в питательной среде ауксинов и цитокининов образовывать почки. Но увеличение размера может привести к негативным последствиям, так как появляется вероятность присутствия в экспланте клеток, содержащих вирусную, грибковую и другие виды инфекции. Оптимальная величина экспланта должна обеспечивать как активный морфогенез, так и полную стерильность.
На регенерационную способность экспланта влияют также физиологическое состояние и таксономическая принадлежность растения-донора. Например, экспланты, выделенные из растений в фазу покоя, обладают более низкой способностью к укоренению и развитию побегов по сравнению с эксплантами, изолированными в фазу активного роста. Двудольные травянистые растения •характеризуются большей регенерационной способностью, чем однодольные.
Физические факторы. Большое значение для успешного клонального размножения имеют температура, условия освещения, качество света, влажность.
Для улучшения клонального микроразмножения физические факторы необходимо подбирать с учетом естественного ареала произрастания культивируемого растения. Так, для тропических растений оптимальная температура культивирования будет приближаться к 27 °С, для растений альпийских лугов – к 18–20 °С, для большинства растений – к 25 °С. Жизнеспособность эксплантов увеличивается, если в начале выращивания поддерживать более низкие температуры. Оптимальная интенсивность освещения для большинства растений составляет 1 000–3 000 лк в течение 14–16 ч в сутки.
Существенное значение для регуляции морфогенеза имеет качество света. У микрочеренков березы красный свет способствовал 100 %-му укоренению, а синий – увеличивал содержание ЦК в тканях растений и таким образом стимулировал образование побегов.
Относительная влажность в камерах, где растут пробирочные растения, поддерживается на уровне 65–75 %. При пересадке в почву эти растения нуждаются в повышенной влажности, что при выращивании в камерах достигается созданием атмосферы «тумана».
Оздоровление посадочного материала
Этот процесс начинается с момента стерилизации экспланта в асептических условиях бокса, с обработки ткани антибиотиками. Однако таким образом удается освободиться главным образом от бактерий, грибных инфекций, нематод. Вирусы, вироиды, микоплазмы остаются в тканях инфицированных растений. Именно из-за вирусных болезней погибает от 10 до 50 % урожая сельскохозяйственных культур, размножающихся вегетативно. Некоторые бобовые растения (соя) могут передавать вирусы даже при семенном размножении.
В 1949 г. было выяснено, что клетки меристематических тканей растений обычно не содержат вирусов. В 1952 г. Дж. Морель и Г. Мартин предложили, используя культивирование меристем, получать здоровые, избавленные от вирусной инфекции растения. Они обнаружили, что при выращивании верхушки побега, состоящей из конуса нарастания и 2–3 листовых зачатков, на ней образуются сферические образования – протокормы. Протокормы можно делить, и каждую часть культивировать до образования корней и листовых примордиев, получая в большом количестве генетически однородные безвирусные растения. В настоящий момент культивирование меристем побега – наиболее эффективный способ оздоровления растительного материала от вирусов, вироидов и микоплазм. Однако при этом способе требуется соблюдать определенные правила. Как уже говорилось, чем меньше размер меристематического экспланта, тем труднее вызвать в нем морфогенез. Чем больше размер экспланта, тем легче идет морфогенез, в результате которого получается целое растение, но тем больше вероятность присутствия вирусов в экспланте. У многих видов и сортов растений зона, свободная от вирусных частиц, различна. Так, при клонировании апикальной меристемы картофеля размером 0,2 мм (конус нарастания с одним листовым зачатком) 70 % полученных растений были свободны от Y-вируса картофеля, но только 10 % – от Х-вируса. В некоторых случаях не удается найти оптимальное соотношение между размером меристематического экспланта и морфогенезом в нем, и при этом избавиться от вирусной инфекции. Приходится дополнять метод культуры меристем термо- или(и) хемитерапией. Так, предварительная термотерапия исходных растений позволяет получать свободные от вирусов растения-регенеранты из меристемных эксплантов размером от 0,3 мм до 0,8 мм. Вместе с тем этот прием может вызвать отставание растений в росте, деформацию органов, увеличение латентных (скрытых) инфекций.
Хорошие результаты дает совместное применение метода культуры тканей и хемитерапии. При внесении в питательную среду препарата «Вирозол» (1-рибофуранозил-1,2,4-триазолкарбоксамид) количество безвирусных растений увеличивается до 80–100%.
В настоящее время для диагностики вирусных растений используют иммуноферментную технику, моноклональные антитела, метод молекулярной гибридизации меченых фрагментов РНК- и ДНК-вироидов и вирусов с вирусами тестируемого объекта. Эти методы очень чувствительны, но трудоемки и дорогостоящи.
После оздоровления с помощью вышеперечисленных технологий нормальные растения-регенеранты размножают обычными методами клонального микроразмножения. Для некоторых растений, например цитрусовых, получить морфогенез из меристем малого размера не удается, поэтому требуется разработка оригинальных методов. Лимоны и апельсины оздоровляют и размножают, используя прививки меристем размером 0,14–0,18 мм на пробирочные подвои, полученные из семян. Достоинство такого подхода состоит и в том, что развивающиеся из меристем побеги не имеют ювенильных признаков, при этом цветение и плодоношение ускоряются.
7.2. КЛЕТОЧНАЯ ИНЖЕНЕРИЯ ЖИВОТНЫХ
7.2.1. Краткая история предмета
Попытки сохранения жизнеспособности животных клеток и их выращивания в питательной среде были предприняты еще в конце XIX в. В 1885 г. исследователь У. Роукс сохранял в жизнеспособном состоянии в теплом физиологическом растворе хорионаллантоисную оболочку куриного эмбриона. В 1897 г. Б. Лоэб установил, что клетки крови и соединительной ткани способны выживать в пробирках с сывороткой и плазмой крови. На той же среде ученый культивировал фрагменты печени, почек, щитовидной железы. Льюнгрен в 1898 г. установил, что в кислой среде экспланты кожи человека можно не только поддерживать в жизнеспособном состоянии, но и сохранять их способность к реимплантации. В 1907 г. Р.Харрисон усовершенствовал метод «висячей капли». Благодаря этому в течение нескольких недель в капле лимфы лягушки сохранялись в жизнеспособном состоянии клетки зачатка нервной системы зародыша лягушки, которые к тому же образовывали нервные волокна. Скорость роста этих клеток составляла 20 мкм за 25 мин. В 1910 г. методика, разработанная Р.Харрисоном, была модифицирована и применена У. Барроузом для выращивания клеток тканей теплокровных животных.
Большой интерес вызвали в 1912 г. работы французского хирурга А. Каррела по созданию культуры «бессмертных» клеток сердца куриного эмбриона. Однако воспроизвести этот результат современники ученого не смогли. Владея хирургической техникой, Каррел при отсутствии антибиотиков сумел усовершенствовать методы создания стерильных условий при пересадке клеток. В 1913 г. он применил новую питательную среду – плазму крови, обогащенную экстрактом эмбриона, которая ускоряла рост ткани в культуре. Наконец, в 1923 г. ученый создал специальный сосуд для культивирования клеток, который получил его имя – колба Каррела. Однако первые попытки длительного культивирования за счет периодического пересаживания клеток в свежую среду были неудачными. Оказалось, что культуры клеток и тканей животных даже при пассировании (пересаживании) имеют ограниченную продолжительность жизни. Примерно после 50 пассажей они стареют и погибают. Исключение составляют опухолевые клетки и клетки с аномальным количеством хромосом. В 1951 г. была создана первая линия опухолевых клеток человека, которую сейчас используют во всех лабораториях мира под названием Hela. В этих клетках содержится 60–70 хромосом вместо обычных 46.
Культуры клеток и тканей нашли широкое применение в вирусологии. Они используются в качестве субстрата для выращивания вирусов в целях изучения последних, а также для получения противовирусных вакцин. Первые удачные эксперименты по получению большого количества вируса оспы крупного рогатого скота были проведены А. Каррелом, У. Риверсом (1927) и Т. Мейтландсом (1928).
Параллельно с совершенствованием методов культивирования клеток и тканей появились важные разработки, позволяющие проводить наблюдения за исследуемыми объектами. В 1928 г. А. Канти создал метод кинефотомикрографии, с помощью которого появилась возможность фото- и киносъемок роста и развития клеток. Была разработана методика трипсинизации – получения индивидуальных клеток. Получение клонов из одной клетки впервые было осуществлено Г. Эрлом с сотрудниками в 1948 г.
Однако основной проблемой культивирования клеток и тканей животных в то время было точное воспроизведение условий выращивания для получения стабильных результатов. Главным препятствием для этого было создание питательной среды с постоянным составом.
7.2.2. Питательные среды
До середины XX в. питательными средами для выращивания клеток служили природные материалы, которые обладают значительной индивидуальностью (лимфа крови, куриный желток и т.д.), что существенно снижало повторяемость результатов. В 1955 г. Игл разработал первый состав стандартной питательной среды (среда Игла), которая позволяла получать воспроизводимые результаты. Она содержит минеральные соли, аминокислоты, витамины, антибиотики, телячью сыворотку, краситель феноловый красный в качестве индикатора рН. Для выращивания животных клеток рН питательной среды служит одним из важнейших факторов, значения которого должны находиться в пределах 7,2–7,4. Поэтому солевые растворы, которые являются основой питательных сред, служат, кроме того, еще и буферными системами, поддерживающими постоянство кислотно-щелочного баланса. Например, для клонального роста диплоидных фибробластов человека W138 оптимальные показатели рН – 7,30 ± 0,15; а для фибробластов из эмбриона цыпленка рН – 7,12 ± 0,18.
Особое значение среди компонентов питательных сред имеет сыворотка, которая выполняет несколько функций. За счет содержащихся в ней компонентов обеспечиваются прикрепление клеток к субстрату и их распластывание на нем, транспорт минеральных и органических веществ, стимулирование роста и деления клеток. За усиление деления клеток отвечают специфические вещества – митогены. Для животных клеток роль мито-генов выполняют такие вещества, как фитогемагглютинин (ФГА), лектины. Очень важна концентрация питательных веществ и факторов роста. Было выяснено, что после протекания питательной среды над клетками следующая группа клеток, которую омоет эта среда, будет делиться хуже, чем клетки, которые омывает среда, протекавшая над свободными от клеток участками колбы. Следовательно, вторая группа клеток будет испытывать недостаток в питательных веществах и факторе роста, которые используют первые клетки. Фактор роста присутствует в среде в ничтожных количествах (10-10 М), и клетки конкурируют за него, что предотвращает неограниченный рост культуры клеток.
Сейчас разработаны модификации среды Игла и другие среды. Созданы среды, которые не содержат сыворотки, что увеличивает воспроизводимость полученных данных. Эти среды предназначены для выращивания определенных типов клеток. Примером могут служить среда Дубелько DME и DMEM (двойная модификация среды Игла), среда Искова IMDM (представляет собой модификацию среды Дубелько). Первую среду используют для культивирования ^трансформированных клеток и гибридом, вторую – для культивирования лимфоцитов и кроветворных клеток.
7.2.3. Источники получения тканей
Для получения культур тканей обычно используют эмбрионы или организмы взрослых животных. Все ткани, полученные от животных в постнатальном периоде, могут рассматриваться как зрелые. Материал, полученный из взрослых животных, необходимо подвергнуть специальной обработке, чтобы обеспечить его стерильность перед культивированием. Обработка обычно заключается в применении антибиотиков и фунгицидных препаратов. Опухолевые ткани, изолированные из органов взрослых животных, ведут себя во многом как нормальные зрелые ткани, отличаясь от последних более быстрым ростом в течение первых дней культивирования. Эмбриональные ткани стерильны, поэтому, чтобы получить стерильный материал, достаточно вести работу в асептических условиях.
Эмбриональные и взрослые ткани животных могут быть получены из разных источников. Наиболее доступны эмбриональные ткани цыпленка, мыши, крысы. Среди взрослых тканей классическими объектами для культивирования служат центральная нервная система, подкожные фибробласты, костный мозг.
7.2.4. Типы культур клеток и тканей
У животных различают культуру клеток и культуру тканей. В культуре тканей выращивают сообщества связанных между собой клеток, которые находятся в непосредственном контакте между собой. В культуре клеток одиночные клетки растут, образуя клоны. Рассмотрим основные типы культур клеток.
1. Первичная культура – небольшая популяция свежевыделенных клеток, полученных из органа взрослого животного организма. Для ее приготовления кусочек ткани органа обрабатывают трипсином, который разрушает ткань с образованием отдельных клеток. Клетки переносят на питательную среду. Время их жизни ограничено 2–3 неделями. В первичной культуре клетки, как правило, гетерогенны и характеризуются низкой пролиферацией. Многие зрелые ткани в культуре растут с большим трудом, и проходит несколько дней, прежде чем рост становится заметным. Так, изолированные фибробласты растут очень слабо. Однако другие типы клеток, например эпителиальные клетки зрелых тканей, развиваются в культуре хорошо.
Развитие клеток при пассировании, которое обеспечивает продление жизни и сохранение свойств клеток, получение более однородных популяций, клонирование и исследование клетки, может идти в двух направлениях. После нескольких пересевов клеточная линия может погибнуть или превратиться в постоянную клеточную линию. Нормальные клетки, превращаясь в постоянную линию, не становятся злокачественными. Обнаружить появление постоянной линии клеток можно по ряду морфологических и физиологических признаков (уменьшение размера, округление, увеличение ядерно-плазменного отношения, снижение времени удвоения клеток в культуре и т.д.).
2. Диплоидная культура – культура клеток, источником которых являются эмбриональные ткани человека и животных. Эта культура растет на питательной среде дольше –примерно 2 месяца. Характерной чертой диплоидных культур является постоянство их биологических свойств, например диплоидного набора хромосом. Клетки сохраняются без изменений в течение приблизительно 50 пассажей. Культуры, выращенные из эмбриональных тканей, отличаются лучшей выживаемостью, более активным ростом, легче поддаются выращиванию, быстрее мигрируют по сравнению с соответствующими тканями, выделенными из взрослых организмов. Это объясняется низким уровнем дифференцировки эмбриональных тканей и присутствием в них клеток-предшественников. Дифференцировка нормальных клеток в культуре сопровождается обычно полным прекращением пролиферации клеток.
3. Стабильная (перевиваемая) культура – культура опухолевых клеток и клеток с аномальным числом хромосом. Размножение этих культур ничем не ограничено. Даже при частичной дифференцировке, которая возможна в культурах опухолевых клеток, их способность к делению сохраняется. Они полностью адаптированы к существованию вне организма.
Культуры клеток лишены структурной организации, не взаимодействуют между собой и восстановить эти взаимодействия достаточно трудно, так же трудно, как контролировать изменения свойств культивируемых клеток. В связи с этим в фундаментальных исследованиях часто отдают предпочтение культурам тканей, клеточным системам, которые сохраняют структурную организацию ткани.
Культура тканей или органов (органная культура) характеризуется сохранением взаимосвязей между клетками, и в этом ее принципиальное отличие от культуры клеток. Все биохимические, физиологические, морфологические процессы в данной культуре приближены к тем, которые происходят в целом организме. Наибольшее сходство отмечено у эмбриональных тканей. Недостаток культур тканей состоит в том, что они не способны к размножению.
7.2.5. Способы и условия культивирования
Культура клеток
Для культивирования животных клеток используют непроточные культуры и проточные культуры. Непроточные культуры характеризуются тем, что клетки выращиваются в постоянном объеме питательной среды. Со временем изменятся состав этой среды, что требует ее периодической замены. Проточные культуры характеризуются добавлением новой питательной среды с одновременным удалением равного объема отработанной. Этот способ культивирования применяют для выращивания суспензионных культур и монослойных культур на микроносителях. Среда с питательными веществами постоянно обновляется, что позволяет поддерживать неизменный состав и концентрацию питательных веществ, количество клеток в культуре, а также выводить продукты их жизнедеятельности.
Существуют два типа клеточных культур: монослойные культуры и суспензионные культуры.
Монослойные культуры образуются в результате пролиферации прикрепленных клеток. Частота деления клеток в культуре возрастает с увеличением степени их прикрепления и распластывания на поверхности субстрата.. В суспензии клетки не прикреплены к твердой поверхности, имеют округлую форму, делятся очень плохо либо почти никогда не делятся. Вероятно, распластанные на субстрате клетки вследствие увеличения своей удельной поверхности могут поглощать питательные вещества и фактор роста с большей интенсивностью. Деление клетки зависит и от возможности ее вступать в контакт с субстратом, как бы ни мала была площадь этого контакта. Такие точечные контакты не дают клетке возможности распластаться, но служат местами взаимодействия внутриклеточных актиновых филаментов с субстратом. При выращивании в культуре клетки одного типа ткани характеризуются согласованной скоростью деления для поддержания определенной плотности популяции, так же как это наблюдается в тканях целого организма. На поверхности питательных сред эпителиальные клетки, или фибробласты, «приклеиваются» к ней, распластываются и делятся до тех пор, пока не образуют сплошной монослой.
1. Монослойные культуры характеризуются рядом особенностей:
- легкое манипулирование культурой (промывание клеток, замена питательной среды и т.д.);
- создание культуры на основе любого типа клеток;
- создание высокой плотности клеток, увеличение выхода необходимого продукта их жизнедеятельности и т.д.
2. Суспензионные культуры удобны для получения метаболитов и увеличения выхода клеток.
Культура тканей
Существует несколько методов культивирования животных тканей.
1. Метод, известный под названием «техника часового стекла», был предложен Феллом и Робинсоном в 1929 г. В качестве субстрата для культивирования обычно используют сгусток плазмы крови цыпленка с добавлением эмбрионального экстракта кур. Часовое стекло с культурой во избежание высыхания помещают в замкнутое пространство (чашка Петри), а затем в термостат при температуре 37,5°С. Это классический метод для морфогенетического анализа эмбриональных органов. Однако он обладает несколькими недостатками. Во-первых, сложный состав питательной среды затрудняет проведение биохимических исследований. Во-вторых, при культивировании питательная среда разжижается, в результате чего тканевой эксплант оказывается в растворе, что мешает нормальному росту тканей, органов или их фрагментов.
Следующие два метода позволяют успешно решить данную проблему.
2. Технология выращивания культуры тканей на плотной агаризованной среде была предложена Спраттом. Основой для таких сред служат жидкие питательные среды определенного состава, солевые растворы с добавлением агара в концентрации от 1 до 4%.
3. Троувелл предложил другой подход к решению проблемы – выращивание тканей и органов на поверхности металлической сетки. Края сетки загибают по углам как ножки столика, после чего его погружают в питательную среду так, чтобы поверхность сетки была вровень или чуть выше поверхности питательной среды. При культивировании мягких тканей на сетку укладывают кусочки миллипоровых фильтров, а уже затем ткани. По технологии этот метод похож на методы «кормящего слоя» и «кондиционирования среды» для культивирования одиночных клеток растений.
7.2.6. Использование культур клеток и тканей животных
Культуры клеток и тканей служат прекрасным объектом для фундаментальных общебиологических и медико-биологических исследований. С помощью культур клеток можно изучать процессы наследования генов, регуляцию их активности, процессы клеточной дифференцировки. Культуры клеток позволяют исследовать действие на клетку физических, химических и биологических факторов. Широкое применение получили культуры фибробластов при изучении диагностики и патогенеза некоторых заболеваний, в том числе наследственных. Культуры тканей используют для таких исследований как, взаимоотношения клеток В тканях и самих тканей, дифференцировка клеток, закономерности размножения клеток, их трансформации. Культуры органов применяют для изучения закономерностей развития зачатков в норме и при различных воздействиях.
Большое практическое значение культуры клеток, в частности культуры клеток беспозвоночных, имеют в вирусологии, где они используются для диагностики вирусов, а также служат субстратом для получения живых противовирусных вакцин.

