ОБЩИЕ СВЕДЕНИЯ
Иммунология сальмонеллеза еще находится на этане накопления фактических данных. В исследованиях клиницистов основное внимание уделялось изучению гуморальных факторов иммунитета, на основании которых была разработана методика серологической диагностики. А. Ф. Блюгер и X. М. Векслер (1973) многообразие клинических проявлений сальмонеллеза объясняют условиями инфицирования и генетики, определенным типом взаимодействия агрессинов возбудителя и систем иммунологического гомеостаза макроорганизма. При острой циклической форме сальмонеллеза имеет место как антигенная чужеродность возбудителя, так и функциональная полноценность факторов клеточного иммунитета – макрофагов, Т- и В-клеток. Это положение подтверждается способностью Т-лимфоцитов выделять фактор торможения миграции макрофагов и наличием феномена локального гемолиза, возникающих при стимуляции плазматических клеток сальмонеллезным эндотоксином. Холероподобное течение сальмонеллеза авторы объясняют избытком эндотоксина, который в этих условиях блокирует иммунокомпетентные клетки. Несвязанная порция эндотоксина стимулирует синтез цАМФ и простагландинов в энтероцитах, что и является причиной усиления секреции электролитов и жидкости. Развитие тифоподобной, септической, субклинической и хронических форм сальмонеллеза объясняется авторами возникновением иммунологической толерантности к антигенам сальмонелл. Последнее является следствием либо мимикрии антигенов, либо результатом временного снижения активности фагоцитов и лимфоцитов макроорганизма.
За последние годы получены новые данные, существенно обогатившие наши представления о роли защитных систем желудочно-кишечного тракта на этапах заражения и выздоровления. С позиций современных представлений кишечник представляет собой один из самых мощных органов иммунитета. Около половины всех лимфоцитов организма, в том числе и большинство Т-лимфоцитов, локализованы в собственной пластинке слизистой оболочки кишечника. До 10% лимфоцитов находится в межэпителиальном пространстве, причем большая их часть представляет собой сунреесорную популяцию Т-лимфоцитов [Holmgren J., Lyck N., 1986]. Иммунные реакции определяют судьбу инвазивных бактерий, таких, как сальмонеллы и шигеллы. Важное значение придают структурным элементам слизистой оболочки кишечника, а также покрывающим её гликопротеидам. Последние не только являются физическим барьером для сальмонелл, но и играют роль «ложного» рецептора для адгезинов бактерий и их токсинов. Оказалось, что карбогидратпые составные части этого геля способны связывать микробы и их токсины, защищая тем самым энтероциты. Важнейшее значение для развития инфекционного процесса при прохождении слизистого геля возбудителем имеют структурные особенности мембран микроворсинок. Структура мембран различна у отдельных видов, что определяет их различную чкствительность к одним и тем же видам вшбудителей. Структура мембран микроворсинок определяется генотипом человека и изменяется с возрастом и по мере созревания энтероцита [Holmgren J., Lyck N., 1986]. Именно эти свойства мембран наряду с другими факторами определяют возрастные особенности течения кишечных инфекций, а также большую вариабельность их клинического течения. О значении генотипа свидетельствует и тот факт, что у лиц с 0 группой крови риск заболевания холерой при однократном инфицировании V. cholerae 0,1 в 10 раз выше, IV группой [Glass R. I et al., 1982].
«МЕСТНЫЙ» КИШЕЧНЫЙ ИММУНИТЕТ
Система защиты кишечной стенки от воздействия антигенов разного рода (пищевые, бактериальные и др.) слагается из большого числа различных элементов. Это эпителиальные клетки, которые продуцируют гликопротеиды и ферменты, препятствующие проникновению патогенных агентов сквозь слизистую оболочку. Защитную роль выполняют перистальтика кишечника, нормальная микрофлора, а также химические вещества (например, хлористоводородная кислота), секретируемые в различных отделах желудочно-кишечного тракта [Шварцман Я. С., Xазенсон Л. В., 1978]. При этом важно подчернуть между неиммунными факторами защиты и местными иммунными реакциями установлена взаимосвязь. Оказалось, что протелитический эффект панкреатического сока у иммунных животных был гораздо выше, чем у неиммунных [Wolker W. A. et al., 1975]. К такого же рода наблюдениям относятся данные о резком усилении выделения секрета бокаловидными клетками при паразитарных инфекциях кишечника [Lake А. М., 1979]. Стимуляция секреции бокаловидными клетками может происходить как за смет IgA-иммунных комплексов, так и за счет реакций: IgE – тучные клетки. Особое место в системе защиты пищеварительного тракта от антигенов занимают специфические иммунные механизмы. Желудочно-кишечный тракт является своеобразным лимфоэнителиальным органом, обладающим иммунной компетенцией. Считают, что лимфоидная ткань кишечника служит аналогом бурсы Фабрициуса птиц, у млекопитающих – центральным органом гуморального иммунитета. Лимфоидная ткань тонкой кишки представлена солитарными лимфоидными фолликулами, так называемыми пейеровыми бляшками, лимфоцитами, расположенными в собственном слое слизистой оболочки и между эпителиальными клетками [Шортор Р. Г., Томаши Т. L., 1985].
Солитарные лимфоидные фолликулы расположены в основном в собственной пластинке слизистой оболочки, но могут проникать в подслизистый слой. Они не связаны с эпителием и состоят из Т- и В-лимфоцитов и макрофагов.
Солитарные лимфоидные фолликулы встречаются в любой части тонкой кишки, однако, больше всего их в подвздошной кишке. В отличие от солитарных фолликулов пейеровы бляшки располагаются на стороне кишки, противоположной месту прикрепления брыжейки. Над ними обычно отсутствуют ворсинки [Хэм А., Кормак Д., 1983].
Пейеровы бляшки представляют собой скопления лимфоидных клеток, расположенные в подслизистом слое и собственном слое слизистой оболочки тонкой кишки. В отличие от солитарных лимфоидных фолликулов они связаны с эпителиальной выстилкой. Пейеровы бляшки тесно связаны с М-клетками [Owen R. L., Jones A. L., 1974]. М-клетки представляют собой специализированные клетки эпителия слизистой оболочки. Лишенные микроворсинок, они избирательно усваивают белки. Полагают, что М-клетки обеспечивают всасывание и транспортировку антигена к лимфоцитам. От 11 до 40% клеток в пейеровых бляшках представлено Т-лимфоцитами. Лимфоциты пейеровых бляшек не обладают свойствами киллеров. Антигены, поступающие в слизистую оболочку, активируют В-лимфоциты. Последние мигрируют в собственный слой слизистой оболочки, где секретируют IgA [Graig S. W., Cebra J. J., 1971].
Лимфоциты, расположенные в собственном слое слизистой оболочки, относятся в основном к В-лимфоцитам, содержащим IgA. Здесь много плазмоцитов и плазмобластов. Скопление этих клеток связано с М-клетками. Помимо лимфоидных клеток, в собственном слое слизистой оболочки выявлены макрофаги и лаброциты, а также незначительное количество нейтрофилов и эозинофилов [Генри К., 1985].
Интраэпителиальные лимфоциты (телио-лимфоциты) обнаружены в эпителии крипт и ворсинок. Они расположены базально между эпителиальными клетками и происходят из лимфоцитов собственного слоя слизистой оболочки, мигрирующих через базальную мембрану. Среди интраэпителиальных лимфоцитов выявлены как В-, так и Т-лимфоциты. Высказано предположение о связи Т-лимфоцитов с лаброцитами [Шортер Р. Г., Томаши Т. Б., 1985].
Иммунные механизмы тонкой кишки, реализацию которых обеспечивают лимфоидные образования ее стенки, очень разнообразны. Важнейшим среди них является секреторная (слизистая) система защиты. Известно, что реакции антител, например в сыворотке крови и слизистой оболочке, протекают независимо друг от друга. Основным иммуноглобулином секрета слизистой оболочки является IgA, а сыворотки крови – IgG. Основную массу IgA вырабатывают плазмоциты, расположенные в собственном слое слизистой оболочки. Помимо IgA, в секрете слизистой оболочки кишечника найдено небольшое количество IgG, IgE и IgM. Основную часть секрета, выделяемого слизистой оболочкой кишки, составляет секреторный компонент (гликопротеид). Его синтезируют клерки эпителия желез. Гликопротеид необходим для транспорта IgA. Полагают, что он действует как рецептор иммуноглобулинов.
Комплексы, состоящие из гликопротеида и иммуноглобулинов захватываются эпителиальными клетками с помощью эндоцитоза и транспортируются в апикальную часть энтероцитов, откуда выделяются в просвет кишки [Brandtzaeg Р., 1974].
Секреторные IgA вызывают торможение прилипания и колонизации бактерий на слизистой оболочке, блокируя антигенные компоненты на поверхности бактерий. В отличие от IgG и IgM механизм действия IgA связан с активацией комплемента (по альтернативному пути) или фагоцитозом. В стенке тонкой кишки, видимо, завязываются и реакции клеточного иммунитета, так как здесь имеются Т-, В-лимфоциты и макрофаги, однако, механизмы развития этих реакций и их значение пока не выяснены [Шортер Р. Г., Томаши Т. Б., 1985]. Естественную защиту против сальмонелл у мышей, например, обеспечивают Т-лимфоциты из пейеровых бляшек и селезенки [Davies R., Kotlarski I., 1976; Tagliabre A. et al., 1984].
Большой интерес вызывает взаимодействие лимфоцитов с нейротрансмиттерами и эпителиальными клетками кишечника. Показано, что субпопуляция Т-лимфоцитов из грудного лимфатического протока мышей имеет высокоаффинные рецепторы к вазоактпвному пептиду (VIP). Поэтому последний участвует в регуляции миграции Т-лимфоцитов через эндотелий посткапиллярных сосудов: кишечника [Ottaway С. А., 1984; Ottaway С. A., Greenberg F. R., 1984].
Другой нейротрансмиттер – субстанция Р – усиливает пролиферацию человеческих лимфоцитов, не являясь при этом митогеном [Payan D. G. et al., 1983].
Прямое влияние лимфоцитов на секреторную, абсорбционную и пищеварительную функцию энтероцитов установлено при глистной инвазии у крыс. Это воздействие наиболее выражено при повторной инфекции и сопровождается изгнанием паразитов. Указанное явление значительно ослабляется при подавлении Т-лимфоцитов, но может быть передано животным сенсибилизированными Т-лимфоцитами [Holmgren J., Lyck N., 1986]. Эти свойства лимфоцитов еще не установлены при бактериальных и вирусных инфекциях. Интраэпителиальные лимфоциты способны модулировать экспрессию 1а-антигена эпителиальными клетками кишечника. Стимуляция последних фитогемагглютинином или конкавалином А сопровождается выработкой особого фактора, вероятно, интерферона, который увеличивает экспрессию 1а-антигена, что имеет определяющее значение для клеточных иммунных реакций.
ИММУННЫЙ ОТВЕТ
Иммунный ответ при сальмонеллезе связан не только с реакциями «местного», но и «общего» иммунитета, так как особенностью течения сальмонеллеза являются повреждение слизистой оболочки и лимфоидного аппарата кишечника, развитие бактериемии и эндотоксинемии. В уничтожении возбудителя и его эндотоксина участвуют как гуморальные, так и клеточные звенья иммунитета [Покровский В. И. и др., 1979]. В противоинфекционном иммунитете принимают участие полиморфно-ядерные лейкоциты, лимфоциты и иммуноглобулины [Кашкин К. П., Караев 3. О., 1984]. Реакции гуморального иммунитета лимфоидная ткань осуществляет с помощью В-лимфоцитов, а реакции клеточного иммунитета – с помощью Т-лимфоцитов. Иммуногенез (механизм развития иммунных реакций) имеет характерное выражение. Гуморальная иммунная реакция складывается из трех звеньев. Афферентное звено включает события от попадания антитела в организм до передачи информации о нем лимфоидной ткани. При сальмонеллезах афферентное звено гуморальной реакции развертывается в лимфоидной ткани стенки тонкой кишки, где антиген через М-клетки попадает к лимфоцитам и макрофагам собственного слоя слизистой оболочки. Одновременно возбудитель и выделяемый им эндотоксин через лимфатические дренажи начинают поступать в кровь. Предъявляют бактериальный антиген Т-лимфоцитам-хелперам макрофаги, которые всегда присутствуют в собственном слое слизистой оболочки, а также в специализированных органах иммунной системы. Известна способность лимфоцитов тонкой кишки к рециркуляции, во время которой и реализуется центральное звено гуморальной реакции, связанное с передачей информации через центральные органы иммуногенеза В-лимфоцитам. Эфферентное звено гуморальной реакции проявляется пролиферацией В-лимфоцитов, трансформацией последних в плазматические клетки и нарастающим синтезом антител – повышением содержания иммуноглобулинов в сыворотке крови. Причем стенка кишки отвечает повышенной секрецией IgA. Одновременно в сыворотке крови происходит повышение концентрации иммуноглобулинов разных классов. Причем разноречивый характер данных о динамике изменения концентрации иммуноглобулинов не позволяет установить специфичность клеточной гуморальной реакции при сальмонеллезах [Ющук Н. Д., Купкина Г. И., 1977].
Образование антител у больных сальмонеллезом нередко рассматривают как реакцию, протекающую по типу вторичного иммунного ответа, так как большинство взрослых людей неоднократно в течение жизни контактирует с сальмонеллами, в результате чего развивается сенсибилизация организма.
Клеточная иммунная реакция также состоит из трех фаз. Вначале контакт с антигеном ведет к сенсибилизации Т-лимфоцитов. Их роль на месте в стенке кишки могут играть интраэпителиальные лимфоциты. Затем происходят пролиферация и бластная трансформация Т-лимфоцитов. И, наконец, сенсибилизированный Т-лимфоцит вступает в реакцию с антигеном, представленным «клеткой-мишенью», поврежденной сальмонеллой или ее эндотоксином. При этом Т-лимфоцит реализует свае цитонатическое действие. Одновременно выделяются лимфоциты, обеспечивающие участки макрофагов в разрушении антигена (иммунный фагоцитоз). Фагоцитоз осуществляют Циркулирующие в крови грануяоциты (микрофагоциты) и тканевые макрофаги моноцптариого происхождения. Тканевые макрофаги имеются в собственном слое слизистой оболочки и подслизнстом слое тонкой кишки, где и реализуется их функция, связанная с элиминацией возбудителя. Однако основную роль в этом процессе играют, видимо, полиморфно-ядерные лейкоциты [Корнилова И. И., 1979]. Причем фагоцитарная активность лейкоцитов возрастает к периоду клинического выздоровления.
В острый период течения сальмопеллеза в организме больного могут развиваться реакции гиперчувствительности – местные иммунные (аллергические) реакции в сенсибилизированном организме. Обычно это цитотоксический иммунный ответ, опосредованный антителами, которые ввязаны в клетками (К-клетки и NK-клетки) [Блюгер А. Ф. и др., 1980]. В период разгара болезни, когда реализуется эфферентное звено гуморальной иммунной реакции и нарастает титр антител к антигенам сальмонелл и поврежденных клеток, антитела через Fc-фрагмент связываются с рецепторами К- и NK-лимфоцптов. Последние осуществляют лизис инфицированных и поврежденных клеток. В этой реакции принимают участие макрофаги, которые актййируюжя лимфокинами. Макрофаги также являются важным звеном в формировании иммунного ответа [Schaffner Т. et al., 1982]. Относительно меньшее значение имеют другие механизмы развития цитотоксичности. Образующееся в ответ на внедрение сальмонелл небольшое количество IgG и IgM вызывает активацию комплемента по классическому пути. IgA активирует комплемент по альтернативному пути. При совместном действии С5b–С9-компонентов комплемента развивается лизис клеток-мишеней. Часть антител (особенно IgM) обладает опсонизирующими свойствами. Опсонизированные клетки поглощаются фагоцитами, которые выделяют при атом ряд лизосомальных ферментов [Пыцкий В. И. и др., 1984].
Таким образом, в настоящее время иммунные реакции при сальмонеляезах представляют в виде сочетания так называемого местного (кишечного) иммунитета, который проявляется прежде всero гуморальной иммунной реакцией fjpepspp IgA), и елабоиыраженной клеточной реакией. В организме организме гуморальная реакция проявляется клинически продукцией различных классов иммуноглобулинов, а клеточная – повышением фагоцитарной активности макрофагов, тесно связанной с активной выработкой антител и реакцией последних с бактериальным антигеном. В сенсибилизировaнном организме (вторичный иммунный ответ) возможно развитие реакций гиперчувствптелъности. Однако представления об иммунитете при сальмонеллезе не были бы полными, если бы мы не рассмотрели механизмы как непосредственного, так и опосредованного влияния сальмонеллезпого эндотоксина на иммунную систему организма.
САЛЬМОНЕЛЛЕЗНЫЙ ЭНДОТОКСИН И ИММУННАЯ СИСТЕМА
Прямое действие эндотоксинов осуществляется за счет липида А, входящего в состав бактериальной стенки. Полагают, что он способен вызывать активацию макрофагов и системы комплемента (альтернативный путь). Сальмонеллезный эндотоксин является тимуснезависимым антигеном. Он вызывает миграцию В-лимфоцитов из маргинальной зоны в фолликулы еелезенки [Lumb J. R., 1979]. Однако основное действие сальмонеллезпого эндотоксина реализуется в лимфоидной системе через простагландины и циклический аденозщтмонофосфат, которые относят к группе веществ нелимфоцитарного и немакрофагального происхождения обладающих свойствами медиаторов иммунного ответа [Медуницын Н. В. и др., 1980]. На эти вещества оказывает воздействие и сальмонеллезный эндотоксин.
Существенную роль в иммунологических реакциях играют простагландины Е1, Е2 и F2. Лимфоциты обладаютрецепторами к простагландинам. Количество клеток воспринимающих простагландины, возрастает после антигнной стимуляции. Причем повышение концентрации простагландинов сопровождается усилением активности аденилциклазы и соответственно циклического аденозин- а гуанозинмонофосфата [Медуницын Н. В. и др., 1980].
Все лимфоциты и моноциты одержат циклический адеиозинмонофосфат и циклический гуанозинмонофосфат, которые служат вторичными передатчиками воздействия на лимфоидные клетки различных гормонов и физиологически активных веществ. Так, эндотоксин, изопротеренол, простагландины и теофиллин стимулируют образование циклического аденозинмонофосфата. В результате усиливается дифференцировка протимоцитов и про-В-лимфоцитов в зрелые популяции этих клеток. Известно, что циклический аденозинмонофосфат способен вызывать дифференцировку и деление клеток, усиливать синтез белка [Parker С. W., 1979]. В то же время ацетилхолин, инсулин, имидазол активируют гуанозинмонофосфат. При этом достигается противоположный эффект торможение дифференцировки лимфоидных клеток [Hadden J. W. et al.v., 1979].
Действие циклических нуклеотидов в клетке тесно связано с ионами кальция, которым отводят роль сигнала от клеточной мембраны к ядру. Прячем гуанозинмонофосфат вызывает увеличение, а аденозинмонофосфат – уменьшение концентрации свободного кальция в цитоплазме клетки [Hadden J. W. et al., 1979].
Простагландины играют значительную рель ж регуляции иммунного ответа. Полагают, что простагландины участвуют преимущественно в ранней стадии иммунного ответа – активации лимфоцитов и макрофагов. Простагландины оказывают супрессорное действие, контролируя таким образом дифференцировку соответствующих клонов лимфоцитов [Hadden J. W. et al., 1979]. Простагландины участвуют в регуляции как гуморальной, так и клеточной иммунной реакции. Простагландины E1 и F2α выступают в роли ингибиторов активации Т-лимфоцитов. Простагландин Е2 является мощным ингибитором Т-лимфоцитов и реализует свое действие с помощью двух механизмов. Во-первых, он тормозит продукцию интерлейкина-2 Т-лимфоцитами, а во-вторых, активирует Т-супрессоры [Fischer A. et al., 1985]. Противоположное действие оказывают некоторые лейкотриены. Например, лейкотриен В4 стимулирует как пролиферацию, так и активность Т-супрессоров [Gualde N. et al., 1985]. Торможение синтеза простагландинов приводит к усилению клеточной иммунной реакции. Простагландины серий Е и F действуют на В-лимфоциты, участвуя в регуляции синтеза антител [Goodwin J. S., Webb D. R., 1980]. Таким образом, простагландины выступают главным образом в роли медиатора, тормозящего иммунную реакцию. Применение ингибиторов простаглавдинсинтетазы поэтому закономерно приводит ж ушлешю иммунного ответа.
Простагландины участвуют в качестве медиаторов в развитии иммунного воспаления. Они увеличивают сосудистую проницаемость, способствуют мобилизации клеток в очаге воспаления. Действие простагландинов на клетки инфильтрата реализуется через циклические нуклеотиды [Ward Р. А., 1983]. Простагландины влияют на хемотаксис нейтрофилов, подавляют фагоцитарную активность макрофагов в очаге воспаления, тормозят освобождение гистамина из лаброцитов при аллергических реакциях [Медуницын Н. В. и др. 1980].
Липополисахариды бактерий вызывают повышение концентрации производных арахидоновой кислоты, в первую очередь тромбоксана А2 и простациклина, в крови. Причем основной мишенью для эндотоксина в организме считают макрофаги ретикулоэндотелиальной системы, которые под действием эндотоксина способны синтезировать простагландины. Хотя действие эндотоксина на макрофаги в настоящее время не вызывает сомнений, ведущая роль макрофагов в повышении концентрации простагландинов остается недоказанной [Sehade U., Rietschel Е. Т., 1982]. Макрофаги обеспечивают представление антигена (эндотоксина) Т-лимфоцитам-хелперам. Важное значение в этом процессе имеет способность липополисахарида стимулировать секрецию макрофагами интерлейкина-1, который активирует стимулированные антигеном Т-хелперы. Одновременно синтезируется колониестимулирующий фактор макрофагов, побуждающий последние к секреции интерферона. Последний усиливает ответ организма на внедрение эндотоксина [Moore R. П., 1982].
Биологические свойства липида А очень разнообразны, а его действие в организме в значительной степени направлено на иммунокомпетентные клетки и иммунную систему в целом. Кроме рш рассмотренных эффектов, следует назвать способность линида А вызывать лейкоцитоз, развитие местной реакции Шварцмана и толерантности к опдотоксипу, активацию системы комплемента [Jirillo К., Fumarola P., 1980].
Явление толерантности при сальмонеллезах связано с наличием общих антигенов е возбудителем заболевания. При этом не продуцируются антитела к возбудителю, что приводит к особенно тяжелому течению заболевания [Покровский В. И. и др., 1979].
Эндотоксин вызывает активацию системы комплемента альтернативным путем, т. е. с участием пропердина [Morrison D. С., Ulevitch J. 11., 1978]. При этом активируются в первую очередь СЗ и его фракции. Этот компонент системы комплемента обладает чрезвычайно важными свойствами, направленными на развитие иммунного воспаления и удаление антигена. Так, СЗа (анафилотоксин) вызывает высвобождение гистамина из лаброцитов и базофилов. СЗ вызывает лейкотаксис нейтрофилов, эозинофилов и моноцитов. СЗb является опсоническим фактором, участвующим в регуляции фагоцитоза [Ward Р. А., 1983].
В организме, сенсибилизированном сальмонеллезным эндотоксином, возможно развитие реакции Шварцмана. Сущность процесса сводится к развитию реакции гиперчувствительности немедленного типа при провокации различными неспецифическими факторами [Блюгер А, Ф. и др., 1980].
Таким образом, воздействие сальмонеллезного эндотоксина на иммунную систему организма может быть как прямым, так и опосредованным. Сальмонеллезный эндотоксин, попадая в организм, воспринимается прежде всего макрофагальной системой: моноцитарными макрофагами кишечной стенки и ретикулоэндотолиальиой системы, а также нейтрофилами. Макрофаги предъявляют обработанный антиген лимфоцитам, после чего развиваются гуморальная и клеточная иммунные реакции, а в сенсибилизированном организме – реакции гиперчувствителыюсти немедленного типа. Опосредованное действие сальмонеллезного эндотоксина связано с активацией синтеза простагландинов и циклических нуклеотидов, обладающих свойствами медиаторов иммунного ответа. Определенное значение имеет активация системы комплемента, участвующей в регуляции выделения физиологически активных веществ клетками, а также в силу опсонизирующей активности ее компонентов в регуляции фагоцитоза (схема 3; сплошная линия – активация, пунктирная – торможение).
Схема 3
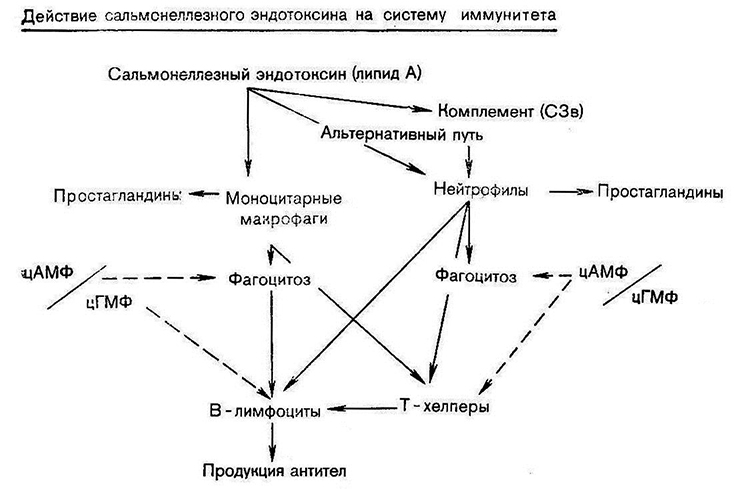
Если исходить из представлений о роли простагландинов в иммунных реакциях как супреесорных факторов, становится понятным эффективность применения ингибиторов простагландинсинтетазы при сальмоншгяезах. Очевидно, при этом происходит усиление иммунного ответа: возрастает продукция антител, повышается фагоцитарная активность, т. е. создаются условия для более аффективной элиминации возбудителя и его антигенов из, организма, возрастают детоксикационные способности фагоцитарной системы.
Под действием сальмонеллезного эндотоксина происходит повреждение эндотелия кровеносных сосудов, приводящее к активации свертывающей системы крови. Эндотоксин воздействует также непосредственно на тромбоциты. Опосредованное влияние эндотоксина на свертывающую систему крови обусловлено активацией синтеза простагландинов, которые принимают участие в регуляции свертывающей и противосвертывающей систем крови, а также повреждением полиморфно-ядерных лейкоцитов и макрофагальной системы. Последние фагоцитируют растворимые комплексы фибрина.
Известно, что через 3 ч после введения мышам сальмонеллезный эндотоксин можно обнаружить в эндотелии капилляров печени, легких, тонкой кишки и почек [Таnaka N. et al., 1959].
Определенное значение в повреждении эндотелия, кроме прямого действия эндотоксина на клетки, имеет система комплемента. Эндотоксин является ее мощным активатором [Evensen S. A. et al., 1975]. D. G. McKay и соавт. (1966) установили, что в ранние сроки после введения эндотоксина повреждаются тромбоциты и полиморфно-ядерные лейкоциты, а изменения в эндотелии обнаруживаются уже после выпадения депозитов фибрина, т. е. являются вторичными (следствие развивающейся гипоксии). Повреждение эндотелиальных клеток ведет к серьезным последствиям. Во-первых, происходит торможение синтеза простациклина (простагландина 1г) и простагландиновых эндоперекисей, которые вырабатываются сосудистой стенкой и являются мощными (особенно простациклин) ингибиторами агрегации тромбоцитов [Mac Intyre D. Е. et al., 1978]. Действие простациклина связано с повышением уровня циклического аденозинмонофосфата в тромбоцитах путем стимуляции аденилатциклазы. Простагландиновые эндопероксид G2 и Н2 являются непосредственными предшественниками простациклина. В тромбоцитах из них образуются тромбоксаны. Простациклин является циркулирующим гормоном. Он постепенно повышает уровень циклического аденозинмонофосфата в тромбоцитах, делая их менее агрегабельными, а также обладает сосудорасширяющими свойствами [Гаврилов О. К., 1981]. Во-вторых, повреждение эндотелия вызывает контактную активацию фактора Хагемана (фактор XII), возникающую в результате контакта этого фактора с поврежденной, отрицательно заряженной стенкой сосуда.
Эндотоксин может оказывать и непосредственное воздействие на фактор Хагемана, вызывая его активацию [Morrison D. С., Cochrane С. С„ 1974]. Активированный фактор Хагемана способен активировать 3 других протеолитических фермента плазмы крови. Калликреин, образующийся под действием фактора Хагемана из прекалликреина, вызывает высвобождение брадикинина, оказывающего сосудорасширяющее действие. Активацию калликреин-кининовой системы после введения эндотоксина рассматривают как косвенное доказательство активации фактора Хагемана под непосредственным влиянием эндотоксина [Morrison D. С., Ulevitch R. J., 1978]. Одновременно активируется система комплемента и плазминогенплазмина [Kase F., Rennerova J., 1981]. Таким образом, одновременно с активацией свертывающей системы крови под действием эндотоксина через фактор Хагемана активируется и противосвертывающая система.
Эндотоксин оказывает непосредственное действие и на клетки крови, в частности на тромбоциты и полиморфно-ядерные лейкоциты. С помощью электронно-микроскопического исследования обнаружено прилипание к тромбоцитам частиц эндотоксина (липополисахарида), приготовленного по методу Буавена и введенного экспериментальному животному. При этом наблюдалось разрушение цитолеммы тромбоцитов под действием лизосомальных ферментов. В этом феномене определенную роль играет система комплемента, так как удаление ее компонентов приводило к торможению прилипания частиц липополисахарида к тромбоцитам и дегрануляции последних [Spielvogel A. R., 1967]. Следствием воздействия эндотоксина на тромбоциты являются их агрегация и запуск реакции высвобождения, т. е. выделение физиологически активных веществ, депонированных в гранулах тромбоцитов. Вначале в стадию индукции из мембраны тромбоцита высвобождается Са++, который в стадию трансмиссии проникает внутрь клетки. Одновременно уменьшается активность аденилатцикдазы и снижается содержание циклического аденозипмонофосфата. Заключительная фаза реакции высвобождения – секреция – состоит из выхода серотонина, АДФ и Са++ из плотных телец тромбоцитов и секреции из α гранул АТФ, фактора 4, который присоединяет и нейтрализует гепарин, фактора III – катализатора стадии образования фибрина.
При действии эндотоксина, вызывающего агрегацию Тромбоцитов и реакцию высвобождения, происходит сипюз простагландинов. В результате активации фосфолипазы А2 происходит выделение арахидоновой кислоты из фосфолипидов мембраны тромбоцитов. Под влиянием циклооксигеназы образуются циклические эндопероксиды – простагландины G2 и Н2, которые при участии тромбоксансинтетазы образуют тромбоксан А2, способный вызывать агрегацию и реакцию высвобождения. Регулятором синтеза тромбоксанов является циклический аденозин-монофосфат, оказывающий двоякое действие. Во-первых, он регулирует уровень внутриклеточного Са++, предупреждая таким образом агрегацию тромбоцитов. Во-вторых, он изменяет активность фосфолипазы А2 [Silver М. J., 1981].
Таким образом, эндотоксин воздействует одновременно на оба компонента свертывающей системы крови – эндотелий сосудов и тромбоциты. При этом реализуются цитотоксическое действие этом соединения, которое проявляется в виде повреждения клеток, а также способность входящего в его состав липополисахарида и особенно наиболее активной составляющей последнего дипида А вступать в химические реакции с компонентами простагландиновой и свертывающей систем крови. При этом нарушается равновесие сложной динамической системы, обеспечивающей швдше состояние крови и функционирующей на границе контакта тромбоцита с сосудистой стенкой. С одной стороны (тромбоцит) действует тромбоксан, являющийся мощным индуктором агрегации тромбоцитов, а с другой стороны (стенка сосуда) – простациклин – наиболее активный известных ныне ингибиторов агрегации. Этот механизм в значительной степени определяет нетромбогенность интактного эндотелия. В норме преобладает простациклиповый, а в патологии – тромбоксановый метаболизм арахидоиовой кислоты. Неслучайно в качестве весьма перспективных средств в лечении заболеваний, связанных с нарушениями свертывающей системы крови, рассматривают препараты, влияющие на метаболизм арахидоиовой кислоты.
Важным проявлением действия эндотоксина является лейкопения, которая развивается вслед за кратковременным лейкоцитозом. Развитие нейтропении после введения эндотоксина связывают с активацией системы комплемента, что ведет к повреждению полиморфно-ядерных лейкоцитов. При электронно-микроскопическом исследовании выявлена секвестрация полиморфнб-ядерных лейкоцитов, обнаруженных в капиллярах различных органов [McKay D. G. et al., 1966; Litz M. J. et al., 1981]. С повреждением этих клеток и выделением гидролитических ферментов их лизосомами связывают повреждение тканей при эндотоксииовом шоке. Плиморфно-ядерные лейкоциты участвуют в элиминации эндотоксина, о чем свидетельствуют эксперименты с введением эндотоксина, меченного тритием [Brtmaiog В. D. et Л, 1064]. Возможно участие лейкоцитов и в регуляции тромбоцитов путем выделения факторов, влияющих на активность последних. Определенную роль активации свертывающей системы крови могут играть макрофаги. Под действием эндотоксина они выделяют не только простагландины, но и активатор плазминогена [Gordon S. et al., 1974].
Наконец, травматическое повреждение клеток эндотоксином само по себе сопровождается высвобождением тканевой жидкости, которая в присутствии фактора VII активирует внешний путь свертывания крови [Фермилен Ж., Ферстрате М., 1984]. После введения эндотоксина в эксперименте содержание фактора VII в крови уменьшается, что свидетельствует о его активном потреблении [Garner R., Evensen S. А., 1974].
В результате одновременной активации свертывающей и фибринолитической систем крови под действием сальмонеллезного эндотоксина в организме нередко развивается синдром диссеминированного внутрисосудистого свертывания крови [Bell W. R., 1980; Semeraro N., Lattanzio A., 1980]. Причем имеют значение все три основных типа клеточных повреждений, вызывающих активацию свертывания крови: повреждение эндотелиальных клеток с последующей адгезией тромбоцитов и контактной активацией фактора Хагемана (фактор XII); повреждение клеток с высвобождением тканевой жидкости и активацией в присутствии фактора VII внешнего пути свертывания крови; повреждение эритроцитов, лейкоцитов и тромбоцитов с выходом фосфолипидов, усиливающих активацию как внешнего, так и внутреннего пути свертывания крови [Фермилен Ж., Ферстрате М., 1984]. Повреждение эндотелиальных клеток ведет к нарушению синтеза простагландинов, предотвращающего агрегацию тромбоцитов. При внутрисосудистом свертывании крови микротромбы обнаружены в капиллярах печени, почек, легких и некоторых других органов [Shimamura К. et al., 1983]. Полагают, что эндотоксин может действовать и непосредственно на фибрин-мономер, приводя к образованию микротромбов. Причем это действие эндотоксина не ингибируется гепарином [Валуда В. П., 1979].
Учитывая значительную роль производных арахидоновой кислоты в регуляции свертывающей системы крови, сделаны попытки предотвратить диссеминированное внутрисосудистое свертывание крови с помощью стероидных и нестероидных противовоспалительных веществ. Оказалось, что глюкокортикоиды тормозят активацию фактора XII эндотоксином и уменьшают продукцию макрофагами тканевого фактора. Нестероидные противовоспалительные препараты, не предотвращая активацию фактора XII эндотоксином, в результате торможения синтеза и выделения нростагландипов защищают сосудистую стенку, снижают риск образования микротромбов [Latour J. G., 1983].
Определенную роль в развитии диссеминированного внутрисосудистого свертывания крови играет и калликреин-кининовая система. Под действием эндотоксина происходит активация синтеза как простагландииов. так: и фактора Хагемана (фактора XII). Простагландины, как известно, играют роль медиаторов и модуляторов калликреин-кининовой системы [Vio С. P. et al., 1983]. В то же время кинины стимулируют сиитез простагландинов. Способность эндотоксинов непосредственно вызывать активацию фактора Хагемана, который в свою очередь способствует превращению прекалликреина в каллккреин с последующим усилением образования кининов из кининогена, в конечном счете приводит к усилению синтеза простагландинов. Видимо, этот каскад превращений направлен на защиту сосудистой стопки от повреждения и расширения кровеносных сосудов для предупреждения воздействия гипоксии на ткани, возникающей в связи с диссемипированным внутрисосудистым свертыванием крови.
Таким образом, после введения сальмопеллезного эндотоксина происходит перестройка направленная как на элиминацию чужеродного аптигена, так и на защиту органов и тканей от повреждения, которое может быть вызвано прямым действием эндотоксина, а также может быть следствием диссеминированного свертывания крови.

