Большинство исследований по патофизиологии сальмонеллеза посвящены вопросам кислотно-щелочного состояния, водно-электролитного обмена и сердечно-сосудистой системы.
СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
Состояние сердечно-сосудистой системы при сальмонел- лезе изучено достаточно полно. Это неудивительно, так как до последнего времени как аксиома принималось положение, что эндотоксин оказывает на нее прямое действие [Бунин К. В., 1974; Первухин Н. К., 1986; Kubi-ckova О., Fencl V., 1968].
По мнению Н. К. Первухиной (1986), высвобождение катехоламзщов является одаой из причин развития сердечно-сосудистых нарушений. Ранее аналогичное мнение было высказано О. Kubickova, У. Fencl (1968), полагавших, что сужение артериол и депонирование крови в брюшной полости, повышение венозного портального давления и другие гемодинамические расстройства также связаны с активацией симпатико-адреналовой системы. При этом страдает миокард из-за метаболических сдвигов и нарушений коронарного кровообращения.
О диффузном поражении миокарда по дистрофическому типу свидетельствуют работы В. В. Петрягина (1967), А. П. Мамона (1973).
Изменения зубца Р электрокардиограммы были подробно проанализированы Ю. М. Михайловой (1965), К. В. Буниным, В. В. Петрягиным (1967), В. И. Вандык (1970). Авторы отметили уплощение, снижение вольтажа, деформацию, двухфазность, расширение зубца Р у 22,6-48,4% больных сальмопеллезом. Основными причинами изменений зубца Р считают диффузные изменения миокарда и нарушение водно-электролитного обмена, в частности гипокалиемию.
В ряде публикаций приводятся данные о непрямом воздействии эндотоксина на миокард, в частности за счет повышения уровней таких биологически активных веществ, как гистамин, серотонин, кинины и катехоламины. По мнению других авторов, характер ЭКГ изменений при сальмонеллезе определяется развитием воспалительного^ процесса в сердечной мышце, особенно при тяжелом течении заболевания.
Приведенный анализ свидетельствует об отсутствии единой концепции, объясняющей механизмы развития нарушений функционального состояния сердца. При изучении сократительной функции левого желудочка сердца» при сальмонеллезе найдены признаки гиподинамии, проявляющейся уменьшением фазы изгнания, механической и электрической систол, механического коэффициента и внутрисистолического показателя, увеличением фазы напряжения и индекса напряжения миокарда [Носова А. А. и др., 1980]. Развитие гиподинамии большинство исследователей объясняют с позиций снижения сократительной функции миокарда, наступающей как из-за прямого токсического действия эпдотоксипа, так и в результате высвобождения (под влиянием токсинов) различных биологически активных веществ.
Фазовый анализ систолы правого желудочка выявил значительное снижение его сократительной функции и: развитие прекапиллярной гипертензии малого круга. Развитие этих изменений связывают с посткапиллярной гипертензией [Булычев В. ВН1979].
Таким образом, исследование сократительной функции: желудочков сердца при сальмонеллезе выявило ее значительное снижение. В объяснении механизмов, определяющих снижение сократительной функции миокарда, среди исследователей нет единодушия. Так, определенную роль отводят тонким биохимическим и энергетическим изменениям, нарушениям гемодинамики и развитию гипоксии миокарда, повреждению периферических механизмов регуляции кровообращения и баланса электролитов.
Для острого периода сальмонеллеза характерно снижение ударного и минутного объема сердца. Увеличение минууиого объема и снийриие периферического сопротивления обнаружено только при тяжелом течении сальминеллеза.
Микроциркуляторное русло в целом отражает состояние всей сердечно-сосудистой системы. У больных сальмонеллезом методами капиляроскопии ногтевого валика [Шлыкова С. П., 1974], бульбарной биомикроскопии, офтальмоскопии глазного дна [Мороа А. С., [1970] показано, что архитектоника сосудов, периваскулярные и внутри сосудистые изменения микроциркулярного русла зависят от тяжести и продолжительности заболевания, степени обезвоживания организма больного. О преимущественном поражении венулярного отдела микрососудов свидетельствуют более частое развитие неравномерностей калибра, извитости микрососудов, преимущественное развитие агрегации форменных элементов крови и замедление кровотока в этих сосудах [Шлыкова С. И., 1974].
Однако механизмы возникновения микроциркуляторных изменений нуждаются в дальнейшем уточнении. По мнению В. И. Покровского и соавт. (1973), замедление кровотока в микрососудах связано с развитием дегидратации, что сопровождается увеличением вязкости крови ш ухудшением ее реологических свойств, а это в конечном1 счете снижает кинетическую энергию эритроцитов и силу их взаимного отталкивания. Последнее является одной из причин, способствующих их слипанию и образованию агрегатов, особенно в посткапиллярных венулах.
Состояние периферического кровообращения достаточно полно охарактеризовано с помощью реографии. При- изучении кровообращения мозга в большинстве случаев, было выявлено снижение тонуса внутричерепных сосудов в бассейщмщ^ггреннфй сонной артерии, не сопровождавшейся, однако, уменьшением кровотока. Отмечено снижение тонуса сосудов верхней конечности.
Таким образом, приведенные данные о состоянищ гемостаза, центральной и периферической гемодинамики, микрбциркуляции при ««сальмонеллезе отражают стереотипные, закономерно повторяющиеся изменения.
ГЕМОСТАЗ У БОЛЬНЫХ ГАСТРОИНТЕСТИНАЛЬНОЙ ФОРМОЙ РАЛЬМОНЕЛЛЕЗА
При острых кишечных инфекциях, сопровождающихся развитием диареи, закономерно выявляются нарушения в системе гемостаза. Установлена связь степени тяжести и продолжительности течения острых кишечных инфекций и концентраций фибриногена в крови, количества тромбоцитов, показателей коагулограммы и тромбоэластограммы, активности фибринолиза. Характер изменений параметров гемостаза при большинстве острых, кишечных инфекций, в том числе и сальмонеллезе, укладывается в представления о диссеминированном внутрисосудистом свертывании крови. Действительно, при среднетяжелом и тяжелом течении сальмонеллеза в разгар заболевания одновременно появляются признаки гипер- и гипокоагуляции, что свойственно для диссеминированного внутрисосудистого свертывания [Блюгер А. Ф. и др., 1975; Бродов Л. Е., Малеев В. В., 1977].
Клинически диссеминированное внутрисосудистое свертывание крови можно диагностировать по наличию геморрагий и тромбозов. Вместе с тем выделепо несколько стадий его развития, каждая из которых характеризуется особыми клинико-лабораторными признаками [Лагутина Н. Я., 1981]. Первая стадия протекает с явлениями гиперкоагуляции и внутрисосудиетой агрегации форменных элементов крови, оставаясь в ряде случаев клинически невыраженной, во вторую и третью стадии развивается гипокоагуляция с коагуляцией потребления, в четвертую наступает либо выздоровление, либо развитие острой почечной или печеночной недостаточности.
Из лабораторных признаков диссеминированного внутрисосудистого свертывания крови наряду с показателями количества тромбоцитов, уровня фибриногена, протром бинового времени важное значение имеет определение растворимых комплексов фибрин-мономера. Известно, что растворимые комплексы фибрин-мономера образуются благодаря большому аффинитету продуктов деградации фибриногена к фибрин-мономерам. Этот процесс сопровождается полимеризацией не связанных с продуктами деградации фибриногена части фибрин-мономера, что закономерно вызывает затруднение кровотока в микрососудах, вызывает тканевую гипоксию, а в дальнейшем – анемию и некрозы различных органов [Лагутина Н. Я., 1981].
Патогенез диссеминированного внутрисосудистого свертывания крови зависит от вызвавшей его причины. При сальмонеллезе, как и при других острых кишечных инфекциях, сопровождающихся развитием диареи, есть два основных патогенетических фактора, способных оказывать влияние на состояние гемостаза, – интоксикация и уменьшение объема циркулирующей крови.
Исходя из известных данных о способности эндотоксина энтеробактерий вызывать нарушения гемостаза, некоторые клиницисты полагают, что развитие желудочно-кишечных, маточных, носовых кровотечений, наличие примеси крови в рвотных массах и испражнениях при острых кишечных инфекциях являются следствием нарушений микроциркуляции и гемостаза, вызываемых эпдотоксином. По мнению В. И. Покровского и В. В. Малеева (1978) генезис нарушений гемостаза при холере, например, связан прежде всего с изменениями характера кровотока в микрососудах.
В клинических условиях интоксикация и гиповолемия, у больных сальмонеллезом наблюдаются одновременно, что не позволяет судить о конкретной роли каждого из этих факторов в развитии нарушений гемостаза.
ЖЕЛУДОЧНО-КИШЕЧНЫЙ ТРАКТ
За последние годы накоплено большое количество фактических данных, свидетельствующих о закономерном поражении системы органа пищеварения в острый период сальмонеллеза.
Состояние секреторной функции желудка нередко определяет возможность заражения. Хорошо известно, что у лиц с пониженной секрецией желудочного сока чаще развиваются острые кишечные инфекции, в том числе и сальмонеллез. У большинства больных сальмонеллезом секреция желудочного сока снижена. По данным С. П. Поповой (1973), снижение кислотообразующей функции желудка в разгар болезни было особенно выраженным у лиц с сопутствующими заболеваниями желудочно-кишечного тракта. В период ранней реконвалесценции оно наблюдалось у 80% больных, а у 39,4% рекоивалесцентов секреторная функция желудка не нормализовалась и в более поздние сроки. Л. Г. Мельникова (1976) обнаружила нарушения кислотообразующей функции желудка у 22% рекоивалесцентов даже через 3-6 мес. после выздоровления. По данным Н. Д. Ющука и соавт. (1976, 1978), у 50% больных сальмонеллезом в желудке и тонкой кишке выявляются патогенные стафилококки, дрожжевые и дрожжеподобные грибы, эшерихии, патогенные энтерококки. Полагают, что сальмонеллез способствует развитию хронических желудочно-кишечных заболеваний. Не исключено, что группа факторов, способствующих поражению желудочно-кишечного тракта, связана с тактикой лечения больных сальмонеллезом. По данным В. И. Покровского и соавт. (1976-1985), применение антибиотиков приводит к развитию дисбактериоза кишечника, пролонгирует диарею, препятствует репарации слизистой оболочки кишечника. Вместе с том трудно исключить и вероятность того, что сальмонеллез развивается у лиц, уже страдающих заболеваниями желудочно-кишечного тракта.
В острый период сальмонеллеза закономерно развиваются функциональные и морфологические изменения желудка и других отделов пищеварительной системы. Причем степень угнетения аветвной кислотности желудочного содержимого, уменьшения концентрации ионов хлора и дебита хлористоводородной кислоты зависели от тяжести заболевания.
При одновременном исследовании секреторной функции желудка и морфологии его слизистой оболочки В. И. Покровский и соавт» (1981) установили, что угнетение секреторной функции желудка возникает только на фоне гастрита. В отсутствие гастрита в острый период болезни отмечено повышение секреторной деятельности желудка. По наблюдениям Ю. А. Ильинского и соавт. (1977), расстройства кислотообразования были более продолжительными, чем нарушения двигательной и секреторной деятельности желудка. По данным В. И. Рябова (1983), признаки поражения желудка наблюдались с одинаковой частотой как у больных гастроэнтероколитическим, так и гаетроэюер и тическим вариантами сальмонеллеза. Продолжительность клинических проявлений дисфункций жимудка (боли в эпшастрии; рвота, тошнота) обычно не превышала 2-4 дней от начала заболевания. В то же время при исследовании кислотообразующей функции желудка было найдено снижение объема желудочной секреции и почасового дебита хлористоводородной кислоты у 2/3 обследованных лиц. Синтез пепсиногена был уменьшен у 70% больных сальмонеллезом, причем низкие значения активности этого фермента были установлены не только при его определении в желудочном содержимом, но и в плазме крови и в суточной моче.
На значительное снижение секреторной функции желудка указывают данные И. К. Митчегтко и соавт. (1977). Авторами использован метод оценки экскреции уропепсина, позволяющий косвенно судить о состоянии главных Kiieiefft слизистой оболочки желудка. При обследовании до лечения имело место значительное, в 2-3 раза ниже нормы, уменьшение экскреции уропепсина с мочой. К 3-6-му дню лечения в стационаре содержание уропепсина практически не увеличивалось. Перед выпиской больных содержание уропепсина было стабильно низким. Особенно низкие показатели уроиепсинурии (15 ед.) отмечены у больных с сопутствующими заболеваниями (гельминтозы, холецистит, неспецифический язвенный колит и др.).
По мнению большинства исследователей изменения секреторной функции желудка объясняются воздействием на слизистую либо токсинов возбудителя, либо самих бактерий. А. В. Момеепко (1979) даже при легком и среднетяжелом течении сальмопелдала в период разгара болезни наблюдал морфологические изменения в виде поверхностного гастрита (72,3%), гастрита с поражением желез (21,7%) и атрофического гастрита (6%). В собственном слое слизистой оболочки обнаружена значите ная клеточная инфильтрация. Среди клеток инфильтрата большинство составляли лимфоциты. Выявлены единичные нейтрофилы и эозивофилы. Усилена секреция нейтральных глюкозаминогликанов клетками покровного и железистого эпителия. В период клинического выздоровления отмечено заметное уменьшение морфологических изменений в эпителии, инфильтрации собственного слоя слизитой оболочки.
Причины изменения кислотообразовательной функции желудка у больных сальмоллезом остаются неясными. В свете развиваемой нами концепции о патогенетической роли системы тканевых гормонов – простагландинов и установления способности эйдотксина сальмонелл резко активизировать их биосинтез особое знамение приобретают данные об активизации синтеза простагландинов слизистой оболочкой желудка [El-Gendi М. A. et al., 1982; Koll- berg В., 1982; Danon A. et al., 198З].
Можно аредположить, что гибель большей: части салмонел в подслизистом слое желудка с выделением эндотоксина, вызывающего активную трансформацию арахидоновой кислоты в простагландины, оказывает выраженное влияние на фнкциональное состояние желудка. Это предположение в известной степени подкрепляется результатами применения индометацина. Прием препарата быстро купирует тошноту и рвоту.
В связ с использованием в последние годы методов оральной регидратации важное значение приобретают сведения о функциональном состояний тонкой кишки у больных сальмонеллезом.
Нарушение процессов всасывания в тонкой кйшке играет патогенетическую роль в развитии диареи. По данным R. A. Gianella и соавт. (1971), при экспериментальной сальмонеллезе у кроликов активность сахаразы и мальтазы в слизистой оболочке тонкой кишки не меняется. Исследователи обнаружили лишь подавление активности лактазы. И. Н. Новицкий (1973) установил, что решение лактазы у больных сальмонеллезом не нарушается при любой степени тяжести заболевания. Различие в отношении активности лактазы в клинических и экспериментальных условиях авторы объясняют видовыми особенностями лактазы у человека и кроликов. А. Ф. Блюгер и соавт. (1975) считают, что нарушения всасывания в тонкой кищке выявляются только в ранний период болезни и не имеют патогенетического значения в развитии диареи.
К противоположным выводам в отношении состояния пристеночного пищеварения при экспериментальном сальмонеллезе пришли Н. Д. Ющук и соавт. (1979) и М. И. Сeмашко (1983). Они обнаружили резкое снижение активности гидролитических ферментов в тощей и особенно в подвздошной кишке. В первые 5 дней опыта резко снижалась активность мальтазы и в меньшей степени лактазы. Ранее П. Д. Ющук и соавт. (1976, 1978) установили нарушение всасывательной и пищеварительной функции у больных гастроинтестинальной формой сальмонеллеза. Причем у 50% больных они выявили в желудке и тонкой кишке патогенный стафилококк, дрожжевые и дрожжеподобные грибы, эшерихии и энтерококки. Указанные нарушения, по данным Н. Д. Ющука и В. А. Утехина (1977), сочетаются с рентгенологическими признаками нарушения моторно-эвакуаторной функции как тонкой, так и толстой кишки. Полостное пищеварение в тонкой кишке, по данным В. И. Рябова (1983), было изменено у 42,2 % из 296 обследованных больных сальмонеллезом. У половины больных отмечено снижение пристеночного гидролиза лактозы. Показатели пробы с d-ксилозой у 45,9 % больных свидетельствовали о нарушении всасывательной функции тонкой кишки.
По многочисленным данным, поражение желудочно-кишечного тракта при сальмонеллезе не ограничивается желудком и тонкой кишкой [Покровский В. И. и др., 1981; Ярков А. Н., 1983; Рябов В. И., 1983; Туманов Ф. А., 1985]. Например, проявления колита обнаружены в 30-62% случаев гастроинтестинальной формы сальмонеллеза.
По данным В. И. Рябова (1983), уменьшение ферментинактивирующей способности микрофлоры толстой кишки в 50% случаев приводило к увеличению активности щелочной фосфатазы, в 1/3 случаев повышалась активность энтерокиназы. У 2/3 обследованных больных отмечено нарушение всасывания йодида калия в прямой кишке.
По данным анализа копрограмм А. Н. Ярков (1983) выявил изменения в толстой кишке у 41 %, а в результате ректороманоскопии – у 59 % больных. В то же время при изучении биоптатов слизистой оболочки толстой кишки у всех обследованных больных были найдены резко выраженные признаки поражения слизистой. С. А. Степанов и соавт. (1976) с помощью аспирационной биопсии обнаружили в тонкой кишке больных сальмонеллезом деструктивные и некробиотические изменения эпителия, острое воспаление слизистой оболочки, захватывающее поверхностные слои и сопровождающееся нарушениями микроциркуляции и сосудистой проницаемости. По данным Ю. Я. Дашевского и М. П. Синельниковой (1976), проводивших свето- и электронно-микроскопическое изучение эпителия кишечника больных сальмонеллезом, слизистая оболочка тонкой и толстой кишки полностью вовлекается в патологический процесс. К. X. ХодЖаев и соавт. (1981) в эксперименте на крысах показали, что сальмонеллезная инфекция вызывает нарушение процессов тканевого дыхания и фосфорилирования.
По данным Н. И. Саратовцевой (1976), у больных сальмонеллезом отмечается снижение температуры в тонкой кишке, что свидетельствует о замедлении кишечного кровотока. Воспалительную реакцию в желудочно-кишечном тракте, нарушения пищеварения и обмена веществ Ф. А. Туманов (1985) объясняет дисбактериозом кишечника, который проявляется отсутствием или резким уменьшением числа бифидобактерий и выраженными изменениями аэробной флоры. Размножение на этом фоне условно-патогенной флоры способствует развитию воспалительного. процесса, дистрофическим и деструктивным изменениям в слизистой оболочке кишечника.
Состояние поджелудочной железы у больных пищевыми токсикоинфекциями, а также при экспериментальном сальмонеллезе изучено Т. А. Белянской (1983). В острый период болезни отмечено снижение форментативпой активности панкреатического сока – уровень трипсина был снижен в 71% случаев, липазы – в 55%, амилазы – в 66%, ингибиторов трипсина – в 4%. Одновременно в сыворотке крови наблюдались повышение уровня активности трипсина и его ингибиторов, липазы, снижение активности амилазы.
Экспериментальные исследования позволили изучить непосредственное действие сальмонеллезного эндотоксина на показатели внешнесекреторной функции поджелудочной железы. Наибольшие изменения активности ферментов поджелудочной железы наблюдались через 18 и 72 ч после введения сальмонеллезного эндотоксина и выражались повышением активности трипсина и его ингибиторов, липазы и некоторым снижением активности амилазы сыворотки крови.
Морфологическое исследование поджелудочной железы при экспериментальной сальмонеллезной интоксикации выявило изменения в системе микроциркуляторного русла и ацинарной ткани поджелудочной железы. Нарушения экскреторной функции поджелудочной железы объясняют повреждением микроциркуляторного русла и ацинарной ткани железы, тканевой гипоксией и нарушением клеточного метаболизма. Эндотоксин вызывает активацию синтеза, преимущественно протеолитических ферментов, задержку экструзии секретируемых проэнзимов в протоковую систему железы, что приводит к секреции их в интерстиций и поступлению ферментов в лимфатическое и кровеносное русло.
ВОДНО-СОЛЕВОЙ ОБМЕН И КИСЛОТНО-ЩЕЛОЧНОЕ СОСТОЯНИЕ
Из всех проявлений сальмонеллеза наиболее изученными являются параметры водно-солевого обмена и кислотно-щелочного состояния.
Большой вклад в разработку этих вопросов внесли сотрудники кафедры инфекционных болезней Московского медицинского стоматологического института им. Н. А. Семашко и Центрального научно-исследовательского института эпидемиологии МЗ СССР. Под руководством академика АМН СССР В. И. Покровского в этих учреждениях за последние 10 лет проведено детальное исследование фактических потерь электролитов, воды, определены критерии степеней водно-электролитных потерь (см. главу 6), проанализировано кислотно-щелочное состояние при различных степенях тяжести течения сальмонеллеза и пищевых токсикоинфекций. Показано также, что нет существенной разницы в сдвигах водно-электролитного обмена и кислотно-щелочного состояния при сальмонеллезе и пищевых токсикоинфекциях нерасшифрованной этиологии [Покровский В. И. и др., 1978-1983; Бунин К. В. и др., 1975, 1977].
Особое внимание исследователей всегда привлекали состояние обмена натрия, калия и хлоридов, концентрация этих электролитов в плазме крови и эритроцитах, а также их выделение с мочой. По данным E. А. Сталькова, И. В. Андреева (1977), Н. Я. Аксеновой (1982), концентрация натрия в острый период болезни снижается. Изучив обмен этого электролита при тех же нозологических формах, К. В. Бунин и соавт. (1974), В. В. Малеев и соавт. (1976, 1982), А. В. Степанов (1979, 1985) пришли к выводу, что происходит снижение абсолютного количества натрия при неизменной концентрации электролита во внеклеточном пространстве.
По данным В. В. Малеева (1979) и А. В. Степанова (1985), при тяжелом течении пищевой токсикоинфекции абсолютное содержание натрия и хлора уменьшается на 20-25%. Дефицит калия во внеклеточном пространстве был еще больше – его концентрация снижалась до 30% от контрольных значений.
Таким образом, несмотря па длительный период изучения, до последнего времени имеются разногласия в отношении характера изменений уровней электролитов у больных сальмонеллезом и пищевой токсикоинфекцией. Указанные разночтения сказываются и при определении типов обезвояшвания. По мнению Е. П. Шуваловой (1980), следует выделять гипотоническую и гипертоническую дегидратации. Например, у ббльных энтероколитом часто наблюдается дефицит воды, что приводит к гипертоническому обезвоживанию. При гастроэнтерите выявлен дефицит электролитов – развивается обезвоживание по гипотоническому типу. По данным В. В. Малеева (1979), даже при тяжелом течении пищевых токсикоинфекций не меняется концентрация натрия и хлора в крови, что свидетельствует об изотоническом характере обезвоживания. Общий объем воды в организме снижался на 6-8% от нормальных значений при одновременном уменьшении объема внеклеточной и клеточной жидкости. Иной вариант перераспределения жидкости выявлен при токсикоинфекциях средней степени тяжести. В этих случаях отмечено значительное уменьшение внеклеточного пространства наряду с переходом жидкости в клетки. А. В. Степанов (1985) считает, что при тяжелом течении болезни преобладает изотоническое обезвоживание, при котором происходит одновременная потеря воды и электролитов. Основные потери воды были связаны с циркулирующей жидкостью.
Изменения водно-электролитного обмена всегда сочетаются с нарушениями кислотно-щелочного состояния крови. В острый период заболевания обнаружена связь между степенью тяжести болезни и развитием метаболического ацидоза в капиллярной крови [Жильцов Ю. Д., 1978 и др.]. В артериальной крови рН не отличалась от нормы. При средней степени тяжести пищевой токсикоинфекции выраженных нарушений кислотно-основного состояния не найдено.
Учитывая значительную противоречивость данных разных исследователей в отношении концентрации натрия в плазме крови и полагая, что это могло зависеть как от степени тяжести, так и от периода заболевания, нами проведено экспериментальное изучение влияния внутривенного введения эндотоксина сальмонелл на показатели водно-электролитного обмена.
С этой целью кроликам шиншилла в ушную вену вводили 1 мг/кг эндотоксина S. typhimurium, очищенного методом Буавена. Через 15-30 мин у экспериментальных животных развивалась диарея, повышалась температура тела, начиналась выраженная тахикардия. Потеря массы тела животных к исходу суток достигала 5 %. Показатели водно-электролитного обмена исследовались через 30 мин, 1 ч и 3 ч после введения эндотоксина. Пробы крови брали из сонной артерии под наркозом, для чего животным внутривенно вводили 40 мг/кг гексенала натрия. Через 30 мин после введения эндотоксина состояние водно-электролитного обмена характеризовалось уменьшением объема внеклеточной жидкости, которое сохранялось на протяжении всего эксперимента. Концентрация натрия в плазме крови через 30 мин увеличивалась, а через 1 ч была отмечена гипонатриемия, которая через 3 ч стала еще более значительной. Изменения осмолярности плазмы крови происходили параллельно с концентрацией натрия в длазме крови, т. е. через 30 мин выявлена гиперосмия, а к 3-му часу эксперимента – гипоосмия. Явления гипокалиемии развивались через 1 ч после введения эндотоксина.
Развитие нарушений водно-электролитного обмена происходит в 2 этапа: вначале развивается гипернатриемия и гиперосмия, в результате чего в первый час эксперимента не меняется объем сосудистого русла, а уменьшение объема внеклеточной жидкости происходит за счет интерстициального сектора. Затем при нарастании явлений интоксикации и водно-электролитных потерь развиваются гипонатриемия, гипоосмия, гипокалиемия и уменьшается объем внеклеточной жидкости.
У больных сальмонеллезом в разгаре заболевания водно-электролитный баланс характеризовался достоверным по сравнению с контролем уменьшением объема внеклеточной жидкости (5,6±0,11 л/м2, контроль – 7,41±0,13 л/м2; р<0,01) , признаками сгущения крови (индекс гематокрита – 0,55±0,009 л/л, контроль – 0,42±0,007 л/л; р<0,01). Концентрация натрия плазмы значительно по сравнению с контролем уменьшилась и составила 122,0±2,56 мроль/л (контроль – 134,9±1,6 ммоль/л; р<0,01). Осмолирность плазмы крови также снизилась (286,1±2,9 ммоль/л, контроль – З01,2±1,65 мосмоль/л; р<0,0,1). Концентрация калия плазмы крови достоверных отличий контрольной группы не имела. В начальный период заболевания состояние водно-электролитного обмена характеризовалось достоверным по сравнению с контролем уменьшением объема внеклеточной жидкости (6,25±0,12 л/м2; р<0,01), увеличением индекса гематокрита до 0,47±0,005 л/л (р<0,01), снижением концентрации натрия в плазме крови (126,4±1,17 ммоль/л; р<0,01). Осмолярность плазмы крови достоверных отличий от группы контроля не имела. Статистически достоверных изменений концентрации калия в плазме крови также не отмечено.
Таким образом при сальмонеллезе развивается обезвоживанжадобусловленное, потерей внеклеточной жидкости, а при тяжелом течении заболевания и части клеточной жидкости. Дегидратация в большинстве случаев имеет изотонический характер, сочетаясь о развитием сгущения крови, дефицитом электролитов, метаболическим авдщозом в капиллярной и периферической венозной крови.
В физиологической регуляции водно-электролитного обмена ведущее место принадлежит ренин-ангиотензинальдостероновой системе. Уровень ее функциональной активности зависит от многих факторов, в первую очередь от постоянства водно-электролитного обмена. Прежде чем представить данные о роли ренин-ангиотензин-альдостероновой системы в регуляции водно-долевого обмена при сальмонеллезе, даем краткую характеристику ее компонентов и основных механизмов регуляции.
Ренин представляет собой высокоснецифияеский протеолитический фермент, который существует в двух основных формах: обычный ренин (молекулярная масса около 40000 дальтон) и более крупная форма, известная как «большой», «про-» или «связанный» ренин (молекулярная масса около 60000 дальтон). Ренинподобная активность, кроме почки и плазмы крови, обнаружена в подчелюстной слюнной железе, головном мозге, матке [Peart W. S., 1978]. Ренин воздействует на содержащийся в плазме альфа-2-глобулин-ангиотензиноген, который синтезируется в печени, и расщепляет его с образованием декапептида ангиотензина I. Ангиотензин I не обладает вазопрессорной активностью и рассматривается лишь как промежуточный продукт. Под действием превращающего фермента (диспептидилкарбоксипептидазы), который образуется в легких, из ангиотензина I образуется эктапептид ангиотензин II. Последний является самым мощным из известных в настоящее время гуморальных прессорных факторов.
Ангиотензин II оказывает непосредственное действие на гладкомышечные клетки в стенках артериол, реализуя таким образом свое вазоконстрикторное действие. Наибольшей чувствительностью к ангиотензину II обладают сосуды почек. Ангиотензин II стимулирует также продукцию альдостерона корковым вещёством надпочечников. Альдостерон способствует задержке натрия в организме и повышению объема внеклеточной жидкости. Учитывая тесную связь ренин-ангиотензинного механизма с зависимой от него активностью коркового вещества надпочечников по выработке альдостерона, в настоящее время выдвинуто положение о единой ренин-ангиотензин-альдостероновой системе. Разрушение ангиотензина II происходит в периферических капиллярах под действием ангиотензина с образованием неактивных продуктов.
W. F. Cook и G. W. Pickering (1959) показали, что ренин вырабатывается клетками, тесно связанными с клубочками почек. Позже Н. Edelnian и P. М. Hartroft (1961) получили антисыворотку к ренину и с ее помощью доказали, что источником ренина в почке является юкстагло- мерулярный аппарат. Основные продуценты ренина – юкстагломерулярные клетки – имеют все признаки клеток эндокринного происхождения (гранулообразование), сохраняя в то же время характеристики гладкомышечных клеток, из которых они происходят (миофибриллы). С помощью электронной иммуногистохимии в них найдены секреторные гранулы, содержащие иммунореактивный ренин [Lindop G. В. М. et al., 1983].
Регуляция секреции ренина юкстагломерулярным аппаратом осуществляется с помощью трех основных механизмов: с помощью внутрипочечных рецепторов (рецепторы в стенке приносящей артериолы и плотное пятно), адренергических нервов, а также ряда гуморальных агентов (ангиотензин, кальций, натрий и др.). Подробные обзоры этих механизмов опубликованы J. О. Davis и R. Н. Freeman (1976), F, S, WrigS| и J. P. Briggs. (1970). Важными факторами, влияющими на работу ренин-ангиотензин-альдостероновой системы, являются простагланди- новая и калликреин-кининовая системы, оказывающие преимущественно антигипертензивное действие и являющиеся ее физиологическими антагонистами.
В 1964 г. А. С. Guyton и другие предположили, что на уровне одного пефрона существует тесная функциональная связь между плотным пятном, юкстагломерулярными клетками и клубочками. Ими была предложена компьютерная модель ауторетуляции почки с помощью системы обратной связи. В простейшем виде систему обратной связи на уровне одного нефрона представляют сейчас следующим образом. Повышение концентрации натрия в ка- нальцевой жидкости стимулирует плотное нятно, которое побуждает элителиоидные клетки к усиленному выбросу ренина, под влиянием последнего образуется ангиотензин II. Ангиотензин II в свою очередь вызывает шазм приносящей артериолы и снижение давления в капиллярах клубочка, а также уменьшение фильтрации в том же нефроне. В результате снижения фильтрации уменьшается всасывание натрия в проксимальном отделе нефрона, что приводит к уменьшению концентрации натрия на уровне плотного пятна (в канальцееой жидкости дистального отдела нефрона). Так включается механизм отрицательной обратной связи, приводящий в конечном итоге к увеличению скорости клубочковой фильтрации.
Увеличение секреции ренина достигается путем действия катехоламино на β-, а торможение – на α-рецепторы на эпителиоидных клетках юкстагломерулярного аппарата [Ganong N. F. et al., 1979; Torretti J., 1982].
Внутриклеточным медиатором выброса ренина при возбуждении или щрможении α- и β-рецепторов является циклический аденозинмонофосфат [Winer N. et al., 1971]. Кальций и натрий являются антагонистами во влиянии на выброс активного ренина и синергистами в действии на синтез неактивного ренина [Noble A. R. et al.r 1982].
Исключительную роль в регуляции синтеза альдостерона играет ангиотензин II, так как он возбуждает секрецию альдостерона корковым веществам надпочечников, воздействуя на имеющиеся там специфические рецепторы к ангиотензину [Glossmann Н. et al., 1974].
Основным афферентным сигналом, активирующим ренин-ангиотензин-альдостероновую систему, является снижение артериального давления или объема циркулирующей крови. Этот сигнал воспринимают плотное пятно и сосудистые рецепторы. Снижение давления или объема крови приводит к уменьшению давления в капиллярах клубочков, снижению скорости клубочковой фильтрации, концентрации ионов натрия и хлора в канальцевой жидкости. Ограниченное поступление ионов натрия и хлора к плотному пятну может быть стимулом для выброса ренина. В то же время сниженные давление и объем крови в области приносящей артериолы вызывают уменьшение напряжения ее стенки, что в свою очередь активирует сосудистые рецепторы и ведет к увеличению выброса ренина. В некоторых условиях оба рецептора могут активироваться одновременно. Плотное пятно как рецептор становится наиболее эффективным в условиях низкого артериального давления, когда стенка (приносящей артериолы максимально расслаблена. В условиях нормального артериального давления наиболее эффективен сосудистый рецептор.
Симпатические нервы почек оказывают прямое влияние на юкстагломерулярные клетки, а также гладкомышечные клетки в стенке приносящей артериолы. Поэтому повышение активности симпатической нервной системы, сопровождающееся усилением выброса репина, связано либо с прямым действием на синтезирующие ренин эпителиоидные клетки, либо с опосредованным действием черев спазм приносящей артериолы, приводящий к снижению давления в капиллярах клубочка и скорости клубочковой фильтрации, а также уменьшением концентрации ионов натрия и хлора в дистальном отделе нефрона. Циркулирующие в крови адреналин и норадреналин вызывают усиление синтеза ренина путем прямого действия на эпителиоидные клетки юнстагломерулярного аппарата.
Нами проведен анализ изменений активности ренина и концентрации альдостерона у больных сальмонеллезом, а также при экспериментальной сальмонеллезной эндотоксинемии. Определение активности ренина проводили с помощью радиоиммуннего набора реактивов фирмы «CIS» (Франция). Активность ренина плазмы измеряли в мжг/л/ч, концентрацию альдостерона плазмы – в нмоль/л. Обследование больных проводили при поступлении в стационар (разгар болезни–1-2-е сутки), через 10-12 ч после проведенной терапии и в период реконвалесценции.
У больных сальмонеллезом с дегидратацией 2-3-й степени в разгар заболевания отмечено повышение активности ренина (19,78±3,09 мкг/л/ч, контроль – 1,58±0,25 мкг/л/ч; р<0,01) и концентрации альдостерона в плазме крови (1,1±0,03 нмоль/л, контроль – 0,49±0,05 нмоль/л; р<0,01). У больных с дегидратацией 1-й степени активность ренина в плазме крови повышалась в меньшей степени (4,0±0,70 мкг/л/ч; р<0,01), а концентрация альдостерона не отличалась от таковой в контрольной группе (0,51 ±0,037 нмоль/л, р<0,05).
Таким образом, в острый период сальмонеллеза наблюдается активация ренин-ангиотензин-альдостероновой системы. Уровень активации был наибольшим у больных с дегидратацией 2-3-й степени, что связано с большими водно-электролитными потерями. Одной из причин активации ренин-ангиотензин-альдостероновой системы является усиленный синтез простагландинов. Последние способны активировать юкстагломерулярный аппарат (см. главу 2). Повышенный уровень ренина в свою очередь стимулирует образование альдостерона корой надпочечников.
Нами выявлена прямая сильная корреляционная связь между показателями активности ренина плазмы крови и концентрацией альдостерона плазмы (r±0,88), что свидетельствует об усиленной выработке ренина в условиях сальмонеллезной интоксикации с одновременным увеличением концентрации альдостерона плазмы. Активация ренин-ангиотензин-альдостероновой системы является одним из механизмов адаптации организма к водно-электролитным потерям. Это положение подтверждается и наличием корреляционной зависимости между активностью ренина плазмы и индексом гематокрита (r=0,50), активностью ренина плазмы и объемом внеклеточной жидкости (r= –0,55). Между показателем активности ренина плазмы и концентрацией натрия плазмы крови выявлена слабая отрицательная корреляционная связь, свидетельствующая о том, что в острый период сальмонеллеза ведущими факторами, стимулирующими ренин-ангиотензинальдостероновую систему, являются объемные потери.
Для детальной характеристики влияние эндотоксина S. typhimurium на состояние ренин-ангиотензин-альдостероновой системы нами проведены экспериментальные исследования. Через 30 мин после введения животным эндотоксина отмечено достоверное по сравнению с контролем увеличение активности ренина, достигающее через 3 ч 34,86±3,42 мкг/л/ч (контроль – 15,3±2,02 мкг/л/ч; р<0,01). При этом концентрация альдостерона в плазме не увеличивалась. Состояние водно-электролитного обмена характеризовалось уменьшением объема внеклеточной жидкости, которое наблюдалось на протяжении всего эксперимента (через 3 ч после введения эндотоксина объем внеклеточной жидкости составил 13,5±0,21 % (контроль– 16,3±0,74%; р<0,01). Концентрация натрия в плазме крови через 30 мин после введения эндотоксина увеличилась и составила 150,0 ±3,43 ммоль/л (контроль – 137,7±2,44 моль/л; р<0,02). Через 1 ч отмечена гипонатриемия, которая через 3 ч стала более значительной (124,6±2,14 ммоль/л; р<0,01). Индекс гематокрита по сравнению с контролем увеличивался и оставался повышенным на протяжении всего эксперимента. Изменения оомолярности плазмы крови происходили параллельно с изменениями концентрации натрия в плазме крови, т. е. через 30 мин после введения эндотоксина выявлена гиперосмия (310,0±2,73 мосмоль/л, контроль 302,8±1,09 мосмоль/л; р<0,05), а через 3 ч после начала эксперимента– гипоосмия (296,0±2,32 мосмоль/л; р<0,05). Явления гипокалиемии в этой группе животных обнаружены через 1 ч после введения эндотоксина (2,83±0,37 ммоль/л, контроль – 4,2±0,15 ммоль/л; р<0,01).
Таким образом, при сальмовеллезной интоксикации имеет место быстрая ответная реакция ренин-ангиотензинальдостероновой системы на потерю жидкости и электролитов, что экспериментально подтверждено. Вместе с тем следует отметить, что, несмотря на уменьшение объема внеклеточной жидкости, развитие гипонатриемии с гипооомией, достоверное увеличение концентрации альдостерона в плазме не наблюдается. Это, понвидимому, связано с влиянием интоксикации на кору надпочечников и выраженной гипокалиемией. Активация ренин-ангиотензин-альдостероновой системы направлена на поддержание объема сосудистого русла в начале эксперимента. В последующем наступает истощение ренин-ангиотешзин-альдостероновой системы, сопровождающееся гинатриемией, гипоосмией, гипокалиемией, 'уменьшением объема внеклеточной жидкости и гемоконцентрацией.
Принимая во внимание участие простагландинов в патогенезе диареи, можно восстановить водно-электролитный обмен и понизить активность ренин-ангиотензин-альдостероновой системы путем торможения синтеза простагландинов и восстановления потери жидкости и солей. Для проверки этого предположения нами проведена серия опытов по установлению эффективности действия ингибитора биосинтеза простатландинов – индометацина у животных с экспериментальной сальмонеллезной. интоксикацией. Этой группе животных (12 «роликов) через 30 мин после введения эндотоксина внутрижелудочно вводили ингибитор биосинтеза простагландинов – индометацин в дозе 8 мг/кг массы тела. Уже к первому часу эксперимента у животных отмечено заметное уменьшение симптомов интоксикации, прекращались водно-электролитные потери, животные охотно шили воду. Уровень активности ренина плазмы крови к этому времени был в пределах контрольных показателей и в дальнейшем не менялся. Напротив, концентрация альдостерона плазмы через 1 ч увеличивалась (2,79±0,11 нмоль/л, контроль – 1,52±0,36 нмоль/л, р<0,01). (Состояние водно-электролитного обмена характеризовалась восстановлением концентрации натрия, калия и осмолярности плазмы крови, снижением индекса гематокрита до физиологических значений. Вместе с тем объем внеклеточной жидкости не восстанавливался, так как активная регидратация животным не проводилась.
Нарушения деятельности почек при сальмонеллезной инфекции обнаружены многими исследователями. Например, О. С. Буханцова (1970) выявила в острый период заболевания нерезкое нарушение деятельности органа, протекавшее по типу клубочково-фильтрационной недостаточности. Уже в 1-е сутки после госпитализации наблюдалось снижение клубочковой фильтрации. В части случаев отмечены олигурия и даже анурия (в течение суток). Уровень мочевины крови был повышен почти у всех тяжелобольных и достигал 753,0 ммоль/л. Повышение уровня мочевины наблюдалось и при среднетяжелом течении заболевания. Более чем у половины больных повышено содержание остаточного азота крови (до 119,04 ммоль/л). В большинстве случаев признаки нарушений функциональной способности почек быстро исчезали, сохраняясь лишь у отдельных больных. В некоторых случаях на 4-6-е сутки болезни наблюдались признаки нарушения функций канальцев, проявлявшиеся в развитии олигурии и выделении мочи с низкой относительной плотностью.
Комплексное исследование функционального состояния ночек три гастроинтестинальной форме сальмонеллеза провели также В. Н. Никифоров и соавт. (1972). Применение радиоизотопной ренографии позволило авторам выявить у значительного числа больных нарушения поглотительной и экскреторной функций органа. Обнаруженные изменения определялись лишь в, разгар забивания и не выявлены в ч периоде реконвалесценции, что дало возможность связать их развитие с интоксикацией. Установлено нарушение кровоснабжения ночен, соответствующее тяжести течения сальмонеллеза. Показатели клубочковой фильтрации коррелировали с состоянием эффективного почечного кровотока. В период реконвалесценции указанные изменения претерпевали обратное развитие.
Наряду с гемодинамическими нарушениями сальмонеллезный эндотоксин вызывает дистрофические изменения, интерстициальный отек и клеточную инфильтрацию внутренних органов [Кузнецова О. Р. и др., 1976; McKay D. Gr. et al., 1966]. Мукоцолисахариды эндотоксина определяются в почках уже в первые 24 ч после его введения.
В наших наблюдениях уже через 3 ч после введения сальмонеллезного эндотоксина кроликам при светоонтическом исследовании отмечалось полнокровие капилляров почечных клубочков и перитубулярных капилляров. Нефроциты канальцев, набухшие с вакуолизированной цитоплазмой. При электрояно-микроскопическом исследовании выявлены набухание и вакуолизация цитоплазмы эндотелиальных клеток клубочка, фибрин и полиморфно-ядерные лейкоциты, в том числе с секвестрированными лизосомами его капиллярах. В перитубулярных капиллярах обнаружено сладжирование эритроцитов. Нефроциты и их митохондрии, набухшие, кристы частично редуцированы, цистерны эндоплазматичесдкой сети расширены. В элементах юкетаг-ломерулярного аппарата развивались главным образом дистрофические изменения. Нефроциты плотного пятна набухшие, их базальный лабиринт сглажен, цистерны эядоплазматической сети очахово расширены. В эпителиоидных клетках выявлены расширение эндоплазматической сети, набухание митохондрий, повышение прозрачности цитоплазмы. Гранулы в эпителиоидных клетках разной электронной плотности.
Через 24 ч после введения сальмонеллезного эндотоксина при снетооптическом иссдедоваппи отмечены резкое полнокровие капилляров клубочков, сладжированные эритроциты, полиморфно-ядерные лейкоциты и фибрин в их просвете, расширение мезангия. Перитубулярные капилляры резко расширены. Нефроциты канальцев набухшие, их цитоплазма вакуолизирована. При электроинно-микросколическом исследовании выявлены полнокровие капилляров клубочков, накопление в последних наряду с эритроцитами тромбоцитов полиморфно-ядерных лейкоцитов и фибрина (рис. 10).
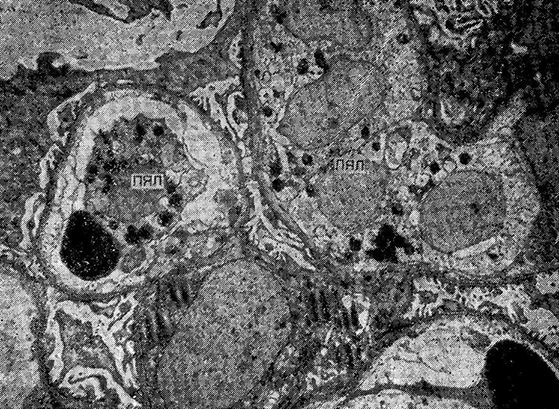
Рис. 10. Введение сальмоиеллезного эндотоксина (24 ч опыта).
Полиморфно-ядерные лейкоциты (ПЯЛ) в просвете капилляров почечного клубочка. X 6000.
В цитоплазме мезашиальных клеток и части подоцитов найдены липидные включения (рис. 11).
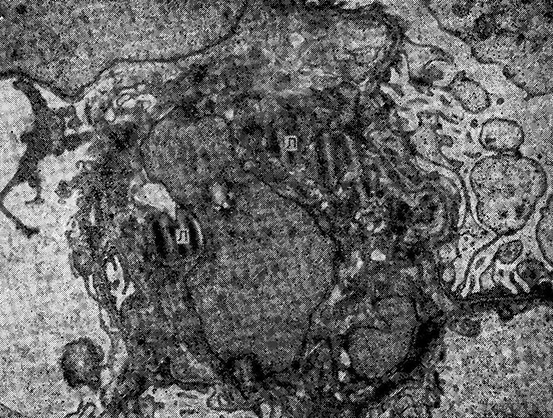
Рис. 11. Введение сальмонеллезпого эндотоксина (24 ч опыта).
Липидные включения (Л) в цитоплазме мезангиальной клетки. X 10000.
В перитубулярных капиллярах наблюдалось скопление полиморфно-ядерных лейкоцитов е секвестрированными лизосомами (рис. 12).
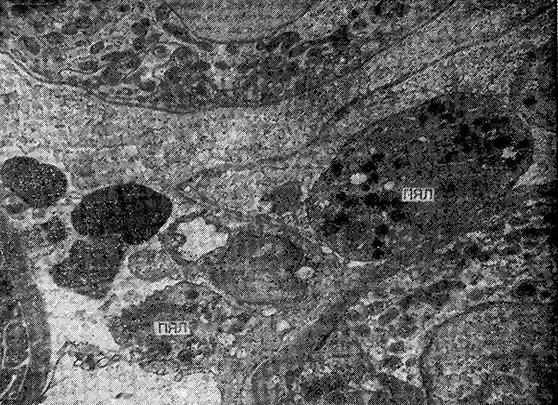
Рис. 12. Введение сальмонеллезного эндотоксина (24 ч опыта).
Полиморфно-ядерные лейкоциты (ПЯЛ)
с секвестрированными лизосомами в перитубулярных капиллярах почки. х 6000.
В части пефроцитов проксймальных канальцев очаговая деструкция микровореинок, в цитоплазме клеток видны крупные липидные капли (рис. 13).
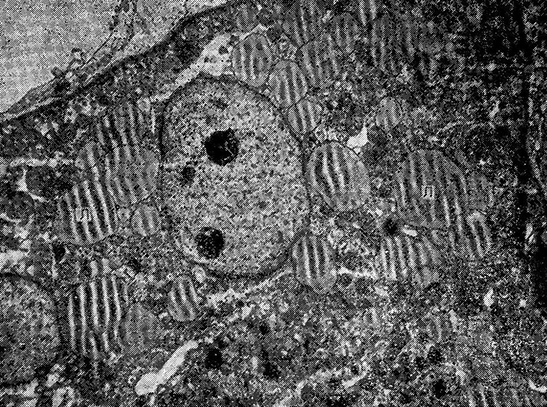
Рис. 13. Введение сальмонеллезного эндотоксина (24 ч опыта).
Крупные липидные включения (Л) в цитоплазме нефроцитов проксимального канальца почки. х 6000
В нефроцитах других отделов пефрона выявлены изменения, расцененные как гидропическая дистрофия. Цитоплазма нефроцитов плотного пятна набухшая, базальный лабиринт стлаженрна апикальной поверхности цитоплазматические выросты. В эпителиоидных клетках юкстагломерулярното аппарата обилие гранул разной электронной плотности, в том числе обнаружены ромбовидные шротогранулы. В части клеток гиперплазия эндопламатической сети (рис. 14).
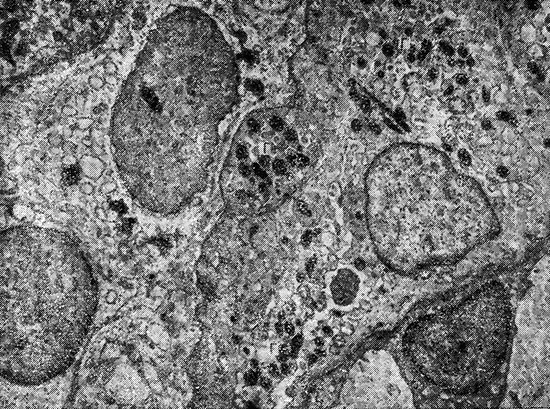
Рис. 14. Введение сальмонеллезного эндотоксина (24 ч опыта).
Обилие гранул (Г) разной формы и электронной плотности в эпптелиоидных клетках
юкстагломерулярного аппарата. X 6000.
Проведенные ранее исследования не были направлены на выявление скрытых механизмов действия сальмонеллеаного эндотоксина и носили главным образом констатационный характер. В частности, не получил морфологического обоснования факт стимуляции эндотоксином синтеза простагландина Е [Jaron М. et al., 1980], который синтезируется и в мозговом веществе почек. Вместо с тем именно нростагландин Е опосредует действие бактериальэного эндотоксина на сосудистую стенку [Kahn А., Brachet Е., 1981]. В последние годы изучена роль простагландинов, тромбоксанов и простациклина в регуляции процессов агрегации и высвобождения тромбоцитов в норме и патологии. Агретацию тромбоцитов человека и кролика вызывают арахидоновая кислота и циклические ондоперркспды. Из рридогенных метаболитов арахидоновой кислоты наибольшей активностью обладает тромбоксан А2 [Fitzpatrich F. A., Gorman R. R., 1977]. Тромбоксан А2 синтезируется в тромбоцитах и, помимо тромбоцитагрегирующего, оказывает и вазоконстрикторное действие. Одним из источников тромбксана А2 при эндотоксинемии являются тромбоциты [Stuart М. J., 1981]. Простагландин Е2 потенцирует АДФ-адреналин-коллаген-индуцированную агрегацию тромбоцитов [Fitzpatrich F. A., Gorman R. R., 1977]. Механизм такого действия шростагландина Е2, видимо, связан с активацией специального мембранного рецептора тромбоцитов [Mac Intyre D. Е., Gordon J. L., 1977]. Антагонистом тромбоксана А2 и простяглсШдина Е2 является простациклин [Moncada S. et al., 1977; Maclntyre et al., 1978]. Считают, что в основе внутрисосудистого свертывания, развивающегося вслед за повреждением эндотелия сосудистой стенки, лежит процесс нарушения синтеза простагландинов. Так, слизистая оболочка тонкой кишки под воздействием эндотоксина синтезирует равные количества простагландинов D2 и Е2 [Pesckar В. М. et al., 1981]. Одновременно эндотоксин тормозит активное всасывание натрия и стимулирует секрецию хлора и цАМФ [Когman S. Н. et al., 1981]. Торможение ангиотензина II саралазином при дисоеминированной внутрисосудистой коагуляции предотвращало развитие почечной недостаточности и приводило к уменьшению количества фибрина в клубочках [Stahl Е. et al., 1981, 1983]. Все это побудило нас провести анализ изменений, развивающихся под воздействием сальмонеллезного эндотоксина в различных отделах нефрона и в первую очередь в простагландиновой системе почек, представленной интерстициальными клетками мозгового вещества и нефроцитами собирательных трубок. Кроликам вводили внутривенно по 2 мг/кг эндотоксина. Забивали их через 3 и 24 ч.
Через 3 ч после введения сальмонеллезного эндотоксина во внутренней зоне мозгового вещества почки выражен отек интерстиция. В части интерстициальных клеток отмечено накопление липидных гранул. В целом происходило статистически недостоверное увеличение количества липидпых гранул в цитоплазме клеток по сравнению с контролем. Гиперплазия эядопдазматпческой сети и пластинчатого комплекса не выявлена. Нефроциты собирательных трубок не испытывали каких-либо существенных изменений.
Через 24 ч после введения сальмонеллезного эндотоксина изменения в интерстициальных клетках мозгового вещества складывались из увеличения плотности цитоплазмы и редукции отростков, набухания клеток с вакуолизацией эндоплазматической сети, набухания митохондрий и некоторого увеличения количества липидных гранул в циетллаада. Происходило статистически недостоверное уменьшение количества липидных гранул в цитоплазме интерстициальных клеток по сравнению с контролем. В нефроцитах собирательных трубок развивались умеренно выраженные дистрофические изменения.
Данные органелдометрии свидетельствуют о том, что через 24 ч после введения эндотоксина увеличивается относительный объем эндоплазматпческой сети и, начиная с 3 ч, возрастает объем липидных гранул. Все это может быть косвенным признаком повышения синтетической активности интерстициальных клеток и предшественников простагландинов. Прямое действие эндотоксина на интерстициальные клетки и нефроциты собирательных трубок проявляется развитием в последних дистрофических изменений.
Сопоставление динамики изменений относительных объемов органелл и гранул в эпителпоидных клетках юкстагломерулярного аппарата и интерстициальных клеток свидетельствует о наличии некоторых общих закономерностей. Так, уже в ранние сроки (через 3 ч) после введения эндотоксина наблюдается накопление гранул в клетках. Через 24 ч развивается гиперплазия эндоплазматической сети и продолжается накопление гранул. Такие довольно синхронные изменения могут свидетельствовать об ответе эндокринной системы почек прежде всего на прямое действие эндотоксина, а также развивающуюся при эндотоксинемии гипоксию.
Вторая серия экспериментов была посвящена изучению факторов, вызывающих торможение простагландиновой системы почек. Наиболее специфичное действие оказывает индометацин, являющийся ингибитором фермента нростагландинеинтетазы. Действие ингибитора морфологически проявлялось уменьшением относительного объема эндоплазматической сети, митохондрий и липидных гранул в цитоплазме интерстициальных клеток. Причем количество липидных гранул в цитоплазме клеток через 3 ч после введения препарата возрастало, а через 24 ч становилось ниже контрольных показателей. Параллельно в эпителиоидных клетках юкстагломерулярного аппарата резко увеличивался относительный объем гранул, которые представлены в основном как бы «пустыми» гранулами, не имеющими сердцевины. Это свидетельствует об усиленном выбросе ренина, так как одновременно существенно увеличивается относительный объем пластинчатого комплекса и митохондрий. Следовательно, сразу же после введения индометацина происходит активация ренин-ангвотензиновой системы почек – опустошаются депо ренина в гранулах.
Сальмонеллезный эндотоксин вызывает усиление синтеза простагландинов. Это действие эндотоксина распространяется и на почку, так как гиперплазия эндоплазматической сети в интерстициальных клетках сопровождалась и увеличением объема липидных гранул. При этом количество липидных гранул в цитоплазме интерстициальных клеток через 3 ч после введения эндотоксина было выше, а через 24 ч – ниже контрольных данных. Гиперплазия эндоплазматической сети в эпителиоидных клетках юкстагломерулярного аппарата сопровождалась увеличением относительного объема гранул. Причем через 3 ч после введения эндотоксина среди гранул много незрелых. Все это свидетельствует об активации ренин-ангиотензиновой системы почек.
Активация юкстагломерулярного аппарата после введения сальмонеллезного эндотоксина, видимо, в большей степени связана с ишемией органа, развивающейся под действием внутрисосудистого свертывания крови, и поэтому не компенсируется простагландиновой системой.
Таким образом, экспериментальные исследования морфологии ренин-ангиотензиновой и простагландиновой систем почек показали синхронность их антагонистических изменений. Активация или торможение одной из систем антагонистов вызывает противоположную реакцию другой. Кроме того, обнаружен определенный стереотип морфологических проявлений активации и торможения эндокринной системы почек, который выявлен во всех группах. Повышение активности ренин-ангиотензиновой системы почки проявляется усилением синтеза и депонирования (гиперплазия эндоплазматической сети) или выброса ренина (гиперплазия пластинчатого комплекса). Общие закономерности изменений интерстициальных клеток в условиях активации и торможения простагландиновой системы менее очевидны, хотя в общих чертах сходны с таковыми эпителиоидных клеток юкстагломерулярного аппарата.
Индометацив тормозит синтез простагландинов, воздействуя на простагландивсивтетазу. В интерстициальных клетках были слабо развиты органеллы – уменьшен по сравнению с контролем отвосительный объем эндоплазматической сети, митохондрий и пластинчатого комплекса. Отвосительный объем липидных гранул также уменьшался. Следует обратить взимание на циклический характер изменений количества гранул в интерстициальных клетках. Так, через 3 ч после введения индометацииа – в фазу накопления препарата в органе – происходило увеличение количества липидных гранул, а через 24 ч, когда начиналась элиминация ивдометацива и интерстициальпые клетки освобождались от тормозящего действия последнего на их простагландинсинтетазу, количество липидных гранул уменьшалось и становилось даже несколько ниже нормы. Одновременно возрастал объем пластинчатого комплекса.
В юкстагломерулярном аппарате через 3 ч после введения индометацина уменьшался объем эндоплазматической сети, хотя объем пластинчатого комплекса, митохондрий и гранул увеличивался. Среди гранул преобладали опустошенные, не имевшие сердцевины, как бы «оболочки» гранул, что свидетельствует об усиленном выбросе ренина. Через 24 ч продолжалось накопление гравул. При этом развивалась гиперплазия эндоплазматической сети, а объем пластинчатого комплекса уменьшался. Таким образом, после введения ивдометацина отчётливо проявился антагонистический характер взаимодействия ренин-ангиотензиновой и простагландиновой систем почек. Через 3 ч после введения индометацина в интерстициальных клетках мозгового вещества обнаружены признаки угнетения синтетических и секреторных процессов. В то же время в юкстагломерулярном аппарате они активировались. Через 24 ч (по окончании действия индометацина) активация синтетических и секреторных процессов в интерстициальных клетках сопровождалась торможением секреторной активности эпителиоидных клеток юкстагломерулярного аппарата, хотя их синтетическая способность и сохранялась на достаточно высоком уровне.
Введение эндотоксина приводит к внутрисосудистой коагуляции, захватывающей в первую очередь капилляры клубочков. Сальмонеллезный эндотоксин является стимулятором синтеза простагландинов в организме. В эндокринной системе почек это его действие проявляется в активации через 24 ч синтетических процессов в интерстициальных клетках мозгового вещества. Дополнительным фактором, влияющим на состояние эндокринной системы почек после введения сальмонеллезного эндотоксина, является ишемия, которая развивается в связи с внутрисосудистой коагуляцией. Поэтому уже в ранние сроки (через 3 ч) повышается секреторная, а затем (через 24 ч) и синтетическая активность эпителиоидных клеток юкстагломерулярного аппарата. Таким образом, при воздействии факторов, оказывающих многостороннее влияние на эндокринную систему почек, нарушены взаимоотношения между ее ренин-ангиотензинным и простагландиновым звеньями, и наступает ранняя дискоординация функций эндокринной системы почек, что имеет большое значение в патогенезе заболевания.
Усиленная секреция простагландинов после введения сальмонеллезного эндотоксина связана, возможно, и с нарушением водно-солевого равновесия, развивающегося вследствие потери жидкости. Введение через 1 ч после сальмонеллезного эндотоксина ингибитора простагландинсинтетазы (индометацин) хотя и не предотвращало полностью развития изменений, вызванных эндотоксемией, но существенно уменьшало тяжесть повреждений. Такое действие индометацина при сальмонеллезной интоксикации можно объяснить его влиянием на синтез простагландинов. Ослабление проявлений внутрисосудистой коагуляции могло быть связано также с опосредованным воздействием индометацина на факторы свертывающей системы крови.
Действие эндокринной системы почки направлено преимущественно на регуляцию внутрипочечного кровотока. Поэтому экстраполировать полученные результаты на весь организм не представляется возможным. Вместе с тем ренин-ангиотензиновая и простагландиновая системы почки, обеспечивая регуляцию внутриорганного кровотока, оказывают и значительное влияние на водно-солевой обмен, центральным органом которого является почка. Безусловно, повреждение сальмонеллезным эндотоксином внутриорганной эндокринной системы почек отрицательно сказывается на способности организма поддерживать необходимый уровень водно-солевого обмена.

