Ячменное зерно, так же как и зерна других злаков, содержит определенное количество белков. Содержание белка в зерне ячменя колеблется в широких пределах— от 7 до 26%, но для пивоварения применяются специальные сорта с низким содержанием белка (9— 11%), так как с увеличением в зерне белка уменьшается содержание крахмала, что приводит к снижению основного экономического показателя производства — выхода экстракта.
Тем не менее белки играют важную роль в технологии пива и оказывают существенное влияние на его качество. Низко- и среднемолекулярные продукты ферментативного гидролиза белков, происходящего на стадиях солодоращения и затирания, — аминокислоты и пептиды — обеспечивают азотистое питание дрожжей и участвуют в сложных процессах метаболизма дрожжевой клетки.
По мере изучения влияния белков на технологический процесс и качество готового пива было установлено, что помимо влияния на коллоидную стойкость белки определяют такие важные свойства пива, как пенистость и полнота вкуса. Для регулирования этих свойств необходимо знание не суммарного количества белка, а изучение отдельных групп или даже индивидуальных белков.
Термином «белки» или «полипептиды» обозначают группу веществ, различающихся как по строению, так и по свойствам. Как известно, белки являются биологическими полимерами, построенными из цепочек аминокислотных остатков, соединенных пептидной связью —СО—NH—. В состав белков входит около 20 аминокислот, но каждый белок характеризуется совершенно индивидуальной структурой, обусловленной числом и последовательностью отдельных аминокислот в нем. Различают 4 уровня структурной организации белков (первичная, вторичная, третичная и четвертичная) [41, 43].
В настоящее время с помощью рентгено-структурного анализа, физико-химических и биохимических методов расшифрована структура многих белков на всех уровнях организации. В конце 60-х годов впервые осуществлен синтез полипептидной цепи (124 аминокислотных остатка), обладающей ферментативной (рибонуклеазной) активностью [43].
Белки ячменя, солода, сусла и пива еще не изучены с нужной степенью детализации, и в большей части исследовательских работ, посвященных белкам в пивоварении, речь идет о всей совокупности этих веществ,
Наиболее широко известная классификация белков, предложенная Осборном [152] в 1895 г. и не утратившая своего значения до настоящего времени, основывается на разделении белков на группы в зависимости от растворимости их в различных растворителях (табл. 13).
Таблица 13 Фракции белка ячменя
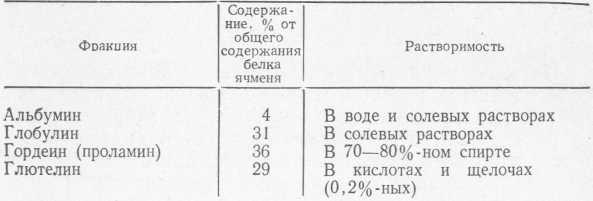
Бишоп [152] объединил две первые группы в одну группу водо- и солерастворимых белков. В последующем было установлено, что гордеины отличаются от альбуминов и глобулинов высоким содержанием глютаминовой кислоты и пролина, а также тем, что тесно соединены в зерне с антоцианогенами, от которых их не удается отделить обычными приемами фракционирования [41].
Глютелины растворяются только в присутствии восстановителей, по своему аминокислотному составу, содержанию глютаминовой кислоты и пролина они приближаются к гордеину.
Шьернинг дифференцировал азотсодержащие вещества ячменя, солода, сусла и пива посредством фракционного осаждения солями металлов. Лундин и Шро- дерхайм фракционировали азот сусла и пива осаждением танином и фосфомолибденовой кислотой [71]. Эти более старые методы фракционирования позволили разделить белки на несколько групп и получить общее представление о количественной стороне превращения исходного белка. Однако исследовать отдельные белки этими методами было невозможно.
Детализация белкового состава ячменя, солода, сусла и пива началась в 40-е годы с появлением таких методов, как ультрацентрифугирование, электрофорез, в последующем — ионообменная хроматография, гельфильтрация, иммуноэлектрофорез, изоэлектрическая фокусировка.
В 1942 г. Квенсел [152], пользуясь методом ультрацентрифугирования, разработанным Сведбергом, разделил глобулины ячменя на 4 группы, различающиеся по молекулярной массе и некоторым другим свойствам (табл. 14).
Таблица 14
Характеристика некоторых фракций белков ячменя

Северборн, Даниэльсон и Сведберг [152] нашли p-фракцию глобулинов только в ячмене и не обнаружили его в пшенице, рисе, овсе и других злаках, а- и у- Фракции, наоборот, были обнаружены во всех злаках. Они установили также, что различные фракции глобулинов локализуются в различных частях семени ячменя: у-фракция — в зародыше, а- и [5-фракции — главным образом в алейроновом слое. Согласно Дьюртоф- ту, a-фракция составляет большую часть (50—80%) солерастворимых белков ячменя. Во время солодора- щения количество [1-фракции не изменяется, а — несколько уменьшается, у —уменьшается сильно,, а 6- фракция в солоде уже не обнаруживается [ПО].
Исследованиями многих ученых установлена многог компонентность каждой из фракций белков ячменя [71]. Так, Эн а ри [113] и Микола, фракционируя альбумины на колонке с ионообменником (ДЕАЕ — целлюлоза), нашли, что альбуминовая фракция состоит по меньшей мере из 16 компонентов. Многокомпонентной оказалась и фракция гордеинов.
Вальдшмидт— Лейтц разделил фракцию гордеинов на 7—8 отдельных компонентов, которые он обозначил как a-компонент (около */з части общего количества гордеина), [3- и у-компоненты (около !/б всего гордеи- на), 6- и е-компоненты, составляющие вместе половину общего количества гордеина. Эти компоненты различались по содержанию глютаминовой кислоты и пролина- а —33,7%, р и у —39,1%, би е —49% [7*1].
Для изучения водо- и солерастворимых белков ячменя были применены различные методы, но наибольшие успехи достигнуты при использовании иммуноэлектрофореза. В этом методе сочетаются два исследовательских принципа: подвижность белка в электрическом поле, зависящая от его заряда, и специфическая реакция между антигеном (изучаемым белком) и антителами, содержащимися в сыворотке крови иммунизированного к этому белку животного. Исследования в этом направлении проводились в Пастеровском институте во Франции (Грабар, Доссан), Финляндии (Эна- ри, Нумми и др.) и других странах [106, 117].
Специальный подкомитет ЕВС по белкам ячменя отмечает, что иммуноэлектрофорез представляет собой простой по выполнению метод, характеризующийся высокой чувствительностью и хорошей воспроизводимостью. Этот подкомитет сделал попытку разработать систему обозначения солерастворимых белков ячменя на основе иммуноэлектрофоретического метода. Для этого в Пастеровском институте вырабатывается стандартная сыворотка от кроликов, иммунизированных к солерастворимым белкам ячменя.
Получаемые на электрофореграммах в агарозном геле дуги преципитации (осадок, образующийся при соединении антигена — белка ячменной вытяжки и антитела сыворотки) обозначаются буквами латинского алфавита, начиная от белка, ближайшего к аноду [23]. Подкомитет по белкам ячменя считает это первым шагом в деле последующего, более глубокого изучения каждого индивидуального белка по таким критериям, как молекулярная масса, растворимость, физиологические свойства, химическая структура, аминокислотный состав и концевые группы.
Пользуясь этим методом, Грабар, Доссан, Нумми И др. [106, 117] установили, что в солевой вытяжке из ячменя имеется свыше 20 различных компонентов. Одни из них обладают свойствами альбуминов, другие — глобулинов.
Между белками ячменя и солода отмечается определенная разница в интенсивности отдельных дуг преципитации, но в основном характер разделения одинаков. Большая часть белков солода в сусле уже не обнаруживается. При кипячении сусла значительная часть растворенных белков выпадает (свертывается) или разрушается, так что в растворе остаются только немногие компоненты.
В готовом пиве можно обнаружить 2—4 иммунологически активных компонента, причем эти компоненты переходят из ячменя, а не образуются в процессе пивоварения. Они обладают высокой устойчивостью против тепловой коагуляции и длительного пребывания во время выдержки при низкой температуре.
С помощью иммуноэлектрофореза установлена идентичность между белками холодной мути и белками пива и сусла: белки мути реагируют с антителами сывороток, полученных иммунизацией кроликов к белкам пива и сусла. Установлено, что все антигены мути, за исключением одного компонента, имеются уже в ячмене. Считают, что он происходит из дрожжей или из солода. Из двух других компонентов один, имеющийся в большем количестве, основной антигенный компонент, по мнению авторов [106], происходит из альбумина ячменя, причем он существует в виде различных по величине молекул—молекулярной массой 15 000— 100 000. По электрофоретической подвижности он отличается от своего предшественника в ячмене: белок мути в процессе хранения пива делается кислее и движется несколько быстрее в сторону анода. Это явление объясняют происходящей при хранении пива ассоциацией между белками и полифенолами, в результате которой блокируются положительные заряды белковой молекулы и изменяется ее электрофоретическая подвижность.
Второй антигенный компонент холодной мути, несколько менее подвижный, чем основной, является, невидимому, продуктом частичного превращения гордеина.
Предложен новый вариант метода иммуноэлектро- фореза, названный методом количественного поперечного иммуноэлектрофореза [132]. В этом методе смесь белков распределяется в одном направлении в геле, затем подвергается иммуноэлектрофорезу в перпендикулярном направлении. С помощью этого метода в солевой вытяжке из ячменя обнаружено 54 иммунохимически различающихся белка, в то время как в систему обозначения белков ячменя ЕВС включено только 24 белка.
Метод иммуноэлектрофореза имеет некоторые недостатки и ограничения. Так, не все белки обладают одинаковой иммунологической активностью. Антигенная активность белка зависит от наличия в его молекуле значительного количества аминокислот с ароматическими радикалами. Кроме того, необходимость получат^ имунную сыворотку усложняет проведение анализа.
Большей разрешающей способностью в выявлении отдельных белков обладает метод изоэлектрической фокусировки. Метод основан на разделении белков по их изоэлектрической точке. Наиболее простым, чувствительным и воспроизводимым вариантом метода является дисковая электрофокусировка в полиакриламидном геле. Этим методом в диапазоне pH 3—6 в пиве было найдено 14 различных белков [230].
Нарцисс и Каттейн [171] с помощью этого метода в диапазоне pH 3—10 проследили изменения белков ог ячменя до готового пива. Установлена сильная много- компонентность каждого из изучаемых объектов (экстракты из ячменя и солода, сусло, пиво): на денситограммах было обнаружено по 20—30 фракций. Отмечены также отчетливые различия между объектами исследования в качественном и количественном составе белков. Белки ячменя, солода и конгрессного (стандартного) сусла фокусировались в более кислой зоне, чем белки пива. Метод позволял отчетливо выявить изменения белков сусла в процессе его кипячения и установить различия в характере белков между разными образцами ячменя. В процессе солодоращения некоторых образцов ячменя состав их белков может становиться более гетерогенным, число обнаруживаемых белков увеличивается и количество белка повышается. По- видимому, здесь находит отражение процесс новообразования многих ферментных систем, происходящий при солодоращении.
Методы электрофореза и изоэлектрической фокусировки позволяют разделить и идентифицировать различные белки, но они ничего не говорят о молекулярной массе разделяемых белков. Этот вопрос решается другими методами и в первую очередь гель-фильтрацией. В этом направлении работал ряд исследователей [81, ПО, 163—165]. Подробное исследование в этом направлении провели Нарцисс и Рёттгер [163—165]. В своей работе они использовали принцип мультико- лоночной гель-фильтрации с применением полиакриламидных гелей (Biogel). Преимущество применения биогелей состоит в том, что они в отличие от сефадексов не адсорбируют полифенолы, ассоциированные с белками. Ниже приводится распределение по молекулярной массе азотистых веществ конгрессного сусла (в пересчете на 12 %-ное сусло) из двух различных солодов.
Пользуясь приведенными данными, фракционный состав азотистых веществ конгрессного сусла можно представить в следующем виде (в мг N/100 мл):

Следовательно, основную массу азотистых веществ конгрессного сусла составляют низкомолекулярные вещества (молекулярная масса менее 2600), т. е. аминокислоты и низшие пептиды. Количество высокомолекулярных веществ (молекулярная масса более 30 000) равна 21,87 — 48,75 мг/100 мл (Nx6,25).
Конгрессное сусло, получаемое из различных Солодов, может весьма существенно различаться по фракционному составу азотистых веществ: в сусле из второго солода в 2 раза больше азотистых веществ с молекулярной массой 4 600—12 000, в 4 раза больше белков с молекулярной массой 30000—60000 и почти в 2 раза больше высокомолекулярных белков (>60 000).
Данные табл. 15 (взяты в сокращенном виде из работ [163—165]) позволяют проследить за изменением фракций азотистых веществ в ходе технологического процесса (в мг/100 мл).
Таблица 15
Изменения фракционного состава азотистых веществ сусла в ходе технологического процесса

Фракционный состав азотистых веществ, приведенный в табл. 15, будет выглядеть следующим образом (табл. 16).
Таблица 16
Изменения в составе азотистых веществ с различной молекулярной массой от сусла до готового пива
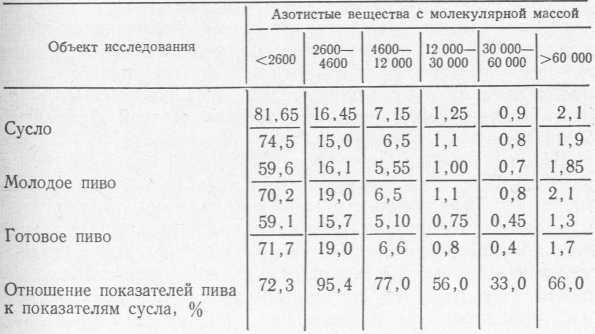
Примечание. В числителе показано содержание азотистых веществ в мг N/100 мл 12%-ного сусла, в знаменателе — в % к общему азоту.
Таким образом, в ходе брожения и дображивания количество азотистых веществ с молекулярной массой ниже 2600 снижается на 28%, с молекулярной массой 2600—4600 изменяется мало, с молекулярной массой 12 000—30 000 и особенно 30 000—60 000 уменьшается существенно, причем последняя фракция изменяется главным образом в ходе дображивания (выдержки), В меньшей степени уменьшается фракция высокомолекулярных белков (>60 000). Авторы объясняют это происходящим при низкой температуре во время выдержки укрупнением белковых молекул среднего размера, что покрывает в какой-то мере уменьшение высокомолекулярной фракции в результате выпадания составляющих ее белков в осадок.
Нарцисс и Рёттгер [164] считают, что для физико- химической стойкости пива основное значение имеет фракция азотистых веществ с молекулярной массой >60 000. Даже незначительное изменение этой фракции сильно влияет на стойкость пива. Содержание высокомолекулярных веществ этой фракции в пиве, по данным этих авторов, очень мало, около 8 мг в 100 мл пива (1,3X6,25).
Наличие в пиве небольшого количества высокомолекулярных азотсодержащих веществ установлено всеми исследователями, занимающимися фракционированием пива, причем величина этих веществ указывается различная. Так, если Нарцисс говорит о веществах с молекулярной массой >60 000, то Вуф и Пирс (2551 находят соединения с молекулярной массой 150000, а Тен Хупен [230]—с молекулярной массой 150 000— 2 000 000.
Наряду с водо- и солерастворимыми белками большой интерес представляют гордеины (проламины) ячменя, которые содержат много глютаминовой кислоты и пролина. Наличие большого количества пролина может обусловливать особенности структуры этого белка: уменьшение числа водородных связей, отсутствие спиралей. Несмотря на нерастворимость в солевых растворах, производные гордеина обнаруживаются в холодной мути, следовательно, они имеются в пиве. По-видимо- му, в процессе затирания, возможно, под влиянием высокой температуры, протеолитических ферментов солода и еще каких-то факторов гордеин изменяет свою растворимость и частично переходит в сусло. Сандегрен нашел, что кипяченое сусло после диализа содержало только высокомолекулярный азотистый компонент, который был назван «альбуминовая фракция», хотя он и не состоял из исходного солодового альбумина. Этот компонент происходил из всех трех фракций солодовых белков, которые расщеплялись в менее высокомолекулярные вещества во время затирания и кипячения сусла.
С увеличением содержания белка в ячмене особенно увеличивается фракция гордеинов. Пиво, полученное из высокобелковистого ячменя, как правило, имеет пониженную коллоидную стойкость, что может быть объяснено участием производных гордеинов в образовании, коллоидного помутнения [134].
При изучении высокомолекулярных азотистых соединений сусла и пива необходимо принимать во внимание происходящую при длительном кипячении сусла термическую денатурацию белков. Под денатурацией белка понимают любую модификацию вторичной, третичной или четвертичной структуры белковых молекул, за исключением разрыва ковалентных связей (29, 41]. В нативном состоянии каждый белок имеет строго определенную, уникальную структуру, после денатурации этот же белок может иметь различные, неспецифические структуры, зависящие от типа и степени денатурирующего воздействия.
Денатурация изменяет почти все свойства белков, иногда очень значительно. Изменяются размеры и форма белковых молекул, электрофоретическая подвижность, вязкость растворов, оптические свойства, характер взаимодействия между молекулами (ассоциация, полимеризация, агрегация), растворимость и др. Обычно денатурированный белок имеет пониженную растворимость. Изменение формы молекул белка при денатурации приводит к тому, что многие функциональные группы становятся более доступными, например увеличивается число доступных тиоловых групп. Заметно увеличивается при денатурации способность к образованию комплексов между белками и различными органическими соединениями, что объясняется демаскированием различных реактивных групп. В результате денатурации изменяется чувствительность белков к ферментам (атакуемость денатурированных белков, как правило, увеличивается), а также может изменяться иммунологическая специфичность белков.
Согласно Жоли [29], изменения, происходящие в белках в процессе старения, можно также считать типичной денатурацией. При этом могут появляться компоненты с измененными молекулярной массой и электрофоретической подвижностью. При старении белков в них снижается количество SH-rpynn.
Из приведенного следует, что о свойствах белков сусла и пива нельзя судить по белкам ячменя или солода, так как термическая денатурация при 2-часовом кипячении сусла существенно изменяет их свойства. Для предотвращения коллоидного помутнения пива особенно важно знание таких последствий денатурации, как изменение растворимости, агрегация молекул, увеличение числа реактивных групп.
Грабар и Нумми [117] показали, что сыворотка с антителами к полипептидам пива очень слабо реагирует с белками ячменя. Это объясняется тем, что азотсодержащие вещества в кипяченом сусле и пиве, которые участвуют в этой реакции, являются не истинными белками, а продуктами распада исходных белков ячменя.
Таким образом, несмотря на то, что по молекулярной массе комплексные азотсодержащие вещества сусла и пива приближаются к истинным белкам, однако по ряду причин эти вещества не могут считаться настоящими белками и поэтому неправильно применять к ним термин «белки» [92]. Белки сусла и пива представляют собой денатурированные белки, которые правильнее называть высокомолекулярными полипептидами. Хотя это название мало говорит о молекулярной массе веществ, оно все чаще используется в литературе по пивоварению вместо термина «белки».

