В предыдущей главе мы узнали, что в клетке имеется множество химических соединений. Как они синтезируются и взаимодействуют друг с другом с достаточно высокими скоростями при относительно низких температурах и давлениях? Как клетка делает свой выбор, какие именно вещества следует в данный момент ввести в реакцию, а какие молекулы подвергнуть деградации? Ответ на оба этих вопроса один – все реакции в клетке осуществляются и регулируются путем ферментативного катализа; ферменты же, как мы уже знаем, представляют собой глобулярные белки.
Поворотным пунктом в развитии энзимологии был 1897 г., когда Бухнер впервые выделил активные ферменты из живых клеток. Эта работа имела большое значение с двух точек зрения. Во-первых, было показано, что работающие в живом организме катализаторы могут функционировать совершенно независимо от любого другого клеточного процесса; как мы увидим в следующей главе, изолированные ферменты в настоящее время находят самбе широкое применение. Во-вторых, открытие Бухнера стимулировало работы по выделению и очистке индивидуальных ферментов. В чистом виде один из ферментов впервые был выделен Самнером в 1926 г. Его изучение показало, что он является белком; сейчас известно, что все ферменты представляют собой белки.
После основополагающих работ Самнера число известных ферментов постоянно возрастало и в настоящее время уже намного превысило 1500. Судя по количеству генетической информации, заложенной даже в таких простых организмах, как Е. coli, можно уверенно предсказать, что в будущем будет идентифицировано и охарактеризовано множество новых ферментов. Действительно, единственная молекула ДНК, составляющая хромосому Е. coli, несет в себе информацию, достаточную для кодирования структур от 3000 до 4500 различных белков.
Поскольку в этой главе и позднее мы будем упоминать ряд конкретных ферментов, здесь уместно сказать несколько слов об их номенклатуре. К сожалению, не существует общих правил номенклатуры, применимых ко всем ферментам. В подавляющем большинстве случаев в названии фермента отражается его функция, а не строение-, обычно к названию субстрата добавляют суффикс -аза (например, уреазой называют фермент, катализирующий разложение мочевины). Иногда тот же суффикс добавляется к названию реакции, которую катализирует данный фермент (алкогольдегидрогеназа, например, катализирует окислительное дегидрирование спирта). Исключения из этого правила представляют исторически сложившиеся названия ферментов (как правило, давно известных); сюда относятся пепсин и трипсин из пищеварительного тракта человека, используемый в сыроделии реннин и «старый желтый» фермент, вызывающий появление коричневой окраски на срезах яблок.
Ферменты катализируют реакции шести основных типов, которые лежат в основе системы, рекомендованной Комиссией по ферментам (КФ), классификации и условного цифрового обозначения всех ферментов (табл. 3.1). Эта «официальная» система позволяет выразить в табличной форме и классифицировать выполняемые ферментами разнообразные функции, хотя наряду с ней до сих пор широко используется и прежняя более традиционная номенклатура ферментов.
Таблица 3.1. Классификация ферментов в соответствии с рекомендациями Международной комиссии по ферментам
(указаны название класса ферментов, кодовые номера Комиссии по ферментам, тип катализируемых реакций)а

Во избежание недоразумений давайте вспомним, что такое катализатор вообще. Катализатором называют вещество, которое повышает скорость химической реакции, не претерпевая при этом необратимых химических Изменений. Повышая скорость химической реакции, катализатор в то же время не нарушает равновесия реакции (рис. 3.1). Равновесные концентрации можно вычислить на основе одних лишь термодинамических свойств субстратов (напомним, что субстратом в биохимии называют вещество, вступающее в катализируемую ферментом реакцию) и продуктов реакции. Кинетика реакции, однако, зависит от молекулярной динамики, и в настоящее время ее невозможно достаточно точно предсказать, не располагая экспериментальными данными.
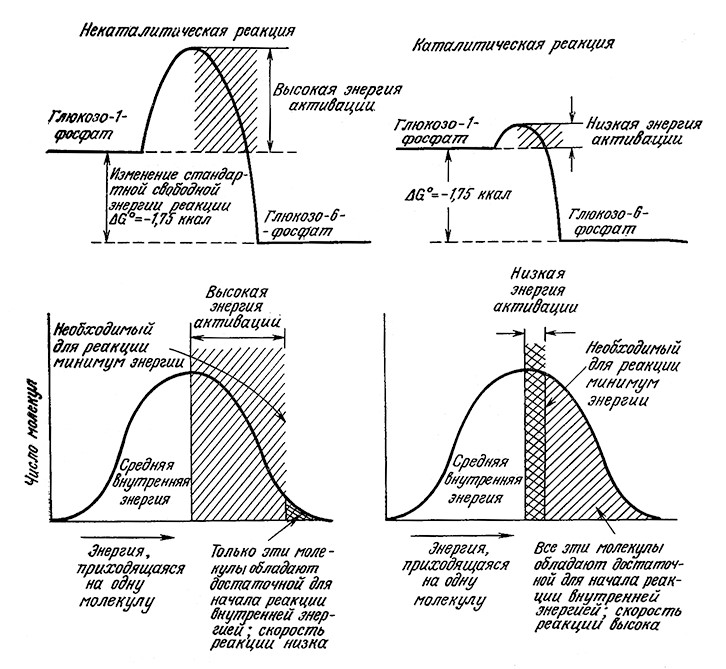
РИС. 3.1. Катализатор снижает энергию активации реакции и тем самым обеспечивает
возможность реакции фермента с молекулами субстрата, обладающими малой внутренней энергией.
Для изучения какой-либо реакции и разработки соответствующего технологического процесса необходимо располагать математическим выражением, определяющим скорость реакции (т. е. число молей вещества, реагирующего в единицу, времени в единице объема) в зависимости от состава, температуры, давления и других параметров реакционной смеси. Если вы ранее изучали каталитические реакции, то вам должны быть известны общие принципы вывода выражений, характеризующих скорость реакций. Обычно прежде всего высказываются достаточно обоснованные соображения относительно элементарных реакций, происходящих на молекулярном уровне. Затем с привлечением некоторых приближений, затрагивающих динамику одного или нескольких реакционноепособных промежуточных соединений, и с использованием ряда простых математических преобразований находят выражение для скорости суммарной реакции. В настоящей главе мы воспользуемся точно таким же подходом для оценки скоростей катализируемых ферментами реакций.
Аналогия между синтетическими катализаторами и ферментами не заканчивается на принципах моделирования кинетики реакций. Математические выражения, определяющие скорости реакций, катализируемых этими двумя типами катализаторов, очень близки, а иногда даже идентичны. Это объясняется тем, что в обоих случаях, как известно, в качестве промежуточного соединения образуется тот или иной комплекс реагирующего вещества (субстрата) с катализатором; общий механизм каталитических процессов, естественно, приводит к одинаковым выражениям для их скоростей. Позднее мы еще раз вкратце остановимся на этом вопросе.
В то же время важно не забывать и о существенных различиях между синтетическими катализаторами и ферментами; о некоторых из таких различий мы уже упоминали. Подавляющее большинство синтетических катализаторов неспецифично в том смысле, что они могут катализировать аналогичные реакции с участием самых разнообразных реагентов. Некоторые ферменты также не отличаются высокой специфичностью, но многие катализируют только одно превращение крайне ограниченного числа субстратов. Обычно степень специфичности фермента соответствует его биологической функции. Высокая специфичность нежелательна, например, для фермента, основная задача которого заключается в гидролизе белков до небольших пептидов и аминокислот. Напротив, фермент, катализирующий изомеризацию одного конкретного соединения, должен быть в высшей степени специфичным. Как уже упоминалось выше в разд. 2.2.4, считается, что специфичность фермента обусловлена его сложной объемной структурой, позволяющей сформировать ответственный за каталитические свойства фермента активный центр.
Другой отличительной чертой многих ферментов является наличие кофакторов, необходимых для проявления ферментативной активности. Кофактором называют соединение небелковой природы, которое связывается с неактивным белком (апоферментом) с образованием каталитически активного комплекса. Последний биохимики часто называют голоферментом, мы же чаще будем называть его просто ферментом. Существует два различных типа кофакторов. Простейшими кофакторами являются ионы металлов (табл. 3.2). Роль кофакторов могут выполнять и сложные органические соединения, называемые коферментами. В предыдущей главе мы уже упоминали коферменты NAD, FAD и кофермент А(СоА); иногда кофактором может быть и АТР. Часто кофакторы связываются с ферментами довольно слабыми связями; в таких случаях существует равновесие между ферментом, апоферментом и кофактором. Вообще говоря, и прочно связанные с ферментом небелковые элементы структуры также являются коферментами, как, например, гем в цитохроме с. Однако, как мы уже упоминали, чаще такие необратимо связанные группы называют простетичес- кими.
Приведенные в табл. 3.2 данные интересны и с той точки зрения, что здесь содержатся сведения, к которым мы будем неоднократно возвращаться при изучении процессов выделения и применения ферментов. Обратите внимание на то, что рядом с названиями некоторых ферментов указаны источники их выделения; например, глюкозоизомераза из бактерии Bacillus coagulans проявляет максимальную активность в присутствии кобальтового кофактора. Для того чтобы точно определить, о каком ферменте идет речь, во многих случаях необходимо указывать и его происхождение. Дело в том, что другие организмы также синтезируют ферменты, катализирующие изомеризацию глюкозы во фруктозу, и поэтому их тоже называют глюкозоизомеразами. В то же время ферменты с одинаковыми названиями, но выделенные из разных организмов, часто имеют различные аминокислотные последовательности и по этой причине различаются по свойствам и каталитической активности. Например, для глюкозоизомеразы из В. coagulans необходим ион Со2+, а глюкозоизомераза из мутантного штамма того же организма при рН>8 активна и в отсутствие кобальта. Надо иметь всегда в виду, что одно лишь название фермента ничего не говорит о природе какого-либо конкретного белка с определенными свойствами и соответствующими технологическими требованиями. Чтобы устранить возможность двусмысленного толкования, нужно указать полное название продуцирующего этот фермент организма.
Таблица 3.2. Некоторые ферменты, содержащие в качестве кофакторов ионы металлов
или проявляющие активность только в присутствии ионов металлов

Как синтетические, так и биологические катализаторы в ходе выполнения своей каталитической функции постепенно утрачивают активность, однако ферменты в общем случае гораздо более недолговечны. Сложная и запутанная пространственная структура ферментов, обусловливающая их необычно высокие специфичность и активность, легко нарушается, что приводит к потере ферментом его каталитических свойств. Различные пути инактивации ферментов и кинетика этих процессов будут рассмотрены в разд. 3.7.
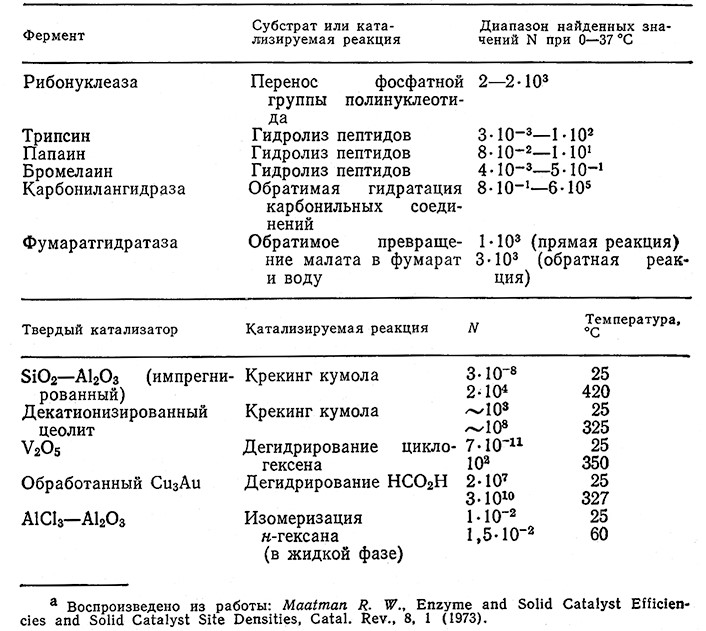
Часто утверждают, что ферменты более активны в том смысле, что они повышают скорость реакций в большей степени, чем небиологические катализаторы. Степень активности катализатора обычно выражают числом оборотов, которое представляет собой число молекул субстрата, реагирующих с активным центром катализатора в единицу времени. Для сравнения- в табл. 3.3 приведены параметры ряда реакций, катализируемых ферментами и синтетическими катализаторами. Оказывается, что в диапазоне температур, в котором ферменты наиболее активны, они действительно повышают скорость реакций в» большей степени, чем большинство синтетических катализаторов. При более высоких температурах, однако, активность искусственных катализаторов обычно превосходит активность, ферментов. К сожалению, ферментативная активность не может бесконечно возрастать при повышении температуры; напротив, ферменты обычно теряют свою активность уже пр» сравнительно низких температурах, часто лишь на несколько градусов, превышающих температуру живой клетки.
Таблица 3.3. Сравнительная активность ферментов и синтетических твёрдых катализаторов
(N – число молекул субстрата, превращаемых одним активным центром катализатора в 1 с)а
Характерной особенностью ферментативного катализа является возможность его регуляции с помощью соединений небольшой молекулярной массы. Некоторые ферменты «выключаются» в присутствии определенных веществ; последними часто- оказываются конечные продукты последовательности реакций, в которой участвует регулируемый фермент. Эта особенность ферментов играет большую роль в нормальном жизненном цикле клетки. Некоторые аспекты кинетики ферментативных реакций такого типа мы изучим в разд. 3.5, а в гл. 6 мы узнаем, как посредством изменения нормальных каналов регуляции внутриклеточных реакций можно резко повысить эффективность промышленных биологических процессов.
Прежде чем приступить к моделированию кинетики ферментативного катализа, мы рассмотрим имеющиеся экспериментальные данные о характере молекулярных превращений, которые действительно происходят в процессе катализируемых, ферментами реакций. На этой основе мы сможем высказать- обоснованные гипотезы о последовательности элементарных, реакций и затем применить эти гипотезы для вывода математических выражений, характеризующих скорость реакций.

