Изменять, или модулировать, каталитическую активность ферментов могут не только субстраты, но и другие взаимодействующие с ферментами вещества; их называют модуляторами, или эффекторами. Эффекторы могут быть обычными компонентами клетки, но- могут и проникать в клетку, из среды или действовать на изолированные ферменты. Основное внимание в этом разделе будет уделено ингибиторам веществам, понижающим ферментативную активность. Следует, однако, иметь в виду, что известны и случаи активации ферментов субстратами.
Взаимодействие фермента с эффектором представляет собой химическую реакцию и поэтому может быть полностью обратимым, частично обратимым или практически необратимым. К числу известных необратимых ингибиторов принадлежат яды, например, цианидный ион, инактивирующий ксантинокси- дазу, а также группа соединений, называемых нерв но паралитическими ядамщ последние необратимо инактивируют холин- эстеразы (ферменты, участвующие в системах передачи нервных импульсов и, таким образом, в моторной активности). Если процесс ингибирования необратим, то кинетика ингибиторзависимых ферментативных реакций не подчиняется уравнению Михаэлиса – Ментен, основой которого является наличие равновесия между свободной и связанной формами фермента. Часто по мере полной инактивации все большего и большего числа молекул фермента процесс необратимого ингибирования прогрессирует во времени. В других случаях, труднее поддающихся выявлению, фермент инактивируетсялишь частично и сохраняет каталитическую активность, хотя и в меньшей степени по сравнению с чистым ферментом.
В разд. 2.6 мы уже говорили о замечательной способности большинства микроорганизмов продуцировать множество разнообразных сложных соединений из относительно небольшого числа простых предшественников. Для достижения этой цели необходима некая система очень эффективного распределения поступающих предшественников по многим биосинтетическим путям, ведущим к различным конечным продуктам метаболизма. В большинстве случаев принцип оптимального усвоения доступного исходного продукта требует синтеза любого из конечных продуктов только в строго необходимом количестве. Если, например, в клетке имеется достаточное количество данного» мономера, то его дальнейшее накопление должно быть прервано, с тем чтобы ресурсы клетки могли быть направлены на синтез других соединений, количество которых в этот момент относительно мало.
Одним из регуляторных механизмов, используемых клеткой для достижения максимально эффективного усвоения питательных веществ, является обратимая регуляция ферментативной активности. (Другой важный механизм управления будет рассмотрен в гл. 6, разд. 1.) Наиболее интересные примеры регуляции ферментативной активности включают в себя сложную сеть реакций с несколькими регуляторными петлями; эти примеры мы рассмотрим позднее, после того как. изучим основы химии клетки (гл. 5). Сейчас же нам будет достаточно примера регуляции простой последовательности реакций. На рис. 3.19 изображена пятистадийная последовательность биосинтеза аминокислоты L-изолейцина. Регуляция этой последовательности реакций осуществляется путем ингибирования по принципу обратной связи, когда конечный продукт, ь-изолейцин, ингибирует активность фермента, катализирующего первую стадию последовательности. Таким образом, биосинтез конечного продукта последовательности реакций будет тормозиться по мере его накопления.
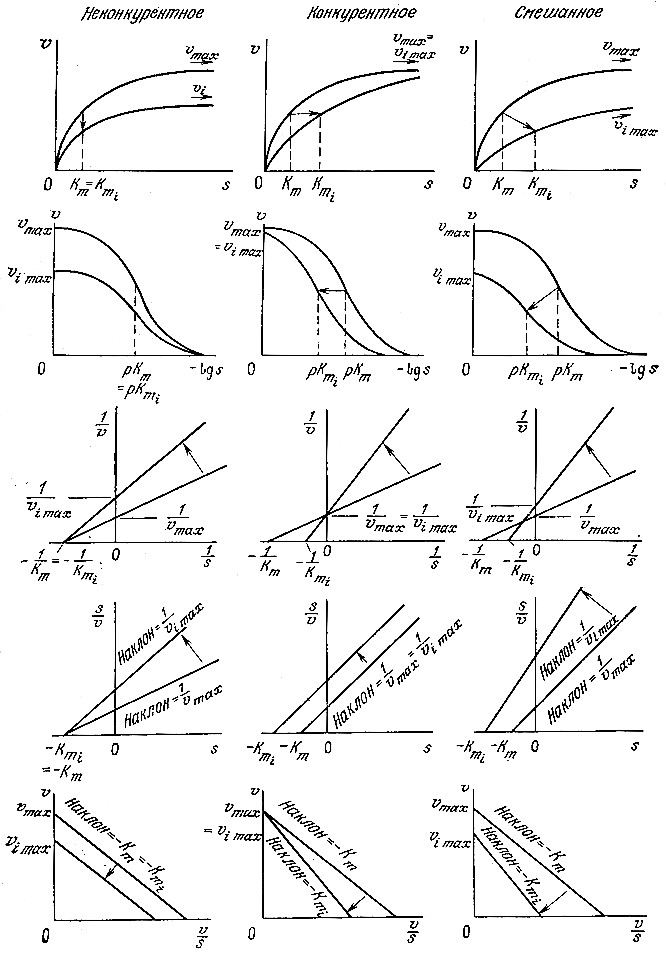
РИС. 3.19. Последовательность реакций биосинтеза L-изолейцина, ингибируемая по принципу обратной связи;
здесь активность фермента E1 (L-треонин-дезаминазы) снижается в присутствии конечного продукта последовательности –
L-изолейцина. (Р1= α-кетобутират; Р2= α-ацетогидроксибутират; Р3– = α, β-дигидрокси- β-метнлвалерат; Р4=с.-кето-β-метилвалерат.)
Таблица 3.7. Некоторые типы обратимого ингибирования

Поскольку катализируемые ферментами Е2–Е5 реакции находятся в состоянии равновесия, а первая реакция в клеточной среде «необратима», то быстродействие такой регуляторной системы очень высоко. По сути дела, большинство регуляторных ферментов катализирует именно такие «необратимые» реакции. С точки зрения биологии клетки очевидно, что такая «природная» регуляция ферментативной активности должна быть обратимой. Если, например, весь L-изолейцин был израсходован в процессе белкового синтеза, то ингибирование фермента E1 должно прекратиться и система вновь должна синтезировать необходимое количество этой аминокислоты.
В случае обратимого ингибирования изложенные в разд. 3.2 подходы к анализу кинетики оказались очень плодотворными. Поскольку многие изолированные фермент-субстратные системы подчиняются кинетике Михаэлиса – Ментен, принято классифицировать ингибиторы по их влиянию на параметры уравнения Михаэлиса – Ментен Vmax и Km.
Обратимые ингибиторы называют конкурентными, если в их присутствии повышается значение Km, а Vmax не изменяется. Вызываемый ингибиторами такого типа эффект можно частично или полностью подавить путем повышения концентрации субстрата. Неконкурентные ингибиторы, напротив, инактивируют фермент или фермент-субстратный комплекс путем уменьшения у max фермента, но не влияют на величину Km. В этом случае повышение концентрации субстрата до сколь угодно высокого уровня уже не позволит повысить скорость реакции до величины, характерной для негангибированного фермента. Типичными примерами неконкурентных ингибиторов являются ионы тяжелых металлов, обратимо реагирующие с сульфгидрильными (–SH) группами цистеиновых остатков.
Известны несколько сочетаний и вариантов этих двух основных типов обратимых ингибиторов; некоторые из них приведены в табл. 3.7. Чуть позже мы рассмотрим экспериментальные методы определения типа ингибирования, но прежде вкратце обсудим некоторые теории, объясняющие механизмы действия регуляторов ферментативной активности, и соответствующие экспериментальные данные.
3.5.1. Механизмы обратимой регуляции ферментативной активности
Многие из известных конкурентных ингибиторов по своей химической природе близки обычным субстратам, такие ингибиторы называют субстратными аналогами. Полагают, что подобные ингибиторы имеют пространственную структуру типа ключа, который может входить в «замочную еиважину» активного центра фермента, однако «ключ» не вполне подходит к данному «замку» и реакция не идет. Рассмотрим, например, ингибирование процесса дегидрирования янтарной кислоты малоновой кислотой:
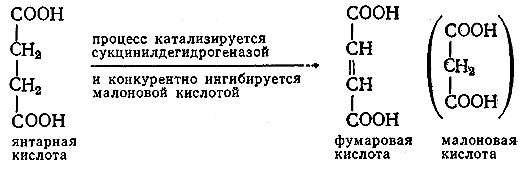
В данном случае малоновая кислота может образовывать комплекс с сукцинилдегидрогеназой, но на этом процесс останавливается.
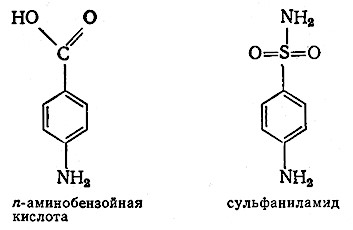
Конкурентное ннгибированне лежит в основе механизма действия одного из лекарственных сульфамидных препаратов – сульфаниламида (стрептоцида). Структура последнего очень близка структуре л-аминобензойной кислоты – важного витамину многих бактерий. Сульфаниламид ингибирует фермент, участвующий в превращении n-аминобензойной кислоты в фолиевую кислоту, тем самым блокируя биохимический аппарат бактерии, что приводит к ее гибели.
При другом механизме, называемом аллостерической регуляцией, поведение фермент-субстратной системы типично для неконкурентного ингибирования. Считается, что механизм аллостерической регуляции вообще играет доминирующую роль в неконкурентном ингибировании и активации. Название аллостерический (имеющий другую форму) было дано этому механизму сначала на том основании, что по своему строению многие эффекторы ферментативной активности существенно отличаются от субстратов. Отсюда был сделан вывод, что регуЛяторное действие таких эффекторов основано на их связывании со специфическим регуляторным центром фермента, отличным от активного центра, в котором осуществляется катализ превращений субстрата. Соответственно ферменты, обладающие центрами регуляции и катализа, были названы аллостерическими ферментами.
Аллостерическая регуляция может как ингибировать (снижать), так и активировать (повышать) каталитическую способность фермента. Процесс аллостерической регуляции схематически изображен на рис. 3.20. Обратите внимание на то, что фермент здесь изображен в виде двух субъединиц; известно, что многие аллостерические ферменты и на самом деле являются олигомерными белками.
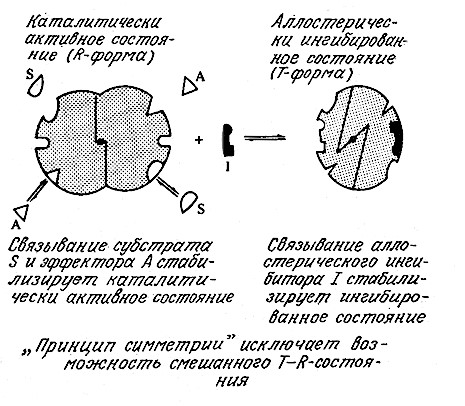
РИС. 3.20. В симметричной модели аллостерической регуляции ферментативной активности
связывание активатора А и субстрата S приводит к каталитически активной R-форме фермента,
а связывание ингибитора изменяет конформацию всех субъединиц в олигомерном белке
таким образом, что молекула белка принимает неактивную Т-форму.
Наиболее убедительным доказательством справедливости аллостерической теории ферментативной активности явилось экспериментальное изучение аспартилтранскарбамоилазы (АТС-азы). После разделения фермента на две субъединицы выяснилось, что на обладающую каталитической активностью большую субъединицу ингибитор интактного фермента СТР (цитидинтрифосфат) не влияет. Напротив, меньшая субъединица каталитически не активна, но связывает СТР.
В отсутствие экспериментальных доказательств типа приведенных выше для ATG-азы нельзя быть уверенным в том, что эффектор не связывается активным центром фермента. С кинетической точки зрения, однако, представляет интерес только влияние эффектора на ряд параметров, в том числе на сродство субстрата к ферменту, концентрацию несвязанного фермента и (или) скорость распад комплекса. В следующем разделе мы попытаемся найти математические выражения, характеризующие эти эффекты количественно.
3.5.2. Анализ влияния обратимой регуляции
на кинетику ферментативных реакций
Основная ценность подхода Михаэлиса и Мёнтен к анализу кинетики ферментативных реакций заключается в том, что он позволяет количественно описать влияние эффекторов. Прежде всего допустим, что приведенная ниже последовательность реакций достаточно точно отражает механизм взаимодействия ингибитора и субстрата с ферментом при (полном) конкурентном ингибировании. Здесь, как обычно, Е и S обозначают фермент и субстрат соответственно, а символами I и EI обозначены ингибитор и фермент-ингибиторный комплекс соответственно.
Равновесные стадии реакции:
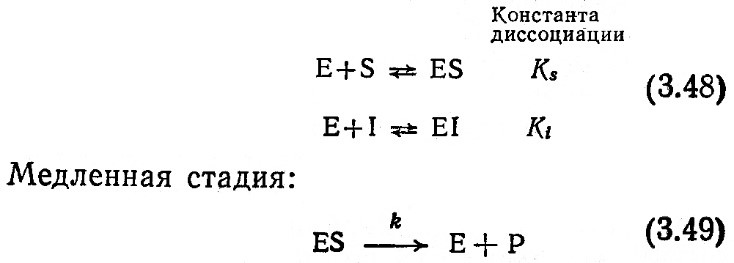
В этом случае фермент может связывать или только субстрат, или только ингибитор. Поскольку часть фермента связана в комплексе EI, не весь фермент участвует в каталитическом превращении субстрата; следовательно, скорость реакции в присутствии ингибитора замедляется.
На базе равновесных реакций (3.48) и уравнения общего материального баланса фермента
![]()
скорость реакции можно выразить через общую концентрацию фермента е0 и концентрации свободного субстрата и ингибитора (s и i соответственно):
![]()
Сравнение с исходной формой уравнения Михаэлиса – Ментен показывает, что параметр Vmах остался без изменений, а кажущаяся константа Михаэлиса Ктарр в присутствий конкурентного ингибитора возрастает:
![]()
Другими словами, обусловленное конкурентным ингибитором снижение скорости реакции может быть полностью компенсировано путем соответствующего повышения концентрации субстрата; на максимально возможную скорость реакции конкурентный ингибитор не влияет.
Если последовательные реакции (3.48) и (3.49) дополнить равновесными реакциями (3.53а) и (3.536), то можно получитьполезную модель (полного) неконкурентного ингибирования:
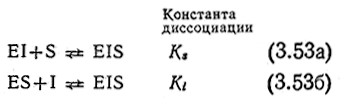
Здесь ингибитор и субстрат могут одновременно связываться с ферментом, образуя тройной комплекс EIS (фермент-ингиби- тор-субстратный). В этой простейшей модели неконкурентного ингибирования мы принимаем, что связывание ингибитора не влияет на сродство фермента к субстрату, а связывание субстрата не сказывается на сродстве фермента к ингибитору. Отсюда следует, что Ks и Ki в уравнениях (3.53) идентичны соответствующим константам диссоциации в уравнении (3.48). Примем также, что комплекс EIS не диссоциирует с образованием продукта реакции Р.
Используя уже известный нам прием выражения концентраций комплексов через e0, s и i, можно получить следующее выражение для скорости реакции:
![]()
Нетрудно заметить, что в этом выражении константа Михаэлиса осталась без изменений, а максимальная скорость реакции снизилась до
![]()
Отсюда следует, что в присутствии неконкурентного ингибитора добавление к реакционной смеси сколь угодно большого количества субстрата не позволит повысить максимальную скорость реакции до той величины, которая может быть достигнута в отсутствие ингибитора.
Конкурентное и неконкурентное ингибирование легко различить по графикам зависимостей кинетических параметров в координатах Лайнуивера – Бэрка. В случае конкурентного ингибирования добавление ингибитора приводит к увеличению отрезка, отсекаемого прямой на оси 1/s, и не влияет на отрезок, отсекаемый на оси 1/V. Напротив, при неконкурентном ингибировании возрастает только отрезок, отсекаемый на оси 1/V. Рассмотрим в качестве примера приведенные на рис. 3.21 данные по гидролизу крахмала. Сравнивая графики зависимостей 1/V от 1/s в присутствии различных ингибиторов, а также без ингибитора, нетрудно видеть, что α-декстрин является конкурентным ингибитором, а мальтоза и предельный декстрин представляют собой неконкурентные ингибиторы.
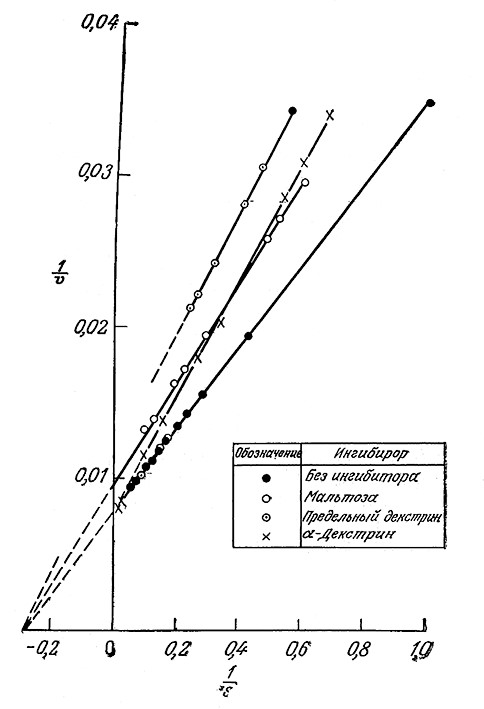
РИС. 3.21. Конкурентное (а-декстрин) и неконкурентное
(мальтоза, предельный декстрин) ингибирование α-амилазы.
Как мы указывали в табл. 3.7, существуют и другие типы ингибирования ферментативных реакций. Ниже мы в нескольких словах обсудим, как можно их описать путем видоизменения рассмотренных выше моделей ингибирования. При частич-: ном конкурентном ингибировании (тип 16 в табл. 3.7) ингибитор и субстрат соединяются с различными участками молекулы фермента и ингибитор влияет на сродство фермента к субстрату. Чтобы описать этот случай, добавим к последовательности реакций (3.48) и (3.49) следующие стадии, _ которые мы будем считать равновесными:

Обратите внимание: можно показать, что Kis=KsKsi/Ki.)
В другом случае неконкурентного ингибирования (типа 116) описанная выше модель видоизменяется с учетом возможности образования продукта реакции из комплекса EIS; диссоциация последнего по сравнению с комплексом ES протекает с меньшей скоростью:
![]()
Одну из моделей смешанного ингибирования, включающего в себя полный конкурентный и частично конкурентный типы, можно получить, опустив реакцию (3.57) в приведенной выше модели частичного конкурентного ингибирования. Результаты анализа всех этих типов ингибирования можно записать в форме уравнения Михаэлиса–Ментен:
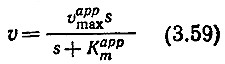
В этом уравнении кажущиеся параметры vmaxapp и Ктарр зависят от концентрации ингибитора и различных кинетических параметров (табл. 3.8). На рис. 3.22 схематически показано влияние разных типов ингибирования на различные формы графического выражения данных по изучению кинетики ферментативных реакций.
Таблица 3.8. Параметры кинетики ферментативных реакций в присутствии ингибиторов различных типов; отрезки,
отсекаемые прямыми на осях 1/ V и 1/s
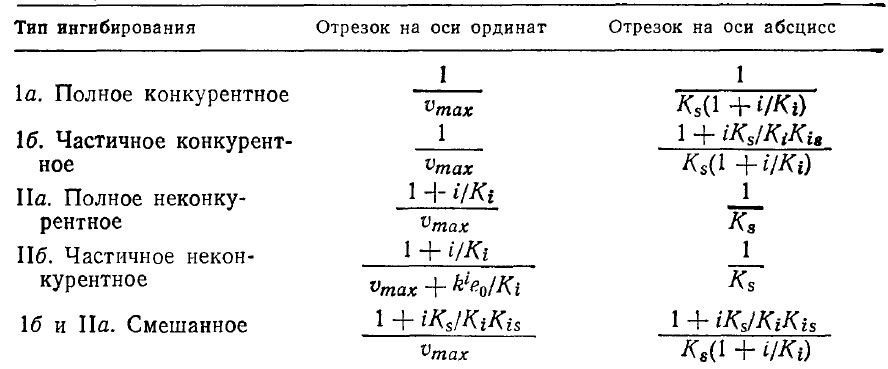

РИС 3.22. Влияние типа ингибирования на различные формы графического выражения
кинетики ферментативных реакций. Индексом i обозначены параметры реакции в присутствии ингибитора
Один из типов активации фермента эффектором может быть описан моделью типа IIб при условии, что kl больше k. С точки зрения механизма процесса это означает, что скорость образования продукта реакции из комплекса EIS выше, чем из комплекса ES. Таким образом, здесь вещество I выполняет функцию активатора фермента.

