Прежде чем приступить к изложению темы этого раздела, полезно напомнить, что основная цель настоящей главы заключается в описании скорости катализируемых ферментами реакций с помощью математических выражений. Без последних мы не сможем разработать проект реактора или спланировать эксперимент с участием изолированных ферментов. Более того, когда мы приступим к изучению кинетики клеточного роста, мы узнаем, что и здесь приложимы различные аспекты кинетики ферментативного катализа. В этой связи становится очевидной важность тщательного изучения различных факторов, влияющих на ферментативный катализ, в том числе количественной оценки степени их влияния.
Мы уже знаем, что различные химические соединения, связываясь с ферментами, могут изменять скорость катализируемых ферментами реакций, и в общих чертах представляем, как это происходит. На каталитическую активность ферментов влияют и многие другие факторы, которые могут изменять строение или химическую природу фермента. К числу таких факторов относятся:
1. рН
2. Температура
3. Силы, действующие в текучих средах (гидродинамические силы, гидростатическое давление и поверхностное натяжение)
4. Химические агенты (например, спирт, мочевина или пероксид водорода)
5. Облучение (свет, звук, ионизирующая радиация)
Иногда снижение каталитической активности, вызванное, например, изменением рН, обратимо; в таких случаях возврат к первоначальным условиям сопровождается восстановлением активности фермента. В известном смысле такая ситуация аналогична рассмотренному случаю обратимого ингибирования; небольшие изменения одного из перечисленных выше факторов, по сути дела, только слегка сдвигают равновесие (или квазистационарное состояние), характерное для данной ферментативной реакции. В общем случае отклонение от условий, типичных для биологического окружения нативного фермента, должно быть относительно небольшим (или кратковременным); в противном случае возрастает вероятность инактивации фермента. Многие из перечисленных выше факторов мы обсудим в следующем разделе, посвященном инактивации ферментов, здесь же основное внимание будет уделено «обратимому» влиянию рН и температуры на каталитическую активность ферментов.
Следует подчеркнуть, что граница между «обратимой» и «необратимой» инактивацией белков не всегда четко определена. Например, подвергнутый кратковременному нагреванию фермент при охлаждении до свойственной ему «рабочей» температуры может полностью восстановить свою активность. С другой стороны, более продолжительное нагревание при той же температуре или столь же, кратковременная термическая обработка при более высокой температуре могут привести к тому, что при последующем охлаждении активность фермента восстановится лишь частично. Такое поведение белков вообще я ферментов в частности становится; понятным, если учесть связь между их строением и функцией, влияние молекулярной динамики на функцию белков и возможность разрыва некоторых слабых связей при изменении условий среды.
3.6.1. Влияние рН на кинетику ферментативных реакций в растворах
На рис. 2.15 приведены структурные формулы различных аминокислот, из которых построены все белки. Аминокислоты обладают основными, нейтральными и кислотными группировками, поэтому интактный фермент при любом заданном рН может содержать как положительно, так и отрицательно заряженные группы. Заряжённые группировки часто входят в состав активных центров ферментов, так как в основе целого ряда механизмов ферментативного катализа лежит катализ кислотного или основного типа. Необходимым условием для Осуществления кислотного или основного катализа может быть лаличие определенного заряда на ионизируемых группах активного центра. Отсюда следует, что каталитически активна» форма фермента существует только в одном строго определенном состоянии ионизации и в зависимости от рН в нее может превращаться большая или меньшая часть всего имеющегося смеси фермента. На рис. 3.23 показано влияние рН на активность некоторых ферментов; нетрудно видеть, что по мере повышения рН каталитическая активность фермента достигает максимума (при оптимальном рН) и затем снижается.
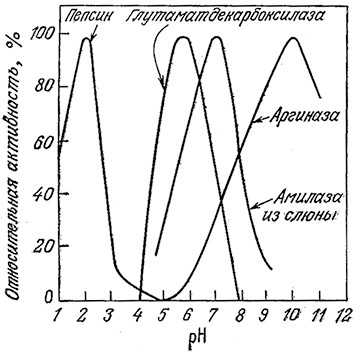
РИС. 3.23. Зависимости активности ферментов от рН и диапазона
максимальной активности фермента от его природы.
Полезное математическое выражение, связывающее активность фермента с рН, можно получить с помощью следующей простой модели ионизации активного центра:
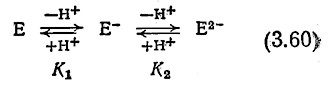
В этих кислотно-основных, реакциях Е– обозначает активную форму фермента, а Е и Е2– – неактивные формы, образующиеся соответственно при протонировании и депротонировании активного центра Е–. Константы равновесия указанных реакций обозначены символами K1 и К2. Мы не будем здесь рассматривать другие состояния ионизации фермента, поскольку предполагается, что депротонирование Е– уже полностью инактивирует фермент.
Записав условия равновесия для двух ступеней ионизации в виде
![]()
где h+– [Н+], мы можем определить относительное количество фермента, находящегося в активной форме. Если обозначить общую концентрацию фермента через е0, так что
е0=е+е–+е2– (3.62)
то активная фракция фермента у– равна е–/е0 и определяется уравнением
![]()
Уравнение (3.63) представляет собой одну из рН-функций Михаэлиса. Две другие, у и у2–, определяют относительные количества фермента, находящегося в кислой и основной формах соответственно.
Зависимость функции у– от рН выражается кривой такого же типа, какие приведены на рис. 3.23 для экспериментально найденных зависимостей ферментативной активности от рН. Функция у– имеет один максимум при следующем рН:
![]()
где рKi, = –lgKi. Функция у– убывает равномерно и симметрично по мере удаления рН от оптимального значения.
Реакции протовирования и депротонирования представляют собой очень быстрые процессы по сравнению со скоростями большинства других реакций в растворах. Поэтому можно принять, что фракция фермента, находящегося в активном состоянии, равна у– и в том случае, когда этот фермент выполняет функцию катализатора. Отсюда следует, что выражение для максимальной скорости реакции можно получить, взяв вместо общей концентрации фермента во общую концентрацию его активной формы e0у–:
![]()
Располагая данными по ферментативной активности при различных рН, с помощью последнего уравнения можно определить параметры К1 и K2. Действительно, рН максимальной активности фермента связан с K1 и К2 уравнением (3.64). Определяемая экспериментальным путем зависимость ферментативной активности от рН устанавливает независимую взаимосвязь между К1 и К2, позволяя таким образом определить оба эти параметра.
Согласно расширенному толкованию уравнения Михаэлиса – Ментен для случая простейшей. катализируемой ферментом последовательности реакций [уравнение (3.4)], рН может влиять и на константу Михаэлиса, Km. В то же время если субстрат не может существовать в нескольких ионизированных состояниях, характеризующихся различным сродством к ферменту и если образование фермент-субстратных комплексов с каждой из форм фермента не влияет на К1 и K2, то в таком случае можно показать, что Km не зависит от рН. Экспериментальные данные показывают, что, как правило, Km очень слабо зависит от рН, поэтому на практике для выражения зависимости скоростей катализируемых ферментами реакций от рН чаще всего пользуются только уравнением (3.65).
Никогда не следует забывать, что все приведенные выше рассуждения могут оказаться несостоятельными, если речь идет о значениях рН, значительно отличающихся от оптимальных. В такой ситуации нарушение сил, стабилизирующих конформацию нативного белка, может привести к его денатурации, и тогда даже после восстановления оптимального (или близкого к оптимальному) рН быстрая реактивация фермента становится маловероятной или вообще невозможной.
3.6.2. Скорость ферментативных реакций и температура
При изучении любых проблем химической кинетики одним из основных теоретических положений является уравнение Аррениуса, выражающее зависимость константы скорости реакции от температуры:
![]()
где Еа – энергия активации реакции; R – газовая постоянная; А – предэкспоненциальный множитель; Т – абсолютная температура.
При графическом изображении зависимость lnk от 1/Т выражается прямой с тангенсом угла наклона – Ea/R [конечно, если соблюдается условие уравнения -(3.66)]. Аррениусовскон зависимости константы скорости реакции от температуры подчиняются и многие реакции, катализируемые ферментами; примером могут служить экспериментальные'данные, представленные на рис. 3.24.
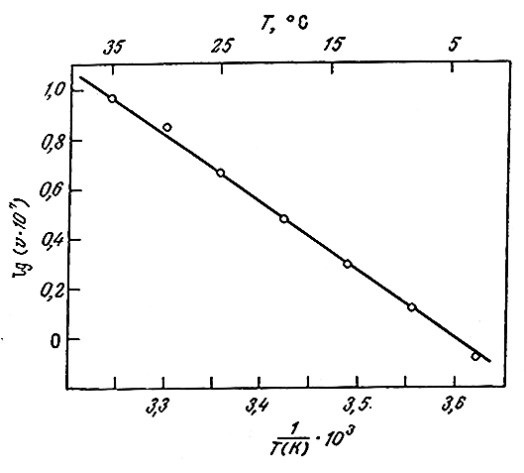
РИС. 3.24. Аррениусовская зависимость скорости ферментативной реакция
(катализируемый миозином гидролиз АТР) от температуры.
Следует подчеркнуть, однако, что температурный диапазон, в котором были получены приведенные на рис. 3.24 данные, очень узок. В этом эксперименте не рассматривались температуры, значительно превышающие обычные в биологических условиях пределы. Что же произойдет, если мы попытаемся заставить фермент катализировать процесс еще быстрее, подняв температуру еще выше? Как показано на рис. 3.25, в большинстве случаев, результат окажется очень печальным. Денатурация большинства белков начинается в диапазоне температур от 45 до 50 °С и завершается очень быстро при 55 °C. Один из механизмов термической денатурации белков очевиден: по мере повышения температуры атомы в молекуле белка приобретают все более высокую энергию, в том числе кинетическую, и в конце концов становится возможным разрушение слабых связей, стабилизирующих глобулярную структуру белка, что и приводит к его инактивации.
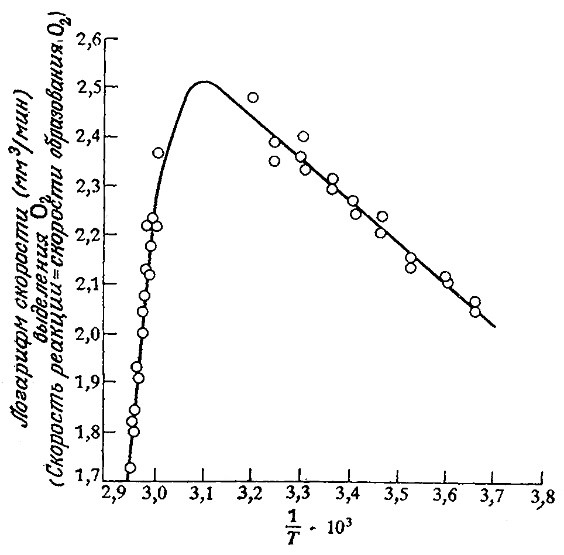
РИС. 3.25. При высоких температурах, когда начинает доминировать процесс термической инактивации
фермента, аррениусовская зависимость скорости реакции от температуры нарушается
(приведен пример разложения Н2О3 каталазой). Сплошная кривая вычислена по уравнению (3.73)
при следующих значениях параметров: E = 3,5 ккал/моль, ∆Hd = 55,5 ккал/моль, ∆Sd = 168 ккал/(моль-К), β = 258 мм3/мин.
Термическая инактивация ферментов может быть обратимой, необратимой или смешанной. Зависимость скорости реакции ферментативного катализа от температуры в достаточно широком диапазоне температур может быть описана с помощью простой модели обратимой термической инактиваций. Согласно этой модели, мы принимаем, что неактивная (i) и активная (а) формы фермента находятся в равновесии:
![]()
Константу равновесия этой реакции можно выразить следующим уравнением:
![]()
В этом уравнении символами AGa, AHd и ASd обозначены свободная энергия, энтальпия и энтропия инактивации соответственно.
Хотя изолированные водородные связй сравнительно слабы (их энергия обычно изменяется в пределах от 3 до 7 ккал/моль), энтальпия инактивации ферментов ∆Hd достаточно высока, составляя, например, для трипсина и лизоцима белка куриных яиц соответственно 68 и 73,5 ккал/моль. Инактивация этих ферментов сопровождается изменением энтропии, равным +213 кал/(моль•К). Благодаря высокой энтальпии денатурации уже небольшие изменения температуры существенно изменяют относительное количество активной формы фермента.
При таких высоких значениях ∆Нd фермент инактивируется! практически полностью в диапазоне тридцати градусов.
Поскольку весь фермент существует либо в активной, либо в неактивной форме, т. е.
![]()
из уравнения (3.68) следует, что
![]()
Согласно теории переходного состояния, скорость реакций (3.4) при высоких концентрациях субстрата может быть выражена следующим образом:
![]()
где
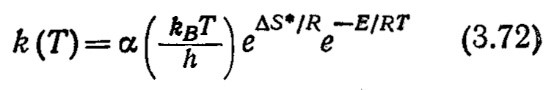
Здесь kв и Л– константы Больцмана и Планка соответственно, а α –коэффициент. Из уравнений (3.68), (3.70) – (3.72) следует, что
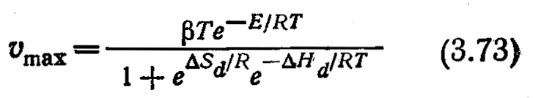
В уравнении (3.73) коэффициент β включает α, kв, h, e9 и. ехр(∆S*/R).
Это уравнение и представляет собой математическое выражение, описывающее схематично изображенное на рис. 3.25 поведение систем фермент–субстрат. Показанная на этом рисунке сплошная линия, проходящая через экспериментально найденные точки, фактически была вычислена по уравнению (3.73) после определения параметров β, Е, ∆Sd и ∆Нd на основе тех же экспериментальных данных. При больших значениях 1/T тангенс угла наклона кривой приближенно равен –E/R (погрешность равна Т (К) и обычно не вносит большого вклада). Тангенс угла наклона другого прямого участка кривой при более высоких температурах равен приблизительно (∆Нd–Е)/R. Величину ∆Sd можно определить, используя тот факт, чта при температуре Тmах, когда lnamax принимает наивысшее значение,
![]()
[Это выражение легко получить, приняв d(ln Vmax)/dT равным нулю.] Поскольку Тmах известна из измерений, а величины E и ∆Нd мы уже определили, то не представляет труда вычислить правую часть уравнения (3.74). Теперь, зная величину Kd(Tmax), возвратимся к уравнению (3.68) и найдем ∆Sd. Наконец, подберем такое значение коэффициента β, чтобы Vmax [Tmax в уравнении (3.73)] стало равным измеренной величине. При необходимости более точные значения параметров можно получить методом последовательного приближения. В частности, очень большое влияние на результаты может оказывать значение Tmax. Конечно, от температуры зависят и другие параметры уравнений скорости реакции, например, константа Ми- хаэлиса или ингибиторная константа. Если эти параметры считать константами равновесия, как это часто бывает в действительности, то мы должны прийти к температурной зависимости типа той, которая выражается уравнением (3.68). Тогда график зависимости lnK (или р/K) от 1/Т будет представлять собой прямую линию, по наклону которой можно определить стандартную свободную энергию.
В некоторых случаях графическая зависимость в этих координатах изображается не прямой линией, иными словами, наклон линии меняется при изменении диапазона температур. Причиной подобных осложнений могут быть неоправданные упрощения в интерпретации Km или Ki или даже в последовательности катализируемых ферментом реакций. Напомним, например, что для случая простейшей последовательности реакций (3.4) Km представляет собой не что иное, как отношение констант скоростей элементарных стадий реакции, выражаемое уравнением (3.5). Если каждую из этих констант элементарных стадий в свою очередь выразить в форме уравнения Аррениуса [уравнение (3.66)] или в форме уравнения теории переходного состояния [уравнение (3.72)], то получится весьма сложная форма зависимости от температуры. Другим возможным источником затруднений в определении зависимости некоторых параметров скорости реакции от температуры может служить существование нескольких промежуточных фермент-субстратных комплексов (или комплексов фермента с продуктом реакции).
Подобные соображения были положены в основу полезного и довольно широко применяемого способа проверки корректности кинетических моделей и соответствующих гипотетических последовательностей реакций. Если зависимость кинетических параметров в аррениусовских координатах выражается не прямой, то исходная модель или чрезмерно упрощена, или вообще неверна.

