Чтобы определить, пойдет ли данная химическая реакция в клетке в прямом или обратном направлении, нам придется принять ряд упрощений, поскольку полный анализ всех путей метаболизма практически нереален. Прежде всего отметим, что в случае элементарной химической реакции
αΑ + βΒ → ץC + δD (5.1)
изменение свободной энергии ΔG' может быть записано в виде
![]()
Как и в предыдущих главах, строчными буквами α, b и т. д. мы будем обозначать молярные концентрации соединений А, B и т. д. Поскольку концентрации веществ в биологических растворах обычно невысоки, то в уравнении (5.2) вместо активностей можно подставить концентрации реагентов. Надстрочный индекс (') над символами ΔG означает, что все расчеты относятся к водным растворам при pH 7; это позволяет не включать концентрации воды и H+ в последний член уравнения (5.2), даже еслиН2О и H+ участвуют в реакции (5.1). Таким образом, стандартное изменение свободной энергии ΔGо' обозначает изменение свободной энергии в реакции (5.1) в нейтральном водном растворе, когда концентрации всех других реагентов и продуктов реакции равны 1 M (см. [1]).
B закрытой системе реакция будет протекать слева направо только в том случае, если ΔG' отрицательно. Отсюда следует, что в состоянии равновесия ΔG' равно нулю; таким образом мы получим хорошо известное выражение для равновесной реакции:
ΔGo’=—RTlnK'eq (5.3)
где
![]()
Запомните, что если в реакции участвуют вода или H+, то их концентрации не входят в правую часть уравнения (5.4); эти параметры уже учтены в К'еq (при pH 7).
B последующем обсуждении время от времени мы будем считать отрицательные значения ΔG0' свидетельством в пользу того, что реакция идет слева направо. Такое допущение, безусловно, справедливо только в самом первом приближении, поскольку, во-первых, клетка не представляет собой закрытую систему и, во-вторых, концентрации реагентов обычно не достигают 1 M. Полезность этого допущения для понимания основных принципов биоэнергетики хорошо освещена в книге Лeнинджера [1], рекомендуемой для дополнительного чтения.
B то же время следует отчетливо представлять себе и те ограничения, которые накладывает такой приближенный подход. B сложной метаболической схеме типа изображенной нарис. 5.1 направление основного пути реакции в метаболизме клетки не всегда можно установить путем изучения изолированной реакции. Рассмотрим, например, реакцию между двумя изомерами, являющимися промежуточными соедииениямипри расщеплении глюкозы по пути Эмбдена — Мейергофа:
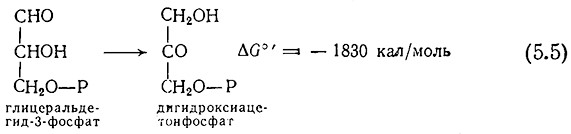
Здесь P — фосфатная группа. Отрицательная величина изменения свободной энергии обусловливает смещение равновесия в сторону дигидроксиацетона до отношения 22 : 1. Однако, как показано на рис. 5.1, в пути Эмбдена — Мейергофа глице- ральдегидфосфат постоянно вовлекается в другую последовательность реакций, приводящую в конце концов к пирувату, в результате чего равновесие смещается и реакция (5.5) протекает справа налево.
Многие биологические реакции и процессы, связанные с энергооб.меном, включают стадии окисления-восстановлении типа
![]()
Для определения направления таких реакций часто используют параметр, называемый изменением стандартного потенциала ΔEo' и определяемый следующим образом:
ΔEo' = Eo'(Aox/.Ared) – E°'(Box/Bred) (5-7)
Здесь Eo'(Aox/Ared) — стандартный электродный потенциал полуреакции
Aox + 2e– → Ared (5.8)
B качестве точки отсчета для таких электродных потенциалов применяют водородный электрод, потенциал которого при давлении водорода 1,01•105 Па и активности ионов- гидроксонияв растворс, равной 1, принимают равным нулю:
2H+ + 2e– →- H2 E0 = 0,00B (pH = 0) (5.9)
Изменения свободной энергии и соответствующие изменения электродного потенциала связаны соотношением
ΔG' = — nF ΔE' (5.10)
Здесь n — число участвующих в реакции электронов, а F — константа Фарадея [F = 23,062 ккал/(В•моль)]. Согласно уравнению (5.10), слева направо протекают только реакции с положительными значениями ΔE'. Если необходимо определить значение ΔΕ' для нестандартных условий, можно воспользоваться уравнениями (5.2) и (5.10).

