Хотя рост клеток представляет собой чрезвычайно сложный и изящный процесс, он, естественно, подчиняется законам сохранения материи. B ходе метаболических процессов в клетке перегруппировываются атомы углерода, азота, водорода, кислорода и других жизненно важных химических элементов, рассмотренных в гл. 2, но общее количество каждого из этих элементов, включенное в структуры клетки, в точности равно количеству, взятому клеткой из питательной среды. Кроме того, количество образующегося метаболита или выделившейся в процессе роста клеток теплоты часто пропорционально количеству поглощенного клеткой субстрата или количеству другого продукта метаболизма, например CO2. B этом разделе мы рассмотрим некоторые достаточно жесткие ограничения, налагаемые на баланс веществ, а также ряд полезных приближенных эмпирических стехиометрических соотношений. Как мы увидим, эти стехиометрические аспекты имеют самое непосредственное отношение к проблемам биохимической технологии, где они должны учитываться при решении самых различных вопросов от выбора состава питательной среды до выбора систем автоматизированного контроля и способа охлаждения биологических реакторов. Кроме того, как и в анализе любых реакторов, стехиометрические соотношения определяют материальный баланс веществ в биореакторе и позволяют наиболее эффективным и целенаправ- леннымпутем использоватьспецифику кинетики реакций(гл.7).
5.10.1. Общая стехиометрия клеточного роста;
состав среды и коэффициенты выхода
B процессе роста клетки потребляют субстраты, которые обеспечивают их энергией и исходными веществами для синтеза новой клеточной массы. C самой общей точки зрения для реализации этого процесса необходимо, чтобы в питательной среде находились все химические элементы, требующиеся для формирования новой клеточной массы, и чтобы свободная энергия усвоенных субстратов превышала свободную энергию образующихся клеток и продуктов метаболизма (рис. 5.28). Другими словами, свободная энергия образующихся веществ должна быть меньше свободной энергии утилизированных субстратов.
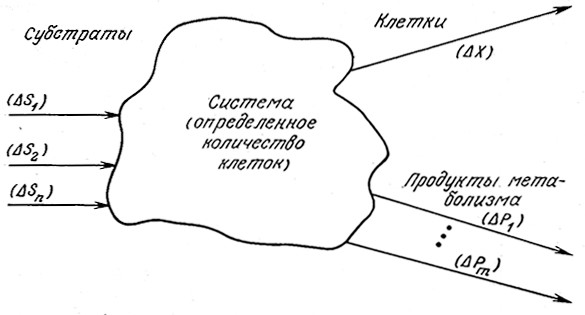
РИС. 5.28. Клеточный рост как единый процесс. Под «системой» здесь
подразумевается определенное количество клеток. B процессе роста «система»
выполняет функции катализатора, превращая субстраты в новые клетки и продукты метаболизма.
Кроме того, питательные вещества должны иметь соответствующее молекулярное строение, определяемое специфичностью клеточных ферментов, участвующих в процессах катаболизма и биосинтеза. B то же время при изучении роста клеток как единого процесса (а именно с этой точки зрения мы будем изучать его в большей части настоящего раздела) привлечение деталей механизмов метаболических превращений можетоказаться не только ненужным, но и вредным. Основной смысл изображенного на рис. 5.28 процесса роста жлеток как единого явления заключается в том, что ему свойственны определенные стехиометрические ограничения независимо от того, какой конкретный механизм или какие метаболические пути использует «система» клеток для достижения цели «реакции» – роста клеток. Поэтому для решения вопроса о пригодности тех или иных питательных веществ мы просто будем рассматривать только те питательные вещества, которые заведомо являются подходящими субстратами для роста изучаемого штамма клеток.
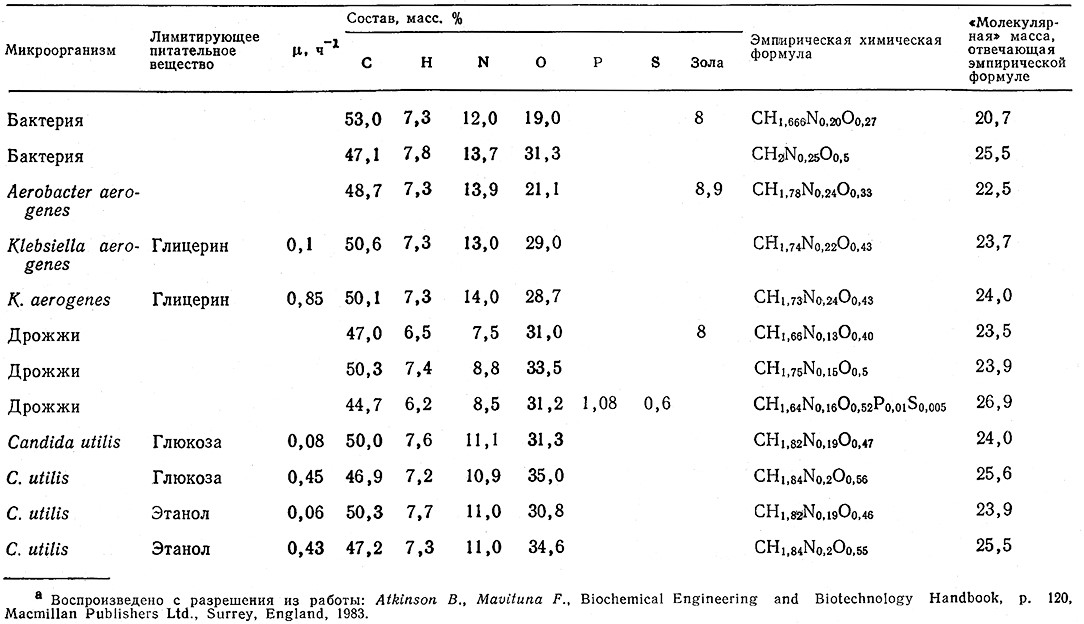
Простейшая форма стехиометрических ограничений, накладываемых на состав питательной среды, в краткой форме может быть выражена следующим образом: если мы хотим вырастить общую массу клеток (X) (пройнсными буквами в скобках мы будем обозначать общую массу компонента, указанного в скобках) и если весовая доля элемента i в клетке равна Wi, то минимально необходимое общее содержание элемента i во всех субстратах должно составлять Wi(X). B общем случае подобные вычисления лучше выполнять в расчете на массу сухого клеточного вещества. При выполнении таких расчетов для различных элементов необходимо знать их относительное содержание в клетке. Примером могут служить довольно подробные данные об элементном составе бактерии E. coll, приведенные в табл. 2.1, а в табл. 5.10 указано оодержание основных элементов (С, N, 0 и H) в клетках целого ряда микроорганизмов. Хотя элементный состав клеток несколько изменяется в зависимости от вида микроорганизма и даже от состава питательнойсреды в случае одного и того же штамма, в целом эти данные вполне надежно определяют элементный состав клеточной массы. Смысл приведенных в этой таблице эмпирических формул клеток и их применение мы рассмотрим в следующем разделе.
Таблица 5.10. Элементный состав некоторых минроорганизмов. Символом μ обозначена удельная скорость роста,
равная массе клеток, образующихся из данной массы клеток в единицу времени (см. гл. 7)а
Ha самом деле определить необходимый для эффективного роста клеток состав среды значительно сложнее, поскольку изложенный выше основной стехиометричеокий принцип не учитывает, во-первых, то, что часть химических элементов субстратов входит в выделяемые в среду продукты метаболизма, во- вторых, ограничений, накладываемых скоростями реакций, в-третьих, особых метаболических свойств данного штамма клеток, обусловленных ингибирующими эффектами каких-либо питательных веществ или продуктов· метаболизма. Первую причину осложнений мы рассмотрим позднее в этом же разделе, а вторую обсудим сейчас. Затем мы перейдем к изучению экономических коэффициентов – простейших параметров, с помощью которых можно количественно оценить стехиометрию роста клеток.
Хотя в этом разделе основное внимание мы постараемся уделять именно стехиометрии, при разработке подходов к упрощению стехиометрических выражений клеточного роста и образования продуктов метаболизма нам придется принимать вовни- маниеикинетическиефакторы.Число питательных веществ в среде обычно очень велико, и учесть все эти вещества в анализе стехиометрии или кинетики процесса практически невозможно. Поэтому обычно стараются описать систему упрощенно, на базе ограниченного числа лимитирующих процесс ключевых соединений или элементов. Найти стехиометрически лимитирующее соединение можно на основе стехиометрии клеточного роста. Для этого необходимо определить, какой субстрат первым полностью израсходуется в «реакции» клеточного роста, изображенной на рис. 5.28. Лимитирующие соединения других типов можно идентифицировать путем изучения влияния состава среды на рост клеток. Для данного штамма в данных условиях (температура, pH, присутствие других питательных веществ) лимитирующий скорость роста компонент питательной среды можно найти экспериментально следующим образом. Предположим, что клетки растут в определенной среде взаданныхусловиях. В этой системе резко повышают концентрацию одного из компонентов среды и затем определяют изменение скорости роста клеток. Часто состав среды подбирают так, чтобы скорость клеточного роста лимитировал только один компонент, а относительно небольшие (по сравнению с базовыми значениями) изменения концентраций всех других компонентов среды практически не влияли бы на окорость роста клеток. B принципе, однако, возможны и такие варианты, когда скорость клеточного роста определяют несколько субстратов одновременно.
Компонент, лимитирующий скорость клеточного роста, и стехиометричеоки лимитирующий компонент не обязательно должны быть одним и тем же веществом. Другими словами, в определенных условиях скорость роста клеток может ограничивать одно соединение, но рост клеток в периодическом процессе может прекратиться в силуистощения запасов другого соединения. B то же время вразличных математических выражениях, описывающих рост микроорганизмов количественно, такая возможность часто игнорируется, что может приводить к известным трудностям при изучении режима биореакторов и неправильным выводам при интерпретации их характеристик. He забывая о возможных осложнениях такого рода, мы тем не менее будем считать, что клеточный рост лимитирует только одно питательное вещество. Если речь идет о конкретной системе и определенной среде, то всегда можно экспериментально проверить справедливость допущения о том, что лимитирующий скорость роста и стехиометрически лимитирующий компоненты являются одним и тем же веществом.
Частооказывается, что общее количество клеточной массы, образующейся в процессе клеточного роста, пропорционально массе утилизированного клетками субстрата (обычно углерод- содержащего предшественника, источника энергии иликислорода) (рис. 5.29). Экономическимкоэффициентом называют соответствующее соотношение:
![]()
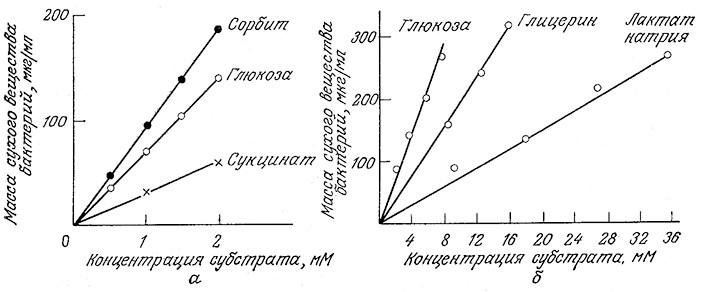
РИС. 5.29. Зависимость общего количества образующейся биомассы от количества утилизированного субстрата
в случае роста бактерий Aerobacter aerogenes в аэробных условиях (а) и бактерий Propionibacterium pentosaceum
в анаэробных условиях (б) на различных источниках углерода.
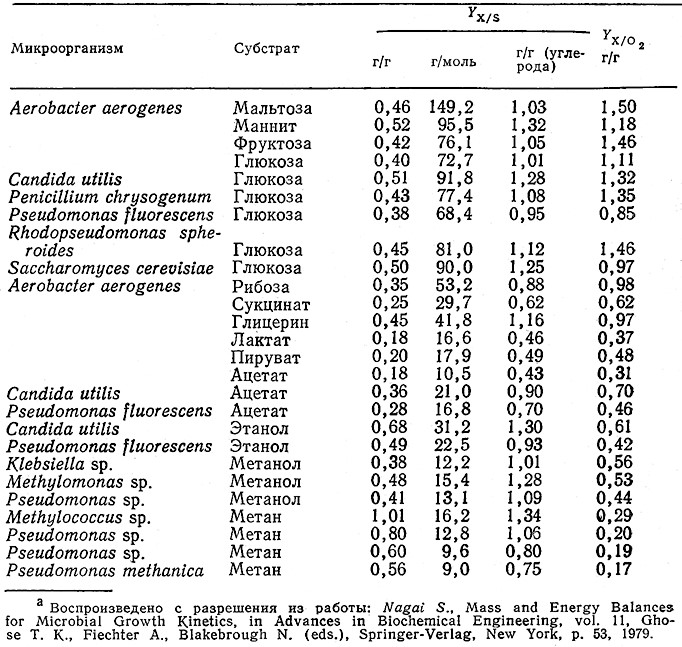
Следует отметить, что размерность экономического коэффициента определяется способом выражения количества клеточной массы и количества субстрата (например, в единицах массы или в числе молей); этот факт всегда следует учитывать при использовании опубликованных в литературе значений Y. При одновременной утилизации из среды нескольких различных субстратов Si можно определить несколько соответствующихэкономических коэффициентов клеточного роста Yх/si. B табл. 5.11 приведены экономические коэффициенты для роста ряда микроорганизмов в средах, отличающихся природой источника углерода; здесь цифры в одной строке отвечают разным способам измерения количества утилизированного субстрата (в граммах, молях или в граммах углерода в 1 моль субстрата).
Таблица 5.11. Экономические коэффицйенты для аэробного роста ряда микроорганизмов
на различных источниках углерода. Здесь символом Yх/о2 обозначен коэффициент, выраженный
в граммах клеточной массы в расчете на 1 г усвоенного О2а
Если для данной культуры клеток в данной питательной среде экономический коэффициент приблизительно постоянен, то уравнение (5.46) позволяет определить изменение концентрации клеточной массы по изменению концентрации субстрата, и наоборот. Иными словами, одну из этих переменныхможно выразить через другую и при расчетах в ходе проектирования реакторов одну переменную можно не учитывать. Это стехиометричеокое соотношение может пригодиться и при контроле работы биологических реакторов; в данном случае концентрация субстрата может служить одновременно и. мерой концентрации клеточной массы, если только известны обе соответствующие исходные величины. Это чрезвычайно удобно, поскольку обычно концентрации субстратов определять значительно легче, чем концентрацию биомассы. Ha практике удобнее всего определять концентрации веществ, покидающих зону аэробного биореактора, например CO2. B этом случае в качестве основы для установления зависимостей между различными переменными биотехнологичееких процессов также используются стехиометрические соотношения. Однако, прежде чем обратиться к изучению таких зависимостей, необходимо упомянуть о вариабельности экономического коэффициента и о понятии метаболизма поддержания.
Нет никакой гарантии, что найденный эмпирическим путем экономический коэффициент, представляющий собой кажущейся стехиометрическоесоотношение, всегда постоянен для данного организма в данной среде. Действительно, экспериментально установлено, что часто экономический коэффициент изменяется при изменении скорости роста клеток. Чтобы понять причину этих изменений, иногда полезно разбить процесс утилизации субстрата на три части: превращение субстрата в клеточную массу (ассимиляция), обеспечение энергии для клеточного синтеза и обеспечение энергии для поддержания культуры. Под энергией поддержания здесь подразумеваются энергетические затраты клетки, необходимые для ее выживания илв сохранения в определенном (потенциально) жизнеспособном состоянии, но не обеспечивающие клеточный рост и образование новых клеток. Эта энергия расходуется на активный транспорт ионов; и другихвеществ через клеточные мембраны и на возобновление деградирующих составных частей клетки.
B случае хемогетеротрофов один и тот же субстрат выполняет функции источника| энергии и углерода, поэтому суммарную утилизацию субстрата можно выразить следующим уравнением:

Истинный экономический коэффициент клеточного роста ΔX/(ΔS)ассимиляция относительно постоянен и представляет собой стехиометрически четко определенную величину. Этого, однако, нельзя сказать об общемкоэффициенте Yх/s, что связано с зависимостью различных (ΔS) в правой части уравнения (5.48) от условий роста. Так, в быстро растущей популяции клеток большая часть субстрата расходуется на ассимиляцию и рост, в то время как в популяции клеток, находящейся в стационарном состоянии или покое, субстрат часто расходуется исключительно на поддержание (в этом случае Yx/s=0).
B следующем разделе мы рассмотрим другие, более строгие стехиометрические выражения для клеточного роста с учетом уравнений материального баланса по углероду, водороду, азоту и кислороду. Кроме того, мы познакомимся с более детальным подходом к моделированию клеточного роста, при котором: рост клеток все еще рассматривается как единый процесс, но вместе с этим учитывается ведущая роль NADH и ATP в метаболизме роста.
5.10.2. Материальный баланс по элементам и клеточный рост
Рост клеток и связанные с ним метаболические процессы можно описать такими же уравнениями, какие используются для изображения обычных химических реакций. Для этого прежде всего необходимо найти «химическую формулу» сухого клеточного вещества. Если известен элементарный состав данного штамма, растущего в определенных условиях (см., например, данные табл. 5.10), то не представляет труда найти и относительные значения коэффициентов в эмпирической формуле клетки C⍬HαOβNδ. Для того чтобы клетке отвечали одна строго определенная формула и соответствующая «молекулярная масса», удобно принять ⍬ = 1 и затем в соответствии с элементным составом найти значения α, β и δ. Приведенные в табл. 5.10 «формулы» клеток получены именно таким путем. Один С-моль клеток определяют как количество клеток, в котором содержится один грамм-атом (12,011 г) углерода и которое отвечает эмпирической формуле клетки при ⍬ = 1.
B качестве простейшего примера анализа стехиометрии клеточного роста на основе материального баланса по элементам рассмотрим прежде всего рост клеток в аэробных условиях, когда помимо новых клеток, CO2 и H2O не образуется никаких иных продуктов метаболизма. Если источники углерода и азота мы обозначим формулами CHxOy и HiOmNn соответственно, то уравнение клеточного роста будет выглядеть следующим образом:
a'CHxOy+b'O2+c'HiOmNn → CHαOβNδ+d'H2O+е'С02 (5.49)
Здесь коэффициент при формуле клетки принят равным единице, что не отражается на общности уравнения, поскольку стехиометрические коэффициенты можно умножать или делить на любое одно и то же число.
Из уравнения (5.49) следует, что пять неизвестных стехиометрических коэффициентов α', b', c', d' и e' связаны четырьмя уравнениями:
С: α'=l+e'
H: α'x+c'l=α+2d'
О: a'y+2b'+c'm=β+d'+2e' (5.50)
N: c'n=δ
Еще одно уравнение можно получить, если экспериментальным путем определить дыхательный коэффициент (RQ) реакции клеточного роста. Дыхательным коэффициентом называют молярное (или объемное) отношение выделяемого при дыхании СО2 к поглощенному O2:
![]()
Для реакции роста клеток, выраженной уравнением (5.49),
RQ=e'/b' (5.52)
Таким образом, пять уравнений (5.52) и (5.50) содержат пять неизвестных стехиометрических коэффициентов, и если известен RQ, то можно определить все эти коэффициенты. Возможные затруднения, связанные с очень большими колебаниями значений стехиометрических коэффициентов при относительно небольших погрешностях в измерении RQ, мы рассмотрим в упражнении 5.16.
B общем случае химическая формула элементного состава клетки и стехиометрические коэффициенты в уравнении (5.49) зависят от состава питательной среды и условий, в которых находится клетка. He следует забывать, что эта зависимость имеет описательный характер и в используемом здесь смысле отражает суммарный эффект множества независимых химических реакций. Чтобы получить какое-то представление о влиянии среды или условий клеточного роста на стехиометрию этого процесса и связать это влияние с обсужденными выше путями метаболизма, можно, например, разделить общую реакцию роста на несколько реакций, отвечающих различным метаболическим функциям (но не обязательно специфическим путям метаболизма).
Теперь мы несколько более детально рассмотрим стехиометрию роста хемогетеротрофного организма в аэробных условиях. C каждой реакцией мы будем связывать реакции генерирования и утилизации ATP. Ниже последние записаны отдельно и не включены в уравнения соответствующих реакций суча- стием соединений углерода, водорода, кислорода и азота из-за ряда практических затруднений, связанных со стехиометрией ATP; вкратце мы рассмотрим и эти затруднения.
Диссимиляция источника энергии:

Взаимосвязь между этими реакциями можно установить, если допустить, что в рассматриваемых здесь, условиях не накапливаются ни ATP, ни NADH, и, следовательно, синтез этих соединений должен уравновешиваться их утилизацией.
Приведенная выше усложненная, но более близкая к действительности система химических уравнений, отражающих клеточный рост, получена ценой резкого увеличения числа стехиометрических параметров. Заметьте, что в уравнениях (5.53) – (5.56), во-первых, стехиометрические коэффициенты отражают баланс по элементам в каждой отдельной реакции и, во-вторых, стехиометрический коэффициент биомассы CHαOβNδ принят равным единице. Поэтому коэффициенты, a, b и с в других реакциях отражают, по сути дела, степень протекания этих реакций относительно реакции роста клеток (биосинтеза). Стехиометрические коэффициенты для воды в двух случаях обозначены словом «коэффициент», а не каким-либо специальным символом, поскольку вовлечение воды в реакцию или ее выделение в результате реакции обычно практически не изменяет ее общего количества в клетке. Символом Ꜫs обозначено число актов фосфорилирования в расчете на атом углерода, участвующий в процессах катаболизма.
Параметрами γB, γS и γN обозначены степени восстановлен- ности биомассы, источника углерода и источника азота соответственно. Степень восстановленности γ соединения с брутто-формулой CHrOsNv определяется как γ = 4+r–2s–3v. Нетрудно видеть, что степень восстановленности CO2, H2O и NH3 равна нулю.
Коэффициент YATPmax обозначает массу клеток, образующихся в результате усвоения 1 моль ATP, при условии, что ATP расходуется только на цели биосинтеза. Предпринимались попытки оценить величину YATPmax по известным элементному составу клеток и путям биосинтеза [13]. Эти оценки показали, что, например, при росте E. coli на глюкозе и неорганических солях YATPmax составляет 28,8 г клеток на 1 грамм-моль ATP. Для перехода от единиц массы к мольным единицам в уравнение (5.556) включена молекулярная масса клеток, обозначенная символом MWB.
Как мы уже отмечали выше, Р/O обозначает число актов фосфорилирования ADP в расчете на один атом усвоенного кислорода; этот параметр характеризует эффективность окислительного фосфорилирования и в общем случае зависит от условий культивирования клеток. Расчетами на основе среднего элементного состава микроорганизмов показано, что теоретические максимальные значения Р/O составляют 2,25, 2,50 и 3,00 при использовании в качестве основного питательного вещества ацетата, малата и глюкозы соответственно.
Прямое экспериментальное определение параметра Р/O затрудняется тем обстоятельством, что изучать опытным путем отдельно пути синтеза или утилизации ATP крайне сложно; к тому же относительные количества образующегося и использующегося в каждом пути ATP зависят от условий культивирования клеток. Основная трудность здесь обусловлена частичной утилизацией ATP в процессах транспорта веществ через мембраны, в биосинтезе соединений, далее разлагаемых внутриклеточными гидролазами, и в других недостаточно изученных процессах (их иногда называют бесполезными циклами). Bce перечисленные источники потребления ATP, сгруппированные здесь в одну «реакцию» (5.56) под общим названием «поддержание и рассеяние энергии», естественно, оказывают влияние на другие процессы генерирования и утилизации ATP.
Поскольку количество вновь синтезированного ATP должно быть равно количеству утилизированного ATP, то любые изменения в относительном количестве ATP, участвующего в «реакции» (5.56) (зто количество отражает коэффициент с), повлекут за собой и изменения в количествах ATP, принимающего участие в других реакциях. Экспериментальные данные показывают, что потребность в ATP для поддержания клетки определяется не стехиометрическими факторами, а скоростями метаболических процессов, поэтому количественную оценку этих затрат мы отложим до изучения кинетики клеточного роста в гл. 7.
Здесь целесообразно упомянуть, что экспериментально найденные величины выхода биомассы в расчете на количество утилизированного ATP в анаэробных условиях обычно весьма мало зависят от типа субстрата и вида микроорганизма и в среднем величина YATP составляет 10,7 г клеточной массы на 1 моль ATP. У хемогетеротрофных организмов, как правило, значительно больше субстрата используется для выработки энергии, чем для роста биомассы. Так, в одной из работ было показано, что при росте пекарских дрожжей Saccharomyces ceremsiae в анаэробных условиях в богатой глюкозой среде (глюкоза являлась источником углерода) 98% усвоенного углерода расходовалось на выработку энергии и только 2% – на рост клеточной массы. Определить с достаточной точностью количество синтезируемого ATP в условиях аэробного роста оказалось крайне сложно. Имеющиеся данные говорят о том, что величина отношения P/O составляет от 0,5 до 1,8, т. е. значительно ниже теоретического значения. Изучение бактерии Aerobacter cloacae показало, что при ее росте в аэробной минимальной среде 55% глюкозы ассимилируется во вновь синтезированной биомассе, а 45% расходуется для выработки энергии. Эти данные свидетельствуют о том.что в аэробных условиях выход клеточной массы в расчете на количество утилизированного субстрата обычно выше, чем при анаэробном росте. Например, коэффициент YX/S (масса клеток в граммах, образовавшихся из Гмоль глюкозы) Streptococcus faecaIis в глюкозной среде составляет 21,5 в анаэробных условияхи 58,2 при аэробном росте B следующем разделе мы изучим: влияние такого распределения субстрата на стехиометрию образования процессов метаболизма.
5.10.3. Стехиометрия процессов образования
продуктов метаболизма
Множество конечных продуктов метаболизма выделяется клеткой в питательную среду или аккумулируется в клетке. B соответствии с особенностями стехиометрии процессы образования продуктов метаболизма удобно подразделить на четыре перечисленных ниже типа; первые три типа отвечают классификации путей анаэробного метаболизма, впервые предложенной в 1955 г. Гэйденом-младшим.
1. Основной продукт метаболизма является результатом первичного энергетического обмена. Примером может служить образование этанола в ходе анаэробного роста дрожжей.
2. Образование основного продукта метаболизма не связано непосредственно с энергетическим обменом, как, например, при биосинтезе лимонной кислоты при аэробном культивировании плесеней.
3. Конечный продукт является вторичным метаболитом. B качестве примера можно привести биосинтез пенициллина, образующегося в аэрируемой культуре плесени.
4. Биотрансформация. Здесь конечный продукт метаболизма образуется из субстрата в результате одной или нескольких реакций, катализируемых клеточными ферментами. Примером может служить гидроксилирование стероидов.
Процессы первого типа характеризуются относительно простой стехиометрией, что связано со сравнительно постоянной величиной отношения количества образующегося метаболита к количеству накопленной клеточной массы и утилизированного субстрата. B этомслучае процессы утилизации субстрата, синтеза биомассы и образования конечного продукта метаболизма формально можно выразить, одним уравнением химической реакции, если, например, к правойчасти уравнения (5.49) добавить продукт метаболизма CHvOw:
a'CHxOy+b'O2+c'HiOmNn → CHαOβNδ+d'H2O+e'CO2+f'СНvОw (5.57)
(Аналогичным путем можно выразить стехиометрию синтеза азотсодержащих продуктов метаболизма.)
Нетрудно получить и выражение для соответствующего экономического коэффициента, если учесть, что в этом параметре количества веществ должны быть выражены в молях. Так, если субстратом является глюкоза, молекула которой содержит шесть атомов углерода, то в реакции (5.57) будет участвовать a'/6 молекул глюкозы. Аналогично если в молекуле продукта метаболизма содержится nр его молекул. Следовательно, молярный коэффициент YP/S (число молей продуктов метаболизма, образующегося из 1 моль утилизированного субстрата) составляет
![]()
Здесь ns – число атомов углерода в молекуле субстрата.
Простая стехиометрия уравнения (5.57) неприменима к метаболитам второго типа, количество которых не обязательно должно быть пропорциональным количеству утилизированного субстрата или приросту клеточной массы. B этом случае стехиометрию процесса можно выразить только с помощью отдельного уравнения реакции образования продукта метаболизма. Интересно проследить за стехиометрией реакций, уравнения которых получены путем введения стадии образования продукта метаболизма в приведенные выше уравнения реакций роста клеток (5.53) – (5.56):
Образование продукта метаболизма:
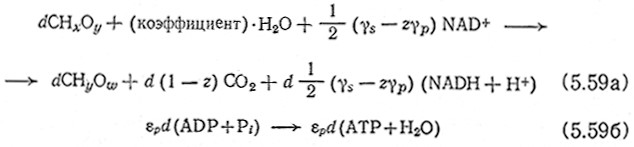
Здесь коэффициентом z обозначена часть углерода субстрата, используемая для образования продукта метаболизма и найденная экспериментально в последнем. Генерируемое в процессе биосинтеза продукта метаболизма число молекул ATP обозначено коэффициентом ερ; этот коэффициент может принимать и отрицательные значения, если в процессе образования продукта метаболизма ATP не синтезируется, а, напротив, расходуется. Аналогично если коэффициент (γs–Zγp) имеет отрицательное значение, то это означает что в процессе образования продукта метаболизма используются восстанавливающие эквиваленты NADH (или NADPH; на принятом здесь довольно невысоком уровне детализации механизмов путей метаболизма нет смысла различать эти два агента).
Способ описания стехиометрии образования метаболитов 3 и 4 зависит от природы субстратов и продуктов метаболизма. B этих случаях образование последних обычно никак не связано с клеточным ростом. Накопление вторичных метаболитов определяется кинетическими факторами и активностью клеток.
Изучение стехиометрии образования продуктов метаболизма позволяет сделать ряд важных с точки зрения инженера-технолога выводов. Например, с помощью стехиометрических расчетов можно оценить максимально возможный выход продукта метаболизма, а эти данные в свою очередь могут оказаться очень полезными в предварительном экономическом анализе технологического процесса (см. гл. 12). B качестве первого примера рассмотрим анаэробный процесс превращения глюкозы в этанол. (Приведенные выше реакции аэробного метаболизма могут быть применены и для изучения анаэробных процессов, если во всех реакциях опустить О2 и стадии окислительного фосфорилирования.) Очевидно, что оптимальным вариантом является использование всего субстрата только для образования продукта метаболизма. Если принять, что рост клеток пренебрежимо мал, то уравнение (5.57) в нашем случае принимает очень простую форму:
CH2O → ⅓CO2+⅔CH3O0,5 (5.60)
Отсюда следует, что в идеальном варианте продукт метаболизма будет содержать две трети углерода утилизированного субстрата. B соответствии с уравнением (5.58) высший предел молярного коэффициента составит: (Yp/s)max=(⅔)(6/2)=2.
Такой же подход может быть использован и в случае образования метаболитов всех других типов, в том числе и при одновременном биосинтезе нескольких продуктов метаболизма. Предельное значение выхода данного продукта метаболизма можно определить, приияв, что одновременно с ним не образуются новые клетки или другие метаболиты. Например, по уравнению реакции биосинтеза пенициллина из соединений-предшественников:
1,5 глюкоза+Н2SO4+2NН3+фенилацетат → пенициллин G+CO2+8H2O (5.61)
легко определить максимально возможный выход пенициллина, составляющий 1,2 г на 1 г глюкозы. B реальных промышленных процессах выходы намного ниже (около 0,1 г/г), что свидетельствует о возможности дальнейшего совершенствования и технологического процесса, и микроорганизма-продуцента. Малая величина реального выхода продукта метаболизма по сравнению с максимальной расчетной величиной указывает на то, что значительное количество субстрата расходуется на рост клеток, на их поддержание или на синтез других веществ.
Изучение зависимости между энергетическим обменом и биосинтезом продуктов метаболизма в том виде, в каком эти процессы выражаются уравнениями (5.53) – (5.56) и (5.59), может дать полезные сведения о влиянии затрат на поддержание клеток на выходы продуктов метаболизма. Предположим, что в анаэробных условиях в среде, содержащей в качестве источника азота аммиак, из глюкозы образуется этанол. Единственным источником ATP здесь является субстратное фосфорилирование [уравнение (5.56)]. B такой ситуации относительно высокие затраты субстрата на поддержание клеток приведут к тому, что сравнительно большие количества глюкозы будут расходоваться в реакциях диссимиляции. Это в свою очередь приведет к регенерации большего количества NADH, не использующегося в сколько-нибудь значительных количествах в реакции биосинтеза [уравнение (5.55a)], поскольку степени восстановленности субстрата и биомассы примерно одинаковы. Восстанавливающие эквиваленты будут использоваться в образовании продукта метаболизма по уравнению реакции (5.59a), что приведет к его накоплению в среде, поскольку степень восстановленности этанола выше степени восстановленности субстрата (глюкозы). Напротив, в аэробных условиях, когда целью процесса часто является синтез метаболитов третьего или четвертого типов, повышение расхода субстрата на поддержание клеток приводит к снижению выхода продукта метаболизма за счет интенсификации утилизации субстрата при выработке энергии.
Очевидно, метаболические превращения можно описывать не только уравнениями (5.53) – (5.56); и (5.59). Эти уравнения должны быть модифицированы, например, в тех случаях, когда одновременно утилизируется несколько источников углерода и(или) азота или когда продукт метаболизма содержит азот. Стехиометрические уравнения могут описывать и превращения по какому-либо определенному пути метаболизма. Действительно, сочетание стехиометрического анализа и экспериментального определения количеств использованного субстрата и образовавшегося метаболита успешно применялось для оценки потоков веществ по параллельным и разветвляющимся путям метаболизма. Более детально альтернативные стехиометрические уравнения рассмотрены в упражнениях, поскольку принципы и методы их построения очень близки принципам, изложенным в этом разделе. Обсуждение стехиометрии мы продолжим в следующем разделе, посвященном проблеме выделения тепловой энергии в метаболических процессах.
5.10.4. Стехиометрия энергетического обмена;
оценка количества выделяющейся теплоты
и соответствующих экономических коэффициентов
B клетках химическая энергия используется очень эффективно, но, как и в любом другом реальном процессе, часть энергии субстрата выделяется в виде теплоты, что, в частности, обусловливает необходимость охлаждения биологических реакторов с культурами клеток. Клетки генерируют теплоту в первую очередь за счет процессов связанного с клеточным ростом метаболизма и энергообмена. Следовательно, можно предполагать наличие примерно пропорциональной зависимости между количеством выделившейся теплоты и количеством утилизированного высокоэнергетического субстрата. B этой связи был введен особый параметр – коэффициент YΔ (отношение количества образовавшейся клеточной массы в граммах к количеству выделившейся теплоты в килокалориях), аналогичный рассмотренным выше другим экономическим коэффициентам. Если количество клеточной массы (в граммах), продуцируемой из одного грамма утилизированного субстрата, мы обозначим символом Ys, а теплоты сгорания субстрата и клеточной массы (в килокалориях на грамм) – символами ΔHs и ΔHc соответственно. то взаимосвязь между этими величинами будет выражаться следующим уравнением:
![]()
Это уравнение вытекает из приближенного энергетического баланса между двумя путями полного окисления субстрата в случае аэробного роста, схематично изображенного на рис. 5.30.
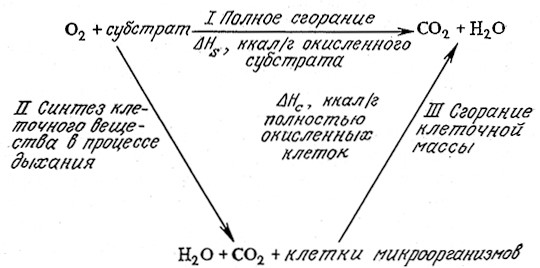
РИС. 5.30. Ориентировочный тепловой баланс утилизации субстрата.
Если окислителем в основном является кислород, то разность между количеством теплоты, выделяющейся при полном окислении одного грамма субстрата (ΔHs), и теплотой сгорания клеток (и сухого остатка внеклеточной жидкости), выросших на таком же количестве субстрата (YsΔHc), будет приблизительно равна количеству теплоты, выделяющейся в процессе роста клеток (а также выделения H2O и CO2), на одном грамме утилизированного субстрата.
Оценить точность допущений, положенных в основу уравнения (5.62) и схемы на рис. 5.30, можно на примере данных, относящихся к росту дрожжей на неразветвленных парафиновых углеводородах. Определенные экспериментальным путем величины ΔHs и ΔHc составляют 11,4 и 4,7 ккал/г соответственно; отсюда по уравнению (5.62) находим, что
![]()
Непосредственное измерение Ys и YΔ дало следующие результаты [16]:

B отсутствие экспериментальных данных теплоту сгорания клеток (как и любых других материалов) можно определить на основе следующего эмпирического факта. При переносе электронов от соединения со степенью восстановленности γs к соединениям с нулевой степенью восстановленности (например, CO2 или H2O) выделяется количество энергии, равное K•γs, где K – коэффициент, величина которого изменяется в пределах от 26 до 31 ккал на один химический эквивалент окисляемого вещества. Поскольку молекулярный кислород O2 в процессе дыхания принимает четыре электрона, то поглощение моля кислорода должно сопровождаться выделением 104–124 ккал теплоты. Ha рис. 5.31 приведены экспериментальные данные для двух бактерий, дрожжей и плесени, выросших на различных средах. Разброс результатов довольно велик, но зависимость скорости тепловыделения от скорости поглощения кислорода просматривается достаточно отчетливо.
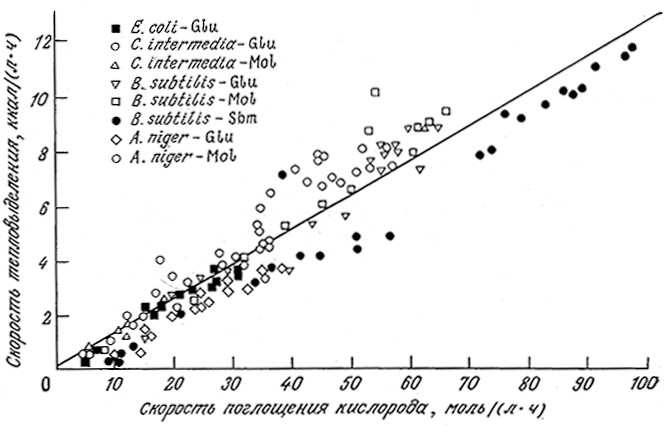
РИС. 5.31. Экспериментально найденные скорости тепловыделения и поглощения кислорода
в процессе роста ряда микроорганизмов в различных средах (Glu – глюкозная среда,
Mol – среда на основе мелассы, Sbm – среда на основе соевых бобов).
Наклон прямой регрессионной зависимости равен 124±3 ккал/моль O2.
B качестве примера оценим теплоту сгорания клеток Pseudomonas fluorescens, растущих на глюкозной среде. Для этого прежде всего запишем уравнение реакции сгорания клеток в расчете на экспериментально найденную «брутто-формулу», приняв, что продуктами сгорания являются CO2, H2O и N2:
CH1,66N0,20O0,27+1,28O2 → CO2+0,10N2+0,83H2O (5.63)
клетки
Далее определим теплоту, выделяющуюся при сгорании бактерий по уравнению (5.63), приняв теплоту сгорания врасчете на 1 моль O2 равной 104 ккал:
![]()
При этом мы не учли, однако, что сухое вещество клеток содержит и золу. Если в сухом клеточном веществе содержится 10% золы, то теплота сгорания клеток будет равна
![]()
Таблица 5.12. Экономические коэффициенты для бактерий, растущих на средах с различными источниками, углеродаa
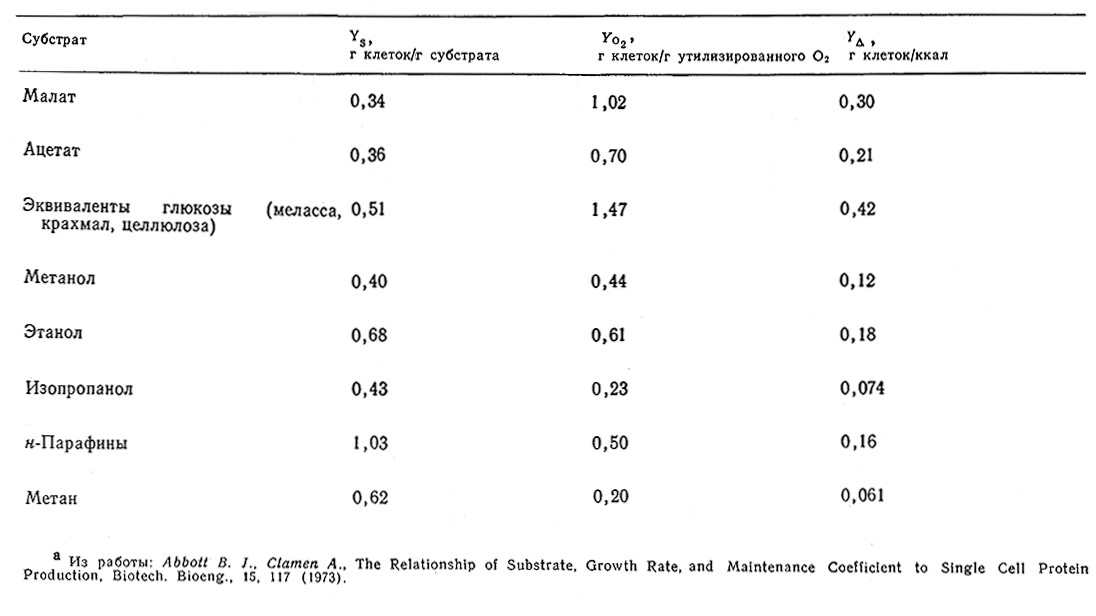
Значение YΔ зависит от природы как микроорганизма (влияющего на ΔHc), так и утилизируемого субстрата (влияющего на ΔHs). B табл. 5.12 приведен ряд вычисленных значений коэффициентов УΔ в зависимости от природы субстрата. Обратите внимание на то, что в общем случае углеводороды обеспечивают большее тепловыделение, чем частично окисленные соединения [YΔ(СН4)< YΔ (СН3ОН); YΔ (н-алканы)<YΔ(глюкоза)]. Следовательно, более восстановленные субстраты в большей степени требуют отвода тепла от биореактора. Влияние энергетической стехиометрии на экономику процессов рассмотрено в гл. 12.
B процессах брожения или очистки сточных вод субстратами часто являются смеси множества веществ с различными теплотами сгорания. Сервици и Боуген [18] отметили, что стехиометрическое отношение m0 (число молей O2, необходимого для· полного окисления 1 моль субстрата) для ряда соединений пропорционально стандартной свободной энергии сгорания ΔGo. Например, для углеводов, промежуточных соединений цикла TKK и некоторых продуктов гликолиза
ΔGo=–116m0 ккал/моль субстрата (5.66)
a для ароматических соединений, спиртов и алифатических кислот
ΔGo=– 104m0 ккал/моль субстрата (5.67)
[Хаттори (ссылка [4] в гл. 13) отмечал, что если известна величина химической потребности в кислороде (ХПК), выраженная в граммах кислорода на моль, то вместо то в этих уравнениях можно применять ХПК/32.] Усредненную свободную энергию полного окисления смеси субстратов можно определить суммированием свободных энергий окисления всех индивидуальных субстратов:
![]()
где i – субстраты; Mi- – число молей i-го субстрата; ΔGio – хвободная энергия полного окисления i-гo субстрата.
Оказалось также, что экономический коэффициент Y процесса, в котором участвуют несколько видов одноклеточных организмов, можно определить так же, как и в случае описанных выше процессов с участием микроорганизмов одного вида (бактерий или дрожжей). Сервици и JBoyreH [18] определили средние экономические коэффициенты Y̅s (выраженные в граммах клеток на моль субстрата) для активного ила (см. тл. 14), содержащего множество микроорганизмов и большое •число субстратов, и нашли (рис. 5.32), что
Y̅s = 0,108AG̅o г клеток/моль субстрата (5.69)
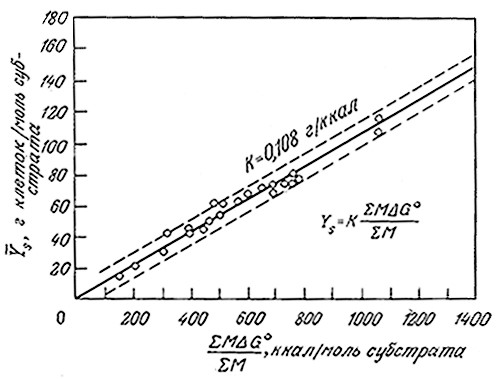
РИС. 5.32. Зависимость среднего экономического коэффициента роста
активного ила от средней свободной энергии окисления субстратов.
При данном Y̅s все другие (величины, входящие в уравнение (5.62), легко определить экспериментально, следовательно, ив этом случае можно вычислить YΔ.
Следует ожидать, что величина коэффициента в уравнении (5.69) зависит от вида микроорганизма, поэтому опять-таки желательно экспериментальное определение этого коэффициента по отношению участвующему в процессе организму (или организмам). В то же время, предполагая существование пропорциоиальной зависимости между Y̅s и ΔG̅°, Сервици и Боуген исходили из линейной зависимости между средиим экономическим коэффициентом Y̅s и числом ΝΑτρ молекул ATP, синтезируемых в ходе утилизации 1 моль субстрата. Поскольку Y̅s есть нечто иное, как количество клеток (в граммах), синтезируемых из 1 г субстрата, то коэффициент пропорциональности· между Ys и ΝΑTP представляет собой массу клеток (в граммах), синтезируемых в процессе утилизации 1 моль ATP. Известно, что последняя величина приблизительно постоянна для большого числа анаэробов, но изменяется в гораздо более широких пределах n случае аэробных организмов (разд. 5.9.2). B отсутствие болес надежных данных уравнение (5.69) в общем случае может служить основой для оценки систем, состоящих из нескольких субстратов и микроорганизмов. Точность такой оценки, по-видимому, не превышает ±20–30%, о чем наглядно·свидетельствуют корреляционные данные, приведенные на рис. 5.32.
Упоминавшаяся выше взаимосвязь между числомучаствующих в процессе электронов и внутренней энергией вещества может быть использована для оценки максимально возможного выхода органического вещества йз органического субстрата. Долю электронов, переходящих в процессе реакции от субстрата к продуктам метаболизма, ζρ можно определить по уравнению

Последний член правой части уравнения (5.70) представляет собой экономический коэффициент Yр/s. Число участвующих в яроцессе электронов в 1 г органического вещества можно выразить как σγ/12, где σ – массовая доля углерода в соединении и γ – степень восстановленности этого углерода. Подставив это выражение в уравнение (5.70), получим
![]()
Поскольку энергии субстрата и продукта метаболизма приблизительно пропорциональны содержанию в них участвующих в реакции электронов, то параметр ζρ можно интерпретировать и как энергетический коэффициент выхода продукта метаболизма из субстрата. B этом случае, очевидно, коэффи- циент ζρ не должен превышать единицы. Следовательно, верхний предел выхода продукта метаболизма YP/smax можно определить по уравнению (5.71) при ζρ = 1 :
![]()
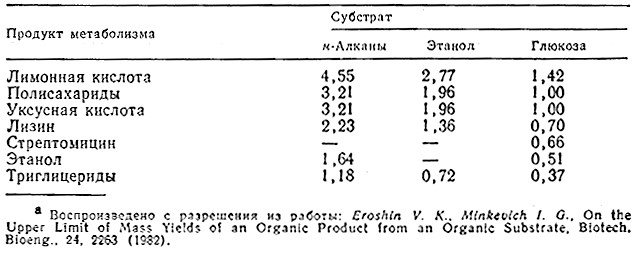
Значения Yp/smax для нескольких субстратов и продуктов метаболизма приведены в табл. 5.13.
Таблица 5.13. Максимальные значения выходов продуктов метаболизма пo массе Ymaxp/s
(выраженные в граммах продукта метаболизма на 1 г субстрата), вычисленные по уравнению (5.72)a
5.10.5. Стехиометрия фотосинтеза
Оценка выходов продуктов реакции фотосинтетического восстановления СО2 до углеводов важна как в процессах производства продуктов питания, так и для определения скоростей воспроизводства исходного сырья при получении биомассы. Известные сведения о последовательности реакций фотосинтеза и сопутствующих потоках электронов позволяют сделать вывод, что теоретически возможная эффективность фотосинтеза (выраженное в процентах отношение свободной энергии глюкозы к свободной энергии поглощенного излучения при 700 нм) составляет 35%. Конечно, эта величина представляет собой предельное значение, только теоретически достижимое в идеальных условиях. Здесь не учтены такие факторы, как утилизация в фотосинтезе только части солнечной радиации (соответствующий понижающийкоэффициент равен приблизительно 0,43), отражение света и затенение листьев (понижающий коэффициент 0,80 или меньше), темновое дыхание (соответствующий коэффициент может изменяться в широких пределах; более или менее типичная величина составляет 0,67). Умножив все эти коэффициенты на теоретическую эффективность фотосинтеза, можно определить реальную (высшую) эффективность, составляющую около 8%.
Соответствующее количество биомассы (в виде крахмала), продуцируемое на единице площади (м2) в единицу времени (например, за1 сут), можно оценить следующим образом:
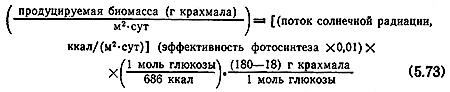
Интенсивность солнечной радиации зависит от времени года и географической зоны. Например, средняя интенсивность солнечной радиациив США составляет 3930 ккал/(м2•сут), а на юго-западе США в летний период достигает 6775 ккал/(м2 Х сут). Последний сомножитель уравнения (5.73) учитывает потерю одной молекулы воды каждой молекулой глюкозы, включаемой в полимерную цепь крахмала.
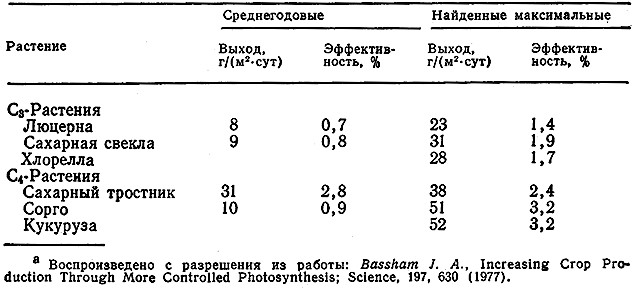
Если имеются экспериментальные данные, характеризующие продуктивность процесса образования биомассы и интенсивность солнечной радиации, то по уравнению (5.73) можно рассчитать действительную эффективность фотосинтеза в растениях и водорослях (табл. 5.14). Найденные таким путем величины лежат в пределах от 0,8 до 3,2 % , т. е. намного ниже теоретической оценки. Обратите внимание также на то, что эффективность в группе фотосинтезирующих так называемых С4 растений значительно выше, чем в группе С3-растений. Ниже мы вкратце рассмотрим биохимическую основу этого различия.
Таблица 5.14. Экспериментально найденные среднегодовые и максимальные значения
эффективности и продуктивности фотосинтеза в некоторых растенияха
Явление фотодыхания (светового дыхания), т. е. поглощение кислорода и одновременное выделение СО2 на свету, представляет собой важный процесс, влияющий на общую эффективность роста фотосинтезирующих организмов. B этом процессе происходящие в растении реакцйи фиксации углерода приводят к промежуточному соединению – рибулозо-1,5-дифосфату (см. разд. 5.6.1), который далее распадается следующим образом:
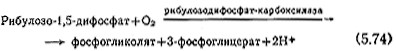
Затем гидролизуется фосфогликолят, образуя гликолят, который в свою очередь, в органоидах растительной клетки превращается в глицин и другие вещества.
B этом окислительном процессе не образуется ATP и не высвобождаются электроны; следовательно, здесь расходуется энергия фотосинтеза. B то же время реакция окисления (5.74) ингйбируется высокими концентрациями CO2. B клетках C4-растений, в которых цикл Калвина (рис. 5.15) любопытным образом видоизменен, поддерживается относительно высокая концентрация CO2. B непосредственно контактирующих с воздухом клетках мезофилла С4-растений осуществляется ряд химических превращений, которЫе суммарно можно выразить следующим уравнением:
Клетки мезофилла:
Пируват+СО2+АТР+2Н2О → малат+АТР+2Рi (5.75)
Образующийся таким образом малат диффундирует в соседние клетки обкладки проводящего пучка, в которых реализуются реакции цикла Калвина. Здесь включенный в малат CO2 выделяется в соответствии с реакцией
Малат – пируват+СО2 → (5.76)
B конечном счете в этом метаболическом цикле для поддержания обеспечивающей минимум фотодыхания высокой концентрации CO2 вблизи от рибулозодифосфат-карбоксилазы расщепляются две высокоэнергетические фосфатные связи. Отсюда следует, что фотосинтез 1 моль глюкозы дополнительно требует 12 моль ATP. Таким образом в С4-растениях энергия, очевидно, расходуется на два конкурирующих процесса: цикл реакций транспорта CO2 и усиленное фотодыхание (в отсутствие цикла транспорта CO2). Интересно отметить, что энергия активации реакции фотодыхания (5.74) превышает энергию активации реакции карбоксилирования (5.37), которая также катализируется рибулозодифосфат-карбоксилазой. Возможно, именно этот факт может объяснить, почему Сграстения шире распространены в тропиках, а С3-растения преобладают в умеренной зоне.

