Мышечная ткань — это часть мяса, обладающая наибольшей пищевой ценностью. Она представляет собой совокупность количественно преобладающих мышечных волокон и соединительнотканных оболочек.
Морфологический состав. Отдельное мышечное волокно можно рассматривать как гигантскую многоядерную клетку. Ее оболочка — сарколемма — представляет собой двойную мембрану. Диаметр развитого мышечного волокна составляет от 10 до 100 мкм, а длина его обычно соответствует длине мышцы. Мышечные волокна содержат нитевидные образования — миофибриллы, расположенные параллельно оси волокна. Миофибриллы окружены жидкой фазой — саркоплазмой, в которой находятся ядра, митохондрии, рибосомы, лизосомы и другие клеточные органоиды. Ядра мышечного волокна, имеющие вытянутую форму, расположены непосредственно под сарколеммой.
Саркоплазма составляет 35—40% клетки. Это неоднородная система, состоящая из полужидкого белкового золя, в котором содержатся включения гликогена липидов, и из эндоплазматической сети (саркоплазматический ретикулум) — сложной системы тончайших трубочек и пузырьков (цистерн) Саркоплазматический ретикулум соединяет отдельные участки миофибрилл между собой и сарколеммой.
Миофибриллы характеризуются поперечно-полосатой ис- черченностью, создаваемой в результате чередования темных (анизотропных) и светлых (изотропных) участков, которые соответственно называются Л-цисками и 1-дисками (рис. 1). Z-линии, расположенные в середине 1-диска, ограничивают повторяющиеся участки миофибрилл, называемые саркомерами. Длина саркомера 2,5—3 мкм. Каждая миофибрилла состоит из нескольких сот саркомеров. Кроме Z-линии различают также М-линию и Н-зону, занимающие центральную часть А-ди- ска. При сокращении мышц длина саркомера может уменьшаться на 25—50% от первоначальной величины.
Химический состав. Содержание отдельных групп химических веществ в мышечной ткани составляет: вода — 72—80%; белки—16,5—20,9; азотистые экстрактивные вещества — 1 —1,7; безазотистые экстрактивные вещества — 0,7—1,4; липиды— 2—3; минеральные вещества — 1—1,5%- Белки, составляющие около 80% сухих веществ мышечной ткани, в решающей степени определяют пищевую ценность, физико-химические показатели мяса, а также особенности его изменений при технологической обработке.
Белки. Белки, входящие в состав мышечной ткани, различны по аминокислотному составу, строению, физико-химическим свойствам и биологическим функциям. Они подразделяются на три основные группы: саркоплазматические (35% всех мышечных белков), миофибриллярные (45% всех мышечных белков) и белки стромы. Состояние мышечных белков определенным образом влияет на консистенцию, водоудерживающую, эмульгирующую способность, адгезионные свойства и цвет мяса.
Белки саркоплазмы. К саркоплазматический белкам относятся белки, характерным свойством которых является растворимость в растворах невысокой ионной силы. Все белки этой группы, за исключением миоглобина, представляют собой сложные гетерогенные системы, близкие по физико-химическим свойствам, что затрудняет их идентификацию. Разделение этих белков на миоген, глобулин X и миоальбумин носит весьма условный характер.
На долю белков фракции миогена приходится около 20% всех белков мышечной ткани. Молекулярная масса миогена составляет от 81000 до 150 000. Изоэлектрическая точка находится в пределах pH 6,0—6,6, температура коагуляции в растворе 55—66°С. Аминокислотный состав этой группы белков хорошо сбалансирован по незаменяемым аминокислотам. Белки фракции миогена выполняют ряд ферментативных функций, в частности регулируют превращения углеводов.
Белки фракции глобулина X составляют около 20% всего количества белков мышечной ткани. Эта группа белков проявляет свойства, характерные для глобулинов. Изоэлектрическая точка глобулина X соответствует pH 5,2. Температура коагуляции в растворе около 50°С. Биологическая роль его не совсем ясна.

Количество миоальбумина составляет 1—2% от общего содержания белка в мышечной ткани. Миоальбумин относится к типичным альбуминам. Изоэлектрическая точка этого белка находится при pH 3,0—3,5. Температура коагуляции миоальбумина равна 45—47°С.
Миоглобин —это белок, обусловливающий характерную красную окраску мышечной ткани. Содержание мио- ьпобина в мышечной ткани составляет около 1% и различается в зависимости от возраста животного и вида мышц. Функция миоглобина в тканях состоит в транспортировании кислорода, доставляемого гемоглобином крови к ферментным системам клеток. Группы мышц, выполняющих большую физическую нагрузку, содержат относительно больше миоглобина и соответственно имеют более темную окраску. С возрастом содержание этого белка в мышечной ткани увеличивается. Молекулярная масса миоглобина крупного рогатого скота 17 000, свиней — 16 500.
Молекула миоглобина состоит из белковой части — глобина, (около 94% общей массы) и простетической группы — тема. В молекуле гема центральное место занимает атом железа.
Миоглобин легко присоединяет кислород с образованием ярко-красного пигмента—оксимиоглобина. При этом железо гема не окисляется, а остается двухвалентным, благодаря тому что гем в молекуле миоглобина окружен неполярным белком. Длительный контакт с кислородом приводит к окислению миоглобина и появлению метмиоглобина, который окрашен в коричневый цвет.
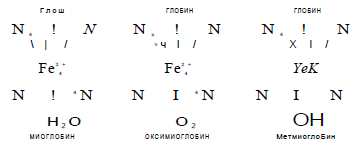
В процессе промышленной переработки мяса миоглобин подвергается различным превращениям. При тепловой обработке сопровождающейся денатурацией хромопротеидов, образуются гемохромы и гематины. При этом цвет мяса изменяется асного до серо-коричневого.
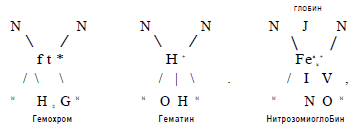
Сохранение характерной окраски мясопродуктов при тепловой обработке обеспечивается введением нитрита. Образуется нитрозомиоглобин, который при денатурации глобина в процессе варки переходит в нитрозомиохром, сообщающий розовокрасную окраску солено-вареным изделиям.
В саркоплазме присутствует белок, обратимо связывающий ионы кальция,— кальмодулин. Являясь регуляторным белком, кельмодулин играет роль посредника во многих ферментативных реакциях, активируемых Са*2. Этот белок влияет на процесс мышечного сокращения, изменение консистенции мяса при его хранении.
Миофибриллярные белки. В состав миофибрилл входят специализированные белки сократительной системы скелетной мускулатуры: миозин, актин, актомиозин, тропомиозин, тропонин и др.
Среди собственно миофибриллярных белков на долю миозина приходится примерно 55%.
Молекулярная масса миозина составляет 450 000. Молекула белка имеет вытянутую форму (150 нм). Две длинные белковые цепочки, имеющие молекулярную массу около 200 000 каждая, образуют двойную спираль, так называемый «хвост» молекулы. Продолжением молекулы является несколько коротких полипептидных цепочек, создающих глобулярную «голову» молекулы (рис. 2).
В аминокислотный состав миозина входят все незаменимые аминокислоты. Всего в белковой молекуле миозина содержится около 5000 аминокислотных остатков. Примерно 30% из них составляют дикарбоновые. аминокислоты, что обусловливает кислые свойства миозина и его способность связывать ионы калия, кальция и магния.
Важнейшим свойством миозина является его способность катализировать расщепление АТФ на АДФ и Н3Р04. В ходе этой реакции выделяется энергия, необходимая для мышечного сокращения. Участки полипептидной цепи, обладающие- АТФазной активностью, сосредоточены в «голове» молекулы.

Именно этот участок молекулы миозина взаимодействует с актином при сокращении мышцы.
Молекулы миозина, соединяясь определенным образом («хвост к хвосту»), образуют толстые нити миофибрилл (рис. 3). Толстые нити, образующие A-диски, состоят примерно из 400 молекул миозина. От М-линии, проходящей в центре зоны Н, миозиновые нити ориентированы в противоположных направлениях. Существует предположение, что в зоне М-линии локализован особый белок (М-белок).
Содержание актина составляет примерно 25% общего количества миофибриллярных белков. Актин является полноценным белком. Существуют две формы актина: глобулярный(Г-актин) и фибриллярный (Ф-актин). Молекулярная масса Г-актина 42 000. Это водорастворимый глобулярный белок. Молекула состоит из 376 аминокислотных остатков. Ф-актин образуется в результате полимеризации Г-актина и имеет двухцепочечную спиральную структуру (рис. 4). Один виток спирали включает 13—14 молекул Г-актина. Тонкие нити миофибрилл (1-диски) образованы Ф-актином.
Сложный белковый комплекс актомиозин образуется при мышечном сокращении в результате соединения миозина с ак тином. При образовании актимиозина молекулы миозина при кпепляются «головой» к глобулам актина. Молекулярная масса актомиозина изменяется в интервале от 1600 000 до 3 900 000.
Тропомиозин, содержащийся в тонких нитях миофиб рплл, составляет 4—7% миофибриллярных белков. Молекулярная масса около 70 000. Молекула тропомиозина представляет собой две спирали длиной 40 нм. В тонких нитях тропомиозина располагается внутри цепочки Ф-актин на отрезках, соот ьетствующих по длине семи глобулам Г-актина.
Тропонин — глобулярный белок, входящий в состав тон ких филаментов (см. рис. 4). Количество тропонина составляет примерно 2% миофибриллярных белков. Молекулярная масса — около 80 000. Сферическая молекула тропонина состоит из трех неодинаковых субъединиц, выполняющих различные регуляторные функции. Молекулы тропонина связывают Са2+ и инициируют АТФ-азную активность миозина.
Рассмотренные миофибриллярные белки принимают участие в акте сокращения мышечной ткани. Источником энергии мышечного сокращения является химическая энергия гидролитического распада АТФ. Катализатором процесса распада АТФ является миозин. Проявление каталитической активности мио зиновой АТФ-азы обусловливается повышением в системе концентрации ионов Са2+ в результате их выделения из саркоплазматического ретикулума. В живой мышце процесс выделения Са2+ стимулируется поступлением нервных импульсов.
Распад АТФ приводит к переходу А актина в фибриллярную форму, что является одним из условий образования актомиозина. Взаимодействие макромолекул миозина и Ф-актина происходит с участием сульфгидрильных групп «головки» миозина.
Процессу образования актомиозинового комплекса предшествует устранение «блокирующего» действия тропонина и тропомиозина миозинсвязующий центр Ф-актина.
Миозиновая головка и глобулы Ф-актина соединяются первоначально под углом 90°, затем головка опускается на 45°. В системе появляется натяжение и актиновая нить продвигается вдоль толстой нити миозина. Совокупным результатом указанных превращений является уменьшение длины саркомера и сокращение мышечного волокна (рис. 5). Максимальное сближение Z-линий, ограничивающих саркомер, определяется длиной А-линий.
Помимо перечисленных белков, в миофибриллах содержится ряд других белков, функции которых окончательно не выяснены. Среди них можно выделить а-актинин. Это белок с молекулярной массой 95 000. По-видимому, он входит в структуру Z-линии миофибрилл. Другой белок, выделенный из миофибрилл (р-актинин), ограничивает нити Ф-актина в 1-дисках.
Десмин— белок, который в виде нитей участвует в построении Z-линий миофибрилл.
Белки стромы. Эти белки входят в состав сарколеммы и соединительнотканных оболочек, окружающих мышечные волокна. Основными белковыми компонентами стромы являются коллаген и эластин. В межклеточном веществе мышечной ткани содержатся муцины и мукоиды.
Липиды. Содержание липидов в мышечной ткани составляет около 3% и колеблется в зависимости от вида, пола, возраста, упитанности животных. Часть липидов, в основном фосфолипиды, входит в состав миофибрилл, клеточных мембран, митохондрий, саркоплазматического ретикулума.
Липиды, являющиеся запасным энергетическим материалом, присутствуют в саркоплазме, в межклеточной соединительной ткани и представлены главным образом триглицеридами. Содержание полиненасыщенных жирных кислот, входящих в состав липидов, значительно ниже в липидах мышечной ткани свиней, чем у жвачных животных.
Экстрактивные вещества. К экстрактивным веществам, подразделяемым на азотистые и безазотистые, относятся вещества, извлекаемые из мышечной ткани водой. Их прижизненная функция состоит в участии в разнообразных реакциях обмена веществ и энергетических процессах в тканях. Присутствие экстрактивных веществ и продуктов их химических превращений в процессе автолиза во многом обусловливает органолептические показатели мяса.
К группе азотистых экстрактивных веществ относятся не белковые вещества, содержащие азот. Среди них конечные и промежуточные продукты азотистого обмена: мочевина, мочевая кислота, пуриновые основания, свободные аминокислоты и др. Среди свободных аминокислот наиболее высокое содержание характерно для глютаминовой кислоты (0,12%).
Важное значение для формирования вкусоароматических характеристик имеют следующие специфические азотистые экстрактивные вещества мышечной ткани: карнозин, ансерин, креатин, креатинфосфат, карнитин, глютатион, свободные нук леотиды (АТФ, АДФ и др.). Содержание ансерина в мышечной ткани птиц значительно выше, чем в говядине и свинине. Отношение ансерина к карнозину характерно для определенных видов мышечной ткани и соответственно составляет для мышечной ткани мяса птицы, говядины и свинины 2,5; 0,2 и 0,1. На долю креатина (метилгуанидинуксусной кислоты) и креатинфосфата приходится до 60% небелкового азота мышечной ткани. Эти экстрактивные вещества принимают участие в химических процессах, связанных с мышечным сокращением.
Свободные нуклеотиды выполняют в живой мышечной тка ни важную роль в обменных процессах и химических реакциях, результатом которых является выделение энергии, используемой в мышечном сокращении.
К важнейшим безазотистым экстрактивным веществам относятся гликоген п различные продукты его превращений. Общее количество компонентов этой фракции составляет около 1%. Гликоген является энергетическим материалом, который накапливается в состоянии покоя и расходуется в процессе мышечной работы. Количественное соотношение между гликогеном и продуктами его распада зависит от условий предубой- ного содержания животных и уровня развития автолитических изменений после убоя. Распад гликогена гликолитическим путем приводит к образованию молочной кислоты, фосфорных эфиров гексоз и других соединений, при амилолизе появляются глюкоза, мальтоза и другие олигоглюкозиды. Количество молочной и содержащихся в незначительных количествах янтарной, пировиноградной и других кислот и определяет величину pH мышечной ткани.
Витамины. Витамины мышечной ткани представлены в основном водорастворимыми витаминами. В мышечной ткани содержатся В] (тиамин), В, (рибофлавин), В, (пиридоксин), РР (никотинамид), В, (пантотеновая кислота), биотин (витамин Н), парааминобензойная кислота, инозит, холин, фолиевая кислота, В12, В15 (пангамовая кислота). По количественному содержанию мышечная ткань является важным источником витаминов группы В. Витамины этой группы в разной степени разрушаются при тепловой обработке. Например, витамин В, (при pH 7,0) в процессе нагревания до 97°С в течение 1 ч теряет активность на 80%. Витамин В2 при pH 7,2 при нагревании 1 ч до 120°С разрушается почти на 50%. Витамин В, устойчив к нагреванию, но разрушается под действием света и окислителей. Витамин В12 в нейтральной среде не теряет активности при нагревании до 121 °С в течение 15 мин.
Минеральные вещества. Содержание минеральных веществ в мышечной ткани составляет 1—1,5%. Среди них в наибольших количествах присутствуют калий, натрий, магний, кальций, железо, цинк, фосфор, сера, хлор. Многие катионы связаны с белковыми веществами мышечной ткани, и часть из них в свободной форме появляется после убоя.
В мышечной ткани присутствуют также микроэлементы: медь, марганец, кобальт, молибден и др.

