К дрожжам, используемым для производства шампанского, предъявляется ряд специфических требований: они должны обладать способностью сбраживать сахар при высоком содержании этанола (свыше 10 % об.), диоксида углерода (6–8 г/л), повышенном давлении (0,5 МПа), низком рН (2,8–3,2), наличии диоксида серы (50–120 мг/л) и при пониженной температуре (8–15 °С). При этом в процессе вторичного брожения дрожжи должны синтезировать гамму веществ, определяющих вкус и букет шампанского, а также способствовать накоплению в шампанском связанных форм СО2, от которых зависят игристые свойства шампанских вин. Наряду с этим в процессах формирования шампанского необходимо учитывать и влияние продуктов распада дрожжей, переходящих в шампанизированное вино при длительной выдержке. Наконец, не безразлична для технологии и структура осадков дрожжей. Так, для бутылочной шампанизации используют дрожжи, образующие зернистый осадок, легко переводимый на пробку в процессе ремюажа. Для резервуарной периодической шампанизации применяют штаммы, быстро оседающие на стенках резервуара. Для шампанизации вина в потоке используют дрожжевые клетки, образующие осадок пылевидной структуры.
7.1. ХАРАКТЕРИСТИКА ДРОЖЖЕЙ
Шампанские дрожжи относятся к роду Saccharomyces виду oviformis (bayanus) или vini. Они имеют овальную форму и средние размеры 7x6 мкм.
Дрожжевая клетка является организмом, в котором протекают многообразные биохимические реакции синтеза белков и других компонентов, обеспечивающие ее жизнедеятельность и размножение. Эти функциональные особенности обусловливают сложную структурную организацию дрожжевой клетки.
Дрожжевая клетка состоит из клеточной стенки, цитоплазматической мембраны, ядра, митохондрий, рибосом, вакуолей, эндоплазматического ретикулума, аппарата Гольджи, лизосом. Каждый органоид клетки имеет мембрану и внутреннюю структуру, соответствующую его функциям. Роль отдельных морфологических структур в жизнедеятельности клеток различна и крайне многообразна.
Помимо описанных органоидов в дрожжевых клетках обнаруживают отдельные гранулы запасных питательных веществ: липидов, гликогена и волютина – комплекса липопротеида, РНК, полифосфатов и ионов магния. Таким образом, высоко- дифференцированная организация клетки, наличие функционально различных органоидов и мембран позволяют дрожжевой клетке обеспечить взаимосвязь и регуляцию процессов биосинтеза и распада отдельных соединений, происходящих в определенных субклеточных структурах.
Дрожжевая клетка построена из большого числа химических веществ, состав которых зависит от расы дрожжей, физиологического состояния, условий культивирования. Соотношение элементов в клетке следующее (в %): углерод – 46, кислород – 30, азот – 9,1, водород – 6,9, неорганические вещества – 8. В дрожжевой клетке около 67 % воды и 33 % сухих веществ. В составе веществ клетки различают неорганические (5–10 %) и органические (90–95 %). Из неорганических элементов преобладают фосфор и калий, в значительно меньших количествах содержатся сера, кальций, натрий, хлор, железо, медь, марганец, цинк, молибден, кобальт, хром и др. Органические вещества в основном включают белки (55 %), нуклеиновые кислоты (30%), полисахариды (12–28%), липиды, свободные аминокислоты, витамины и др.
Углеводы дрожжей в основном представлены полисахаридами: маннаном, глюканом, гликогеном и дисахаридом трегалозой. Маннан и глюкан являются структурными полисахаридами, гликоген и трегалоза – запасными питательными веществами. В дрожжах также найдены пентозаны, глюкозамин и хитин.
Из азотистых веществ в дрожжах содержатся белки, пептиды, свободные аминокислоты, нуклеиновые кислоты. В составе фосфорных соединений идентифицированы ортофосфаты, полифосфаты, соединения фосфора с сахарами, нуклеозидами, инозитом, липидами. Дрожжи являются источником многих витаминов группы В, Е, инозита, холина, содержат эргостерин.
В процессе спиртового брожения и выдержки отмеченные компоненты дрожжей в клетке подвергаются различным превращениям. Биохимические реакции в клетке катализируются ферментами. В дрожжах содержится большое число ферментов, ускоряющих сложные биохимические процессы обмена веществ (метаболизма) клетки. Нормальная жизнедеятельность клетки, как известно, предполагает распад питательных веществ и биосинтез новых компонентов: углеводов, кислот, азотистых веществ, липидов и др. Протекание этих процессов сопровождается образованием или потреблением энергии. Биохимические реакции трансформации питательных веществ среды, накопления энергии и биосинтеза структурных компонентов протекают в дрожжевой клетке согласованно. Координация между различными метаболическими процессами распада (катаболизма) и синтеза (анаболизма) в дрожжевой клетке обеспечивается благодаря сложнейшим регуляторным механизмам: регулированием активности и биосинтеза ферментов. Благодаря этому дрожжевые клетки могут приспосабливаться к неблагоприятным условиям и, например, в зависимости от состава среды изменять состав внутриклеточных ферментов. В связи с этим подбор соответствующих условий и сред для размножения дрожжей может оказать существенное влияние на набор индуцибельных ферментных систем в клетках и, следовательно, на состав продуктов брожения и автолиза. Таким образом, дрожжевая клетка является как бы миниатюрной автономной «биохимической фабрикой», в которой непрерывно перерабатываются питательные вещества, синтезируются новые необходимые для жизни компоненты и экскретируются ненужные продукты обмена. Совершенно очевидно, что жизнедеятельность дрожжевых клеток в виноградном сусле и в шампанизируемом вине влияет на состав вина. В свою очередь состав среды (сусла или вина) влияет на метаболизм дрожжевых клеток.
7.2. РОЛЬ ДРОЖЖЕЙ ПРИ ПРОИЗВОДСТВЕ ИГРИСТЫХ ВИН
В производстве игристых вин роль дрожжевых клеток особенно велика, так как проводится два вида брожения как минимум на двух разных штаммах дрожжей; зачастую в брожении участвуют не один, а комплекс штаммов, кроме того, виноматериалы, и особенно шампанизируемое вино, выдерживают на дрожжах. Наряду с этим дрожжевые клетки применяются при подготовке виноматериалов для ассимиляции кислорода, при обработке холодом и теплом.
Штаммы дрожжей, используемые в производстве, образуют продукты, сильно различающиеся по качественному и количественному составу.
Концентрации индивидуальных веществ, образующихся при брожении на отдельных расах, различаются иногда в несколько десятков раз. Так, дикие дрожжи продуцируют больше эфиров и меньше высших спиртов и жирных кислот, чем винные дрожжи [5]. Большой интерес представляет явление различного соотношения н-пропанола, изобутанола и изоамилола в соках, сброженных отдельными штаммами. Для дрожжей ФШ-2, Агавнатун и Штейнберг-92 количества синтезированных н-пропа- нола и изобутанола примерно одинаковы, большинство же дрожжей в этот период дают более высокую концентрацию н-пропанола, a S. ludwigii – изобутанола. Указанная закономерность, вероятно, обусловлена различной активностью ферментных систем клетки и может быть использована как биохимический тест для характеристики отдельных таксономических групп дрожжей.
В соке с 4 % об. спирта различные расы незначительно различаются по образованию ацетальдегида, метилацетата, этилпеларгоната, этилкаприната, но сильно – по синтезу этилацетата, высших спиртов, жирных кислот и ряда сложных эфиров. Дикие дрожжи продуцируют повышенные количества этилацетата, который при чрезмерном накоплении может обусловить «штих» вина, но совершенно необходим в небольшой концентрации.
Следует подчеркнуть, что аромат соков, в сбраживании которых принимают участие дикие дрожжи, и особенно Н. apiculata, отличается эфирномасляными и цветочными тонами. В аромате соков, сброженных на винных дрожжах, эти оттенки менее выражены. Анализ букетистых веществ показал, что при брожении на спонтанной микрофлоре, среди которой "Основная роль в начальный период до накопления 4 % об. спирта принадлежит диким дрожжам, и в частности Н. apiculata, получаются Вина с высокой концентрацией сложных эфиров. С этой точки зрения спонтанное брожение, практикуемое в районах качественного виноделия, имеет определенный смысл.
Полученные после окончания брожения виноматериалы различаются также по составу терпенов. Наибольшее число терпеноидов и ароматических соединений получено в виноматериале, сброженном дрожжами расы Штейнберг-92.
После окончания брожения шампанские виноматериалы отделяют от дрожжевого осадка или выдерживают на дрожжах. Интенсивность автолитических процессов также зависит от вида дрожжей. Имеющиеся данные свидетельствуют о том, что штаммы дрожжей различаются по скорости отмирания. Указанное также подчеркивает важность генетических признаков дрожжевых клеток.
Различные штаммы дрожжей выделяют различное количество продуктов автолиза. При выдержке, обработке холодом и теплом из дрожжевых клеток в среду переходит около 40 компонентов: эфиров, альдегидов, кислот, терпеноидов, причем состав этих веществ зависит как от способа автолиза, так и от штамма используемых дрожжей [3]. Существенное влияние на состав выделяемых дрожжами компонентов оказывает возраст клеток: в среде с молодыми клетками выше скорость восстановительных реакций, больше накапливается азотистых веществ, ферментов, ряда легколетучих веществ, при контакте с 1- и 3-летней культурами дрожжей среда в большей степени обогащается жирными кислотами и некоторыми сложными эфирами. Таким образом, интенсивность реакций и состав продуктов, выделяемых в вино, зависят от возраста дрожжевых клеток.
Особо велика роль дрожжей при шампанизации, так как в этом случае дрожжи трансформируют состав вина как в процессе вторичного брожения, так и при длительной выдержке шампанизированного вина на дрожжах.
Как указывал А. М. Фролов-Багреев, от вида применяемых при шампанизации дрожжей зависит развитие тонкого букета шампанского. Важное значение дрожжам в формировании качественных особенностей шампанского придавал Г. Г. Агабальянц. Штаммы дрожжей существенно различаются по биосинтезу эфиров, спиртов и альдегидов [5]. Различен и состав букетистых веществ, выделяющихся в вино при автолизе отдельных видов дрожжей. У дрожжей, выделенных из шампанизируемого вина, приготавливаемого на заводах шампанских вин нашей страны, отсутствует зависимость между бродильной функцией и качеством получаемого при этом шампанского [96]. Исходя из этого, при подборе дрожжей для шампанизации наряду с другими физиологическими свойствами необходимо учитывать биохимические признаки дрожжей, в частности биосинтез ими веществ, формирующих вкус и букет шампанского.
Для изучения роли дрожжей в сложении качественных особенностей шампанского были заложены опытные тиражи на 4 штаммах шампанских дрожжей: МШ, Штейнберг-92, ФШ-1 и ФШ-2. Опыты показали, что по скорости сбраживания Сахаров, образованию диоксида углерода, энергии размножения указанные штаммы различаются незначительно, обладают достаточно высокой активностью дыхания и брожения [5], дают примерно одинаковое содержание СО2 в образцах готового шампанского. Различия заключаются в качественном и количественном составе синтезируемых ими букетистых веществ. Так, после шампанизации с дрожжами ФШ-2 образуется наибольшее количество этиловых эфиров молочной, пеларгоновой, лауриновой и яблочной кислот, изоамиловых эфиров капроновой, каприловой и каприновой кислот, фенилэтилового спирта и капроновой кислоты. В опыте с дрожжами ФШ-1 содержание этих компонентов также высоко, накапливается много фенилэтилацетата, изобутилкаприната, этилмиристата и каприновой кислоты. Шампанизация с дрожжами Штейнберг-92 приводит к образованию повышенных количеств этиловых эфиров каприловой, каприновой и пальмитиновой кислот, изоамиллаурата, а также ряда жирных кислот: пропионовой, масляной, изовалериановой, каприловой и пеларгоновой. В шампанском, полученном на дрожжах МШ, содержится наименьшее количество почти всех букетистых веществ.
В связи с тем, что в образцах шампанского с дрожжами ФШ-2 и ФШ-1 содержится больше этиловых и изоамиловых эфиров жирных кислот и фенилэтилового спирта, его букет и вкус значительно богаче. В шампанских винах, полученных с дрожжами ФШ-1 и ФШ-2, развивается тонкий букет, характерный для бутылочного шампанского; их дегустационная оценка соответственно 9,1 и 8,99 балла. При использовании дрожжей Штейнберг-92 аромат и вкус шампанского посредственные, оценка его 8,89 балла. Брожение на дрожжах МШ дает наиболее низкокачественное шампанское с акратофорными тонами; оценка 8,7 балла.
Вид дрожжей оказывает существенное влияние на биохимические превращения аминокислот, альдегидов, высших спиртов, эфиров [3]. Штамм дрожжей определяет направленность окислительно-восстановительных реакций, величину показателей игристых и пенистых свойств отдельных вариантов. Значительно различается и скорость автолиза отдельных штаммов. Указанное обусловливает и заметные различия в формировании качественных особенностей шампанского (табл. 17).
Таблица 17
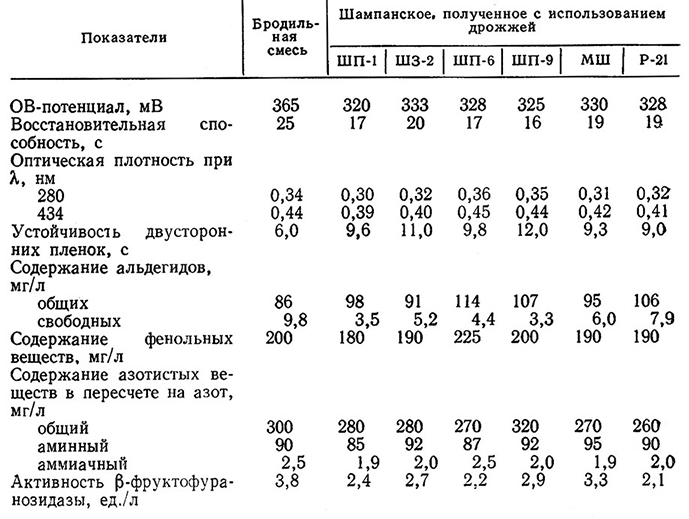
Штаммы дрожжей значительно различаются по биосинтезу в шампанском спиртов, эфиров и альдегидов (табл. 18). Так, минимальные количества отрицательно влияющих на букет шампанского ацетальдегида, изобутанола, изопентанола (метил-2- и метил-З-бутанола-1) продуцируют дрожжи ШП-1 и Р-21.
Таблица 18
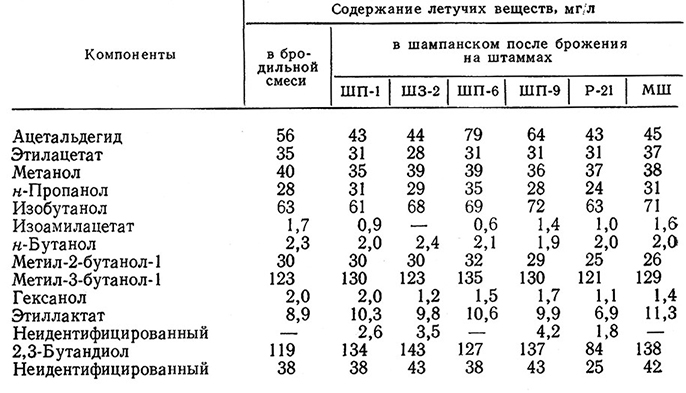
Этиллактат в небольших количествах образуют МШ, а 2,3-бутандиол – ШЗ-2.
Различия в биосинтезе отдельных компонентов и направленности биохимических процессов при вторичном брожении исследованными штаммами дрожжей оказывают существенное влияние на формирование органолептических свойств шампанского.
Наиболее высокую дегустационную оценку (9,1 балла) имеет шампанское, приготовленное с использованием дрожжей ШП-1. Ниже всех оцениваются образцы, сброженные на дрожжах МШ и Р-21 (8,75 и 8,76 балла соответственно).
Брожение На дрожжах ШП-1 дает шампанское с более низкими величинами ОВ-потенциала, оптической плотностью при длине волн 280 и 434 нм, с меньшей концентрацией фенольных веществ и альдегидов, с повышенной активностью β-фруктофу- ранозидазы и более высокой величиной устойчивости двусторонних пленок, т. е. с лучшими качественными показателями. По содержанию букетобразующих веществ различия между шампанским, полученным на дрожжах ШП-1 и Р-21, незначительны, но оценка первого шампанского на 0,1 балла выше, чем контрольного.
Выдержка шампанизируемого вина на обоих видах дрожжей в течение 5 сут при –5 °С способствует обогащению шампанского ферментами, азотистыми веществами, восстанавливающими соединениями, вследствие чего их дегустационная оценка повышается на 0,1 балла. Готовое шампанское, полученное с использованием дрожжей ШП-1, характеризуется тонким и нежным букетом, полным и свежим вкусом, хорошими игристыми и пенистыми свойствами, гармоничностью; его оценка 8,98 балла. Шампанское, выброженное на дрожжах Р-21, грубее, отличается худшей «игрой», слабым дрожжевым тоном, горчинкой во вкусе; его оценка 8,89 балла.
Штамм ШП-1 образует пылевидные осадки, легко автолизуется и обладает повышенным биосинтезом сложных эфиров и фенилэтанола, улучшающих качество шампанского. В связи с этим штамм П1П-1 перспективен для резервуарной непрерывной шампанизации. Штаммы ШЗ-2 и ШЗ-6 в отличие от ШП-1 образуют крупнозернистые, легко ремюируемые осадки, в связи с чем они перспективны для бутылочной шампанизации.
Селекция новых штаммов и практическое использование перспективных штаммов, в частности предложенного ШП-1, позволит улучшить качество Советского шампанского.
В пределах одного вида отдельные штаммы также существенно различаются между собой по физиолого-биохимическим свойствам [67]. Заметные различия в биосинтезе отдельных компонентов вызывают изменение органолептической оценки игристых вин. Так, при использовании селекционированных рас дрожжей после вторичного брожения и 6-месячной выдержки в вине содержалось 880 мг/л липидов, тогда как в контрольном образце – 550 мг/л [81]. Накопление липидов способствует улучшению показателей игристых и пенистых качеств вин. В связи с тем, что зависимость между качеством и бродильной активностью дрожжей отсутствует, при выборе культуры дрожжей определяющими должны быть объективные биохимические и физико-химические показатели, обусловливающие получение игристых вин высокого качества [96].
Наряду с положительным дрожжи могут оказывать отрицательное влияние: обусловливать появление дрожжевого, сероводородного тонов, при сбраживании на марку в отдельных резервуарах может появиться «акратофорный тон». При бутылочном способе производства осадки дрожжей совместно с другими веществами могут вызвать появление «масок» й «барров». Дрожжи ответственны за биологические помутнения готовых игристых вин,
В связи с тем, что в сусле и виноматериалах содержится разнообразная микрофлора, при брожении и шампанизации проявляют жизнедеятельность также нежелательные виды дрожжей – возбудители инфекции [1]. Некоторые из представителей вредной микрофлоры синтезируют в больших количествах летучие кислоты, альдегиды и другие компоненты, вызывающие снижение качества продукции и нарушение процесса вторичного брожения [96]. Особо благоприятные условия для длительной адаптации к основной к сопутствующей дрожжевой флоры создаются при поточной организации производства. Вместе с тем и при периодических процессах брожение зачастую осуществляется не одним добавленным штаммом» а ассоциатами дрожжей. С этим следует считаться, так как недооценка роли посторонней микрофлоры может привести к снижению качества продукции. Меры борьбы с посторонней микрофлорой (фильтрация, пастеризация) не всегда дают желаемый эффект. Стерильная фильтрация через микропористые элементы, УФ-облучение дают лучшие результаты. Для снижения отрицательного эффекта посторонних микроорганизмов применяют также повышенные концентрации засева чистой Культурой, пониженные температуры брожения, дрожжи с киллер-фактором.
7.3. ОСОБЕННОСТИ КУЛЬТИВИРОВАНИЯ ДРОЖЖЕЙ
ДЛЯ ИГРИСТЫХ ВИН
В процессе метаболизма дрожжевые клетки ассимилируют многие вещества, используя их, а также продукты их распада для получения энергии и построения новых биополимеров. Для нормальной жизнедеятельности дрожжам необходимы вода, макроэлементы (С, О, Н, N, S, Р, К, Са, Fe, Mg), витамины и микроэлементы (Mn, Zn, Си, Mo, Na, Со, Ni, Va, С1, В, Si и др.). Источниками углерода, кислорода и водорода служат углеводы и некоторые другие органические соединения (кислоты, спирты, альдегиды и др.). Дрожжи активно потребляют также молекулярный кислород, который усиливает их дыхательную функцию и активизирует процессы размножения. В качестве источника азота дрожжевые клетки используют аммиак, аминокислоты, амиды, соли аммония и, вероятно, пептиды. Имеются данные об адсорбции белков и ферментов дрожжами, при этом белки гидролизуются, а образовавшиеся аминокислоты потребляются дрожжами. Атомы серы и фосфора, входящие в состав аминокислот, белков, нуклеиновых кислот и других компонентов клетки, играют важнейшую роль в метаболизме дрожжей. Дрожжи хорошо ассимилируют сульфаты и соли ортофосфорной кислоты. Ионы калия регулируют рост дрожжевых клеток, в отсутствии калия дрожжи не размножаются. Крайне необходимы дрожжевым клеткам катионы железа, магния и микроэлементы, так как они входят в состав ферментов. Стимуляторами роста дрожжей являются многие витамины, большинство из которых известны как коферменты. Кроме того,, решающее значение имеют рН среды и температура.
Питательные вещества поступают в клетку через клеточную стенку и цитоплазматическую мембрану. Механизм проникновения компонентов из питательной среды в клетку чрезвычайно сложен и до конца не изучен. Считается, что при этом происходит как «пассивная», так и «активная» диффузия. При «активном переносе» вещество соединяется с белком (ферментом), расположенным на мембране дрожжей, при этом расходуется энергия АТФ. Таким образом, поглощаться может только тот субстрат, для которого в клетке имеется специфичный транспортный механизм. В отличие от этого ряд веществ проникает в клетку вследствие разницы концентраций их внутри клетки и в среде.
Компоненты, поступившие в дрожжевую клетку, трансформируются, при этом образуются продукты обмена, которые выделяются в среду, накапливается энергия и синтезируются новые соединения. Образующиеся биополимеры используются для замены клеточных структур и построения новых органоидов. Существует тесная связь между питанием, ростом и развитием дрожжей. Быстро растущие клетки эффективно используют питательные вещества на биосинтез клеточных компонентов и воспроизведение новых клеток.
В процессе своего роста и развития дрожжевые клетки размножаются путем почкования и деления. Период, в течение которого отделившаяся от материнской молодая клетка достигает максимальной величины и сама начинает размножаться, называют продолжительностью генерации. Выделяют 5 основных стадий развития дрожжей:
I – лаг-фаза (фаза задержки роста). В этот период, следующий после внесения культуры в питательную среду, дрожжевые клетки приспосабливаются к среде, но еще не размножаются;
II – экспоненциальная фаза, характеризуется максимальной скоростью деления клеток;
III – фаза замедленного роста, в течение которой размножающиеся клетки полностью потребляют питательные вещества среды и накапливают продукты метаболизма, тормозящие процесс размножения;
IV – стационарная фаза. Концентрация клеток становится максимальной и остается постоянной;
V – фаза отмирания. Количество клеток снижается вследствие их отмирания и автолиза.
Для каждой из описанных фаз характерны определенные скорости размножения, морфологические и физиологические свойства клеток. Это обусловливается теми биохимическими процессами, которые протекают внутри клеток.
Процесс культивирования дрожжей зависит от состава питательной среды, температуры, режима аэрации, интенсивности перемешивания и других факторов, которые могут лимитировать скорость роста культуры.
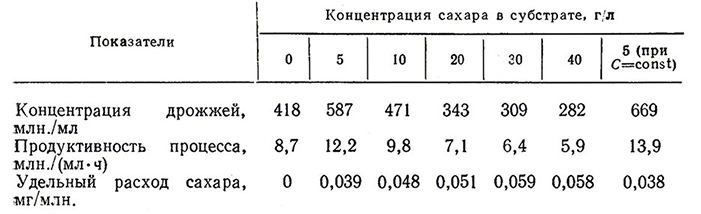
Состав питательной среды должен обеспечивать высокую скорость размножения и выход биомассы. Многие авторы (Н. Ф. Саенко, Е. И. Квасников, Н. Г. Саришвили, Н. И. Бурьян) используют для культивирования дрожжей естественные питательные среды, в частности виноматериалы для игристых вин. Для интенсификации процесса рекомендуют добавки аммиачного азота [16, 91 и др.]. В ряде стран применяют искусственные питательные среды, после чего отделяют биомассу дрожжей от культуральной жидкости. Среда для размножения должна содержать источники углерода, азотистые вещества, соли, микроэлементы. Было установлено [91], что выращивание дрожжей, можно проводить на виноматериалах без сахара или при низкой сахаристости (4–6 г/л) (табл. 19). При более высокой сахаристости наблюдается репрессия глюкозой процесса дыхания, понижается активность дыхания, сахар используется неэкономично, снижается выход биомассы, уменьшаются размеры клеток. Добавка аммиака вызывает существенное увеличение выхода дрожжей: при повышении содержания азота аммиака с 14 до 50 мг/л концентрация клеток в дрожжевой разводке возрастает с 45 до 240 млн./мл.
Таблица 19
Температура оказывает большое влияние на метаболизм дрожжей. Максимальная активность дыхания дрожжей при рН 3 проявляется при 20 °С [96].
Режим аэрации может вызывать активирование или торможение роста микроорганизмов. Для каждого микроорганизма существует определенная минимальная концентрация кислорода в среде (0,01–0,02 ммоль О2 на 1 л среды), ниже которой недостаток кислорода лимитирует рост.
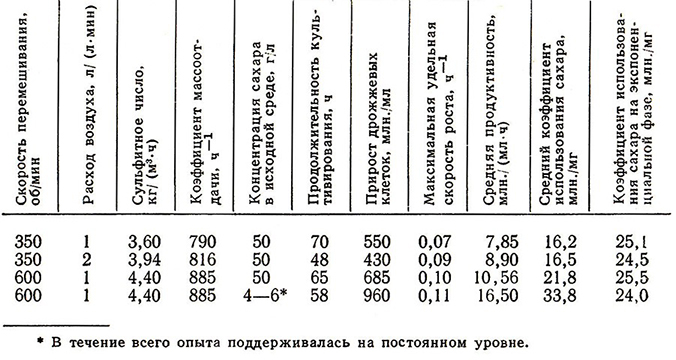
Интенсивность перемешивания зависит от конструкции перемешивающих устройств, формы аппарата, свойств культуральной жидкости. Повышенная скорость перемешивания, обеспечивающая улучшение массообмена, в сочетании с пониженным содержанием сахара в среде стимулирует процесс размножения дрожжей (табл. 20). Максимальный выход дрожжей (960 млн./мл) наблюдается при коэффициенте массоотдачи 885 ч-1. В промышленной установке максимальная продуктивность процесса и минимальный удельный расход сахара достигаются при скорости разбавления 0,025 ч-1 [96].
Таблица 20
Учет факторов, влияющих на культивирование дрожжей, и выбор оптимальных технологических режимов позволили разработать новые принципы культивирования дрожжей для игристых вин [91, 96 и др.].
Процесс культивирования дрожжей сопровождается интенсивными биохимическими превращениями компонентов среды [3]. Аэрация накладывает существенный отпечаток на биохимические реакции в дрожжевых клетках, их состав и структуру. Аэробно выращенные клетки в отличие от анаэробных менее богаты гликогеном, волютином и азотистыми соединениями, а также имеют меньшие размеры и массу. Значительно подвержен колебаниям и ферментный состав дрожжевой клетки, особенно комплекс дыхательных ферментов. Амплитуда изменения активности ферментов дрожжевой клетки при переходе из аэробных условий в анаэробные связана с положением фермента в цепи переноса электронов. Терминальный фермент (цитохром-оксидаза), который непосредственно реагирует с молекулярным кислородом, изменяется наиболее сильно. В отсутствии кислорода в дрожжах падает активность лактат-, малат- и изо-цитратдегидрогеназы. У дрожжей, лишенных длительное время кислорода, отсутствуют цитохромоксидаза и цитохром в, уменьшается содержание цитохрома с. Однако при аэрации анаэробно выросших дрожжей происходит синтез типичных аэробных цитохромов.
В связи с тем, что при поточном производстве шампанского полученная биомасса дрожжей поступает на шампанизацию вместе с культуральной жидкостью, представляет интерес изменение ее состава с точки зрения тех продуктов метаболизма клетки, которые могут отрицательно сказаться на качестве шампанского. Анализы дрожжевой разводки, поступающей в линию шампанизации на ряде заводов, показали, что в отдельных случаях в культуральной жидкости накапливается большое количество альдегидов, что обусловлено в основном аэрацией. Так, при выращивании на шампанском виноматериале без сахара или с небольшим его содержанием (2,4 %) при аэрации вина дрожжи после 24 ч культивирования накапливают альдегидов до 400 мг/л, на среде с 5,9 % сахара они синтезируют до 260 мг/л альдегидов, а на среде с 11 %–190 мг/л. Основная часть альдегидов дрожжевой разводки при аэрации образуется из этилового спирта. Глюкоза и фруктоза в небольшой мере обогащают культуральную жидкость альдегидами, расходуясь главным образом на биосинтез биомассы дрожжей. При глубинной ферментации вин с аэрацией дрожжи интенсивно окисляют спирт в уксусный альдегид, реакция полного окисления этанола имеет меньшее значение.
Окисление содержащегося в питательной среде этанола в ацетальдегид катализируется алкогольдегидрогеназой дрожжей. В дрожжевых клетках присутствуют 2–3 ее изоэнзима, один из которых специфичен к этанолу и катализирует реакцию его дегидрирования, а другой ответствен за способность дрожжей использовать этанол в качестве субстрата.
Большое влияние на обмен дрожжей оказывает концентрация глюкозы. Окислительный обмен начинает преобладать над гликолитическим лишь после полного использования глюкозы дрожжами. Это обусловливается репрессирующим действием глюкозы на синтез ферментов окислительного метаболизма.
У S. cerevisiae глюкоза подавляет синтез алкоголь- и малатдегидрогеназ, изоцитратлиазы, мелатсинтетазы, НАД-глютамат- дегидрогеназы. Повышение степени репрессии клеток дрожжей приводит к снижению окислительной активности изолированных митохондрий, в результате чего тормозится реакция дегидрирования этанола.
Наряду с альдегидами в культуральной жидкости накапливаются повышенные количества (2–5 мг/л) диацетила, который при концентрации свыше 0,8 мг/л вызывает появление тона окисленности. Размножающиеся дрожжевые клетки интенсивно ассимилируют азотистые вещества и особенно аминокислоты. При культивировании дрожжей без аэрации содержание аминокислот в вине за три дня снижается почти в 2 раза. В условиях аэрации к концу воспроизводства дрожжей в вине почти не остается аминокислот.
Таким образом, при воспроизводстве дрожжей в питательной среде происходят интенсивные изменения составных компонентов. Аэрация, способствуя повышению выхода биомассы, вызывает глубокие окислительные процессы, вследствие чего происходит дегидрирование этанола, окислительное дезаминирование аминокислот и в среде накапливаются значительные количества свободного ацетальдегида, диацетила и других веществ. В связи с этим следует обращать серьезное внимание на режимы аэрации и не допускать глубоких изменений химического состава питательной среды. При чрезмерном накоплении в культуральной жидкости нежелательных компонентов и значительном ухудшении качества вина следует проводить предварительное сепарирование дрожжевой разводки и вводить на шампанизацию густую суспензию дрожжей. Указанное позволит исключить попадание в шампанизируемое вино культуральной жидкости и повысить качество шампанского.На оснований Проведенных исследований был предложен: способ производства дрожжей для виноделия [5], предусматривающий отделение дрожжевых клеток от питательной среды, улавливание выделяющихся при аэрации углерод- и азотсодержащих веществ, обогащение культуральной жидкости компонентами, необходимыми для размножения дрожжей, замораживание и лиофилизацию дрожжевых клеток.
По данным П. Г. Саришвили [96], накопление альдегидов к диацетила происходит в период лаг-фазы, при этом культуральная жидкость приобретает тона окисленности. После накопления дрожжевой биомассы усиливаются восстановительные процессы, приводящие к снижению ОВ-потенциала и содержания альдегидов. Выдержка дрожжевой разводки в анаэробных условиях улучшает окислительно-восстановительные показатели в вине. Кроме того, после аэробного выращивания целесообразна подготовка дрожжевых клеток к жизнедеятельности в анаэробной среде. Учитывая указанное, был предложен технологический прием, названный «активация дрожжей», предусматривающий выдержку дрожжевой разводки без доступа воздуха при температуре 8–10 °С и давлении 470–500 кПа в течение 3–5 ч, дающий возможность перестроить обмен с дыхания на брожение и восстановление аэробных продуктов обмена.
Дрожжи для производства игристых вин культивируют периодическим и непрерывным способами.
Периодический способ приготовления разводок дрожжей чистой культуры заключается в постепенном наращивании биомассы. Разводку чистой культуры дрожжей начинают готовить в лаборатории. С этой целью в пробирку с 10 мл свежей питательной среды (купаж обработанных виноматериалов с добавкой ликера до содержания сахара в среде 2–6 г на 100 мл), подвергнутой стерилизации (для стерилизации среду нагревают до 85–90 °С и выдерживают 15 мин), вносят культуру дрожжей. После размножения в период бурного брожения содержимое пробирки переливают в колбу вместимостью 250 мл со 100 мл питательной среды. Активно бродящую суспензию наливают в литровую колбу с 500 мл питательной среды, содержимое которой в стадии бурного брожения переливают в трехлитровую колбу с 1700 мл среды. Полученную разводку чистой культуры активно бродящих дрожжей переливают в дрожжевой аппарат и получают пятую генерацию дрожжей, которую используют в производстве. Производственные разводки дрожжей готовят на обработанных купажированных виноматериалах с добавкой ликера или бродильной смеси, которые предварительно подвергают стерильной фильтрации или пастеризации.
Культивирование дрожжей периодическим способом в производственных условиях проводят в специальных аппаратах с устройствами для перемешивания и аэрации. Питательную среду заливают в аппарат, в котором 1/3 объема заполнена свежей дрожжевой разводкой, включают мешалку и дозируют стерильный воздух. Когда в дрожжанке накопится необходимое количество дрожжевых клеток, аэрацию прекращают и 2/3 полученной разводки используют для вторичного брожения. К оставшейся массе добавляют новую питательную среду, и цикл повторяют. Описанный способ имеет ряд существенных недостатков, в частности полученные дрожжевые клетки обладают неодинаковой и зачастую невысокой физиологической активностью.
Усовершенствованный в СССР периодический способ предусматривает раздельное дозирование компонентов питательной среды (виноматериала и ликера) для постоянного поддержания оптимальной концентрации сахара в культуральной жидкости на уровне 5–7 г/л, а также добавление к среде раствора аммиака для повышения содержания аммиачного азота до 70 мг/л. Перемешивание среды осуществляется мешалкой со скоростью не более 600 об/мин или непрерывной циркуляцией среды центробежным насосом из нижней части аппарата в верхнюю для распыления ее в наджидкостном пространстве через кольцевой перфорированный распылитель. В процессе культивирования при температуре не выше 18 °С среду аэрируют из расчета до 0,5 л воздуха в 1 мин на 1 л культуральной жидкости. За 3–5 ч до направления разводки на вторичное брожение аэрацию прекращают. Рекомендуется полученную дрожжевую разводку адаптировать в том же аппарате к температурным условиям вторичного брожения. Из аппарата отбирают 70–75 % разводки для производственных нужд, к оставшейся суспензии добавляют свежую питательную среду и начинают новый цикл культивирования. Данный способ позволяет интенсифицировать процесс размножения, создать оптимальные условия для повышенного накопления физиологически активных дрожжевых клеток.
Непрерывное культивирование дрожжей является одним из наиболее эффективных средств управления обменом веществ, ростом и развитием микроорганизмов. При непрерывном процессе в отличие от периодического обеспечиваются постоянные условия роста, клетки получают необходимое количество питательных веществ, благодаря чему поддерживается их стабильное физиологическое состояние, появляется возможность регулирования процесса, обеспечения высокой продуктивности. При непрерывном культивировании происходит генетическая перестройка, образуются мутанты, более приспособленные к среде, т. е. имеет место селекция и адаптация клеток, селекция перспективных штаммов. Автоселекционность непрерывного культивирования благоприятствует повышению продуктивности процесса.
Н. Д. Иерусалимским предложена следующая классификация непрерывных методов:
- непрерывный без проточных сред (например, отъемный метод выращивания маточных дрожжей);
- прерывисто-проточный (проточно-циклический) с использованием твердой фазы или без нее;
- гомогенно-непрерывный с одинаковыми условиями во всех точках аппарата;
- градиентно-непрерывный в батарее аппаратов, в колонке с секциями или аппарате с твердым наполнителем.
Непрерывное культивирование дрожжей для игристых вин было предложено Е. И. Квасниковым и Н. Г. Саришвили в 1963 г. Вначале был разработан градиентно-непрерывный способ, который заключается в выращивании дрожжей в батарее аппаратов с неодинаковыми условиями культивирования и градиентом концентрации питательных веществ в разных аппаратах. Позднее был предложен гомогенно-непрерывный способ, предполагающий размножение дрожжей в одном аппарате с хорошо перемешиваемой средой и одинаковой скоростью поступления питательных веществ и выхода дрожжевой разводки из аппарата [91].
Градиентно-непрерывный способ предусматривает приготовление дрожжей в системе последовательно соединенных аппаратов, каждый из которых снабжен перемешивающими и аэрирующими устройствами и рубашками для регулирования температуры (рис. 9). Культивирование дрожжей осуществляют на питательной среде, содержащей 20–40 г/л сахара, при непрерывном перемешивании для равномерного диспергирования дрожжевых клеток и аэрации. Подачу воздуха постепенно уменьшают от первого аппарата, который аэрируют из расчета 0,6–0,8 л/ч на 1 л жидкости, к последнему, в котором аэрацию прекращают. Температуру в первом аппарате поддерживают не выше 15°С, постепенно снижая к последнему до уровня температуры в последнем аппарате бродильной батареи. Отмеченные градиенты температуры и аэрации обусловлены необходимостью подготовки дрожжевых клеток к условиям вторичного брожения.
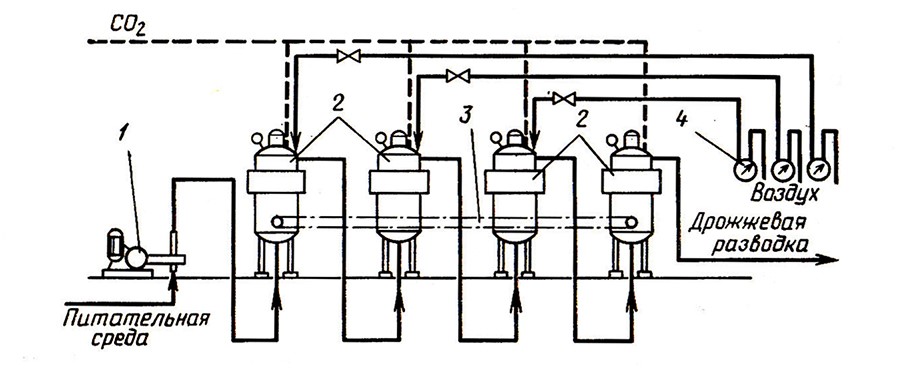
Рис. 9. Установка для культивирования дрожжей градиентно-непрерывным способом:
1 – насос-дозатор; 2 – аппарат дрожжевой; 3 – перемешивающие устройства; 4 – счетчики расхода воздуха
В пусковой период дрожжевые аппараты загружают питательной средой (купажом и ликером) и дрожжевой разводкой, начиная с последнего, с интервалами в 10–12 ч. После заполнения всех аппаратов и начала размножения дрожжей в 1-м аппарате в него начинают непрерывно дозировать питательную среду при непрерывном перемешивании и аэрации. Культуральная жидкость со взвешенными клетками дрожжей перетекает по трубопроводам из первого в последующие аппараты. В последнем аппарате в анаэробных условиях при низкой температуре дрожжевая разводка подготавливается к условиям вторичного брожения и направляется в резервуары для шампанизации.
Гомогенно-непрерывный способ предусматривает приготовление дрожжей в одноемкостной системе или спаренной установке [А. с. 492541 (СССР). – Б. И., 1975, № 43; А. с. 520396 (СССР). – Б. И., 1976, № 25; А. с. 529209 (СССР). – Б. И., 1976, № 35]. Аппарат снабжен перемешивающим, аэрирующим и пеногасящим устройствами, а также системой для регулирования температуры (рис. 10). В аппарат непрерывно дозируют купаж и ликер для постоянного поддержания содержания сахара в культуральной жидкости в пределах 5–7 г/л, а также раствор аммиака до концентрации 10–15 мг/л аммиачного азота. Среду аэрируют из расчета не более 0,5 л воздуха в 1 мин на 1 л жидкости. Культуральную жидкость центробежным насосом непрерывно перекачивают из нижней части аппарата в верхнюю, распыляя в наджидкостном пространстве через кольцевой перфорированный распылитель для равномерного диспергирования дрожжевых клеток и устранения пенообразования. Перемешивание можно осуществлять установленной внутри аппарата мешалкой, обеспечивающей 400–600 об/мин.
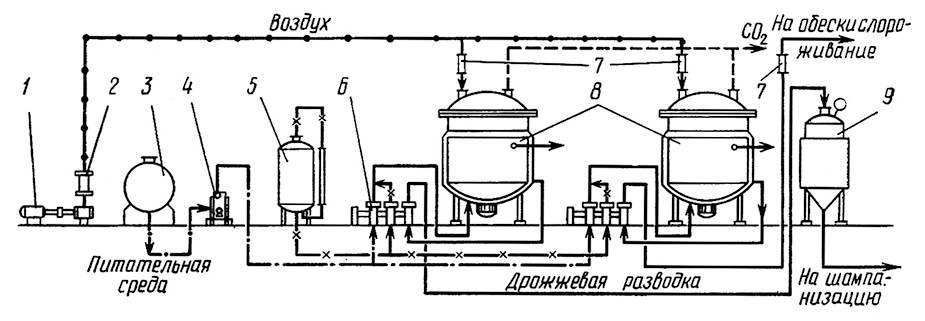
Рис. 10. Способ культивирования дрожжей гомогенно-непрерывным способом:
1 – воздуходувка; 2 – воздушный фильтр; 3 – резервуар для купажа; 4 – фильтр; 5 – резервуар для ликера; 6 – агрегат дозирующий;
7 – ротаметр; 8 – дрожжевой аппарат; 9 – активатор
Культивирование дрожжей в аппарате проводят при 18–20 °С в течение 2,0–2,5 сут при коэффициенте потока 0,020–0,015. Готовую дрожжевую разводку отбирают из аппарата и используют в производстве. Перед вторичным брожениемразводку рекомендуется адаптировать путем выдержки в течение 3–5 ч в специальном аппарате – активаторе в анаэробных условиях при температуре и давлении, при которых осуществляют процесс вторичного брожения.
Непрерывные способы культивирования позволяют получать разводку с высокой концентрацией физиологически активных дрожжевых клеток.
7.4. ИСПОЛЬЗОВАНИЕ СУХИХ ДРОЖЖЕЙ ДЛЯ ПРОИЗВОДСТВА ИГРИСТЫХ ВИН
В последние годы в нашей стране и ряде зарубежных стран находят применение активные сухие дрожжи. Основными достоинствами сухих дрожжей являются простота применения в производстве, исключение введения с дрожжами культуральной жидкости, содержащей продукты метаболизма дрожжей, возможность длительного хранения препаратов и др.
Приготовление сухих дрожжей предусматривает культивирование клеток в оптимальных условиях, отделение культуральной жидкости я сушку дрожжей [5], осуществляемые в соответствии со схемой, приведенной на рис. 11.
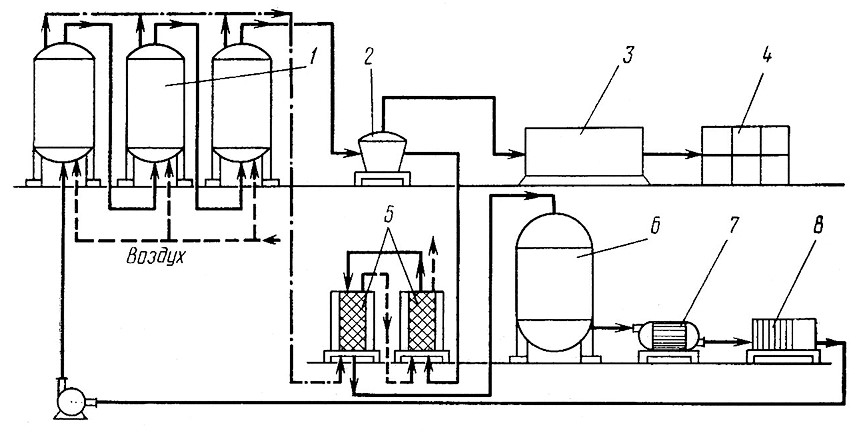
Рис. 11. Технологическая схема производства лиофилизованных дрожжей
Подготовленную питательную среду (виноматериал с сахаром) полают насосом в систему последовательно соединенных аппаратов 1 для культивирования дрожжей и аэрируют. Культуральную жидкость отделяют от дрожжей на сепараторе 2. Дрожжевой осадок с сепаратора направляют на замораживание и лиофильную сушку в аппарат 3. Лиофилизованные дрожжи упаковывают в пакеты 4. Отделенную от дрожжей культуральную жидкость направляют по трубопроводам в систему последовательно соединенных адсорберов 5 с насадками. Туда же по трубопроводам направляют газы, в которых присутствуют углерод- и азотсодержащие вещества, выделившиеся при аэрации культуральной жидкости в аппаратах 1. В адсорберах 5 эти вещества улавливаются культуральной жидкостью и смесь направляется в реактор 6 для приготовления питательной среды. Для улучшения растворения газов улавливание осуществляют при температуре 0–5 °С.
Для приготовления питательной среды в реактор 6 вводят виноматериал, сахар, азотистые вещества, витамины, минеральные соли и другие необходимые для размножения дрожжей компоненты в количествах, достаточных для ассимиляции их дрожжами в аппаратах 1. Приготовленную питательную среду из реактора направляют на пастеризацию в теплообменник 7 и фильтрацию на фильтре 8. После этого ее вновь перекачивают в аппараты 1.
По описанной технологии процесс культивирования можно осуществлять на одном предприятии и централизованно снабжать сухими дрожжами остальные заводы. В этом случае на многих первичных винзаводах и заводах игристых вин отпадет необходимость в дрожжевых отделениях, упростится технология.
За рубежом в настоящее время существуют 3 вида концентрированных препаратов дрожжей: жидкие пасты или кремы; лиофилизованные дрожжи; активные сухие дрожжи. Кремы или дрожжевые пасты получают путем размножения дрожжей на виноградном сусле или концентрированном соке селекционированных дрожжей путем декантации или центрифугирования. Жидкие пасты дрожжей получать проще, чем сухие, но они не могут долго храниться. Вместе с тем дрожжевые пасты и кремы выпускаются в большом количестве. Например, во Франции их производится 50 т в год. Лиофилизованные дрожжи хорошо хранятся. Лиофилизация – наилучший способ высушивания дрожжевых клеток, вместе с тем в отдельных партиях выживаемость бывает недостаточно высокой, что требует совершенствования технологии.
Активные сухие дрожжи получают путем размножения клеток на сусле или вине, концентрирования и высушивания культуры при 37–40 °С до состояния пудры или гранул.
Ежегодное производство активных сухих дрожжей достигает 200 т [133]. Их выпускают фирмы «Универсал Фуд» (США), «Лалман» (Канада), «Гест Брокадес» (Голландия), «Хефликс» (ФРГ), «Дэнск Гейеринг Индастри» (Дания) и др.
Наиболее часто активные сухие дрожжи применяют при производстве шампанского, игристых вин и в первичном виноделии. Например, во Франции сухие дрожжи покупают 158, кооперативных предприятий и 150 тыс. частных заводов. В США почти все брожение (99%) проводится непосредственно активными сухими дрожжами или полученными из них дрожжевыми разводками [133]. Сухие дрожжи фасуются в банки под вакуумом или в атмосфере инертных газов (С02 или азота) для лучшего хранения.
Особый интерес для технологии игристых вин представляет выпускаемый совместно Институтом энологии в Шампани (Франция) и фирмой «Лалман» в Монреале (Канада) препарат сухих дрожжей «Лалвен». Дрожжи вида Saccharomyces bayanus были селекционированы специалистами Института энологии в Шампани из самых лучших «крю» – партий шампанского Шампани. Они показали хорошие результаты как при брожении сусла, так и при производстве шампанского и других игристых вин в различных странах. Применение этих дрожжей обеспечивает полное сбраживание сахара с оптимальным образованием этанола, получение тонких высококачественных вин с развитым букетом. Селекционированный штамм обладает киллер-фактором и во время брожения ингибирует развитие нежелательных дрожжей. Препарат, выпускаемый в виде гранул и упакованный в металлические банки по 500 г, может храниться при 4–5 °С в течение 1 года без заметной потери активности. Перед использованием проводят регидратацию дрожжей. Для этого 100 г гранул дрожжей засыпают в 1 л воды температурой 38–40 °С, перемешивают и оставляют на 15–20 мин. Полученную суспензию используют для сбраживания белого сусла из расчета 2 г сухих дрожжей на 1 дал, красного – 4 г/дал; для дображивания в случае остановки брожения – 5 г/дал. При производстве игристых вин рекомендуются дозы 1–2 г/дал. Разводку готовят в 3 стадии: 1-я – регидратация, как описано выше; 2-я – приготовление закваски и 3-я – окончательное размножение. Стадия приготовления закваски заключается в добавлении регидратированной суспензии дрожжей к обработанному виноматериалу (купажу) с ликером. Для вторичного брожения в виноматериал вносят 5 % полученной дрожжевой разводки.
Проверка препарата в лабораторных условиях показала, что дрожжи обладают высокой активностью, быстро сбраживают сахар, игристые вина получаются хорошего качества. Поставлены производственные опыты на ряде заводов.
Таблица 21
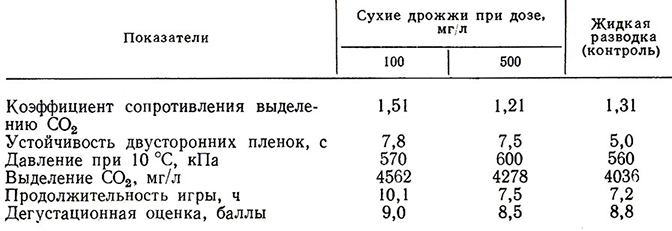
При использовании сухих дрожжей в дозе 100 мг/л для вторичного брожения в бутылках происходит равномерное сбраживание Сахаров, полученное игристое вино по игристым и пенистым свойствам и дегустационной оценке выгодно отличается как от контрольного, так и от образца с повышенной дозой сухих дрожжей (табл. 21) [118].
7.5. АВТОЛИЗ ДРОЖЖЕЙ И ЕГО РОЛЬ В ФОРМИРОВАНИИ
КАЧЕСТВЕННЫХ ОСОБЕННОСТЕЙ ИГРИСТЫХ ВИН
Автолиз дрожжей в настоящее время широко используется в виноделии для ускорения созревания столовых, крепленых вин и особенно шампанского. Мартини еще в 1926 г. заметил, что эффект созревания бутылочного шампанского, развитие в нем тонкого букета и продолжительной игры связаны с выдержкой его на дрожжах. В нашей стране большую роль в практическом применении автолиза дрожжей в виноделии сыграли работы А. М. Фролова-Багреева. Исследованиями А. И. Опарина и сотр. была научно обоснована и расшифрована биохимическая роль автолитических процессов при шампанизации вин в бутылках. Работы Н. М. Сисакяна и сотр., А. К. Родопуло, Е. М. Поповой и др. подтвердили и расширили эти представления.
Под автолизом понимают процесс расщепления отдельных компонентов клетки под действием различных ферментов, освоводившихся в результате распада клеточных мембран. Гибель дрожжевой клетки может происходить мгновенно, например при нагревании, и медленно. В первом случае строение клетки после смерти не меняется, при постепенном отмирании происходят изменения, называемые некробиозом. Механизм старения и отмирания клеток является спорным.
Автолиз происходит особенно интенсивно в тех случаях, когда жизнь клетки прекращается, а внутриклеточные ферменты сохраняются. Наиболее благоприятные условия для этого создаются при температуре 40–45 °С. При понижении температуры скорость автолиза снижается. Оптимум рН для автолиза винных дрожжей 5,5. Автолизу способствует содержание спирта до 12 % об. Повышенная концентрация сахара замедляет его ход. Автолитические процессы усиливаются в анаэробных условиях, так как при недостатке кислорода в клетке активизируются гидролитические ферменты. При большом доступе кислорода автолиз приобретает иную направленность. Для обогащения вин продуктами автолиза дрожжей приняты длительная выдержка вин на дрожжах, обработка вина с дрожжами, внесение дрожжевых автолизатов, а также использование ферментных концентратов и ферментных препаратов из дрожжей. Длительная выдержка виноматериалов с дрожжами требует тщательного внимания и ухода, чтобы избежать нежелательных последствий: появления дрожжевого, сероводородного тонов и др.
Нагревание вин с дрожжами при 40–45 °С, предложенное А. К. Родопуло в 1945 г., широко используется в производстве. Для шампанских виноматериалов термическая обработка должна проводиться в отсутствие кислорода.
Внесение в виноматериал массы дрожжей, предварительно автолизованных ускоренными методами в специально созданных условиях, несмотря на различие методов получения автолизатов, обеспечивает улучшение качества различных типов вин.
Ферментные концентраты и ферментные препараты из дрожжей были предложены В. И. Ниловым и Е. Н. Датунашвили. Исходя из концепции А. И. Опарина о решающей роли ферментов в улучшении качества шампанского, авторы разработали способ получения ферментных концентратов путем длительного настаивания вина с дрожжами при температуре не выше 10 °С.
Введение ферментных концентратов обеспечивает понижение ОВ-потенциала, снижение содержания альдегидов, увеличение количества сложных эфиров. Рекомендовано применение ферментных препаратов, полученных путем экстракции ферментов из дрожжей водой и последующего осаждения спиртом.
Семишон впервые показал, что выдержка вина на дрожжах в течение нескольких недель более чем в 2 раза повышает содержание в нем фосфорных соединений. Контакт вина с дрожжами способствует накоплению в вине азотистых веществ.
А. И. Опарин и сотр. выяснили, что автолизующиеся дрожжевые клетки являются источником ферментов инвертазы и протеазы, ускоряющих ферментативные превращения в вине. Выделение дрожжами ферментов в среду зависит от физиологической активности клеток. В дрожжевых клетках в процессе голодания активность многих ферментов понижается и исчезает.
Установлено, что при автолизе из дрожжей в вино переходят аминокислоты, причем не только содержавшиеся в среде, но и синтезированные дрожжами. Считается, что выделение дрожжами азотистых веществ связано с актом брожения и обусловливается повышением проницаемости клеточной оболочки. Так, при длительном промывании дрожжей водой абсолютно не наблюдается потерь аминокислот. При голодании дрожжей содержание азота аминокислотного фонда снижается на 70%. Выделение аминокислот дрожжами зависит от природы и концентрации сахара, температуры, расы дрожжей.
Дрожжи выделяют в вино и другие азотсодержащие компоненты– белки и нуклеотиды. С точки зрения повышения биологической ценности вина большое значение имеет обогащение его при автолизе витаминами группы В. Однако содержание витаминов в вине достигает первоначального уровня (в сусле) лишь по истечении 8 мес.
Цитологические исследования показали, что автолиз дрожжевых клеток в вине протекает медленно и имеет своеобразную направленность [8]. Этому способствуют относительно низкое значение рН и присутствие в вине разнообразных химических веществ: спирта, кислот и др. В случае высокого рН (при выдержке дрожжей в воде) процесс разрушения дрожжей идет глубоко, с разрывом клеточных структур. За время выдержки дрожжей в вине происходит увеличение зернистости цитоплазмы и наступает ее коагуляция, уменьшаются размеры дрожжевых клеток, причем чем выше температура выдержки, тем нагляднее выражены эти процессы.
Исследования с помощью просвечивающей электронной микроскопии (ПЭМ) показали, что в процессе выдержки дрожжей в вине при 20 °С происходит постепенное нарушение целостности цитоплазмы и клеточных органелл, клетка деформируется, накапливаются фосфолипидные образования. Если до выдержки можно наблюдать ровную клеточную стенку и гомогенную цитоплазму с органеллами (рис. 12), то спустя 14 сут в цитоплазме появляется много светлых пятен, вероятнее всего, вакуолей. На 30-е сутки (рис. 13) клеточная стенка утолщается, контуры ее становятся размытыми, появляется периплазм этическое пространство, обнаруживаются темные вкрапления хроматина, который образуется вследствие разрушения нуклеопротеидных комплексов клетки.
Через 40 сут увеличивается число светлых зон, появляются темные участки, которые являются, вероятнее всего, фосфолипидными, образовавшимися при распаде комплексов этих веществ с белками. После 60 сут выдержки цитоплазма становится зернистой и внутриклеточные структуры различить трудно.
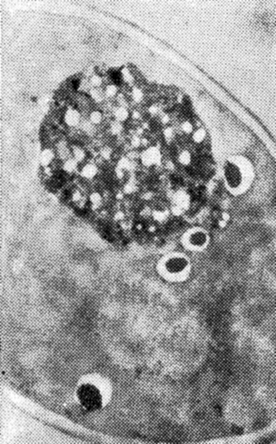
Рис. 12. Дрожжевая клетка до автолиза (ПЭМ)
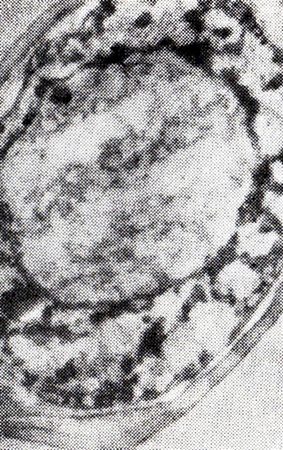
Рис. 13. Дрожжевая клетка после выдержки
при 20 °С в течение 30 сут (ПЭМ)
После 1 мес выдержки в клетках видна цитоплазматическая мембрана, между мембраной и клеточной стенкой образуется периплазматическое пространство. После 2 мес выдержки цитоплазматическая мембрана разрывается.
С помощью растровой электронной микроскопии (РЭМ) было обнаружено интересное явление: изменение рельефа клетки. Так, если до выдержки клетка имела овальную форму, равномерно шероховатую поверхность (рис. 14), то через 77 сут основную массу составляют деформированные клетки, похожие на грибы сморчки (рис. 15), что скорее всего свидетельствует о плазмолизе клеток. Можно предположить, что в клетке уменьшилось внутреннее давление (тургор), которое обусловлено осмотическими факторами.
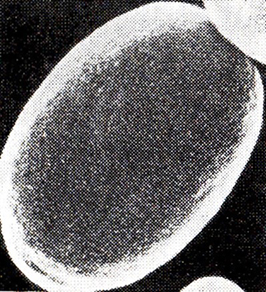
Рис. 14. Дрожжевая клетка до автолиза (РЭМ)
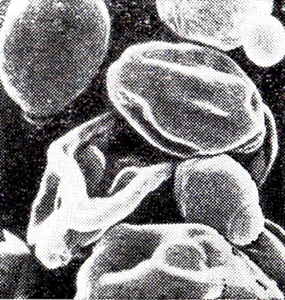
Рис. 15. Дрожжевые клетки после выдержки
при 20 °С в течение 77 сут (РЭМ)
Как известно, осмотическим барьером в клетке служит цитоплазматиче- ская мембрана, которая регулирует поступление в клетку питательных веществ и выведение наружу вредных продуктов обмена. Просвечивающей ЭМ были обнаружены разрывы цитоплазматической мембраны. Вероятно, нарушение целостности цитоплазматической мембраны и привело к тому, что дрожжевая клетка сморщилась. Вместе с тем клеточная стенка остается неповрежденной (см. рис. 13), поэтому содержимое клетки не выходит наружу.
Аналогичные структурные изменения наблюдаются в клетках и при шампанизации. Следует отметить, что на отдельных стадиях шампанизации встречалось большое разнообразие ультраструктур, обусловленное различным физиологическим состоянием дрожжевой клетки.
В первые сроки бутылочной шампанизации в дрожжевой клетке можно наблюдать стенку, вакуоль, ядро, митохондрии, рибосомы, липидные гранулы. В 7-суточной культуре цитоплазма гомогенная, с большим количеством липидных гранул. На 14-е сутки брожения в цитоплазме появляются светлые зоны, которые считают ветвями или псевдоподобиями центральной вакуоли. Они, смыкаясь и обособляя участок цитоплазмы, способствуют ее перевариванию под действием вакуольных ферментов. Учитывая, что в дрожжевых клетках обнаруживается много лизосом, можно считать, что гидролитические ферменты лизосом вызывают автолиз клеток.
Через 45 сут на светлые зоны приходится примерно 1/3 клеток. К этому сроку отмечается деформация клеточной стенки, которая далее усиливается. В 2-месячных клетках внутриклеточные структуры трудноразличимы (рис. 16). В дальнейшем эти закономерности автолиза сохраняются.
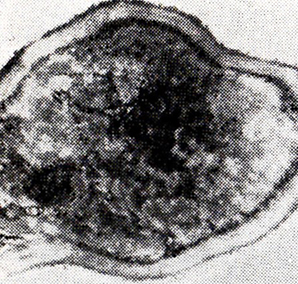
Рис. 16. Дрожжевая клетка после 60 сут
шампанизации в бутылках (ПЭМ)
На рис. 17, 18 показаны дрожжевые клетки после 3 и 5 лет выдержки в шампанизированном вине. Как можно заметить, клеточная стенка в них цела, цитоплазма обеднена биополимерами и весьма неоднородна.
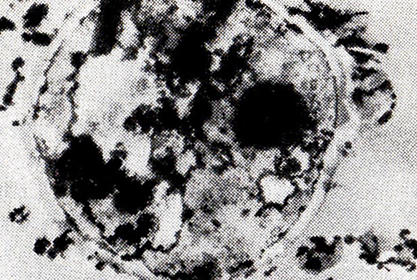
Рис. 17. Дрожжевая клетка после 3 лет
послетиражной выдержки в бутылках (ПЭМ)
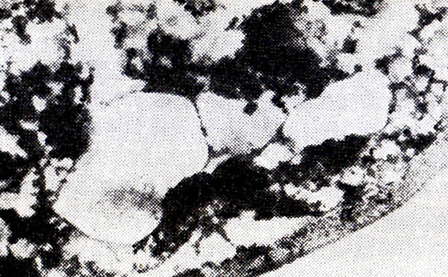
Рис. 18. Дрожжевая клетка после 5 лет
послетиражной выдержки в бутылках (ПЭМ)
Таким образом, автолиз дрожжевых клеток в вине имеет особую направленность и не приводит к полному разрушению клетки. Вместе с тем форма клеток изменяется весьма существенно. Некоторые клетки деформируются на 45-е сутки бутылочной шампанизации, через 2 мес их становится большинство (рис. 19). Складчатая (сморчкообразная) структура поверхности присуща всем длительно выдержанным в вине дрожжам. На рис. 20 показаны 5-летние клетки.
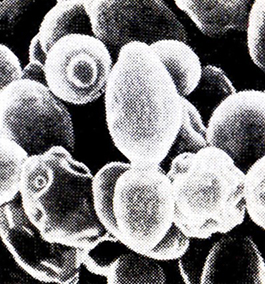
Рис. 19. Микрорельеф дрожжевых клеток
после 60 сут шампанизации в бутылках (РЭМ)
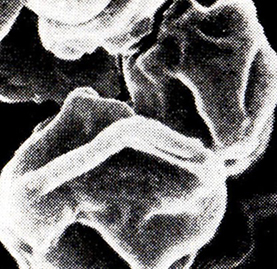
Рис. 20. Микрорельеф дрожжевых клеток,
выдержанных после тиража 5 лет (РЭМ)
Отбор проб из резервуаров линии непрерывной шампанизации выявил большое разнообразие клеток в одной пробе. Через 9 сут шампанизации наряду с нормальными обнаруживались автолизованные клетки (рис. 21) с обилием светлых зон, отслоением цитоплазмы от клеточной стенки и ее деформацией. В последнем резервуаре бродильной батареи они доминируют.
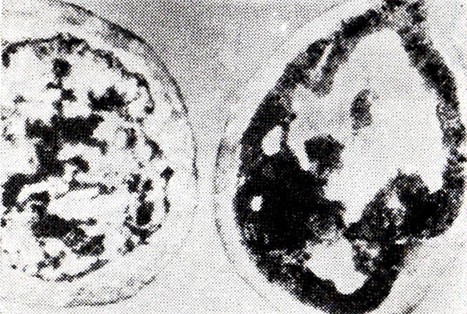
Рис. 21. Дрожжевые клетки из четвертого резервуара
линии непрерывной шампанизации (ПЭМ)
Выдержка дрожжевых клеток в вине на холоде при –5 °С вызывает менее глубокие цитоморфологические изменения. Через 2 сут в клетке хорошо просматриваются ультраструктуры (рис. 22): светлая клеточная стенка, гомогенная цитоплазма, центральная вакуоль, отделенная мембраной, вакуоли с гранулированным содержимым, липидные гранулы с кольцевидной каемкой. Часть липидов (ненасыщенных) экстрагируется из клетки при подготовке к электронной микроскопии и поэтому дает на фотографии светлые участки. Основной массе липидов соответствуют наиболее, электронно-плотные участки. Через 8–10 сут выдержки при –5 °С ультраструктурные изменения в клетках невелики, также незначительны изменения поверхности и формы клеток.
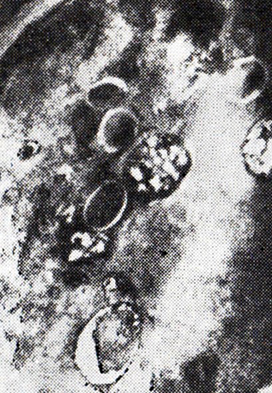
Рис. 22. Дрожжевая клетка после обработки холодом
при –5° С в течение 2 сут (ПЭМ)
Тепловая обработка вин с дрожжами вызывает глубокие цитологические изменения в клетках. Через 1 сут нагревания при 40 °С цитоплазма гомогенна, видны структуры, даже аппарат Гольджи; через 2 сут клетка деформируется, появляется большое число светлых участков (рис. 23); через 3 сут часть светлых участков сливается, давая две большие светлые зоны, т.е. структура цитоплазмы нарушается, изменяются рельеф поверхности и форма, клетка сморщивается (рис. 24).
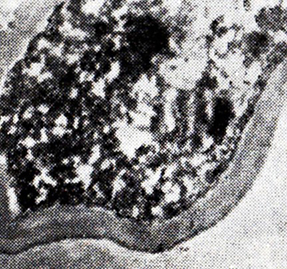
Рис. 23. Дрожжевая клетка после нагревания
в вине при 40 °С в течение 2 сут (ПЭМ)
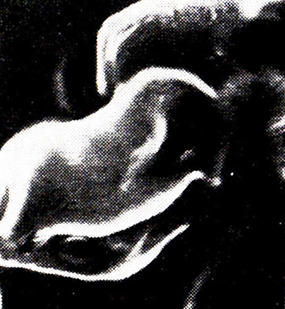
Рис. 24. Дрожжевые клетки после нагревания
в вине при 40 °С в течение 5 сут (РЭМ)
Несколько иные закономерности наблюдаются в начальной стадии нагревания при-60 °С. Так, в течение 36 ч тепловой обработки вина с дрожжами изменения структуры клетки невелики, хорошо видны мембранные структуры, митохондрии, эндо- плазматический ретикулум, вакуоли, лизосомы, липиды. Лишь спустя 2–3 сут наступает коагуляция цитоплазмы (рис. 25).
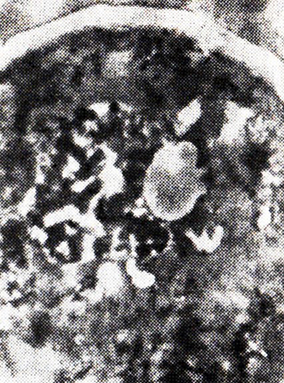
Рис. 25. Дрожжевая клетка после нагревания
в вине при 60 °С в течение 3 сут (ПЭМ)
Разрушение мембранных структур и существенные изменения цитоплазмы и формы клеток отмечены на 4-е сутки нагрева.
Можно предположить, что нагревание при 40 °С, способствуя активации внутриклеточных протеолитических ферментов, вызывает ускоренный гидролиз протеидов цитоплазмы и, таким образом, быстрый автолиз дрожжевой клетки. В отличие от этого нагревание при 60 °С инактивирует гидролитические ферменты, поэтому вначале в клетке сохраняются многие структуры. Лишь при дальнейшей выдержке наступает тепловая денатурация биополимеров, которая и приводит к коагуляции цитоплазмы и автолизу клетки.
Таким образом, при автолизе дрожжей в вине происходят следующие изменения клеточной организации; клеточная стенка не разрушается, цитоплазма из гомогенной становится неоднородной, грубозернистой, между клеточной стенкой и цитоплазмой образуется периплазматипеское пространство, в цитоплазме появляются светлые участки. Спустя 2 мес при 20 °С или через 2–3 сут при нагревании светлые зоны, цитоплазматическая мембрана и другие мембраны клетки начинают разрушаться, после чего ультраструктуры клетки становятся Неразличимыми. Эти светлые зоны; могут быть либо множеством вакуолей, которые возникают при повреждении клеток, либо дизосомами, «отшнуровывающимися» от аппарата Гольджи. В них находятся протеолитические ферменты (вначале неактивные]. На приведенных рисунках встречаются вакуоли звездчатой формы – фагосомы или фаголизосомы. Имея способность активно передвигаться в цитоплазме, они фагоцитируют, т, е. захватывают и переваривают поврежденные органеллы клетки. По всей вероятности, и вакуоли, и лизосомы причастны к автолизу дрожжевых клеток.
В процессе автолиза в вине изменяются микрорельеф и форма клетки: из гладкой лимонообразной клетка становится морщинистой, что, вероятно, обусловлено плазмолизом.
На направленность цитоморфологических изменений в клетке оказывают влияние температура и продолжительность выдержки в вине. Наименее значительные изменения в клетках наблюдаются При выдержке При –5 °С. Процессы деградации цитоплазмы, мембран и других ультратонких структур клетки, видимых в электронном микроскопе, происходят под действием внутриклеточных гидролитических ферментов по истечении 2 мес при 20 °С и 2–3 сут при 40 °С. Выдержка при 60 °С вызывает тепловую денатурацию биополимеров клетки.
Наблюдаемые цитофизиологические изменения, естественно, вызываются изменениями в ферментативном аппарате дрожжевой клетки» Для углубленного изучения механизма процесса автолиза дрожжей были проведены исследования изменения ферментов дрожжей и вина при выдержке и термообработке.
Было обнаружено, что дрожжевые клетки после различных обработок и выдержки хуже поддаются раздавливанию. По- видимому, механическая прочность оболочек клеток при испытанных способах автолиза увеличивается. Наибольшая устойчивость была зафиксирована у клеток, подвергшихся тепловой обработке: она была в 1,2–1,5 раза выше, чем у начальных.
После тепловой обработки ж выдержки в дрожжах падает содержание белков, которые, частично переходят в окружающую среду, а частично подвергаются гидролизу и денатурации. Лишь после обработки холодом количество белков в дрожжевых клетках, контактирующих с модельной средой и вином, возрастает.
Активность протеиназы в дрожжах, подвергнутых тепловой обработке в вине и модельной среде, несколько уменьшается, а после обработки холодом или выдержки в течение 1 мес заметно возрастает. Активация протеиназ вызвана наличием в винных дрожжах неактивных комплексов протеиназ и их распадом при автолизе.
Наибольшее обогащение вина протеиназами наблюдается при обработке холодом (активность увеличивалась почти в 2,6 раза), в 2 раза возрастает активность протеиназ после выдержки и нагревания до 45 °С.
Дрожжевые клетки выделяют пептидазу. Наряду е переходом пептидазы из клеток в вино при нагревании происходит ее инактивация. В дрожжах одновременно с выделением пептидаз в среду при нагревании также имеет место их инактивакция. В отличие от этого обработка холодом и выдержка способствуют активации пептидаз в дрожжевых клетках.
При всех способах автолиза активность пероксидазы, глютамат- и сукцинатдегидрогеназ в дрожжевых клетках падает. Наименьшая активность дегидрогеназ Зафиксирована в дрожжах, выдержанных 1 мес и подвергнутых нагреванию.
Таким образом, при автолизе дрожжей резко снижается активность ферментов, принимающих участие в биологическом окислении и других важных биосинтетических процессах. Вместе с тем у дрожжевых клеток не отмечается полной инактивации ключевого фермента аминокислотного метаболизма – глютамат- дегидрогеназы и ферментов дыхательной цепи.
В винных дрожжах нами доказано наличие цитохромов ааз, в и с в соотношении 1:2,5:3,8. Выдержка дрожжей в течение 2 сут при –5 °С приводит к некоторому снижению их абсолютного содержания в бесклеточном экстракте, особенно сильно (в 3 раза) – наиболее лабильного цитохрома ааз и меньше цитохрома с; изменяется и соотношение цитохромов, которое становится равным 1:2,6:4,9. Анализ цитохромов суспензии с разрушенными клеточными структурами выявил лишь уменьшение содержания цитохрома ааз. После 48 ч выдержки при 45 °С или 24 ч при 60 °С цитохромы не обнаруживаются ни в выделенном экстракте, ни в разрушенных клетках, хотя считается, что цитохром с довольно термостоек. Разрушение цитохромов в клетках вызвано действием сильноактивирующихся при таких обработках протеолитических ферментов.
Исследование изменения активности оксидоредуктаз в среде при автолизе показало, что наряду с процессами активации происходит и выделение данных ферментов из дрожжевых клеток.
На основании проведенных биохимических и цитофизиологических исследований изменений, возникающих в дрожжевых клетках при длительной выдержке в вине и термической обработке, механизм процесса автолиза дрожжей в вине представляется следующим образом.
При автолизе дрожжей в вине отсутствие кислорода, сбраживаемых углеводов и повышение концентрации ряда продуктов анаэробного обмена приводит к нарушению клеточного метаболизма. При отмирании клеток барьерные функции клеточных мембран исчезают. Выдержка в вине обусловливает проникновение через мембрану компонентов вина, в частности органических кислот. Это влечет за собой изменение внутриклеточного рН и состояния цитоплазматических гелей, вследствие чего в дрожжевых клетках, согласно полученным данным, активируются протеолитические ферменты.
Протеиназа и пептидаза катализируют распад белков и ферментов, выполняющих важные биологические функции в клетках. Указанное вызывает нарушение координированной связи и клеточной регуляции ферментов дрожжей.
Усиление гидролитических реакций обусловливает разрушение субклеточных структур. Подтверждением их деструкции служат микроскопические наблюдения за автолизующимися винными дрожжами. Если при люминесцентной микроскопии молодых дрожжевых клеток отмечается значительное разнообразие цвета и яркости свечения отдельных органоидов, то по меревыдержки еорбционная способность внутриклеточных структур к различным красителям существенно изменяется и после 2 мес они люминесдируют практически одинаково- В процессе автолиза винных дрожжей, разрушаются ядро, митохондрии и друг гяе органеллы.
Гидролитические процессы приводят к распаду составляющих основу цитоплазмы комплексов, белков с липидами и полисахаридами. При наблюдении в фазово-контрастный микроскоп в автолизующихся клетках винных дрожжей отмечается появление ярко светящихся включений й небольших гранул липоидной природы. В процессе выдержки их количество увеличивается и отдельные липидные шарики переходят в вино. Указанные внутриклеточные изменения зависит от способа автолиза дрожжей. Они минимальны при автолизе на холоде и усиливаются при повышении; температуры.
Вместе с тем имеются и качественные различия в явлениях деструкции органелл клетки при выдержке и нагревании. Так, если в процессе выдержки при 10–20 °С распад внутриклеточных структур протекает медленно и дрожжи длительный период сохраняют физиологическую активность, то нагревание до 40 °С вызывает быстрые и необратимые явления тепловой денатурации белков, что приводит к гибели клетки.
При тепловой обработке активация гидролитических ферментов сопровождается последующей их инактивацией. Клетки в короткий срок выделяют в вино значительное количество веществ, часть из которых одновременно денатурирует и трансформируется. При повышении температуры свыше 40–50 °С и увеличении срока нагревания вина с дрожжами более 2–5 сут снижается скорость ферментативных процессов, но интенсифицируются химические реакции, например карбониламинные, этерификации и др.
В отличие от этого при выдержке вина в течение 1 года и •более в дрожжевых клетках сохраняют активность многие гидролитические и отдельные окислительно-восстановительные ферменты. Вследствие этого в цитоплазме; и на отдельных органоидах таких клеток протекают ферментативные реакции, т. е. помимо внеклеточных ферментов в биохимических процессах, происходящих в вине, важную роль играют внутриклеточные ферменты.
Таким образом, при выдержке вина с дрожжами биохимические изменения в вине обусловлены не только выделением продуктов автолиза дрожжей в вино, как это считалось ранее, но и ферментативной трансформацией отдельных компонентов вина внутри клеток. Указанные положения, выдвинутые впервые, позволяют изменить некоторые существовавшие концепции о возможности улучшения качества вина специально приготовленными автолизатами дрожжей.
Приведенные сведения показывают роль внутриклеточных изменений в дрожжах при их автолизе в вине. Следует учитывать влияние генетических особенностей и физиологического состояния дрожжевых клеток на ход процесса автолиза.
Наряду с эндогенными процессами большое значение имеют экзогенные факторы, в частности состав среды. При выдержке в модельных средах – водных, водно-спиртовых растворах с высоким значением рН и недостаточной концентрацией питательных веществ дрожжевые клетки быстро гибнут и разлагаются. При добавлении к среде органических кислот скорость автолиза снижается. В вине содержатся и другие соединения: аминокислоты, альдегиды и др., которые могут служить субстратом для дрожжей.
В начальный период голодания в дрожжевых клетках происходят глубокие биохимические сдвиги не только катаболического, но и анаболического характера. Так, в клетках синтезируется ряд ферментов, увеличивается содержание фракций щелочерастворимых белков, что приводит к повышению прочности мембранных структур.
Наличие в дрожжах биохимических механизмов, предотвращающий отмирание клеток, способствует длительному сохранению жизнеспособности винных дрожжей в такой богатой питательными веществами среде, как вино. Распад дрожжевой клетки тормозится и вследствие того, что клеточная оболочка состоит из глюкан- и маннанпротеинов, для разрушения которых необходимы не только протеолитические, но и сахаролитические ферменты, т. е. активаций протеиназ недостаточно для полного автолиза дрожжей в вине. Оболочка клеток быстро лизуется при добавлении к дрожжам наряду с протеазой 1,3-глюканазы. Вероятно, внутриклеточные ферменты, гидролизующие полисахариды, в дрожжах малоактивны. Для разрушения клеточных стенок необходимо обработать дрожжи, например, специально приготовленными литическими ферментами.
По-видимому, низкая величина рН вина (рН 3) не является оптимальной для действия внутриклеточных сахаролитических ферментов, так как в модельной среде при рН 6–7 большинство клеток быстро автолизовалось. Приведенные сведения позволяют объяснить сохранение клеточной оболочки в дрожжах в процессе выдержки в вине. По этой причине дрожжевая клетка после длительной (2–3 года) выдержки в шампанском теряет большую часть веществ, сильно уменьшается в размере, но полностью не разлагается, а как бы «мумифицируется», сморщивается, приобретая форму грибов сморчков. Присутствие в вине ряда продуктов обмена дрожжей, напротив, вызывает их угнетение. Наличие активных гидролитических ферментов в вине также способствует ускорению отмирания дрожжевых клеток.
Наконец, важную роль играют температурные условия и продолжительность процесса автолиза. Обработка вина с дрожжами при минус 5–6 °С, не вызывая глубоких цитофизиологических изменений в клетках, способствует переходу значительной части ферментного комплекса дрожжей в вино. Повышение температуры и продолжительности автолиза усиливает выделение азотистых, фосфорных соединений и других продуктов глубокого распада дрожжевой клетки. Температурный фактор обусловливает не только количественные, но и качественные различия в составе продуктов автолиза.
Полученные данные подчеркивают, что, устанавливая оптимальные режимы автолиза, можно обеспечить переход желаемых компонентов дрожжей в вино и создать условия для протекания определенных биохимических процессов.

