Таким образом, исходные предпосылки «энергетической» теории материального баланса неверны. Они не учитывают того, что в клетке одновременно протекают как бы два процесса.
1. Катаболизм – преобразование субстратов в элементарные биохимические соединения, в том числе и содержащие энергию (АТФ), которые в дальнейшем используются при биосинтезе. Есть здесь и «отходы» – диоксид углерода, тепло – то, что напрямую не идет для синтеза биомассы и других продуктов.
2. Анаболизм – построение макромолекулярных соединений (белков, нуклеиновых кислот, компонентов клеточной стенки), а также продуктов метаболизма с использованием универсальных биохимических «кирпичей».
При катаболизме энергия выделяется, при анаболизме – расходуется.
Затраты энергии (да и материи – молекул, атомов) на анаболизм никогда не бывают равны разности энергетических уровней исходных и конечных веществ. Прежде всего это вытекает из второго закона термодинамики (нужна энергия на осуществление биохимических превращений). С другой стороны, биохимические механизмы не идеальны, часть энергии и вещества расходуется на побочные продукты и тепло. Эти потери вещества учитываются реальными стехиометрическими (экономическими) коэффициентами, которые как раз и определяются из эксперимента – сравнением кривых изменения концентрации 'биомассы, субстрата и продуктов.
При этом общее стехиометрическое соотношение для объединенного процесса, включающего катаболизм и анаболизм, может быть записано в виде: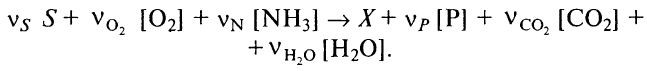 (5.7)
(5.7)
Здесь биомасса выражена в С-молях, а субстрат – в обычных молях.
Другое соображение, поясняющее различия между стехиометрическим и фактическим выходом биомассы, заключается в следующем. В ходе процесса культивирования наряду с «конструктивными» биохимическими превращениями (образование биомассы и различных продуктов метаболизма) протекают также биохимические процессы, которые в совокупности можно назвать «поддержанием жизнедеятельности» микроорганизмов. При этом происходит синтез клеточных компонентов, которые естественным образом деградируют, и для сохранения жизнеспособности клеток нужна их «репарация». В принципе мы можем так подавать субстрат, чтобы его хватало только на поддержание жизнедеятельности, а новая биомасса микроорганизмов и продукты метаболизма при этом не образовывались. Ясно, что в таких процессах выход биомассы Нравен нулю. И он (то, что в табл. 5.3 определено как «фактический» выход) не является постоянным и зависит от условий и скорости роста биомассы. Представленные цифры характеризуют максимально достигнутый выход, но и он далек от стехиометрического. Затраты субстрата на поддержание жизнедеятельности существуют всегда.
Рассмотрим теперь вопрос о нахождении стехиометрических коэффициентов, указанных в объединенном стехиометрическом уравнении (5.7), если известны из эксперимента фактические данные по потреблению субстрата и образованию продуктов биохимического взаимодействия.
Необходимо знать, по меньшей мере, количество израсходованного субстрата (в реальных мерах – граммы, килограммы и т. д.) и соответствующие данные по количеству образовавшейся биомассы микроорганизмов или продукта метаболизма – соответственно GS, GX и GP (в пересчете на весь аппарат) или для периодического процесса приращения их концентраций – соответственно ΔS, ΔX и ΔР.
Разделив эти величины на молекулярные массы соответственно субстрата, биомассы или продукта, получаем для этих веществ количества г·• молей (или кг· молей), которые и являются основой для последующих стехиометрических расчетов.
Первый из этих расчетов – приведение всех количеств к одному С-молю биомассы. Мы уже упоминали, что все стехиометрические коэффициенты можно умножать или делить на одно и то же число. Поэтому условимся находить такие стехиометрические коэффициенты, которые дают стехиометрический коэффициент при биомассе (выраженной в С-молях) равным 1, как это и записано в уравнении (5.7).
Таким образом сразу находим νS и νP.
Для определения коэффициентов по другим веществам (O2, CO2, NH3 и H2O) необходимо составить и решить систему уравнений элементного баланса. имея в виду, что каждое вещество (субстрат, биомасса, продукт, вода, кислород, диоксид углерода) может быть описано общей элементной формулой CmHnOpNq.
При этом индексы в формуле субстрата обозначим как mS, nS, pS, qS., а в формуле продукта – соответственно mp, np, pp, qp. Для биомассы соответствующие индексы mX = 1, nX – 1,8, рX= 0,5, qX= 0,2.
Тогда уравнение баланса по углероду можно записать следующим образом: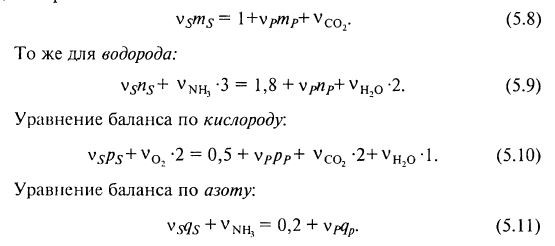
Решение системы уравнений (5.8) – (5.11) позволит найти все стехиометрические коэффициенты для данного процесса ферментации.
Для примера рассмотрим конкретный процесс производства лимонной кислоты.
Известно, что в процессе ферментации на 1 кг потребленной сахарозы получается 0,6 кг лимонной кислоты и 0,3 кг сухой биомассы.
Рассчитаем стехиометрические коэффициенты уравнения (5.7).
Переведем все величины в г • моли соответствующих веществ.
Молекулярная масса сахарозы (C12H22O11) равна 342, лимонной кислоты (C6H8O7) – 192, С-моля биомассы – 24,6.
Отсюда получаем в молях: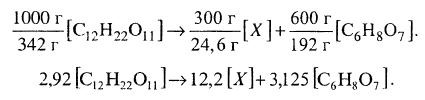 (5.12)
(5.12)
Пересчитаем все стехиометрические коэффициенты на С-моль биомассы, т.е. разделим обе части равенства (5.12) на 12,2. Получаем:![]() (5.13)
(5.13)
Иначе говоря, для полного уравнения (5.7) уже имеем vS = 0,24 и VP = 0,26.
Для нахождения оставшихся коэффициентов записываем систему уравнений элементного баланса для данного процесса.
При этом для субстрата (сахарозы) значения индексов mS =12, nS = 22, pS -11, 0, qP = 0.
Для продукта (лимонной кислоты) mР = 6, nР = 8, рР – 7, qP = 0.
Баланс по углероду [см. уравнение (5.8)]:
0,24•12 = 1+ 0,26-6 +vCO2,
откуда получаем:
vCO2 = 0,32. (5.14)
Баланс по водороду [см. уравнение (5.9)]:
0,24•22 + vNH3 -3 = 1,8 + 0,26•8 + 2νΗ2O,
или
2 vH2O – 3vNH3 = 1,4. (5.15)
Баланс по кислороду [см. уравнение (5.10)]:
0,24•11+2νO2 = 0,5+7-0,26+2-0,32 +vH2O, (5.16)
или
2VO2 -VH2O= 0,32. (5.17)
Баланс по азоту [см. уравнение (5.11)]:
О+vNH3 = 0,2+ О,
откуда
VNH3 = 0,2. (5.18)
Из (5.15) получаем:
VH2O= 1,0. (5.19)
Из (5.16) следует:
VO2 = 0,66. (5.20)
Таким образом, стехиометрическое уравнение для данного процесса можно записать следующим образом:
0,24 [C12H22O11]+ 0,66 [O2]+ 0,2 [NH3] → [СH1,8О0,5N0,2]+ 0,32 [CO2]+[H2О]. (5.21)
То, что в итоговом уравнении большинство коэффициентов оказалось меньше единицы, не должно смущать. Главное – полученное уравнение дает четкую количественную связь между участвующими в биохимических превращениях веществами.

