При выделении липидов и всякого рода неустойчивых, лабильных соединений, проводя экстрагирование, следует учитывать дальнейшие операции выделения. Поэтому часто используют легкокипящие соединения – спирт, нефрас, гексан, ацетон, которые в дальнейшем удаляют путем выпаривания.
Но для выпаривания этих соединений требуются относительно высокие температуры, которые могут повлиять на качество выделяемых биопродуктов. При этом также необходимы затраты энергии на испарение экстрагентов и их последующую конденсацию.
Кажется очевидным, что для решения этих проблем следовало бы брать в качестве растворителей жидкости, имеющие более низкую температуру кипения. Одной из таких жидкостей является диоксид углерода. Правда, при атмосферном давлении температура его кипения довольно низка (ниже –50 °С). Но с повышением давления температура повышается: при давлении 7,3 МПа, например, температура кипения составляет +31 °С.
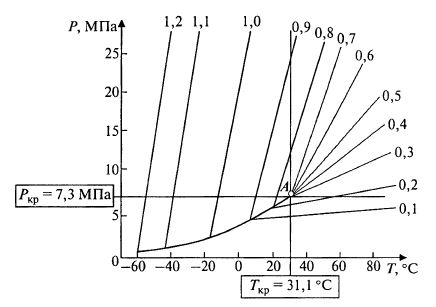
На рис. 15.5 представлены линии равной плотности жидкости (сверху от граничной линии) и газа (снизу). Числа даны в размерности плотности – г/см3.
Рис. 15.5. Влияние температуры и давления на физические свойства углекислоты:
А – критическая точка. Сплошной линией дана граница между условиями,
в которых углекислота существует в виде жидкости (сверху) и газа (снизу).
Справа от точки А имеют место промежуточные состояния (сверхкритические)
Обычно плотности газа и жидкости резко различаются. Например, при +10 0C плотность жидкости CO2 составляет 0,86 г/см3, а газа – 0,14 г/см3. При 20 0C – соответственно 0,77 и 0,19 г/см3, а при 30 °C – 0,59 и 0,35. А вот при 31,1 °C и давлении 7,3 МПа плотность жидкости и газа становится равной. Если и температура, и давление выше своих критических значений, вещество обладает свойствами, промежуточными между жидкостью и газом. Эта фаза – фаза «суперкритической» жидкости.
На рис. 15.5 показано, что путем повышения давления газ при любой температуре до критической точки А (31,1 °С) можно превратить в жидкость. И наоборот, газ при любом давлении ниже критического (7,3 МПа) можно превратить в жидкость путем снижения температуры.
Физические и диффузионные свойства «суперкритических» жидкостей находятся в диапазоне между значениями соответствующих свойств газов и истинных жидкостей и обычно весьма благоприятны для их применения в качестве экстрагентов. В частности, очень низка их вязкость, что снижает затраты на перекачивание. Кроме того, при работе на границе области критических значений температуры и давления можно путем небольших температурных воздействий переводить «суперкритические» жидкости в газы и обратно в жидкости.
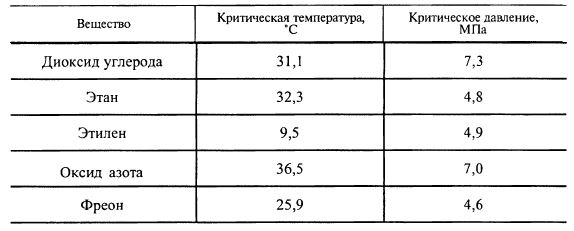
Существуют и другие вещества, имеющие критические температуры в областях, близких к нормальной температуре (табл. 15.1).
Таблица 15.1. Критическая температура и давление «суперкритических» экстрагентов
Таким образом, процесс выделения продукта проводится при обычной температуре и не требует выпарки для разделения продукта и растворителя-экстрагента.
«Суперкритические» жидкости являются неполярными растворителями и лучше растворяют неполярные вещества. Ионизированные вещества в «суперкритических» жидкостях практически нерастворимы.
Хорошо растворяются: углеводороды и растворимые в жирах органические соединения – парафины, многие эфиры, лактоны и глицериды; многие лекарства, кофеин, никотин, стероиды и алкалоиды, вкусовые и ароматические компоненты.
Интересно, что выделение может быть даже из водных растворов!
Общая оценка процесса экстрагирования «суперкритическими жидкостями» такова.
Преимущества:
- высокая энергетическая эффективность;
- низкие температуры;
- нетоксичные и недорогие растворители (экстрагенты);
- низкая вязкость, высокая диффузионная способность;
- силой растворителя можно управлять.
Недостатки:
- необходимо оборудование высокого давления;
- относительно низкая сила растворителя;
- плохие растворители для полярных соединений;
- недостаточно данных для надежного проектирования (все нужно проверять экспериментально).