В процессе ультрафильтрации используют селективные полупроницаемые мембраны, пропускающие низкомолекулярные и задерживающие высокомолекулярные соединения. Известно, что движущей силой процесса ультрафильтрации является перепад давления на мембране, как и при обычной фильтрации. Применительно к ультрафильтрации высокомолекулярные соединения – это те соединения, у которых молекулярная масса растворенного вещества превосходит молекулярную массу растворителя более чем в 500 раз.
При ультрафильтрации происходит не разделение фаз, а перераспределение растворенных в жидкости веществ. По существу здесь используется ситовой эффект.
Полимерные мембраны, используемые при ультрафильтрации, обычно являются двухслойными. Основной фильтрующий слой имеет толщину менее 1 нм. Очевидно, такой слой не может быть механически прочным, и поэтому он дублируется со вторым слоем толщиной от 20 мкм до 2 мм, который к тому же имеет и значительно больший размер пор. Выполнены оба слоя как единое целое, но мембрана является анизотропной. Давление должно быть приложено со стороны тонкого слоя, а не наоборот.
Ясно, что для создания прочности мембраны дополнительно должна использоваться и более жесткая (металлическая или пластмассовая) арматура: ведь перепад давления для процессов ультрафильтрации достигает 0,3–1 МПа.
Обычный материал мембран – полиуретаны, сложные эфиры целлюлозы, полисульфон. В последнее время научились делать и металлокерамические (наиболее прочные) мембраны.
Обычно не существует мембран с совершенно одинаковым размером пор. Среди пор попадаются и такие, которые по размеру больше молекул растворенного вещества. Поэтому частично оно все же проходит в пермеат. Важной характеристикой мембраны является так называемый коэффициент удержания R: (17.1)
где Cк и Cп – концентрации растворенного вещества соответственно в концентрате и в пермеате (фильтрате).
От чего зависит скорость ультрафильтрации Qф?
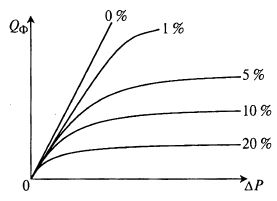
Рассмотрим это на примере ультрафильтрации растворов белка. На рис. 17.3 представлена зависимость скорости Qф от перепада давления ΔP при различных концентрациях белка в растворе.
Рис. 17.3. Зависимость скорости ультрафильтрации растворов белка
от перепада давления на мембране при различных концентрациях белка
в обрабатываемом водном растворе (числа у кривых)
Из рисунка видно, что с повышением концентрации белка скорость падает и, главное, повышение давления в широком диапазоне перестает влиять на скорость ультрафильтрации.
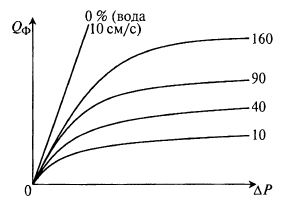
На рис. 17.4 для раствора одной концентрации белка приведены данные по зависимости скорости фильтрации от перепада давления на мембране при различной линейной скорости фильтруемого раствора параллельно поверхности мембраны.
Рис. 17.4. Зависимость скорости фильтрации 10%-го раствора белка
от перепада давления при различных линейных скоростях
потока фильтруемого раствора над мембраной:
0 % – вода; 10, 40, 90, 160 – линейное скорости потока в см/с
Очевидно, что причина такого поведения раствора в концентрационной поляризации.
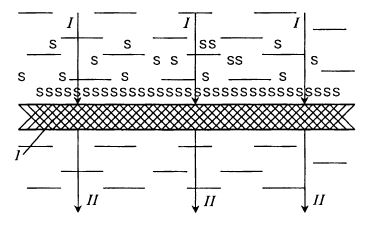
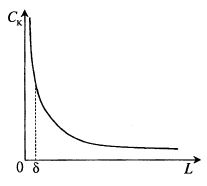
В процессе ультрафильтрации вблизи обращенной к потоку поверхности мембраны возникает градиент концентрации. Это изображено схематически на рис. 17.5. На рис. 17.6 показано изменение концентрации Cк в зависимости от расстояния до мембраны L.
Рис. 17.5. Распределение взвешенных коллоидных частиц со стороны
концентрата в зависимости от расстояния до мембраны (I):
/– поток фильтрации в концентрате; II – пермеат
Рис. 17.6. Изменение концентрации Cк отфильтровываемых
высокомолекулярных веществ в зависимости от расстояния до мембраны L
Возникающий градиент концентрации напоминает диффузионный пограничный слой при массопередаче (хотя закономерности здесь другие), которая вызывает дополнительное (помимо мембраны) сопротивление потоку растворителя. Эффективная толщина слоя δ зависит, с одной стороны, от концентрации растворенного вещества, а с другой – от коэффициента турбулентной диффузии, т. е. степени турбулизации потока.
Образуется что-то похожее на «динамическую мембрану». Но в дальнейшем за счет полимеризации белков возможно образование не просто динамической мембраны, но и геля, «лепешки», которая практически закупоривает реальную мембрану.
Борьба с концентрационной поляризацией. Для этого кроме повышения скорости потока над мембраной используют следующие приемы:
- предварительная обработка раствора (создание подходящей температуры, рН, ионной силы);
- предварительная фильтрация через мембрану определенных растворов полимеров, создающих на поверхности мембраны слой, препятствующий осаждению растворенного вещества на поверхности мембраны;
- покрытие мембраны ферментом, способствующим разжижению геля;
- создание на поверхности мембраны отрицательно заряженных ионогенных групп, предотвращающих осаждение белков; гидрофилизация мембраны полиэтиленгликолем; очистка мембраны.
- Последний прием (очистка мембраны) осуществляется: легким обратным потоком жидкости (для больших потоков операция рискованна, так как может быть нарушена целостность мембраны);
- пузырями пены;
- биологическими детергентами (например, сывороткой);
- раствором щавелевой кислоты (для жирных стоков);
- раствором пероксида водорода (для белков); раствором гипохлорита калия;
- добавлением в поток порошков, имеющих легкое абразивное действие на мембрану (тоже есть опасность «царапания» мембран, снижающего их долговечность).
Конструктивное оформление ультрафильтрационных систем реализуется в следующих вариантах:
- трубчатые (с диаметром трубок 6–25 мм) могут развивать плотность упаковки (поверхность фильтрования на единицу объема) 60-200 м2/м3;
- плоскорамные – 60–300 м2/м3;
- рулонные – 300–800 м2/м3;
- с полыми волокнами (капилляры диаметром 20–100 мкм и толщиной стенки 10–50 мкм) – до 30 000 м2/м3; недостаток – трудность замены поврежденных волокон.
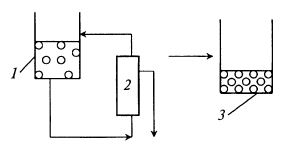
Рассмотрим несколько примеров использования ультрафильтрационных установок при концентрировании (рис. 17.7), диафильтрации (очистка от низкомолекулярных веществ) (рис. 17.8) и очистке от высокомолекулярных соединений (рис. 17.9).
Рис. 17.7. Схематическое изображение процесса концентрирования:
1 – сосуд с исходным раствором;
2 – ультрафильтрационный модуль;
3 – сосуд со сконцентрированным раствором после ультрафильтрациипроцессов
биосинтеза продуктов метаболизма, отличных от биомассы микроорганизмов.
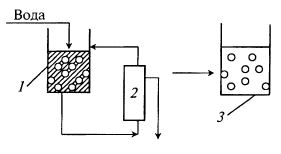
Рис. 17.8. Схема процесса диафильтрации:
1 – сосуд с исходным раствором, содержащим высокомолекулярные
и низкомолекулярные соединения; 2 – ультрафильтрационный модуль;
3 – сосуд с раствором после диафильтрации, в котором остались
только растворенные или взвешенные высокомолекулярные соединения
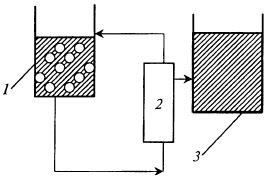
Рис. 17.9. Схема очистки, в которой продуктом является
низкомолекулярное соединение (например, антибиотик пенициллин):
1 – исходный раствор, содержащий низкомолекулярные
и высокомолекулярные растворенные вещества;
2 – ультрафильтрационный модуль;
3 – сборник пермеата с низкомолекулярными веществами
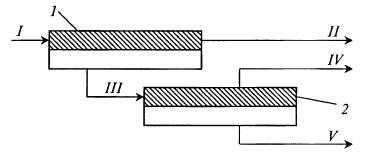
Схема, представленная на рис. 17.10, предусматривает двухступенчатое разделение, по сути фракционирование сыворотки на три потока.
Рис. 17.10. Схема процесса выделения протеина и лактозы из молочной сыворотки:
1 – ультрафильтрационный модуль; 2 – установка обратного осмоса или нанофильтрации;
I– разделяемая молочная сыворотка; II– протеиновый концентрат (сывороточные белки);
III – лактозосодержащий пермеат; IV – концентрат лактозы; V – сток без лактозы
Общая оценка процессов ультрафильтрации приведена ниже.
Преимущества:
- мягкие технологические режимы, нет перехода выделяемого вещества ни в жидкую органическую фазу, ни в твердую;
- возможность одновременно осуществлять очистку и концентрирование растворов;
- мембранные установки не имеют движущихся элементов, невелики по габаритам;
- из-за несжимаемости жидкостей энергетические затраты малы.
Недостатки:
- необходимость тщательной подготовки и очистки растворов;
- наличие концентрационной поляризации;
- значительные объемы пермеатов, требующих утилизации или очистки;
- трудности эксплуатации мембранных элементов в течение длительного времени без нарушения их целостности.