Форма и размеры
Клетки дрожжей имеют разнообразную форму: круглую, овальную или эллиптическую, лимонообразную, цилиндрическую, иногда сильно вытянутую в виде гифов.
По сравнению с другими микроорганизмами дрожжи являются довольно крупными формами. Диаметр клеток дрожжей достигает 1–8 мкм, длина – 1–10 мкм. При таких размерах клеток поверхность их в 1 л сбраживаемого виноградного сока может достигать 10 м2. Именно такая большая поверхность клеток дрожжей определяет интенсивность их метаболизма и процесса обмена веществ с окружающей средой. Масса дрожжевых клеток, равнозначная по массе животному (500 кг), за сутки синтезирует более 50 т белка, а животное – всего около 0,5 кг.
Плотность (удельный вес) клеток дрожжей мало отличается от плотности бактериальных клеток. Относительная плотность бактериальных клеток составляет от 1,050 до 1,112; дрожжевых – от 1,055 до 1,060 [139].
Морфологически неизменные формы клеток дрожжей наблюдаются только у молодых культур на стандартной питательной среде. Одна и та же культура дрожжей может состоять из клеток, различающихся по форме и размерам, особенно в зависимости от стадий развития и условий окружающей среды. Так, хересные дрожжи в период брожения, как правило, крупные, имеют эллиптическую или круглую форму клеток, тогда как в стадии образования пленки они становятся мельче, приобретают более вытянутую конфигурацию [177, 223]. Дрожжи рода Hansenula, обычно образующие пленку на поверхности вина из скоплений клеток сильно вытянутых, мелких, при развитии в среде с ограниченным доступом воздуха, например на дне бутылки, становятся крупнее, круглой формы. Форма и величина клеток дрожжей при введении СО2 в среду значительно изменяется. Размеры клеток пивных дрожжей (Sacch. carlsbergensis ) увеличиваются и, наоборот, клетки слабо бродящих дрожжей (Torula latvica) становятся значительно мельче [37].
Структура
Клетка дрожжей имеет сложное строение и состав. Размеры отдельных элементов ее находятся за пределами разрешающей способности светового микроскопа. Значительные успехи, достигнутые в настоящее время в расшифровке структур клетки дрожжей и их функций, основаны на новых методах исследования – электронной микроскопии и комплексной цитологии.
Дрожжевая клетка является одноклеточным микроскопическим организмом и имеет в основном то же строение, что и клетки животных и растений (рис. 16, 17). Внутри клетки содержатся компоненты, которые обычно подразделяются на органеллы и включения. К органеллам относятся клеточная оболочка, цитоплазматическая мембрана, цитоплазма, митохондрии, вакуоли, аппарат Гольджи, ядро. Включения – это временные образования клетки (гликоген, трегалоза, жир, метахроматин и др.К которые появляются и исчезают в процессе обмена веществ.
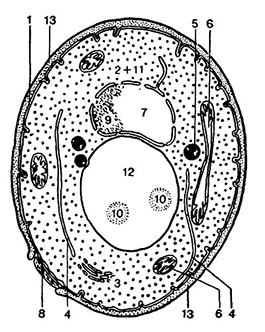
Рис 16. Схема строения дрожжевой клетки [280]:
1 – цитоплазматическая мембрана: 2 – цитоплазма; 3 – аппарат Гольджи; 4 – эндо плазматическая сеть;
5 – жировые капельки; 6 – митохондрия; 7 – ядро; 8 – рубец, где отпочковалась клетка; 9 – ядрышко;
10 – гранулы мстахроматина (волютина); 11 – рибосомы; 12 – вакуоль; 13 – клеточная оболочка.
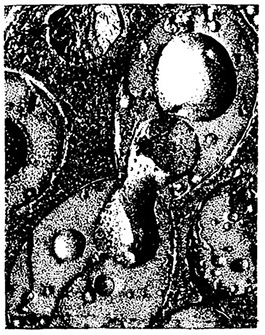
Рис. 17. Электронная микрофотография клетки дрожжей Saccharomyces cerevisiae [280]:
видны клеточная оболочка и цитоплазматическая мембрана, эндоплазматическая сеть, ядро, включения.
Клеточная оболочка – плотная, тонкая и эластичная, окружает цитоплазму и придает характерную форму клетке дрожжей, защищает ее от вредных факторов среды, несет электрический заряд. Оболочка поддерживает внутриклеточное осмотическое давление, регулируя поступление в клетку через поры солей и других низкомолекулярных соединений.
В химический состав клеточной оболочки входят белково-нолисахаридные комплексы, фосфаты и липиды. У Sacch. cerevisiae полисахаридная часть комплекса состоит примерно из равных количеств глюкана и маннана, сумма которых составляет около 90% от сухой массы оболочки; остальное количество ее приходится на долю белка, липидов, глюкозамина [165]. Белковые комплексы насыщены дисульфидными и сульфгидрильными группами. Липиды в основном (примерно на 2/3) состоят из свободных жирных кислот (олеиновой, пальмитолеиновой, пальмитиновой и стеариновой); остальную часть их представляют триглицериды, стерины и фосфолипиды.
В клеточных оболочках других видов дрожжей содержится глюкан, который не всегда связан с маинаном. Маннан может содержаться в клеточных оболочках дрожжей в небольших количествах (Sacch. guttulata и Endomycopsis capsularis), или совсем отсутствовать (Nadsonia fulvescens, Schizosaccharomyces). Оболочки клеток дрожжей, лишенные маннана, за исключением видов рода Schizosaccharomyces, содержат повышенные количества хитина.
В области периплазмы, которая находится между внутренней поверхностью клеточной оболочки и внешней поверхностью цитоплазматической мембраны, найден ряд ферментов. В основном это гидролитические ферменты, в том числе β-фруктофуранозидаза (инвертаза) и кислая фосфатаза.
Обычно с составом клеточной оболочки связывают явление хлопьеобразования (флокуляции) дрожжей. Для дрожжей, так же как и для бактерий, установлено, что переход S-форм (гладких) в R-формы (шероховатые) и образование хлопьев в жидкой среде обусловлены превращением гидрофильных групп клеточной оболочки в гидрофобные [115, 146]. Однако анализ клеточных оболочек дрожжей, выделенных из хлопьеобразующих и нехлопьеобразующих штаммов Sacch. cerevisiae и Sacch. carlsbergensis, выращенных на синтетической среде, не выявил значительных различий в содержании основных компонентов, хотя по мере роста как у тех, так и у других количество маннана постепенно уменьшалось, а глюкана – увеличивалось. И лишь активная связь фосфоманнана и ионов кальция у двух соседних хлопьеобразующих клеток дрожжей может служить объяснением явления флокуляции [275].
Электронно-микроскопически также не обнаружены какие-либо особенности клеточных оболочек у флокулирующих дрожжей. По-видимому, эффект флокуляции дрожжей обусловлен наследственностью штамма.
Цитоплазматическая мембрана образует наружный слой цитоплазмы. Она окружает протопласт – отдельную структурную фракцию клетки, которую можно получить при удалении клеточной оболочки с помощью ферментов. Цитоплазматическая мембрана состоит из разных по плотности электронных слоев общей толщиной не более 10 нм тесно связанных с цитоплазмой. При микроскопировании в темном поле мембрану можно наблюдать в виде тонкого светящегося ободка.
В клетке микроорганизма цитоплазматическая мембрана осуществляет 4 основные функции [165]: действует как осмотический барьер, регулирует проникновение питательных веществ из раствора в клетку и удаление продуктов обмена веществ, выполняет биосинтез некоторых составных частей клетки (компонентов клеточной оболочки), представляет собой место локализации некоторых ферментов и органелл (рибосомы).
Поступление (транспорт) веществ в клетку связано с изменением проницаемости мембраны, которая в свою очередь зависит от активности фосфолипазы и липазы [77].
Цитоплазма клетки дрожжей содержит все основные структуры, присущие высокодифференцированным клеткам, а именно: митохондрии, рибосомы, более или менее развитый эндоплазматический ретикулум (эндоплазматическая сеть), запасные вещества и другие внутриклеточные включения липоидной и углеводной природы. Они принимают активное участие в осуществлении важных ферментативных процессов в цитоплазме.
В результате электронно-микроскопических и биохимических исследований установлено, что цитоплазма представляет собой коллоидную систему, состоящую из белков, углеводов, липидов, минеральных веществ, воды и соединений других видов. По консистенции она характеризуется высоким показателем вязкости, превышающим вязкость воды в 800–8000 раз, что соответствует вязкости глицерина или густого сиропа. Вязкость цитоплазмы при старении клеток возрастает.
Структура цитоплазмы изменяется в зависимости от условий культивирования и возраста клетки. Изменения цитоплазмы могут быть обратимые (паранекроз) и необратимые (некротические), что обусловлено степенью воздействия внешних факторов. У молодых клеток дрожжей цитоплазма гомогенна; при старении появляются вакуоли, зернистость, жировые капельки, гранулы полифосфатов и липоидов, т. е. цитоплазма становится гетерогенной.
При длительном дифференциальном центрифугировании цитоплазма делится на растворимую фракцию (клеточный сок) и на фракцию частиц, состоящую из мембран и рибосом. Растворимая фракция, заполняющая пространство между частицами в пнтактной клетке, является основным компонентом, который обеспечивает взаимодействие метаболитов с той средой, где находятся и функционируют структурные элементы. В растворимой фракции содержатся вещества с высокой молекулярной массой, преимущественно ферменты и транспортная РНК (тРНК), а также низкомолекулярные соединения, к которым относятся запасные углеводы, например, трегалоза и фонд (пул) аминокислот и нуклеотидов [165]. В результате наличия в цитоплазме низкомолекулярных соединений возникает заметная разность в осмотическом давлении клеточного содержимого и наружной среды. Величина осмотического давления у дрожжей обычно составляет около 1,2 МПа [165].
Электронно-микроскопические исследования ультратонких срезов клеток показали, что цитоплазму пронизывает эндоплазматическая сеть (ретикулум), имеющая гранулярную или гладкую структуру. Тесный контакт ретикулума с другими компонентами клетки позволяет ему выполнять важную роль в обменных процессах клетки.
Одним из компонентов эндоплазматического ретикулума являются рибосомы. Это ультрамикроскопические плотные сферические гранулы. Они содержат почти равное количество РНК. и белка, незначительное – липидов. С функциональной особенностью рибосом связан синтез клеточных белков. На них происходит конденсация активированных аминокислот и укладка их в полипептидную цепь в соответствии с генетической информацией, переданной из ядра через информационную РНК [88].
Митохондрии – это высокоспециализированные обязательные мельчайшие органеллы дрожжевой клетки. Они обычно распределены равномерно между клеточной оболочкой и вакуолью. Их можно обнаружить не только в покоящихся клетках дрожжей, но и в клетках почкующихся, находящихся на различных стадиях роста и размножения, в почках и спорах. В монографии А. В. Котельниковой и Р. А. Звягильской «Биохимия дрожжевых митохондрий» [85] рассмотрена подробно структурно-функциональная организация дрожжевых митохондрий.
Форме и размерам дрожжевых митохондрий присуща изменчивость. Длина их у различных дрожжевых организмов составляет от 0,2 до 7,5 мкм. По форме они могут быть в виде небольших гранул, палочек, нитей, цепочек.
Обычно число митохондрий в клетке колеблется от одной да 50. Но даже если в клетке присутствует всего одна митохондрия, она занимает не менее 20% объема клетки. В дрожжах Sacch. cerevisiae объем этих органелл может достигать 80% объема всей клетки. При низкой концентрации глюкозы в среде дрожжевая клетка содержит 100–200 митохондрий, при высокой – 30–40.
Митохондрии совершают свои функции при непрерывном перемещении с изменением размеров и формы, характеризуются быстротой и специфичностью реакции на изменения условий культивирования и физиологического состояния клетки.
Митохондрии отделены от цитоплазмы наружной двухслойной мембраной. Внутренняя мембрана образует выступы-кристы, чаще всего пузырчато-трубчатого строения. Пространство между кристами заполнено гомогенным веществом – матриксом. Слой внешней мембраны митохондрий, прилегающий к цитоплазме, имеет шероховатую поверхность и содержит перфорацию нерегулярного устройства.
Факт обязательного присутствия митохондрий в структуре клетки свидетельствует о локализации в них особых процессов, важных в обмене веществ. Дрожжевые митохондрии состоят главным образом из липидов – около 30% и белков – 65–70% сухой массы митохондрий, из которых около 25–35% находятся в форме структурного белка.
Дрожжевые митохондрии содержат ферменты, которые обеспечивают выполнение основной энергетической функции (окисление субстратов в цикле Кребса, перенос электронов через дыхательную цепь и окислительное фосфорилирование) – участвуют в сложном механизме воспроизведения митохондриальной ДНК, транскрипции и трансляции генетической информации, в биосинтезе фосфолипидов стеринов, в активации жирных кислот и др. Дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК) составляют количественно небольшой структурный компонент митохондрий.
Одним из наиболее значительных достижений молекулярной биологии последних лет считают обнаружение в митохондриях специфической ДНК [85]. Митохондриальная ДНК (мДНК) существенно отличается от ядерного компонента ДНК клетки.
Вакуолив дрожжевых клетках являются обязательным органоидом. Кроме растворенных в воде электролитов, в вакуолях содержатся в коллоидном состоянии белки, жиры, углеводы и ферменты. В вакуолях накапливаются: Na, К, Са, Mg, Cl, SO4 и РО4 в виде отдельных элементов и солей, причем концентрация их во много раз превышает содержание солей в окружающей среде [109].
Размеры и форма вакуолей в дрожжевых клетках подвержены значительным изменениям. В одной дрожжевой клетке их может быть или несколько, или одна – центральная вакуоль.
Вакуоли содержат разнообразные включения как в состояли раствора, так и в форме кристаллических или аморфных гранул и капель; pH сока вакуоли 5,9–6,0; осмотическое давление составляет величину, близкую осмотическому давлению 2,5–3,5%-ных растворов хлористого натрия. Содержимое вакуоли обычно оптически пусто. Светятся лишь кристаллические и липоидные включения, находящиеся в энергичном броуновском движении. В вакуолях протекают активные окислительно-восстановительные процессы [109].
Аппарат Гольджи (диктиосома) состоит из ряда двойных мембран, концентрически изогнутых. Иногда от концов мембран отшнуровываются круглые пузырьки, которые могут затем превращаться в крупные вакуоли. Считают, что функция аппарата Гольджи заключается в управлении общим ходом физиологических процессов.
Ядро является постоянным структурным компонентом дрожжевой клетки. В живых дрожжах ядра можно отчетливо наблюдать в клетках, пробывших несколько дней в стерильной воде, цитоплазма которых вследствие голодания становится более гомогенной и прозрачной, а также при флуоресцентной микроскопии после обработки дрожжевых клеток растворами флуорохромов и при фазовоконтрастной микроскопии.
Ядро у дрожжей имеет оболочку, ядрышко (кариосому) и основное содержимое – кариоплазму. Оболочка принимает участие в регуляции внутриядерных процессов путем изменения проницаемости и непосредственных сообщений между ядром и внеклеточной средой и ядром и цитоплазмой [109, 168].
Диаметр дрожжевого ядра около 2 мкм, чаще всего ядра имеют шаровидную или эллиптическую форму. Расположение их может меняться в процессе жизнедеятельности клетки.
Размеры дрожжевого ядра неодинаковы не только в клетках различных родов, но и в клетках одной и той же культуры при разном физиологическом состоянии. Крупные ядра с отчетливой кариосомой наблюдаются у дрожжей представителей родов Saccharomyces, Schizosaccharomyces, Saccharomycodes. В противоположность им клетки, принадлежащие к слабо бродящим и небродящим дрожжам (Torulopsis pulcherrima, Т. utilis), имеют обычно относительно мелкие ядра. У растущих дрожжевых клеток ядра обогащаются нуклеиновыми кислотами и часто перемещаются в активные участки роста ближе к участкам, в которых происходит почкование или деление клеток.
Основным химическим ингредиентом ядра является ДНК. С нею и только с нею связана передача генетической информации от одного поколения клеток к другому. В состав ядра обязательно входит также РНК, но обычно в меньшем количестве, чем ДНК. Ядро содержит и белки, не связанные с нуклеиновыми кислотами. Молекулами ДНК и РНК обусловливаются синтез и особенности белков клетки. Поток генетической информации направлен от ДНК через РНК к белку (ДНК→РНК→белок).
Содержание ДНК в любой клетке или в организме строго постоянно и не зависит от условий внешней среды, от питания или от воздействия различных факторов, влияющих на метаболизм клетки. Так, количество ДНК в дрожжах Sacch. cerevisiae XII расы на различных фазах роста в пределах 72 ч составляло 0,18–0,17% в расчете на сухую биомассу. Содержание ДНК в дрожжевых клетках винных дрожжей после термической обработки почти не изменяется [6].
Нуклеотидный состав ДНК весьма специфическим образом зависит от вида организма. Однако число остатков аденина равно числу остатков тимина (т. е. А=Т), а число остатков гуанина равно числу остатков цитозина (Г = Ц), т. е. число пиримидиновых остатков равно числу пуриновых остатков (А + Г = Т + Ц). Близкие виды дрожжей имеют сходный нуклеотидный состав, а эволюционно отдаленные организмы весьма заметно различаются по этому показателю. Поэтому часто нуклеотидный состав ДНК используют как таксономический признак [76].
При размножении клеток в ядрах обнаруживаются структуры, содержащие ДНК,– хромосомы, которые у дрожжей можно видеть иногда на фиксированных препаратах при окраске [109]. В хромосомах ДНК, связанная с белками-гистонами, образует нуклеопротеидные нити толщиной около 10 нм [63]. Для конкретного вида дрожжей число хромосом, длина и форма их постоянны.
Однако данные о числе хромосом у дрожжей весьма противоречивы и пока не подкрепляются ни результатами электронномикроскопических исследований, ни генетическими данными [168].
В определенных условиях в природе и в эксперименте при воздействии различных химических и физических агентов число хромосом в клетке может изменяться. У гаплоидных клеток набор хромосом одинарный (п), у диплоидных – двойной (2 п). С увеличением числа хромосомных наборов возрастает содержание ДНК, увеличиваются размеры клетки, ее ядра и ядрышка. Гаплоидные клетки содержат точно половину того количества ДНК, которое обнаруживается в диплоидных.
Внутриклеточные включения и запасные вещества, находящиеся в цитоплазме и вакуолях клеток в процессе их жизнедеятельности,– это морфологически дифференцированные образования гранул гликогена, метахроматина (волютина), жироподобных веществ и капель жира, скоплений серы, кристаллов кислот и сахаров. Они находятся в клетке в осмотически инертной форме, обычно нерастворимы в воде.
Трегалоза (нередуцирующий дисахарид) и гликоген (полисахарид) содержатся в клетке в значительных пределах: трегалоза – от 20 до 150 мг, гликоген – от 30 до 100 мг на 1 г сухих веществ клеток. В дрожжах, выращенных в аэробных условиях, преобладает трегалоза, в то время как в дрожжах, взращенных анаэробно,– гликоген. С повышением температуры среды количество трегалозы в клетках увеличивается [4]. Гранулы гликогена появляются в начале брожения и постепенно исчезают к концу. По современным сведениям, гликоген у дрожжей Sacch. cerevisiae локализован снаружи цитоплазматической мембраны в периплазматическом пространстве и связан с нерастворимыми компонентами клеточных оболочек.
Липиды (жиры и жироподобные вещества), являясь важными компонентами цитоплазматических мембран органоидов клетки, выполняют и роль запасного питательного материала. Жиры дрожжей представляют собой смесь истинных жиров (глицеридов жирных кислот) с фосфолипидами (лецитин, кефалин) и стеролами (эргостеролом). Капельки жира в клетках дрожжей хорошо различимы в световом микроскопе благодаря тому, что они сильно преломляют свет. Особенно хорошо они видны у пленчатых дрожжей.
Фосфолипиды наряду со стеринами, каротиноидами и скваленами способствуют росту дрожжей и выполнению биосинтетических реакций в анаэробиозе [62, 240].
В зависимости от вида и условий культивирования дрожжи способны синтезировать от 1 до 74% липидов в расчете на сухую массу. Наибольшей способностью накапливать липиды в клетках обладают дрожжи Rhodotorula gracile. В клетках дрожжей этого рода количество липидов может достигать 74% сухой массы клеток.
Метахроматин (волютин), в состав которого входят преимущественно полифосфаты, находится в состоянии коллоидного раствора в вакуолях и без окраски или осаждения фиксаторами как правило неразличим. Однако иногда в результате каких-то отклонений в клеточном обмене веществ в вакуолях можно наблюдать метахроматин, частично выпавший из раствора в виде сферических гранул, хорошо преломляющих свет и энергично броунирующих. Метахроматин используется при построении клеточного протопласта и как источник энергии. Поэтому количество его уменьшается при активных синтетических процессах и увеличивается при задержанном размножении [109].
Сера, иногда содержащаяся в протоплазме дрожжей, обнаруживается по сильному преломлению света. Отложение серы в клетках дрожжей приводит к появлению инволюционных форм [223].
Клетки некоторых родов дрожжей (Rhodotorula, Sporobolomyces salmonicolor) окрашены в оранжевый и красный цвета, обусловленные содержанием пигментов, принадлежащих к группе каротиноидов. Дрожжи рода Candida (С. pulcherrima, С. reukaufii) на средах, содержащих железо, образуют колонии темно-красного цвета за счет красного пиразинового пигмента, в состав которого входит комплексно-связанное железо.
Итак, в структуре дрожжевой клетки содержатся различные вещества, изменения которых в результате биохимических процессов должны быть идеально согласованы между собой.
Переход клеток дрожжей от аэробного существования к анаэробному (брожение) сопровождается укрупнением ядра и кариосом, уменьшением содержания дезоксирибонуклеиновой кислоты; поверхность митохондрий по отношению к биомассе их вещества уменьшается; в клетках дрожжей бродильного типа обычно накапливаются метахроматин и гликоген.
Структура клеток дрожжей разных родов неодинакова. Установлено, что митохондрии, эндоплазматический ретикулум и оболочки клеток дрожжей Sacch. vini и Rhodotorula glutinis существенно различаются. Ультраструктурная организация клеток дрожжей Rh. glutinis более развита и специализирована, чем дрожжей Sacch. vini. У Rh. glutinis митохондрии более многочисленны, с более упорядоченной внутренней структурой, со значительно развитым и своеобразно построенным ретикулумом.
Размножение, рост и развитие культур дрожжей
Одним из последствий морфолого-физиологических изменений, объединяемых понятием развитие, является размножение – воспроизведение новой клетки, тождественной с материнской.
У большинства одноклеточных организмов следствием размножения является увеличение числа организмов в популяции. Процесс размножения клеток микроорганизмов обусловлен прежде всего «взаимосвязью» их с питательной средой, в которой создаются благоприятные физико-химические условия, регулирующие действие соответствующих ферментов. Установлено, что в период задержки роста клеток дрожжей выделяемые в среду мощные восстановители (редуцирующие ферменты), действуя на дисульфидные связи белка клеточной оболочки, делают ее проницаемой для питательных веществ из среды, чем и обеспечивается индуцированный биосинтез ферментов, в том числе конститутивных [77].
Размножение. В зависимости от условий культивирования клетки дрожжей размножаются вегетативным и' половым способами. Форма вегетативного способа размножения определяется принадлежностью к той или иной биологически самостоятельной группе – семейству – почкованием, делением, посредством почкования, завершающегося делением.
В результате цитологического изучения функциональной морфологии клеточных оболочек дрожжей, электронно-микроскопического исследования «родовых шрамов», или рубцов, остающихся на месте отделения дочерней клетки от материнской, описано 4 типа вегетативного размножения клеток дрожжей (рис. 18) [110]:
первый тип – у почкующихся дрожжей, например, семейства Saccharomycetaceae, рода Saccharomyces, когда материал оболочек материнских клеток непосредственно не переходит на оболочки дочерних клеток. Клетки в начальных стадиях своего роста получают тот материал клеточных оболочек, который синтезируется и накапливается у основания образующейся почки.
Рубцы располагаются в областях максимальной кривизны клеточной оболочки, часто тесно примыкая один к другому, по кругу или по спирали;
второй тип – у дрожжей семейства Saccharoinycoaaceae родов Saccharomycodes и Hanseniaspora, особенностью которых является полярное почкование с образованием множественного рубца. Почка образуется путем выпячивания почечного рубца, оставшегося от предыдущего почкования, и растяжения межклеточной перегородки;
третий тип – у делящихся дрожжей семейства Schizosaccharomycetaсеае, например рода Schizosaccharomyces, для которых характерным является биполярный рост клеточных оболочек. Новый материал стенок откладывается от центра к концам клетки в виде кольцеобразного выроста в месте ее деления;
четвертый тип – принадлежит цилиндрическим клеткам Endomyces magnusii. Структурные изменения при делении происходят на всей оболочке цилиндрической клетки. Если делений много, то оболочка состоит из нескольких пластин, расположенных параллельно и заключенных одна в другой на рубце.
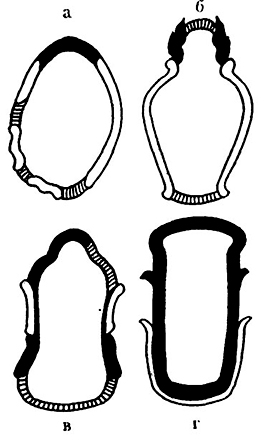
Рис, 18. Структура клеточной оболочки у дрожжей
с разными типами вегетативного размножения [110]:
а – Saccharomyces cerevisiae; б Saccharomycodes ludwigii;
в – Schi zosaccharomyces pombe; г – Endomyces magnusii.
В процессе вегетативного размножения дрожжей из материнской клетки в дочернюю переходит часть структурных образований цитоплазмы и ядра. При этом перед каждым клеточным делением в ядре хромосомы воспроизводятся все одновременно и по одному разу, чем и обеспечивается равное распределение их между материнской и дочерней клеткой. В основе превращения хромосом лежит молекулярный механизм воссоздания ДНК-При таком типе деления ядра, называемом митозом, в поколениях клеток сохраняется строго постоянное число хромосом [63].
Если рассматривать размножение дрожжей во времени, то в оптимальных условиях примерно за 1 ч происходит полное формирование новой дочерней клетки. Однако одна дрожжевая клетка не может бесконечно повторять процесс почкования. На протяжении всего периода жизни материнская клетка среднем имеет 25–30 родовых шрамов, т. е. почкований. Сдерживающим фактором является изменение структуры клеточной оболочки, связанное с образованием рубцов, уменьшающих полезную поверхность материнской клетки, что ведет к снижению обмена веществ и содержания РНК, ДНК, протеина в клетках и в конечном счете к гибели.
Половой способ размножения дрожжей, связанный с прорастанием аскоспор (спор, находящихся в сумках или асках) в вегетативные клетки, сопровождается мейотическим процессом деления ядра.
Резкий переход культивирования дрожжей из полноценной среды в среду, бедную питательными веществами, при достаточной влажности, значительном накоплении запасных веществ в клетке и доступе кислорода воздуха приводит к спорообразованию. Аскоспоры устойчивы к неблагоприятным внешним условиям, действию высокой температуры, высушиванию, но они менее термостабильны, чем бактериальные споры, и погибают при температуре 60°С, а споры бактерий выдерживают температуру кипящей воды и более высокую.
Аскоспоры обычно образуются в результате предшествующего полового слияния двух дрожжевых клеток и деления оплодотворенного ядра. В одном аске образуются 1–4, иногда 8 спор. При условиях, благоприятных для вегетативного развития, на свежей питательной среде споры прорастают и снова превращаются в почкующиеся клетки.
Жизненный цикл у дрожжей связан с чередованием вегетативного размножения и спорообразования с разной продолжительностью гаплоидной и диплоидной стадий (рис. 19). Дрожжи-сахаромицеты со сменой дипло- и гаплофаз делятся на 2 группы: гетероталличные и гомоталличные [64].
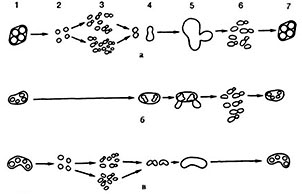
Рис. 19. Схема жизненного цикла дрожжей родов:
а – Saccharomyces; б – Saccharomycodes; в – Zygosaccharomyces
(1 – аскоспоры; прорастание спор; 3 – гаплофаза; 4–копуляция;
5 –зигота; 6 –диплофаза; 7 – скоры).
Гетероталличные штаммы дрожжей имеют устойчивые диплоидную и гаплоидную фазы. Диплоидные клетки могут неограниченно долго размножаться вегетативно, переходить при неблагоприятных условиях к спорообразованию, в результате чего образуются аски с гаплоидными спорами, каждая из которых принадлежит к одному из двух типов спаривания (а и а). При этом копуляция совершается лишь при встрече двух аскоспор или клеток из разных гаплоидных штаммов, происходит образование зигот и восстановление диплофазы (рис. 20) [63]. Природа различия клеток а и а обусловлена их способностью вырабатывать соединения гормональной природы. Предполагается, что «половой гормон» увеличивает активность ферментов, разрушающих клеточную стенку. Реакция клеток, предшествующая их копуляции (удлинение клеток), может проявляться при помещении клеток разных типов спаривания на некотором расстоянии одна от другой [64].
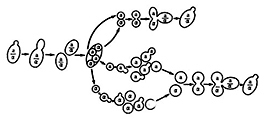
Рис. 20. Жизненный цикл (схема) гетсроталличных дрожжей
Saccharomyces ccrcvisiae;
α и a-типы спаривания.
Гомоталличные штаммы дрожжей отличаются от гетероталличных тем, что имеют только устойчивую диплофазу. Гаплоидные споры, изолированные из аска, образуют диплоидную культуру, т. е. в потомстве отдельной споры происходит слияние гаплоидных клеток – самодиплоидизация, за счет слияния спор в любых комбинациях сестринских гаплоидных клеток или материнской клетки со своей почкой. Типы спаривания существуют и у гомоталличных дрожжей [64, 121]. А. Ф. Руснак, проанализировав большой набор рас дрожжей вида Sacch. vini, используемых в виноделии, сделала вывод о преимущественно гомоталличной природе их [169].
Однако некоторые дрожжи, например Zygosaccharomyces и Schizosaccharomyces, длительное время размножаются вегетативно, находясь в гаплоидном состоянии. Перед спорообразованием гаплоидные клетки сливаются и образуется диплоидная зигота, которая делится путем мейоза и дает начало 4 или 8 гаплоидным спорам. Споры эти прорастают и начинают размножаться бесполым путем в гаплоидном состоянии.
При спорообразовании замедлен обмен веществ и общая жизнедеятельность микроорганизмов. Такое состояние обеспечивает их выживаемость в условиях, неблагоприятных для вегетативного размножения. Поэтому спорообразование, объединяющее в себе процесс размножения и сохранения вида, следует рассматривать как положительную стадию в индивидуальном развитии дрожжевых организмов [83].
Интересные результаты получены Б. Пазоньи [290] по влиянию половой стадии размножения у дрожжей на их жизненность и продуктивность. Культуры винных дрожжей, прошедшие массовую споруляцию с последующим прорастанием спор и диплоидизацией, превосходят те же культуры, не прошедшие этих стадий, по быстроте сбраживания виноградного сусла, и при испытании в полупроизводственных условиях наблюдалось сокращение периода главного брожения с 35 до 21–31 сут.
Рост и развитие культур дрожжей
Микробные культуры в жидкой питательной среде развиваются по кривой. Наблюдение за ходом ее, сопровождаемое определением морфолого-физиологических и химических изменений в клетках и вереде, является основным методом микробиологии [65, 151]. Фазы роста на определенных участках кривой могут свидетельствовать до некоторой степени об определенных стадиях развития и физиологическом состоянии культуры дрожжей (рис. 21). В общем виде кривая роста приведена на рис. 22. В периодических условиях культивирования различают 4 основные фазы роста.
Лаг-фаза – это период с момента внесения посевного материала в питательную среду до установившейся постоянной скорости роста культуры. Эта фаза включает латентный (скрытый) этап, когда микроорганизмы приспосабливаются к новым условиям и некоторое число клеток может даже погибнуть, и этап начала роста – этот период характеризуется интенсивной метаболической активностью, хотя число организмов в культуре или совсем не увеличивается или увеличивается незначительно. Наблюдается заметное увеличение размеров клеток, возрастает содержание в них общего белка, нуклеиновых кислот, энергично синтезируются адаптивные ферменты. Чем полноценнее среда и моложе культура, тем короче лаг-фаза. Если вносят значительное количество молодого посевного материала, то культура развивается без лагфазы [151].
Рис. 21. Стадии физиологического состояния дрожжей (схема):
а – почкующиеся клетки; б – мертвые клетки;
в – автолизированные клетки; г – покоящиеся клетки; д – аскоспоры.
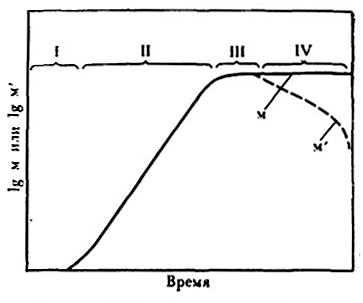
Рис. 22. Общий вид кривой роста одноклеточных микроорганизмов:
м – общее число клеток; м' – число жизнеспособных клеток;
I – лагфаза; II – экспоненциальная фаза; III – стационарная фаза; IV – фаза отмирания.
Логарифмическая, или экспоненциальная, фаза характеризуется максимальной скоростью размножения дрожжей, самой быстрой для данных условий. В этот период численность клеток и их суммарная биомасса возрастают в геометрической прогрессии. Средний размер клеток дрожжей становится минимальным, большинство из них – почкующиеся, с однородной цитоплазмой и тонкой оболочкой. Для них характерна физиолого-биохимическая активность и в то же время они более чувствительны к действию различных неблагоприятных факторов, чем зрелые и покоящиеся.
Культура состоит из «стандартных клеток». Однако длительность экспоненциальной фазы роста для периодических условий культивирования на жидких питательных средах невелика, так как питательные вещества потребляются из среды, а в ней накапливаются ненужные продукты обмена, т. е. среда постепенно становится менее благоприятной для роста, в результате чего культура переходит в стационарную фазу.
Чтобы стабилизировать культуру в одном и том же состоянии, применяют проточные, непрерывно обновляемые среды. В непрерывно обновляемой культуре устанавливается динамическое равновесие между составом среды и количеством клеток. Метод непрерывных культур имеет практическое применение в генетике: он позволяет наблюдать за появлением и исчезновением мутантных форм в популяции; в бродильной и микробиологи ческой промышленности он используется при производстве продукции определенного состава.
Стационарной фазе свойственно постоянное число живых организмов и максимальная плотность популяции. В этот период число погибающих клеток становится равным числу вновь образующихся, устанавливается уравновешенное размножение их и отмирание.
Фаза отмирания клеток характеризуется уменьшением числа жизнеспособных клеток в культуре, преобладанием мертвых, часто автолизованных. При брожении виноградного сусла эта фаза проявляется после полного сбраживания сахара и при выдержке виноматериала на дрожжевом осадке. В этой фазе наступает старость культуры, которая сопровождается резкой функционально-морфологической перестройкой клеток. Они становятся мельче, часто деформируются, протоплазма приобретает зернистый вид. Особенно вид клеток меняется при долгом пребывании дрожжей в осадке вина при недостатке или полном отсутствии кислорода воздуха. Количество протоплазмы у автолизующихся клеток постепенно уменьшается в результате расщепления белков под влиянием собственных протеолитических ферментов, клетки становятся почти пустыми с небольшими капельками жира. При длительном пребывании клеток дрожжей в осадке вина с доступом кислорода воздуха можно видеть покоящиеся формы, которые долго остаются жизнеспособными главным образом за счет усвоения органических кислот.
Каждая фаза соответствует определенным скоростям роста, для выражения которых пользуются абсолютными и относительными показателями. Абсолютную (валовую) скорость роста культуры (U) за определенный отрезок времени вычисляют по формуле [65, 152]


Величина экономического коэффициента зависит от характера энергетических процессов. При дыхании этот коэффициент относительно высок, при брожении он ниже и меняется в зависимости от условий.
Скорость роста дрожжей и ее лимитирование разнообразными факторами влияют на кинетические свойства культуры (популяции), на состав клеток и состав продуктов обмена веществ [152].
Рост культуры дрожжей на виноградном сусле определяется главным образом четырьмя факторами: концентрацией продуктов обмена (этанола), температурой, концентрацией растворенного кислорода и концентрацией клеток дрожжей. Поскольку этиловый спирт всегда присутствует в бражке, а брожение протекает в анаэробных условиях (концентрация растворенного кислорода практически равна нулю) обычно при постоянной температуре, влияние этилового спирта на рост культуры имеет решающее значение и основным уравнением кинетики процесса является уравнение [27]:
µ = 0,19 – 0,019 * P,
где Р – концентрация этилового спирта, % об.
Следует отметить, что в литературе еще мало сведений, которые позволили бы выявить зависимость образования определенных продуктов брожения от той или иной скорости роста культуры (популяции) и вида фактора, ограничивающего рост. Изучение это осуществимо только при непрерывном методе культивирования, математическое описание которого позволяет отойти от эмпирического подбора оптимальных условий [19, 32, 59,123]

