Адаптация
Выращивая дрожжи при постепенно изменяющихся условиях культивирования, можно получить новые формы их, приспособленные к высоким концентрациям сернистой кислоты, сахаров, этанола, кислой реакции среды, к высоким или низким температурам и т. п.
Показательным примером выведения новых форм дрожжей в процессе адаптации может быть работа, проведенная Н. Ф. Саенко по получению спиртоустойчивых дрожжей для хересного производства [178].
Н. Ф. Саенко разработаны методы селекции хересных дрожжей на спиртоустойчивость, основанные на адаптации в процессе непрерывного культивирования их в периодически обновляемой среде, в которой постепенно повышалась концентрация спирта, и при последовательных пересевах на вино с постепенно повышающейся концентрацией спирта от 14 до 17% об. Получены спиртоустойчивые расы Херес 20-С/96К, Херес 20-С/96-5 и другие, которые образуют сплошной рост на вине на третьи сутки.
По данным, приведенным в табл. 20, можно судить также об усилении биохимической активности полученных рас хересных дрожжей – при поверхностном развитии накопление в вине ацетальдегида и ацеталя – компонентов, обусловливающих специфический хересный тон в вине.
Таблица 20

При адаптации дрожжей, применяемых для изготовления плодово-ягодных вин, к повышенной концентрации сахара получена раса Вишневая 33, которая быстро и полно сбраживала яблочное сусло с содержанием сахара 28%. При этом количество образовавшегося спирта составляло 16,8% об. [178].
Культивированием при постепенно повышающейся температуре получен наиболее термостойкий вариант дрожжей расы Ркацители 6. Он отличается от исходной расы более полным выбраживанием сахара и высокой жизнеспособностью клеток при температуре 37–38°С [10].
В результате длительной адаптации нескольких рас винных дрожжей к температуре 38°С нами получены термотолерантные формы, которые по сравнению с исходными культурами больше синтезируют витаминов (пантотеновой кислоты, пиридоксина), обладают более высокой энергией брожения и резко сниженной энергией дыхания. Однако методом адаптации не удается быстро усиливать определенные полезные свойства у дрожжей.
Индуцированный мутагенез
Селекция с применением разнообразных мутагенов является методом, наиболее интенсивно используемым в работах по повышению продуктивности полезных форм микроорганизмов. Под мутацией понимается стойкое изменение генетически значимых структур, функция которых воспроизведение типичной организации клетки из поколения в поколение. Мутации делят на два вида:
- цитоплазматические – наследственные изменения, возникающие в цитоплазме и передаваемые с цитоплазмой,
- ядерные – наследственные изменения, возникающие в ядре и передаваемые с ядром.
При искусственном получении мутаций главная роль принадлежит методам радиационного и химического мутагенеза при использовании УФ-лучей, рентгеновских лучей и нейтронов, азотистой формы иприта, этиленимина и диэтилсульфата и др. Об эффективности индуцированного мутагенеза судят по частоте возникновения активных вариантов, достоверно превышающих по активности крайние варианты контрольного ряда, а окончательная проверка осуществляется в производственных условиях [43].
Селекция винных дрожжей с применением мутагенов – ультрафиолетовых лучей и паров диэтилсульфата (ДЭС) – проведена С. И. Алиханяном и Г. М. Налбандяном [12, 13]. Новые формы дрожжей характеризуются высокой спиртонакапливающей способностью. Они рекомендованы для сбраживания виноградных соков с высоким содержанием сахара при изготовлении натуральных крепких столовых вин, устойчивых к помутнениям биологического характера. При проведении опытов спиртоустойчивые штаммы Sacch. oviformis на поверхности вина с содержанием спирта 17,5% об. быстро образовывали пленку, в течение 30 дней ферментации накапливали от 700 до 800 мг/л альдегидов. Ни в одном случае в контрольных образцах, засеянных исходным штаммом Sacch. oviformis Херес 96К, клетки не размножались.
Получены мутантные формы дрожжей, образующие зернистые, подвижные осадки. Однако эти штаммы не нашли широкого применения в винодельческой промышленности.
Гибридизация
Применение гибридизации в селекции основано на возможности объединения полезных признаков скрещиваемых штаммов и на получении гибридов, обладающих гетерозисом (более мощным ростом и размножением, чем исходные родительские формы) по одному или нескольким признакам. Наименее разработана гибридизация полезных форм микроорганизмов, вследствие чего практический эффект ее в селекции более продуктивных форм невелик.
Гибридизация дрожжей основана на способности спор или гаплоидных клеток копулировать между собой. В результате копуляции и слияния ядер образовавшаяся зигота при размножении вегетативным путем дает гибридные диплоидные клетки. В практической работе по гибридизации дрожжей пользуются скрещиванием как спор, так и гаплоидных клеток.
Искусственная гибридизация гетероталличных дрожжей на уровне аскоспор была проведена впервые О. Винге и О. Лаустзеном в 1938 г. Они соединяли аскоспоры дрожжей одного или различных видов попарно в каплях питательной среды при помощи микроманипулятора. В нашей стране такой метод гибридизации впервые был применен К. В. Косиковым [83, 84].
Другой метод гибридизации гетероталличных дрожжей был предложен в 1943 г. К.Линдегреном и Г. Линдегрен. Он основан на смешивании устойчивых гаплоидных культур, полученных из одиночных спор, с последующей изоляцией зигот при помощи микроманипулятора. При размножении такие зиготы образуют диплоидные гибридные культуры.
Что касается третьего способа гибридизации гомоталличных штаммов [64], то в этом случае гаплоидные споры, изолированные из аска, образуют диплоидную культуру, т. е. в потомстве отдельной споры происходит слияние гаплоидных клеток.
При помощи микромаиипулятора путем скрещивания спиртовых рас Sacch. cerevisiae (расы Я) с Sacch. carlsbergensis К. В. Косиковым и О. Раевской [43, 84] получены для спиртового производства гибриды, сбраживающие полностью рафинозу.
Весьма интересными являются опыты по скрещиванию форм, относящихся к разным семействам: Sacch. cerevisiae и Schiz. pombe.
Полученный гибрид обладал морфологическими и физиологическими особенностями.
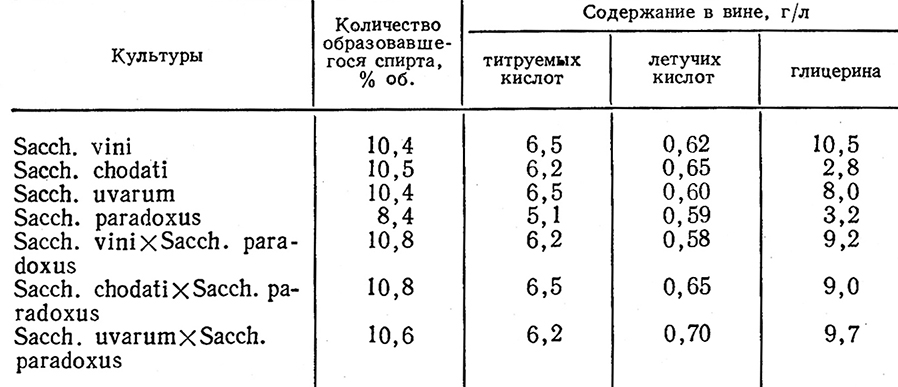
Таким же методом с использованием микроманипулятора Г. И. Мосиашвили и И. Д. Шалуташвили получили гибриды дрожжей для виноделия [120]. Было проведено скрещивание рас различных видов рода Saccharomyces (Sacch. vini раса Кахури 42, Sacch. chodati раса ГИВ-51, Sacch. uvarum раса С-61) с расой Sacch. paradoxus, обладающей высокой пектолитической активностью.
Новые формы дрожжей наряду с высокой энергией брожения обладали пектолитической активностью, что позволяло получать вина лучшего качества. Основные показатели гибридных культур приведены в табл. 21.
Таблица 21
Селекцию дрожжей для виноделия на основе получения гибридов ведут ученые Франции [259], Италии [336], США [250], ФРГ [330]. Получены мутантные формы, не образующие пену и отличающиеся от исходных дрожжей электрофоретической подвижностью. Однако условия брожения также могут влиять на этот признак, поскольку пенообразование обусловлено выделением дрожжами белков и полисахаридов [250].
Гаплоидные и диплоидные штаммы дрожжей, несмотря на одинаковую биомассу, различались по спиртообразующей способности, причем больше спирта давали диплоидные штаммы [330].
Гибридизацию можно применять для получения полиплоидного эффекта. Существование у дрожжей копуляции гаплоидных клеток и клеток более высокой плоидности позволяет последовательно вводить гаплоидные геномы в клетку, постепенно повышая таким образом плоидность.
Так можно получить полиплоидные серии от гаплоида до гексаплоида, которые остаются стабильными в отношении их плоидности при вегетативном размножении [64].
Методические трудности обнаружения у дрожжей хромосом вследствие относительно малых их размеров привели к тому, что полиплоидность у дрожжей преимущественно определяется косвенными методами: морфологическим (объем клеток и ядер); биохимическим (количество ДНК, РНК и других химических компонентов в клетке); генетическим (частота летальных мутаций, индуцированных радиацией, анализ расщепления по маркерам) [107].
Спонтанная полиплоидизация у сахаромицетов может возникать не только в результате эндомитоза, но и путем прямой копуляции диплоидных клеток и конъюгации материнской клетки с одной или несколькими почками. Более того, высказывается мнение, что все культурные дрожжи и наиболее близкие к ним дикие формы практически полиплоидны, при этом чаще всего встречаются триплоиды. Так, выделен из производства штамм винных дрожжей (RS-6), обладающий высокими производственными показателями. Генетический анализ показал, что штамм является триплоидом [107]. Установлена триплоидная природа хлебопекарной расы 14-2 (рис. 27) [141].
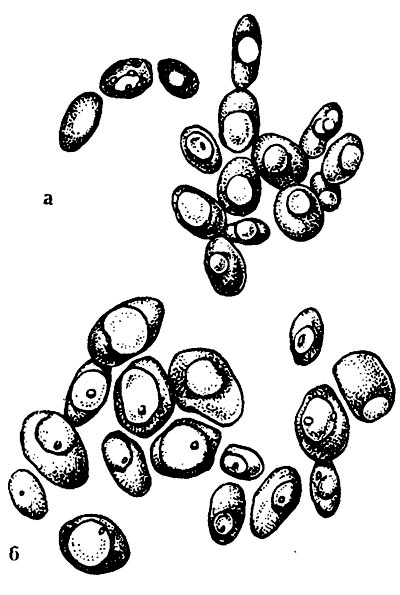
Рис. 27. Культуры дрожжей (Х1200) [141]:
а – диплоидная; б – триплоидная.
Существование высокопродуктивного триплоида среди производственных штаммов подтверждает перспективность экспериментального получения и использования полиплоидных форм дрожжей в практической селекции. У дрожжей рода Saccharomyces (Sacch. cerevisiae, Sacch. vini и Sacch. oviformis) полиплоидные формы получены действием камфоры, а-нафтиламина, аценафтена и хризина, колхицина, УФ-облучения с последующей гибридизацией, а также посредством межвидовой и внутривидовой гибридизации. Межвидовые и внутривидовые тетраплоидные гибриды, созданные А. Ф. Руснак [170] на основе ауксотрофных мутантов рас винных дрожжей Ленинградская (Sacch. oviformis) и С-28 (Sacch. vini), отличаются от исходных форм. Представленные данные свидетельствуют о большей скорости брожения (на 30% и выше) у тетраплоидной культуры по сравнению с диплоидной.
Полиплоидные расы дрожжей, имеющие клетки большего объема, быстрее оседают, их можно легче и полнее отфильтровывать. В то же время крупные клетки легче разрушаются при механических воздействиях при помощи дезинтеграторов, что особенно важно для получения практически ценных эндоферментов, не накапливающихся в культуральной жидкости, или выделения других физиологически активных веществ, содержащихся в самой клетке [43, 82, 190]. Однако широкого практического применения полиплоидные формы дрожжей пока не получили. Это обусловлено тем, что биохимические свойства полиплоидных форм дрожжей и методы их экспериментального получения мало изучены.
Производственный метод селекции дрожжей
Основой этого метода является повторное выделение в производственных условиях ряда культур, сравнение их и отбор лучшей для дальнейшего применения. Этот метод предложен В. И. Кудрявцевым [90, 91] и основан на изменениях культур дрожжей, возникающих в результате влияния условий производства. Область его применения суживается, поскольку выделение культуры в производстве, где условия нестерильны, может приводить не только к усилению, но и к ослаблению ее или к вытеснению спонтанной флорой. По этой причине селекция в производстве не нашла отражения в условиях приготовления виноматериалов. В шампанском производстве бутылочным методом, где действие посторонней микрофлоры минимально, В. И. Кудрявцев и Р. Д. Зубкова [91] выделили новые расы дрожжей, которые по производственным показателям значительно превосходят исходные. Однако при обследовании заводов шампанских вин акратофорного производства [204] установлено, что производственный метод селекции дрожжей привел к вытеснению дрожжей вида Sacch. vini дрожжами Sacch. oviformis, которые оказались более приспособленными к жизнедеятельности в вине.
На Горьковском заводе шампанских вин был получен производственный штамм расы Штейнберг 1892 г. – Штейнберг Горьковский. Позднее на Ленинградском заводе шампанских вин из штамма Штейнберг Горьковский была отселекционирована новая производственная раса Ленинградская [174].
Н. Ф. Саенко отмечала, что все полученные производственные штаммы хорошо бродят при температуре 11 – 12°С и при pH 2,8–3,0, но все они потеряли зернистую структуру осадка исходной расы Штейнберг 1892 г.
Однако проведенное нами определение систематического положения дрожжей расы Ленинградская, применявшейся на заводах с резервуарным методом шампанизации, показало, что она принадлежит к виду Sacch. oviformis, а не к Sacch. vini, к которому относится Штейнберг 1892 г. [204]. Определение скорости размножения клеток дрожжей рас Штейнберг 1892 г. и Ленинградская на вине с содержанием этилового спирта 11,15% об. и глюкозы 8,15% показало, что дрожжи расы Ленинградская размножаются быстрее. Количество клеток дрожжей было через 24 ч у расы Штейнберг 5,7 млн./мл, а у расы Ленинградской–11,9 млн./мл. Из рис. 28 видно, что при применении дрожжей расы Ленинградская вино забраживает раньше, чем при использовании дрожжей расы Штейнберг 1892 г.
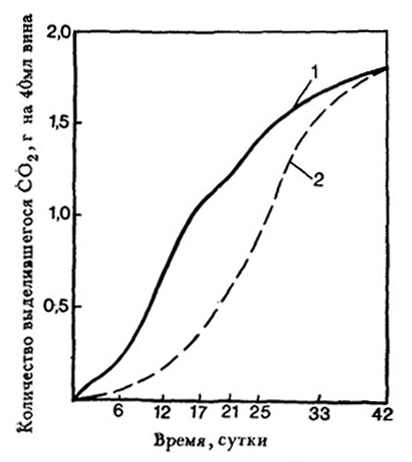
Рис. 28. Интенсивность брожения вина при использовании дрожжей различных видов:
1 – Sacch. oviformis раса Ленинградская;
2 – Sacch. vini раса Штейнберг 1892 г.
На Киевском заводе шампанских вин производственная селекция позволила отобрать расу Киевская вида Sacch. oviformis, хотя применявшаяся там культура дрожжей Ркацители 6 принадлежит к виду Sacch. vini [204].
Анализ дрожжевых осадков из лучших по результатам брожения вин в акратофорах Харьковского, Ростовского и Алма-Атинского заводов шампанских вин, проведенный нами в 1964 г. путем их рассева на плотную питательную среду, выделения отдельных колоний и определения их систематического положения, показал, что на этих заводах также используются дрожжи вида Sacch. oviformis.
Таким образом, производственный метод селекции позволил отобрать дрожжи, более приспособленные к условиям шампанского производства. Такими культурами оказались дрожжи вида Sacch. oviformis, попавшие в акратофоры вместе с шампанизируемым нестерильным виноматериалом, а не производственные штаммы рас Штейнберг 1892 г. и Ркацители 6 вида Sacch. vini.
Более поздние исследования микрофлоры большинства заводов шампанских вин показали, что процесс шампанизации и в настоящее время осуществляется дрожжами вида Sacch. oviformis (по систематике Лоддер – Sacch. bayanus) [55]. В производственной дрожжевой разводке в качестве сопутствующих дрожжей выявлены дрожжи Sacch. vini, а также родов Candida, Pichia и иногда Brettanomyces. Основным источником инфицирования чистой культуры дрожжей в производственных условиях являются шампанские виноматериалы и приготовляемая из них бродильная смесь, которую используют в качестве питательной среды для размножения дрожжей [55].
* * *
Таким образом, производство вин связано с жизнедеятельностью дрожжей. Брожение виноградного сусла, шампанизация и хересование вин происходят в результате сложных биохимических реакций, осуществляемых дрожжевыми клетками. В зависимости от физиолого-биохимических особенностей дрожжей и технологических приемов, создающих разные условия для их жизнедеятельности (состав среды, температура, режим аэрации), образуются разнообразные продукты обмена веществ дрожжей, которые определяют тип получаемого вина, оказывают влияние не только на вкусовые и ароматические свойства, но и на формирование вин в процессе выдержки и хранения.
На основании оценки видов и рас дрожжей рода Saccharomyces и других родов дрожжей, встречающихся в виноделии, определения оптимальных условий развития их и биосинтеза тех или иных продуктов метаболизма с целью более эффективного использования технологических возможностей дрожжей для повышения качества вин предлагаются следующие рекомендации.
1. Определение возбудителей брожения. Микроскопирование позволяет определить физиологическое состояние дрожжей и идентифицировать некоторые дрожжи по способу их размножения, по величине и форме клеток и спор. Однако такая характеристика недостаточна для определения состава дрожжей, участвующих в брожении, и оценки возможного влияния их на качество продукции на разных этапах виноделия. Поэтому для определения возбудителей брожения необходимо уметь определять род и вид дрожжей, пользуясь их систематикой.
2. Контроль условий развития дрожжей. Необходимо следить за размножением дрожжей, изменением их физиологического состояния, а также за скоростью брожения. Весьма опасной является преждевременная остановка брожения вследствие массового отмирания дрожжей. Возобновить размножение дрожжей и завершить сбраживание сахаров в таких случаях очень трудно. Для дображивания рекомендуются расы дрожжей вида Sacch. oviformis.
3. Регулирование режимов технологического процесса для предотвращения развития вредных микроорганизмов. После окончания брожения молодые виноматериалы, находящиеся на осадках дрожжей, самоосветляются. Степень осветления рекомендуется проверять микроскопированием их после центрифугирования, при этом обращают внимание на физиологическое состояние дрожжевых клеток (процент мертвых, ход автолиза) и наличие посторонней микрофлоры.
По окончании спиртового брожения, если не приняты соответствующие меры (быстрое снятие виноматериалов с дрожжевого осадка и повышенная сульфитация), в вине обычно развиваются молочнокислые бактерии. Внешним признаком наличия молочнокислых бактерий в молодом вине служит образование легкого осадка, слабое выделение углекислоты. При микроско-пировании в нем обнаруживаются палочки или кокки. Если в виноматериалах необходимо понизить кислотность, то следят за развитием бактерий. После использования ими яблочной кислоты виноматериалы обрабатывают, чтобы освободить их от бактерий, и сульфитируют.
Виноматериалы, находящиеся на хранении, следует микроскопировать не реже одного раза в месяц.
Микробиологическое состояние вина проверяют также на других стадиях технологического процесса: при переливках, оклейках, доливках, фильтрации путем микроскопирования после центрифугирования.
4. Определение веществ, усиливающих и угнетающих развитие дрожжей. Помимо необходимых витаминов стимулировать развитие дрожжей могут и другие вещества. Например, пировиноградная кислота (по 60 мг/л) и уксусный альдегид (по 14 мг/л), вводимые перед началом брожения, активируют размножение дрожжей; экстракты дрожжей (специально гидролизованные) также положительно влияют на рост дрожжей, активируют брожение. Однако продукты эти еще мало изучены.
К химическим веществам – антисептикам, угнетающим развитие дрожжей и бактерий, допущенным к использованию в виноделии Министерством здравоохранения СССР, относятся сернистая кислота, сорбиновая кислота, аллилгорчичное масло. Из физических способов угнетения брожения в виноделии рекомендуются только нагревание и охлаждение. Ультрафиолетовые лучи, ультразвук, ионизирующие излучения пока не рекомендуются.
Микробиологический контроль ведут в соответствии с инструкциями, в которых изложены методы исследования, объекты микробиологического контроля, определение микробиологической стойкости виноматериалов при выдержке и хранении вин, подготовленных к розливу [184].

