ХАРАКТЕРИСТИКА ОСНОВНЫХ ГРУПП
МОЛОЧНОКИСЛЫХ БАКТЕРИЙ И ИХ КЛАССИФИКАЦИЯ
Схемы классификации
Изучение процессов, вызываемых молочнокислыми бактериями в вине, должно проводиться после предварительного таксономического исследования и определения видовой принадлежности бактерий-возбудителей. Без таксономической идентификации бактерий даже тщательные технологические и биохимические исследования не смогут установить закономерностей в жизнедеятельности бактерий и воспроизвести их. Поэтому все работы в этой области прежде всего начинаются с изолирования из вин чистых культур молочнокислых бактерий и определения их вида.
Первую научную систему классификации молочнокислых бактерий разработал Орла-Иенсен в 1919 г.
Швейцарские исследователи Г. Мюллер-Тургау и А. Остервальдер подробно изучили химические изменения в больных винах, выделили возбудителей заболевания, изучили их морфологические, культуральные и биохимические свойства и присвоили им видовые названия Bact. mannitopoeum, Bact. gracile, Bact. intermedium, Micrococcus acidovorax, Micrococcus variococcus. Перечисленные названия были даны, однако, произвольно, без сопоставления с известными, уже описанными видами. В современных учебниках по технологии и микробиологии виноделия приводятся описания и названия этих микроорганизмов, которые при критическом рассмотрении являются в лучшем случае синонимами известных ранее.
Е. И. Квасников обосновывает необходимость сравнительного подхода к изучению молочнокислых бактерий, выделенных из различных природных субстратов [68, 73].
Большой вклад в изучение молочнокислых бактерий вина и их классификацию сделан группой ученых винодельческой стандии в Бордо (Франция) под руководством Э. Пейно [295, 300, 315]. Ими изучено более 700 штаммов молочнокислых бактерий, выделенных из вин, и установлено соответствие признаков бактерий, описанных Г. Мюллером-Тургау и А. Остервальдером, вновь выделенным бактериям, идентифицированным по современным системам.
В табл. 33, составленной 3. Д. Рабинович по работам Э. Пейно, приведены возбудители заболеваний вина, идентичные по своим признакам и свойствам ранее описанным.
Таблица 33

Таким образом, молочнокислые бактерии вина, описанные Г. Мюллером-Тургау и А. Остервальдером, нашли место в общей системе классификации молочнокислых бактерий и должны именоваться согласно номенклатуре, принятой в настоящее время. Исключение составляет Bact. tartarophtorum, описание которой не удалось идентифицировать ни с одним из выделенных штаммов. Э. Пейно считает, что свойство разлагать винную кислоту, положенное в основу характеристики данного вида, присуще также молочнокислым бактериям других видов и не может считаться основным видовым признаком.
В последние годы было предложено много новых схем и принципов классификаций.
Кроме общепринятых методов изучения морфологических, культуральных и физиологических свойств в качестве диагностических признаков учитывают потребность молочнокислых бактерий в витаминах, инфракрасные спектры поглощения, химический состав клеточных оболочек бактерий, серологические свойства, данные хроматографического изучения свободных аминокислот и другие методы [185].
Подробный анализ имеющихся схем классификаций молочнокислых бактерий проведен Е. И. Квасниковым и О. А. Нестеренко в монографии [73]. Схема классификации, предложенная для молочнокислых палочек английскими исследователями М. Рогозой и М. Шарп, признана европейскими микробиологами наиболее удовлетворительной [317].
Род Lactobacillus
К роду молочнокислых бактерий Lactobacillus относятся грамположительные неветвящиеся палочки, неподвижные, не восстанавливающие нитратов в нитриты, не образующие каталазы, сбраживающие углеводы с образованием молочной кислоты. Они характеризуются сложными потребностями в источниках питания, слабой дыхательной активностью, незначительным воздействием на белки и жиры, относительно кислотоустойчивы (способны расти при pH 3,8 и ниже), развиваются в анаэробных условиях.
До настоящего времени общепринятым является разделение рода лактобацилл на три подрода, проведенное Орла-Иенсеном: Thermobacterium объединяют гомоферментативные бактерии, которые развиваются при высоких температурах; Streptobacterium – гомоферментативные, развивающиеся при температурах 15–30°С; Betabacterium – гетероферментативные бактерии.
Для определения вида молочнокислых бактерий в литературе описан 41 тест [70]: рост при температуре 15 и 45°С и в присутствии 0,4% типоля, характер роста в лакмусовом молоке, предельное кислотообразование в молоке, конфигурация образуемой молочной кислоты, образование зерен волютина, образование .аммиака из аргинина и углекислого газа из глюкозы и цитратов, гидролиз эскулина, сбраживание арабинозы, ксилозы, рамнозы, фруктозы, маннозы, галактозы, сорбозы, а-метил-D-маннозида, а-метил-D-глюкозида, мальтозы, лактозы, сахарозы, трегалозы, целлобиозы, мелибиозы, рафинозы, мелезитозы, инулина, декстрина, гликогена, крахмала, глицерина, эритрита, адонита, маннита, дульцита, сорбита, инозита, салицина, амигдалина.
А. А. Ленцнер, М. А. Тоом и сотр. [132] отобрали 16 тестов, диагностическая ценность которых, по их мнению, достаточна для определения вида лактобацилл. В табл. 34 приведены физиолого-биохимические свойства некоторых видов молочнокислых бактерий и видовая характеристика палочковидных бактерий, составленная ими с учетом общепризнанных схем классификации.
Таблица 34
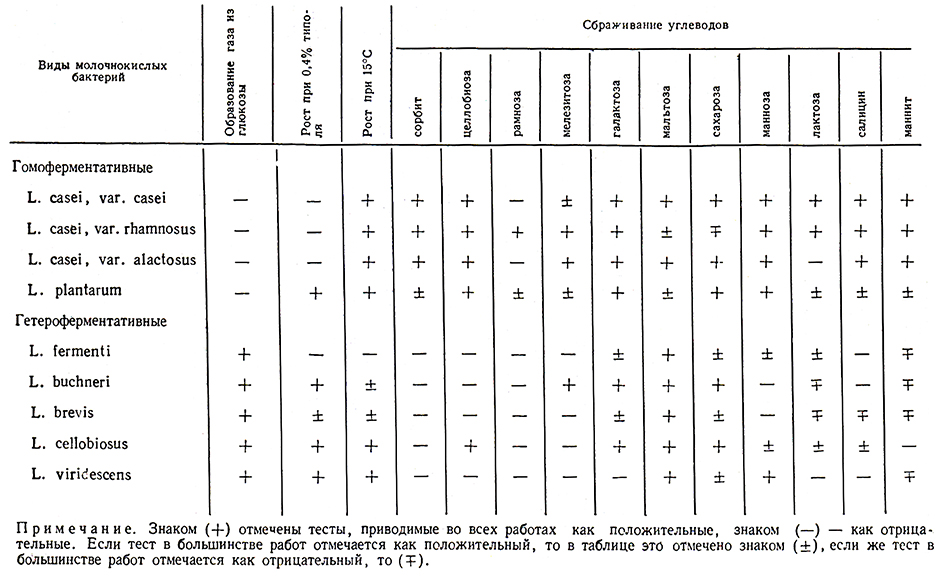
Согласно схеме классификации М. Рогозы и М. Шарп [317], гетероферментативные палочки L. buchneri отличаются от L. brevis сбраживанием мелезитозы, L. fermenti отличаются от других гетероферментативных палочек тем, что не растут при температуре 15°С, а растут при 45°С. Гомоферментативные палочки L. plantarum отличаются от гетероферментативных сбраживанием целлобиозы, рамнозы, мелезитозы, маннозы и другими признаками (рис. 32 и 33).

Рис. 32. Lactobacillus plantarum (Х1000) (315].

Рис. 33. Lactobacillus brcvis (Х1000) [315].
Французские исследователи [266, 315] предлагают и следующим образом обосновывают необходимость введения специфической классификации молочнокислых бактерий для энологической бактериологии. Сбраживание мелезитозы, целлобиозы, рафинозы и других сахаров для энологии не имеет большого практического значения. Гораздо важнее отношение бактерий к сахарам, распространенным в винных средах, таким, как арабиноза и ксилоза.
Функция сбраживания пентоз у кокков и палочек заслуживает особого внимания. Оказывается, что кокки чрезвычайно редко сбраживают ксилозу, но еще реже палочки сбраживают арабинозу. Также немногочисленны кокки, которые сбраживают обе эти пентозы, и палочки, которые не сбраживают ни одну из пентоз.
Таким образом, обнаруживается параллелизм между формой клеток и некоторыми функциями брожения. Эти наблюдения придают большую ценность тестам сбраживания пентоз. В связи с этим предложен для дифференциации молочнокислых палочек пентозный тест, который взят за основу в системе классификации Вогна. Для энологической классификации предложен и второй тест – сбраживание лимонной кислоты.
В табл. 35 приведена классификация молочнокислых бактерий вина на основании пентозного теста и сбраживания лимонной кислоты [315].
Таблица 35

Таким образом, по энологической классификации имеется две разновидности L. plantarum: гомоферментативные бактерии, сбраживающие пентозы и разлагающие лимонную кислоту, и бактерии, разлагающие лимонную кислоту и не сбраживающие пентоз. Такая характеристика бактериальных видов удобна для практического виноделия.
Род Pediococcus
К роду Pediococcus относятся грамположительные, неспорообразующие, неподвижные кокки, располагающиеся единично, парами, кучками (см. рис. 36), тетрадами, но никогда цепочками; микроаэрофильные или анаэробные, часто требующие присутствия СО2 для роста, образующие D (–) молочную кислоту или смесь кислот D (–) и L ( + ), не восстанавливающие нитраты и нитриты, не разжижающие желатину, в основном не образующие каталазу, гомоферментативные. Некоторые штаммы продуцируют слизь из сахарозы [73].
В вине встречается вид Pediococcus cerevisiae – гомоферментативные кокки, не сбраживающие пентоз. Этот вид анаэробен и требует для своего роста присутствия углекислого газа. Всегда сбраживает глюкозу, фруктозу, маннозу, целлобиозу, трегалозу.
Гомоферментативные кокки, сбраживающие пентозы, относятся к виду Pediococcus pentosaceus.
Род Leuconostoc
Бактерии рода Leuconostoc относятся к гетероферментативным коккам, имеющим удлиненную яйцевидную форму; располагаются единично, парами или короткими цепочками (рис. 34, 35). Особенностью лейконостоков является неспособность их образовывать из аргинина аммиак, как правило, они не имеют каталазы. При сбраживании углеводов наряду с молочной кислотой образуют СО2, этиловый спирт и летучие кислоты; некоторые штаммы образуют маннит из фруктозы. Растут при температуре 10°С, но не при 45°С [73].

Рис. 34. Leuconostoc gracilc (X1000) 1315).
Рис. 35. Lcuconostoc oenos (X+) (X1000) [315].
Энологический интерес представляет отношение гетероферментативных кокков к пентозам, которые сбраживаются преимущественнее гексоз. Брожение сахарозы и гексоз часто ослабленное и эта черта стабильная, не адаптивная. Предлагается различать варианты вида Leuconostoc oenos (см. табл. 35) по классификации молочнокислых бактерий вин, приведенной выше [315].
Характеристика вида Leuconostoc oenos: гетероферментативные кокки, располагающиеся в виде цепочек, грамположительны, развиваются при pH ниже 5,0 и даже ниже 4,0; микроаэрофильны или анаэробны, сбраживают глюкозу, иногда сахарозу, редко – рафинозу. Пентозы (арабиноза и ксилоза) сбраживаются обе или одна из них. Яблочная кислота сбраживается при низком pH, сбраживается лимонная кислота. При потреблении сахаров образуется D (–)-молочная кислота. Leuconostoc oenos выделяется из вин при яблочно-молочном брожении, реже – из испорченных вин.
Э. Пейно [297] приводит следующее описание вида Leuconostoc gracile: грамположительные кокки, располагающиеся иногда в виде цепочек, развивающиеся при pH ниже 5,0 и даже ниже 4,0, гетероферментативные, микроаэрофильны или анаэробны. Кроме глюкозы и фруктозы ферментируют лишь немногие сахара. Иногда сбраживают сахарозу, редко мальтозу, в исключительных случаях – лактозу. Не сбраживают арабинозу, ксилозу, рамнозу. Яблочную кислоту сбраживают при низких значениях pH, всегда разлагают лимонную кислоту. При потреблении сахаров образуется молочная кислота D (–). Leuconostoc gracile изолируется из вин при яблочно-молочном брожении.
По мнению ряда авторов [223, 297, 304, 306], Leuconostoc gracile совершенно идентичен виду Bact. gracile, описанному Г. Мюллером-Тургау и А. Остервальдером в 1913 г.
Классификация молочнокислых бактерий, изолированных из вин, выполнена во многих винодельческих районах мира. Проведено определение видового состава молочнокислых бактерий и в нашей стране. По наблюдениям Л. С. Юстратовой [230], из вин Молдавии наиболее часто выделяются гомоферментативные палочки, реже гетероферментативные палочки. Г. Ф. Кондо [79] в молдавских винах неоднократно найдены молочнокислые кокки.
Выделение в чистую культуру и таксономическое определение молочнокислых бактерий из армянских вин проведено Э. О. Петян [138] и Б. П. Авакяном [2]. Определен видовой состав молочнокислых бактерий в винах Крыма (Южный берег, предгорная и степная части), в винах Кировабадского района Азербайджанской ССР и в некоторых винах Одесской области. Выделенные штаммы молочнокислых бактерий принадлежали к гомоферментативным палочкам Lactobacillus plantarum и коккам Pediococcus cerevisiae и гетероферментативным палочкам Lactobacillus brevis и L. buchneri и коккам Leuconostoc gracile и Leuconostoc oenos. В табл. 36 приведен количественный состав выделенных культур по районам и соотношение биохимических групп бактерий. Из приведенных данных видно, что наиболее распространены в исследованных винах гетероферментативные палочки и гетероферментативные кокки. Гомоферментативные палочки и кокки встречались реже. Для сравнения в таблице приведены также данные, полученные Э. Пейно в основном при анализе французских вин [150].
Таблица 36

В других винодельческих районах соотношение биохимических групп молочнокислых бактерий может быть, несомненно, иным. Не исключена возможность иного соотношения и в зависимости от состава вина, условий года, природных условий района.
Из работ, посвященных экологии молочнокислых бактерий в отдельных винодельческих районах страны, надо отметить исследования Р. Г. Гогоберидзе [47] грузинских вин и В. П. Журавлевой [60] туркменских вин.
МОРФОЛОГИЯ И ФИЗИОЛОГИЯ МОЛОЧНОКИСЛЫХ БАКТЕРИЙ
Морфология клеток
Молочнокислые бактерии имеют форму палочек или кокков, размеры которых зависят от состава среды и условий культивирования.
Палочковидные формы могут быть короткими, почти коккообразными, длиной 0,5–0,7 мкм и длинными нитевидными, иногда достигающими длины 8,0 мкм. Располагаются они единично, парами или цепочками, некоторые с характерными «обрубленными» концами.
Кокковые формы молочнокислых бактерий бывают овальными, диаметр клеток от 0,5–0,6 до 1 мкм. Они располагаются единично, парами или цепочками различной длины (рис. 36).
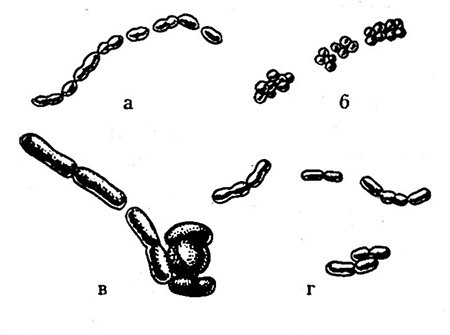
Рис. 36. Форма клеток молочнокислых бактерий. Электронно-микроскопические снимки:
кокки — а — Leuconostoc oenos (Х6000) б — Pediococcus cerevisiae (Х5000); палочки — в — Lactobacillus casei (Х8500) г — Lactobacillus brevis (Х5500) [309].
На форму клеток значительное влияние оказывает состав среды. Так, длина клеток молочнокислых бактерий увеличивается в средах с высоким содержанием этилового спирта [69, 73,137]. Этиловый спирт тормозит деление клеток сильнее, чем рост. Поэтому в спиртсодержащих средах палочки вытягиваются в длину, становятся тонкими, кокки сохраняют свою форму [69].
Молочнокислые бактерии, встречающиеся в виноделии, неподвижны, не образуют спор, положительно окрашиваются по Граму, не образуют пигмент, не восстанавливают нитраты в нитриты, характеризуются неактивной каталазой.
Структура и компоненты клеток молочнокислых бактерий во многом сходны с другими грамположительными бактериями.
Клеточная оболочка представляет собой электронноплотный гомогенный слой толщиной 15–60 нм. Цитоплазматическая мембрана может быть двухслойной или трехслойной толщиной до 7–8 нм [73].
В цитоплазме клеток обнаружены рибосомы диаметром до 15 нм, ядерный материал (нуклеоид), состоящий из тонких плотных нитей, отождествляемых с дезоксирибонуклеиновой кислотой (ДНК) (рис. 37, 38). Структура и состав клеток могут быть различными у молочнокислых бактерий отдельных видов. Некоторые палочковидные формы содержат в качестве включений зерна метахроматина.
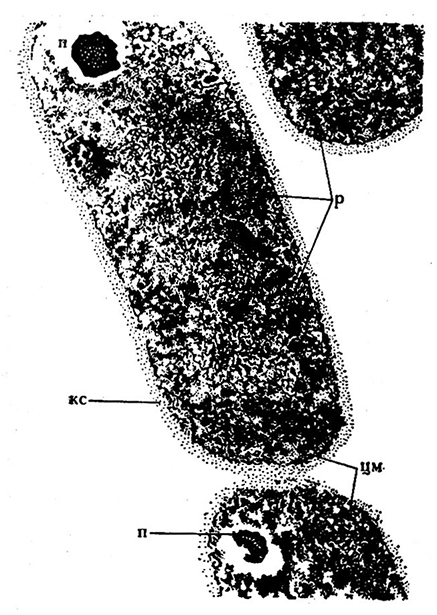
Рис. 37. Электронная микрофотография клетки Lactobacillus casei (Х88000):
п — полифосфатные включения; р — рибосомы; кс —клеточная стенка;
цм — цитоллазматическая мембрана [731].

Рис. 38. Электронная микрофотография клеток Leuconostoc (X 80000);
видны стенка клетки и цитоплазматическая мембрана [315].
Молочнокислые бактерии размножаются путем простого деления. Бактериальная клетка увеличивается в размерах и делится на две одинаковых клетки. Деление клетки в одной плоскости приводит к образованию цепочек, в двух плоскостях – к образованию тетрад, характерных для рода Pediococcus. При благоприятных условиях некоторые бактерии дают новое поколение через 15 мин и менее, при неблагоприятных – через 24 ч и более.
На поверхности желатиновых, агаризованных сред молочнокислые бактерии образуют мелкие колонии, иногда без выраженного поверхностного роста. По данным О. К. Палладиной [136], палочковидные бактерии на средах, содержащих вещества с восстановительными свойствами, например с 0,2% цистеина, образуют типичные шероховатые формы колоний. У бактерий рода Leuconostoc найдены S-, О- и R-типы колоний.
Физиология молочнокислых бактерий
Характерным признаком молочнокислых бактерий является отсутствие каталазы. Однако в последние годы появились сообщения об обнаружении каталазной активности у различных видов молочнокислых бактерий. Псевдокаталаза есть у штаммов некоторых видов родов Pediococcus, Leuconostoc, Lactobacillus.
Протеолитическая активность установлена как у кокковых форм, так и у палочек и стрептобактерий, при этом палочковидные бактерии обладают большей активностью, чем кокковые 164 формы. Обнаружены протеазы, разрушающие пептиды. В производстве важно использовать молочнокислые бактерии, образующие в больших количествах свободные аминокислоты. При подборе штаммов важно также отобрать такие, которые не образуют фракции пептидов с горьким вкусом [74].
Липолитической активностью обладают штаммы многих видов молочнокислых бактерий кокковых и палочковидных форм. Препарат липазы, полученный из бесклеточных экстрактов L. brevis, довольно легко гидролизовал простые триглицериды [73].
По биохимической деятельности молочнокислые бактерии в зависимости от характера продуктов сбраживания гексоз (глюкоза, фруктоза, манноза, галактоза), дисахаридов (лактоза, мальтоза, сахароза) и полисахаридов (декстрин, крахмал) делятся на гомоферментативные и гетероферментативные. Гомоферментативные бактерии при брожении сахаров образуют в основном молочную кислоту и незначительные количества фумаровой и янтарной, летучих кислот, этилового спирта и углекислоты; гетероферментативные – наряду с молочной значительно большие количества уксусной кислоты, этилового спирта, углекислого газа и других продуктов, используя на это до 50% сахаров.
Гомоферментативное молочнокислое брожение выражается формулой:
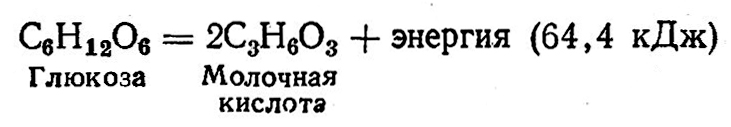
Осуществляется гомоферментативное молочнокислое брожение по гликолитической схеме Эмбдена – Мейергофа – Парнаса (см. главу I). При этом выход молочной кислоты от потребленной глюкозы составляет почти 100%.
Процесс расщепления гексозы проходит через те же стадии, что и при спиртовом брожении, т. е. по гексозодифосфатному пути до образования пировиноградной кислоты. Далее пировиноградная кислота не превращается как при спиртовом брожении в уксусный альдегид и углекислый газ из-за отсутствия фермента карбоксилазы, а восстанавливается в молочную кислоту.
В. Н. Шапошников [224] рассматривает процесс гомоферментативного брожения как классический пример строгого разграничения в материальном отношении конструктивного и энергетического обменов. Гомоферментативное брожение – только энергетический обмен. Для построения массы бактерий используется не глюкоза, а готовые аминокислоты субстрата.
Гетероферментативное молочнокислое брожение происходит по другому пути – по пентозофосфатному и выражается общей формулой:
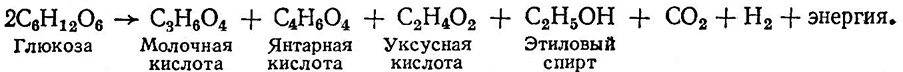
Пировиноградная кислота частично расщепляется до уксусного альдегида и СО2. В результате превращений уксусного альдегида и пировиноградной кислоты образуются янтарная и уксусная кислоты и этиловый спирт.
При гетероферментативном брожении может накопиться молочной кислоты до 40% от количества сброженного сахара, янтарной кислоты – около 20%, этилового спирта–10%, уксусной кислоты – 10%, газов – около 20%.
Гетероферментативные бактерии вызывают молочнокислое брожение в крепких, десертных и столовых недоброженных винах. При этом наблюдается уменьшение сахара, увеличение титруемой кислотности (до 9 г/'л) и летучей (до 4 г/л), выделение углекислого газа.
Деление молочнокислых бактерий на гомо- и гетероферментативные было предложено Орла-Иенсеном. Однако следует заметить, что нет строгого функционального различия между этими группами молочнокислых бактерий. Приводится много исследований, свидетельствующих о том, что в зависимости от ряда факторов (pH, присутствия СО2 и 02, физиологического состояния клеток) изменяется характер конечных продуктов брожения. Так, некоторые штаммы L. plantarum, L. casei, не обладающие способностью образовывать газ из глюкозы на специальной среде, в аэробных условиях накапливают летучие кислоты, диацетил, ацетоин [73], т. е. гомоферментативные бактерии в зависимости от состава среды могут образовать кроме молочной кислоты различные вторичные продукты брожения.
Е. И. Квасников и Г. Ф. Кондо [68] при исследовании молочнокислых бактерий, развивающихся в винах, наблюдали у штаммов L. buchneri, L. brevis, L. fermenti потерю способности к образованию летучих кислот, углекислоты и спирта. Такое превращение гетероферментативных бактерий в гомоферментативные происходило при длительном культивировании бактерий, выделенных из больных вин, на автолизатглюкозных и люцерновых средах.
А. Ф. Войткевич считал необоснованным отказываться на этом основании от деления бактерий на гомо- и гетероферментативные, так как наличие переходных форм не исключает возможности выделения основных типов.
Молочнокислые бактерии могут также проводить в вине процесс яблочно-молочного брожения, который заключается в разложении яблочной кислоты до молочной по схеме:
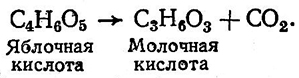
В результате превращения двухосновной яблочной кислоты в одноосновную молочную уменьшается титруемая кислотность, увеличивается значение pH, выделяется углекислый газ. В весовом отношении из 134 г яблочной кислоты образуется 90 г молочной кислоты и 44 г углекислого газа, т. е. 1 г яблочной кислоты дает 0,67 г молочной кислоты. Эта реакция не сопровождается выделением энергии. Следовательно, энергетический обмен осуществляется иным путем. Источником энергии при процессе яблочно-молочного брожения являются очень незначительные количества углеводов. Для разложения 1 г яблочной кислоты бактериям достаточно 0,1–0,2 г глюкозы.
Превращение яблочной кислоты в молочную через пировиноградную осуществляется при помощи яблочного фермента (маликфермента), который является адаптивным и образуется бактериями в том случае, если в субстрате имеется яблочная кислота.
Превращение яблочной кислоты в молочную осуществляется молочнокислыми бактериями и через щавелевоуксусную кислоту, а также прямым декарбоксилированием.
- Общепризнано, что гомо- и гетероферментативный тип брожения гексоз вызывается в вине соответственно гомо- и гетеро-ферментативными бактериями. Существенные разногласия вызывает вопрос о принадлежности возбудителей яблочно-молочного брожения к определенному биохимическому типу молочнокислых бактерий, строго приспособленному к гомо- или гетероферментативному процессу.
Е. И. Квасников и Г. Ф. Кондо [68], в течение ряда лет изучавшие биологию молочнокислых бактерий, выделенных из больных вин Средней Азии, считали неправильным связывать процессы молочнокислого скисания и яблочно-молочного брожения с определенными, узко специализированными видами бактерий. Проведенное ими искусственное заражение вин различными штаммами молочнокислых бактерий показало, что гетерофер-ментативные бактерии вызывают заболевание вин молочнокислым скисанием, сбраживая сахар с образованием молочной и летучих кислот.
Эти же бактерии при недостатке сахара вызывают процесс яблочно-молочного брожения, используя яблочную кислоту.
В настоящее время мнения большинства ученых сходятся на том, что и гомо- и гетероферментативные бактерии могут вести в вине процесс яблочно-молочного брожения [71, 72, 235, 251, 264, 287, 291, 304].
Многочисленные исследования, проведенные в последнее время за рубежом, показали, что из вин, подвергшихся яблочно-молочному брожению, изолируются различные виды молочнокислых бактерий гомоферментативных (L. plantarum, L. casei) и гетероферментативных (палочек L. buchneri, L. brevis, L. hilgardii, кокков – Leuconostoc mesenteroides, Leuc. citrovorum, Leuc. vini, Leuc. gracile).
Таким образом, яблочно-молочное брожение в вине может быть вызвано любым видом гомо- и гетероферментативных молочнокислых бактерий. Разложение яблочной кислоты – свойство всех видов молочнокислых бактерий. Его легко обнаружить, выращивая молочнокислые бактерии на средах, в которых единственным источником углерода является яблочная кислота. Лимонная, винная и молочная кислоты используются меньшим количеством молочнокислых бактерий, поэтому деление молочнокислых бактерий на гомоферментативных, гетероферментативных и яблочномолочного брожения является неверным. Самостоятельно третьей группы бактерий не существует, имеются лишь гомо- и гетероферментативные, вызывающие яблочномолочное брожение в винах с различной кислотной характеристикой.
Продукты обмена веществ
Основными веществами функциональной деятельности молочнокислых бактерий являются молочная кислота, спирты и летучие кислоты, диацетил и ацетоин и др.
Образование молочной кислоты. Форма молочной кислоты, образуемой при брожении сахаров, зависит от вида бактерий. Гомоферментативные L. casei образуют только L ( + )-молочную кислоту. Все гетероферментативные кокки и редкие штаммы гетероферментативных палочек образуют только молочную кислоту D (–). Смесь молочной кислоты L ( + ) и D (–) продуцируют все гетероферментативные палочки L. plantarum, другие неклассифицированные Streptobacterium и гомоферментативные кокки [257, 324].
В винах, в которых молочнокислые бактерии не развивались, содержится мало молочной кислоты, в пределах 0,7–1,0 г/л с довольно высокой пропорцией изомера D (–). Наоборот, в процессе яблочно-молочного брожения накапливается L (4-)-молочная кислота, которая составляет 75% общего количества кислоты [243, 253, 296]. Таким образом, считается, что все молочнокислые бактерии, даже те, которые образуют из сахара молочную кислоту D (–), и те, которые дают смесь двух изомеров, превращают яблочную кислоту в L ( + )-молочную [268, 298, 308]. Образование молочной кислоты в процессе яблочно-молочного брожения Leuconostoc oenos в красном вине характеризуется данными, приведенными в табл. 37 [238].
Таблица 37
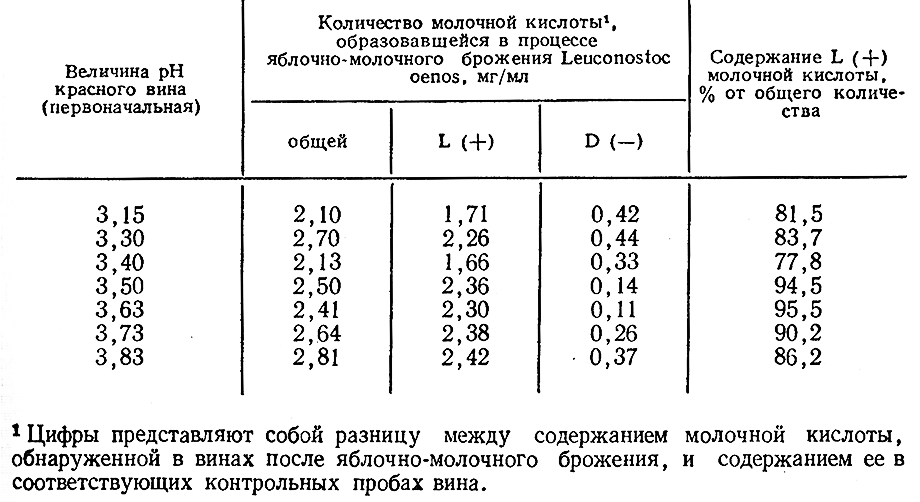
Такие данные являются свидетельством того, что путь превращения яблочной кислоты отличается от пути сбраживания сахаров молочнокислыми бактериями, и механизм яблочно-молочного брожения следует рассматривать как прямое декарбоксилирование, а не участие в нем специфических лактатдегидрогеназ [254, 269, 303, 320, 321].
Образование полиолов (многоатомных спиртов). При брожении глюкозы и пентоз молочнокислые бактерии образуют глицерин и бутандиол-2,3, фруктозы–маннитол. При этом» качественный и количественный составы многоатомных спиртов находятся в зависимости от вида бактерий.
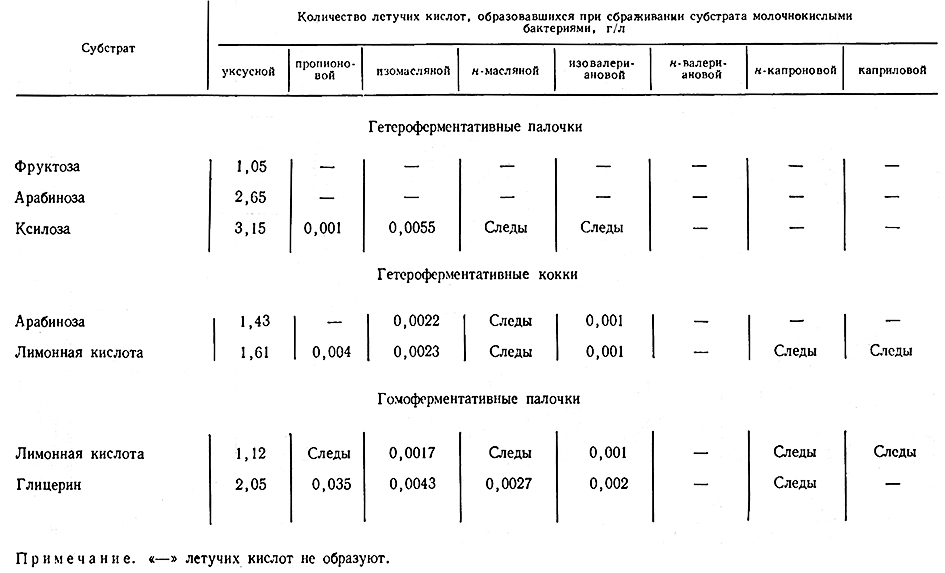
Образование летучих кислот. Летучие кислоты образуются в винах разными биохимическими группами молочнокислых бактерий при брожении сахаров (гексоз и пентоз), органических кислот (яблочной, лимонной, винной) и глицерина [148, 149]. Данные, полученные 3. Д. Рабинович [149], свидетельствуют о следующем: гетероферментативные палочки образуют много летучих кислот (1–3 г/л) при сбраживании фруктозы, арабинозы, ксилозы; лимонную кислоту сбраживают слабо; гомоферментативные палочки почти не образуют летучих кислот при сбраживании фруктозы и, напротив, синтезируют до 2 г/л из лимонной кислоты. При культивировании на среде с глицерином летучие кислоты образуют только гомоферментативные палочки.
При сбраживании глюкозы и яблочной кислоты все виды молочнокислых бактерий образуют лишь очень незначительные количества летучих кислот.
Гетероферментативные кокки синтезируют летучие кислоты при сбраживании фруктозы, арабинозы и лимонной кислоты.
В табл. 38 приведен качественный анализ летучих кислот, образуемых молочнокислыми бактериями при использовании тех или иных источников углерода. Летучие кислоты, как видно, почти на 100% состоят из уксусной кислоты. Лишь в процессе сбраживания глицерина гомоферментативными палочками образуется заметное количество пропионовой кислоты (0,035 г/л). Остальные летучие кислоты образуются в очень малых количествах (0,001–0,005 г/л) или в виде следов.
Таблица 38
Образование диацетила и ацетоина. Установлена связь между яблочно-молочным брожением и наличием в вине повышенных количеств диацетила и ацетоина. В винах, в которых прошло кислотопонижение, образуется ацетоина и диацетила в среднем (в сумме) 9,3 мг/л, а в винах, не прошедших яблочно-молочное брожение,– 4,3 мг/л.
Диацетил рассматривается как вкусовое вещество, оптимальные концентрации которого улучшают аромат и не ухудшают качества вин окисленного типа [161, 261]. Диацетил образуется в процессе яблочно-молочного брожения гетероферментативными кокками рода Leuconostoc и гомоферментативными бактериями.
3. Д. Рабинович [41] хотя и не удалось выяснить вопрос об источниках образования диацетила и ацетоина молочнокислыми бактериями, но полученные данные свидетельствуют о том, что гетероферментативные палочки при культивировании на испытанных питательных субстратах диацетила и ацетоина не образуют и, наоборот, гомоферментативные образуют, гетероферментативные кокки синтезируют диацетил и ацетоин при сбраживании лимонной кислоты. В табл. 39 приведены данные, характеризующие биосинтез диацетила и ацетоина молочнокислыми бактериями (выборочно из изученных 20 штаммов).
Таблица 39
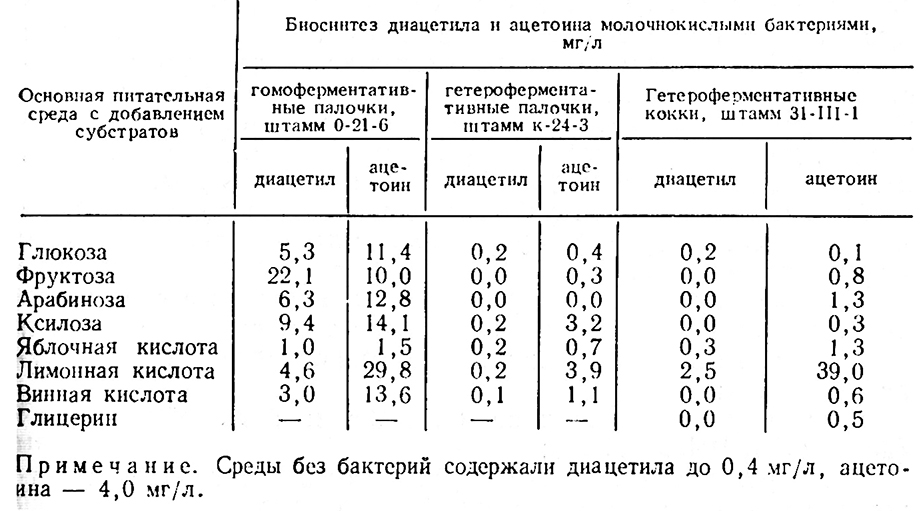
Таким образом, есть основание предполагать, что в процессе биологического кислотопонижения, проходящего в винах за счет сбраживания яблочной и лимонной кислот, повышение содержания диацетила и ацетоина вызывается гомоферментативными палочками и гетероферментативными кокками. При молочнокислом брожении сахаров вина диацетил и ацетоин образуют только гомоферментативные палочки.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА РАЗВИТИЕ МОЛОЧНОКИСЛЫХ БАКТЕРИЙ
Углеродное питание
Молочнокислые бактерии используют незначительные количества тех соединений, которые служат источником энергии. Основным источником энергии для молочнокислых бактерий являются моно- и дисахариды – глюкоза, лактоза, сахароза, мальтоза.
В качестве источника энергии и в конструктивном обмене они используют и органические кислоты – лимонную, яблочную, пировиноградную, фумаровую и др. L. brevis в качестве источника углерода могут использовать уроновые кислоты – глюкуроновую и галактуроновую с образованием СО2, уксусной и молочной кислот [73]. В отсутствие сбраживаемых углеродсодержащих субстратов молочнокислые бактерии в качестве источника энергии утилизируют аминокислоты (глутаминовую кислоту, аргинин, тирозин), декарбоксилируя их с выделением СО2. Полисахариды, как правило, молочнокислые бактерии не используют.
Многие молочнокислые бактерии нуждаются при развитии в наличии СО2, который они употребляют для биосинтеза белков, жирных кислот и др.
Азотное питание
По потребности в источниках азота молочнокислые бактерии можно разделить на три основные группы: нуждаются в сложном комплексе аминокислот (подрод Thermobacterium) ;
- хорошо развивающиеся на цистеине и аммонийных солях (подрод Streptobacterium);
- могут развиваться на аммонийных солях в качестве единственного источника азота (подрод Streptococcus).
Поскольку значительное число молочнокислых бактерий не способно синтезировать сложные органические формы азота, им необходимы питательные среды со сложными органическими формами азота – смесями аминокислот, гидролизатами белков (мяса, казеина, муки фасолевой, соевой, виковой), являющимися источниками пептонов, пептидов, различных аминокислот.
Витамины
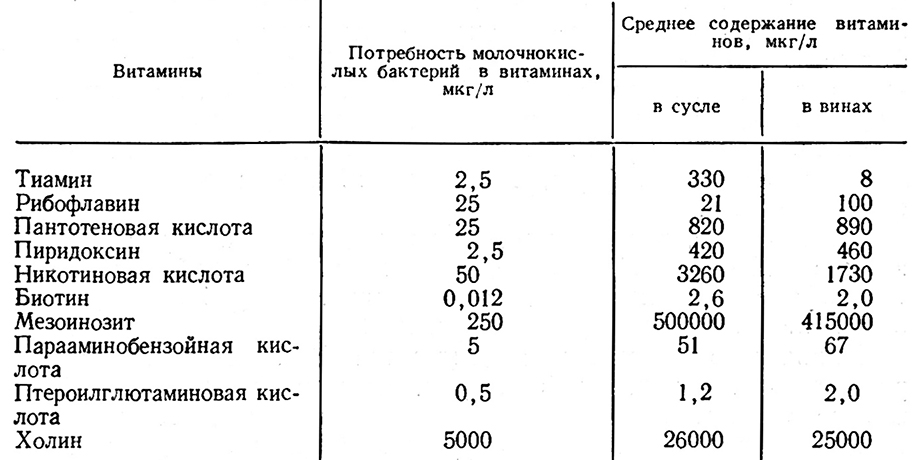
Для развития молочнокислых бактерий, особенно для палочковидных форм, витамины являются необходимыми факторами [73].
Установлено, что все виды палочковидных бактерий нуждаются в пантотеновой кислоте, биотине, никотиновой кислоте, а гетероферментативные–еще и в тиамине. Не требуется им инозит, холин и n-аминобензойная кислота.
Количество пиридоксина (витамина В6), необходимое для развития молочнокислых бактерий, зависит от качественного и количественного аминокислотного состава среды, что является свидетельством определенной функции витамина Вб – катализ синтеза необходимых им аминокислот.
При наличии в среде олеиновой кислоты у L. fermenti утрачивается потребность в биотине [21].
Е. И. Квасников и О. А. Нестеренко, используя полную питательную среду, изучили большую коллекцию штаммов молочнокислых бактерий и установили зависимость между потребностью в витаминах и видовой принадлежностью штаммов.
Следует обратить внимание на то, что потребность молочнокислых бактерий в отдельных витаминах может изменяться от присутствия тех или иных аминокислот, жирных кислот и дезоксирибозидов. Пуриновые основания влияют на потребность бактерий в n-аминобензойной кислоте; потребность в фолиевой кислоте значительно снижается, если используют среду, содержащую все известные аминокислоты, тимин (или тимидин) и пуриновые основания, которые синтезируются бактериями при участии фолиевой кислоты.
В винах витамины содержатся в количествах, необходимых для развития молочнокислых бактерий. Потребность молочнокислых бактерий в витаминах показана в табл. 40 [315].
Таблица 40
Отчетливую стимуляцию роста молочнокислых бактерий, кроме аминокислот и витаминов, вызывает олеиновая кислота (до 4 мкг/мл), а также линолевая и линоленовая, которые могут заменять олеиновую кислоту; уксусная (до 40 мкг/мл) и лимонная кислоты; тимидин (до 2 мкг/мл) [21]. Для роста некоторых бактерий эффективны вещества с высокой восстановительной способностью, такие, как глутатион, аскорбиновая кислота [73].
Иногда пептиды стимулируют рост клеток молочнокислых бактерий более эффективно, чем свободные аминокислоты, к примеру, гистидиновый пептид по сравнению с гистидином.
Неорганические соединения
Для развития молочнокислых бактерий необходимы неорганические соединения – медь, железо, натрий, калий, фосфор, йод, сера, магний, марганец. Особенно важен марганец, который предохраняет клетки от автолиза [73].
Бактерии-кислотопонижатели нуждаются в присутствий комплекса минеральных веществ. Гетероферментативные кокки не развиваются в средах, лишенных путем ионообмена катионов металлов. Рост бактерий может быть вызван добавлением ионов К+ совместно с ионами Mg2+ или Мn2+. При содержании в среде Na+ совместно с К+ рост молочнокислых бактерий усиливается, в отсутствие ионов К+ усиление роста ион Na+ не вызывает. Ион Мn2+ расщепление яблочной кислоты увеличивает в 4 раза, Мg2+– на 50%.
Отмечено [333] положительное влияние на яблочно-молочное брожение стимуляторов роста, содержащихся в томатном соке. Наличие этого рода стимуляторов обнаружено и в других плодах и винограде, в красном больше, чем в белом, а в кожуре больше, чем в мякоти. Для выяснения природы этого фактора томатный сок был разделен физико-химическими способами на фракции. Исследования показали, что Мg оказывает такое же влияние, как томатный сок, и его заменяет. Из 71 штамма бактерий 63 нуждались в добавлении к основной среде томатного сока или иона Мn. Несмотря на несомненно стимулирующее влияние такого рода активаторов внесение их в вино вряд ли желательно, так как нарушает его натуральное сложение. Для стимуляции яблочно-молочного брожения могут быть применены приемы, свойственные технологическому процессу виноделия.
Кислород
Молочнокислые бактерии в отличие от аэробных, цитохромсодержащих, не имеют цитохромов, участвующих вдыхании, но они осуществляют активное окисление некоторых веществ благодаря наличию флавопротеидных систем [51, 73]. Процесс окисления у молочнокислых бактерий часто связан с образованием перекиси водорода, подавляющей окисление. А некоторые из них могут вести процесс дальше, восстанавливая перекись до воды в присутствии окисляемых субстратов [335]. Максимум образования перекиси водорода наблюдается в логарифмической фазе роста культуры.
Отношение видов молочнокислых бактерий к аэрации среды различно и иногда противоположно., Так, строгий анаэробиоз, как правило, замедляет только начало развития гетероферментативных палочек; рост же гомоферментативных палочек явно снижает на 10%, а брожение на 23% [295]. Из кокковых форм, относящихся к гетероферментативным (Leuc. oenos), сбраживающие арабинозу достигают оптимального роста в анаэробных условиях, тогда как формы, не усваивающие пентозы, очень плохо развиваются в этих условиях [315].
Температура
В качестве основного критерия при классификации используется рост при температуре 15°С или при 45°С. Бактерии, изолированные из вин, не термофильны, не развиваются при температуре 45°С. Некоторые штаммы гомоферментативных молочнокислых бактерий могут развиваться при температуре 40°С в первые сутки. Оптимальной для развития молочнокислых бактерий признана температура 25°С. Однако кокковые формы в общем менее чувствительны к температуре, чем бактерии, и могут хорошо развиваться при температуре от 15 до 25°С. Результаты практики подтверждают эти сведения, поскольку яблочно-молочное брожение происходит при температуре 15°С и несколько медленнее при 10–12°С.
Спирты
Спирты обладают бактерицидным и бактериостатическим действием. Наибольшее бактерицидное действие этилового спирта наблюдается при концентрации 60–75% об.
Е. И. Квасниковым [69] и Э. О. Петян [137] изучено отношение к спирту нескольких тысяч штаммов молочнокислых бактерий как свежевыделенных из различных природных и производственных субстратов, так и коллекционных. Значительное количество штаммов молочнокислых палочковидных бактерий развивалось при концентрации этилового спирта (в % об.) 15–18, некоторые при 20 и 22 и даже при 24. Более низкие концентрации этилового спирта – 12–16% об. были предельными для кокковых форм.
Таким образом, приспособленность молочнокислых бактерий к развитию при высоких концентрациях этилового спирта является характерным свойством, присущим как гомо-, так и гетероферментативным формам. Так, из больных вин (сухих столовых и десертных) были выделены штаммы L. buchneri, которые развивались при содержании спирта 16–22% об. Значительной (до 23–25% об.) спиртоустойчивостью обладали штаммы, выделенные из резервуарного шампанского [67, 68]. Однако максимальная устойчивость к спирту проявляется на полноценных питательных средах, богатых аминокислотами и витаминами, и, наоборот, устойчивость к спирту значительно снижается на неполноценных питательных средах. Обогащение среды автолизатом дрожжей повышает спиртоустойчивость молочнокислых бактерий. Устойчивость бактерий к спирту также повышалась на 2% об. при длительном культивировании их с винными дрожжами.
Э. Пейно и С. Домерк [299] приводят процентное соотношение штаммов бактерий, способных развиваться в присутствии максимального количества этилового спирта (табл. 41).
Таблица 41

Температура повышает угнетающее действие спирта. L. buchneri в средах без спирта развиваются при температуре 45°С, тогда как в присутствии спирта в количестве 16% об. они не развиваются уже при 36°С.
Наличие спирта в питательных средах способствует длительному выживанию бактерий. Установлена высокая продолжительность жизни молочнокислых бактерий в винах (в осветленных винах в течение 7 мес и более, в дрожжевых осадках сухих вин– свыше 4 лет) [69, 73].
Спирт у многих видов бактерий вызывает морфологические изменения, проявляющиеся в увеличении длины клеток. В хересных виноматериалах при пленочном методе хересования бактерии принимают вид длинных тонких изогнутых нитей.
Молочнокислые бактерии оказались менее устойчивыми к бутиловому спирту, чем к этиловому. Глицерин они хорошо усваивают [69, 73].
Величина pH
Большинство штаммов молочнокислых бактерий, развивающихся в винах, выдерживают кислотность среды, соответствующую pH 3,0–3,5; незначительный процент составляют кислотовыносливые штаммы, способные к развитию в вине при pH 2,9 [238].
Наибольшей кислотовыносливостью обладают гетероферментативные кокки, наименьшей – гетероферментативные палочки. Гомоферментативные палочки занимают промежуточное положение. 3. Д. Рабинович определила последовательность потребления молочнокислыми бактериями глюкозы, фруктозы и яблочной кислоты при низких значениях pH на солодовом сусле. Из данных, приведенных в табл. 42, следует, что гетероферментативные кокки при низких значениях pH среды потребляют сначала яблочную кислоту, не затрагивая сахаров, при более высоких pH – яблочную кислоту и фруктозу, при еще более высоких – яблочную кислоту, фруктозу и глюкозу одновременно [147, 153].
Таблица 42
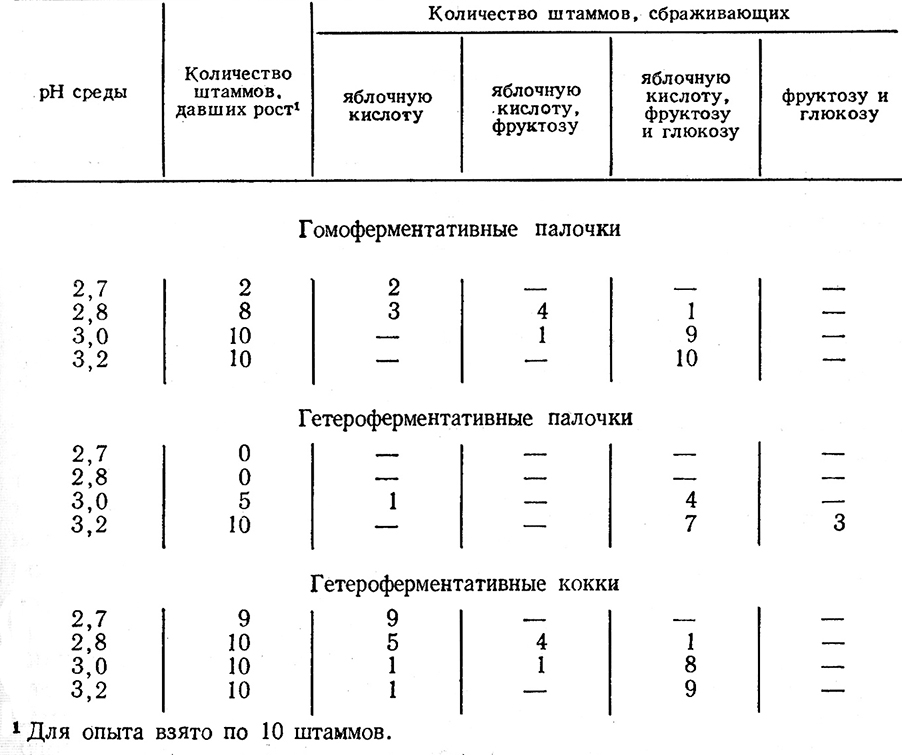
Гомоферментативные палочки потребляют сахара и кислоты в такой же последовательности, но при крайне низких значениях pH они не развиваются.
Гетероферментативные палочки начинают развиваться при более высоких значениях pH, причем потребляют яблочную кислоту одновременно с сахарами, либо только одни сахара, не затрагивая яблочной кислоты.
Таким образом, только гетероферментативные кокки являются наиболее пригодными для кислотопонижения высококислотных вин. Гомоферментативные бактерии несколько менее пригодны для этой цели, так как они менее кислотовыносливы. Гетероферментативные палочки приносят несомненный вред, так как развиваются в малокислотных винах, где используют одновременно яблочную кислоту и сахара, вызывая ненужный для этого вина процесс яблочно-молочного брожения и вредный процесс молочнокислого скисания.
Сернистый ангидрид
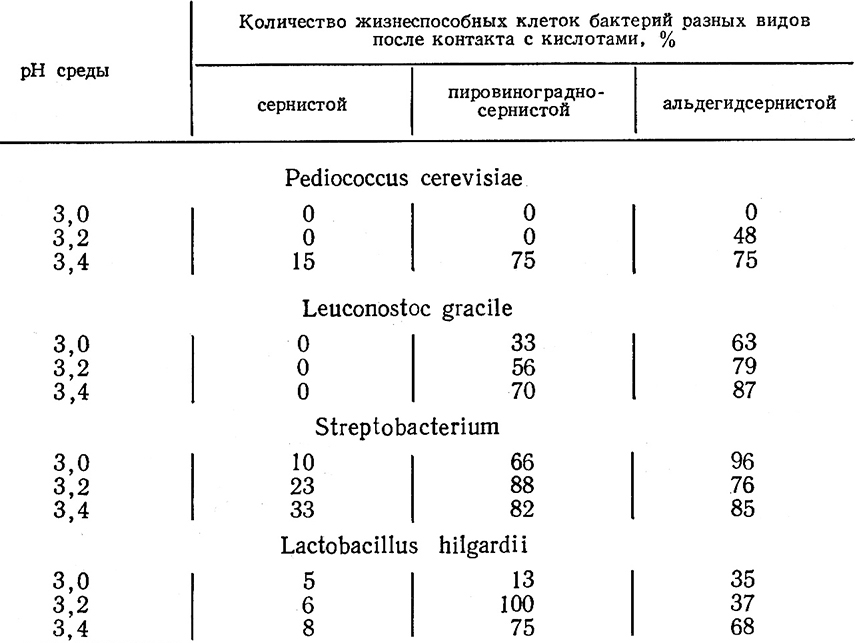
Бактерии очень чувствительны к сернистому ангидриду (SO2). Он ограничивает рост молочнокислых бактерий гораздо в большей степени, чем рост дрожжей. Через несколько минут контакта бактериальной суспензии с различными формами сернистой кислоты – свободной или связанной (пируватсернистая и альдегидсернистая кислота), введенной в среду в количестве 30 мг/л, – процент жизнеспособных клеток молочнокислых бактерий уменьшается (табл. 43) [300].
Таблица 43