Сусло, соки и вина являются благоприятной средой для развития как полезных микроорганизмов, на биохимической деятельности которых основана технология вин, так и вредных, вызывающих нежелательные изменения вина, его порчу (болезни вин). Следовательно, весь цикл приготовления вина характеризуется определенной направленностью микробиологических процессов, начиная с брожения и кончая розливом вина в бутылки. Поэтому освоение методов своевременного определения принадлежности микроорганизмов к той или иной группе даст возможность рекомендовать меры по устранению деятельности вредных для виноделия микроорганизмов и созданию благоприятных условий для развития и жизнедеятельности полезных.
ПОДГОТОВКА ПОСУДЫ ДЛЯ МИКРОБИОЛОГИЧЕСКОГО АНАЛИЗА
Обработка посуды
Для микробиологических работ применяют посуду из специального стекла, выдерживающего нагревание при высокой температуре.
Пробирки, чашки Петри, не бывшие в употреблении, промывают подкисленной (1–2% НСL) водой, так как при нагревании новое стекло выделяет много щелочи и может изменить реакцию питательной среды.
Посуду моют в проточной теплой воде ершами с использованием кальцинированной соды, полужидкого мыла, мыльного раствора и синтетических моющих средств, после чего тщательно ополаскивают водопроводной, а затем дистиллированной водой. Сильно загрязненную посуду со следами жира обрабатывают хромовой смесью.
Состав хромовой смеси: в 150 мл концентрированной серной кислоты всыпают 25 г измельченного двухромовокислого калия. Через сутки, после растворения осадка, смесь темно-оранжевого цвета можно применять для мойки посуды. Перед применением смесь следует подогреть до температуры 45–60°С. Изменение темно-оранжевого цвета хромовой смеси на темно-зеленый свидетельствует о ее непригодности.
Пипетки и другие градуированные приборы должны быть совершенно чистыми и хорошо обезжиренными. Моют градуированные приборы в теплом растворе горчицы, мыльной воды или стирального порошка в сосудах, где они могут быть полностью погружены в раствор, ополаскивают теплой проточной водой, а затем дистиллированной.
При ополаскивании чисто вымытой посуды вода стекает, оставляя на поверхности стекла ровную водяную пленку. Отдельные капельки воды на стенках посуды свидетельствуют о том, что она плохо обезжирена.
Вымытую посуду сушат при комнатной температуре или в сушильном шкафу при температуре 100–105°С.
Чисто, вымытую и высушенную посуду закрывают ватными пробками и хранят в местах, надежно защищенных от пыли, лучше всего в плотно закрывающемся шкафу. Ватные, пробки предохраняют посуду, питательные среды и культуры от заражения посторонними микроорганизмами (микробы оседают в волокнах ваты). Лучше употреблять для изготовления пробок гигроскопическую вату, так как она не так сильно тлеет. Ватная пробка должна легко входить в пробирки и при извлечении из них не терять своей формы. Длина пробки для обычной пробирки около 4 см. Пробка должна входить в пробирку на 1,5– 2,0 см. Удобно для работы обертывать пробку чистой марлевой салфеткой. Ватные пробки делают из пласта ваты, скручивая его руками на столе или на пинцете, или на специальной машине.
Стерилизация посуды
Перед стерилизацией посуду завертывают в бумагу для сохранения стерильности после прогревания. Бумагу удаляют непосредственно перед использованием посуды.
Пробирки завертывают в бумагу по 10–20–40 шт., закрывая верхнюю часть пробирок, чашки Петри – каждую отдельно или по 5–10 шт. в пакеты.
В концы пипеток, которые берут в рот, вставляют ватные тампоны. Пастеровские пипетки завертывают в бумагу по 3– 15 шт. Градуированные пипетки завертывают в длинные полоски бумаги шириной 4–5 см. Обмотку начинают с конца, который опускают в среду. Пипетку обматывают по спирали. Конец бумаги закручивают или приклеивают. Пипетки можно завертывать в лист бумаги по 3–5 шт. На бумаге указывают объем завернутых пипеток. При наличии пеналов пипетки стерилизуют в них.
Шпатели стерилизуют завернутыми в бумагу по одному или несколько (до 5) штук.
На пробки колб, склянок, трубок надевают бумажные колпачки.
Посуду, подготовленную для стерилизации, загружают в сушильный шкаф не слишком плотно, чтобы обеспечить некоторую циркуляцию воздуха и равномерный, надежный прогрев стерилизуемого материала. Сушильный шкаф при стерилизации должен быть закрыт. За температурой необходимо следить, так как при понижении ее не осуществляется стерилизация, а при нагреве выше 175°С бумага и пробки начинают разрушаться. Стерилизация длится 2 ч при температуре 160–170°С. По окончании стерилизации шкаф не открывают до тех пор, пока температура в нем не снизится до 100–70°С, так как при резком охлаждении иногда нарушается стерильность материала, а стекло может растрескаться.
Посуду можно стерилизовать и в автоклаве.
Мелкие металлические инструменты стерилизуют прокаливанием в пламени непосредственно перед использованием.
Приборы для культивирования микроорганизмов, а также детали к этим приборам (резиновые пробки и шланги) стерилизуют автоклавированием. Предметы, подлежащие стерилизации в автоклаве, завертывают в бумагу.
Стерилизация кипячением является наиболее простым и легкодоступным способом. В стерилизатор наливают дистиллированную воду, так как водопроводная вода образует накипь. Стеклянные предметы погружают в холодную воду, металлические– в горячую с добавлением соды. Кипячение ведут на слабом огне [131, 140].
Предметы, изготовленные из термолабильных пластмасс, например центрифужные пробирки, стерилизуют этиловым спиртом или ультрафиолетовыми лучами. Время стерилизации зависит от мощности используемой бактерицидной лампы и расстояния между лампой и объектом. После облучения предметы до использования следует хранить в стерильной посуде [25].
ПРИГОТОВЛЕНИЕ ПИТАТЕЛЬНЫХ СРЕД
Синтетические среды
В эту группу питательных сред входят среды, имеющие определенный состав, т. е. их основные составные части известны.
Для микробиологического исследования дрожжей используют среду Ридер. В состав среды входят следующие соли (в г на 1 л воды):
Сернокислый аммоний 3
Сернокислый магний 0,7
Азотнокислый кальций 0,4
Хлористый натрий 0,5
Фосфорнокислый калий однозамещенный 1
Фосфорнокислый калий двузамещенный 0,1
Начальная величина pH среды 6,6. Из состава среды может быть исключен азотнокислый кальций, который не используется дрожжами. Для опытов по размножению в среду добавляется 2% сахара, для опытов по брожению – 5–10%.
Полная синтетическая среда содержит кристаллические витамины в следующих концентрациях (в мкг на 1 мл):
Инозит 5,0
Биотин 0,0001
Пантотеновая кислота 0,25
Тиамин 1,0
Пиридоксин 0,25
Никотиновая кислота 0,5
Состав синтетических сред для размножения уксуснокислых и молочнокислых бактерий очень сложный [73]. Рекомендуются полусинтетические среды.
Для уксуснокислых бактерий с набором веществ (в г на 1 л дистиллированной воды):
Глюкоза 20
(NH4)2SО4 3
KH2PО4 2
MgSО4•7H2О 2
Этанол 20
Для молочнокислых бактерий рода Lactobacillus среда Де Мана:
МРС — жидкая и МРС-1 — полужидкая с 0,15% агара. В среду МРС с рН 6,2—6,6 входят (в %):
Дрожжевой экстракт 0,5 Уксуснокислый натрий 0,5
Мясной экстракт 1,0 Твин-80 0,1
Пептон 1,0 К2НРО4 0,2
Глюкоза 2,0 MgSО4•7H2О 0,02
Лимоннокислый аммоний 0,2 MnSО4•4H2О 0,005
Для молочнокислых бактерий рода Leucoпоstо
с используют среду МРС, а также среду Гарви — АТБ, в состав которой входят (в г/л):
Пептон 10
Дрожжевой ""экстракт 5
MnSО4 • 4Н2О 0,05
MgSО4•7HaО 0,2
Глюкоза 10
В среду добавляют 250 мл томатного сока, pH среды 4,8.
Натуральные питательные среды
Для выращивания дрожжей, уксуснокислых и молочнокислых бактерий готовят различные питательные среды, состав которых точно не известен.
Виноградное сусло. Сусло помещают в колбу и нагревают до кипения в кипятильнике Коха. После охлаждения его отфильтровывают от выпавших белковых веществ через бумажный складчатый фильтр и разливают в пробирки по 5 мл, стараясь не смочить горлышка. Среду используют для выращивания дрожжей.
Солодовое сусло. Неохмеленное пивное сусло фильтруют через бумажный фильтр для удаления осадка белковых веществ. Содержание сухих веществ (в % СВ) определяют сахарометром. Путем разведения водопроводной водой готовят сусло с различным содержанием сухих веществ: для выращивания грибов 3–4%, дрожжей 6–8, молочнокислых бактерий 2–5%.
Дрожжевая вода. 70–100 г свежих прессованных или 7–10 г сухих дрожжей разбалтывают в 1 л дистиллированной воды и кипятят 30 мин. После отстаивания на холоде в высоком цилиндре жидкость декантируют и фильтруют. К фильтрату добавляют 1 л воды, еще раз кипятят 30 мин и вновь фильтруют. Для лучшего осветления жидкости можно прибавить до кипячения взбитый с водой яичный белок. В дрожжевую воду вносят необходимые вещества (углеводы, соли), доводят pH среды до нужного значения и стерилизуют. Среда используется для выращивания дрожжей [131].
Вино с сахаром. В белое сухое вино добавляют 8–10% сахара. После его растворения среду фильтруют и разливают по пробиркам. Среда используется для посева дрожжей и уксуснокислых бактерий.
Вино с суслом. Среда состоит из виноградного сусла – 1/3 объема, сухого вина – 1/3 и водопроводной воды – 1/3 объема. Среду фильтруют и разливают в пробирки. Среда рекомендуется для посева уксуснокислых бактерий.
Виноградное сусло разбавленное. Сусло разбавляют водой до содержания сахара 5%, добавляют 1% автолизата дрожжей и доводят pH до 5–6 добавлением 1 н. раствора щелочи. Среда рекомендуется для выращивания молочнокислых бактерий.
Дрожжевой автолизат. К 1 кг прессованных дрожжей прибавляют 1 л водопроводной воды, прокипяченной и охлажденной до 60°С, смешивают в гомогенную массу и ставят в термостат при температуре 48–50°С. Для предотвращения инфицирования к дрожжевой суспензии добавляют толуол (несколько капель до появления ясного его запаха). Дрожжевую массу помещают в сосуды с запасом пространства, учитывая расширение толуола. Во время перемешивания (1–2 раза в день) сосуд открывают. Через 48–72 ч автолиз дрожжей заканчивается, дрожжевая масса разжижается. Затем массу нагревают в автоклаве при давлении 0,02 МПа 30 мин, по остывании фильтруют до полной прозрачности (лучше через бумажную мезгу на воронке Бюхнера). Прозрачный фильтрат содержит около 0,9% азота.
Осадок разводят в 600 мл воды и вновь фильтруют. Фильтраты объединяют. В смеси содержание общего азота становится равным 0,6–0,8%. При необходимости автолизат нейтрализуют до pH 6,8–7,0, разливают в пробирки или склянки и стерилизуют 15 мин при давлении 0,05 МПа.
Автолизат дрожжей особенно богат парааминобензойной кислотой, пантотеновой кислотой и пиридоксином. Его удобно добавлять как источник витаминов в небольшом количестве к синтетическим средам.
Полученный автолизат разбавляют водой (1: 10) с добавлением 1–2% сахара.
Для приготовления автолизата можно использовать осадочные винные дрожжи. Для этого их освобождают от вина, несколько раз промывают холодной водой, которую после осаждения дрожжей декантируют. Из отмытых дрожжей готовят автолизат так же, как описано выше.
Среда из автолизата дрожжей применяется для посева молочнокислых бактерий.
Капустная среда. 200 г измельченной капусты помещают в кастрюлю, заливают 1 л воды и кипятят в течение 10 мин, затем отжимают через двойной слой марли, полученную жидкость фильтруют и в 2 раза разводят водой. К отвару добавляют 2% глюкозы и 1% пептона.
Можно использовать сухую капусту (измельченную капусту следует сушить в тени при температуре 20–35°С при притоке свежего воздуха). Для приготовления питательной среды 6–8 г сухой капусты кипятят в 1 л воды. Среду разливают в пробирки высоким слоем, по 8–10 мл. Среда используется для накопления и выделения молочнокислых бактерий.
Элективные питательные среды
Эти среды обеспечивают преимущественное развитие одного вида или группы родственных микроорганизмов и менее пригодны или совсем не пригодны для развития других.
Во все описанные жидкие питательные среды, предназначенные для высева молочнокислых бактерий из сусла и вина, перед посевом вводят этиловый спирт из расчета содержания в среде 14% об, (0,95 мл спирта на 5 мл среды). При таком содержании спирта размножаются преимущественно молочнокислые бактерии,
В питательной среде, содержащей 20 ед./мл мономицина, при высеве пробы исследуемого вина развиваются уксуснокислые бактерии. В присутствии этого антибиотика молочнокислые бактерии не размножаются.
Для преимущественного развития дрожжей и подавления сопутствующих бактерий в среду рекомендуется вводить антибиотик неомицин в количестве 20 ед./мл среды или совместно пенициллин и стрептомицин (50–100 ед. каждого на 1 мл среды).
Для подавления роста плесневых грибов, которые интенсивно растут на сусле и сусло-агаре, рекомендуется добавлять 4% об. спирта или 0,2% пропионовокислого натрия.
При необходимости получения изолированной культуры пленчатых дрожжей в среду добавляют йодуксусную кислоту в количестве 0,1–0,2%.
Дифференциально-диагностические среды
Эти среды позволяют быстро отличить одни виды микроорганизмов от других. Готовят их часто с введением специальных красителей – индикаторов.
Для предварительного ориентировочного определения уксуснокислых бактерий и дифференциации их от молочнокислых делают рассев культуры на дрожжевую воду с добавлением в нее 5–10% глюкозы, 10% желатина или 1% агара и 1% углекислого цинка. Молочнокислые бактерии к вредному действию цинка очень чувствительны, тогда как уксуснокислые бактерии растут на этой среде хорошо [131].
Для раздельного определения уксуснокислых и молочнокислых бактерий служит жидкая или плотная питательная среда 1 с pH 7, состоящая из дрожжевой воды с добавлением 10% дрожжевого автолизата и смешанного индикатора 1 : 1 (бромкрезол красный и бромкрезол зеленый, 0,1%-ные растворы в смеси воды со спиртом). Молочнокислые бактерии образуют молочную и уксусную кислоты, в результате чего реакция среды становится кислой и цвет индикатора меняется от синего через желто-зеленый до желтого. При развитии уксуснокислых бактерий образуется аммиак, который подщелачивает среду и изменяет ее цвет с синего на фиолетовый.
СТЕРИЛИЗАЦИЯ ПИТАТЕЛЬНЫХ СРЕД
Жидкие и плотные питательные среды, содержащие сахара, стерилизуют в кипятильнике Коха ежедневно по 20 мин в течение трех дней, либо в автоклаве под давлением не выше 0,05 МПа в течение 20 мин. Среды, не содержащие сахаров, стерилизуют в автоклаве при давлении 0,1 МПа и температуре 121°С в течение 20 мин. Соотношения показаний манометра и температуры кипения воды приведены в табл. 52.
Таблица 52
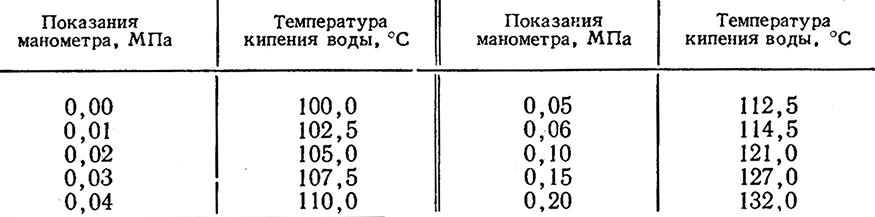
Виноградное сусло является кислой средой, поэтому стерилизуют его однократным кипячением в течение 20–30 мин в кипятильнике Коха. Время стерилизации отсчитывают с момента закипания воды, что определяют по показанию термометра, вставленного в крышку кипятильника.
Вино как среду кислую и содержащую спирт стерилизуют путем пастеризации при температуре 70°С в течение 10–15 мин.
Плотные питательные среды готовят на тех же жидких субстратах, добавляя к ним уплотнители – агар или желатин.
В питательные среды агар добавляют в количестве 2–2,5%. Для приготовления плотной среды (сусло-агара) смешивают расплавленный 4%-ный водный раствор агара и сусло в горячем виде при температуре 60–70°С в равных количествах над пламенем спиртовки. После перемешивания разливают в чашки Петри или в пробирки стерильно. Желатин добавляют в среды в количестве 10–15%.
Для лучшего прилипания агаровых сред к стеклу рекомендуется к сусло-агару добавлять желатин в количестве 5%.
Сохраняют питательные среды в прохладном, защищенном от света и не слишком влажном помещении. В сыром помещении ватные пробки пропитываются влагой и через них прорастает мицелий плесневых грибов. На каждой склянке, колбе со средой или на колпачке указывают название среды и время приготовления. Надпись на стекле делают специальными чернилами, на бумажном колпачке – карандашом.
Состав чернил для записи по стеклу:
- раствор 1: 2 г танина растворить в 15 мл дистиллированной воды, хорошо прокипятить, остудить;
- раствор 2: 1 г основного фуксина или метиленового синего растворить в 15 мл спирта концентрацией 96% об.
Растворы соединяют и хранят в склянке с притертой пробкой.
ПОСЕВ МИКРООРГАНИЗМОВ НА ПИТАТЕЛЬНЫЕ СРЕДЫ
Пересев из одной пробирки в другую
Берут 2 пробирки: одну – с исследуемым микробом, выросшим в жидкой или на плотной питательной среде, другую – со стерильной плотной или жидкой средой. Первую пробирку помещают между большим и указательным пальцами левой руки, вторую пробирку зажимают между указательным и средним пальцами той же руки.
В правую руку берут микробиологическую петлю или иглу, или стерильную пипетку и, держа пробирки в наклонном, почти горизонтальном положении в левой руке, правой рукой вынимают ватные пробки из пробирок и зажимают их между свободными пальцами так, чтобы входившая в пробирку часть ватной пробки не прикасалась к руке. Класть ватные пробки на стол нельзя.
Обожженную иглу или петлю охлаждают в первой пробирке, затем берут из нее немного исследуемого материала и переносят его в пробирку со стерильной средой (рис. 48). Пробки проводят через пламя и закрывают ими пробирки.
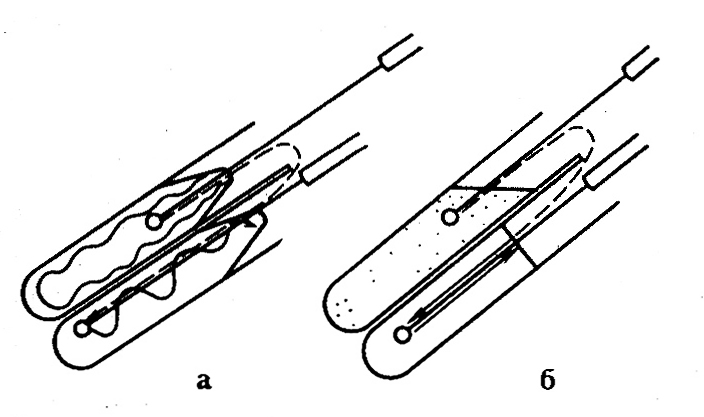
Рис. 48. Пересев культуры микроорганизма из одной пробирки в другую:
а – с плотной на плотную питательную среду; б – из жидкой в жидкую питательную среду.
На пробирке обычно пишут специальными чернилами или восковым карандашом название культуры и дату посева.
Посев из пробирки в чашку Петри
В левую руку берут пробирку с исследуемым материалом, в правую – петлю, иглу или пипетку, этой же рукой около пламени вынимают пробку из пробирки, берут немного посевного материала и закрывают пробирку пробкой. Левой рукой пробирку ставят в штатив, затем приоткрывают крышку чашки Петри, а правой вносят в чашку Петри на поверхность агара посевной материал петлей, иглой или пипеткой и распределяют по поверхности агара штрихом или размазывают легкими движениями стерильного стеклянного шпателя (рис. 49). На дне чашки пишут название культуры, дату посева или другое обозначение.
Рис. 49. Микробиологические игла, петля и шпатель Дригальского.
ПРИЕМЫ МИКРОСКОПИРОВАНИЯ ОБЪЕКТОВ
Прямым микроскопированием исследуют объекты, содержащие большое количество микроорганизмов (сусло до и после отстаивания, бродящее сусло, дрожжевую разводку), с предварительным центрифугированием, микроскопируют виноматериалы после обработки и фильтрации, готовую продукцию, смывные воды. Микроскопические наблюдения можно осуществлять, рассматривая специально приготовленные препараты как живых, так и убитых микроорганизмов.
Препарат для микроскопирования готовят на предметном стекле размером 76X26 мм и толщиной не более 1,4 мм. Покровные стекла обычно используют размером 14X14 и 18X18 мм и толщиной 0,15–0,17 мм. Все стекла тщательно очищают кипячением их в мыльной дистиллированной воде или в 1%-ном растворе соды в течение 10–20 мин, затем ополаскивают водой и сушат или протирают мягкой полотняной тканью. Предметные стекла хранят сухими; покровные – в 95%-ном спирте или в смеси спирта и эфира (1:1) в банках с притертыми пробками. Стекла следует вынимать пинцетом. Перед использованием их необходимо просушить фильтровальной бумагой и слегка обжечь над пламенем горелки.
Для изучения морфологии клеток микроорганизмов чаще всего используют светлопольную микроскопию, позволяющую исследовать объекты в проходящем свете. При микроскопировании препарата необходимо прежде всего установить правильное освещение. Лучше пользоваться рассеянным дневным светом, а при недостаточности его – осветительными лампами. Независимо от устройства источника света необходимо установить зеркало микроскопа так, чтобы свет от источника был направлен в конденсор микроскопа. Конденсор поднимают до упора. Сняв с микроскопа окуляр и глядя прямо в объектив, устанавливают зеркало таким образом, чтобы источник света был виден посредине объектива. Регулировка интенсивности освещения объекта достигается поворотом зеркала и раскрытием или суживанием ирисдиафрагмы. Готовый препарат кладут на предметный столик и укрепляют зажимами. Глядя сбоку, опускают объектив почти до соприкосновения с покровным стеклом. Затем макровинтом поднимают тубус до появления изображения. Пользуясь микровинтом, получают четкое изображение. При микроскопировании раздавленной капли лучше пользоваться объективом 40X и окуляром 10Х или 15Х.
При микроскопировании с иммерсионной системой очень осторожно погружают объектив 90X в масло почти до соприкосновения с поверхностью стекла и затем медленно при помощи макровинта поднимают до появления в поле зрения объекта. Дальнейшую фокусировку производят микрометрическим винтом.
После работы с иммерсией следует немедленно привести в порядок объектив 90X – снять кедровое масло чистой тряпочкой или тряпочкой, смоченной бензином. Ксилол употреблять не рекомендуется, так как он растворяет канадский бальзам, которым прикреплены линзы к оправе.
Для повышения контрастности слабоконтрастных объектов исследования применяют способ микроскопирования в темном поле. Этот способ основан на освещении объекта косыми лучами света при использовании специального конденсора темного поля, который вставляют вместо обычного. При темнопольной микроскопии необходим более мощный источник света, чем для микроскопии в светлом поле, поэтому особое значение приобретает правильная установка света, максимальное его использование и тщательная центрировка [140]. Предметные стекла должны быть не толще 1,2 мм, чистыми. При наблюдении микроорганизмов в темном поле различают яркие объекты (только их контуры) на интенсивно темном поле.
Для изучения препаратов слабоконтрастных живых микроорганизмов (клетки мало отличаются по окраске и прозрачности от окружающей среды) применяют фазово-контрастную микроскопию. Для микроскопирования этим способом используют кроме обычного биологического микроскопа фазово-контрастное устройство, в комплект которого входит вспомогательный микроскоп, специальные фазовые объективы и конденсор с набором кольцевых диафрагм; кроме того, необходима сильная осветительная лампа. Методика и порядок работы с фазово-контрастным устройством описаны в специальных руководствах [140].
Клетки микроорганизмов способны в большей или меньшей степени светиться (люминесцировать, флуоресцировать) под влиянием падающего на них света. Большинство микроорганизмов обладает слабой собственной, или первичной, люминесценцией. При обработке препаратов специальными красками (флуорохромами) клетки микроорганизмов приобретают наведенную, или вторичную, флуоресценцию. Флуоресценцию клеток наблюдают в люминесцентном микроскопе в проходящем и падающем свете, часто в сочетании с фазово-контрастным устройством [25].
Для электронной микроскопии используют сложный электронный микроскоп, полезное увеличение которого достигает 20– 50 тыс. раз. При последующем оптическом увеличении в 5–6 раз можно получить полезное увеличение до 200–300 тыс. раз. Разрешающая способность современных электронных микроскопов составляет 1,5–1,0 и даже 0,5 нм. Электронная микроскопия позволяет исследовать микроорганизмы только в фиксированном состоянии.
ПРИГОТОВЛЕНИЕ ПРЕПАРАТОВ ДЛЯ МИКРОСКОПИРОВАНИЯ
Препараты живых микроорганизмов
Для определения формы микроорганизмов, их подвижности, физиологического состояния готовят препараты живых микроорганизмов и ведут прижизненное наблюдение.
Приготовление препарата для наблюдения в раздавленной капле. На чистое предметное стекло стерильной петлей помещают каплю исследуемой жидкости и накрывают покровным стеклом. При опускании покровного стекла на каплю следует прикоснуться ребром его к краю капли и, постепенно наклоняя, опустить. Иногда под стеклом остаются пузырьки воздуха. Если пузырьки воздуха единичные, то они не мешают микроскопированию и ими можно воспользоваться при отыскании мелких микроорганизмов в поле зрения микроскопа. Если пузырьков воздуха много, то препарат следует переделать. Капля должна быть небольшой, чтобы жидкость не выступала за края покровного стекла. Излишек жидкости, вышедшей из-под покровного стекла, удаляют полосками фильтровальной бумаги.
Если рассматривают культуру, выросшую на плотной питательной среде, то на чистое предметное стекло наносят каплю водопроводной воды и в нее вводят иглой небольшое количество исследуемой культуры. Приготовленный препарат рассматривают под микроскопом.
Приготовление препарата для наблюдения в висячей капле. Для этого используют предметное стекло со специальным углублением, с луночкой. Висячей каплей удобнее пользоваться для наблюдения подвижности микроорганизмов, размножения, прорастания спор.
Препарат готовят так: в центр покровного стекла помещают небольшую каплю жидкости с микроорганизмами; покровное стекло с каплей культуры накрывают предметным стеклом с лункой, предварительно смазав ее края тонким слоем вазелина; предметное стекло осторожно прижимают к покровному и быстро перевертывают препарат.
Приготовление препаратов для изучения клеточных структур. Микроорганизмы можно наблюдать в неокрашенном виде и с прижизненной окраской. Для этого используют малоконцентрированные растворы различных красок, которые не оказывают на микроорганизмы губительного действия, дифференцированно окрашивают содержимое клетки и способствуют более точному изучению формы клеточных структур.
Для прижизненной окраски дрожжей и бактерий применяют нейтральную красную, метиленовую синюю, нейтральную фиолетовую, зеленый янус, эозин и эритрозин в очень незначительных концентрациях – от 0,001 до 0,0001%. Окрашенный препарат готовят введением под покровное стекло небольшой капли раствора красителя или микроорганизмы вносят в каплю краски на предметном стекле, после чего каплю накрывают покровным стеклом. Метод подробно описан в руководствах [109, 140].
Препараты убитых микроорганизмов
Такими препаратами пользуются в тех случаях, когда необходимо рассмотреть детали строения клеток (ядро, включения, споры), произвести подсчет микроорганизмов и т. д. Для этого микроорганизмы фиксируют на предметном стекле и окрашивают. Приготовление препарата состоит из ряда операций.
Каплю с микроорганизмами петлей распределяют возможно более тонким слоем на обезжиренном предметном стекле площадью около 4 см2. Можно приготовить мазок, пользуясь стеклом со шлифованным краем, которое для распределения капли передвигают вдоль предметного стекла. Затем препарат высушивают при комнатной температуре. Для ускорения высушивания препарат мазком вверх осторожно прогревают над пламенем горелки.
Следующая важная операция – фиксация, целью которой является убить микроорганизмы и закрепить их на стекле. Существует много способов фиксации. Простейшим из них является фиксация пламенем. Для этого препарат медленно 3–4 раза проводят над верхней частью пламени горелки таким образом, чтобы сильно нагреть нижнюю поверхность стекла, чем и достигается фиксация. Для фиксации микроорганизмов также широко применяют растворы различных химических веществ: этиловый спирт (96% об.) в течение 5–20 мин; смесь равных объемов этилового спирта и эфира – 5 мин; метиловый спирт – 5 мин; смесь формалина (5 мл) со спиртом (95 мл) – 2 мин и др.
На фиксированный препарат наносят раствор какого-либо красителя в зависимости от цели исследования.
Прямое флуорохромирование – это непосредственная окраска живых или фиксированных микроорганизмов флуоресцирующими красителями, такими, как берберин-сульфат, акридин оранжевый, аурофосфин, нейтральная красная, примулин и др. Они объединяются по двум признакам: по способности ярко люминесцировать в сине-фиолетовых или ультрафиолетовых лучах и по избирательному связыванию с определенными тканевыми или клеточными элементами.
При окраске для наблюдений за формой микроорганизмов применяют водно-спиртовые растворы метиленовой синей или метиленовой фиолетовой (насыщенный спиртовой раствор, разведенный в 5–10 раз водой). Окрашивание длится 3–5 мин, после чего краску сливают, препарат промывают легкой струей дистиллированной или водопроводной воды и высушивают.
На сухой мазок наносят каплю воды, накрывают стеклом и микроскопируют. Если для исследования пользуются иммерсионной системой, то кедровое масло наносят непосредственно на сухой мазок [131].
Окраска по Граму – это важный диагностический признак. Метод основан на том, что протоплазма одних видов микроорганизмов образует прочное, нерастворимое в спирте соединение йода с красителем, у других видов это соединение не образуется. Для окраски препарат фиксируют и обрабатывают карболовым раствором генцианового фиолетового, затем раствором Люголя. Последовательность окраски препарата описана в литературе [131].
Из микроорганизмов, развивающихся в сусле и в вине, красятся по Граму (грамположительные), имеют сине-фиолетовый цвет – дрожжи, молочнокислые бактерии (стрептококки и палочки); не красятся по Граму (грамотрицательные), имеют красный цвет – уксуснокислые бактерии.
Окраска клеточных включений
Каплю исследуемой жидкости смешивают на предметном стекле с каплей водного раствора красителя, накрывают покровным стеклом и через 5 мин мйкро-скопируют.
При прижизненной окраске во л ют и н чаще всего образует зерна в вакуолях. При окраске нейтральной красной и метиленовой синей (растворы 1 :5000) волютин в вакуолях клеток дрожжей выпадает в виде ярко окрашенных красных или синих шариков [25]. При окраске фиксированного препарата метиленовым синим волютиновые зерна приобретают фиолетовый или фиолетово-красный цвет, а цитоплазма клетки окрашивается в голубой. Хорошо окрашиваются также включения молочнокислых бактерий–палочек.
Для наблюдений живых микроорганизмов готовят 0,01%-ные и 0,001 %-ные водные растворы красок. Для этого 10 мг сухой краски растворяют в 1 л дистиллированной воды.
Для окраски фиксированных препаратов готовят растворы в соотношении 1 :40 (1 мл насыщенного спиртового раствора краски смешивают с 40 мл воды).
Гликоген почти всегда содержится в клетках микроорганизмов в виде включений или в растворенном состоянии в цитоплазме. Характерной для него является окраска йодом в красно-бурый цвет. Для обнаружения гликогена на фиксированных препаратах используют крепкий раствор йода (7 г йода + 20 г йодистого калия + 100 мл дистиллированной воды). Препарат рекомендуется предварительно обезжирить, можно при фиксировании в смеси спирта с эфиром 1 : 2.
Для прижизненного окрашивания микроорганизмов используют раствор Люголя (0,33 г йода кристаллического+ 0,66 г йодистого калия+100 мл воды дистиллированной). Сначала в 10 мл воды растворяют йодистый калий, затем – йод и доливают водой до 100 мл.
Жир в клетках микроорганизмов чаще всего встречается в виде липопротеидных телец. Для окраски жира используют раствор 0,1 г Судана (судан III) в 20 мл 95%-ного спирта или в концентрированной молочной кислоте. К капле густой суспензии микроорганизмов на предметном стекле добавляют каплю 40%-ного формалина и оставляют на 5 мин. К фиксированному таким образом препарату прибавляют каплю раствора метиленовой синей (1:40) и оставляют на 10 мин. Затем добавляют каплю свежеприготовленной смеси равных объемов спиртового раствора Судана и воды. Плазма окрашивается в синий цвет, капли жира в розовый, а вакуоли остаются бесцветными.
Сера может быть в клетках в виде полужидких маслянистых капель, сильно преломляющих свет. Чтобы убедиться, что клетки дрожжей содержат элементарную серу, их следует высушить, затем растворить капли серы в сероуглероде или безводном спирте, или в растворе гидроксида калия и соды (в последней при нагревании). Обработав препарат высокой температурой, затем в течение 1 мин концентрированной пикриновой кислотой, после промывания водой можно наблюдать кристаллизацию серы в виде одноклиномерных кристаллов, чаще расположенных вне клеток.
При наличии большой массы дрожжей ее высушивают, помещают в сероуглерод, а затем профильтровывают настой, дают ему испариться на часовом стекле. Полученный желтый маслянистый остаток при сжигании превращается в сернистый ангидрид, легко обнаруживаемый по характерному запаху.

