Для определения количества микроорганизмов в 1 мл жидкости производят подсчет их под микроскопом в счетной камере (Тома-Цейса, Горяева, Бюркера или Предтеченского). Счетная камера имеет вид толстого предметного стекла, в центре которого находится стеклянная пластинка с выгравированной на ней сеткой (или 2 сетки на разделенной пополам пластинке). Справа и слева от центральной пластинки находятся 2 другие стеклянные пластинки с уровнем на 0,1 мм выше.
После тщательного перемешивания исследуемой жидкости берут каплю ее сухой стеклянной палочкой или петлей, наносят на сетку счетной камеры, накрывают покровным стеклом размером 18X18 мм толщиной 0,25–0,35 мм и притирают покровное стекло к боковым пластинкам камеры. Притирают покровное стекло для того, чтобы высота слоя исследуемой жидкости в камере была 0,1 мм. Затем счетную камеру кладут на столик микроскопа и находят в его поле зрения сетку. Легче ее находить под малым увеличением (10X8). Затем, не двигая счетную камеру, делают увеличение в 400 раз (окуляр ЮХобъектив 40). При таком увеличении в поле зрения микроскопа помещается 1 большой квадрат, состоящий из 16 маленьких квадратов или не разделенный на маленькие квадраты.
Подсчитывают все клетки микроорганизмов, находящиеся внутри большого квадрата, а также на пограничных линиях, если клетки большей половиной находятся в данном квадрате. Клетки, большая половина которых находится в другом квадрате, не подсчитываются. Если клетки пересекаются пограничной линией пополам, то клетки считают только на двух смежных сторонах квадратов, например, на левой и нижней.
В каждом препарате подсчитывают клетки в пяти больших квадратах, например, по углам и в центре сетки. В слишком густых суспензиях считать микроорганизмы трудно, поэтому их следует разбавлять водой и пользоваться такими разведениями при которых количество клеток в одном большом квадрате будет не более 30.
Для того чтобы результат подсчета был достоверен, необходимо сосчитать не менее 600 микроорганизмов. Количество препаратов, в которых нужно подсчитать микроорганизмы, будет зависеть от количества клеток в них. Так, если в пяти больших квадратах одного препарата содержится около 150 клеток, то нужно приготовить 4 препарата, чтобы общее количество сосчитанных клеток было около 600 [108].
Объем одного большого квадрата во всех счетных камерах равен 1/250 мм3, соответственно объем 5 квадратов равен 5/250 или 1/50 мм3.
Чтобы определить количество клеток в 1 мл (в 1000 мм3) исследуемого субстрата нужно среднюю сумму количества клеток, в пяти больших квадратах умножить на 50 000.
Число микроорганизмов в 1 мл исследуемого субстрата (х) удобно определять по формуле
х = α • 50000 b,
где α – средняя сумма количества подсчитанных клеток в пяти больших квадратах;
b – разведение исходной суспензии микроорганизмов;
50000 – коэффициент пересчета объема пяти больших квадратов на 1 мл.
Для подсчета общего количества клеток культур дрожжей, образующих конгломераты, рекомендуется в исследуемую пробу добавлять равное количество 10%-ной серной кислоты и тщательно ее перемешивать для разъединения скоплений клеток. Подсчитывая результаты, следует учитывать разбавление вдвое раствором серной кислоты.
При дифференцированном подсчете почкующихся, живых и мертвых клеток дрожжей на сетку помещают каплю исследуемой дрожжевой суспензии, добавляют каплю водного раствора метиленовой синей (1 : 10 000), перемешивают, накрывают покровным стеклом, притирают его. Через 5 мин после приготовления препарата подсчитывают отдельно количество почкующихся, живых и мертвых клеток. Подсчитывая результаты, следует учитывать разбавление вдвое метиленовой синей.
МЕТОД ДИФФЕРЕНЦИАЦИИ ЖИВЫХ И МЕРТВЫХ МИКРООРГАНИЗМОВ
Метод состоит в окрашивании препарата в флуорохромом примулином. При рассматривании препарата в люминесцентном микроскопе тела мертвых микроорганизмов люминесцируют в результате проникновения красителя внутрь клеток. Живые микроорганизмы не видны.
При микроскопировании белых вин бактериологической петлей диаметром не более 2 мм помещают на предметное стекло каплю осадка и рядом каплю водного раствора примулина (1 : 20 000), смешивают кх и накрывают покровным стеклом, на которое затем кладут каплю нелюминесцирующего иммерсионного масла.
При микроскопировании красных вин в связи с гашением люминесценции красным цветом вина последний необходимо устранить, что достигается созданием в препарате щелочной среды. Красный цвет вина при этом превращается в синий. Бактериологической петлей помещают на предметное стекло рядом каплю осадка вина и 2 капли раствора примулина (1 : 20000) в фосфатном буферном растворе pH 8–9.
Все капли тщательно смешивают петлей и покачиванием стекла в течение 1–2 мин, накрывают покровным стеклом, на которое помещают каплю нелюминесцирующего иммерсионного масла.
Приготовленные препараты рассматривают в люминесцентном микроскопе в фиолетовой и синей видимой части спектра.
Для этого пользуются светофильтрами «синий свет», «сине-зеленый свет», «белый свет» и запирающим желтым.
Применяют объектив масляной иммерсии 90Х, окуляр 5Х и дополнительное увеличение 1,6Х (для микроскопа MЛ-2).
Сначала препарат рассматривают в проходящем свете и подсчитывают общее количество микроорганизмов, а затем в свете люминесценции, подсчитывая только количество мертвых клеток.
В свете люминесценции живые микроорганизмы не видны, иногда у дрожжевых клеток светится только оболочка в виде
тонкого зеленого кольца (рис. 50). Мертвые дрожжи и бактерии в свете люминесценции светятся зеленым и желтым светом разной интенсивности. Исключение составляют уксуснокислые бактерии в красных винах, погибшие под воздействием высоких температур. В этом случае мертвые бактерии не люминесцируют, так же, как и живые.
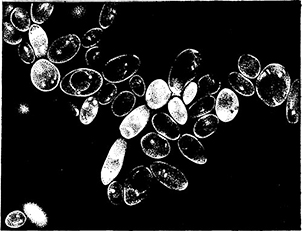
Рис. 50. Дифференциация живых и мертвых клеток дрожжей,
обработанных примулином при люминесцентной микроскопии.
Мертвые клетки светятся, живые окружены светящимся кольцом оболочки.
Для уточнения физиологического состояния уксуснокислых бактерий рекомендуется производить контрольное микроскопирование убитой культуры. Для этого на два предметных стекла наносят по капле осадка вина. На первом стекле готовят препарат для микроскопирования, как описано выше, для красного вина. Каплю вина на втором стекле осторожно подогревают, несколько раз проводя стекло нижней поверхностью над пламенем горелки, пока оно не станет горячим (определяется тыльной стороной кисти руки). После остывания продолжают приготовление препарата. Сравнивают микроскопическую картину в обоих препаратах. Если уксуснокислые бактерии в исследуемой пробе вина живы, то в первом препарате они не светятся, а во втором (погибшие в результате мягкого термического воздействия) – ярко люминесцируют. Если бактерии в пробе вина были мертвы – в обоих препаратах микроскопическая картйна будет одинаковой.
Контрольное параллельное микроскопирование препаратов можно применять во всех случаях, когда определение физиологического состояния микроорганизмов затруднительно.
При подсчете микроорганизмов необходимо учитывать разведение исследуемого материала в 2 раза для белых вин и в 3 раза – для красных.
ПОДСЧЕТ ЖИВЫХ КЛЕТОК МЕТОДОМ ПОСЕВА
Для определения небольшого количества живых клеток, которые нельзя подсчитать в счетной камере, и для более точного определения большого количества живых микроорганизмов в исследуемом материале пользуются методом посева и культивирования. Для этого делают посев исследуемого субстрата на плотную питательную среду в чашки Петри и подсчитывают количество выросших колоний.
При небольшом количестве живых микроорганизмов в анализируемой пробе делают посев без разведений, а при большом их количестве делают разведения с таким расчетом, чтобы на чашке вырастали отдельные колонии и можно было их подсчитать.
Для разведений готовят пробирки со стерильной водопроводной водой по 4,5 мл в каждой (разливают стерильной пипеткой в стерильные пробирки около пламени). Затем стерильной пипеткой берут 0,5 мл исследуемой жидкости и вносят в пробирку № 1 с 4,5 мл стерильной воды. Получают разведение в 10 раз •(или 1-е). Другой стерильной пипеткой перемешивают содержимое пробирки № 1, отбирают из нее 0,5 мл и вносят в пробирку № 2 с 4,5 мл стерильной воды – получают разведение в 100 раз (или 2-е). Таким же образом, каждый раз беря новые стерильные пипетки, делают разведения в 1000 раз (3-е), в 10000 (4-е) и т. д.
Для посева берут стерильные чашки Петри (с заранее разлитой плотной питательной средой, благоприятной для размножения исследуемых микроорганизмов), надписывают на дне чашек номер разведения, берут новую стерильную пипетку и в чашку с № 4 вносят 0,1 мл из 4-го разведения, этой же пипеткой берут затем 0,1 мл из 3-го разведения и вносят в чашку с № 3, этой же пипеткой берут 0,1 мл из 2-го разведения и вносят в чашку № 2 и т. д.
Для равномерного распределения клеток на всей поверхности агара посевной материал растирают стерильным шпателем, начиная с большего разведения. Чашки с посевами переворачивают вверх дном и помещают в термостат с температурой 25–28°С. Через 5–7 сут подсчитывают выросшие колонии. Для подсчета лучшими разведениями следует считать те, которые дали на агаре от 50 до 200 колоний. При большем числе колоний дно чашки Петри расчерчивают чернилами или восковым карандашом на несколько одинаковых секторов, считают число колоний в 2–3 секторах и среднее число, найденное для одного сектора, умножают на количество секторов.
Для определения количества живых микроорганизмов в 1 мл исследуемой жидкости умножают число сосчитанных колоний на разведение и на 10, так как для посева на чашки бралось 0,1 мл. Например, на чашке выросло 120 колоний в 3-м разведении. Это означает, что в 1 мл исходного субстрата было 120Х X 1000Х 10=1 200 000 живых клеток микробов.
ИЗМЕРЕНИЕ ВЕЛИЧИНЫ КЛЕТОК
Величину микроорганизмов измеряют при помощи окулярного микрометра – круглого стеклышка с нанесенными на него делениями (1 мм разделен на 10 делений). Окулярный микрометр вставляют стороной с делениями вверх на диафрагму окуляра.
Для определения размеров клеток применяют также специальные винтовые окулярные микрометры.
Для определения истинной величины клетки необходим поправочный коэффициент, который устанавливают с помощью объективного микрометра с делениями 1 мм на 100 частей (одно деление равно 10 мкм). Объективный микрометр помещают на столик микроскопа и определяют, сколько окулярных и объективных делений помещается на отрезке от окулярного нуля до ближайшего совпадения черточек (рис. 51). В данном случае одно деление окулярного микрометра равно 4 мкм (20 : 5).
При микроскопировании препарата с живыми микроорганизмами с тем же объективом и окуляром, при которых определялся поправочный коэффициент, измеряют длину и ширину клеток. Замеряют обычно несколько клеток, затем средний показатель 236 умножают на поправочный коэффициент [108, 140].
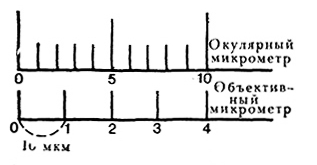
Рис. 51. Определение цены деления окулярного микрометра.
МЕТОДЫ ВЫДЕЛЕНИЯ ЧИСТЫХ КУЛЬТУР МИКРООРГАНИЗМОВ
Выделение чистых культур дрожжей
Для изучения свойств какого-либо микроба прежде всего необходимо получить его в чистой культуре, т. е. в культуре, представляющей потомство одной клетки.
Изолирование (выделение) микробов или получение чистых культур возможно следующими методами:
- из отдельной колонии методом посева на плотную питательную среду;
- выделением чистой культуры заведомо из одной клетки (методом Линднера или при помощи микроманипулятора).
Выделение микроорганизмов из отдельной колонии. Этим методом часто пользуются для выделения чистых культур винных дрожжей. Метод основан на выделении чистой культуры из дрожжевой колонии, выросшей изолированно на плотной питательной среде. Для получения изолированных колоний можно пользоваться поверхностным посевом. С этой целью заранее за 2–3 сут разливают стерильно в чашки Петри виноградный сусло-агар слоем 5–6 мм.
Каждая клетка дрожжей, попав на плотную питательную среду, начинает размножаться и образует колонию – скопление клеток, расположенных вплотную одна к другой, которые являются потомством одной клетки. Если суспензия дрожжей, из которой делался посев, была густая, то на плотной питательной среде колонии вырастают близко одна к другой, часто сливаются вместе и в таком случае невозможно выделить потомство одной клетки, т. е. чистую культуру дрожжей.
Чтобы получить рост отдельных колоний на поверхности агара при выделении культур из бродящего виноградного сусла, нужно сделать его разведение. Для этого только что прокаленную и остуженную иглу погружают примерно на 1 см в бродящее сусло и сразу переносят в 0,5 мл стерильной водопроводной' воды в пробирке. После перемешивания содержимого пробирки из нее берут одну петлю посевного материала и переносят его на поверхность агара в чашку Петри. Маленькую каплю исследуемого материала размазывают легкими движениями стерильного стеклянного шпателя по поверхности агара.
Если чистую культуру дрожжей выделяют из виноматериала или других проб, содержащих неизвестное количество живых дрожжей, то делают обычно два посева. Первый – более густой делают из первоначального материала без разведения, второй – после предварительного разведения небольшого количества (1 – 2 капли) первоначального материала в 5 мл стерильной воды в пробирке. Из этого разведения и из первоначального материала берут стерильной пипеткой по 1 капле посевного материала и переносят на поверхность агара в чашки Петри, где его распределяют по поверхности агара шпателем.
Можно посевной материал распределять по поверхности агара для получения отдельных колоний не шпателем, а посевом при помощи петли штрихом. Для этого нужно взять стерильной (прокаленной и остуженной) петлей каплю исследуемого материала и сделать штрих по всей поверхности чашки с агаром (рис. 52). Чашки с посевами перевернуть вверх дном и инкубировать 4–5 сут при температуре 25–28°С.
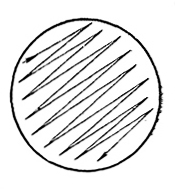
Рис. 52. Посев штрихом для выделения отдельных колоний.
Для выделения чистой культуры дрожжей прокаленной и остуженной петлей или лучше иглой прикасаются к выросшей изолированной колонии и переносят небольшое количество образующих ее клеток в пробирку со стерильным виноградным суслом или сусло-агаром. Через 2–3 сут размножится чистая культура.
Чашечным методом не всегда можно сразу получить колонии чистых культур, так как часть выросших колоний может образоваться не из одной клетки, а из нескольких, склеившихся между собой или из попавших на поверхность агара близко одна к другой и давших сначала изолированные колонии, но вскоре слившихся в одну смешанную. Поэтому необходимо провести повторный рассев выделенной из отдельной колонии культуры одним из выше описанных способов и снова отсеять культуру из изолированной колонии. Чистоту выделенной культуры проверяют как микроскопированием (однородность клеток), так и повторными рассевами в чашках Петри (однородность вырастающих колоний).
Выделение дрожжей из одной клетки по методу Линднера. На стерильное покровное стекло наносят стерильным чертежным пером ряд мелких капель из последовательных разведений дрожжей в стерильном сусле. Стекло перевертывают и помещают над лункой стерильного предметного стекла, края покровного стекла замазывают расплавленным парафином или смазывают вазелином, чтобы не происходило испарения. При просмотре под микроскопом отмечают капли, содержащие по одной клетке. Препараты помещают в термостат при температуре 25–28°С. Через 12–24 ч снова просматривают капли и отмечают те, где образовалась одна колония. Эту каплю осторожно снимают стерильной маленькой полоской фильтровальной бумаги, зажатой стерильным пинцетом, и вносят ее в пробирку со стерильным суслом (рис. 53).
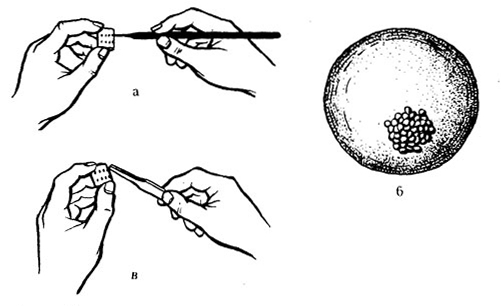
Рис. 53. Выделение чистой культуры дрожжей из одной клетки:
а – нанесение капель; б – капля с развившейся колонией; в – снятие капли с колонией.
Выделение дрожжей из одной клетки при помощи микроманипулятора. Микроманипулятор позволяет производить захват одной клетки дрожжей специальной микроскопической пипеткой или иглой под контролем микроскопа. Микроманипулятор имеет два операционных штатива (ассистента), между которыми расположен микроскоп. В держателях штативов закрепляются микропипетки или иглы. Перемещение их осуществляется с микронной точностью благодаря системе винтов и рычагов, которые позволяют кончики инструментов вводить в висячую каплю и захватывать ими отдельную клетку [25, 140].
Выделение чистых культур уксуснокислых бактерий
Выделение ведут путем высева отдельных хорошо изолированных колоний, выросших на плотной питательной среде. Для выделения уксуснокислых бактерий отбирают образцы вин с запахом уксусноэтилового эфира, в которых при микроскопировании обнаружены отдельные клетки бактерий или скопления их – неподвижные короткие палочки, иногда с инволюционными формами.
Накопительную культуру готовят на вине с суслом. Пробу вина в количестве 0,5–1 мл высевают в среду. После 2–3 сут развития при температуре 28–30°С визуально судят о росте культуры – появление тонкой, гладкой, глянцевато-влажной или сухой пленки на поверхности среды.
Рассев накопительной культуры (разведений в стерильной водопроводной воде) проводят на сусло-агаре в чашках Петри. Через 2–3 сут при температуре 30–35°С вырастают колонии дрожжей и между ними – мелкие, плоские, неправильной формы, беловато окрашенные, влажно блестящие, слизистые колонии уксуснокислых бактерий. Отдельные колонии переносят в пробирки со стерильной жидкой питательной средой и выдерживают при температуре 28–30°С. О развитии бактерий судят по образованию пленки на поверхности питательной среды, внешние признаки которой следующие: тонкая, умеренно прочная, несмачиваемая, всползающая по стенкам пробирки.
При определении чистоты выделенной культуры ее визуально осматривают, чтобы убедиться в росте пленки. Микроскопический контроль должен подтвердить наличие бактерий палочек укороченных или удлиненно-яйцевидных, одиночных или соединенных по 2–3. Для проверки чистоты культуры можно воспользоваться окраской по Граму. Хранят выделенные культуры уксуснокислых бактерий на жидких или плотных питательных средах в холодильнике при температуре 5–10°С с пересевом 1 раз в месяц.
Выделение чистых культур молочнокислых бактерий
Для выделения молочнокислых бактерий берут вина, в которых при микросшширшашш; .обнаружены бактерии, могущие быть отнесенными к выделяемой группе на основании морфологических признаков. Накопительную культуру получают при высеве пробы вина в любую питательную среду, рекомендуемую для развития молочнокислых бактерий, с добавлением этилового спирта. Предпочтение отдается жидкой капустной среде или солодовому суслу с содержанием сухих веществ 3%.
Пробу вина в количестве 0,5–1 мл стерильно высевают в среду. После подращивания в термостате при температуре 28°С в течение суток в посев добавляют этиловый спирт до содержания 12–16% об. и продолжают инкубацию в термостате. О получении накопительной культуры судят по помутнению среды, появлению осадка. Помимо визуальной оценки культуральную жидкость микроскопируют и выявляют присутствие молочнокислых бактерий.
Накопительную культуру можно получить путем подращивания бактерий в пробе вина. Для этого в пробу вина добавляют несколько миллилитров дрожжевого автолизата (20–30 мл на 1 л вина) и оставляют при комнатной температуре на несколько дней без доступа воздуха. Затем вино центрифугируют при 5000 об/мин дважды: первый раз 2–3 мин для отделения дрожжей, второй – 10–20 мин для осаждения бактерий. Вино сливают из центрифужных пробирок, а осадок используют для рассева.
Основным методом выделения чистой культуры молочнокислых бактерий является известный способ выделения отдельной колонии, которую считают результатом развития одной клетки.
Накопительную культуру или ее разведения в стерильной водопроводной воде высевают на поверхность плотной среды – 1,5% солодового сусла-агара, содержащего 3% СВ. Порядок работы при этом такой же, как и при выделении чистых культур дрожжей.
Через 7–14 дней на поверхности плотной среды вырастают крупные выпуклые кремового оттенка колонии дрожжей, а между ними – мельчайшие плоские, голубоватые, опалесцирующие колонии молочнокислых бактерий не совсем правильной округлой формы с неровными краями, хорошо видные в лупу с четырехкратным увеличением. Из выросших на чашках типичных колоний бактерий, далеко отстоящих от колоний других микробов, захватывают посевной петлей или лучше иглой колонию и переносят ее в пробирку с жидкой средой. Пробирки помещают в термостат при температуре 20–25°С на 7–10 дней.
Когда среда в пробирках слегка помутнеет и в ней при встряхивании пробирки станут видны прозрачные шелковистые волны, а на дне – легкий беловатый осадок, это значит, что бактерии размножились.
Чаще бывает достаточно одного посева на плотную среду, чтобы получить чистую культуру. Однако для уверенности в чистоте культур посев на плотную питательную среду повторяют. В качестве посевного материала при этом используют культуру, полученную из отдельной колонии.
Чистота культуры выделенных молочнокислых бактерий должна быть проверена визуальным способом, микроскопическим контролем и высевом на диагностическую питательную среду.
Визуальный осмотр посева на скосе плотной питательной среды должен подтвердить однородность культуры.
Микроскопический контроль должен подтвердить наличие тонких коротких или длинных палочек, или кокковых форм, расположенных по две или цепочками.
Для предварительного ориентировочного определения молочнокислых бактерий делают рассев культуры на поверхность агаризованного солодового сусла с 2% мела. Вокруг колоний молочнокислых бактерий возникает зона растворения мела в результате образования ими молочной кислоты и растворимого лактата кальция.
Хранят выделенные культуры молочнокислых бактерий на жидких питательных средах, в том числе и на смеси (1 : 1) виноградного сусла с солодовым, содержащим 3% сухих веществ, в холодильнике при температуре 5–10°С с пересевом 1 раз в месяц.
Для хранения лейконостоков рекомендуется среда АТБ с 1,5% агара. Культуры, посеянные уколом, выращивают в анаэробных условиях в атмосфере Н2 и СО2 (9 : 1), а затем хранят в холодильнике в течение нескольких месяцев [73].

