ДРОЖЖИ
Спорообразование
Форма спор, способ их образования и прорастания являются родовыми признаками дрожжей. Поэтому при определении систематического положения выделенных культур дрожжей их высевают на специальные среды для спорообразования.
Для получения спор у дрожжей было предложено много разных сред [90]. В настоящее время для получения спор наиболее распространенным является прием выращивания дрожжей в течение 1–2 сут на полной среде, а затем пересев их на среду с ацетатом [63].
Состав полной среды (в г на 1 л воды):
Пептон 10
Дрожжевой экстракт 5
Глюкоза 20
Агар 20
Стерилизацию проводят в течение 30 мин при давлении 0,08 МПа.
Состав среды с ацетатом (в г на 1 л воды):
Ацетат натрия 10
Хлористый калий 5
Агар 20
Стерилизацию ведут в течение 30 мин при давлении ОД МПа.
Усвоение сахаров
Изучение усвоения различных сахаров необходимо для определения видовой принадлежности дрожжей.
Готовят дрожжевой отвар (200 г прессованных хлебопекарных дрожжей в 1 л водопроводной воды) или полную жидкую среду без глюкозы и агара (пептон – 10 г, дрожжевой экстракт – 5 г, вода – 1л). Среду фильтруют, разливают по склянкам, в каждую из них добавляют по 2% одного из сахаров (глюкозы, галактозы, сахарозы, мальтозы, лактозы, рафинозы) и стерилизуют либо 3 дня подряд в кипятильнике Коха, либо в автоклаве при давлении 0,05 МПа в течение 20–30 мин.
Опыты по усвоению различных сахаров ставят в трубках Дун-242 бара (рис. 54), в которые стерильно разливают приготовленную питательную среду с разными сахарами и засевают изучаемыми культурами дрожжей. После перемешивания содержимого трубок их ставят таким образом, чтобы закрытое колено было направлено вверх, а открытое было в наклонном положении. Трубки помещают в термостат, ежедневно просматривают, их содержимое перемешивают и отмечают по выделению углекислоты и скоплению ее в закрытом колене трубок усвоение сахара.
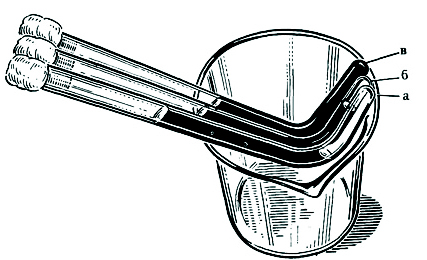
Рис. 54. Трубки Дунбара:
а – сахар сброжен полностью; б – сброжен не полностью; в — сахар не сброжен.
Бродильная и спиртообразующая способность
У выделенных чистых культур винных дрожжей обычно в первую очередь определяется бродильная способность (скорость и полнота сбраживания 18–20% сахара в виноградном сусле).
Опыты по брожению ставят в колбах, закрытых пробками. Для выхода углекислоты и предотвращения испарения бродящего сусла в пробке делают отверстие и вставляют в него специальный бродильный затвор, а при его отсутствии – стеклянную трубку с верхним концом, оттянутым в капилляр, или стеклянную трубку с ватным тампоном, на верхний конец которой надевают резиновый клапан. Для изготовления клапанов берут резиновый шланг такого же диаметра, как стеклянная трубка, разрезают на отрезки длиной 5 см, делают на каждом лезвием острой бритвы прорезь длиной около 1 см, надевают каждый на стеклянную трубку, а верхний конец закрывают стеклянной бусинкой или коротким отрезком стеклянной палочки. Углекислота, выделяющаяся при брожении, будет выходить через прорезь в клапане.
В колбы наливают виноградное сусло на 2/3 их объема, закрывают колбы ватными пробками и стерилизуют в кипятильнике Коха текучим паром в течение 30 мин. Когда сусло остынет, в него вносят разводки испытуемых культур дрожжей в одинаковом количестве и одного возраста. Колбы закрывают пробками с бродильными затворами, капиллярами или клапанами, взвешивают на технических весах и ставят в термостат при температуре 25–28°С. Ежедневно колбы взвешивают и по убыли в массе, которая соответствует количеству выделившейся углекислоты, судят о скорости сбраживания сахара в сусле разными расами дрожжей. Опыты с каждой культурой нужно ставить не менее чем в двух повторностях. Конец брожения определяют по отсутствию изменения в массе колб. По общему количеству выделившейся к концу брожения углекислоты ориентировочно можно судить о полноте сбраживания сахара сусла.
Чтобы отобрать сильные культуры, обладающие наибольшей спиртообразующей способностью, сбраживают сусло с содержанием сахаров 29–30%. Спиртообразующую способность определяют по максимальному количеству спирта, которое могут образовать расы при сбраживании высокосахаристого сусла. По окончании брожения определяют содержание спирта. При изучении большого количества культур и необходимости определения содержания спирта во многих образцах удобно пользоваться флотационным методом определения спирта [202]. По точности он не уступает пикнометрическому, к его преимуществам относятся быстрота определения и потребность малых количеств анализируемой жидкости.
Спиртовыносливость
В большинстве случаев расы, обладающие высокой спиртообразующей способностью, являются и спиртовыносливыми. Под спиртовыносливостью следует понимать способность рас проявлять жизнедеятельность при высоких концентрациях спирта в среде.
Для определения спиртовыносливости рас дрожжей готовят разводки исследуемых рас на пастеризованном вине, содержащем 10–11% об. спирта и 2% глюкозы при температуре 25°С. Через 5 сут разводку каждой расы дрожжей вносят в количестве 1% в пропастеризованное вино, содержащее 15% об. спирта и 2% глюкозы. Вино выдерживают при температуре 25°С и отмечают, на какие сутки в нем размножились дрожжи и оно начало забраживать. Опыты удобно ставить в пенициллиновых склянках, закрытых резиновыми пробками. Наиболее спиртовыносливыми являются расы дрожжей, ранее других размножившиеся в вине с 15% об. спирта, наименее спиртовыносливые расы в таком вине не размножаются.
Холодо- и термостойкость
Брожение сусла при температурах ниже 10°С и выше 30°С часто заканчивается недобродом, т. е. неполным сбраживанием сахаров виноградного сусла. Недоброды дают некондиционный виноматериал, склонный к заболеваниям. Чтобы избежать этого, для сбраживания сусла при низких и высоких температурах целесообразно применять холодо- и термовыносливые расы дрожжей.
Для отбора холодовыносливых культур изучают бродильную способность (скорость и полноту сбраживания 18–20% сахаров в виноградном сусле) при температуре 7°С и отбирают те расы, которые начинают размножаться и сбраживают сусло быстрее и полнее других.
Для отбора термовыносливых культур изучают бродильную способность при температуре 35°С и отбирают те расы дрожжей, которые начинают размножаться и сбраживают сусло быстрее и полнее других при этой температуре.
Методика постановки опытов и контроль за ходом брожения описаны в разделе «Определение бродильной и спиртообразующей способности». Целесообразно при отборе новых холодо- и термовыносливых рас дрожжей в качестве контроля брать музейные расы, обладающие этими свойствами.
Сульфитостойкость
Для сравнительного изучения сульфитостойкости различных культур дрожжей их нужно подвергнуть действию одинаковой дозы свободной SO2. Сульфитостойкие расы можно отбирать по скорости забраживания виноградного сусла, содержащего 100 мг/л свободной SO2 в момент внесения в сусло разводок изучаемых культур.
Вначале проводят пробную сульфитацию сусла разными дозами SO2 и выбирают такую, при которой через час после внесения SO2 в сусло в нем будет содержаться около 100 мг/л свободной сернистой кислоты. Сразу после сульфитации содержание ее быстро уменьшается, так как она вступает в соединение с составными частями сусла (сахарами, альдегидами и др.), а спустя 1–2 ч ее количество уже заметно не меняется. Затем сульфитируют сусло выбранной дозой SO2 в склянке вместимостью 2 л с нижним тубусом, склянку закрывают, сусло перемешивают и оставляют на час.
За это время в стерильные небольшого объема склянки, размеченные до стерилизации по 20 мл, вносят по 0,2 мл двухсуточных разводок исследуемых рас дрожжей. Каждую культуру вносят в три склянки, т. е. опыты ставят в трех повторностях.
Через час после сульфитации сусло из 2-литровой. склянки разливают через нижний тубус по 20 мл в склянки быстро, но осторожно, чтобы оно не разбрызгивалось. Для предотвращения улетучивания SO2 склянки закрывают резиновыми пробками, обработанными спиртом, и затем ставят в термостат при температуре 27°С. При такой постановке опыта все культуры дрожжей подвергаются действию одинаковой дозы свободной SO2. Ежедневно в течение 10 дней опытные склянки просматривают и отбирают сульфитостойкие расы дрожжей по скорости размножения и забраживания сусла.
Быстрее и проще можно определять сульфитостойкость по скорости размножения штаммов дрожжей на сульфитированном виноградном сусло-агаре в чашках Петри [207]. Виноградное сусло перед розливом в чашки Петри смешивают с равным количеством 3%-ного водного агара. В связи с невозможностью определять содержание сернистой кислоты в сусло-агаре для подбора дозы сульфитации виноградное сусло в нескольких контрольных порциях смешивают с таким же количеством водопроводной воды (вместо 3%-ного водного агара). Разбавленное сусло в склянках сульфитируют несколькими дозами крепкого водного раствора сернистой кислоты для того, чтобы можно было выбрать дозу сульфитации, при которой через час после внесения SO2 в сусле, а также в сусло-агаре будет содержаться около 100 мг/л свободной сернистой кислоты. Содержание свободной сернистой кислоты определяют йодометрическим методом.
Штаммы исследуемых дрожжей предварительно выращивают в течение 2 сут в виноградном сусле при температуре 27°С, а затем уколом иглы наносят на поверхность сульфитированного сусло-агара в количестве 25 штаммов на чашку. Кончик иглы при этом погружают в разводки исследуемых культур примерно на 1 см. Чашки с посевами помещают в термостат и выдерживают при температуре 27°С. Ежедневно в течение недели просматривают чашки и отбирают сульфитостойкие штаммы, колонии которых вырастают раньше.
Первичный отбор проводится при содержании свободной сернистой кислоты 100 мг/л, а затем наиболее сульфитостойкие штаммы отбирают при содержании ее 150 мг/л.
Кислотовыносливость
В годы, неблагоприятные для вызревания винограда, отдельные его партии могут поступать на переработку при величине pH сусла 2,5–2,9. Имеются наблюдения, что не все расы дрожжей могут полностью сбродить сахар в сусле с такой низкой кислотностью. Чтобы получить полностью выброженные высококислотные виноматериалы, рекомендуется применять кислотовыносливые расы дрожжей.
Для отбора кислотовыносливых культур необходимо определять их бродильную способность в сусле с величиной pH 2,6 и содержанием сахаров 18% при температуре 25°–27°С. При отсутствии в лаборатории сусла с такими кондициями его можно получить подкислением 10%-ным раствором винной кислоты и разбавлением водой обычного сусла с более высокой концентрацией сахаров и меньшей кислотностью. Отбирают те расы дрожжей, которые начинают размножаться и сбраживают сусло быстрее и полнее других. В конце брожения необходимо определить остаточные сахара, чтобы убедиться в полном выбраживании их в сусле с pH 2,6 отобранной культурой.
Ранее был предложен метод отбора кислотовыносливых рас дрожжей, основанный на нефелометрическом определении интенсивности роста культур, выращиваемых в тонком слое виноградного сусла с величиной pH 2,5–2,7 [127]. Однако этот метод позволяет отбирать культуры, образующие биомассу с большим количеством сухих веществ, которая зависит не только от числа клеток, но и от их размеров, формы, различной проницаемости плазмы и т. д. Как показали проведенные нами исследования, культуры, образующие биомассу с большим количеством сухих веществ, могут быть слабобродящими и менее кислотовыносливыми, чем культуры с биомассой, содержащей меньше сухих веществ [201]. Поэтому отбирать кислотовыносливые расы дрожжей этим методом нельзя, а нужно отбирать их по бродильной способности в сусле с pH 2,6.
Определение фенотипов киллер, нейтральный, чувствительный
При описании различий между расами винных дрожжей сообщалось о том, что все дрожжи-сахаромицеты принадлежат к одному из трех фенотипов: убийца (киллер К), нейтральный (N) или чувствительный (S).
Применение рас дрожжей определенных фенотипов (К, N или S) позволяет проконтролировать, в какой степени чистая культура, внесенная в нестерильное виноградное сусло, овладела средой. Для этого необходимо определить процентное содержание дрожжей фенотипов К, N, S в спонтанно сбраживаемом сусле (контроль) и в отстоенном сусле, забродившем при внесении в него разводки чистой культуры дрожжей определенного фенотипа.
Металлургия определения фенотипов К, N, S состоит в следующем. В чашки Петри разливают 1,5%-ный виноградный сусло-агар за 2–3 сут до использования, чтобы он слегка подсох и затем хорошо впитывал нанесенные на него дрожжевые суспензии. Для предотвращения гидролиза агара его 3%-ный водный раствор стерилизуют отдельно от виноградного сусла и смешивают при температуре 60–70°С в равных количествах. Для лучшей контрастности зон, подавления роста чувствительных культур в расплавленную среду можно добавлять перед розливом в чашки Петри стерильный 0,5%-ный водный раствор метиленового синего в количестве 1 мл на 200 мл среды.
Отдельную колонию штамма дрожжей, фенотип которого необходимо определить, изолируют иглой с плотной питательной среды и примерно в равном соотношении переносят на внутреннюю стенку пробирки с 0,5 мл стерильной водопроводной воды и уколом – на чашку Петри с газоном культуры фенотипа S.
На одну чашку можно нанести в определенной последовательности до 30 уколов исследуемых штаммов (рис. 55).
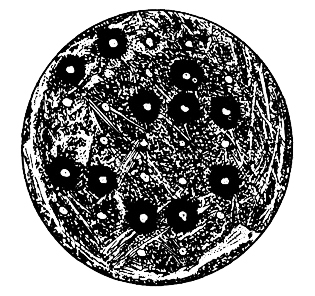
Рис. 55. Колонии исследуемых штаммов на газоне чувствительного штамма.

Рис. 56. Колонии штамма-убийцы на газоне исследуемых штаммов.
Стерильно готовят водные суспензии тех же колоний в пробирках с 0,5 мл водопроводной воды и на других чашках Петри с виноградным сусло-агаром (без газона штамма фенотипа S) делают петлей газоны исследуемых штаммов дрожжей диаметром около 1,5 см. На них в центр наносят уколом штамм фенотипа К, предварительно выращенный на виноградном сусло-агаре. На одну чашку можно нанести газоны десяти исследуемых штаммов в той же последовательности, что и на газоне штамма фенотипа S (рис. 56), Через 2 сут инкубации чашек Петри с посевами при температуре 25–28°С определяют фенотипы штаммов. Если вокруг колоний образовались зоны на газоне чувствительного штамма, то штаммы идентифицируются как киллеры. Штаммы, на газонах которых киллер образует зоны, являются чувствительными, остальные – нейтральные.
В качестве тестеров (индикаторных культур) можно использовать расы Берегово 4–7 (киллер) и Кахури 7 (чувствительная) вида Sacch. vini, имеющиеся в коллекции культур Всесоюзного научно-исследовательского института виноделия и виноградарства «Магарач».
Уксуснокислые бактерии
Морфологические признаки
Морфологию уксуснокислых бактерий изучают при выращивании культур на какой-либо из описанных питательных сред, например, на вине с суслом. Определяют внешние признаки (характер пленки на жидкой среде и колоний – на плотной), вид клеток под микроскопом (форма и подвижность), размеры и др.
Пробу на каталазу ведут упрощенным методом: на предметное стекло берут каплю перекиси водорода и добавляют одну петлю бактериальной массы. При микроскопировании с малым увеличением в случае наличия каталазы у культуры наблюдается интенсивное выделение пузырьков кислорода.
Способность окислять этиловый спирт и уксусную кислоту. Для изучения этого свойства делают посев культуры бактерий на дрожжевой агар с 3% об. этилового спирта или уксусной кислоты и 2% мела. Через 3–4 сут вокруг колоний уксуснокислых бактерий возникают зоны растворения мела.
Способность окислять молочную кислоту. Ее определяют посевом бактерий на дрожжевой агар с 2% лактата кальция. Через несколько дней вокруг колоний бактерий, окисляющих молочную. кислоту, образуется расплывчатый белый ореол.
Кетогенная способность. Определяется по методу оксидо-грамм Фратера. Для получения их на поверхность дрожжевого агара с глицерином (2%) в чашках Петри наносят (петлей, пипеткой) густую бактериальную массу. Чашки выдерживают в термостате при температуре 30°С. Через сутки агар осторожно заливают раствором Фелинга. Бактерии, окисляющие глицерин в диоксиацетон, образуют закись меди, и зона вокруг бактериальной массы окрашивается в желтый цвет. По количеству закисной меди можно судить об относительной активности окисления многоатомных спиртов в кетосоединения.
Способность к окислению глюкозы. Для определения способности бактерий окислять глюкозу в глюконовую кислоту делают их посев на дрожжевой агар, содержащий 10% глюкозы и 3% мела. Вокруг колоний бактерий, окисляющих глюкозу, образу ются прозрачные зоны. Если бактерии обладают способностью окислять глюконовую кислоту, то позднее вокруг колоний образуются кристаллы глюконата кальция.
Реакция на целлюлозу. Определяется раствором йода (0,5 г йода в 100 мл 1,5%-ного раствора йодистого калия), В каплю раствора на предметном стекле вносят каплю бактериальной пленки и добавляют 2 капли 50–60%-ной (по объему) серной кислоты. О наличии целлюлозы судят по окрашиванию клеток в синий цвет.
Колонии бактерий, образующие крахмал, также окрашиваются в синий цвет.
Способность уксуснокислых бактерий усваивать различные источники углерода (сахара, спирты, кислоты). Эту способность определяют по интенсивности роста бактерий (в пробирках или в чашках Петри) на плотной синтетической питательной среде Ридер с добавлением 0,1%-ного дрожжевого автолизата. В качестве индикатора добавляют на 100 мл среды 3 мл 0,04%-ного щелочного раствора бромтимол синего. Сахара и спирты добавляют в количестве 1%, органические кислоты – 0,2% (уксусная кислота 0,1%). Контролем служит среда без добавления источников углерода. Степень усвоения источников углерода оценивают по массе выросших бактерий и изменению цвета индикатора.
Молочнокислые бактерии
Морфологические признаки бактерий
Морфологию изучают после выращивания культур (18–24 ч) на какой-либо из сред, например на капустной. Изучают форму, размеры и соединение клеток. Для этого готовят препараты живых или фиксированных окрашенных клеток.
Форма колоний R или S изучается на агаризованных средах, не содержащих поверхностно-активных веществ. Форму колоний исследуют в глубине питательного агара после засева его уколом или внесения в него небольшой петлей культуры, выросшей на жидкой среде. Посевы выдерживают при температуре 30°С в течение 2 сут.
Влияние температуры на рост культуры
Для молочнокислых палочек показатель роста при различных температурах является признаком для предварительной классификации [73]: при температуре 45°С растут L. fermenti и иногда L. buchneri; не растут – L. brevis, L. cellobiosus, L. viridessens; при температуре 15°С растут L. buchneri, L. brevis, L. cellobiosus, L. viridescens, не растут – L. fermenti.
Жидкие питательные среды, лучше МРС или АТБ, разливают по 10 мл в пробирки, засевают и выдерживают при температуре 15°С в течение 2–3 недель, а при температуре 45°С – 4–7 дней. Пробирки закрывают колпачками или резиновыми пробками для предотвращения испарения.
Принадлежность к гомо- или гетероферментативной группе устанавливают по образованию бактериями углекислого газа из сахаров. Для этого широко используется среда Джибсона и Абдэль-Малека: глюкоза–5,0 г; капустный или томатный сок – 10 мл; дрожжевой автолизат – 0,25 мл; мясопептонный желатин
10–12%-ный – до 100 мл. Капустный сок готовят из листьев, нарезанных и нагретых на водяной бане в течение 15 мин. Затем листья растирают, выжимают сок, фильтруют его и устанавливают pH 6,5. Можно использовать консервированный томатный сок, профильтрованный через марлю и бумажный фильтр, с pH 6,5. Среду разливают в пробирки по 5–6 мл и стерилизуют текучим паром.
Перед засевом среды расплавляют, охлаждают до 40–45°С и засевают 2–3 каплями активной культуры. Затем на поверхность полужидкой среды осторожно по стенкам пробирки наливают охлажденный до 45°С водный 2%-ный агар, который при остывании образует пробку высотой 1–1,5 см. Через 2–4 сут культивирования в термостате гетероферментативные бактерии образуют углекислый газ, что визуально определяется по разрыву агаровой пробки. Гомоферментативные бактерии газа не образуют. Наблюдения ведут в течение 14 сут.
Использование углеводов и спиртов
Способность молочнокислых бактерий усваивать в качестве питательных веществ фруктозу, глюкозу, пентозы, глицерин определяют по изменение красного цвета среды в желтый. Среда Виттенбари имеет следующий состав в 1 л водопроводной воды: мясной экстракт – 5 г; пептон – 5 г; дрожжевой автолизат – 50 мл или дрожжевой экстракт – 5 г; твин-80 – 0,5 мл; индикатор – бромкрезоловый пурпурный (1,4 мл 1,6%-ного спиртового раствора на 1 л среды, pH 6,8–7,0). Углеводы и спирты добавляют в виде стерильных растворов в дистиллированной воде в таком объеме, чтобы окончательная концентрация составляла 0,5%.
Наблюдения за изменением индикатора проводят в течение 10 сут при температуре 30°С.
Слизеобразование из сахарозы
Бактерии рода Leuconostoc могут образовывать слизь на среде АТБ и на среде Виттенбари с добавлением 5% сахарозы [73].
Образование СО2 из яблочной и лимонной кислот
Это свойство молочнокислых бактерий определяют, пользуясь средой МРС с 0,5% глюкозы. К ней добавляют раствор яблочной или лимонной кислоты, нейтрализованной КОН до pH 5,5. Окончательная концентрация каждой кислоты –2 г на 100 мл среды. Среду разливают по 10 мл и стерилизуют при давлении 0,05 МПа в течение 30 мин. После засева среды сверху наносят слой (1– 1,5 см) стерильного расплавленного вазелина.
Образование СО2 из цитрата определяют по методу Джибсона и Абд-эль-Малека, используемому для оценки принадлежности бактерий к гомо- или гетероферментативному типу [73].
Использование лимонной, яблочной и винной кислот
Это свойство изучают на среде, содержащей в 1 л 400 мл водопроводной воды, 500 мл мясной воды, 100 мл томатного сока, 10 г пептона и 2% изучаемого субстрата. pH среды 4,5–5,0. Стерильную среду разливают по 4–5 мл в пробирки, засевают двумя каплями активной культуры молочнокислых бактерий и термо-статируют при 30°С. Об использовании бактериями кислот судят по данным периодического хроматографического анализа (контролем служит среда без кислот), проводимого следующим образом.
Реактивы:
1. Растворитель – н-бутиловый спирт, муравьиная кислота 85%-ная, вода (4: 1 :5). Смесь взбалтывают 10–15 мин в делительной воронке или колбе и оставляют на сутки для расслаивания. Верхний слой используют для хроматографирования.
2. Проявитель – 0,05%-ный раствор бромфенолового синего в спирте-ректификате концентрацией 96% об. На каждые 250 мл проявителя добавляют 2 мл 0,1 н. раствора NaOH.
Для приготовления свидетелей – чистых растворов винной, яблочной и янтарной кислот – по 30 мг кислоты растворяют в 5 мл спирта. Для приготовления раствора молочной кислоты 1–2 капли 50%-ной молочной кислоты растворяют в 5 мл спирта.
Используются хроматографическая бумага № 1–ленинградская или фильтровальная, эксикатор (диаметром 20 см и больше) и капилляры для нанесения капель.
Из бумаги вырезают круг по диаметру эксикатора. На бумаге описывают круг диаметром 2 см, на котором отмечают точки на расстоянии 1,5 см одна от другой. В отмеченные точки (положив под круг бумаги что-нибудь твердое) наносят капиллярами вина и растворы свидетелей. Размер пятна на бумаге должен быть не более 3 мм. Каждую последующую каплю наносят после высыхания предыдущей. Свидетели наносятся 5–б раз, исследуемое вино 7–8. После подсушивания в центр круга вставляют фитилек из хроматографической бумаги и круг помещают в эксикатор, где находится чашка Петри с растворителем. Свободный конец фитилька помещают в растворитель, эксикатор герметически закрывают крышкой. Когда растворитель пройдет по радиусу расстояние 7–8 см от центра, разделение считают законченным. Обычно это происходит за 50–60 мин. Затем бумагу извлекают, высушивают в вытяжном шкафу до исчезновения запаха муравьиной кислоты и опрыскивают раствором проявителя из пульверизатора. Кислоты располагаются по радиусу в следующем порядке: винная, яблочная, янтарная и молочная.
Для идентификации пятен кислот на бумаге отмеряют циркулем расстояние по радиусу от точки нанесения капли до начала пятна. Полученное расстояние сравнивают с расстоянием, пройденным свидетелем. Идентичные кислоты проходят одинаковое расстояние.

