Выпаривание имеет целью частично или полностью удалить растворитель из раствора. В зависимости от преследуемой цели и природы растворенного вещества и растворителя выпаривание можно проводить следующими способами:
при комнатной температуре и нормальном давлении, когда растворитель легколетучий, например этиловый эфир;
при температуре немного выше комнатной и пониженном давлении, когда растворитель малолетучий и выделяемое вещество разлагается при нагревании;
нагреванием на водяной бане. Широко применяется для водных растворов и среднелетучих растворителей;
нагреванием на песчаной бане, когда необходимо быстро удалить малолетучий растворитель;
нагреванием на открытом пламени для быстрого удаления слаболетучих растворителей или уменьшения количества раствора.
Для выпаривания используют посуду с большой площадью испарения (выпарительные чашки, часовые стекла, кристаллизаторы, стаканы).
Декантация — удаление осветленной надосадочной жидкости. Применяется только в случае образования тяжелых, плотных осадков. Обычно ее сочетают с последующей фильтрацией. Декантацию проводят с помощью резинового или полиэтиленового шланга.
Дистилляция — операция, посредством которой жидкость при нагревании превращается в пар, который, охлаждаясь, конденсируется. Дистилляция может быть осуществлена различными способами в зависимости от цели. Прибор для простой дистилляции состоит из перегонной колбы, холодильника и приемника для сбора дистиллята. Для дистилляции растворов веществ при пониженной температуре используют вакуум-дистилляцию, предусматривающую частичное удаление воздуха из перегонного аппарата с помощью водоструйного насоса.
Перегонку малолетучих веществ с высокой температурой кипения осуществляют также перегонкой с паром или в токе инертного газа. В этих случаях к перегонной колбе подключается парообразователь или баллон с газом.
Озоление — частный случай прокаливания (при температурах до 500° С); цель — полное разрушение органических веществ под действием тепла. В результате остается зола минеральных солей. Озоление органических веществ можно проводить и «мокрым» способом, применяя нагревание в сочетании с концентрированными минеральными кислотами и окислителями.
Осаждение — образование нерастворимого вещества, выпадающего в осадок, в результате взаимодействия двух растворов (осадителя и осаждаемого). Осадок может иметь кристаллическую, аморфную или коллоидальную структуру. Полнота процесса осаждения зависит от температуры, количества осадителя, степени перемешивания, времени отдыха. Повышение температуры увеличивает скорость реакции и способствует образованию больших кристаллов. Осаждающий реактив добавляют с избытком, т. е. в большем, чем нужно для реакции, количестве. Этим достигается уменьшение растворимости осадка.
Прокаливание заключается в нагревании вещества до температуры 500—1000° С на газовых горелках, в муфельных и электрических печах. При анализе вин, содержащих преимущественно органические вещества, к таким операциям прибегают сравнительно редко, например, когда соли органических кислот вин или сусла необходимо перевести в соответствующие карбонаты, легко отделяемые объемным анализом.
Прокаливание производят в тиглях или чашках из фарфора, а при высокой точности анализа — в сосудах из платины.
Промывка осадка применяется для удаления остатков раствора, захваченного осадком, и, следовательно, веществ, в нем растворенных. Для промывки используют растворитель, иногда с добавкой реактива осадителя, с тем чтобы уменьшить растворимость осадка. Промывают осадок на фильтре тонкой струей жидкости из промывалки. Следует учитывать, что многократная промывка небольшими порциями промывной жидкости более эффективна, чем одноразовая большим объемом.
Сушка — операция, заключающаяся в удалении из вещества, посуды или материала содержащейся в них воды. Сушку осуществляют в сушильных шкафах при 100—105° С. Вещества, разлагающиеся при высокой температуре, сушат в шкафах, отрегулированных на температуру, не превышающую температуру разложения или плавления. Для сушки легколетучих или плавящихся веществ используют эксикаторы, из которых с помощью лабораторного насоса выкачивают воздух. В аналитических операциях, предусматривающих сушку вещества до постоянной массы, для предупреждения поглощения влаги из воздуха высушенное вещество взвешивают в бюксах и хранят в эксикаторах.
Фильтрация — удаление взвешенных в жидкости частиц путем пропускания ее через пористый материал (фильтровальная бумага, картон, пористый фарфор, стекло, асбест и др.).
Центрифугирование — отделение осадка от раствора с помощью лабораторных центрифуг с частотой вращения до 6000 об/мин и центрифужными пробирками вместимостью 10, 25, 50 и 100 мл.
Растворение — операция, посредством которой вещество, обычно твердое, при контакте с жидкостью (растворителем) образует гомогенную прозрачную смесь (раствор). В простых растворах растворимое вещество не реагирует с растворителем (обычно водой), а только распадается на гидратированные ионы. Из простых растворов растворенное вещество может быть выделено путем выпаривания растворителя. В химических растворах, получаемых при растворении в кислотах, вещество реагирует с растворителем, образуя новые растворимые соединения. В энохимическом анализе чаще готовят простые растворы.
Концентрация раствора — количество вещества, растворенного в единице объема или массы раствора.
Концентрацию растворов выражают следующими способами:
проценты объемные (% об.) — число миллилитров вещества, растворенного в 100 мл раствора;
проценты объемно-массовые (% об.-мас.)—число граммов вещества, растворенного в 100 мл раствора;
проценты массовые (% мас.)—число граммов вещества, растворенного в 100 г раствора;
промилле (%о)—число граммов вещества, растворенного в 1000 мл раствора;
нормальность (N)—число грамм-эквивалентов вещества, растворенного в 1 л раствора; [грамм-эквивалент (г-экв) — количество граммов вещества, химически равноценное одному грамм- атому водорода в данной реакции. Грамм-эквивалент отдельных элементов находят делением величины атомной массы в граммах на его валентность. Грамм-эквивалент кислот равен их молекулярной массе в граммах, деленной на количество атомов водорода, способных взаимодействовать со щелочью (основность кислот), например, грамм-эквивалент НС1 и HN03 равен их молекулярной массе в граммах; а грамм-эквивалент H2S04 и Н3Р04 равен молекулярной массе, деленной соответственно на 2 и на 3. Грамм-эквивалент гидроксидов равен их молекулярной массе в граммах, деленной на число участвующих в реакции ОН~-ионов, например, грамм-эквивалент Ва(ОН)2 равен молекулярной массе этого гидроксида, деленной на 2, а А1(ОН)з — на 3. Для нахождения грамм-эквивалента вещества окислителей или восстановителей молекулярную массу (в граммах) делят на число электронов, получаемых или отдаваемых одной молекулой (см. прилож. 3)];
молярность (М) — число грамм-молекул вещества, растворенного в 1 л раствора; [грамм-молекулярная масса (г-моль) — количество граммов вещества, равное его молекулярной массе. Например, г-моль H2S04 —98,08 г, КОН —56,10 г, Са(ОН)2 — 74,102, Na2S04 — 142,05];
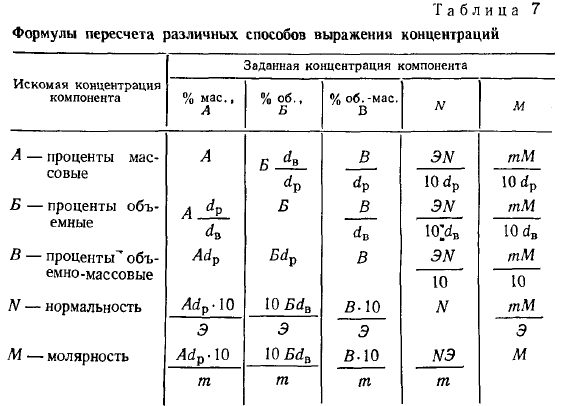
Условные обозначения: dp— плотность раствора; dв— плотность растворенного вещества; Э — грамм-эквивалентная масса растворенного вещества; m — грамм-молекулярная масса растворенного вещества.
Титр (Т)—число граммов вещества в 1 мл раствора.
Формулы для перехода от одного способа выражения концентрации к другому приведены в табл. 7.
Нормальные растворы содержат 1 г-экв вещества в 1 л. Соответственно растворы, содержащие 0,1 или 0,01 г-экв, называют деци- или сантинормальными. Растворы одинаковой нормальности реагируют в равных объемах. Если нормальность взаимодействующих растворов различна, то раствора с большей нормальностью на титрование расходуется в соответствующее число раз меньше (по объему). При этом произведение объема раствора, затрачиваемого на титрование, на его нормальность остается постоянной величиной для обоих реагирующих веществ, т. е. N1V1=N2V2.
Растворы с точно определенной концентрацией называются титрованными. Применяют их для количественного определения веществ объемными методами. Концентрацию титрованных растворов обычно выражают числом грамм-эквивалентов вещества в 1 л раствора.

