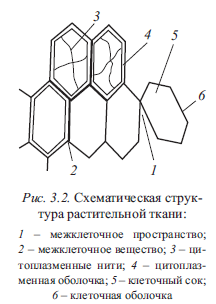
Клетки могут прилегать друг к другу не по всему периметру, образуя пустоты, межклеточные пространства, заполненные воздухом (рис. 3.2).
В зрелой клетке вакуоль достаточно увеличена - масса клеточного сока достигает 40-90 %. Под давлением клеточного сока цитоплазма свободно прилегает к наружной оболочке в виде тонкого слоя - цитоплазменной мембраны (ЦПМ) и образует как бы вторую, внутреннюю оболочку клетки.
Носительницей жизни клетки является цитоплазменная оболочка, состоящая в основном из белковых веществ и некоторого количества жироподобных веществ, называемых липоидами. Когда говорят, что клетка дышит, питается и размножается, это означает, что дышит, питается и размножается цитоплазма.
Особое значение для жизни клетки, а также для технологии ряда пищевых производств имеет структура цитоплазменной мембраны. Отверстия в ней настолько малы, что через них могут проходить молекулы небольших размеров, например молекулы воды. Более же крупные молекулы, например сахара и соли, через поры цитоплазмы пройти не могут. Таким образом, цитоплазменная оболочка проницаема для воды и непроницаема для растворенных веществ. Принято говорить, что она полупроницаема. Полупроницаемость цитоплазменной оболочки осложняет протекание ряда процессов в пищевых производствах и должна приниматься во внимание при построении технологического процесса.
Представим себе, что в стакан налили некоторое количество крепкого раствора сахара (60 %-ного), а затем осторожно прилили равное количество слабого раствора сахара (например, 10 %-ного). В соответствии с законом диффузии молекулы сахара будут перемещаться из слоя с большей концентрацией в слой с меньшей концентрацией, пока концентрация сахара не уравняется (рис. 3.3, а). Но если поместить в стакан с 60 %-ным раствором сахара плодовую клетку (рис. 3.3, б), в соке которой содержится 10 % сахара, то молекулы сахара не перемещаются из крепкого раствора внутрь клетки, так как цитоплазменная оболочка клетки непроницаема для молекул сахара.
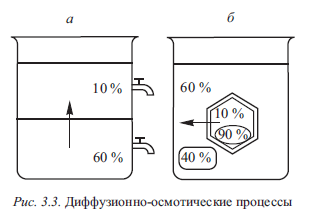
Диффузия осуществляется в отношении того вещества, для которого цитоплазменная мембрана проницаема - т.е. для воды. В соответствии с законом диффузии вода будет перемещаться от места с большей ее концентрацией к месту с меньшей концентрацией, т.е. из клетки наружу, поскольку концентрация воды в клетке 90 %, а в сахарном растворе - 40 %.
Выравнивание концентраций происходит за счет перемещения молекул растворителя, а не растворенного вещества. При этом клеточный сок будет сгущаться, а наружный сироп разбавляться. Такая диффузия, осложненная наличием полупроницаемой перегородки, называется осмосом. В данном случае получается, что крепкий сахарный раствор будет осмотическим путем выкачивать воду из клетки.
По мере осмотического отсасывания из клетки воды содержимое «цитоплазменного мешочка» уменьшается (рис. 3.4). Цитоплазма начинает отслаиваться от клеточной оболочки сначала по углам клетки, а потом по всему периметру. Чем крепче наружный раствор, тем большее количество влаги будет отсасываться из клетки, тем больше будет сжиматься цитоплазма. Этот процесс «съеживания» цитоплазмы называется плазмолизом.
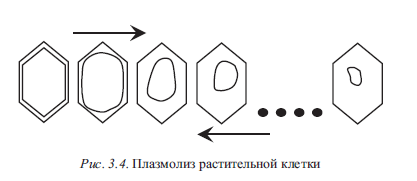
В плазмолизованном состоянии клетка является нежизнедеятельной. Она не погибает, но нормальные ее функции приостанавливаются.
Все сказанное о растительной клетке можно полностью отнести к микробной клетке. Создав в пищевом продукте высокую концентрацию сахара или соли, можно вызвать плазмолиз микробных клеток и тем самым предохранить продукты от бактериальной порчи.
Если поместить плазмолизованную клетку в чистую воду, то процесс пойдет в обратном направлении. Клетка будет всасывать воду, а цитоплазменный мешочек будет увеличиваться до тех пор, пока плотно не прижмется к наружной клеточной оболочке. Последняя является ограниченно растяжимой, и при наступлении предела ее растяжения поступление воды в клетку прекратится, а сама она будет находиться в напряженном состоянии, называемом тургор. В клетке возникает давление, которое по роду вызвавшего его процесса называется осмотическим.
Так как поведение веществ в растворенном состоянии во многом подчиняется газовым законам, то и осмотическое давление р можно рассчитать по характеристическому уравнению для газов:
pV=RT,
где р - давление, кПа; V - объем раствора данной концентрации, в котором растворен 1 граммоль данного вещества, л; R - газовая постоянная [8,314 -10 3 Дж/(кмоль-К)]; Т - температура, °К,
или
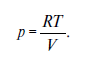
Например, требуется рассчитать осмотическое давление, которое может вызвать 4 %-ный раствор сахарозы при температуре 15 °С.
В первую очередь требуется рассчитать V- количество литров данного 4 %-ного раствора сахара, в котором растворен 1 гмоль этого вещества. 1 гмоль сахарозы C12H22Ou составляет 342 г. Можно с некоторой погрешностью принять, что 4 %-ный раствор сахара - это такой раствор, в 1 л которого находится 40 г сахара. Тогда искомая величина V находится из пропорции
1 л - 40 г
V л - 342 г,
отсюда V = 342/40 = 8,55 л; p = 8,3 1 4-103-(273+15)/8,55~300кПа (~3 атм).
Если учесть, что раствор сахара был весьма слабым (4 %), то полученное давление следует оценить как высокое. В практике пищевых производств приходится иметь дело с гораздо более концентрированными растворами, порядка 60-70 %, осмотическое давление, которое они могут вызвать, измеряется десятками атмосфер.
Однако следует понимать, что в самом растворе сахара никакого осмотического давления нет, каким бы крепким он ни был, а есть только осмотический потенциал, т.е. возможность возникновения давления, если такой раствор войдет в соприкосновение с полупроницаемой системой, например, если в него погрузить плод или если в него попадут микробные клетки. Тогда на границе раствор - полупроницаемая мембрана осмотический потенциал будет реализован и возникнет не потенциальное, а реальное давление, величину которого можно не только рассчитать, но и измерить.
В рассмотренном случае величина V = 8,55 л получена как частное от деления 342 (молекулярная масса сахара М) на 40 г (массовая концентрация его в данном растворе G). Таким образом, в общем виде V = M/G. При подстановке этого выражения в формулу для расчета осмотического давления получим
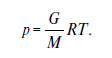
Отсюда видно, что осмотическое давление прямо пропорционально массовой концентрации данного вещества и обратно пропорционально его молекулярной массе. Следовательно, для создания равного осмотического давления раствор сахара должен иметь большую концентрацию, чем раствор соли. При одной и той же массовой концентрации осмотическое давление будет больше для тех веществ, у которых меньше молекулярная масса. Например, осмотический потенциал 4 %-ного раствора поваренной соли примерно в 6 раз больше, чем осмотический потенциал 4 %-ного раствора сахарозы.
Осмотические процессы учитываются при организации технологических процессов. Примером может служить приготовление варенья из небланшированных ягод черноплодной рябины, в результате чего получают сморщенные сухие ягоды и количество сиропа, превышающее оговоренные стандартом 50 %.
Осмотические процессы сами составляют предмет нового технологического процесса, получившего название обратный осмос. Сущность его заключается в следующем. В сосуд, разделенный вертикальной перегородкой (рис. 3.5, а), изготовленной из полупроницаемого материала (пленки из синтетических полимеров), наливают в одну половину фруктовый сок, содержащий 10 % сахара, а в другую - чистую воду. Вода в силу осмотического давления будет всасываться в ту половину, где находится сок, и уровень жидкости в этой половине сосуда повысится.
Если теперь приложить к той части сосуда, где находится сок, давление (рис. 3.5, б), большее, чем то, под которым вода осмотически прокачивается в процессе прямого осмоса, то вода потечет в обратном направлении, т.е. в ту половину, где находится чистая вода. Это и будет так называемый обратный осмос. При этом сок сгущается, концентрация сахара в нем увеличивается. При таком способе концентрирования фруктовых соков затрачивается меньше энергии и повышается качество продукции.
Полупроницаемость цитоплазменной мембраны связана с ее физико-химической структурой и с той ролью, которую она играет в физиологии растений.
По химическому составу цитоплазма состоит из белковых веществ и липоидов. В ней различают три слоя (рис. 3.6).
Липоиды, являющиеся поверхностно-активными веществами, скапливаются в поверхностных слоях цитоплазменной мембраны, образуя строго ориентированные и плотно прилегающие друг к другу моно- и бимолекулярные ряды. При этом в наружном (верхнем) слое, называемом плазмалеммой, молекулы липоидов обращены своим гидрофобным концом наружу, к воздуxy, который является гидрофобным веществом. Получается мономолекулярный ряд из выстроенных в строгом порядке и прилегающих друг к другу молекул (палочки с кружочками на рис. 3.6). Через зазоры-капилляры из липоидов между молекулами не могут «пробраться» крупные молекулы растворенных в соке веществ, но могут проходить молекулы воды.
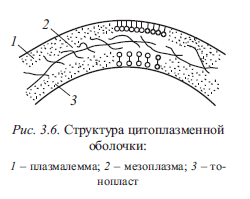
Еще более непроницаемым является нижний, внутренний слой ЦПМ, называемый тонопластом. Он также образован молекулами липоидов, но ориентированными гидрофильными концами наружного ряда к клеточному соку (водному раствору запасных веществ клетки), а гидрофобными концами к гидрофобным концам молекул второго, примыкающего к наружному, ряда поверхностно-активных веществ. Получается малопроницаемый двойной липоидный слой. Средний слой, называемый мезоплазмой, состоит из беспорядочно расположенных и находящихся в хаотическом движении молекул белковых веществ. Этот слой является проницаемым.

