Основная цель экспериментов по клонированию генов, которые предполагается использовать в биотехнологии, – подбор условий для эффективной экспрессии в нужном организме-хозяине. К сожалению, сам факт встраивания того или иного гена в клонирующий вектор еще не означает, что этот ген будет экспрессирован. В то же время, чтобы получение коммерческого продукта было экономически оправданным, уровень его синтеза должен быть достаточно высоким. Для достижения эффективной экспрессии уже сконструировано много специфических векторов; для этого проводились манипуляции с целым рядом генетических элементов, контролирующих процессы транскрипции и трансляции, стабильность белков, секрецию продуктов из хозяйской клетки и т. д. Среди молекулярно-биологических свойств систем экспрессии наиболее важны следующие:
1) тип промотора и терминатора транскрипции;
2) прочность связывания мРНК с рибосомой;
3) число копий клонированного гена и его локализация (в плазмиде или в хромосоме хозяйской клетки);
4) конечная локализация синтезируемого продукта;
5) эффективность трансляции в организме хозяина;
6) стабильность продукта в хозяйской клетке.
Никакой универсальной стратегии оптимизации экспрессии клонированных генов не существует. Большинство таких генов имеют уникальные молекулярные свойства, и оптимальные системы экспрессии для каждого из них приходится подбирать всякий раз заново. Эффективность экспрессии любого чужеродного гена зависит также от его родства с организмом-хозяином. Несмотря на то, что многие представители как протак эукариотических организмов способны к экспрессии чужеродных генов, для получения важных в коммерческом отношении продуктов с помощью технологии рекомбинантных ДНК используют в основном Escherichia coli. Это связано прежде всего с тем, что генетические, молекулярно-биологические, биохимические и физиологические свойства этого микроорганизма детально изучены. Кроме того, это наиболее дешевый и быстрый способ получения многих белков. Но для экспрессии некоторых клонированных генов используются и другие организмы-хозяева: В. subtilis, дрожжи, животные, растения и т. д., хотя стратегии, разработанные для Е. coli-систем, в принципе применимы и в этих случаях.
ЭКСПРЕССИЯ ГЕНОВ ПРИ УЧАСТИИ
СИЛЬНЫХ РЕГУЛИРУЕМЫХ ПРОМОТОРОВ
Для эффективной экспрессии любого гена совершенно необходимо наличие сильного регулируемого промотора, расположенного перед данным геном. Такой промотор имеет высокое сродство к РНК-полимеразе, поэтому прилегающие к нему последовательности эффективно (с высокой частотой) транскрибируются. Регулируемость промотора позволяет клетке (и исследователю) осуществлять строгий контроль транскрипции. Для экспрессии клонированных генов широко используется промотор хорошо изученного lac (лактозного)-оперона Е. coli. Однако есть и другие промоторы, обладающие полезными для контроля экспрессии свойствами. Для их идентификации перед так называемым геном-репортером, кодирующим легко регистрируемый продукт, но лишенным промотора, встраивают случайные фрагменты ДНК (рис. 6.1). Если в результате такой вставки ген-репортер эффективно экспрессируется, то делают вывод, что клонированный фрагмент содержит функциональный промотор. Большинство генов-репортеров кодируют либо продукты, обусловливающие устойчивость к антибиотикам, либо фермент, который идентифицируется с помощью достаточно простого колориметрического теста.
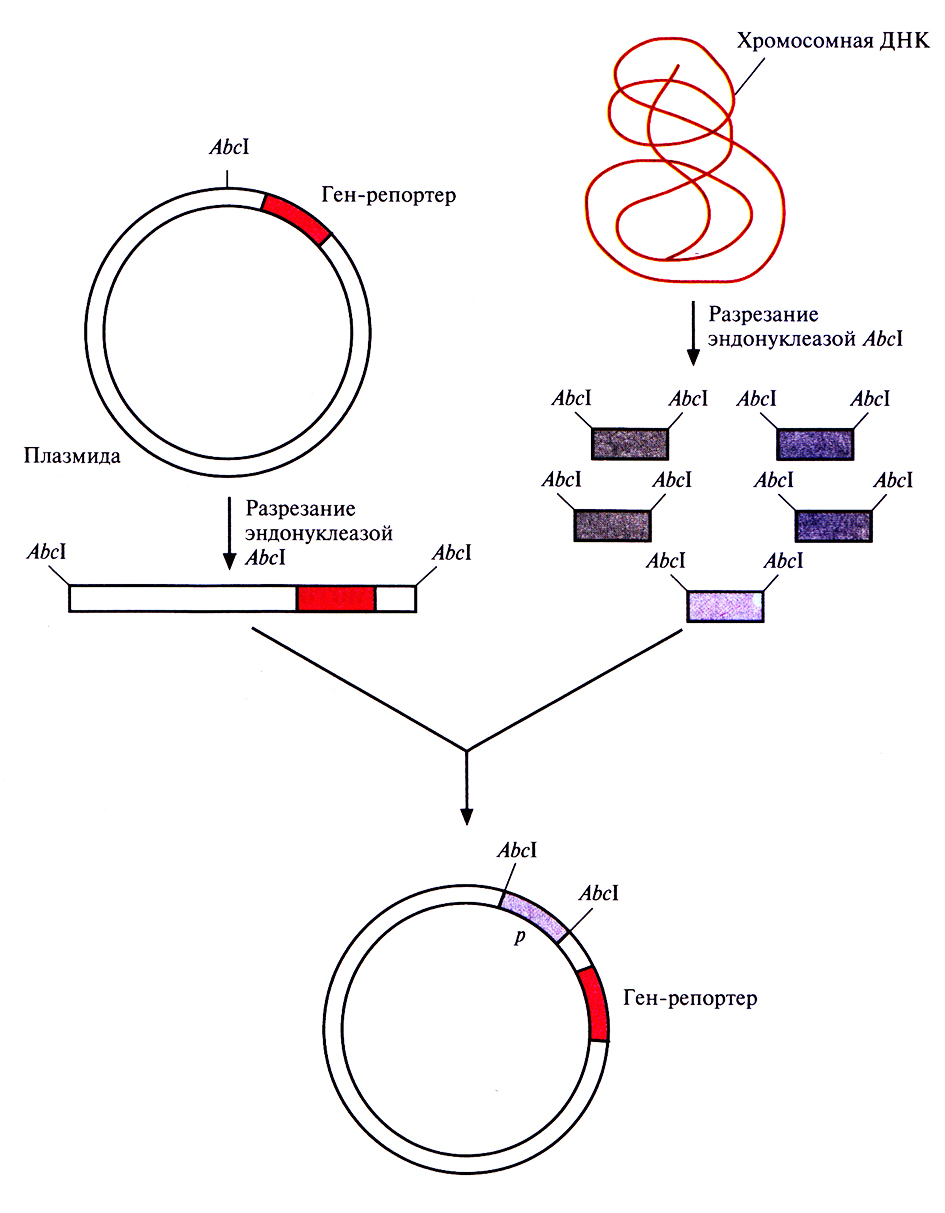
Рис. 6.1. Идентификация сильных регулируемых промоторов. В плазмиду встраивают ген-репортер без промотора. Хромосомную ДНК разрезают рестрицируюшей эндонуклеазой AbcI и встраивают фрагменты в плазмиду. Если ген-репортер эффективно экспрессируется, значит, клонированный фрагмент содержит функциональный промотор.
Может показаться, что наиболее подходящим способом оптимизации экспрессии клонированного гена является встраивание его в плазмиду так, чтобы он находился под контролем постоянно функционирующего сильного промотора. Однако непрерывная экспрессия чужеродного гена может оказаться гибельной для клетки-хозяина, поскольку приводит к истощению ее энергетических ресурсов и нарушению метаболизма. Кроме того, плазмиды, несущие постоянно (конститутивно) экспрессирующийся ген, нередко утрачиваются после нескольких клеточных циклов, поскольку не содержащие их клетки растут быстрее и со временем становятся в культуре преобладающими. Нестабильность плазмид – это основная проблема, мешающая получению продукта гена, локализованного в плазмиде, в промышленных масштабах. Для ее решения нужно научиться контролировать экспрессию таким образом, чтобы клонированный ген экспрессировался только в определенной фазе клеточного цикла и только в течение определенного времени, а для этого нужно использовать сильные регулируемые промоторы. Плазмиды, сконструированные для этих целей, называются экспрессирующими векторами.
Регулируемые промоторы
Наиболее широко используются следующие сильные регулируемые промоторы: промоторы lac- и trp-оперонов Е. coir, специально сконструированный tac-промотор, включающий – 10-область tас-промотора и –35-область trp-промотора (участки, находящиеся на расстоянии 10 и 35 п. н. до сайта инициации транскрипции); левый, или pL, промотор бактериофага А; промотор гена 10 бактериофага Т7. С каждым из них связываются соответствующие репрессоры, которые опосредуют включение и выключение транскрипции специфических генов. Кроме того, каждый из этих промоторов узнается холоферментом РНК-полимеразой Е. coli, в который входит основной сигма-фактор, присутствующий в клетке в значительно больших количествах, чем другие, минорные сигма-факторы. Благодаря этому транскрипция не останавливается по причине недостатка свободных сигма-факторов.
В отсутствие лактозы в среде lac-промотор Е. coli находится в репрессированном состоянии, т. е. он выключен белком-репрессором, блокирующим транскрипцию lac-оперона. Индукция, или включение lас-оперона происходит при добавлении в среду лактозы или изопропил-β-D-тиогалактопиранозида (ИПТГ). Оба этих соединения предотвращают связывание репрессора с lас-оператором, и транскрипция возобновляется.
Транскрипция, контролируемая с-промотором, регулируется также с помощью белка – активатора катаболизма (САР) (рис. 6.2). При связывании САР с промотором повышается сродство последнего к РНК-полимеразе и усиливается транскрипция примыкающих к нему генов. В свою очередь сродство САР к промотору повышается при его связывании с циклическим AMP (сАМР), уровень которого повышается при снижении концентрации глюкозы в среде. Таким образом, если репрессор не связан с оператором, то в присутствии индуктора при повышении внутриклеточной концентрации сАМР может произойти усиление транскрипции генов, регулируемых lас-промотором.
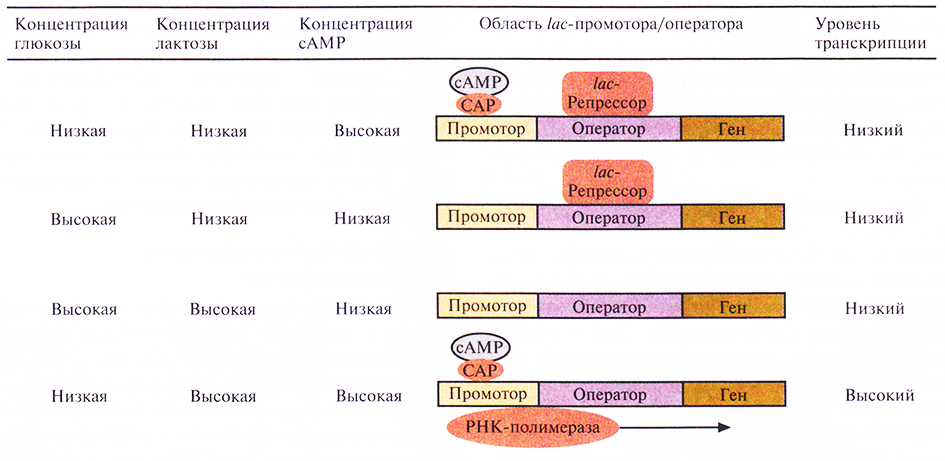
Рис. 6.2. Влияние глюкозы, лактозы и сАМР на транскрипцию, регулируемую lac-промотором Е. coli. Стрелка указывает направление транскрипции. (По данным работы Abelesetal., 1992, Biochemistry, p. 383, Jones and Barlett Publishers, Boston, Mass.)
На самом деле в плазмидных экспрессирующих векторах используется один из вариантов lac-промотора – lacUV5 с измененной – 10-последовательностью, более сильный, чем lac-промотор дикого типа. Транскрипция с промотора tac также подавляется /ас-репрессором и возобновляется при добавлении в среду лактозы или ИПТГ.
Промотор trp выключается под действием комплекса триптофан – trp-репрессор, который связывается с trp-оператором и предотвращает транскрипцию trp-оперона. Активация (включение) trp-промотора происходит либо при удалении из среды триптофана, либо при добавлении 3-индолилакриловой кислоты.
Работа промотора pL регулируется репрессорным белком сl бактериофага λ. На самом деле для регуляции транскрипции с pL-промотора обычно используется термочувствительная мутантная форма репрессора сl – белок cl857. Клетки, синтезирующие этот репрессор, сначала выращивают при температуре 28–30 °С; в этих условиях репрессор блокирует транскрипцию с pL-промотора. Когда культура достигает нужной фазы (как правило, середины log-фазы), температуру повышают до 42 °С. при которой cl857-peпрессор инактивируется и начинается транскрипция.
Для транскрипции с промотора бактериофага Т7 нужна соответствующая РНК-полимераза. Чтобы можно было использовать этот промотор, ген РНК-полимеразы фага Т7 встраивают в хромосому Е. coli в составе профага λ, поместив его под контроль lас-промотора. Затем клетки трансформируют плазмидой, содержащей ген-мишень под контролем Т7-промотора, и добавляют в среду ИПТГ. В этих условиях происходит индукция гена РНК-полимеразы Т7, синтезируется РНК-полимераза и происходят транскрипция и трансляция клонированного гена. Часто между временем индукции гена РНК-полимеразы Т7 и началом транскрипции гена-мишени проходит более часа. Для транскрипции с сильного Т7-промотора создана целая серия плазмид, получивших название рЕТ-векторов.
Эффективность инактивации белка-репрессора и соответственно активации транскрипции зависит от соотношения между числом молекул репрессора и числом копий промотора. Если концентрация репрессора слишком велика, то транскрипция не инициируется, и наоборот, если молекул репрессора очень мало (даже при том, что их больше, чем копий промотора), то транскрипция может идти и в отсутствие индукции. Про такие промоторы говорят, что они «текут». Чтобы осуществлять строгий контроль таких регулируемых систем, разработаны разные стратегии. Например, ген репрессора и соответствующий промотор помешают в две разные плазмиды, присутствующие в клетке в разном числе копий; это позволяет поддерживать нужное соотношение между числом молекул репрессора и числом копий промотора. Обычно ген репрессора находится в малокопийной плазмиде, число ее копий в клетке не превышает 8, а промотор – в мультикопийной плазмиде с 30–100 копиями на клетку. Ген репрессора может быть локализован и в хромосомной ДНК, находясь в ней в единственном числе, что позволяет поддерживать низкую концентрацию репрессора. В системах, использующих lас-промотор, можно получить lас-репрессор в значительно большем количестве, если заменить lacJ-ген его мутантной формой laclq, что приводит к уменьшению «протекания» промотора, т. е. к снижению уровня транскрипции клонированного гена без индуктора.
Получение больших количеств белковых продуктов
Для получения больших количеств чужеродных белков с помощью рекомбинантных штаммов Е. coli была сконструирована плазмида pPLc2833. Она содержит сильный промотор, селективный маркерный ген и короткий участок с несколькими уникальными сайтами для рестрицирующих ферментов (полилинкер), следующий непосредственно за промотором. Эффективность этого экспрессируюшего вектора в осуществлении синтеза чужеродных белков в Е. coli можно еще больше повысить, заменив сайт инициации репликации плазмиды pPLc2833 аналогичным сайтом плазмиды pKN402. Это приводит к увеличению числа копий модифицированной плазмиды в 5–10 раз при температуре 42 °С (табл. 6.1). Полученная таким образом плазмида рСРЗ содержит pL-промотор и ген β-лактамазы (ген устойчивости к ампициллину) из pPLc2833, а сайт инициации репликации – из pKN402 (рис. 6.3). Несущие ее клетки сначала выращивают при температуре 28 °С, а затем – при 42 °С. При пониженной температуре ген сl-репрессора, интегрированный в ДНК Е. coli, экспрессируется, pL-промотор не функционирует и образуется обычное число копий плазмиды (табл. 6.1). При повышении температуры cl-penpecop инактивируется, pL-промотор переходит в активное состояние, и число копий плазмиды увеличивается. Все это и делает плазмиду рСРЗ эффективным экспрессирующим вектором. Когда ген ДНК-лигазы Т4 был встроен в полилинкер рСРЗ, то выход его продукта составил примерно 20% от общего количества белка, синтезируемого Е. coli при 42 °С. При этом на долю собственных, наиболее активно синтезируемых белков Е. coli, например фактора элонгации EF-Тu, приходится примерно 2%.
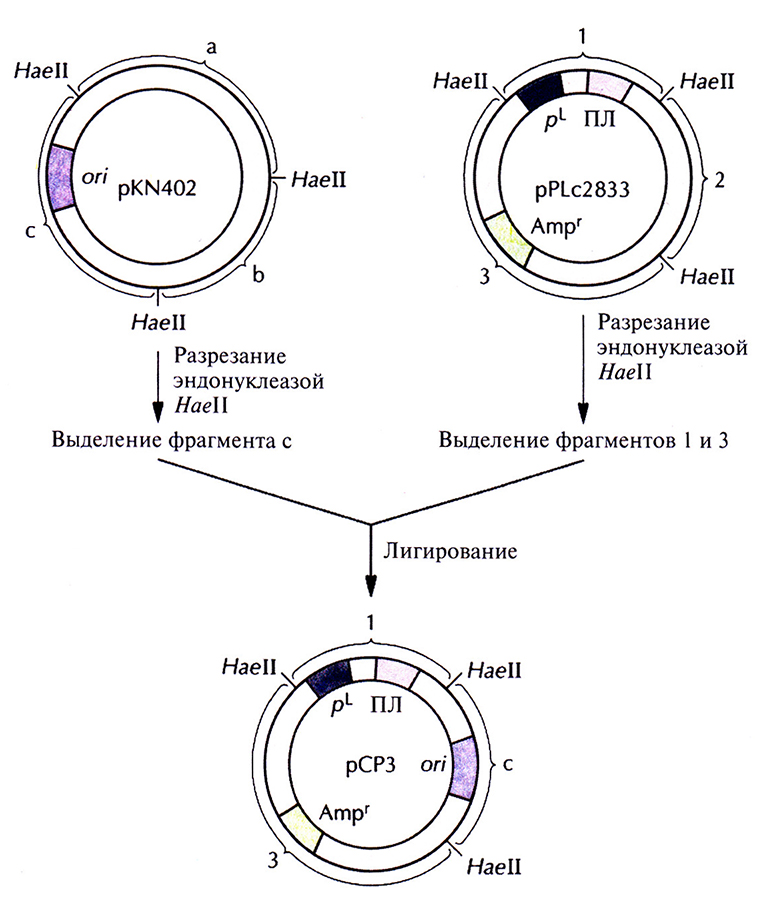
Рис. 6.3. Создание плазмиды рСРЗ. Из плазмиды pKN402 с помощью рестрицируюшей эндонуклеазы HaeII вырезают фрагмент с, содержащий температурочувствительный сайт инициации репликации (оп), и сшивают его с Haellфрагментами 1 и 3 плазмиды pPLc2833 Фрагмент I содержит pL-промотор и полилинкер (ПЛ), а фрагмент 3 – селективный маркерный ген устойчивости к ампициллину (Ampr).
Таблица 6.1. Зависимость числа копий трех плазмидных
экспрессирующих векторов от температуры

Крупномасштабные системы
При культивировании в небольших объемах (от 1 до 5 л) индукцию экспрессии осуществляют либо изменением температуры, либо добавлением химического индуктора. Однако в опытных установках (20–100 л) и в промышленных биореакторах (>200 л) температуру нельзя изменить мгновенно, для этого требуется время от 30 до 60 мин; кроме того, на подъем температуры нужна энергия. И время, и энергия стоят дорого. Столь же дорого обходится и применение химического индуктора, например ИПТГ. Все это может сделать процесс неэкономичным. Для преодоления некоторых проблем, связанных с использованием pL-npомотоpa для крупномасштабного производства белковых продуктов, была разработана двухплазмидная система. Ген репрессора сl поместили под контроль trp-промотора и включили в малокопийную плазмиду (рис. 6.4), что обеспечило невысокий уровень синтеза репрессора. Вторая плазмида содержала клонированный ген, находящийся под контролем pL-промотора. Как видно из рис. 6.4, А, в отсутствие триптофана включается trp-промотор и синтезируется репрессор cl, выключающий pL-промотор. И наоборот, как видно из рис. 6.4, Б. при наличии триптофана trp-промотор выключается, репрессор не синтезируется, а pL-промотор активно работает.
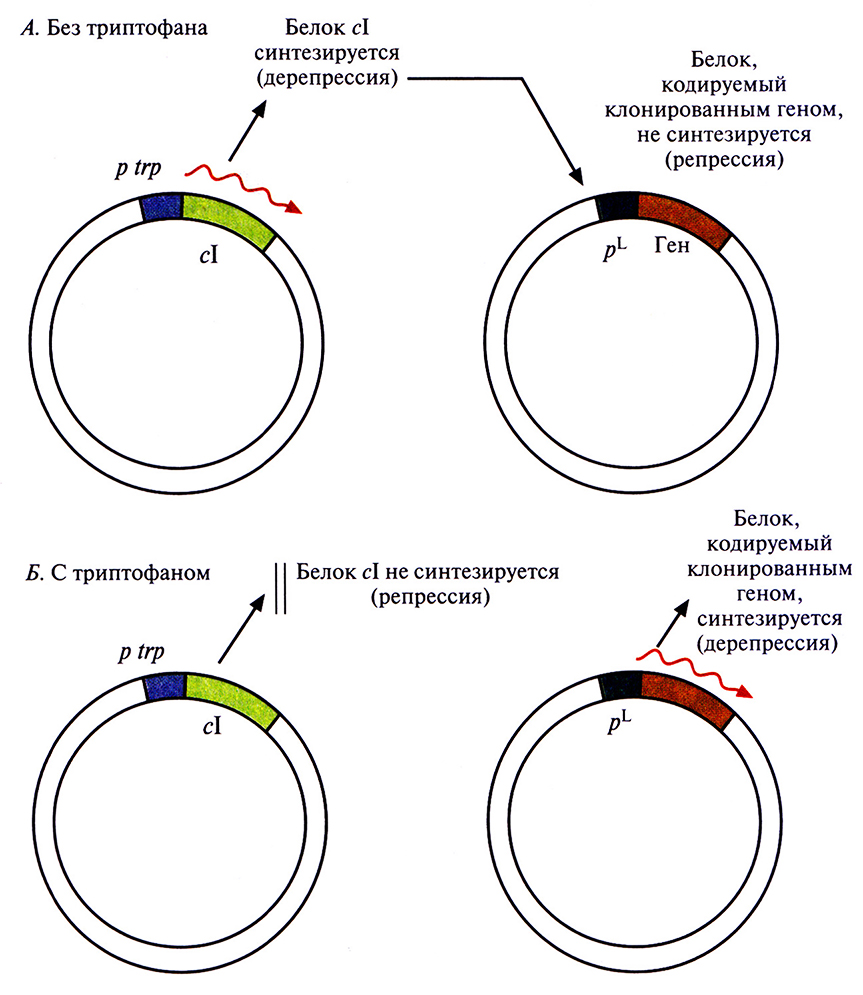
Рис. 6.4. Двухплазмидная система, позволяющая контролировать работу pL-промотора фага X путем регуляции синтеза cl-peпрессора с помощью триптофана. Ген репрессора cl вместе с триптофановым промотором (р trp) находятся в одной плазмиде, a pL-промотор и клонированный ген – в другой. Стрелками указано направление транскрипции. А. В отсутствие триптофана в среде ген cl транскрибируется и транслируется, репрессор cl связывается с pL-промотором и блокирует транскрипцию клонированного гена. Б. В присутствии триптофана ген cl репрессируется, его продукт не синтезируется, поэтому клонированный ген транскрибируется и транслируется.
Культуры с такими двухплазмидными системами можно выращивать на недорогих средах на основе гидролизатов мелассы или казеина, содержащих незначительное количество свободного триптофана, и индуцировать экспрессию клонированного гена добавлением в среду триптона. Последний содержит свободный триптофан в количестве, достаточном для эффективной индукции транскрипции. Пробные испытания этой системы показали, что на долю продуктов клонированных генов β-лактамазы и цитратсинтазы после индукции транскрипции добавлением триптона приходится соответственно 21 и 24% от общего количества синтезируемого белка. Таким образом, двухплазмидные системы позволяют получать белковые продукты с помощью рекомбинантных микроорганизмов в промышленных масштабах и относительно недорого.
Использование для экспрессии других микроорганизмов
Е. coli– не единственный микроорганизм, который используется для синтеза чужеродных белков. К сожалению, генетические и молекулярно-биологические свойства большинства других микроорганизмов изучены не так хорошо. Кроме того, нет ни одного вектора или даже промоторно-репрессорной системы, которая обеспечивала бы оптимальный уровень экспрессии в клетках всех или хотя бы только грамотрицательных бактерий. К счастью, многие стратегии, разработанные для Е. coli, пригодны и для множества других микроорганизмов, что позволило проверить различные промоторы на их способность обеспечивать транскрипцию в других грамотрицательных бактериях. Так, в одном из исследований был сконструирован набор плазмидных экспрессирующих векторов, содержащих промоторы lac, tac, Nm (гена устойчивости к неомицину) и S1 (гена рибосомного белка SI Rhisobium meliloti), и определен уровень экспрессии гена β-лактамазы под контролем каждого из них (табл. 6.2). Обнаружилось, что:
1) указанные промоторы проявляют ту или иную активность во всех использованных бактериальных системах;
2) промотор tac наиболее активен в Е. coli и гораздо менее – в других бактериях;
3) Nm – второй по активности промотор в Е. coli и самый активный в других бактериях. Промоторные участки у всех грамотрицательных бактерий имеют сходную нуклеотидную последовательность, однако это не означает, что самым эффективным промотором для того или иного организма будет тот, который наиболее эффективен в Е. coli. Тем не менее Е. со//-промоторы могут оказаться вполне приемлемыми для регуляции экспрессии клонированных генов и в других грамотрицательных бактериях.
Таблица 6.2. Активность β-галактозидазы в грамотрицательных бактериях,
несущих плазмидный вектор с геном lacZ E.coli и гетерологичным промотором1)

Попытки создания «универсального» экспрессирующего вектора для грамотрицательных бактерий были весьма многочисленными. В конце концов была выбрана следующая стратегия. Фрагмент ДНК размером 70 п. н., происходящий от одного из концевых инвертированных повторов в транспозоне 5 (Тп5), встроили вместе с соответствующим промотором в полилинкер малокопийной плазмиды pRK290 с широким спектром хозяев и получили плазмиду pAVIO (рис. 6.5). Клонированный сегмент ДНК из Тп5 содержал два независимых, но перекрывающихся промотора, каждый из которых необходим для транскрипции одного из ключевых Тп5-генов. Поскольку Тn5 эффективно экспрессируется в разных бактериях, его промоторы можно использовать для транскрипции различных генов. Чтобы проверить это, в полилинкер сразу за клонированными промоторами Тn5 встроили гены хлорамфеникол-ацетилтрансферазы и β-галактозидазы. Их эффективная экспрессия происходила в клетках Alcaligenes sp., Е. coli, Enterobacter cloacae, Klebsiella pneumoniae, Pseudomonas stutzeri, Pseudomonas fluorescens и Serratia marcescens. Таким образом, есть реальная возможность использовать Тn5-промоторы для инициации транскрипции чужеродных генов в клетках различных бактерий.
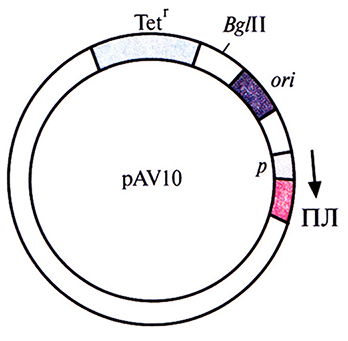
Рис. 6.5. Клонирующий вектор pAV10 (без соблюдения масштаба). Показано положение гена устойчивости к тетрациклину (Tetr), сайта рестрикции для эндонуклеазы Bglll, сайта инициации репликации (ori), промотора (р) и полилинкера (ПЛ). Встраивание клонированного гена в полилинкер ставит его под контроль промотора Тn5 (p). Стрелка указывает направление транскрипции.
ХИМЕРНЫЕ БЕЛКИ
Очень часто чужеродные белки, особенно небольшие, обнаруживаются в гетерологичных хозяйских клетках лишь в минимальных количествах. Такой кажущийся низкий уровень экспрессии кодирующих их генов во многих случаях объясняется деградацией чужеродных белков в хозяйских клетках. Один из способов решения этой проблемы состоит в ковалентном присоединении продукта клонированного гена к какому-нибудь стабильному белку клетки-хозяина. В составе подобной конструкции, получившей название «химерный белок», продукт клонированного гена оказывается защищенным от расщепления протеазами хозяйской клетки, что было показано в ходе экспериментов.
Слияние белков программируется на уровне ДНК лигированием кодирующих участков соответствующих генов. В самом простом виде векторная система слияния предусматривает включение гена-мишени иди его сегмента в кодирующий участок клонированного гена-хозяина. Очень важно, чтобы РНК, транскрибируемая с клонированного гена-мишени, имела правильную нуклеотидную последовательность, обеспечивающую образование продукта клонированного гена. Если при объединении сегментов ДНК происходит изменение рамки считывания, т. е. последовательность кодонов детерминирует укороченный или неправильный трансляционный продукт, то не сможет образоваться и функционально активная форма белка. Убедиться в правильности рамки считывания можно разными способами. Как правило, для этого необходимо знать точную нуклеотидную последовательность лигируемых фрагментов ДНК.
Расщепление химерных белков
В зависимости от предназначения белкового продукта клонированного гена он может использоваться как таковой или в составе химерного белка, причем последний вариант встречается нечасто. Например, из-за присутствия фрагмента хозяйского белка большинство химерных белков оказываются непригодными для применения в клинике, а сам продукт клонированного гена-мишени может оказаться неактивным. Кроме того, для химерных белков предусмотрена более сложная процедура тестирования, которую они должны пройти, чтобы получить разрешение к применению у соответствующих организаций. Все это заставляет искать способы удаления лишних аминокислотных последовательностей из молекулы получаемого продукта. Один из таких способов основан на присоединении белка, кодируемого геном-мишенью, к белку клетки-хозяина, содержащему короткий пептид, распознаваемый специфической протеазой небактериального происхождения. Такое присоединение тоже программируется на уровне ДНК. Олигонуклеотидные линкеры, несущие сайты для протеаз, можно пришить к клонированному гену до того, как такая конструкция будет введена в экспрессирующую векторную систему слияния. Линкером может служить, например, олигонуклеотид, кодирующий пептид Ile-Glu-Gly-Arg. После синтеза и очистки химерного белка для отделения белкового продукта, кодируемого клонированным геном, можно использовать фактор свертывания крови Xа, который является специфической протеиназойР, разрывающей пептидные связи исключительно на С-конце последовательности Ile-Glu-Gly-Arg (рис. 6.6). Более того, поскольку такой пептид встречается в природных белках довольно редко, этот подход можно использовать для отделения многих других продуктов, кодируемых клонированными генами.

Рис. 6.6. Протеолитическое расщепление химерного белка фактором свертывания крови Ха. Фактор Ха узнает аминокислотную последовательность, разделяющую два компонента химерного белка. После расщепления высвобождается функциональный белок, кодируемый клонированным геном.
Применение химерных белков
В некоторых случаях конечным продуктом, который предполагается использовать, является сам химерный белок. Например, нередко возникает необходимость в получении антител, узнающих конкретный участок белковой молекулы. Чтобы решить эту задачу, можно встроить в подходящий вектор сегмент ДНК, кодирующий белковый домен, к которому будут вырабатываться нужные антитела. Образующийся в результате химерный белок и будет служить антигеном. Антитела к стабилизирующему его белковому компоненту, происходящему от хозяйской клетки, можно удалить абсорбцией их на чистом стабилизирующем белке, и тогда останутся только антитела, связывающиеся с нужной аминокислотной последовательностью.
Один из клонирующих векторов системы слияния, сконструированных для получения специфических антител, содержит 5'-концевой сегмент гена ompF Е. coli, кодирующего один из наружных мембранных белков, и прилегающую к нему часть гена lacZ β-галактозидазы) Е. coli (рис. 6.7). Этот сегмент содержит информацию, необходимую для инициации транскрипции и трансляции химерного гена, а также для секреции химерного белка. Несмотря на то что укороченный ген lacZ лишен кодонов для первых восьми аминокислот, кодируемый им белок сохраняет ферментативную активность. В такой форме β-галактозидаза способна функционировать независимо от того, какие пептиды присоединены к ее N-концу. Ген lacZ встроен в вектор таким образом, что он попадает «не в ногу» с рамкой считывания лидерной последовательности ompF, поэтому активная β-галактозидаза не образуется. Однако если рамка считывания какого-либо клонированного фрагмента ДНК согласуется с таковой для генов amp F и LacZ, то образуется трехкомпонентный химерный белок, состоящий из OmpF-фрагмента, белка, кодируемого клонированным геном, и функционально активной С-концевой части β-галактозидазы. Он может использоваться как антиген для выработки антител, дающих перекрестную реакцию с белком клонированного гена, или как инструмент для получения небольших фрагментов специфических белков.
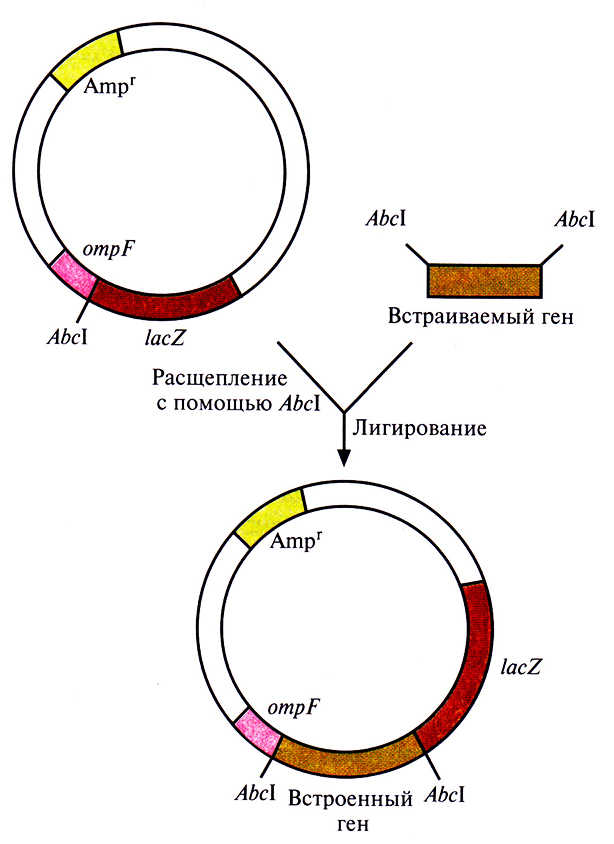
Рис. 6.7. Клонирующий вектор системы слияния. Он содержит ген устойчивости к ампициллину (Ampr) в качестве селективного маркера, 5'-концевой сегмент гена ompF, кодирующий N-конец наружного мембранного белка, сайт для рестрицирующей эндонуклеазы Abcl и укороченный ген β-галактозидазы (lacZ). Ген, который хотят клонировать, встраивают в АЬсl-сайт. После транскрипции и трансляции этой генетической конструкции образуется трехкомпонентный химерный белок.
Химерные белки используются не только для стабилизации полипептидов, но и для упрощения процедуры очистки рекомбинантных белков (табл. 6.3). Так, плазмидная конструкция Saccharomyces cerevisiae, содержащая ген человеческого интерлейкина-2 с присоединенным к нему сегментом ДНК, кодирующим маркерный пептид Asp-Tyr-Lys-Asp-Asp-Asp-Asp-Lys (он продается под названием Flag), выполняет двоякую функцию: обеспечивает стабилизацию продукта гена интерлейкина-2 и облегчает его очистку. Интерлейкин-2 – это биологический фактор, стимулирующий рост Т-клеток и синтез В-клеточных антител. Химерный белок, образующийся после экспрессии этой генетической конструкции в дрожжевых клетках, может быть очищен за один прием с помощью иммуноаффинной хроматографии. Для этого моноклональные антитела к маркерному пептиду фиксируют на полипропиленовом носителе и пропускают через колонку химерный белок, который связывается с этими антителами (рис. 6.8). Маркерный пептид – небольшая молекула, на его образование расходуется лишь малая часть клеточных ресурсов. Химерный белок обладает такой же биологической активностью, что и нативный интерлейкин-2. Однако если он предназначен для применения в клинике, то маркерный пептид необходимо удалить. Таковы требования государственных служб, контролирующих использование фармацевтических препаратов. Для этого можно использовать бычью энтерокиназу.
Таблица 6.3. Очистка химерных белков, продуцируемых Е. соli1)
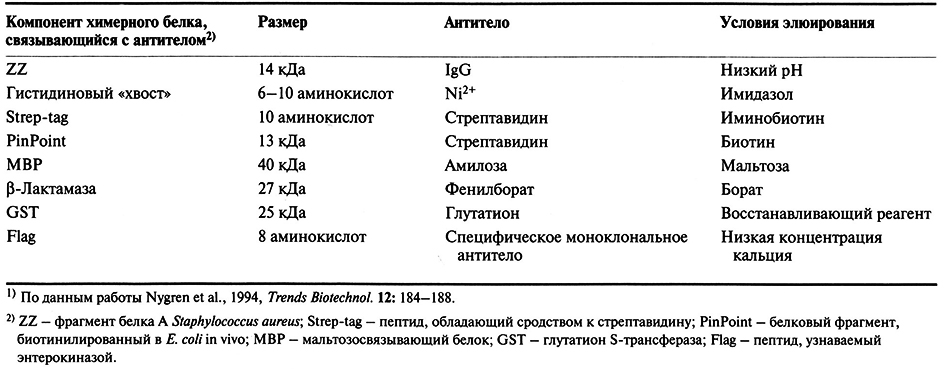
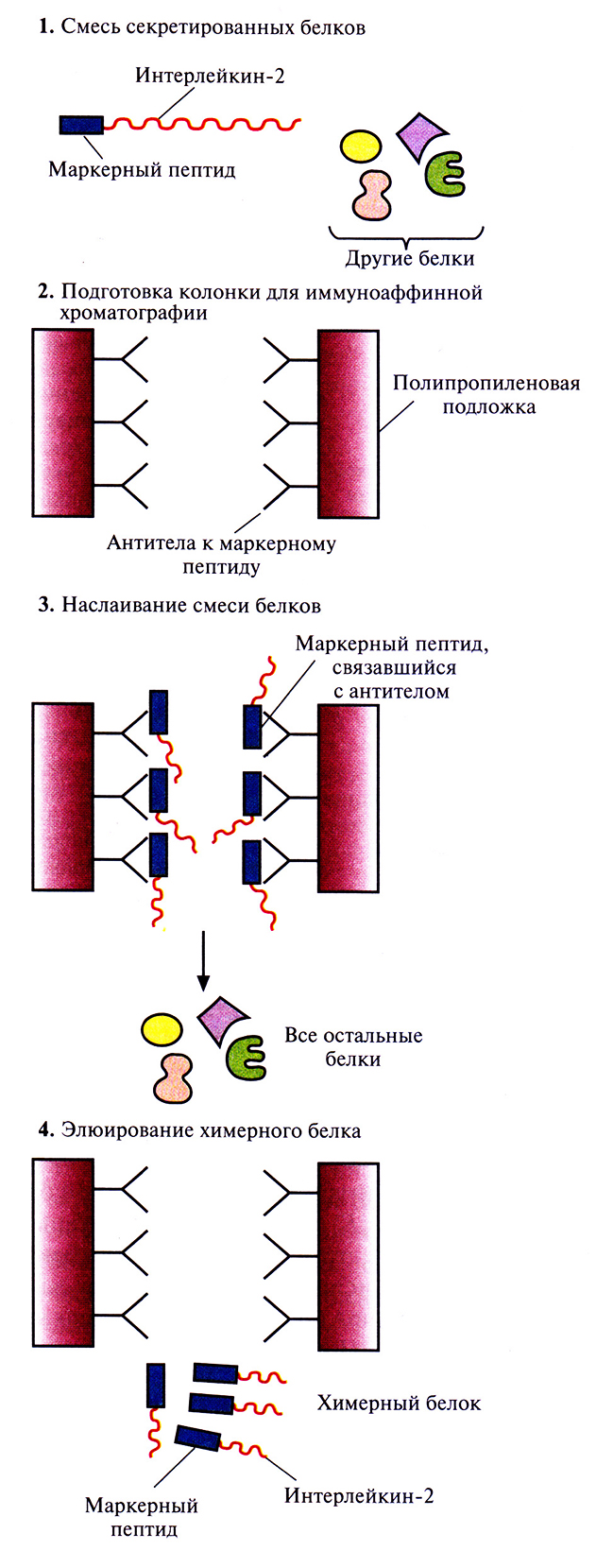
Рис. 6.8. Очистка химерного белка с помощью иммуноаффинной хроматографии. Антитела к маркерному пептиду химерного белка фиксируют на твердом носителе и пропускают через колонку химерный белок. Маркерный пептид, входящий в состав химерного белка, связывается с антителами, а все остальные белки свободно проходят через колонку. Очищенный химерный белок элюируют из колонки.
Многие белки, продуцируемые Е. coli, накапливаются в клетках в форме нерастворимых биологически неактивных телец включения. И хотя из таких структур часто удается получать в небольших количествах биологически активный белок, для этого приходится проводить продолжительную солюбилизацию. Плохая растворимость белков in vivo часто обусловливается их неправильной укладкой, и эту проблему пытались решить различными способами. Так, известно, что химерные белки, одним из компонентов которых является тиоредоксин, белок мол. массой 11,7 кДА, остаются в растворе, даже если на их долю приходится 40% суммарного клеточного белка. Имея это в виду, ген-мишень встроили в полилинкер сразу вслед за геном тиоредоксина, так чтобы оба этих гена попали под контроль pL-промотора в плазмидном векторе Е. coli (рис. 6.9). В хромосоме хозяйских клеток Е. coli, использующихся в этой системе, присутствует генетическая конструкция, детерминирующая образование репрессора cl – копия гена сl, находящаяся под транскрипционным контролем промотора trp. В отсутствие триптофана (рис. 6.9, А) репрессор образуется в количестве, достаточном для блокирования транскрипции с pL-промотора, и химерный белок не синтезируется. Когда в среду добавляют триптофан (рис. 6.9, Б), trp-промотор выключается и белок-репрессор не синтезируется, а гены химерного белка транскрибируются с плазмидного pL-промотора. Синтезируемый химерный белок, состоящий из тиоредоксина и белка-мишени, концентрируется в основном в особых областях с внутренней стороны плазматической мембраны Е. coli, называемых зонами адгезии, и высвобождается из клеток при осмотическом шоке. Далее белок-мишень можно отщепить от химерного белка с помощью энтерокиназы. Химерный белок, содержащий тиоредоксин, можно очистить еще одним способом. Если белок-мишень остается стабильным при повышении температуры, то, поскольку тиоредоксин не разрушается при нагревании вплоть до 80 °С, химерный белок можно инкубировать при высоких температурах и освободиться от большинства других клеточных белков, разрушающихся при этих условиях.
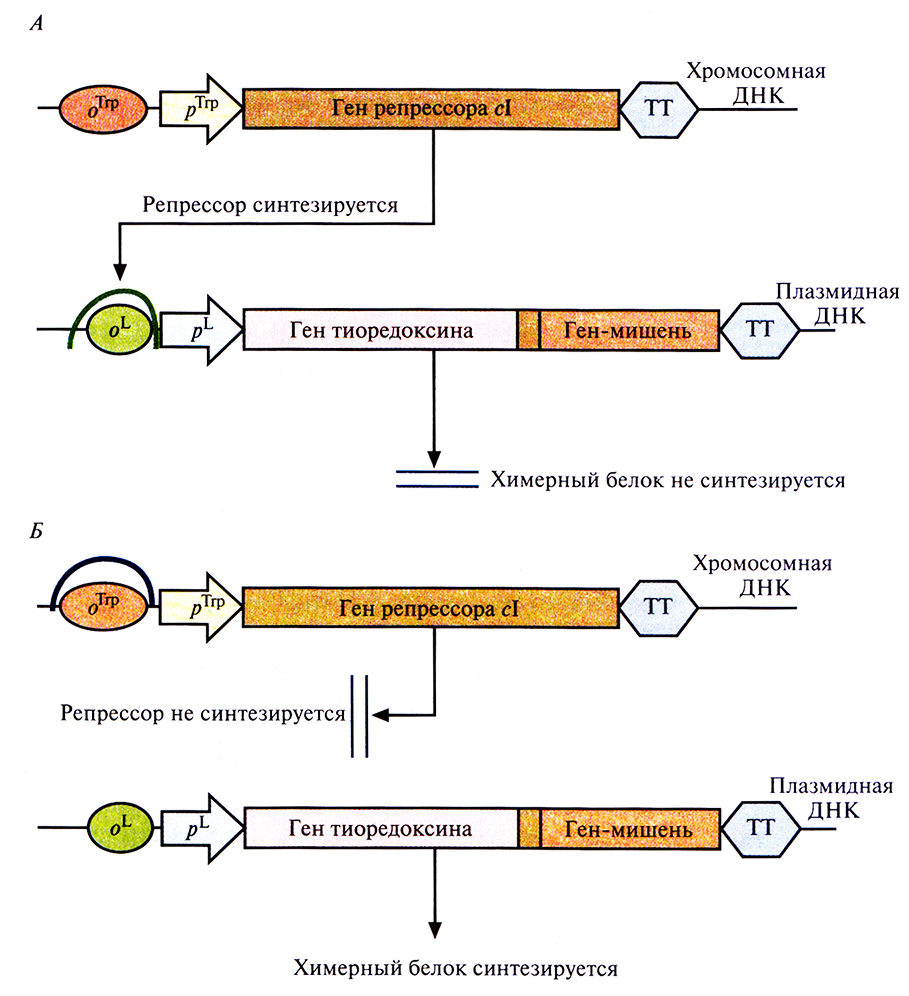
Рис. 6.9. Экспрессия пдазмидного вектора с генетической конструкцией «ген тиоредоксина–ген белка-мишени» в отсутствие (А) и в присутствии (Б) триптофана. Стрелки, помеченные pТrр и pL, указывают направление транскрипции. Сокращения и обозначения: оТгр – оператор, с которым связывается репрессор trp: оL – оператор, с которым связывается репрессор cl; рТrр – trp-промотор, рL – левый промотор бактериофага λ; ТТ – сигнал терминации транскрипции. Между генами тиоредексина и белка-мишени находится нуклеотидная последовательность, которая кодирует пептид, расщепляемый энтерокиназой. Подковообразными кривыми изображено связывание репрессоров с соответствующими операторами.
Включение белков в поверхностные структуры
Для скрининга обширных (до 5-1010 клонов) библиотек комплементарных ДНК (кДНК), кодирующих редко встречающиеся белки, были разработаны специальные системы слияния. Обычно кДНК встраивают в гены поверхностных белков (белков филаментов или пилей) нитчатых бактериофагов (например, М13) или бактерий и после транскрипции и трансляции получают химерные белки, входящие в состав поверхностных структур этих микроорганизмов. Здесь их идентифицируют иммунологическими методами. Часто для слияния используют ген поверхностного белка рlll фага М13, который связывается с F-пилями Е. coli и инициирует инфекцию. Для клонирования кДНК и других кодирующих последовательностей была сконструирована плазмида (фагмида), содержащая небольшой фрагмент ДНК М13, который обеспечивал ее упаковку in vitro в фаговые частицы, ген белка рIII под контролем какого-нибудь регулируемого бактериального промотора (например, lос-промотора Е. coli) и сайт клонирования вблизи 5'-конца гена рIII. После репликации рекомбинантного фага М13 в Е. coli белок-мишень оказывался сшитым с N-концом фагового белка, и содержащие его бляшки можно было идентифицировать иммунологическими методами. Рекомбинантные фагмиды, выделенные из таких бляшек, могут служить источником соответствующей кДНК. Эта весьма эффективная селективная система позволяет обнаруживать кДНК редких, но очень важных белков.
Библиотеки, содержащие гены поверхностных бактериальных белков, можно использовать и для идентификации клонов, несущих специфические нуклеотидные последовательности. Чтобы включить искомый белок в поверхностные структуры грамотрицательной бактерии, например Е. coli, сшивают его гены и гены белков этой структуры. В качестве бактериальных белков используются белок наружной мембраны А (ОтрА) и пептидогликансвязанный липопротеин (PAL) Е. coli, а также белок F наружной мембраны Pseudomonas aeruginosa (OprF). При этом белок-мишень обычно находится либо на С-, либо на N-конце химерного белка, но иногда короткие полипептиды включаются в середину молекулы бактериального белка (рис. 6.10).
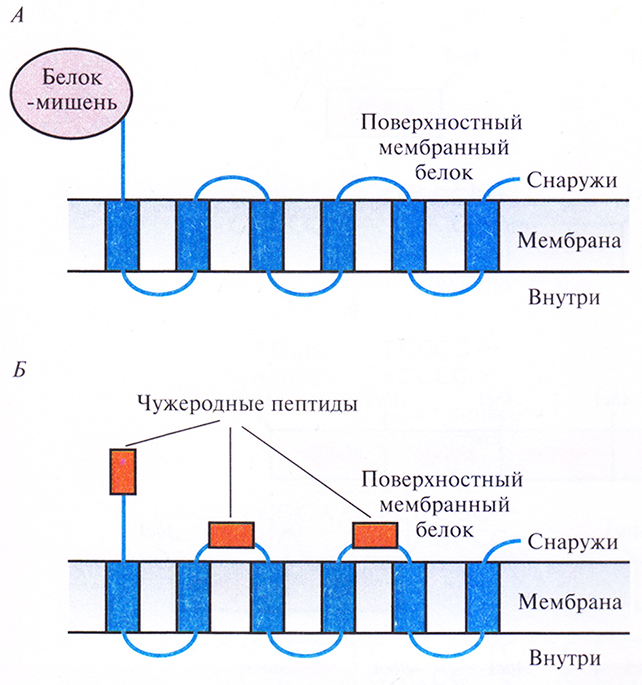
Рис. 6.10. Химерные белки, состоящие из поверхностного бактериального белка и чужеродного белка-мишени, присоединенного к его N- или С-концу (А) либо включенного в экспонируемые участки молекулы (Б). В обоих случаях чужеродные пептиды или белок оказываются на поверхности бактериальной клетки.
Системы слияния с локализацией белков-мишеней на поверхности бактериальных клеток можно использовать также для суперпродукции некоторых белков и пептидов. Так, в одной из работ в участок, кодирующий основной белок наружной мембраны Pseudomonas aeruginosa (OprF), был встроен ген антигенного детерминанта возбудителя малярии Plasmodium falciparum. Бактериальные клетки, синтезирующие соответствующий химерный белок, давали положительную реакцию с моноклональными антителами к P. falciparum. Следовательно, поверхностные химерные белки можно использовать в качестве вакцин (гл. 11).
ОДНОНАПРАВЛЕННОЕ ТАНДЕМНОЕ РАСПОЛОЖЕНИЕ ГЕНОВ
Обычно уровень генной экспрессии пропорционален числу копий транскрибируемого гена в хозяйских клетках. Отсюда следует, что с увеличением числа копий плазмиды должно увеличиваться и количество продукта встроенного в эту плазмиду гена. Однако помимо клонируемого гена плазмида содержит и другие транскрибируемые последовательности, например гены устойчивости к антибиотикам, и по мере увеличения ее копийности энергетические ресурсы клетки будут во все большей степени направляться на образование белков, кодируемых плазмидой, и метаболическая активность хозяйской клетки упадет. Выходом из этой ситуации могло бы стать встраивание в малокопийную плазмиду нескольких копий интересующего исследователя гена. Однако при этом возникает одна техническая проблема – расположение генов в такой ориентации, чтобы все они могли правильно транскрибироваться и транслироваться. Простое сшивание «конец-в-конец» приводит к случайной ориентации генов, так что одни из них экспрессируются, а другие, находящиеся в противоположной ориентации, – нет (рис. 6.11).
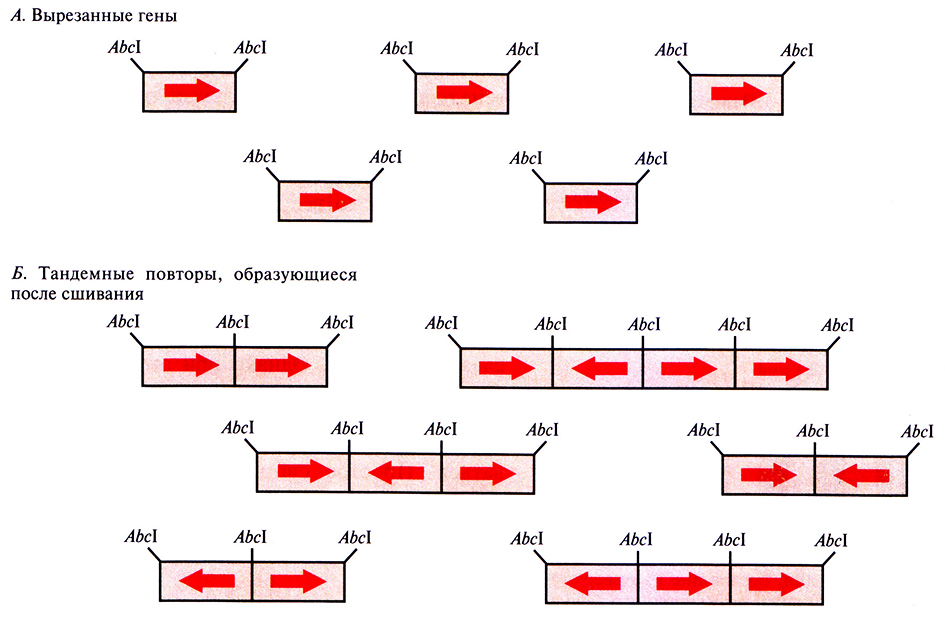
Рис. 6.11. Образование случайно ориентированных тандемных повторов. А. Клонированные гены вырезают из клонирующего вектора с помощью рестрицирующей эндонуклеазы АbсI и отделяют от векторной ДНК. Б. Создают условия, при которых происходит сшивание вырезанных генов. Поскольку нуклеотидные последовательности обоих выступающих концов генов одинаковы, последние могут соединяться в любой ориентации. В результате образуются тандемные повторы из случайно ориентированных последовательностей.
Чтобы решить эту проблему можно использовать рестрицирующий фермент Aval, который узнает последовательность CTCGGG и разрезает ДНК с 5'-конца от остатка Т. Процедура состоит в следующем. Плазмиду, содержащую эту последовательность, разрезают с помощью Aval и, используя ДНК-полимеразу I, достраивают липкие концы, затем к обоим ее тупым концам пристраивают EcoRI-линкер (GAATTC), вновь замыкая кольцо. Получившаяся плазмида содержит сегмент ДНК с двумя AvaI-сайтами, фланкирующими EcoRI-сайт и перекрывающимися с ним (рис. 6.12, А и Б), т. е. последовательность CTCGGGAATTCTCGGG (здесь подчеркнутые основания – сайты узнавания для AvaI). Нужный ген вместе с трансляционными старт- и стоп-сигналами встраивают в EcoRI-сайт и затем вырезают из плазмиды с помощью Aval (рис. 6.12, В). Такие фрагменты имеют неидентичные липкие концы, и поэтому при последующем сшивании соединяются в одной ориентации Подобный набор однонаправленных тандемных копий гена может быть встроен в экспрессирующий вектор. При этом тандемная последовательность может находиться в двух ориентациях относительно промотора, так что ее экспрессия будет происходить только в 50% случаев.
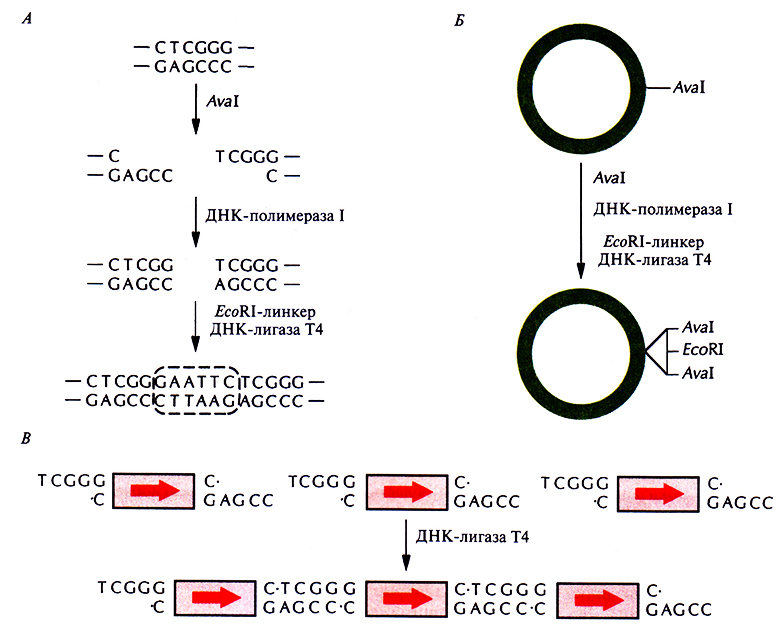
Рис. 6.12. Клонирование нескольких копий гена в одной плазмиде. А. Создание вектора. Плазмиду разрезают по Aval-сайту и образовавшиеся липкие концы достраивают с помощью ДНК-полимеразы l Е. coli. К тупым концам присоединяют EcoRI-линкер, замыкающий кольцо. Б. Встраивание EcoRI-линкера в Aval-сайт в плазмиде. В. Образование однонаправленного тандемного повтора.
Другой подход основан на использовании синтетических ориентированных адапторов – коротких олигодезоксинуклеотидов, присоединенных к концам линеаризованной плазмидной ДНК и к концам фрагментов ДНК с клонируемым геном. При лигировании эти фрагменты располагаются только в одной ориентации. Описанная процедура технически значительно более проста, чем та, в которой используется рестрицирующая эндонуклеаза Aval, кроме того, она не требует, чтобы в гене-мишени отсутствовали Aval- и EcoRI-сайты.
Уже показано экспериментально, что уровень экспрессии генов интерферона действительно увеличивается пропорционально числу тандемных копий гена, по крайней мере до четырех копий на плазмиду. Однако тандемные повторы иногда оказываются нестабильными и со временем некоторые из них или даже все утрачиваются плазмидой.
ТРАНСЛЯЦИОННЫЕ ЭКСПРЕССИРУЮЩИЕ ВЕКТОРЫ
Наличие сильного регулируемого промотора – это очень важное, но недостаточное условие максимизации количества продукта клонированного гена. Большую роль играют также эффективность трансляции и стабильность самого продукта. В прокариотических клетках разные мРНК не всегда транслируются с одинаковой эффективностью. Различие может составить несколько сотен раз, и в результате в клетке будут присутствовать сотни или даже тысячи копий одних белковых молекул и лишь несколько копий других.
Различия в трансляции связаны – по крайней мере частично – со свойствами имеющегося в транскрибированной РНК сигнала инициации трансляции, называемого сайтом связывания рибосомы. Сайт связывания рибосомы – это последовательность из шести-восьми нуклеотидов (например, UAAGGAGG), спаривающаяся с комплементарной последовательностью (в данном случае AUUCCUCC) РНК-компонента (рРНК) малой субъединицы рибосомы. Обычно чем прочнее связывание между мРНК и рРНК, тем выше эффективность инициации трансляции. Именно поэтому большинство экспрессирующих Е. соli-векторов конструируют таким образом, чтобы мРНК клонированного гена обязательно содержала сильный сайт связывания рибосомы. Это необходимое условие трансляции гетерологичных про- и эукариотических генов в Е. coli. Однако должны соблюдаться и некоторые другие условия. Во-первых, нуклеотидная последовательность, связывающаяся с рРНК, должна находиться на определенном расстоянии от старт-кодона клонированного гена (в РНК старт-кодоном является AUG; в ДНК ему соответствует кодон ATG). Во-вторых, участок ДНК, содержащий сайт связывания рибосомы и несколько первых кодонов клонированного гена, не должен иметь такую нуклеотидную последовательность, при которой после транскрипции может произойти внутрицепочечное спаривание (рис. 6.13), нарушающее связывание мРНК с рибосомой. Именно локальная вторичная структура мРНК, обеспечивающая экранирование или, напротив, экспонирование сайта связывания рибосомы, и определяет прочность связывания мРНК с комплементарной рРНК. Таким образом, при клонировании любого гена важно убедиться в том, что сайт связывания рибосомы расположен на нужном расстоянии от этого гена и что вторичная структура мРНК не помешает его присоединению к рибосоме.
Уже создано большое количество векторных систем, которые включают как транскрипционный, так и трансляционный сигналы, обеспечивающие экспрессию клонированных эукариотических генов в Е. coli. Одной из таких систем является экспрессирующий вектор рКК233-2, содержащий следующие элементы (рис. 6.14):
- селективный маркер устойчивости к ампициллину
- tас-промотор
- lacZ-участок связывания рибосомы
- старт-кодон ATG, расположенный на расстоянии восьми нуклеотидов от сайта связывания рибосомы
- сайты терминации транскрипции Т1 и Т2 фага λ.
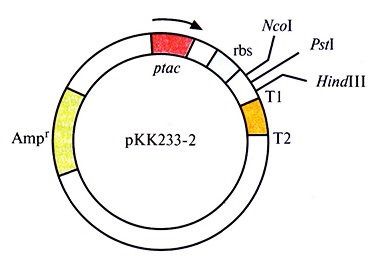
Рис. 6.14. Экспрессирующий вектор на основе плазмиды рКК233-2 (без соблюдения масштаба). Он содержит ген устойчивости к ампициллину (Аmрг), являющийся селективным маркером, госпромотор (ptac), lacZ-участок связывания рибосомы (rbs), три сайта для рестрицирующих эндонуклеаз (Ncol, Pstl и #/«dIII) и два сайта терминании транскрипции (Т1 и Т2) Стрелка – направление транскрипции.
ВАЖНАЯ ВЕХА
tac-Промотор: функциональный гибрид, полученный из trp- и lac-промоторов
H. A. DeBoer, L J. Comstock, M. Yasser Proc. Nail. Acad. Sa. USA 80: 21-25, 1983
Приступая к конструированию tac-промотора, Де Боер и его коллеги ставили своей целью создание на основе двух разных сильных регулируемых промоторов еще более сильного промотора, способного обеспечивать высокий уровень экспрессии чужеродных белков. Когда они начинали свои исследования, нуклеотидные последовательности большинства прокариотических промоторов, в первую очередь Е. coli, были уже установлены, однако конкретные свойства, обусловливающие их эффективность, оставались неизвестными. Было показано, что почти все мутации, влияющие на силу промотора, локализуются в -10- или в –35-областях (находящихся на расстоянии 10 или соответственно 35 п. н. до точки инициации транскрипции). Более того, силу промотора увеличивали только те мутации, в результате которых нуклеотидные последовательности указанных областей приближались к консенсусным: 5'-ТАТААТ-3' для -10 и 5'-TTGACA-3' дня -35 соответственно. Эти последовательности были получены в результате сравнения нуклеотидных последовательностей всех известных промоторов и идентификации наиболее часто встречающихся нуклеотидов. Де Боеру было известно, что у промотора lacUV5, более сильного варианта lос-промотора, –10-область имеет консенсусную нуклеотидную последовательность, а –35-область – нет, а у trр-промотора, в норме контролирующего транскрипцию генов, которые отвечают за биосинтез триптофана, ситуация как раз обратная. Он и его коллеги решили сконструировать химерный промотор, у которого – 10-область происходила бы от lac-промотора, а –35 – от промотора trp. Этот новый, так называемый госпромотор был проверен на способность контролировать синтез фермента галактокиназы Е. coli по сравнению с lac- и trp-промоторами в таких же условиях. Как и ожидалось, юс-промотор оказался гораздо более сильным – примерно в 5 раз по сравнению с промотором trp ив 10 – по сравнению с lac. Кроме того, tac-промотор, как и lac, реагировал на /ос-репрессор и активировался под действием ИПТГ. Таким образом, новый промотор был не только более сильным, но и регулируемым.
Клонируемый ген встраивают в Ncol-, Pstl- или Hindill-сайт, расположенный между сайтом связывания рибосомы и сайтами терминации транскрипции. Если его рамка считывания не попадает «в ногу» с кодоном AUG, то необходимо произвести минимальную коррекцию. В этом случае после индукции и транскрипции происходит достаточно эффективная трансляция клонированного гена. Однако следует иметь в виду, что поскольку нуклеотидная последовательность, кодирующая N-концевой участок белка-мишени, у разных клонированных генов неодинакова, нельзя создать универсальный вектор, исключающий одноцепочечное спаривание мРНК при любых обстоятельствах. Поэтому ни одна из областей инициации трансляции, как бы она ни была оптимизирована, не может гарантировать эффективность трансляции всех клонированных генов. Таким образом, описанные выше экспрессирующие векторы – это только основа для создания оптимальной системы трансляции.
Эффективной трансляции может препятствовать и «несовместимость» клеток, обусловленная тем, что в клонируемом гене имеются кодоны, редко встречающиеся в геноме организма-хозяина. В таких случаях в хозяйской клетке может не доставать транспортных РНК (тРНК), узнающих редко используемые кодоны, что снижает выход продукта клонированного гена. Как решить эту проблему – не совсем понятно. Если продукт клонированного гена очень ценен, можно попытаться химически синтезировать такой вариант клонируемого гена, который состоит из кодонов, обычно используемых хозяйским организмом (оптимизация кодонов).
СТАБИЛИЗАЦИЯ БЕЛКОВ
Обычно время полужизни белков составляет от нескольких минут до нескольких часов. Такая вариабельность обусловливается различиями в числе дисульфидных связей в белковых молекулах и наличием или отсутствием на 5'-конце определенных аминокислот. Например, если к N-концу Р-галактозидазы присоединять разные аминокислоты, то время жизни модифицированного белка in vitro может варьировать от двух минут до более 20 часов (табл. 6.4). Аминокислоты, увеличивающие время жизни белков, можно включать в белки генноинженерными методами. Часто для стабилизации белка-мишени достаточно присоединить к N-концу всего один аминокислотный остаток. Долгоживущие белки накапливаются в клетках, что увеличивает конечный выход продукта. Это характерно как для эу-, так и для прокариот.
Таблица 6.4. Время полужизни β-галактозидаз,
к N-концу которых присоединены разные аминокислоты1)

Однако стабильность белков может не только повышаться. Так, включение некоторых аминокислотных последовательностей во внутреннюю часть белковой молекулы делает ее более чувствительной к протеолитическому расщеплению. Такие последовательности обогащены остатками пролина (Р), глутаминовой кислоты (Е), серина (S) и треонина (Т), отсюда и их название – PEST-последовательности. Они часто бывают фланкированы кластерами из положительно заряженных аминокислот и, возможно, служат маркерами для протеаз. Стабильность белков, содержащих такие последовательности, можно было бы повысить, внося изменения в соответствующие гены. При этом, однако, необходимо позаботиться о том, чтобы не произошло нарушений функции белка-мишени.
РОСТ В УСЛОВИЯХ НЕДОСТАТКА КИСЛОРОДА
Е. coli и многие другие микроорганизмы, которые используются для экспрессии чужеродных белков, обычно растут только в присутствии кислорода. К сожалению, растворимость кислорода в водных средах ограничена, а по мере увеличения плотности культуры содержание растворенного кислорода в культуральной среде быстро падает. Более того, поскольку кислород растворяется очень медленно, эту проблему нельзя решить простым продуванием через среду воздуха или кислорода даже при интенсивном перемешивании. При уменьшении концентрации кислорода экспоненциальный рост замедляется и культура медленно переходит в стационарную фазу, характеризующуюся другим метаболическим статусом. Одним из последствий этого является образование в клетках протеиназ, которые могут расщеплять белок-мишень. Проблему аэрации культуральной среды пытались решить разными способами: изменением конструкции биореактора, повышением интенсивности продувания воздуха и перемешивания, добавлением в среду веществ, увеличивающих растворимость кислорода. Все это, однако, не привело ни к каким ощутимым результатам.
Применение хозяйских штаммов с дефицитом протеиназ
Один из возможных подходов к стабилизации чужеродных белков, синтезируемых Е. coli, состоит в использовании хозяйских штаммов с дефицитом протеолитических ферментов. Однако здесь есть свои трудности. В клетках Е. coli синтезируется по крайней мере 25 разных протеиназ, и только некоторые из них изучены на генетическом уровне. Кроме того, протеиназы выполняют в клетке очень важную функцию, разрушая чужеродные или дефектные белки и обеспечивая тем самым жизнеспособность клеток. В одной из работ были сконструированы штаммы, несущие мутации в одном или даже нескольких протеиназных генах, и чем более выражен был суммарный дефицит по протеиназам, тем хуже рос штамм. Таким образом, снижение протеиназной активности приводит к истощению клеточных ресурсов. И все же удалось создать штаммы Е. coli, несущие мутации в гене сигма-фактора РНК-полимеразы, ответственного за синтез белков теплового шока (rроН), и в гене протеиназы, необходимой для роста клеток при высоких температурах (degP), у которых удельная активность секретируемых белков была в 36 раз выше, чем у штаммов дикого типа. Это кажущееся увеличение было обусловлено снижением интенсивности протеолитического расщепления белков.
Бактериальный «гемоглобин»
Местообитанием некоторых штаммов грамотрицательных облигатных аэробных бактерий Vitreoscilla являются сильно обедненные кислородом непроточные водоемы. Чтобы получать нужное количество кислорода для роста и метаболизма, они синтезируют гемоглобиноподобное вещество, связывающее кислород окружающей среды и увеличивающее концентрацию доступного кислорода в клетке. Когда ген, кодирующий этот белок, был введен в клетки Е. coli, в последних сразу произошли серьезные изменения: повысился уровень синтеза клеточных и рекомбинантных белков, возросла эффективность протонных насосов, увеличилось количество образующегося АТР и его концентрация, особенно при низком содержании кислорода в среде. Чтобы такую стратегию можно было использовать применительно к другим хозяйским клеткам, необходимо, чтобы эти клетки не только эффективно экспрессировали «гемоглобиновый» ген Vitreoscilla, но и синтезировали гем – составляющую гемоглобиновой молекулы. Это позволит улучшить рост таких важных в коммерческом отношении бактерий, как Е. coli, Streptomyces lividans, Corynebacterium glutamicum и Xanthomonas maltophilia, а также осуществлять в них экспрессию чужеродных генов.
ИНТЕГРАЦИЯ ЧУЖЕРОДНОЙ ДНК В ХРОМОСОМУ ХОЗЯИНА
При наличии в клетке плазмиды часть энергетических ресурсов расходуется на ее репликацию, транскрипцию и синтез белков, которые она кодирует. При этом, как правило, многокопийные плазмиды требуют больше энергии, чем малокопийные, и в результате часть клеток в процессе роста популяции утрачивает плазмиды. Клетки, лишившиеся своих плазмид, обычно растут быстрее тех, в которых они сохранились, и в конечном счете оказываются в культуре преобладающими. По прошествии нескольких генераций это отражается на количестве синтезируемого продукта клонированного гена. Разработано по крайней мере два подхода к решению этой проблемы. В лабораторных условиях для сохранения плазмид клетки выращивают в присутствии антибиотиков или метаболитов, обеспечивающих рост только тех клеток, в которых есть плазмида. Однако добавление антибиотиков и каких-то других веществ в культуры, выращиваемые в больших объемах, или в промышленные ферментеры приводит к значительному удорожанию конечного продукта. Особенно важно, чтобы клонированные гены сохранялись, не утрачиваясь и не передаваясь другим микроорганизмам, в том случае, когда сконструированный микроорганизм предназначен для использования вне стен лаборатории. Он должен не только оставаться эффективным, но и быть экологически безопасным. Включение клонированной ДНК в хромосомную ДНК хозяйского организма позволяет обойтись без плазмид и избежать утраты плазмидных генов.
При встраивании нужного гена в хромосомную ДНК хозяина нужно позаботиться о том, чтобы сайт интеграции не находился внутри гена, кодирующего важную клеточную функцию. Для этого чужеродный ген включают в заведомо несущественный сайт. Кроме того, для обеспечения эффективной экспрессии его помещают под контроль регулируемого промотора. Для интеграции в нужный сайт вводимый ген должен содержать нуклеотидную последовательность длиной не менее 50 нуклеотидов, сходную с таковой в хромосомной ДНК, в пределах которых и должен произойти физический обмен (рекомбинация) между двумя молекулами ДНК. Вкратце процесс интеграции состоит в следующем.
1. Идентификация подходящего сайта интеграции, т. е. сегмента хозяйской ДНК, последовательность которого может быть прервана без ущерба для функционирования клетки.
2. Выделение и клонирование всего хромосомного сайта интеграции или его части.
3. Встраивание нужного гена вместе с регулируемым промотором в клонированный сайт интеграции (рис. 6.15, А) или вблизи него (рис. 6.15, Б).
4. Перенос полученной генетической конструкции «хромосомный сайт интеграции/клонированный ген» в хозяйскую клетку в составе плазмиды, не способной к автономной репликации в клетках этого хозяина.
5. Отбор и сохранение тех хозяйских клеток, которые экспрессируют клонированный ген. Наследование клонированного гена возможно только в случае его интеграции в хромосому клеток хозяина.
Если клетка трансформирована нереплицируюшейся плазмидой, несущей клонированный ген в середине клонированного фрагмента с хромосомным сайтом интеграции, то может произойти спаривание между гомологичными нуклеотидными последовательностями плазмиды и хозяйской ДНК (рис. 6.15, А) и далее интеграция в результате двойного кроссинговера, осуществляемого ферментами клетки-хозяина. Альтернативный вариант – интеграция всей плазмидной ДНК в хромосому хозяина в результате одиночного кроссинговера (на рисунке не показано). Интеграция всей плазмиды может произойти и в том случае, если клонированный ген встроен вблизи клонированного хромосомного сайта интеграции.
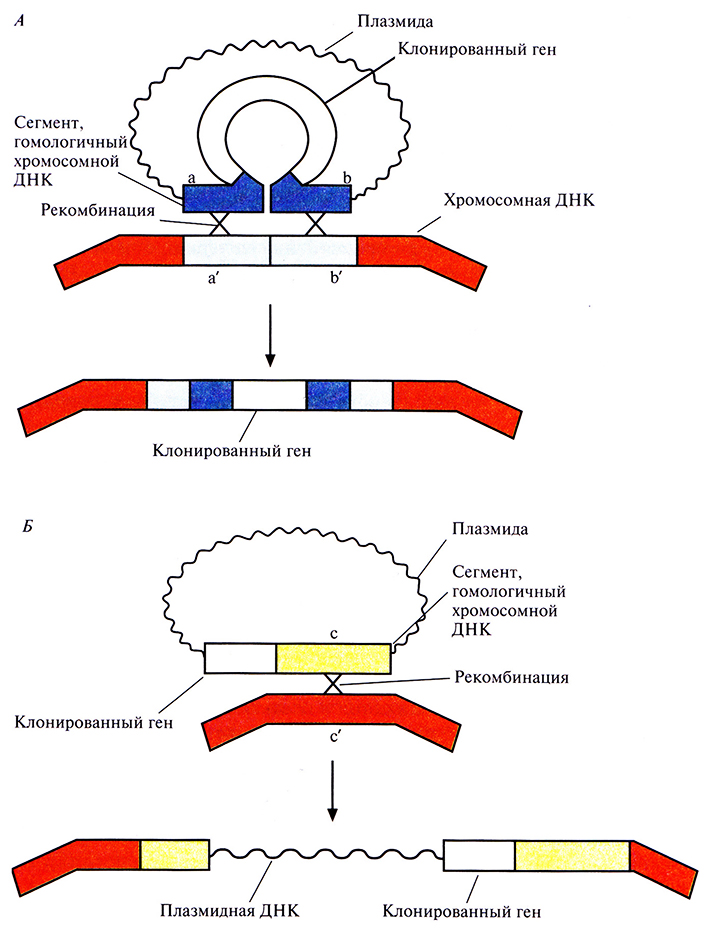
Рис. 6.15. Два способа интеграции клонированного в плазмиде гена в хромосому. А. Ген встроен в середину клонированного в плазмиде сегмента ab, гомологичного сегменту а'b' в хромосомной ДНК. В результате двойного кроссинговера (Х-Х) клонированный ген оказывается в составе хромосомы. Б. Ген встроен вблизи клонированного в плазмиде сегмента с, гомологичного сегменту с' в хромосомной ДНК. В результате одиночного кроссинговера (X) происходит интеграция в хромосому всей плазмиды вместе с включенным в нее геном.
Для проверки эффективности интеграции клонированного гена использовали В. subtilis. Была сконструирована плазмида Е. coli, содержащая ген а-амилазы (фермента, участвующего в гидролизе крахмала) Bacillus amyloliquefaciens, встроенный в середину фрагмента ДНК из В. subtilis. Она была неспособна реплицироваться в этом микроорганизме, но ею можно было трансформировать клетки В. subtilis. Обнаруженные трансформанты синтезировали а-амилазу, что свидетельствует об интеграции гена, кодирующего данный фермент, в хромосому В. subtilis, и о его функционировании. Отобранные рекомбинанты были устойчивы к ампициллину и хлорамфениколу. Поскольку оба гена устойчивости находились в плазмиде, было очевидно, что произошла одиночная рекомбинация, в результате которой вся плазмида включилась в хромосомную ДНК В. subtilis.
Чтобы увеличить число копий гена α-амилазы, локализованных в хромосоме В. subtilis, исходные трансформанты выращивали в присутствии хлорамфеникола в высокой концентрации. В таких условиях выживали только те клетки, в которых происходила спонтанная дупликация интегрированной плазм иды. Клетки, отобранные по признаку устойчивости к хлорамфениколу, проверяли на активность α-амилазы (табл. 6.5). После такой процедуры были получены клетки, содержащие до 9 копий гена а-амилазы. Уровень ферментативной активности в клетках, содержащих а-амилазные гены в составе хромосомы, была гораздо выше, чем в том случае, когда эти гены находились в многокопийной плазмиде (от 20 до 40 копий на клетку) В. subtilis.
Таблица 6.5. Связь между числом копий гена а-амилазы
и уровнем ее активности в клетках В. Subtilis1)
В одном из исследований несколько копий чужеродного гена было встроено в разные заранее выбранные сайты в хромосоме В. subtilis, при этом для каждой из копий использовалась двухэтапная процедура (рис. 6.16). На первом этапе выбирали селективный маркерный ген (например, ген устойчивости к какому-либо антибиотику) и встраивали его в середину вполне определенного, но несущественного фрагмента хромосомной ДНК В. subtilis в составе плазмидного вектора, не способного к репликации в этом микроорганизме. Отбирали клетки, экспрессирующие маркерный ген, т. е. клетки, у которых этот ген включился в хромосомную ДНК. На втором этапе ген-мишень с соответствующими сигналами инициации транскрипции и трансляции, введенный в середину такого же, как и выше, несущественного фрагмента хромосомной ДНК В. subtilis в составе плазмиды, включали в хромосомную ДНК с помощью рекомбинации, заменив им маркерный ген. Отбирали клетки, которые уже не экспрессировали маркерный ген, т. е. несли вместо него ген-мишень, интегрированный в хромосомную ДНК. Для интеграции других копий гена-мишени в хромосомную ДНК хозяйской клетки повторяли эту процедуру, используя другие несущественные области ДНК.
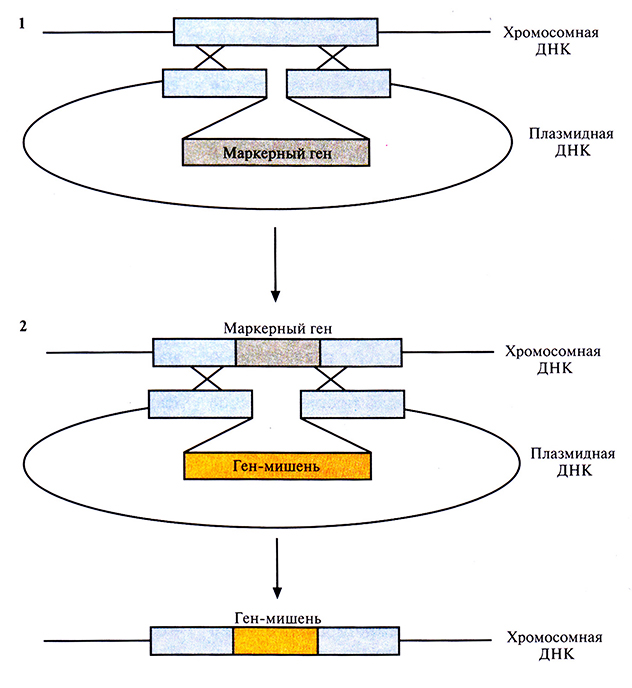
Рис. 6.16. Встраивание чужеродного гена в заранее выбранный сайт в хромосоме В. subtilis. На этапе 1 в хромосомную ДНК хозяйской клетки с помощью гомологичной рекомбинации встраивают маркерный ген. На этапе 2 маркерный ген замещают геном-мишенью. Аналогичную операцию повторяют для других сайтов.
ПОВЫШЕНИЕ ЭФФЕКТИВНОСТИ СЕКРЕЦИИ
Стабильность белков, кодируемых клонированными генами, зависит от их клеточной локализации. Например, рекомбинантный проинсулин оказывается примерно в 10 раз более стабильным, если он секретируется (экспортируется) в периплазму (пространство между плазматической и наружной мембранами), а не остается в цитоплазме. Кроме того, белки, секретируемые в периплазму или в среду, легче очистить.
Обычно транспорт белков через клеточную мембрану обеспечивают N-концевые аминокислотные последовательности, называемые сигнальными пептидами (сигнальными последовательностями, лидерными пептидами). Иногда удается сделать белок секретеруемым, присоединив к кодирующему его гену нуклеотидную последовательность, ответственную за синтез сигнального пептида. Однако простое наличие сигнального пептида не обеспечивает эффективной секреции. Кроме того, Е. coli и другие грамотрицательные микроорганизмы обычно не могут секретировать белки в окружающую среду из-за наличия наружной мембраны. Есть по крайней мере два способа решения этой проблемы. Первый – использование грамположительных про- или эукариот, лишенных наружной мембраны, второй – создание грамотрицательных бактерий, способных секретировать белки в среду, с помощью генной инженерии.
Если слияние гена-мишени с фрагментом ДНК, кодирующим сигнальный пептид, не приводит к эффективной секреции белкового продукта, приходится использовать другие стратегические приемы. Один из таких приемов, с успехом примененных в отношении интерлейкина-2, основывался на слиянии гена, кодирующего интерлейкин-2, с геном, кодирующим полноразмерный предшественник мальтозосвязывающего белка, а не только его сигнальную последовательность, и разделении этих генов сегментом ДНК, кодирующим сайт узнавания для фактора Ха. Когда такой химерный ген включили в плазмидный вектор и использовали его для трансформации Е. coli, в периплазме хозяйской клетки обнаружили в большом количестве химерный белок. Обработав его фактором Ха, получили функциональный интерлейкин-2.
По данным одной из работ, секреция многих гетерологичных белков в Е. coli зависит от уровня экспрессии соответствующих генов. Чужеродные белки, синтезируемые наиболее активно, не обязательно столь же активно секретируются. Иногда интенсивный синтез чужеродного белка вызывает перегрузку секреторного аппарата и его блокирование. Таким образом, если нужно, чтобы данный белок непременно секретировался, то можно попытаться понизить уровень экспрессии соответствующих генов.Некоторые грамотрицательные бактерии секретируют в среду белок, называемый бактериоцином. Он активирует фосфолипазу А, локализованную во внутренней мембране бактериальной клетки, в результате чего и внутренняя, и наружная мембраны становятся проницаемыми, и не которые цито- и периплазматические белки высвобождаются в культуральную среду. Таким образом, можно встроить ген бактериоцина в плазмиду так, чтобы он находился под контролем сильного регулируемого промотора, трансформировать клетки Е. coli этой плазмидой и сделать их проницаемыми. Если же Е. coli уже несут ген бактериоцина, их можно трансформировать другой плазмидой, которая содержит ген нужного белка, сшитый с нуклеотидной последовательностью, кодирующей сигнальный пептид Если оба гена находятся под контролем одного промотора, то их можно индуцировать одновременно, и белок клонированного гена будет секретироваться в среду.
Когда секретируемые чужеродные белки образуются в Е. coli в слишком большом количестве, очень часто процессинг претерпевают не все белки-предшественники: примерно половина секретированных белков сохраняет лидерную последовательность, а другая половина полностью процессируется с образованием зрелой формы. Это может быть связано с недостатком каких-то белков, участвующих в секреции. В такой ситуации, чтобы увеличить долю процессированных белков, можно попытаться повысить уровень экспрессии генов, ответственных за синтез лимитирующих компонентов секретирующей системы. Для проверки этого предположения были поставлены следующие эксперименты. Плазмиду, несущую гены рг1А4 и secE, которые кодируют основные компоненты молекулярного механизма, ответственного за физическое перемещение белков через мембрану, ввели в клетки Е. coli. После такого усиления секреторного аппарата хозяйской клетки доля рекомбинантного белка (цитокина интерлейкина-6), секретируемая в плазмиду в зрелой форме, увеличилась с 50 до более чем 90%.
Грибы Aspergillus секретируют в среду большое количество ферментов и широко используются для их промышленного производства. В одной из работ осуществили слияние гена человеческого интерферона с геном сигнального пептида, ответственного за секрецию, и поместили эту конструкцию под контроль глюкоамилазного промотора Aspergillus nidulans, индуцируемого крахмалом После добавления последнего в среду с трансформированными клетками Aspergillus nidulans выход секретируемого человеческого интерферона достиг 1 мг на 1 л, что эквивалентно примерно 5% всего секретируемого клеточного белка. Эта работа показывает, что стратегии модулирования генной экспрессии, разработанные для Е. coli, можно использовать и применительно к другим биологическим системам.
МЕТАБОЛИЧЕСКАЯ ПЕРЕГРУЗКА
Введение в клетку чужеродной ДНК и ее экспрессия часто приводят к нарушениям клеточного метаболизма. Эти нарушения весьма разнообразны и обусловлены давлением, которое оказывает чужеродная ДНК на все клеточные процессы. Метаболическая перегрузка может возникать по разным причинам.
- Увеличение числа копий и/или размера плазмид и связанное с этим увеличение количества энергии, необходимого для их репликации и сохранения.
- Недостаток растворенного кислорода в среде и невозможность обеспечения им и всех метаболических реакций, и процесса экспрессии плазмидных генов.
- Гиперпродукция чужеродных белков, приводящая к истощению пула некоторых аминоацил-тРНК (или даже некоторых аминокислот) и/или энергетических запасов (в виде АТР и GTP).
- Перегрузка системы экспорта и нарушение правильной локализации жизненно важных белков хозяйской клетки вследствие «перепроизводства» чужеродного белка, экспортируемого из цитоплазмы к клеточной мембране или в периплазматическое пространство.
- Наличие у организма-хозяина необычных метаболических свойств (например, высокая дыхательная активность у Azotobacter spp.), что делает его более чувствительным к различным воздействиям, чем обычные клетки.
- Непосредственное влияние чужеродных белков на функционирование хозяйской клетки (например, превращение с их помощью важных незаменимых предшественников в неприемлемые, а иногда и токсичные соединения).
Метаболическая перегрузка может привести к разнообразным изменениям в физиологии и функционировании хозяйской клетки. Одно из наиболее частых – снижение скорости роста клеток после введения чужеродной ДНК. Так, клетки, содержащие плазмиду, растут медленнее, чем нетрансформированные, не содержащие плазмид (табл. 6.6), что часто сопровождается утратой рекомбинантной плазмиды. Иногда метаболическая перегрузка приводит к тому, что под давлением отбора из плазмиды делегируется рекомбинантный ген или его часть. Поскольку клеткам, растущим в условиях метаболической перегрузки, не хватает энергии для нормального функционирования, затрагиваются прежде всего такие энергоемкие метаболические процессы, как фиксация азота или синтез белков. Могут изменяться также размер и форма клеток, образовываться слишком много внеклеточного полисахарида, склеивающего клетки друг с другом и затрудняющего микрофильтрацию.
Таблица 6.6. Влияние числа копий плазмиды на скорость роста хозяйских клеток1)

Как следствие метаболической перегрузки, обусловленной образованием избыточного количества чужеродного белка и нехваткой питательных веществ или «строительных блоков» – аминокислот, может произойти запуск стрессовых механизмов, в частности инициироваться синтез клеточных протеиназ, под действием которых произойдет быстрая деградация рекомбинантного белка. Истощение пула аминокислот может стать результатом эффективной экспрессии не только клонированных генов-мишеней, но и генов самого вектора, кодирующих маркеры устойчивости к антибиотикам.
Вероятность трансляционных ошибок для Е. coli составляет 2 • 10-4–2 • 10–3 на 1 клетку за генерацию. Однако в условиях нехватки определенных аминоацил-тРНК, что часто случается при суперпродукции чужеродных белков, вероятность включения в белковую молекулу неправильной аминокислоты вместо недостающей сильно увеличивается. Кроме того, точность трансляции еще больше снижается из-за недостатка GTP, который является необходимым компонентом корректирующего аппарата. В одной из работ было показано, что в условиях гиперпродукции фактора роста эпидермиса мыши в клетках Е. coli частота ошибочных включений аминокислот в рекомбинантный белок увеличивается в 10 раз. Это не позволяет использовать синтезируемый белок в качестве лекарственного средства, поскольку: 1) удельная активность и стабильность белка могут быть гораздо ниже ожидаемых; 2) наличие в молекуле «неправильных» аминокислот может вызвать нежелательную иммунологическую реакцию при введении такого белка в организм человека.
К счастью, правильно спланировав эксперимент, можно минимизировать влияние метаболической перегрузки, оптимизировать выход рекомбинантного белка и повысить стабильность трансформированных хозяйских клеток. Например, нагрузку можно снизить, если использовать малокопийные плазмидные векторы. А еще лучше вообще отказаться от векторов и встроить чужеродную ДНК в хромосомную ДНК организма-хозяина. В этом случае не нужно заботиться об обеспечении стабильности плазмиды. Кроме того, клетке не приходится расходовать свои ресурсы на синтез ненужных продуктов, кодируемых маркерными генами устойчивости к антибиотикам. Синтез продуктов таких генов, входящих в состав плазмидных векторов наряду с генами-мишенями, является одной из основных причин метаболической перегрузки. Интеграция в хромосому особенно важна в тех случаях, когда используется сам рекомбинантный микроорганизм, а не синтезируемый им продукт. Уменьшению метаболической перегрузки помогает также применение сильных, но регулируемых промоторов. В таких случаях ферментацию проводят в две стадии. На первой из них, во время роста, промотор, контролирующий транскрипцию гена-мишени, вы ключей, а на второй, во время индукции, включен.
Если частота использования кодонов у чужеродного гена отличается от таковой у организма-хозяина, то проблему нехватки специфических аминоацил-тРНК можно решить, синтезировав часть гена-мишени или даже весь ген с более близким к хозяйскому организму набором кодонов. Так, в одном из исследований было показано, что количество стрептавидина, образующегося при экспрессии синтетического гена с GC-содержанием 54%, было в 10 раз больше, чем при экспрессии «природного» гена с GC-содержанием 69%. Однако этот подход довольно сложен и может применяться лишь в редких случаях.
Как это ни парадоксально, но один из способов увеличения количества чужеродного белка, синтезируемого рекомбинантным микроорганизмом, состоит в поддержании уровня экспрессии его гена на среднем уровне (так, чтобы на долю продукта приходилось примерно 5% суммарного клеточного белка), но зато в максимальном увеличении плотности культуры. Микробиологическая система с 5%-ным уровнем экспрессии чужеродного белка и низкой метаболической нагрузкой, в которой плотность может достигать 40 г/л (масса сухого вещества), оказывается более эффективной, чем система с 15%-ным уровнем экспрессии и плотностью 10 г/л.
Достичь одновременно и высокого уровня синтеза чужеродного белка, и высокой плотности культуры часто не удается из-за накопления вредных побочных продуктов (в первую очередь ацетата), подавляющих рост клеток и синтез белка. Чтобы уменьшить накопление ацетата в богатой среде, не нарушая роста клеток, можно снизить скорость поглощения глюкозы, добавив в среду ее аналог, метил-а-глюкозид. Альтернативный подход состоит в использовании клеток Е. coli, несущих мутацию в гене ptsG, который кодирует фермент II глюкозофосфотрансферазной системы. Максимальная плотность культуры Е. coli дикого типа составила примерно 10 г/л, а культуры Е. coli с мутацией в гене ptsG – 15 г/л. Кроме того, уровень синтеза [3-лактамазы в мутантных клетках был на 25% выше (на 1 г массы сухого вещества), чем в клетках дикого типа, так что суммарное различие достигает примерно двукратной величины.
Достичь аналогичного результата можно гораздо проще и быстрее, если использовать методы генной инженерии, а не мутагенез и отбор. Один из подходов состоял во введении в Е. coli генов, кодирующих ацетолактатсинтазу. Этот фермент катализирует образование ацетолактата из пирувата, что приводит к уменьшению количества образующегося ацетата (рис. 6.17). Гены ацетолактатсинтазы вводят в клетки в составе одной плазмиды, а гены-мишени – в составе другой, из другой группы несовместимости. Трансформированные клетки синтезируют гораздо меньше ацетата, чем нетрансформированные; вместо него образуется ацетоин, соединение примерно в 50 раз менее токсичное, чем ацетат.
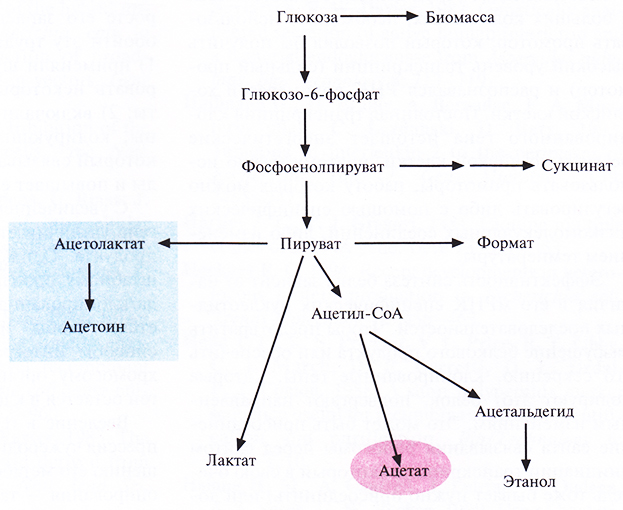
Рис. 6.17. Схематическое представление метаболизма глюкозы в клетках Е. coli, трансформированных плазмидой, несущей гены ацетолактатсинтазы.
ЗАКЛЮЧЕНИЕ
Чтобы получить какой-то белковый продукт, необходимо обеспечить правильную транскрипцию кодирующего его гена и трансляцию соответствующей мРНК. Для инициации транскрипции в нужном сайте необходим промотор, а для ее остановки – терминирующий код он. Клонированный ген часто бывает лишен таких сигнальных последовательностей, и для его экспрессии в прокариотической клетке-хозяине нужно обеспечить и то, и другое. Кроме того, поскольку для решения большинства биотехнологических задач белок должен образовываться в больших количествах, необходимо использовать промотор, который позволял бы получить высокий уровень транскрипции (сильный промотор) и распознавался РНК-полимеразой хозяйской клетки. Постоянная транскрипция клонированного гена истощает энергетические ресурсы хозяйской клетки, поэтому нужно использовать промоторы, работу которых можно регулировать либо с помощью специфических низкомолекулярных соединений, либо изменением температуры.
Эффективность синтеза белка зависит от наличия в его мРНК специфических нуклеотидных последовательностей. Чтобы предотвратить разрушение белкового продукта или обеспечить его секрецию, клонированные гены, которые кодируют этот белок, подвергают направленным изменениям. Это может быть присоединение сайта связывания рибосомы перед сайтом инициации транскрипции (который в свою очередь тоже бывает нужно присоединить) или добавление к концу клонированного гена терминирующего кодона, который обеспечивал бы остановку трансляции. Если нужно, чтобы белок секретировался, то перед клонированным геном необходимо встроить сигнальную последовательность, рамка считывания которой согласуется с таковой гена-мишени.
Еще одна проблема – невысокая стабильность белков, кодируемых клонированными генами Рекомбинантный белок может расщепляться протеиназами хозяйской клетки. Чтобы избежать этого, можно изменить клонированный ген таким образом, чтобы на N-конце белковой молекулы оказались одна или несколько дополнительных аминокислот. В такой форме рекомбинантный белок уже не подвергается столь быстрой деградации. Кроме того, «лишние» аминокислоты иногда помогают в последующей очистке химерного белка, например с помощью иммуноаффинной хроматографии на колонке. При этом место соединения компонент подбирается так, чтобы по нему можно было расщепить молекулу (химическим или ферментативным путем) и получить эти компоненты в чистом виде.
Большинство микроорганизмов, с помощью которых получают белковые продукты, растут только в присутствии кислорода. Последний плохо растворяется в воде, и при интенсивном росте его запасы быстро истощаются. Чтобы обойти эту трудность, использовали два пути: 1) применяли штаммы, неспособные синтезировать некоторые протеолитические ферменты; 2) включали в геном хозяйских клеток гены, кодирующие гемоглобин Vitreoscilla sp., который связывает кислород окружающей среды и повышает его концентрацию в клетке.
С увеличением числа копий клонированного гена увеличивается количество синтезируемого продукта. Однако при переходе к крупномасштабному производству конструкция «плазмида/клонированная ДНК» очень часто утрачивается. Чтобы избежать этого, разработали способы интеграции клонированного гена в хромосому организма-хозяина. В этом случае ген остается в клетке как часть хозяйской ДНК. Введение в геном организма-хозяина и экспрессия чужеродной ДНК часто приводят к нарушению его метаболизма и нормального функционирования – так называемой метаболической перегрузке. Разработан целый ряд способов, позволяющих минимизировать этот эффект и одновременно оптимизировать выход белка-мишени и стабильность трансформированных клеток.
Системы экспрессии весьма разнообразны, и исследователям приходится каждый раз подбирать условия, наиболее подходящие для получения того или иного белка в том или ином организме-хозяине. И все же, несмотря на различия в деталях, для создания самых разных систем экспрессии используются одни и те же основные приемы.

