До появления технологии рекомбинантных ДНК многие лекарственные препараты на основе белков человека удавалось получать только в небольших количествах, их производство обходилось очень дорого, а механизм биологического действия иногда был недостаточно изучен. Предполагалось, что с помощью новой технологии можно будет получать весь спектр таких препаратов в количествах, достаточных как для их эффективного тестирования, так и для применения в клинике. И эти ожидания оправдались. На сегодняшний день клонировано более 400 генов (в основном в виде кДНК) различных белков человека, которые в принципе могут стать лекарственными препаратами. Большинство этих генов уже экспрессированы в клетках-хозяевах, и сейчас их продукты проходят проверку на возможность применения для лечения различных заболеваний человека (табл. 10.1). Впрочем, хотя более .30 таких биотехнологических препаратов и получило одобрение в США (табл. 10.2), пройдет еще несколько лет, прежде чем они будут рекомендованы для широкого использования и поступят в продажу; вначале их подвергнут проверке на животных и проведут тщательные клинические испытания. Однако фармацевтические фирмы уже сейчас проявляют к ним интерес. По подсчетам специалистов, ежегодный объем мирового рынка лекарственных препаратов на основе белков человека составляет около 150 млрд. долларов и постоянно растет. Объем мирового рынка лекарственных средств на основе рекомбинантных белков увеличивается на 12–14% в год и к 2000 г. составит примерно 20 млрд. долларов.
Таблица 10.1. Некоторые белки человека, полученные генноинженерными методами
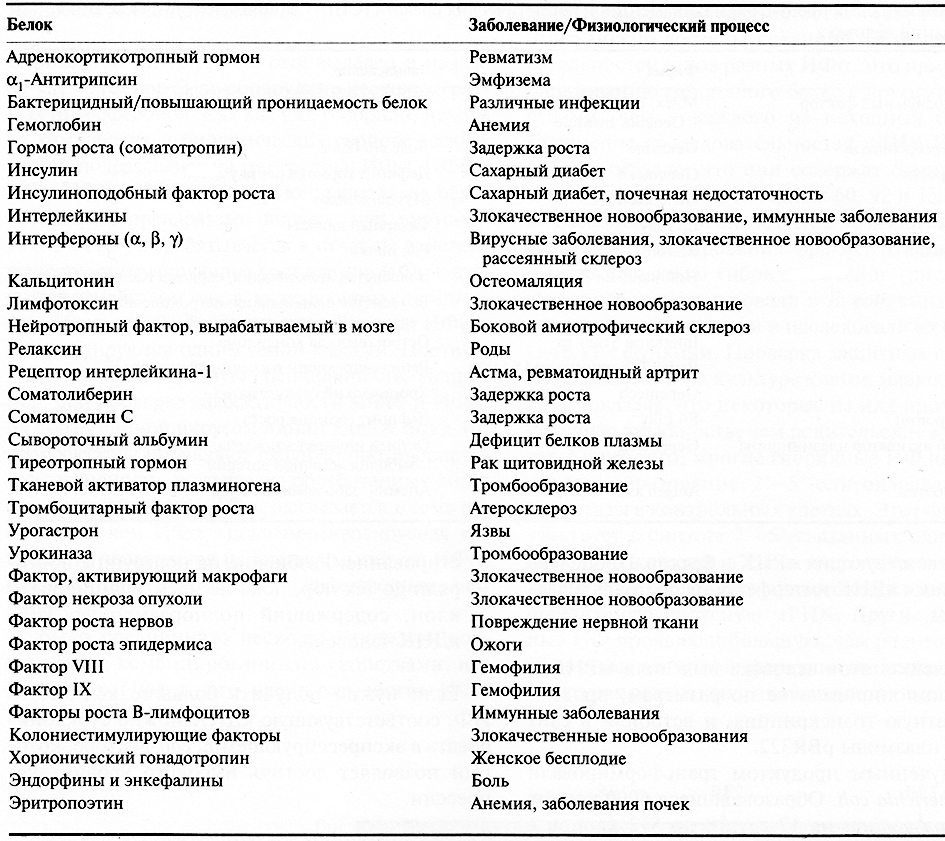
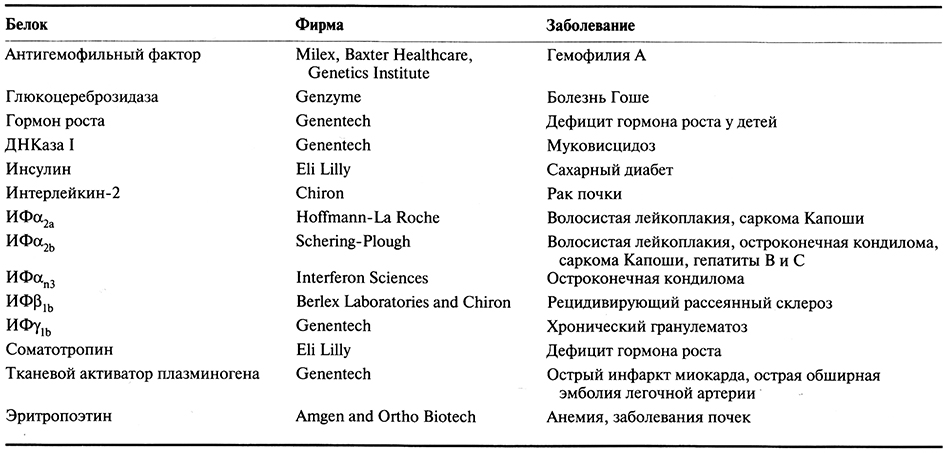
Таблица 10.2. Некоторые рекомбинантные белки, получившие разрешение
Департамента по контролю за качеством пищевых продуктов, медикаментов
и косметических средств (США) на применение для лечения заболеваний человека
Разработка новых методов профилактики и лечения многих заболеваний человека внесла огромный вклад в рост благосостояния людей в XX в. Однако этот процесс никогда нельзя считать завершенным. Так называемые «старые» заболевания (например, туберкулез) могут дать о себе знать вновь, как только будут ослаблены профилактические меры или появятся резистентные штаммы. Весьма привлекательной выглядит перспектива применения в качестве терапевтических средств специфических антител; их можно будет использовать для нейтрализации токсинов, борьбы с бактериями, вирусами, для лечения раковых заболеваний. Антитело можно уподобить самонаводящейся ракете, которая либо нейтрализует «нарушителя» – чужеродный агент, либо, если она оснащена «боеголовкой», разрушает специфическую клетку-мишень. К сожалению, несмотря на многообещающие возможности, антитела довольно редко применялись для профилактики и лечения болезней и других патологий. И лишь в последнее время, с развитием технологии рекомбинантных ДНК и разработкой методов получения моноклональных антител и с расшифровкой молекулярной структуры и функции иммуноглобулинов, интерес к применению специфических антител для лечения различных заболеваний вновь пробудился.
ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
Выделение кДНК интерферонов
Для выделения генов или кДНК белков человека используют разные подходы. В ряде случаев выделяют нужный белок и определяют аминокислотную последовательность соответствующего участка молекулы. Исходя из этого находят кодирующую его нуклеотидную последовательность, синтезируют соответствующий олишнукеотид и используют его в качестве гибридизационного зонда для выделения нужного гена или кДНК из геномных или кДНК-библиотек. Другой подход состоит в выработке антител к очищенному белку и использовании их для скрининга библиотек, в которых происходит экспрессия определенных генов. Для белков человека, синтезируемых преимущественно в какой-то одной ткани, кДНК-библиотека, полученная на основе мРНК, выделенной из этой ткани, будет обогащена последовательностью ДНК-мишени. Например, основным белком, синтезируемым клетками островков Лангерганса поджелудочной железы, является инсулин, и 70% мРНК, выделенных из этих клеток, кодируют именно его.
Однако принцип обогащения кДНК неприменим для тех белков человека, количество которых очень мало или место синтеза которых неизвестно. В этом случае могут понадобиться другие экспериментальные подходы. Интерфероны (ИФ) человека, включающие α-, β- и у-интерфероны (ИФα, ИФβ, ИФγ), – это природные белки, каждый из которых может найти свое терапевтическое применение (табл. 10.3). При выделении их кДНК пришлось разработать новый подход, позволяющий преодолеть трудности, связанные с недостаточным содержанием соответствующих мРНК и белков. Процедура выделения кДНК интерферонов состояла в следующем.
1. Из лейкоцитов человека выделили мРНК и фракционировали ее по размерам; провели обратную транскрипцию и встроили в сайт Pstl плазмиды pBR322.
2. Полученным продуктом трансформировали Escherichia coli. Образовавшиеся 6000 клонов подразделили на 12 групп: по 512 клонов в каждой. Тестирования проводили на группе клонов, что позволило ускорить процесс их идентификации.
3. Каждую группу клонов гибридизовали с неочищенным препаратом ИФ-мРНК.
4. Из образовавшихся гибридов, содержащих клонированную ДНК и мРНК, выделили мРНК и провели ее трансляцию в бесклеточной системе синтеза белка.
5. Определили интерферонную противовирусную активность каждой смеси, полученной в результате трансляции. Группы, проявившие интерферонную активность, содержали клон с кДНК, гибридизовшейся с ИФ-мРНК.
6. Позитивные группы разбили на 8 подгрупп, содержащих по 64 клона, и вновь провели тестирование. Разбиение на подгруппы повторяли до тех пор, пока не идентифицировали клон, содержащий полноразмерную ИФ-кДНК человека.
Таблица 10.3. Возможное терапевтическое применение
некоторых интерферонов человека

Если нужно получить большие количества ИФ, соответствующую кДНК можно субклонировать в экспрессирующем Е. coli-векторе, который позволяет достичь высокого уровня экспрессии.
Интерфероны человека,
полученные методом генной инженерии
Первый ген интерферона был выделен в начале 80-х гг. С тех пор было обнаружено несколько разных интерферонов. Как мы уже говорили, исходя из химических и биологических свойств всех их можно подразделить на три группы: ИФα, ИФβ и ИФγ. ИФα а и ИФβ синтезируются клетками, обработанными препаратами вирусов или вирусной РНК, а ИФγ вырабатывается в ответ на действие веществ, стимулирующих рост клеток. ИФα кодируется семейством генов, включающим как минимум 15 неаллельных генов, в то время как ИФβ и ИФγ кодируются одним геном каждый. Подтипы ИФα проявляют разную специфичность. Например, при проверке эффективности ИФα1 и ИФα2 на обработанной вирусом линии клеток быка эти интерфероны проявляют сходную противовирусную активность, в случае же обработанных вирусом клеток человека ИФα2 оказывается в семь раз активнее, чем ИФα. Если противовирусная активность проверяется на клетках мыши, то ИФα2 оказывается в 30 раз менее эффективным, чем ИФα1.
Было предпринято несколько попыток создать ИФ с комбинированными свойствами, используя тот факт, что члены семейства ИФα различаются по степени и специфичности своей противовирусной активности. Теоретически этого можно достичь, соединив части последовательностей генов разных ИФα. Это приведет к образованию гибридного белка с другими свойствами, чем у каждого из исходных белков. Сравнение последовательностей кДНК ИФα, и ИФα2 показало, что они содержат одинаковые сайты рестрикции в позициях 60, 92 и 150. После расщепления обеих кДНК в этих сайтах и последующего лигирования фрагментов было получено несколько гибридных генов (рис. 10.1). Эти гены экспрессировали в Е. coli, синтезированные белки очистили и исследовали их биологические функции. Проверка защитных свойств гибридных ИФ на культуре клеток млекопитающих показала, что некоторые из них проявляют большую активность, чем родительские молекулы. Кроме того, многие гибридные ИФ индуцировали образование 2'–5'-олигоизоаденилат-синтетазы в контрольных клетках. Этот фермент участвует в синтезе 2'–5'-связанных олигонуклеотидов, которые в свою очередь активируют латентную клеточную эндорибонуклеазу, расщепляющую вирусную мРНК. Другие гибридные ИФ проявляли большую, чем родительские молекулы, антипролиферативную активность в культурах различных раковых клеток человека.
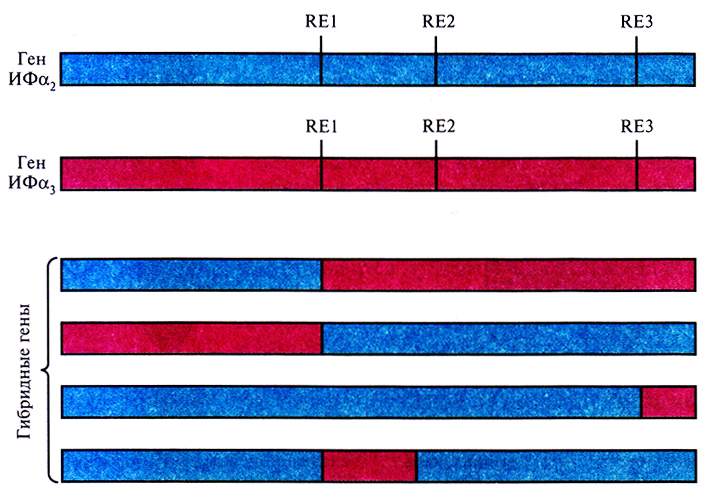
Рис. 10.1. Структура генов ИФα2, ИФα3 и четырех гибридных генов. Сравнение нуклеотидных последовательностей генов ИФα2 и ИФα3 обнаруживает наличие у них одинаковых сайтов для рестрицирующих эндонуклеаз (RE1, RE2, RE3). Рестрикция по этим сайтам и дотирование полученных фрагментов приводят к образованию различных гибридных генов. В нижней части рисунка представлены четыре из них.
Гормон роста человека,
полученный методом генной инженерии
Стратегию конструирования новых белков путем замены функциональных доменов или с помощью направленного мутагенеза можно использовать для усиления или ослабления биологического действия белка. Например, нативный гормон роста человека (ГРЧ) связывается в разных типах клеток как с рецептором гормона роста, так и с пролактиновым рецептором.
Чтобы избежать нежелательных побочных эффектов в процессе лечения, нужно исключить присоединение ГРЧ к пролактиновому рецептору. Поскольку участок молекулы гормона роста, связывающийся с этим рецептором, по своей аминокислотной последовательности лишь частично совпадает с участком молекулы, который взаимодействует с пролактиновым рецептором, удалось избирательно снизить связывание гормона с последним. Для этого использовали сайт-специфический мутагенез, в результате которого произошли определенные изменения в боковых группах некоторых аминокислот (His-18, His-21 и Glu-174) – лигандов для ионов Zn2+, необходимых для высокоаффинного связывания ГРЧ с пролакгиновым рецептором (рис. 10.2). Модифицированный гормон роста связывается только со «своим» рецептором. Полученные результаты представляют несомненный интерес, но смогут ли модифицированные ГРЧ найти применение в клинике, пока неясно.
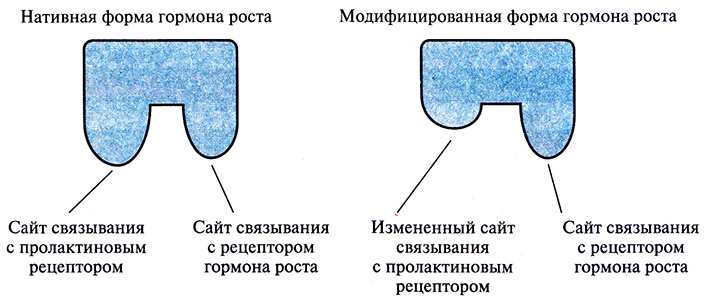
Рис. 10.2. Схематическое изображение нативной и модифицированной форм гормона роста человека (ГРЧ). С помощью олигонуклеотид-направленного мутагенеза получена форма ГРЧ, утратившая способность связываться с пролактиновым рецептором, но сохранившая специфичность к рецептору гормона роста.
Оптимизация генной экспрессии
Недостаточно создать новый белок, важно оптимизировать экспрессию его гена. Для начала исследователи определяют возможность синтеза достаточных количеств аутентичного белка в прокариотической или эукариотической системах экспрессии. Прокариотическим системам отдается предпочтение, поскольку работа с ними обходится дешевле, а производительность выше. К сожалению, не все микроорганизмы синтезируют функциональные формы гетерологичных белков с одинаковой эффективностью, поэтому необходимо проводить сравнительные количественные оценки.
При изучении экспрессии гена интерлейки на-3 человека в различных клетках-хозяевах «наилучшим» хозяином оказалась Bacillus licheni-formis (табл. 10.4). Хотя в одной из систем Е. coli был достигнут несколько более высокий уровень экспрессии, полученный белок мол. массой 20 кДа представлял собой продукт слияния интерлейкина-3 с участком р-галактозидазы Е. coli, а не зрелый аутентичный белок мол. массой 15 кДа. Как правило, подобный химерный белок нельзя использовать в качестве лекарственного средства. Клетки дрожжей Kluyveromyces la сtis и Saccharomyces cerevisiae, а также клетки человека были способны гликозилировать интерлейкин-3, однако уровень экспрессии в них был относительно низок. Гликозилирование не оказывает заметного влияния на активность интерлейкина-3, но ведет к ощутимой разнице в размерах молекулы.
Таблица 10.4. Уровень экспрессии гена интерлейкина-3 в разных системах клеток-хозяев1)

ФЕРМЕНТЫ
ДНКаза I
Наиболее частым летальным наследственным заболеванием среди европеоидов является муковисцидоз. В США выявлено 30 000 случаев этого заболевания, в Канаде и странах Европы – 23 000. Пациенты с муковисцидозом часто страдают инфекционными заболеваниями, поражающими легкие. Лечение рецидивирующих инфекций антибиотиками в конце концов приводит к появлению резистентных штаммов патогенных бактерий. Бактерии и продукты их лизиса вызывают накопление в легких вязкой слизи, затрудняющей дыхание. Одним из компонентов слизи является высокомолекулярная ДНК, которая высвобождается из бактериальных клеток при лизисе. Ученые из биотехнологической компании Genentech (США) выделили и экспрессировали ген ДНКазы – фермента, который расщепляет высокомолекулярную ДНК на более короткие фрагменты. Очищенный фермент вводят в составе аэрозоля в легкие больных муковисцидозом, он расщепляет ДНК, вязкость слизи снижается, что облегчает дыхание. Хотя эти меры и не излечивают муковисцидоз, они облегчают состояние больного. Применение данного фермента было недавно одобрено Департаментом по контролю за качеством пищевых продуктов, медикаментов и косметических средств (США), и объем его продаж составил в 2000 г. примерно 100 млн. долларов.
Алъгинат-лиаза
Альгинат – это полисахарид, синтезируемый целым рядом морских водорослей, а также почвенными и морскими бактериями. Его мономерными единицами являются два сахарида – β-D-маннуронат и α-L-гулуронат, относительное содержание и распределение которых и определяют свойства конкретного альгината. Так, остатки α-L-гулуроната образуют межцепочечные и внутрицепочечные сшивки путем связывания ионов кальция; остатки β-D-маннуроната связывают ионы других металлов. Альгинат, содержащий такие сшивки, образует эластичный гель, вязкость которого прямо пропорциональна размеру полисахаридных молекул.
Выделение альгината слизистыми штаммами Pseudomonas aeruginosa существенно повышает вязкость слизи у больных муковисцидозом. Чтобы очистить дыхательные пути и облегчить состояние больных, в дополнение к обработке ДНКазой I следует провести деполимеризацию альгината с помощью альгинат-лиазы.
Ген альгинат-лиазы был выделен из Flavobacterium sp., грамотрицательной почвенной бактерии, ативно вырабатывающей этот фермент. На основе Е. coli был создан банк клонов Flavobacterium и проведен скрининг тех из них, которые синтезируют альгинат-лиазу, путем высевания всех клонов на твердую среду, содержащую альгинат, с добавлением ионов кальция. В таких условиях весь альгинат, находящийся в среде, за исключением того, который окружает продуцирующие альгинат-лиазу колонии, образует сшивки и становится мутным. Гидролизованный альгинат теряет способность к формированию сшивок, поэтому среда вокруг синтезирующих альгинатлиазу колоний остается прозрачной Анализ клонированного фрагмента ДНК, присутствующего в одной из положительных колоний, показал наличие открытой рамки считывания, кодирующей полипептид мол. массой около 69 000. Более детальные биохимические и генетические исследования показали, что этот полипептид, по-видимому, является предшественником трех альгинат-лиаз, вырабатываемых Flavobacterium sp. (рис. 10.3). Сначала какой-то протеолитический фермент отрезает от него N-концевой пептид массой около 6000. Оставшийся белок мол. массой 63 000 способен деполимеризовать альгинат, вырабатываемый как бактериями, так и морскими водорослями. При его последующем разрезании образуется продукт мол. массой 23 000, деполимеризующий альгинат морских водорослей, и фермент мол. массой 40 000, разрушающий альгинат бактерий. Для получения больших количеств фермента мол. массой 40 000 кодирующую его ДНК амплифицировали методом полимеразной цепной реакции (ПЦР), а затем встраивали в выделенный из В. subtilis плазмидный вектор, несущий ген, кодирующий сигнальный пептид а-амилазы В. subtilis. Транскрипцию контролировали при помощи системы экспрессии гена пенициллиназы (рис. 10.4). При трансформации клеток В. subtilis полученной плазмидой и высевании их на содержащую альгинат твердую среду с добавлением ионов кальция образовались колонии с большим ореолом. Когда такие колонии выращивали в жидкой среде, рекомбинантная альгинат-лиаза выделялась в культуральную среду. Последующие тесты показали, что этот фермент способен эффективно разжижать альгинаты, синтезируемые слизистыми штаммами Р aeruginosa, которые были выделены из легких больных муковисцидозом. Для того чтобы определить, целесообразно ли проводить клиническое тестирование рекомбинантной альгинат-лиазы, нужны дополнительные исследования.
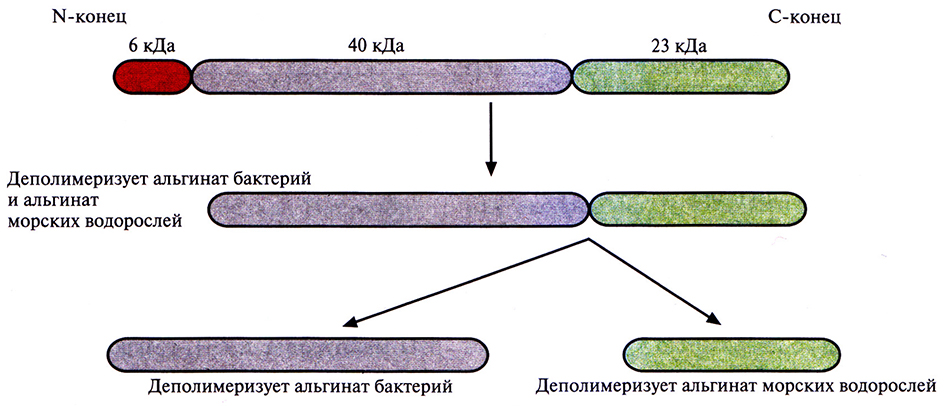
Рис. 10.3. Процессинг белка – предшественника рекомбинантной альгинат-лиазы Flavobacterium, происходящий в Е. coli. В результате отщепления от белка мол. массой 69 кДа пептида 6 кДа образуется белок мол. массой 63 кДа, способный деполимеризовать альгинат морских водорослей и бактериальный альгинат. Расщепление белка 63 кДа дает белок мол. массой 23 кДа, активно деполимеризующий альгинат морских водорослей, и белок мол. массой 40 кДа, гидролизующий бактериальный альгинат.

Рис. 10.4. ДНК, кодирующая альгинат-лиазу мол. массой 40 кДа. К последовательности, кодирующей N-конец альгинатлиазы, присоединен сегмент гена α-амилазы В. subtilis, кодирующий ее сигнальный пептид. Транскрипция контролируется при помощи системы экспрессии гена пенициллиназы В. subtilis.
МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА
КАК ЛЕКАРСТВЕННЫЕ СРЕДСТВА
Примерно 100 лет назад была предпринята попытка лечения детей, больных дифтерией, с помощью неочищенной антисыворотки, полученной от лошадей, которых инфицировали Corynebacterium diphtheriae, вызывающей дифтерию у человека. С. diphtheriae инфицирует горло и миндалины, выделяя экзотоксин, приводящий к гибели клеток человека. Проникая в кровоток, этот токсин поражает органы, удаленные от места первичной инфекции, и в отсутствие лечения болезнь может иметь летальный исход. (В те времена, о которых идет речь, смертность достигала 45%.) Однако, если больному в первые несколько дней после начала инфекции ввести лошадиную антисыворотку, содержащую антитела к этому экзотоксину, то у него возникнет пассивный иммунитет, который позволяет избежать летального исхода.
К сожалению, риск, связанный с использованием антител, не позволяет широко применять этот метод терапии. Дело в том, что в организме больного часто вырабатываются собственные антитела на чужеродные белки, присутствующие в цельной или частично очищенной антисыворотке, и ее повторное введение в случае сенсибилизации организма может привести к развитию анафилактического шока и гибели пациента.
С развитием гибридомной технологии вновь появилась надежда на то, что антитела можно будет использовать в качестве терапевтических средств для поддержания постоянного уровня чистых моноспецифичных антител в организме. Однако остаются проблемы, связанные с риском развития перекрестных реакций, приводяших к развитию иммунного ответа и анафилаксии: ведь в организме больного могут вырабатываться собственные антитела на детерминанты моноклональных антител мыши. Поэтому основная задача в настоящее время состоит в том, чтобы разработать методы получения моноклональных антител человека, обладающих как специфическими иммунотерапевтическими свойствами, так и пониженной иммуногенностью.
Структура и функции антител
Молекула антитела (иммуноглобулин) состоит из двух «легких» (L) и двух «тяжелых» (Н) белковых цепей, которые соединены водородными связями и расположенными в строго определенных местах дисульфидными мостиками. N-концевые участки L- и Н-цепей образуют антигенсвязывающий сайт. Отдельные домены (области) молекулы антитела выполняют разные функции, что облегчает манипуляции с генами антител (рис. 10.5). Антигенсвязывающие сайты состоят из трех участков, определяющих комплементарность антител к антигену (CDR, от англ. complementarity-determining regions), и образующих вариабельные (VH и VL) области на N-концах Н- и L-цепей. Для CDR характерна очень высокая изменчивость последовательности аминокислот, поэтому их еще называют гипервариабельными. Помимо вариабельных (VH и VL), каждая L-цепь содержит одну константную область, или домен (CL), а каждая Н-цепь – три константных области, или домена (СН1, СН2 и СH3). При обработке антитела протеолитическим ферментом папаином образуются три фрагмента: два идентичных (Fab), каждый из которых содержит интактную L-цепь, связанную дисульфидным мостиком с VH- и СН1-доменами Н-цепи, и один Fc, состоящий из двух соединенных дисульфидной связью СH2- и СH3-доменов Н-цепи. Fab-фрагмент, точнее его N-концевая часть, называемая Fv-фрагментом, обладает антиген-связывающей активностью, присущей интактной молекуле антитела (рис. 10.5). При этом его аминокислотная последовательность у разных молекул существенно различается.
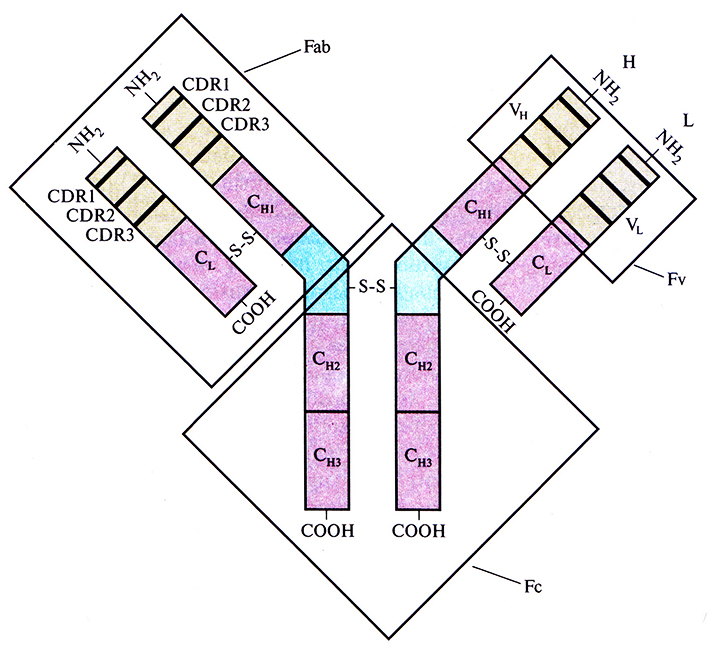
Рис. 10.5. Строение молекулы антитела. Н- и L-цепи состоят из вариабельных (VH и VL ) и константных (CL, СН1, СH2 и СH3) доменов. Вариабельные домены содержат CDR-участки (CDR1, CDR2 и CDR3).
После связывания антигена с интактным антителом запускаются следующие реакции иммунного ответа.
- Активируется система комплемента. Компоненты этой системы разрушают клеточные мембраны, активируют фагоциты и генерируют сигналы, мобилизующие другие компоненты системы иммунного ответа.
- В результате связывания Fc-участка антитела с Fc-рецептором эффекторной клетки запускается реакция опосредованной антителами клеточной цитотоксичности. Активированная эффекторная клетка высвобождает вещества, лизирующие чужеродную клетку, с которой связан Fab-участок молекулы антитела.
- После связывания Fab-участка с растворимым антигеном Fc-участок антитела может присоединяться к Fc-рецепторам фагоцитов, которые захватывают и разрушают комплекс антиген–антитело.
Профилактика отторжения трансплантированных органов
В 1970-х гг. были пересмотрены взгляды на пассивную иммунизацию: ее стали считать профилактическим средством борьбы с отторжением трансплантированных органов. Предлагалось вводить пациентам специфические антитела, которые будут связываться с лимфоцитами определенного типа, уменьшая иммунный ответ, направленный против пересаженного органа.
Первыми веществами, рекомендованными Департаментом по контролю за качеством пищевых продуктов, медикаментов и косметических средств (США) для использования в качестве иммуносупрессоров при пересадке органов у человека, были моноклональные антитела мыши ОКТЗ. За отторжение органов отвечают так называемые Т-клетки – лимфоциты, дифференцирующиеся в тимусе. ОКТЗ связываются с рецептором, находящимся на поверхности любой Т-клетки, который называется CD3. Это предупреждает развитие полного иммунного ответа и отторжение трансплантированного органа. Подобная иммуносупрессия весьма эффективна, хотя и оказывает некоторые побочные действия, например вызывает лихорадку и приводит к появлению сыпи.
Лекарственные вещества,
связанные с моноклональными антителами
Лекарственные вещества, проявляющие высокую активность при тестировании in vitro (обычно в культуре клеток), зачастую оказываются значительно менее эффективными in vivo. Кажущееся снижение их активности объясняется тем, что они не достигают органа или клетки-мишени в нужной концентрации. Увеличение дозы принимаемого препарата не решает проблему, поскольку при этом часто возникают побочные эффекты. Более того, чтобы избежать таких эффектов, многие терапевтические средства заведомо вводят в дозах, не достигающих оптимальных, что дополнительно снижает их эффективность.
Для облегчения доставки лекарственного вещества к месту его действия используют несколько приемов.
1. Заключают его в особые частицы – липосомы, липидная оболочка которых имеет высокое сродство к нужным органам.
2. Встраивают гены специфических токсинов в инфильтрирующие опухоль лимфоциты, которые высвобождают эти токсины непосредственно в опухоли.
3. Присоединяют молекулы лекарственных веществ к моно-клональным антителам, специфичным по отношению к белкам, находящимся на поверхности строго определенных клеток, например опухолевых (рис. 10.6).
4. Используют лекарственные вещества в неактивной форме, переводя их в активное состояние при помощи ферментов. Чтобы такое превращение происходило только вблизи клетки-мишени, фермент присоединяют к моноклональному антителу, специфичному к поверхностному антигену этой клетки (рис. 10.6).
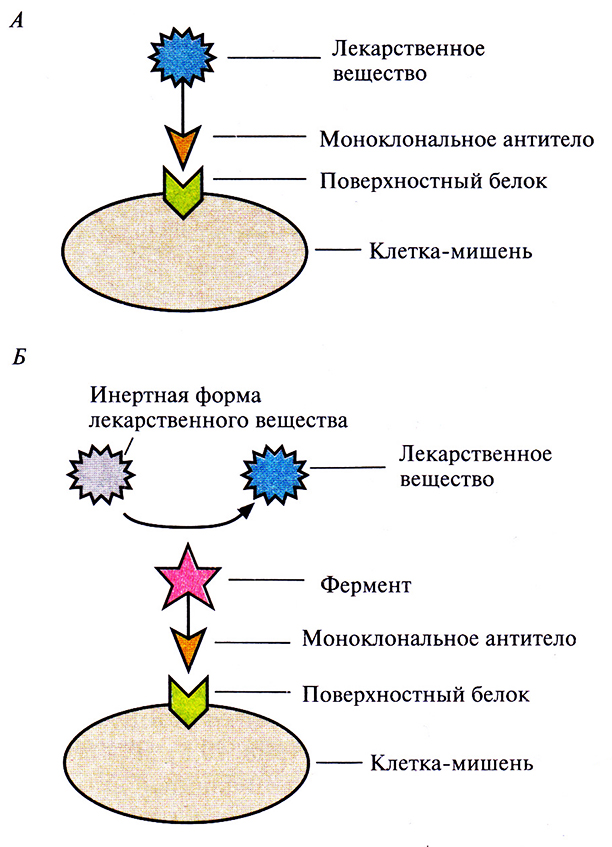
Рис. 10.6. Схематическое изображение системы целевой доставки лекарственного вещества, основанной на использовании моноклональных антител.
А. Молекула лекарственного вещества присоединена к моноклональному антителу.
Б. К моноклональному антителу присоединен фермент, превращающий инертную форму лекарственного вещества в активную только в непосредственной близости от клетки-мишени. В обоих случаях моноклональное антитело связывается с одним специфическим белком на поверхности клетки-мишени.
Для эффективной работы последней из описанных систем необходимо, чтобы а) моноклональное антитело, связанное с ферментом, переводящим лекарственное вещество в активную форму, было в достаточной степени очищено и имелось в нужном количестве; б) связывалось с высокоспецифичным для клетки-мишени белком; в) было стабильным в физиологических условиях, но в то же время быстро выводилось из кровотока; 2) при необходимости могло проникать в опухолевую ткань, обеспечивая действие препарата на все ее клетки. В этом случае мишенями оказываются строго определенные клетки, что позволяет использовать лекарственное вещество в гораздо меньших дозах, чем при прямом введении. Применение в такой системе моноклональных антител мыши может приводить к развитию иммунного ответа, поэтому очень важно использовать фрагменты антител человека или антител, максимально сходных с ними по структуре.
Наиболее частой причиной смерти в странах Северной Америки и Европы является тромбоэмболия мозговых или сердечных артерий. Тромб состоит из молекул фибрина, фактора свертывающей системы крови, образующего сеть в ответ на повреждение сосудистой стенки. В норме молекулы фибрина в образовавшемся тромбе расщепляются с помошью плазмина сериновой протеиназы, который образуется из плазминогена под действием активатора (рис. 10.7). Однако нередко эта биологическая система работает недостаточно эффективно, что приводит к закупорке артерий. В таких ситуациях для повышения уровня плазмина в крови было предложено использовать активатор плазминогена в качестве терапевтического средства.
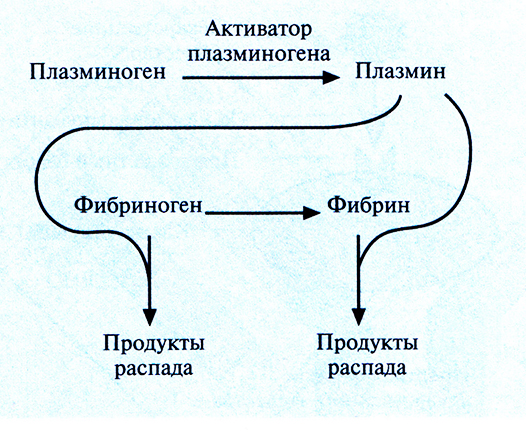
Рис. 10.7. Активация плазминогена с превращением его в плазмин и разрушение плазмином двух субстратов (фибриногена и фибрина) в крови.
Однако плазмин способен разрушать и предшественник фибрина фибриноген (рис. 10.7), и если уровень последнего в результате терапии с использованием активатора плазминогена снизится слишком сильно, могут произойти обширные внутренние кровотечения. Это привело к необходимости создания тромболитических препаратов, разрушающих только фибрин в тромбе. Ученые исходили из того, что если к активатору плазминогена «пришить» антитело, специфичное к фибрину, то будет происходить только локальное повышение концентрации плазмина вблизи тромба (рис. 10.8). Для проверки этой гипотезы тканеспецифичный активатор плазминогена был присоединен к моноклональному антителу, специфичному в отношении фибрина. Испытания на модельных системах показали, что комплекс присоединялся к сгусткам крови и лизировал их, не вызывая значительного разрушения фибриногена. Были созданы и другие типы конъюгатов антитело–активатор плазминогена, тоже приводящие к локальному образованию плазмина, разрушающего кровяные сгустки.
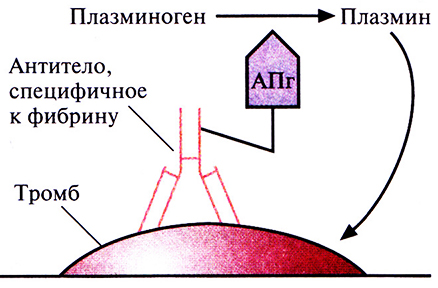
Рис. 10.8. Структура иммунотерапевтического тромболитического агента. К моноклональному антителу, специфичному к фибрину, присоединен активатор плазминогена (АПг). Этот комплекс связывается с фибрином, находящимся в тромбе, активатор плазминогена вызывает накопление плазмина вблизи тромба, и плазмин лизирует тромб.
Моноклоналъные антитела человека
Несмотря на кажущуюся перспективность иммунотерапии, этот метод имеет и ряд ограничений, связанных с применением моноклональных антител животных и процедурой присоединения к ним нужных молекул. Сам процесс химического присоединения весьма неэффективен, присоединение происходит случайным образом, а кроме того, при этом может снижаться ферментативная активность активатора плазминогена или других веществ, используемых в терапии. И наконец, если предполагается многократное введение препарата, необходимо использовать антитела человека, а не животных, чтобы предотвратить возникновение перекрестных иммунных реакций и сенсибилизацию пациента.
Создание специфических антител, не вызывающих перекрестных реакций, представляет собой довольно трудную задачу, поскольку получение антител человека путем традиционной гибридомной технологии сталкивается с радом проблем.
- Хромосомы человека в клетках, полученных слиянием лимфоцитов человека с клетками миеломы мыши, нестабильны, поэтому трудно получить клетки, способные вырабатывать моноклональные антитела человека.
- Пока не удалось получись эффективые клеточные линии миеломы человека, которые могли бы заменить мышиные.
- Иммунизация человека различными антигенами не проводится по соображениям этического характера.
Таким образом, для получения антител человека необходимо разрабатывать другие подходы В одной из схем В-лимфоциты человека, активно продуцирующие специфические антитела, обработали флуоресцентно меченным антигеном, затем с помощью клеточного сортера провели обогащение образца В-лимфоцитами, вырабатывающими эти антитела. Поскольку В-клетки плохо растут в культуре, для улучшения роста их трансформировали вирусом Эпштейна–Барр. Некоторые клоны трансформированных В-клеток вырабатывают моноклональные антитела человека, взаимодействующие с селектирующим антигеном. К сожалению, выход моноклональных антител был очень небольшим и они обладали низкой антигенсвязывающей активностью. К тому же вероятность того, что в неиммунизированном организме найдутся секретирующие антитела клетки, которые будут распознавать селектирующий антиген, очень мала.
Еще один подход заключается во введении иммунных клеток человека мутантным мышам, которые практически лишены собственной иммунной системы. После трансплантации иммунных стволовых клеток человека таким мышам, страдающим тяжелым сочетанным иммунодефицитом (scid-мыши), они приобретают клетки иммунной системы человека и в ответ на введение антигена могут вырабатывать антитела человека.
Предпринимаются попытки ввести зародышам мышей гены иммуноглобулинов человека с целью создания трансгенных мышей, которые в ответ на иммунизацию конкретным антигеном смогут вырабатывать иммуноглобулины человека. Чтобы получить от трансгенных животных клетки, секретирующие специфические моноклональные антитела, можно использовать стандартную гибридомную технологию, затем провести скрининг таких положительных клеточных линий и определить, какие из них вырабатывают антитела, кодируемые генами иммуноглобулинов человека. Недавно появилось сообщение о том, что уже получена трансгенная мышь, экспрессирующая нативные формы Н- и L-цепей иммуноглобулинов человека.
Трансплантация стволовых клеток иммунной системы человека scid-мышам и получение линий трансгенных мышей – весьма трудоемкие способы производства моноклональных антител человека. Поэтому ученые пытаются создать генноинженерные методы получения антител человека, которые можно использовать в качестве терапевтических средств, и эффективных бифункциональных белков, способных связываться с мишенью и разрушать ее.
ВАЖНАЯ ВЕХА
Полипептид, обладающий действием лейкоцитарного интерферона человека, синтезируется в Е. coli.
S. Nagata, Н. Taira, A. Hall, L. Johnsrud, M. Streuli, J. Ecsodi, W. Boll, K. Cantell, C. Weissmann
Nature 284: 316–320, 1980
В конце 70-х–начале 80-х гг. молекулярная биотехнология стала привлекать к себе внимание общественности и крупных инвесторов. Одним из биотехнологических продуктов был интерферон, на который в то время возлагали надежды как на чудодейственное средство против множества вирусных заболеваний и рака. О выделении кДНК интерферона человека и его последующей экспрессии в Escherichia coli сообщали газеты и журналы всего мира.
Некоторые особенности интерферона сделали выделение его кДНК особенно сложным. Во-первых, несмотря на то что интерферон был очищен более чем в 80 000 раз, его удавалось получать лишь в очень небольших количествах, поэтому в то время не была известна его точная моп. масса. Во-вторых, в отличие от многих белков интерферон не обладает легко идентифицируемой химической или биологической активностью: ее оценивали только по снижению цитопатического действия вируса животных на культуру клеток, а это сложный и длительный процесс. В-третьих, в отличие от инсулина было неизвестно, есть ли клетки человека, способные вырабатывать интерферон в достаточно больших количествах, т. е. существует ли источник мРНК интерферона. Несмотря на все эти трудности, в конце концов была выделена и охарактеризована кДНК, кодирующая интерферон. С тех пор было обнаружено несколько разных типов интерферонов. Были выделены гены нескольких интерферонов и показана их эффективность при лечении различных вирусных заболеваний, но, к сожалению, интерферон не стал панацеей.
Гибридные моноклональные антитела человека и мыши
Тот факт, что разные участки молекулы иммуноглобулина выполняют разные функции, позволяет модифицировать моноклональное антителомыши таким образом, что оно приобретает некоторые сегменты антитела человека, сохраняя в то же время свою исходную антигенсвязывающую специфичность. Такое гибридное антитело называют химерным. Первым участком моноклонального антитела мыши, который был заменен соответствующим участком антитела человека, был Fc-фрагмент. Выбор объяснялся тем, что Fc-фрагмент антитела мыши выполнял роль эффектора иммунного ответа у человека недостаточно хорошо; кроме того, он с большой вероятностью индуцировал образование антител в организме человека. Чтобы снизить иммуногенность и усилить эффекторные функции, провели замену последовательностей ДНК, кодирующих Fv-области L- и Н-цепей иммуноглобулина человека, на аналогичные фрагменты специфического моноклонального антитела мыши (рис. 10.9). Такую замену можно осуществить разными путями: реплицировать ДНК in vitro с применением олигонуклеотидов в качестве затравки либо использовать субклонированные фрагменты ДНК. Сегменты ДНК, кодирующие химерные цепи, встраивали в экспрессирующий вектор и вводили в культуру В-лимфоцитов, из которой выделяли наработанные антитела.
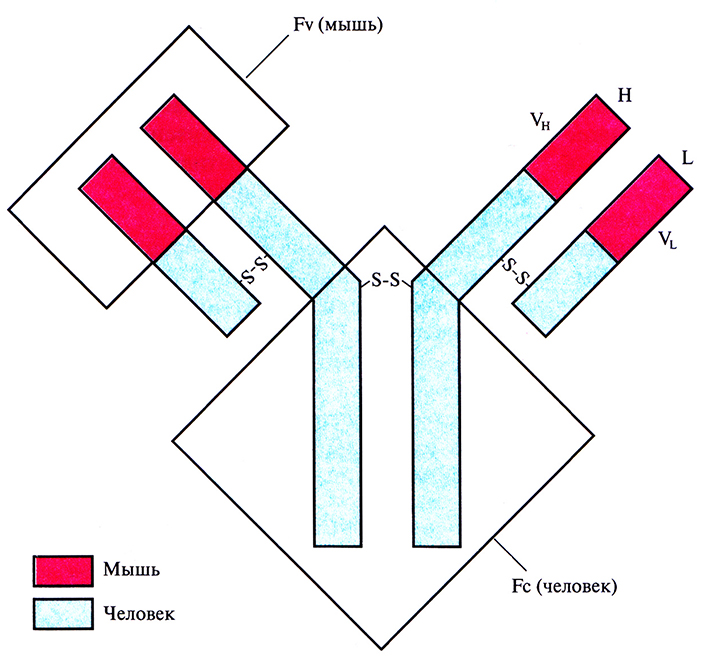
Рис. 10.9. Полученное методом генной инженерии антитело, сходное по своей структуре с антителом человека. Участки генов L- и Н-цепей иммуноглобулина человека, кодирующие VL- и VH-домены, заменены последовательностями ДНК, кодирующими VL- и VH-домены иммуноглобулина мыши. Продуктом рекомбинантных генов является химерный иммуноглобулин, обладающий антигенсвязывающей специфичностью моноклонального антитела мыши, эффекторными свойствами Fc-фрагмента иммуноглобулина человека и пониженной иммуногенностью для человека.
Химерные антитела, несущие антигенсвязывающий участок моноклонального антитела мыши к поверхностному антигену клеток рака толстой кишки человека, тестировали на больных с раком толстой и прямой кишки. Антитела оставались в кровотоке примерно в шесть раз дольше обычных антител мыши, тем самым оказывая свое действие в течение большего времени. При этом лишь у одного пациента из 10 наблюдался слабо выраженный иммунный ответ. К сожалению, в этих испытаниях не удалось получить противоопухолевого эффекта антител; возможно, это было связано с введением их в слишком малых дозах или с тем, что раковый процесс находился на поздних стадиях. В опытах in vitro химерные антитела проявляли высокую эффекторную активность, что позволяет надеяться на успешное их применение в других случаях.
Конструирование химерных молекул, о которых шла речь выше, – это первый этап в создании моноклональных антител мышей и крыс, обладающих сходством с антителами человека. Другой подход состоит в замещении только CDR-участков человеческих антител фрагментами моноклональных антител грызунов (рис. 10.10). Такие «восстановившие форму» антитела человека могут стать эффективным терапевтическим средством, поскольку они по своей антигенсвязывающей способности приближены к исходным моноклональным антителам грызунов.
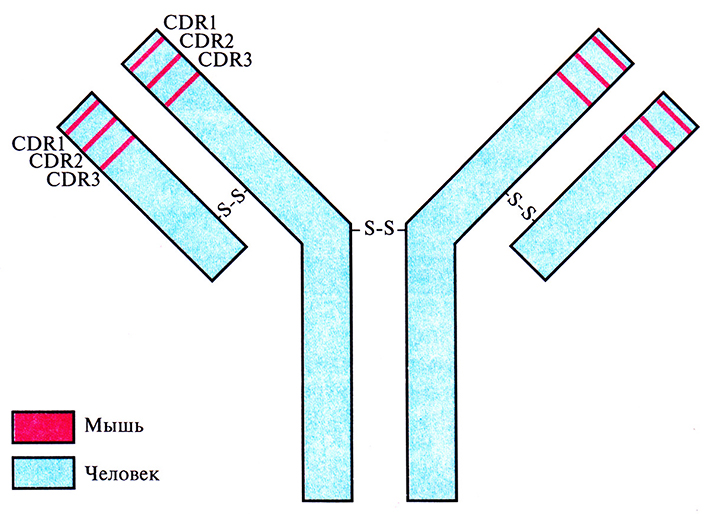
Рис. 10.10. Полученное методом генной инженерии антитело, сходное по своей структуре с антителом человека. Сегменты ДНК, кодирующие CDR-участки (CDR1, CDR2 и CDR3) антитела человека, заменены на последовательности, кодирующие CDR-участки Н- и L-цепей иммуноглобулина мыши. Продуктом этого рекомбинантного гена является иммуноглобулин с антигенсвязывающей специфичностью моноклонального антитела мыши (участки, выделенные розовым цветом) и остальными свойствами антитела человека (участки, выделенные голубым цветом).
Моноклональные антитела грызунов, сходные с антителами человека, можно получить, выделив кДНК L- и Н-цепей из клеточной линии гибридомы грызунов и амплифицировав их вариабельные области с помощью ПЦР. В качестве праймеров для амплификации можно использовать олигонуклеотиды, комплементарные высококонсервативным сегментам ДНК, фланкирующим с 5'- и 3'-концов последовательность, кодирующую вариабельную область. Зная нуклеотидные последовательности кДНК вариабельных областей легкой и тяжелой цепей (VL и VH), легко определить границы CDR, основываясь на том, что соответствующие им последовательности гипервариабельны, в то время как каркасные области относительно консервативны. Исходя из данных о нуклеотидных последовательностях ДНК, кодирующих CDR грызунов, синтезировали шесть пар олигонуклеотидных праймеров. Каждая пара инициировала синтез ДНК, кодирующей одну из шести CDR грызунов: три, локализованных на L-цепи, и три – на Н-цепи. Кроме того, на 5'-конце каждого праймера находилось 12 дополнительных нуклеотидов, комплементарных фланкирующим последовательностям каркасных участков ДНК человека, по которым происходило встраивание CDR-ДНК грызунов (рис. 10.11). Далее с помощью олигонуклеотид-направленного мутагенеза осуществляли последовательную замену CDR-ДНК человека амплифицированной CDR-ДНК грызунов – фактическую «пересадку» CDR от грызунов в каркасные участки молекулы антитела человека. Модифицированную таким образом кДНК антител встраивали в векторы экспрессии и трансформировали ими подходящие клетки-хозяева, обычно Е. coli или клетки млекопитающих, в которых и вырабатывались антитела.
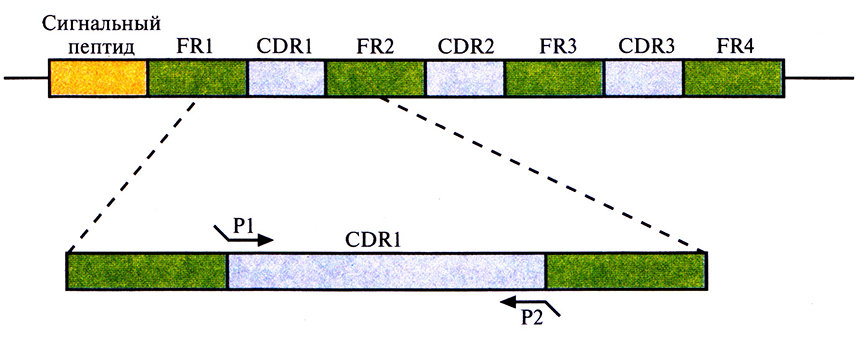
Рис. 10.11. ПЦР-амплификация CDRl-участка, входящего в состав кДНК L-цепи моноклонального антитела грызуна. Олигонуклеотидные праймеры Р1 и Р2 комплементарны последовательностям ДНК CDRl-участка антитела грызуна. Кроме того, каждый праймер содержит на 5'-конце 12 нуклеотидов, комплементарных каркасным участкам (framework region, FR) кДНК L-цепи антитела человека. Используя шесть пар олигонуклеотидных праймеров – три для VL- и три для VH-областей, – с помощью ПЦР амплифицировали отдельно каждый из ДНК-сегментов, кодирующих CDR-участки антитела грызуна. Затем, используя олигонуклеотид-направленный мутагенез, заменили ими соответствующие сегменты генов антитела человека. Такая замена оказалась возможной благодаря тому, что амплифицированные фрагменты содержали участки, комплементарные каркасным областям гена антитела человека.
Данный метод предполагает, что за антиген-связывающую способность антитела отвечают только CDR-участки, а не каркасные области. Однако, если связывание «гибридного» антитела с антигеном происходит недостаточно эффективно, может возникнуть необходимость в замене некоторых аминокислот в каркасных областях с помощью олигонуклеотид-направленного мутагенеза.
К настоящему времени этим методом получено более 50 различных моноклонадьных антител, обладающих сходством с антителами человека. К сожалению, данная технология, являясь весьма эффективной и универсальной, довольно дорогостоящая и требует больших затрат времени. Возможно, более предпочтительным способом получения антител человека и их фрагментов окажется метод, основанный на использовании фаговых «комбинаторных» библиотек, созданных на основе мРНК, полученной из В-клеток неиммунизированных доноров.
ПРОИЗВОДСТВО АНТИТЕЛ С ПОМОЩЬЮ Е. COLI
Гибридомы, подобно большинству других клеточных культур животных, растут относительно медленно, не достигают высокой плотности и требуют сложных и дорогих сред. Получаемые таким образом моноклональные антитела очень дороги, что не позволяет широко использовать их в клинике. Чтобы решить эту проблему, были предприняты попытки создания своего рода «биореакторов» на основе генетически модифицированных бактерий, растений и животных. Для эффективной доставки и функционирования некоторых иммунотерапевтических средств зачастую достаточно одной антигенсвязывающей области антитела (Fab- или Fv-фрагмента), т. е. присутствие Fc-фрагмента антитела необязательно.
На рис. 10.12 представлена методика получения функциональных антител с помощью Е. coli (рис. 10.12).
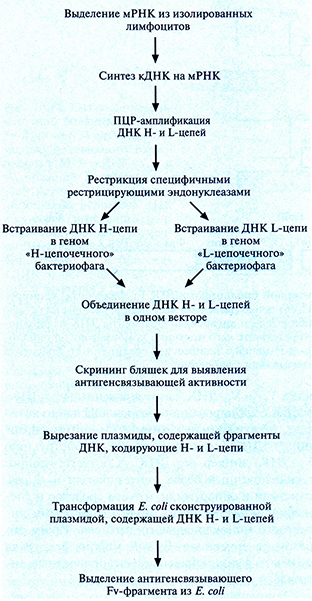
Рис. 10.12. Создание с помощью Е. coli комбинаторной библиотеки кДНК VL- и VH-областей антитела.
1. Используя мРНК, выделенную из вырабатывающих антитела клеток (В-лимфоцитов) мыши или человека, синтезируют кДНК.
2. Проводят раздельную ПЦР-амплифицикацию кДНК, кодирующих Н- и L-цепи.
3. Амплифицированные кДНК обрабатывают специфическими рестрицирующими эндонуклеазами, а затем встраивают в вектор на основе бактериофага X. кДНК Н- и L-цепей содержат разные, характерные для каждой из них эндонуклеазные сайты, что облегчает специфическое встраивание каждой нуклеотидной последовательности в свой вектор. На этом этапе происходит клонирование множества разных сегментов Н- и L-цепей (рис. 10.13, А и Б).
4. кДНК одной Н- и одной L-цепи встраивают в общий «комбинаторный» вектор, так что в бактериофаге синтезируются обе цепи и образуется «полноценный» Fv-фрагмент (рис. 10.13, В).
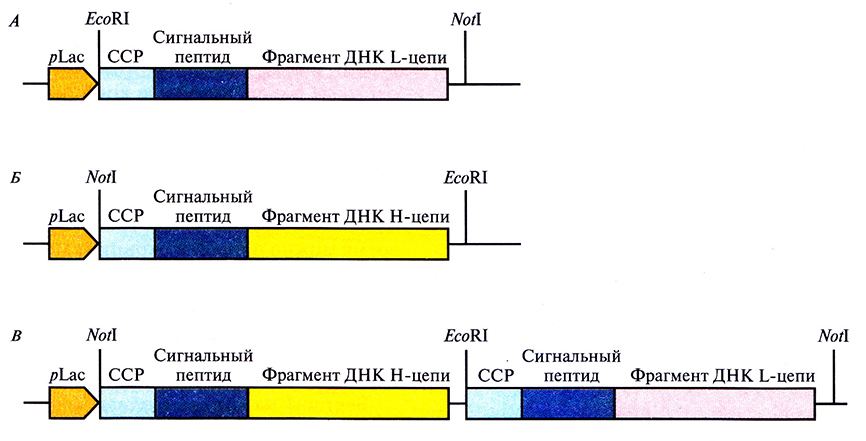
Рис. 10.13. Сконструированные участки ДНК из комбинаторной библиотеки кДНК Fv-фрагмента, клонированные в бактериофаг а. А и Б. Фрагменты ДНК I -(А) и Н-(Б) цепей раздельно встроили в векторы на основе бактериофага α. В. Провели рестрикцию каждой Eco RI-библиотеки и лигировали фрагменты ДНК из библиотеки Н-цепи с фрагментами ДНК из библиотеки L-цепи, в результате чего получили комбинаторную библиотеку, содержащую все возможные сочетания фрагментов L- и Н-цепей с экспрессией соединенного фрагмента в одном векторе. pLac – lас-промотор Е. coli, ССР – сайт связывания с рибосомой.
Синтез Н- и L-цепей происходит во время литического цикла бактериофага X, поэтому можно провести скрининг библиотеки клонов комбинаторных бактериофагов с целью определения их антигене вязывающей активности.
На этапе соединения кДНК Н- и L-цепей в одном векторе образуется широкий спектр генов различных антител. Некоторые из них кодируют уникальные сайты связывания, получить которые с помощью обычной гибридомной технологии было бы невозможно. Пул антител млекопитающих включает 106–108 разных антител. Фаговая библиотека содержит примерно столько же клонов, поэтому можно ожидать, что одна комбинаторная библиотека будет вырабатывать такое же количество различных антител (Fv-мoлекул), как любое млекопитающее. Кроме того, однажды создав исходную комбинаторную библиотеку, можно комбинировать L- и Н-цепи и получать Fv-фрагменты, распознающие необычные эпитопы. Еще большего разнообразия можно достичь, используя неспецифический мутагенез. Поскольку за относительно короткое время можно провести скрининг миллионов фаговых бляшек, идентификация Fv-фрагментов с нужной специфичностью занимает от 7 до 14 дней. Для сравнения: скрининг нескольких сотен гибридомных клеточных линий обычно занимает месяцы.
Векторы на основе бактериофага 'К не очень пригодны для получения больших количеств белковых молекул. Чтобы решить эту проблему, сконструировали такой вектор, в котором ДНК Н- и L-цепей встраиваются в сайт, фланкированный плазмидной ДНК. Такую плазмиду, содержащую ДНК Н- и L-цепи, можно вырезать из вектора и трансформировать ею Е. coli (рис. 10.12). Являясь частью плазмиды, ДНК Fv-фрагментов будет многократно реплицироваться в клетках Е. coli с образованием большого количества продукта, который можно использовать как в диагностических, так и в терапевтических целях.
При создании комбинаторных библиотек вместо фага λ можно использовать нитевидные бактериофаги М13 или fd (рис. 10.14). В этих случаях соответствующий фрагмент антитела синтезируется как часть химерного белка, локализованного на поверхности фаговой частицы. Скрининг комбинаторной библиотеки фрагментов антител можно провести при помощи ферментного иммуносорбентного анализа (ELISA). Суть метода состоит в следующем: образцы (аликвоты) из библиотеки помещают в ячейки планшеты, содержащие антиген-мишень. Ячейки промывают, чтобы удалить несвязанные фаговые частицы. В каждую ячейку вносят конъюгат, состоящий из антитела, связывающегося с белком фаговой оболочки, и фермента. Ячейки промывают для удаления несвязанного конъюгата и добавляют в каждую из них хромогенный субстрат, который расщепляется ферментом, связанным с фагом, и окрашивает те ячейки, в которых находятся фаговые частицы, несущие антитела к антигену-мишени. Процесс отбора и последующая очистка бактериофагов, синтезирующих фрагмент антитела, специфичный к нужному антигену, в этом случае гораздо проще, чем тогда, когда проводится подсчет бляшек бактериофага λ. Выделив фаг, синтезирующий желаемый фрагмент антитела, можно экстрагировать кодирующую этот фрагмент ДНК и субклонировать ее в экспрессирующем векторе. Разные варианты антител с повышенным сродством к антигену-мишени можно получать замещением фрагментов ДНК VL- и VH-областей или с помощью неспецифического мутагенеза.
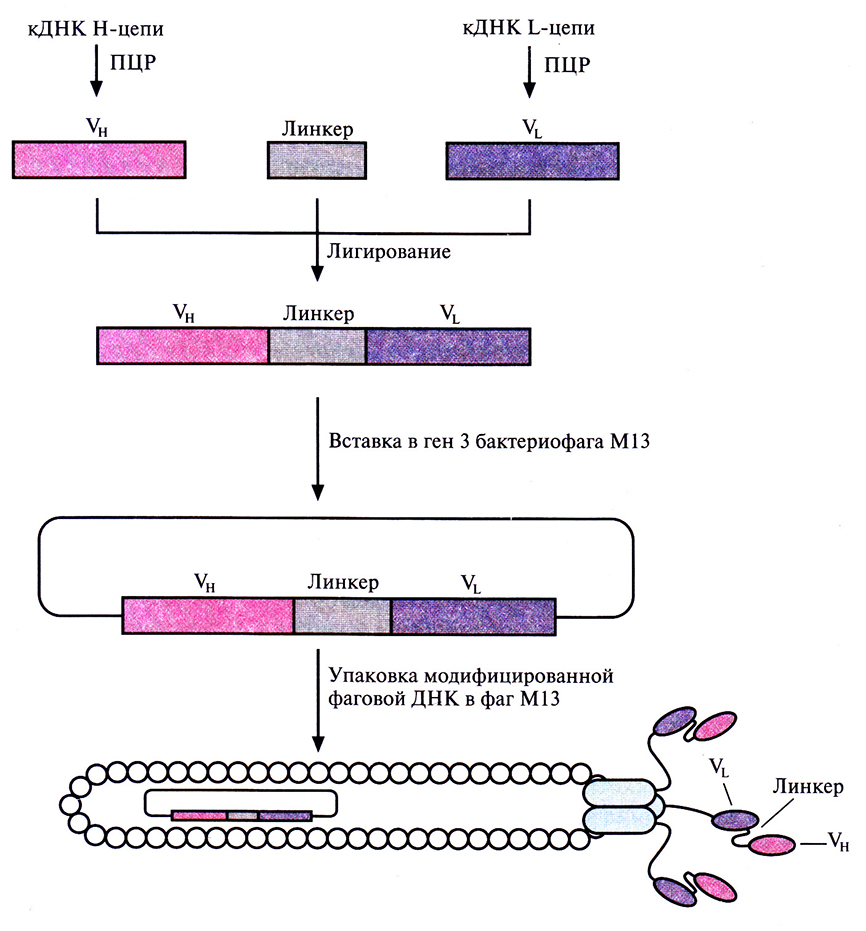
Рис. 10.14. Создание комбинаторной библиотеки кДНК Fv-фрагментов антител с помощью нитевидного бактериофага М13. кДНК VL- и VH-областей амплифицировали методом ПЦР, а затем лигировали, используя ДНК короткого линкерного пептида. Полученные фрагменты ДНК, составляющие комбинаторную библиотеку кДНК одноцепочечных антител, встроили в геном фага М13 с присоединением их к фаговому гену 3, который кодирует поверхностный фаговый белок. В М13 с гена 3 синтезируется три белковых молекулы, поэтому каждый рекомбинантный фаг М13, содержащий комбинаторную библиотеку кДНК одноцепочечных антител, будет нести три молекулы химерного белка, состоящего из продукта гена 3 и одноцепочечного антитела.
Разработав методы получения Fv-фрагментов, исследователи попытались определить, способна ли отдельная белковая цепочка, состоящая только из VL- и VH-доменов, образовать функциональную молекулу, связывающую антиген. Компьютерное моделирование трехмерной структуры предполагаемого одноцепочечного антитела показало, что для образования конформации, необходимой для связывания антигена, VL- и VH-домены должны быть разделены линкерным пептидом. Имея это в виду, VL- и VH-ДНК, синтезированные на кДНК-матрице клонированного моноклонального антитела, присоединили к химически синтезированному ДНК-линкеру, создав конструкцию VL-ДНК–линкер– VH-ДНК. Соответствующий одноцепочечный белок синтезировали в Е. coli, очистили и обнаружили, что его сродство и специфичность к антигену сходны с таковыми интактного моноклонального антитела. Таким образом, с помощью Е. coli можно без труда получать функциональные одноцепочечные антитела.
Одноцепочечные антитела могут найти широкое применение в клинике в тех случаях, когда проявление Fc-эффекторных функций не является необходимым, а малый размер молекулы (мол. масса одноцепочечного антитела составляет примерно 27 кДа, а иммуноглобулина G – 150 кДа) дает определенные преимущества. Кроме того, к одноцепочечному антителу можно присоединить последовательность, кодирующую тот или иной белок, получив бифункциональную молекулу, которая сможет связываться с определенной мишенью, проявляя при этом специфическую активность.
Был проведен также еще один эксперимент: вместо того чтобы соединять VL- и Ун-цепи коротким пептидом, аминокислоты каркасной области модифицировали таким образом, чтобы между ними образовывался дисульфидный мостик. Эффективность такой стабилизированной дисульфидной связью Fv-молекулы, связанной с токсином, разрушающим раковые клетки, сравнили с эффективностью одноцепочечной Fv-молекулы, связанной с тем же токсином (рис. 10.15). Обнаружилось, что стабилизированный дисульфидной связью и одноцепочечный Fv-иммунотоксины обладают одинаковой активностью и специфичностью, но первый в несколько раз стабильнее. Можно предположить, что в каких-то ситуациях стабилизированные Fv-молекулы могут оказаться предпочтительнее одноцепочечных Fv-молекул.
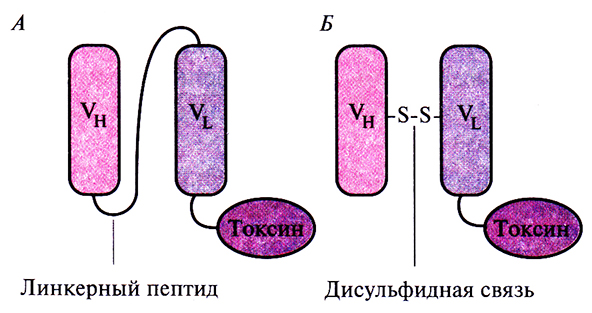
Рис. 10.15. Схематическое изображение одноцепочечного Fv-иммунотоксина (А) и Fv-иммунотоксина, стабилизированного дисульфидной связью (Б).
ЛЕКАРСТВЕННЫЕ СРЕДСТВА ПРОТИВ ВИЧ
Ученым пока не удалось получить вакцину, достаточно эффективную против вируса иммунодефицита человека (ВИЧ), который вызывает развитие синдрома приобретенного иммунодефицита (СПИД). Параллельно с созданием такой вакцины идет поиск других средств, позволяющих замедлить патологический процесс.
ВИЧ поражает один из видов лимфоцитов, а именно Т-хелперы (ТH-клетки). В норме в процессе развития иммунного ответа ТH-клетки связывают продукты деградации специфических антигенов и высвобождают факторы, стимулирующие другие клетки иммунной системы к участию в иммунном ответе. Тн-клетки играют в этом процессе ключевую роль, а при ВИЧ-инфекции они перестают функционировать. Как только вирус внедряется в ТH-клетку, он становится защищенным от иммунной системы организма и начинает оказывать свое разрушающее действие на ТH-клетки.
- В результате размножения вируса в инфицированной клетке происходит ее лизис.
- Пораженная клетка действует как фабрика по производству ВИЧ-гликопротеина (gp120), который вызывает разрушение ТH-клеток и других Т-лимфоцитов.
- Пораженная клетка сливается с другими ТH-клетками, формируя синцитий, который не способен выполнять функции, свойственные индивидуальным ТH-клеткам.
Основным следствием ВИЧ-инфекции является неспособность иммунной системы организма обеспечивать его защиту от обычных бактериальных и вирусных инфекций, которые в конце концов приводят к гибели больного, несмотря на лечение антибиотиками и другими средствами.
На первом этапе ВИЧ-инфекции происходит взаимодействие между гликопротеином оболочки вируса мол. массой 120 кДа (gpl20) и рецептором на поверхности ТH-клеток – CD4 (рис. 10.16, A). In vitro поражение Тн-клеток блокируется антителами к CD4; процесс замедляется также при избытке свободного белка CD4. Однако ни один из этих способов не приводит к уничтожению вируса. Один из подходов, обеспечивающих как защиту ТH-клеток, так и инактивацию вируса, заключается в создании химерного белка, состоящего из фрагмента молекулы CD4 и Fc-фрагмента иммуноглобулина. Свойства этого белка, называемого CD4-иммуноадгезином, определяются составными частями его молекулы: СD4-компонент связывает gpl20 и блокирует ВИЧ, а иммуноглобулиновый обеспечивает замедление разрушения молекулы в плазме и ее связывание с клетками, несущимирецептор к антителу. После присоединения СD4-иммуноадгезина к свободной вирусной частице или к инфицированной клетке запускается реакция опосредованной антителами клеточной цитотоксичности, которая обеспечивает уничтожение вируса или пораженной им клетки.
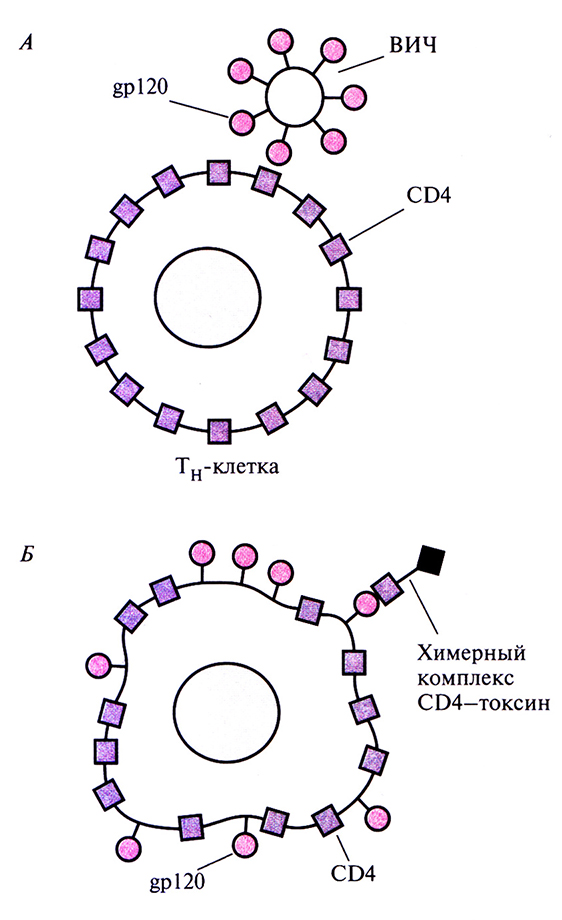
Рис. 10.16. ВИЧ-инфекция и ее терапия. А. Связывание ВИЧ с ТH-клеткой опосредуется контактированием вирусного белка gpl20 с ТH-клеточным поверхностным белком CD4. Б. На поверхности ВИЧ-инфицированной клетки находится белок gpl20, с которым может связываться свободный химерный комплекс CD4–токсин. Попав внутрь инфицированной клетки, токсиновая часть химерной молекулы убивает ее.
Другой подход, позволяющий контролировать развитие ВИЧ-инфекции, заключается в создании системы мечения ВИЧ-пораженных клеток для их специфического уничтожения. Например, если сшить два фрагмента ДНК, один из которых кодирует рецептор CD4, а другой – внутриклеточный токсин Pseudomonas (экзотоксин А), то мы получим ген, кодирующий химерный белок с комбинированными свойствами (рис. 10.17). Экзотоксин A Pseudomonas – это белок с мол. массой 66 кДа, состоящий из трех доменов: домен I отвечает за связывание с клеткой, II – за проникновение белка в клетку, III – за присоединение ADP-рибозы к эукариотическому фактору элонгации (EF-2), что приводит к его инактивации. Химерный белок CD4–экзотоксин A Pseudomonas вместо домена I содержит большую часть последовательности CD4 (рис. 10.17), в результате чего обладает и цитотоксической активностью экзотоксина Pseudomonas, и gp120-связывающий активностью CD4. На поверхности всех ВИЧ-пораженных клеток находится гликопротеин gpl20, поэтому С04-домен химерного белка соединяется исключительно с этими клетками. Присоединившись к инфицированной клетке, химерный белок проникает внутрь нее при участии домена II экзотоксина A Pseudomonas. Затем экзотоксиновая часть химерного белка инактивирует фактор элонгации EF-2, участвующий в синтезе белка. Это препятствует дальнейшему синтезу белка, что в конце концов приводит к гибели клетки. Таким образом, СD4-домен «помечает» ВИЧ-пораженные клетки, а экзотоксин выступает в роли «наемного убийцы».
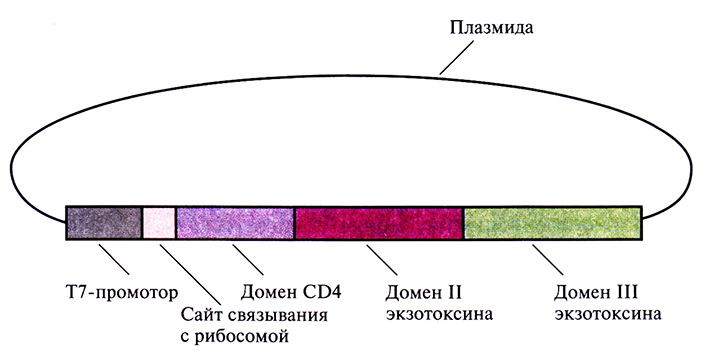
Рис. 10.17. Генетически сконструированный химерный комплекс CD4–экзотоксин A Pseudomonas. Использован промотор бактериофага Т7 Е. coli.
Синтезируясь в Е. coli, химерный белок образует нерастворимые цитоплазматические включения. Их растворяют в гуанидингидрохлориде и выделяют с помощью быстрого разведения и анион-обменной хроматографии. Полученный таким образом белок с успехом выдержал проверку в контрольной культуре клеток. Однако в организме человека на Pseudomonas-компонент химерного белка может возникнуть иммунная реакция, и не исключено, что его придется вводить вместе с каким-либо иммуносупрессантом, например циклоспорином. Нужно иметь в виду, что описанный выше способ борьбы с ВИЧ-инфекцией находится на начальной стадии разработки, хотя в будущем и может оказаться весьма эффективным.
Подобные иммунопрепараты обладают достаточно высокой эффективностью, что позволяет применять их в низких дозах и свести к минимуму побочное действие на иммунную систему. Кроме того, они могут оказаться полезными для лечения различных новообразований, а иногда и заменять химиотерапию. На пораженные клетки можно «нацелить» и другие цитотоксичные белки, например дифтерийный токсин или растительный токсин рицин. Впрочем, даже приоптимальном развитии событий пройдет еще несколько лет, прежде чем терапевтическое применение рекомбинантных экзотоксинов станет рутинным.
ЗАКЛЮЧЕНИЕ
С помощью клонирования специфических генов и последующей их экспрессии в бактериях получен целый ряд белков, которые можно будет использовать в качестве лекарственных препаратов. Большинство этих белков имеют эукариотическое происхождение, так что для выделения нужного гена сначала получают препарат мРНК, обогащенный интересующими исследователя фракциями, затем создают кДНК-библиотеку и встраивают соответствующую ДНК в подходящий вектор для экспрессии. Произведя обмен участков родственных генов, кодирующих аналогичные белковые домены, или прямо заменяя сегменты клонированного гена, кодирующие функциональные части белка, можно создавать новые модификации таких белков. В качестве лекарственных средств можно использовать и некоторые ферменты. Например, для снижения вязкости слизи, которая накапливается в легких больных муковисцидозом, применяют в виде аэрозоля рекомбинантную ДНКазу I и альгинатлиазу.
С развитием технологии рекомбинантных ДНК и разработкой способов получения моно-клональных антител, а также с установлением структуры и функций иммуноглобулинов появился интерес к использованию специфических антител для лечения различных заболеваний. Работа с генами антител облегчается тем, что отдельные домены молекулы антитела выполняют разные функции.
Лекарственные вещества или ферменты можно присоединять к моноклональным антителам или их Fv-фрагментам, специфичным в отношении поверхностных белков определенных клеток, например опухолевых. При этом лекарственное вещество может находиться в инертной форме. Если предполагаются многократные введения таких комплексов, то их иммуноглобулиновый компонент должен представлять собой антитело или фрагмент антитела человека; это позволяет предотвратить развитие перекрестной иммунной реакции и сенсибилизацию больного. Если же предполагается использовать в этих целях моноклональные антитела грызунов, их структуру следует максимально приблизить к структуре антител человека. Для этого в последних достаточно заменить CDR-участки на аналогичные фрагменты антител грызунов. Недавно удалось провести отбор и синтез моноклональных антител человека с помощью Е. coli.
Генноинженерные методы позволяют получать уникальные лекарственные средства, которые представляют собой комплекс белка, связывающегося со специфическими клетками, например ВИЧ-инфицированными, и токсина. Этот подход пока только разрабатывается, но его перспективы обнадеживают.

