Еще относительно недавно ни у кого не возникало сомнения в том, что окружающая среда – воздух, земля и вода – всегда будут эффективно «перерабатывать» бытовые, промышленные и сельскохозяйственные отходы. Теперь мы знаем, что это не так. Человечество столкнулось с двумя фундаментальными проблемами: переработкой отходов, постоянно образующихся в огромном количестве, и разрушением токсичных соединений, десятилетиями накапливавшихся на свалках, в воде и почве. Правительства разных стран пытались решить эти проблемы законодательным путем, однако к успеху это не привело.
В настоящее время проходит проверку целый ряд технологических, в том числе и биотехнологических, подходов, с помощью которых, возможно, удастся перерабатывать большие количества отходов (например, лигноцеллюлозы) и токсичные вещества. Предпринимаются попытки поощрять те предприятия, которые перерабатывают отходы производства и повторно используют содержащиеся в них полезные вещества.
Употребляемый нами здесь термин «биодеградация» относится к процессу разрушения отходов, попавших в окружающую среду, с помощью живых микроорганизмов, а термин «биомасса» – ко всей совокупности веществ и материалов – побочных продуктов пищевой и перерабатывающей промышленности, – которые раньше считались отходами, а теперь могут служить сырьем для производства многих экономически важных продуктов.
ДЕГРАДАЦИЯ КСЕНОБИОТИКОВ
С ПОМОЩЬЮ МИКРООРГАНИЗМОВ
Проблема утилизации токсичных отходов сейчас стоит очень остро. В 1985 г. мировое производство лишь одного из загрязняющих окружающую среду химических веществ, пентахлорфенола, составило более 50 ООО т. Раньше токсичные вещества разрушали, сжигая их или обрабатывая другими химикатами, однако это тоже приводило к загрязнению окружающей среды, а кроме того, обходилось очень дорого. В середине 1960-х гг. были обнаружены почвенные микроорганизмы, способные к деградации ксенобиотиков (неприродных, синтетических химических веществ; от греч. xenos, чужой) – гербицидов, пестицидов, хладагентов, растворителей и т. д. Это открытие подтвердило правильность предположения о том, что микроорганизмы можно использовать для экономичного и эффективного разрушения токсичных химических отходов.
Основную группу почвенных микроорганизмов, разрушающих ксенобиотики, составляют бактерии рода Pseudomonas. Биохимические исследования показали, что разные штаммы Pseudomonas способны расщеплять более 100 органических соединений. Нередко один штамм использует в качестве источника углерода несколько родственных соединений.
В биодеградации сложной органической молекулы обычно участвуют несколько разных ферментов. Кодирующие их гены могут иметь хромосомную локализацию, но чаще входят в состав крупных (50–200 т. п. н.) плазмид (табл. 13.1), а иногда обнаруживаются как в хромосомной, так и в плазмидной ДНК.
Таблица 13.1. Плазмиды Pseudomonas, их размер и соединения,
за разрушение которых ответственны кодируемые ими ферменты1)

Бактерии, разрушающие негалогенированные ароматические соединения, как правило, превращают их в катехол (рис. 13.1) или протокатехоат (рис. 13.2), а затем, в ходе нескольких реакций окислительного расщепления, – в ацетил-СоА и сукцинат (рис. 13.3) или пируват и ацетальдегид (рис. 13.4). Эти последние соединения метаболизируются практически всеми микроорганизмами. Галогенированные ароматические соединения, основные компоненты большинства пестицидов и гербицидов, с помощью тех же ферментов разрушаются до катехола, протокатехоата, гидрохинона или их галогенированных производных, причем скорость их деградации обратно пропорциональна числу атомов галогена в исходном соединении. Дегалогенирование (отщепление замещающего атома галогена от органической молекулы), необходимое для детоксикации соединения, часто осуществляется в ходе неспецифической диоксигеназной реакции, путем замещения галогена в бензольном кольце на гидроксильную группу. Эта реакция может происходить как в ходе биодеградации исходного галогенированного соединения, так и потом.
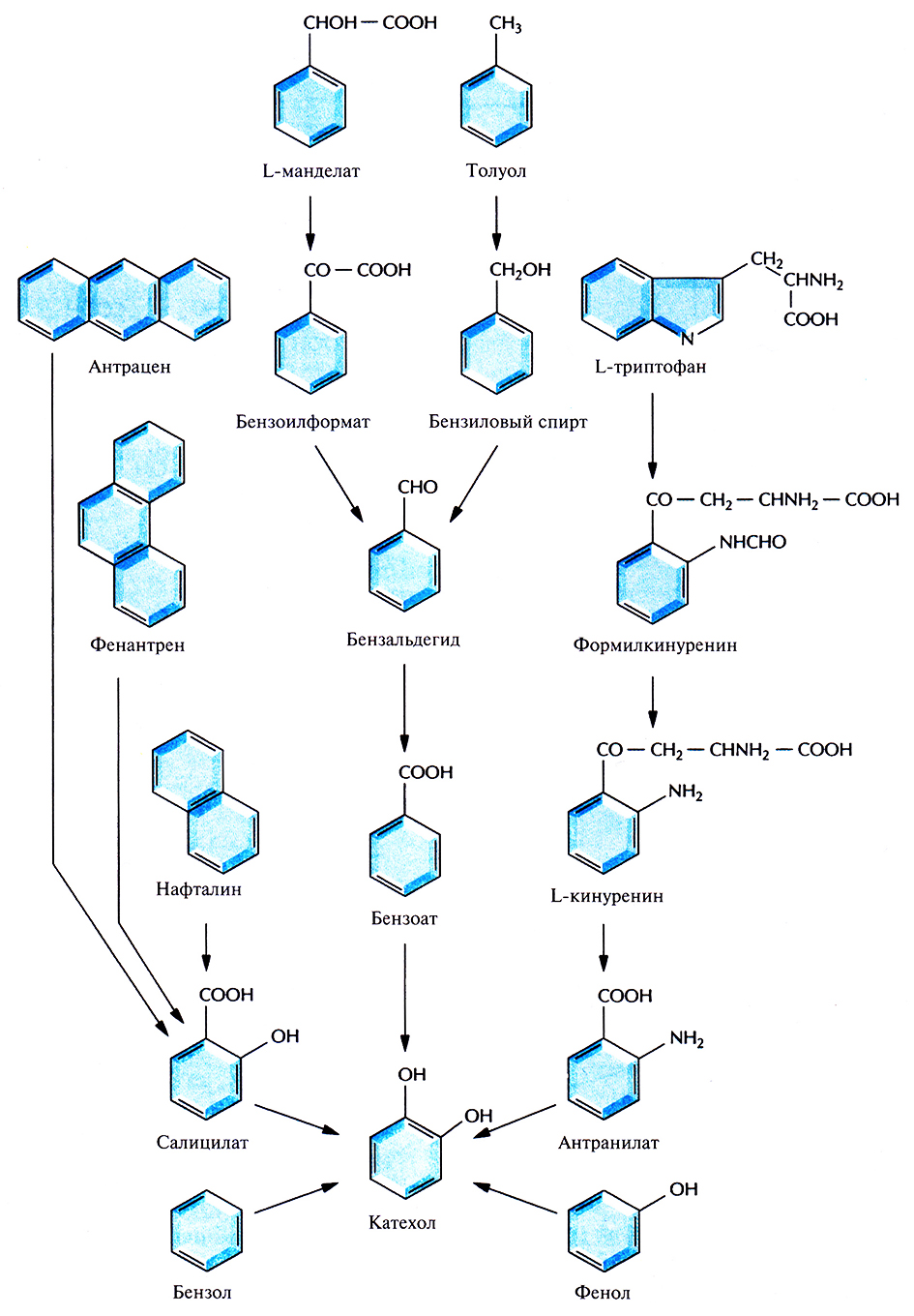
Рис. 13.1. Пути ферментативного превращения ароматических соединений в катехол бактериями, разрушающими ксенобиотики.
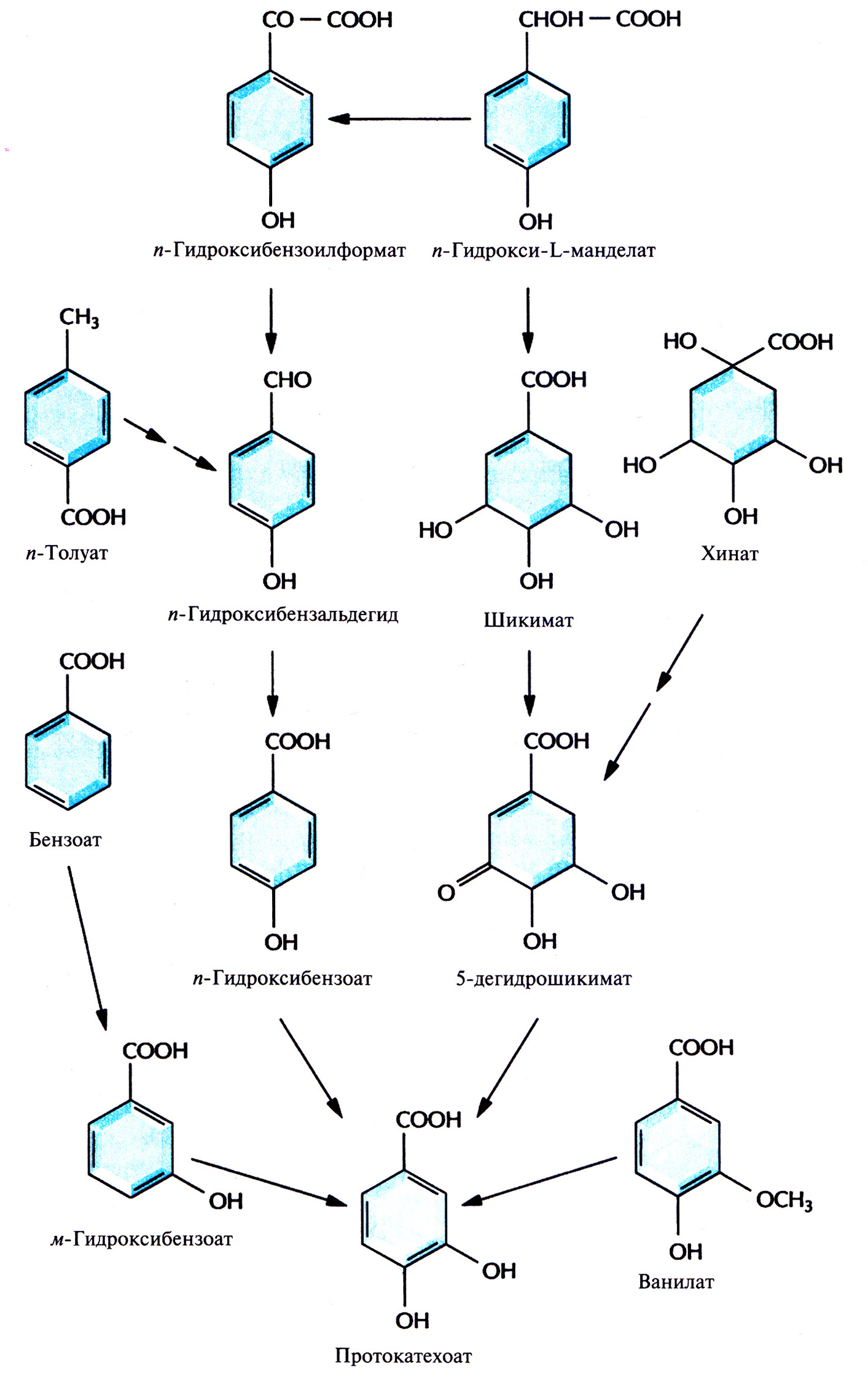
Рис. 13.2. Пути ферментативного превращения ароматических соединений в протокатехоат бактериями, разрушающими ксенобиотики.
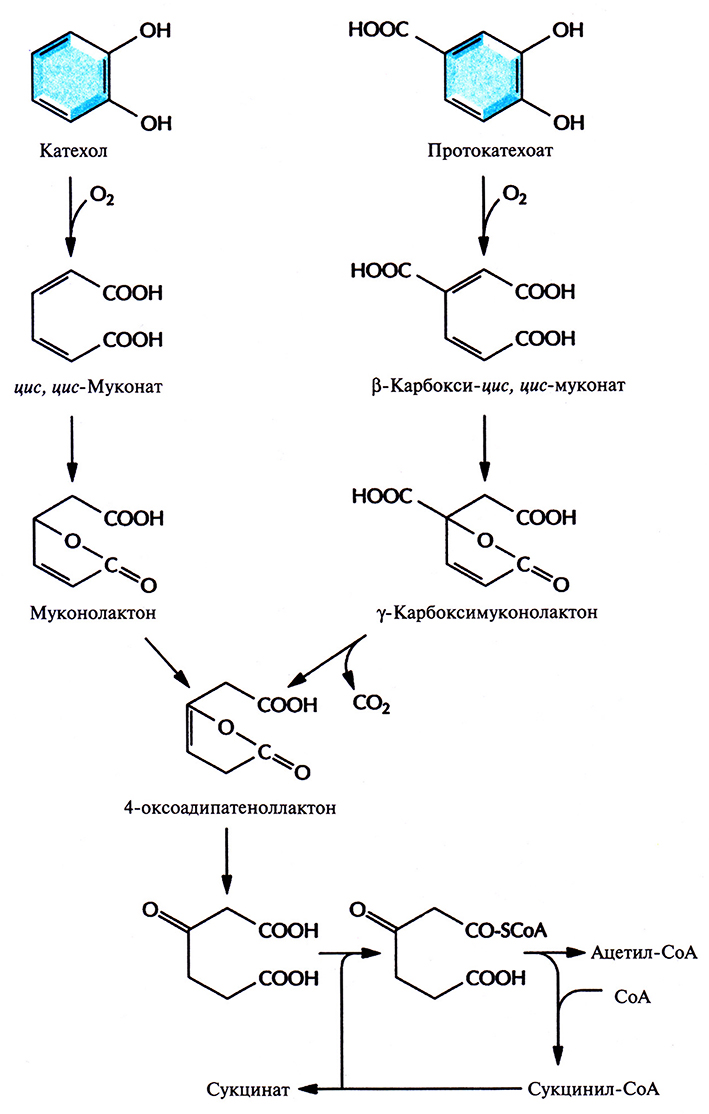
Рис. 13.3. Путь орто-расщепления при ферментативном превращении катехола и протокатехоата в ацетил-СоА и сукцинат.
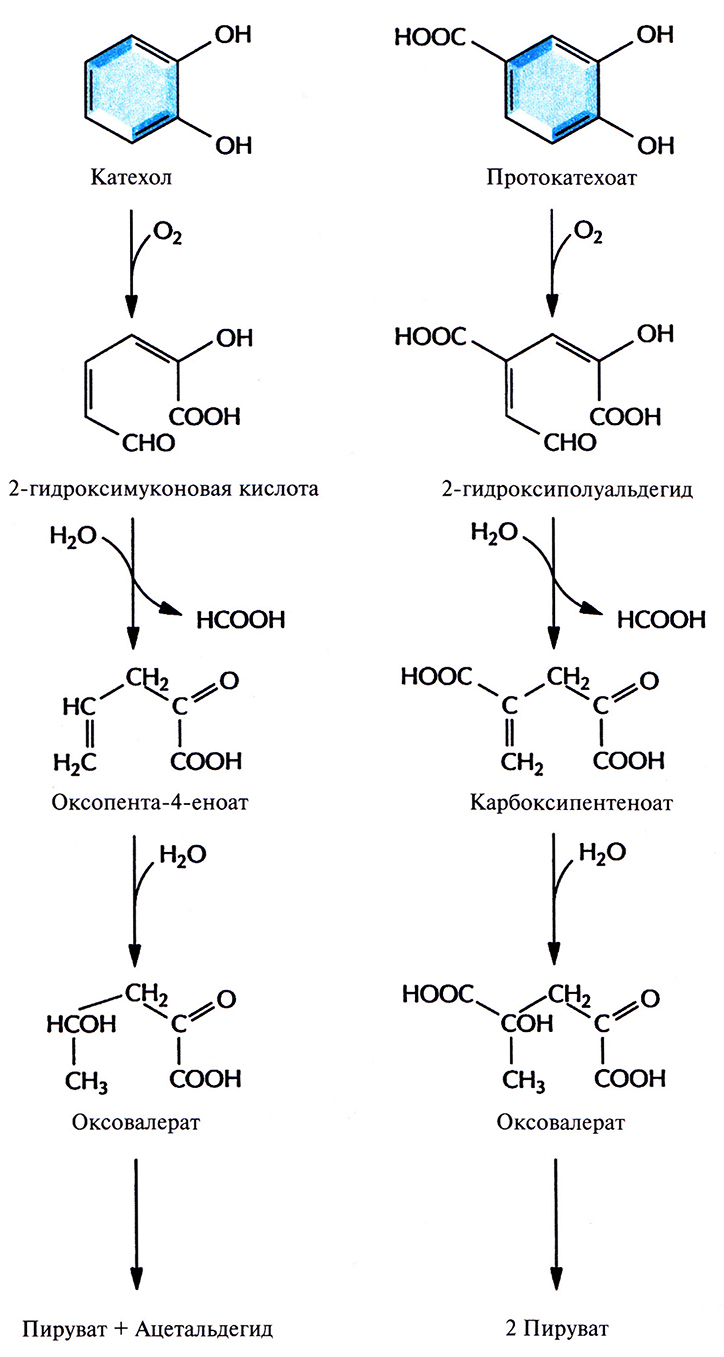
Рис. 13.4. Путь мета-расщепления при ферментативном превращении катехола и протокатехоата в пируват и ацетальдегид.
МЕТАБОЛИЧЕСКИЕ ПУТИ БИОДЕГРАДАЦИИ КСЕНОБИОТИКОВ,
СОЗДАННЫЕ МЕТОДАМИ ГЕННОЙ ИНЖЕНЕРИИ
Некоторые микроорганизмы обладают природной способностью к деградации различных ксенобиотиков, однако следует иметь в виду, что:
1) ни один из них не может разрушать все органические соединения;
2) некоторые органические соединения в высокой концентрации подавляют функционирование или рост деградирующих их микроорганизмов;
3) большинство очагов загрязнения содержит смесь химикатов, и микроорганизм, способный разрушать один или несколько ее компонентов, может инактивироваться другими компонентами;
4) многие неполярные соединения адсорбируются частицами почвы и становятся менее доступными;
5) биодеградация органических соединений часто происходит довольно медленно.
Часть этих проблем можно решить, осуществив конъюгационный перенос плазмид, которые кодируют ферменты разных катаболических путей, в один реципиентный штамм (рис. 13.5). Если две плазмиды содержат гомологичные участки, то между ними может произойти рекомбинация с образованием гибридной плазмиды, которая имеет больший размер и обладает свойствами исходных плазмид. Если же две плазмиды не содержат гомологичных участков и относятся к разным группам несовместимости, то они могут сосуществовать в одной бактерии.
Перенос плазмид
В 1970-х гг. Чакрабарти и его коллегами был создан первый бактериальный штамм, обладающий более широкими катаболическими возможностями. Он расщеплял большинство углеводородов нефти и был назван «супербациллой». Для его получения использовали плазмиды, каждая из которых кодировала фермент, расщепляющий определенный класс углеводородов: плазмида САМ детерминировала деградацию камфары, ОСТ – октана, NAH – нафталина, XYL – ксилола (рис. 13.5). Сначала путем конъюгации перенесли плазмиду САМ в штамм, несущий плазмиду ОСТ. Эти две плазмиды несовместимы (не могут существовать в одной клетке в виде отдельных плазмид), но в результате происходящей между ними рекомбинации образуется одна плазмида, объединяющая их функции. Затем аналогичным путем плазмиду NAH перенесли в штамм, несущий плазмиду XYL. Эти плазмиды совместимы и могут сосуществовать в одной клетке-хозяине. И наконец, гибридную плазмиду перенесли в штамм, несущий плазмиды NAH и XYL. В результате всех этих манипуляций получили штамм, который растет на неочищенной нефти лучше исходных штаммов, взятых по отдельности или вместе.
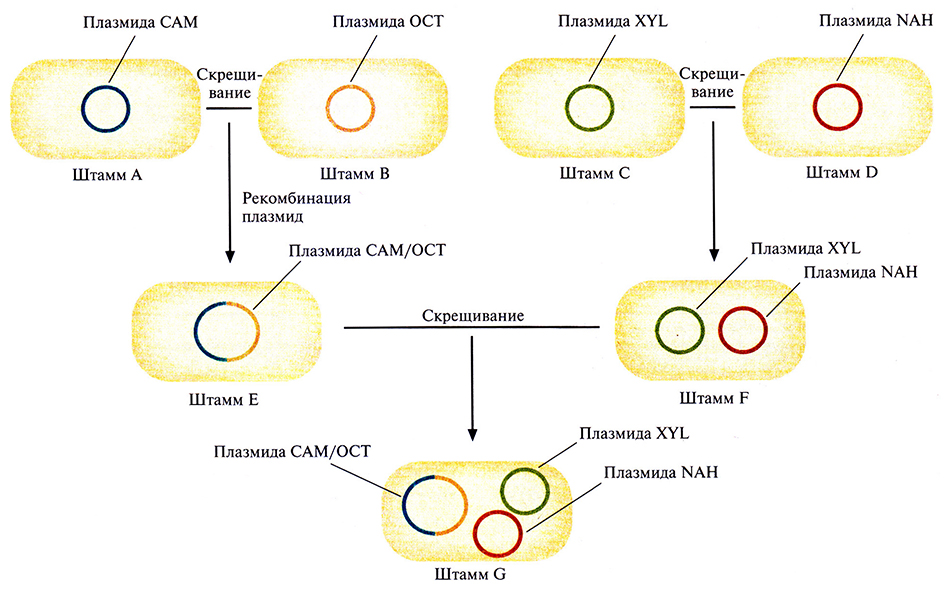
Рис. 13.5. Создание бактериального штамма, способного разрушать камфару, октан, ксилол и нафталин. Штамм А, несущий плазмиду САМ (она детерминирует разрушение камфары), скрещивают со штаммом В, несущим плазмиду ОСТ (разрушение октана). При этом образуется штамм Е, который содержит гибридную плазмиду, образовавшуюся в результате гомологичной рекомбинации между исходными плазмидами и обладающую функциями каждой из них. Штамм С, содержащий плазмиду XYL (разрушение ксилола), скрещивают со штаммом D, содержащим плазмиду NAH (разрушение нафталина), и получают штамм F, который несет обе эти плазмиды. Наконец, скрещивают штаммы Е и F, в результате чего образуется штамм G, содержащий плазмиды САМ/ОСТ, XYL и NAH.
Хотя сам этот штамм не использовали для ликвидации нефтяных загрязнений, он сыграл важную роль в становлении биотехнологической промышленности. Изобретатель «супербациллы» получил патент США, описывающий структуру данного штамма и возможности его применения. Это был первый патент, выданный за создание генетически модифицированного микроорганизма и подтвержденный Верховным судом США, который проиллюстрировал, что биотехнологические компании могут защищать свои изобретения точно так же, как химические и фармацевтические.
Большинство разрушающих ксенобиотики бактерий, модифицированных путем переноса плазмид, являются мезофильными микроорганизмами (хорошо растут при 20–40 °С), а температура воды в загрязненных реках, озерах и океанах обычно лежит в диапазоне от 0 до 20 °С. Чтобы проверить, можно ли создать бактерию, обладающую более широкими катаболическими возможностями и в то же время способную расти и развиваться при низких температурах, плазмиду TOL (детерминирует разрушение толуола) мезофильного штамма Pseudomonas putida перенесли с помощью конъюгации в психрофильный (с низким температурным оптимумом) штамм, утилизирующий салицилат при температуре, близкой к О °С. Трансформированный штамм содержал введенную в него плазмиду TOL и собственную плазмиду SAL, детерминирующую разрушение салицилата, и был способен утилизировать как салицилат, так и толуол в качестве единственного источника углерода при 0°С (табл. 13.2). Психрофильный штамм дикого типа (нетрансформированный) не мог расти при любой температуре, если единственным источником углерода был толуол (толуат). Эта работа показала принципиальную возможность создания психрофильных штаммов бактерий, эффективно разрушающих ксенобиотики в природных условиях, но для их реального получения необходимо провести дополнительные исследования.
Таблица 13.2. Время генерации дикого и трансформированного психрофильных штаммов P. putida,
использующих в качестве единственного источника углерода салицилат или толуат, при разных температурах1)

Изменение генов
Объединение разных метаболических путей в одном микроорганизме с помощью конъюгации – это лишь один из способов создания бактерий с новыми свойствами. Расширить их катаболические возможности можно и другим путем, модифицируя гены, кодирующие ферменты того или иного метаболического пути. Осуществимость этого подхода проверяли на примере плазмиды pWWO, 12 генов которой кодируют мета-расщепление толуола и ксилола. Обладающие этой плазмидой псевдомонады могут использовать в качестве источника углерода алкилбензоаты (рис. 13.6). Указанные гены входят в состав одного хуl-оперона, находящегося под контролем Pm-промотора. Транскрипционная активность последнего находится под позитивным контролем продукта гена xylS, активируемого почти всеми субстратами данного метаболического пути (например, бензоатом и 3-метилбензоатом) (рис. 13.6). Детальный биохимический и генетический анализ показал, что несущие pWWO-плазмиду бактерии могут расщеплять 4-этилбензоат только до 4-этилкатехола, который инактивирует один из основных ферментов данного метаболического пути, катехол-2,3-диоксигеназу, являющуюся продуктом гена xylE, и поэтому не разрушается и накапливается в среде. Кроме того, 4-этилбензоат, в отличие от остальных алкилбензоатов, не активирует XylS-белок; поэтому, если он является единственным субстратом, хуl-оперон не транскрибируется. Для усовершенствования природной системы меmа-расщепления алкилбензоатов необходимо решить две основные задачи: 1) предотвратить инактивацию катехол-2,3-диоксигеназы 4-этилбензоатом; 2) индуцировать транскрипцию генов хуl-оперона в том случае, если единственным субстратом является 4-этилбензоат.
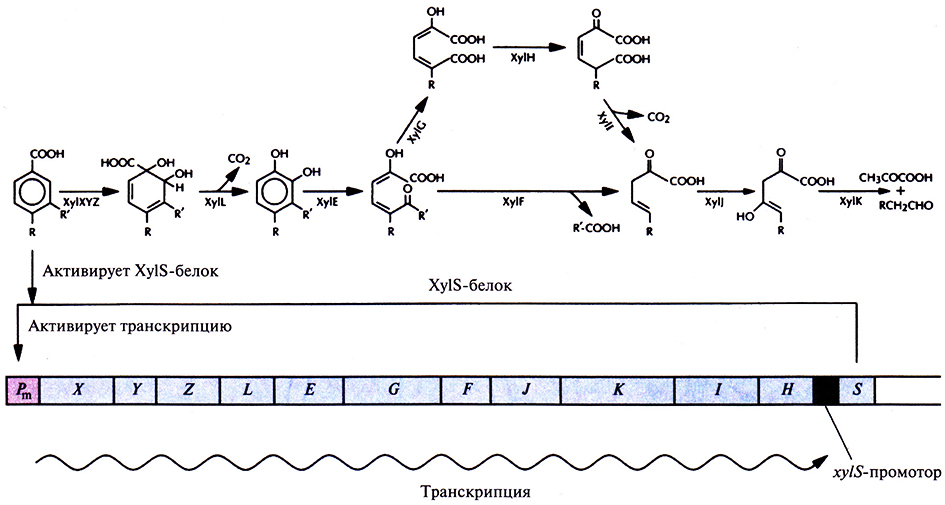
Рис. 13.6. Путь мета-расщепления толуола и ксилола и xyl-оперон плазмиды pWWO. хуl-Oпepoн находится под контролем Рm-промотора, который регулируется с помощью продукта гена xylS, в свою очередь активируемого одним из исходных субстратов. Гены xylX–xylH находятся под контролем Pm-промотора. Ген xylS не входит в состав оперона и экспрессируется конститутивно. Исходным субстратом может быть бензоат (R и R' – это Н), 3-метилбензоат (R – это Н, R' – это СН3), 3-этилбензоат (R – это Н, R' – это СН2СН3) и 4-метилбензоат (R – это СН3, R' – это Н). Гены xylXYZ кодируют толуолдиоксигеназу, xylL – дигидроксициклогексадиенкарбоксилатдегидрогеназу, xylE– катехол-2,3-диоксигеназу, xylF– гидролазу полуальдегида гидроксимуконовой кислоты, xylG – дигидрогеназу полуальдегида гидроксимуконовой кислоты, xylH – 4-оксалокротонат-таутомеразу, xyll – 4-оксалокротонатдекарбоксилазу, xylJ – 2-оксопента-4-еноатгидратазу, xylJ– 2-оксо-4-гидроксипентонатальдолазу.
Для решения второй задачи был проведен поиск мутантной плазмиды. Для этого в плазмиду, несущую ген устойчивости к ампициллину, встроили ген устойчивости к тетрациклину, находящийся под контролем Pm-промотора. В другую плазмиду, несущую ген устойчивости к канамицину, встроили ген xylS. Полученными конструкциями трансформировали Е. coli, отобрали клетки, содержащие обе плазмиды, по признаку устойчивости к ампициллину и канамицину (рис. 13.7, А), обработали их мутагеном этилметансульфонатом и вырастили на среде, содержащей тетрациклин и 4-этилбензоат. Растущие на этой среде клетки содержат мутантный ген xylS и продуцируют измененный XylS-белок (S*), который способен взаимодействовать с 4-этилбензоатом и активировать транскрипцию гена устойчивости к тетрациклину. Чтобы решить проблему инактивации катехол-2,3-диоксигеназы, мутантный ген xylS встроили в плазмиду с широким кругом хозяев, несущую ген устойчивости к канамицину, и ввели ее в клетки P. putida, содержащие плазмиду pWWO (рис. 13.7, Б). Трансформированные клетки высеяли с высокой плотностью на чашки с минимальной средой, содержащей 4-этилбензоат в качестве единственного источника углерода, канамицин для отбора клеток с плазмидой и этилметансульфонат. Клетки, растущие на этой среде, вырабатывают измененную катехол-2,3-диоксигеназу, которая не ингибируется 4-этилкатехолом. Дополнительный анализ подтвердил, что в гене катехол-2,3-диоксигеназы pWWO действительно произошла мутация и что два мутантных гена (xylS и ген катехол-2,3-диоксигеназы) обеспечивают расщепление 4-этилбензоата.
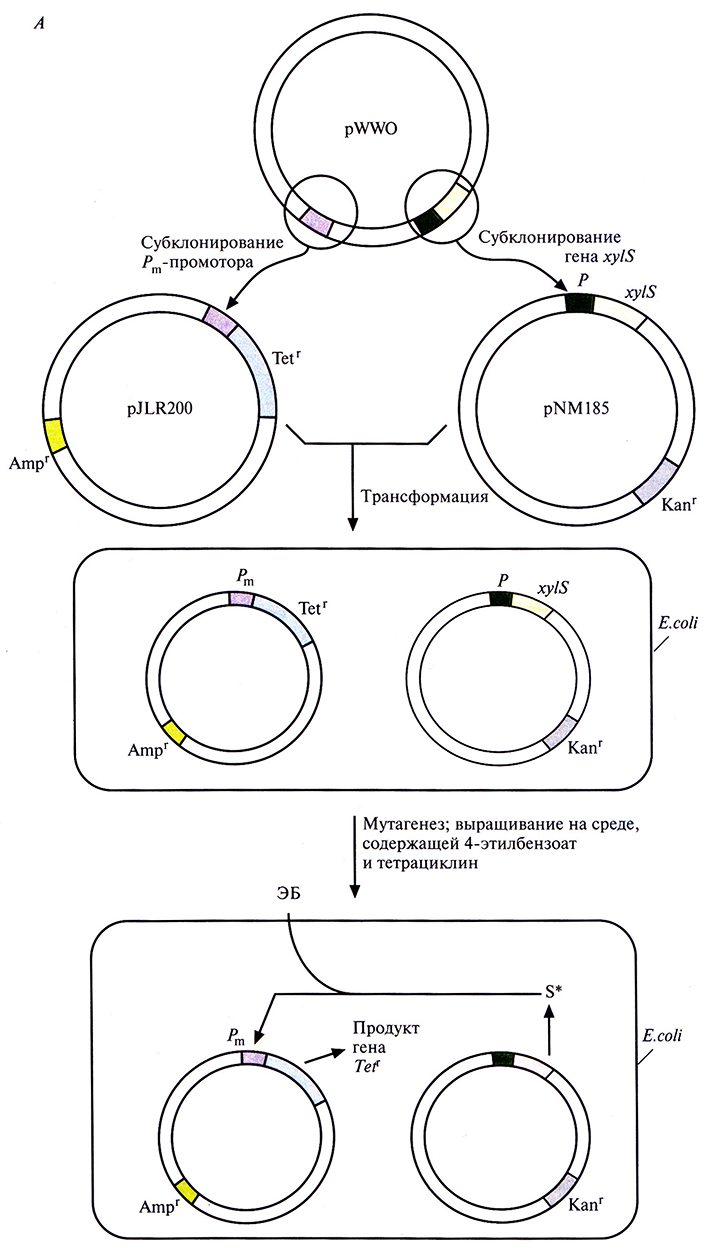
Рис. 13.7. А. Создание системы синтеза XylS-белка, активируемого 4-этилбензоатом. Сначала заменяют промотор гена устойчивости к тетрациклину в плазмиде pBR322 Pm-промотором и получают плазмиду pJLR200. Затем ген xylS с собственным промотором встраивают в плазмиду с широким кругом хозяев, несущую ген устойчивости к канамицину. Полученными плазмидами трансформируют Е. coli. Отбирают трансформированные клетки по признаку устойчивости к ампициллину и канамицину и подвергают мутагенному действию этилметансульфоната. В клетках, несущих мутантный ген xylS (S*), XylS-белок активируется 4-этилбензоатом (ЭБ), активируя в свою очередь Pm-промотор, поэтому они могут расти на среде, содержащей 4-этилбензоат и тетрациклин.
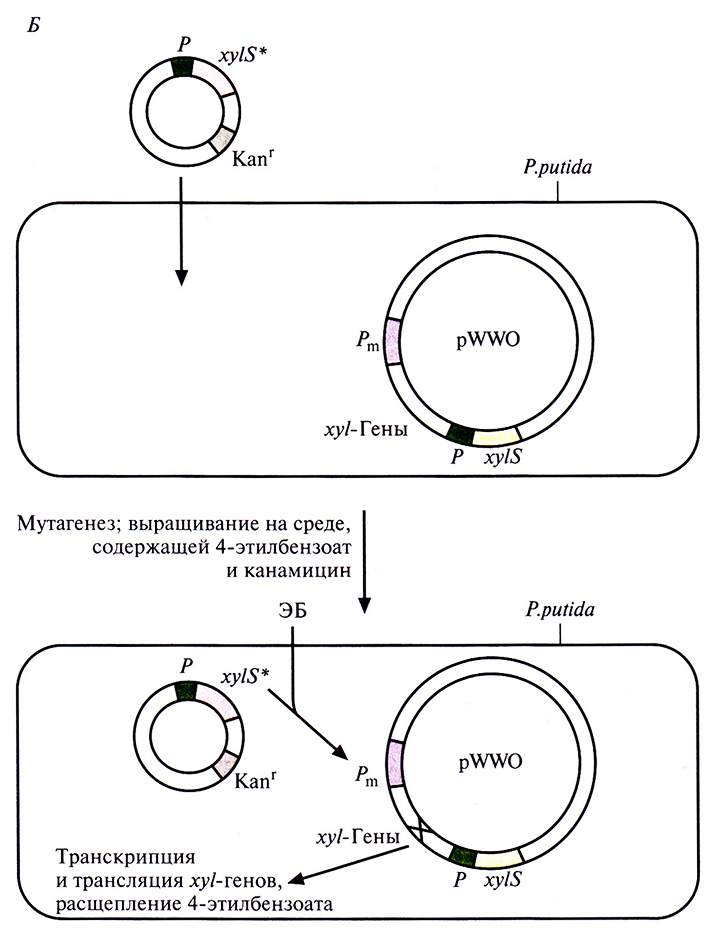
Рис. 13.7. Б. Создание системы синтеза модифицированной катехол-2,3-диоксигеназы, которая не ингибируется 4-этилкатехолом. Штамм P. pulida, несущий плазмиду pWWO, трансформируют плазмидой с широким кругом хозяев, содержащей мутантный ген xylS*, продукт которого активирует Pm -промотор. Проводят химический мутагенез трансформированных клеток и выращивают их на минимальной среде, содержащей 4-этилбензоат и канамицин. Клетки, растущие на этой среде, содержат мутантный ген катехол-2,3-диоксигеназы (мутация X в середине xyl-оперона).
Оба модифицированных гена участвуют в процессе деградации всех субстратов данного метаболического пути. Поэтому стратегия, использованная для повышения эффективности расщепления 4-этилбензоата, применима и в случае других соединений: мутация, приводящая к гиперпродукции XylS-белка, может усиливать активацию Рm-промотора и повышать скорость разрушения субстрата; кроме того, можно избирательно модифицировать Рm-промотор, чтобы он стал более сильным, сохранив способность взаимодействовать с XylS-белком. Таким образом, проведенная работа показывает, что вполне реально усовершенствование того или иного катаболического пути с помощью технологии рекомбинантных ДНК, традиционного мутагенеза и соответствующих методов отбора.
Одним из наиболее распространенных веществ, загрязняющих почву и воду, является трихлорэтилен, широко использующийся в качестве растворителя и обезжиривающего средства. Он длительное время остается в окружающей среде и считается канцерогеном. Кроме того, анаэробные почвенные бактерии могут дегалогенировать его, превращая в еще более токсичное соединение винилхлорид.
Было показано, что некоторые штаммы P. pulida, разрушающие ароматические соединения, такие как толуол, разрушают и трихлорэтилен. С помощью проведенных генетических исследований удалось установить, что для полной детоксикации трихлорэтилена не нужны все ферменты мета-расщепления ксилола и толуола, достаточно лишь толуолдиоксигеназы, которая в норме катализирует реакцию окисления толуола до цис-толуолдигидродиола.
Образование функциональной толуолдиоксигеназы кодируется четырьмя генами (рис. 13.8, А). Их выделили и экспрессировали в Е. coli под контролем сильного индуцибельного tac-промотора, который активируется изопропил-β-D-тиогалактопиранозидом (ИПТГ), в результате чего трихлорэтилен разлагается до безвредных соединений. Исходная скорость деградации трихлорэтилена в Е. coli ниже, чем в P. putida, но она сохраняется в Е. coli дольше. С этим различием может быть связана меньшая, чем у P. putida, чувствительность Е. coli к повреждающему действию трихлорэтилена.
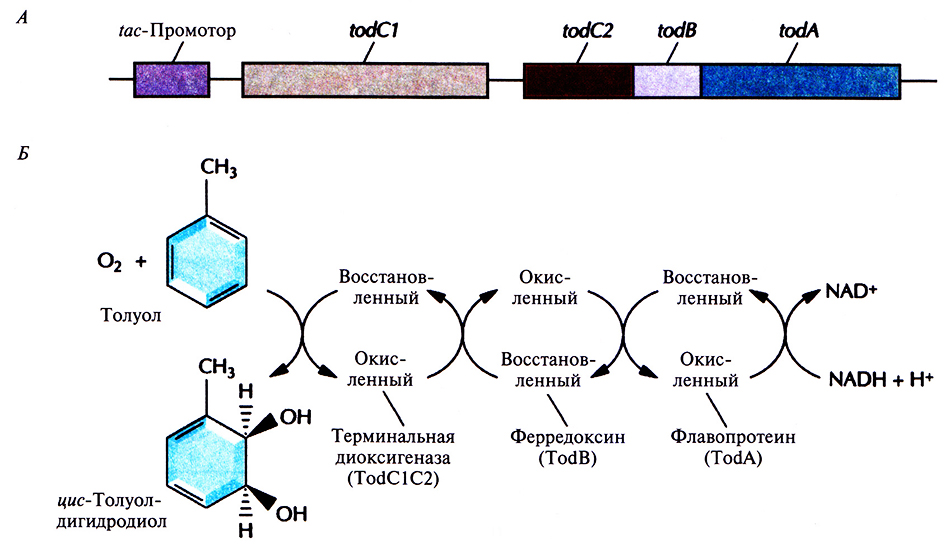
Рис. 13.8. А. Клонированный оперон толуолдиоксигеназы, находящийся под контролем tac-промотора Е. coli. Образование толуолдиоксигеназы обеспечивают четыре гена (todA, todB, todCI и todC2). Ген todA кодирует флавопротеин, который акцептирует электроны с восстановленного никотинамидадениндинуклеотида (NADH) и переносит их на ферредоксин. Последний кодируется геном todB и восстанавливает терминальную диоксигеназу, кодируемую генами todC1 и todC2. Эти гены эквивалентны генам xylXYZ нa рис. 13.6, Б. Превращение толуола в цис-толуолдигидродиол в результате совместного действия Тоd-белков.
В одном из вариантов этого эксперимента был создан рекомбинантный штамм Pseudomonas, в котором были объединены элементы двух разных катаболических путей. Бактериальные штаммы, способные разрушать бифенил, содержат бифенилдиоксигеназу. В состав этого ферментного комплекса входят состоящая из двух субъединиц терминальная диоксигеназа, ферредоксин и ферредоксинредуктаза. По своим структуре и функции бифенилдиоксигеназа сходна с толуолдиоксигеназой, однако утилизирующие бифенил псевдомонады не могут расти на толуоле, а штаммы, утилизирующие толуол, не растут на бифениле. После того как в штамме KF715 P. putida ген bphAl, кодирующий большую субъединицу бифенилдиоксигеназы, был заменен с помощью гомологичной рекомбинации на кодирующий большую субъединицу толуолдиоксигеназы ген todCI из штамма F1 P. putida, получили штамм, способный эффективно разрушать трихлорэтилен (табл. 13.3). Кроме того, этот штамм растет на многих ароматических соединениях, а следовательно, есть возможность создания микроорганизмов, способных разрушать сразу несколько разных соединений.
УТИЛИЗАЦИЯ КРАХМАЛА И САХАРОВ
Крахмал, основной резервный полисахарид растений, представляет собой смесь гомополимеров D-глюкозы – как линейных (амилоза), так и разветвленных (амилопектин). Молекула амилозы состоит из 1·102–4·105 остатков D-глюкозы, соединенных α-1,4-связями (рис. 13.9, А), а амилопектина – из коротких (17–23 остатков D-глюкозы, соединенных α-1,4-связями) линейных цепей, соединенных 1,6- и 1,3-связями и формирующих сильно разветвленную структуру, содержащую 1•-104–4•107 остатков глюкозы (рис. 13.9, Б). Степень разветвления и соотношение между амилозой и амилопектином варьируют в зависимости от вида и возраста растения, из которого был получен крахмал.
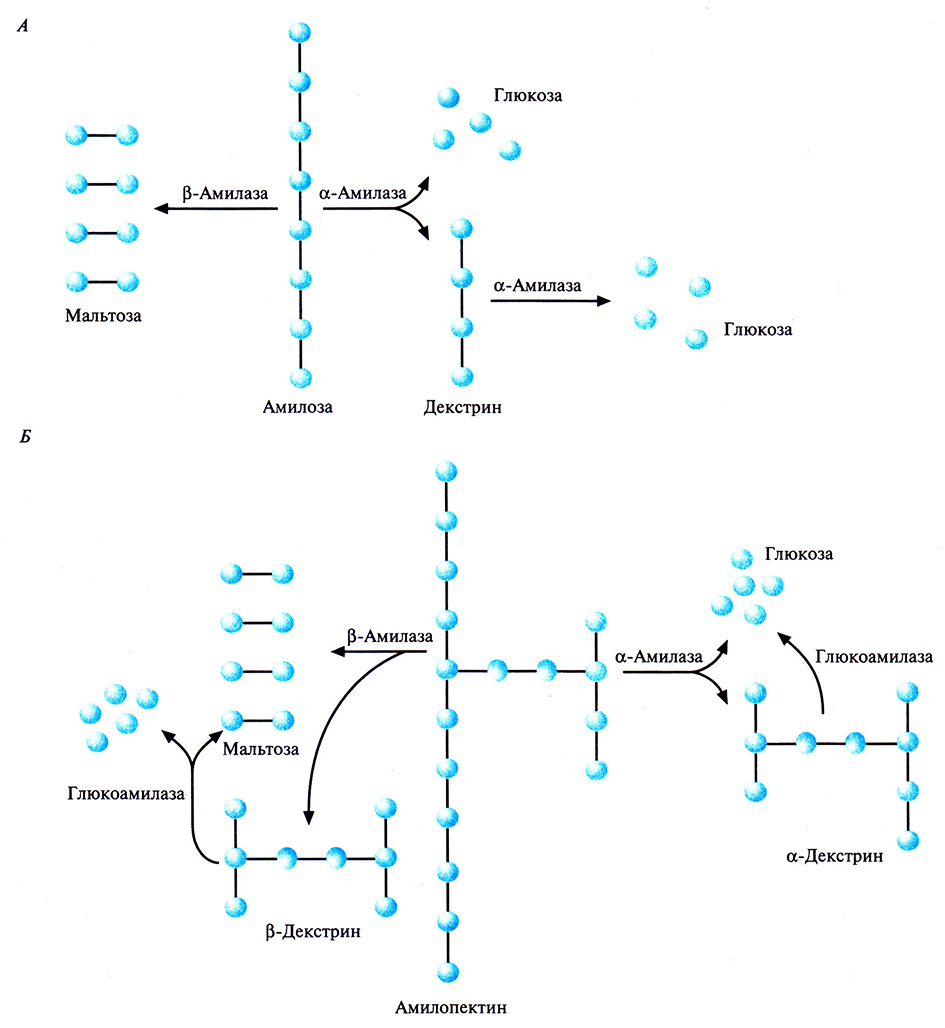
Рис. 13.9. А. Ферментативный гидролиз амилозы. Б. Ферментативный гидролиз амилопектина. Голубые кружки – остатки D-глюкозы.
Промышленное производство фруктозы и этанола
Крахмал широко используется в пишевой промышленности и пивоварении; при этом его сначала гидролизуют до низкомолекулярных компонентов, а затем превращают в другие соединения, преимущественно во фруктозу и этанол. Основные ферменты, необходимые для гидролиза крахмала и дальнейших превращений, – α-амилаза, глюкоамилаза и глюкозоизомераза. Их стоимость составляет примерно 30% общей стоимости всех ферментов, применяемых в настоящее время в промышленности.
Промышленное производство фруктозы и этанола из крахмала – это многоэтапный процесс, включающий следующие ферментативные и неферментативные стадии (рис. 13.10).
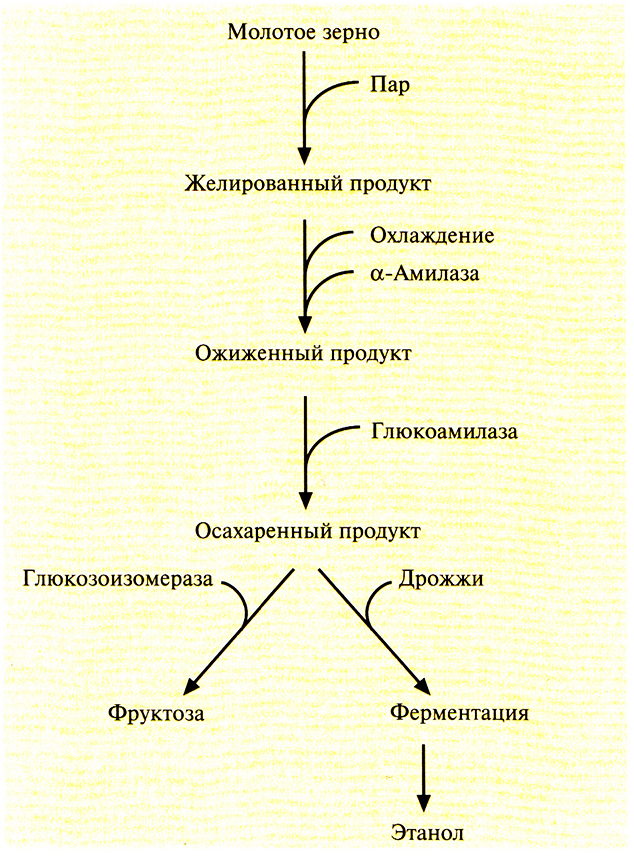
Рис. 13.10. Промышленное производство фруктозы и этанола из крахмала.
1. Желирование молотого зерна (обычно кукурузного, содержание крахмала в котором составляет примерно 40%). Для этого зерно обрабатывают паром под давлением, в результате чего разрушаются крахмальные зерна и крахмал становится доступным для последующего фрементативного гидролиза. Получаемый продукт имеет желеобразную консистенцию.
2. Ожижение. Желированный крахмал охлаждают до 50–60 °С и добавляют α-амилазу. При этом происходит гидролиз доступных а-1,4-связей и образуются низко молекулярные полисахариды. Высокая температура повышает эффективность проникновения фермента в желированный крахмал и увеличивает скорость гидролиза.
3. Осахаривание (полный гидролиз) низкомолекулярных полисахаридов (как линейных, так и разветвленных) до молекул глюкозы. Происходит под действием глюкоамилазы.
Конечным продуктом такой обработки является глюкоза, из которой затем можно получить этанол (с помощью дрожжевой ферментации) или фруктозу (с помощью глюкозоизомеразы). Благодаря высокой эффективности последнего процесса вместо сахарозы при приготовлении пищи и в пивоварении в Северной Америке используют более дешевую фруктозу. Крахмал при промышленном производстве фруктозы обычно получают из кукурузы, поэтому его конечный продукт называют кукурузным сиропом с высоким содержанием фруктозы или просто сиропом с высоким содержанием фруктозы, хотя он состоит из примерно равных долей фруктозы и глюкозы.
Фермент α-амилаза гидролизует α-1,4-связи в молекулах амилозы и аминопектина случайным образом, при этом образуется смесь глюкозы, мальтозы (два остатка глюкозы, соединенные α-1,4-связью), мальтотриозы (три остатка глюкозы, соединенные α-1,4-связью) и ряд α-декстринов, которые представляют собой фрагменты амилопектиновых цепей с поперечными сшивками (рис. 13.9). α-Амилазу можно выделять из многих микроорганизмов, но для промышленных целей ее обычно получают из Bacillus amyloliquefaciens.
Иногда для расщепления крахмала вместо α-амилазы или одновременно с ней используют β-амилазу, которая гидролизует каждую вторую а-1,4-связь, начиная с концов цепей амилозы и амилопектина, в результате чего образуются остатки мальтозы и различные р-декстрины.
Фермент глюкоамилаза гидролизует α-1,3-, α-1,4- и α-1,6-связи. Однако а-1,4-связи она гидролизует менее эффективно, чем α-амилаза, и поэтому обычно используется совместно с ней. Основная функция глюкоамидазы – расщепление поперечных сшивок в молекуле декстрина с превращением его в глюкозу. Этот и другие ферменты используются для уменьшения доли углеводов (декстринов) в нормальных сортах пива и получения так называемых светлых и сухих сортов. Обработку глюкоамилазой обычно проводят перед ферментацией, однако эти два процесса можно объединить. Глюкоамилазу синтезируют многие микроорганизмы, но обычно ее получают из грибов Aspergillus niger.
ВАЖНАЯ ВЕХА
Получение мультиплазмидных микроорганизмов, способных утилизировать несколько соединений
А. М. Чакрабарти U.S. patent 4,259,444, 1981
До появления технологии рекомбинантных ДНК одним из способов переноса генетического материала из одного микроорганизма в другой была конъюгация. Такой механизм обеспечивал перенос из клетки в клетку целых плазмид. А. М. Чакрабарти, проводивший эксперименты по переносу плазмид-«разрушительниц», т. е. плазмид, кодирующих все ферменты пути биодеградации определенного соединения, сконструировал штамм, содержащий несколько таких плазмид. Кодируемые плазмидными генами ферменты каждого катаболического
пути разрушали определенное органическое соединение. Взяв четыре разные бактерии, он создал один микроорганизм, содержащий плазмиды, которые обусловливали деградацию камфары, октана, салицилата и нафталина. Эта работа была новаторской и очень интересной не только с научной точки зрения (следует учесть, что она была проведена в начале 1970-х гг., до появления большинства генноинженерных методов). Она сыграла ключевую роль в официальном признании биотехнологии, поскольку данное изобретение получило в марте 1981 г., почти через девять лет с момента подачи заявления, патент США. После того как Верховный суд США вынес решение в пользу Чакрабарти, создание микроорганизмов с помощью генноинженерных методов было признано изобретением, которое можно было патентовать наравне с другими. Это решение суда и последующая выдача патента сыграли не менее важную роль, чем сам научный эксперимент, стимулировав развитие биотехнологической промышленности.
Повышение эффективности производства фруктозы и этанола
Стоимость производства этанола или фруктозы из молотого зерна в основном определяется стоимостью ферментов, которые обычно используются однократно. Поэтому разработка новых подходов недорогого широкомасштабного производства этих ферментов может существенно снизить стоимость конечных продуктов. Этого можно достичь несколькими способами.
- Использовать для сверх продукции ферментов быстрорастущие рекомбинантные микроорганизмы, утилизирующие недорогой субстрат. Это будет дешевле, чем получать ферменты из природных микроорганизмов.
- Использовать разновидности α-амилазы (встречающиеся в природе или созданные методами генной инженерии), которые обладают более высокой активностью и позволяют проводить ожижение при 80–90 °С. Это ускорит гидролиз желированного крахмала и сэкономит энергию, расходуемую на его охлаждение до температуры, при которой обычно проводят гидролиз.
- Модифицировать гены α-амилазы и глюкоамидазы таким образом, чтобы кодируемые ими ферменты имели одинаковые оптимумы температуры и рН. Это позволит совместить этапы ожижения и осахаривания.
- Найти или создать фермент, который будет эффективно расщеплять необработанный крахмал, что позволит исключить этап желирования и сэкономит большое количество энергии.
- Создать такой микроорганизм для ферментации, который будет синтезировать и секретировать глюкоамилазу, что устранит необходимость ее добавления в процессе ферментации.
В настоящее время проводятся исследования, которые покажут, возможна ли разработка таких подходов.
Гены, кодирующие α-амилазу, были выделены из многих микроорганизмов, в том числе из В. amyloliquefaciens и термофильной бактерии В. stearothermophilus. Для этого экстрагировали их хромосомную ДНК, частично гидролизовали ее рестрицирующей эндонуклеазой Sau3Al и встроили в обработанную рестриктазой BamHI плазмиду pUB110, которая содержит уникальный BamHI-сайт и несет ген устойчивости к канамицину. Полученным банком клонов трансформировали не обладающие α-амилазной активностью клетки В. subtilis, отобрали трансформированные клетки по признаку устойчивости к канамицину и тестировали их на способность к синтезу и секреции а-амилазы при помощи иод-крахмального теста. Для этого чашки с колониями, образованными трансформантами при 65 °С на содержащей крахмал твердой среде, поместили в пары иода. Колонии, продуцирующие α-амилазу, были окружены четко различимым гало, что свидетельствовало о гидролизе крахмала вблизи них. Положительный иод-крахмальный тест указывает на транскрипцию гена α-амилазы под контролем своего промотора (вектор не содержит промотора) и на наличие сигнала, необходимого для секреции (молекулы субстрата велики и не могут проникнуть в клетку). Возможность получения генов а-амилазы из разных источников позволила исследователям внести в них изменения, необходимые для того, чтобы эти гены можно было использовать в конкретных промышленных процессах.
Возможность исключения этапа осахаривания при производстве этанола из крахмала была доказана следующим образом. Выделенную из грибов Aspergillus awamori полноразмерную кДНК глюкоамилазы встроили в одну из плазмид Saccharomyces cerevisiae так, чтобы она находилась под контролем промотора и регуляторных последовательностей терминации транскрипции гена енолазы дрожжей (EN01). «Лабораторный» штамм S. cerevisiae, трансформированный этой плазмидой, приобрел глюкоамилазную активность и мог превращать растворимый крахмал в этанол.
К сожалению, некоторые свойства этого штамма (чувствительность к высокой концентрации этанола, неэффективность экспрессии кДНК глюкоамилазы, поддержание плазмид только при определенном давлении отбора) делают его непригодным для промышленного использования. Однако эти недостатки удалось устранить. Во-первых, продукцию глюкоамилазы повысили примерно в 5 раз, удалив из плазмиды область отрицательной регуляции ENO1-промотора длиной 175 п. н. Во-вторых, из плазмиды удалили «дрожжевой» сайт инициации репликации и встроили в нее сегмент ДНК, гомологичный участку дрожжевой хромосомы, превратив ее тем самым в интегрирующий вектор, который встраивается в дрожжевую хромосому и стабильно поддерживается в клетке. В-третьих, в качестве клетки-хозяина для модифицированной таким образом плазмиды использовал: другой штамм S. cerevisiae (пивные дрожжи), устойчивый к высокой концентрации этанола.
В результате получили два новых штамма дрожжей, которые гидролизуют и ферментируют растворимый крахмал более эффективно, чем близкие к S. cerevisiae природные амилолитические (гидролизующие крахмал) дрожжи S. diastaticus (табл. 13.4). «Пивной» штамм S. cerevisiae с встроенным в хромосому геном глюкоамилазы действовал более эффективно, чем «лабораторный» с тем же геном в составе многокопийной плазмиды, что, по-видимому, свидетельствует о ее нестабильности и утрате введенного гена глюкоамилазы. Как «лабораторный», так и «пивной» штаммы S. cerevisiae до введения в них гена глюкоамилазы не могли утилизировать растворимый крахмал. Плазмидная и интегрированная кДНК глюкоамилазы A. awamori находилась под контролем регуляторных последовательностей гена EN01, откуда была удалена область отрицательной регуляции длиной 175 п. н. Для поддержания плазмиды создавалось определенное селективное давление.
Таблица 13.4. Расщепление растворимого крахмала (25%, в/о) разными штаммами дрожжей1)

Для повышения продукции глюкоамилазы в хромосомную ДНК грибов A. niger встроили несколько копий ее гена. Оказалось, что активность глюкоамилазы не коррелирует с числом копий гена, но сильно зависит от того, в какой участок хромосомы они были встроены. Таким образом, простого увеличения числа копий гена недостаточно для повышения продукции активного фермента.
Фермент глюкозоизомеразу следовало бы назвать ксилозо/глюкозоизомеразой, поскольку основная катализируемая им реакция – это превращение пятиуглеродного моносахарида D-ксилозы в D-ксилулозу, а реакция изомеризации D-глюкозы в D-фруктозу является побочной. Ксилозо/глюкозоизомераза имеет более низкую каталитическую константу kсаt и более высокую константу связывания Км для глюкозы, чем для ксилозы; это означает, что ксилоза прочнее связывается с ферментом и быстрее превращается в ксилулозу, чем глюкоза превращается во фруктозу.
С помощью внутриклеточных ферментов, к которым относится ксилозо/глюкозоизомераза, не удается получать продукты такой же степени чистоты и в таком же количестве, как в случае внеклеточных (секретируемых) ферментов. Большинство ферментов, используемых в промышленных процессах, не подвергаются тщательной очистке, а в препарате внеклеточного фермента обычно содержится гораздо меньше белковых примесей, чем в экстракте внутриклеточного. Кроме того, для получения экстракта внутриклеточного фермента необходимо отделить клетки от культуральной среды, механически их разрушить и удалить образовавшиеся фрагменты. Все это повышает стоимость конечного продукта – ксилозо/глюкозоизомеразы. Чтобы решить эту проблему, можно иммобилизовать фермент на твердом носителе и использовать его многократно.
Изомеризация глюкозы с образованием фруктозы – обратимая реакция, конечное содержание образующейся в ее ходе фруктозы находится в прямой зависимости от температуры, которая в большинстве производственных процессов составляет примерно 60 °С. Повысив температурный оптимум и термостабильность ксилозо/глюкозоизомеразы, можно увеличить выход фруктозы.
Термофильная бактерия Thermus thermophilus продуцирует ксилозо/глюкозоизомеразу, которая сохраняет свою активность и остается стабильной при 95°С, а потому представляется весьма перспективной для промышленного использования. К сожалению, природный штамм Т. thermophilus вырабатывает ее в небольшом количестве. Чтобы устранить этот недостаток, выделили ген ксилозо/глюкозоизомеразы Т. thermophilus и осуществили его экспрессию в Е. coli и В. brevis с использованием разных промоторов и разных сайтов связывания с рибосомой (табл. 13.5). В последней из представленных в табл. 13.5 систем фермент вырабатывался в количестве, более чем в 1000 раз превышающем исходное, что позволяет использовать ее для промышленного получения фруктозы.
Таблица 13.5. Активность ксилозо/глюкозоизомеразы Т. thermophilus в разных бактериях1)

Есть еще одна возможность – повысить субстратную специфичность фермента. В одной из серий экспериментов с помощью сайт-специфического мутагенеза заменяли нуклеотиды, кодирующие одну шт две аминокислоты ксилозо/глюкозоизомеразы термофильной бактерии Clostridium thermosulfurogenes. Выбор сайтов для модификации основывался на данных об участии соответствующих аминокислот в связывании субстрата. Замена триптофана в положении 139 на фенилаланин или валина в положении 186 на треонин привела к повышению каталитической эффективности (kсаt/KM) фермента в отношении глюкозы в 1,7 и 2,6 раза соответственно (табл. 13.6) и к ее уменьшению для ксилозы в 2 и 7 раз. При одновременной замене двух аминокислот каталитическая эффективность в отношении глюкозы повысилась в 5,7 раза, а в отношении ксилозы снизилась в 4,5 раза. Таким образом, двойная замена привела к тому, что фермент, который исходно был в 17 раз активнее в отношении ксилозы, стал в 1,5 раза активнее в отношении глюкозы. Изменение специфичности и повышение термостабильности ксилозо/глюкозоизомеразы, которого удалось достичь, позволит использовать ее для промышленного превращения глюкозы во фруктозу.
Таблица 13.6. Каталитическая эффективность природной
и мутантных форм ксилозо/глюкозоизомеразы С. thermosulfurogenes1)

Zymomonas mobilis
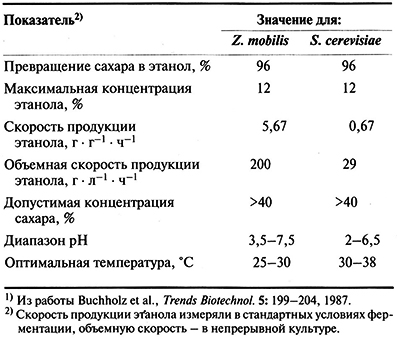
Сбраживание субстрата при промышленном производстве этанола осуществляют в основном с помощью S. cerevisiae, но вместо нее можно было бы использовать бактерию Zymomonas mobilis. Это грамотрицательная палочка, которая сбраживает глюкозу, фруктозу и сахарозу с относительно большим выходом этанола (табл. 13.7). По-видимому, это связано со снижением ее пролиферации (прироста биомассы) в ходе ферментации и уменьшением количества расходуемого на это субстрата, который теперь идет на образование этанола. Расщепляя 1 моль глюкозы, дрожжи вырабатывают 2 моля ATP, а использующая другой метаболический путь Zymomonas – 1 моль. Исторически сложилось так, что Zymomonas использовали для ферментации при производстве алкогольных напитков в тропических странах (например, в Мексике для производства напитка, называемого пулька, который содержит 3–5% спирта и вырабатывается из сока агавы).
Основное различие между Zymomonas и S. cerevisiae как продуцентами этанола заключается в скорости его образования. У Zymomonas она гораздо выше (табл. 13.7). Однако существуют некоторые биологические и технические ограничения, не позволяющие использовать Zymomonas для промышленного производства этанола:
1) небольшое число углеродных субстратов, которые она может использовать для синтеза этанола;
2) проблемы, возникающие при поддержании в ней клонирующих векторов с широким кругом хозяев, а значит, и чужеродных генов;
3) природная устойчивость к наиболее распространенным антибиотикам, что не позволяет при проведении экспериментов по клонированию использовать стандартные маркерные системы устойчивости к антибиотикам.
Таблица 13.7. Сравнение Z. mobilis и S. cerevisiae как продуцентов этанола1)
Несмотря на все это ученым удалось встроить и экспрессировать в Zymomonas некоторые чужеродные гены. Большинство проведенных экспериментов были направлены на расширение спектра утилизируемых ею субстратов. Так, в Zymomonas были введены гены ферментов, гидролизующих лактозу, крахмал, целлюлозу, ксилозу и целлобиозу. Трансформированные клетки экспрессировали все эти гены, но в большинстве случаев не могли использовать перечисленные выше субстраты в качестве единственного источника углерода. Придать Zymomonas новые катаболические свойства оказалось весьма непросто, хотя по крайней мере в одном случае удалось использовать этот микроорганизм для получения этанола из отходов, содержащих ксилозу.
В самом начале работы по созданию штаммов Z. mobilis, способных расти и продуцировать этанол с использованием ксилозы в качестве субстрата, в эту бактерию ввели гены глюкозо/ксилозоизомеразы и ксилулокиназы – ферментов, необходимых для утилизации ксилозы. Но полученные трансформанты не могли использовать образующиеся при расщеплении ксилозы пентозы (ксилулозо-5-фосфат, рибулозо-5-фосфат и рибозо-5-фосфат). Поэтому на следующем этапе в Z. mobilis ввели плазмиду, несущую два синтетических оперона, один из которых кодировал два фермента, расщепляющих ксилозу, а другой – два фермента, метаболизирующих пентозу (транскетолазу и трансальдолазу) (рис. 13.11). Транскрипция генов первого оперона находилась под контролем сильного конститутивного промотора гена глицеральдегид-3-фосфатдегидрогеназы Z. mobilis, а второго – под контролем промотора гена енолазы Z. mobilis. Эти два синтетических оперона встроили в челночный вектор Е. coli–Z. mobilis, которым и трансформировали Z. mobilis. Как и ожидалось, трансформированные клетки утилизировали ксилозу и преобразовывали пентозы до фруктозо-6-фосфата и глицеральдегид-3-фосфата, которые затем превращались в этанол по пути Энтнера–Дудороффа. Более того, трансформанты эффективно росли на глюкозе, ксилозе и их смеси и превращали ксилозу в этанол с большим выходом последнего. Эта работа продемонстрировала возможность генноинженерной модификации Z. mobilis для создания микроорганизма – продуцента этанола, который использовал бы в качестве источника углерода ксилозу, побочный продукт деревообрабатывающей и целлюлозно-бумажной промышленности.
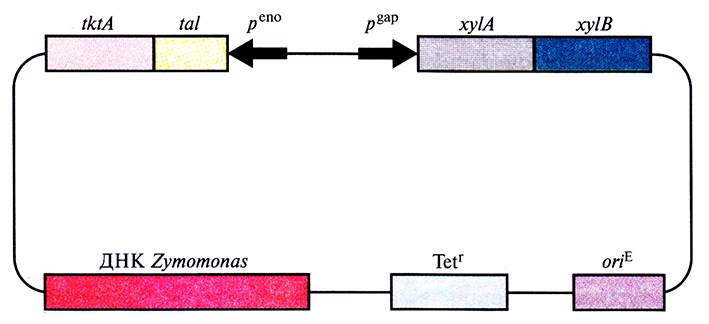
Рис. 13.11. Челночный вектор Zymomonas–Е. coli, несущий два оперона, один из которых содержит гены ферментов, необходимых для утилизации ксилозы (xylA и xylB), а другой – гены ферментов, участвующих в метаболизме пентозы (tktA и tal). Стрелками указано направление транскрипции с каждого промотора рeno – промотор гена енолазы, pgap – промотор гена глицеральдегид-3-фосфатдегидрогеназы, xylA – ген ксилозоизомеразы, xylB – ген ксилулокиназы, tktA – ген транскетолазы, tal – ген трансальдолазы, Tetr – ген устойчивости к тетрациклину, oriE– точка инициации репликации Е. coli. ДНК Zymomonas содержит собственную точку инициации репликации.
Получение силоса
Такие сельскохозяйственные культуры, как кормовые злаки, кукуруза и люцерна, широко используются в качестве корма для скота, поэтому очень важно обеспечить правильные условия их хранения в течение многих месяцев. Традиционно для этого применяют природные молочнокислые бактерии, для которых растительный материал служит субстоатом при синтезе молочной и уксусной кислот. Эти кислоты подавляют рост других микроорганизмов, способствуя сохранению кормовой растительной массы (силоса). Если молочнокислые бактерии присутствуют на свежем растительном материале в небольшом количестве, нужно добавить бактериальный посевной материал (обычно Lactobacillus plantarum). К сожалению, эта мера оказывается малоэффективной в том случае, когда растительная культура содержит недостаточное для поддержания роста бактерий и производства молочной кислоты количество водорастворимых углеводов.
Для создания бактерии, способной осуществлять эффективную ферментацию растительного материала, встроили ген α-плазмиды «не силосного» штамма L. amylovorus в хромосомный ген конъюгированной гидролазы желчных кислот (cbh) одного из штаммов L. plantarum (рис. 13.12). Этот ген кодирует фермент, который активируется при попадании бактерии в кишечник животного и, следовательно, не нужен при образовании силоса. Данная работа представляет собой первый шаг на пути создания штаммов L. plantarum, способствующих более эффективному образованию силоса из сельскохозяйственных культур, содержащих много крахмала, таких как люцерна.
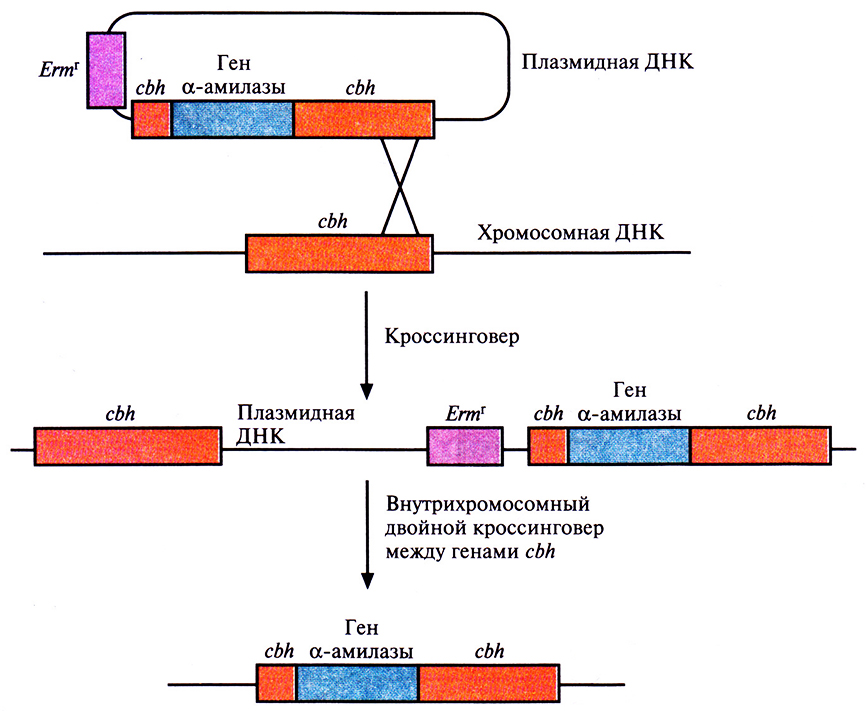
Рис. 13.12. Введение гена α-амилазы в хромосому L. plantarum. Ген α-амилазы встраивают в ген cbh челночной плазмиды Е. coli–L. plantarum, которой затем трансформируют клетки L. plantarum. В результате кроссинговера между cbh-локусами плазмидной и хромосомной ДНК образуются клоны L. plantarum, устойчивые к эритромицину и обладающие α-амилазной активностью. При выращивании трансформированных клеток в течение достаточно длительного времени (не менее 30 генераций) в неселективных условиях может произойти внутрихромосомный двойной кроссинговер, приводящий к элиминации гена устойчивости к эритромицину Ermr, хромосомного гена cbh и плазмидной ДНК.
УТИЛИЗАЦИЯ ЦЕЛЛЮЛОЗЫ
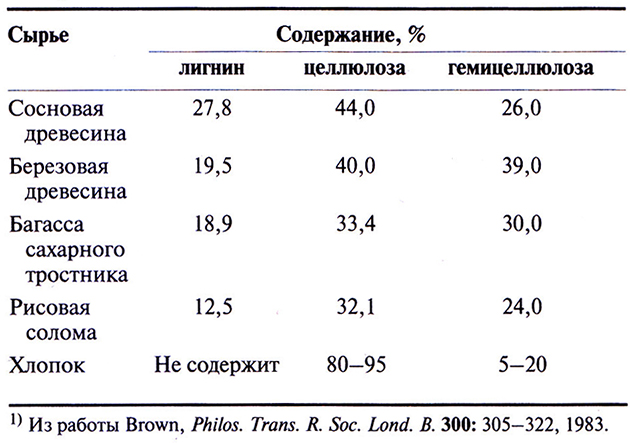
Структурный каркас почти всех наземных растений состоит из полимеров: лигнина, гемицеллюлозы и целлюлозы. Объединяясь в разных пропорциях, они образуют лигноцеллюлозный материал (табл. 13.8), на долю которого приходится основная часть биомассы, остающейся в огромном количестве в виде отходов сельского хозяйства, деревообрабатывающей промышленности и других отраслей хозяйственной деятельности человека. Эти отходы необходимо переработать или использовать в качестве промышленного сырья. С этой точки зрения лигноцеллюлозные материалы можно разделить на три класса.
- Сами растения, специально выращиваемые для получения целлюлозы, строительных материалов или корма для скота (хлопок, древесина, сено).
- Растительные отходы, остающиеся после сбора и переработки урожая и после обработки древесины (солома, рисовая шелуха, багасса сахарного тростника, древесная шепа, опилки и т. д.).
- Бытовые отходы (использованные бумага, картон и т. д.).
Таблица 13.8. Состав разных лигноцеллюлозных материалов 1)
Компоненты лигноцеллюлозы
Лигнин – глобулярный нерегулярный нерастворимый полимер (мол. масса >10 000), состоящий из остатков фенилпропана (рис. 13.13). Молекулы этого ароматического вещества при образовании лигнина соединяются друг с другом случайным образом с помощью разных химических связей, не поддающихся ферментативному гидролизу или химическому расщеплению. У растений лигнин образует комплекс с гемицеллюлозой, в который заключены проводящие пучки. Лигнин обусловливает ригидность растений, а также их устойчивость к механическим повреждениям и действию микробов.
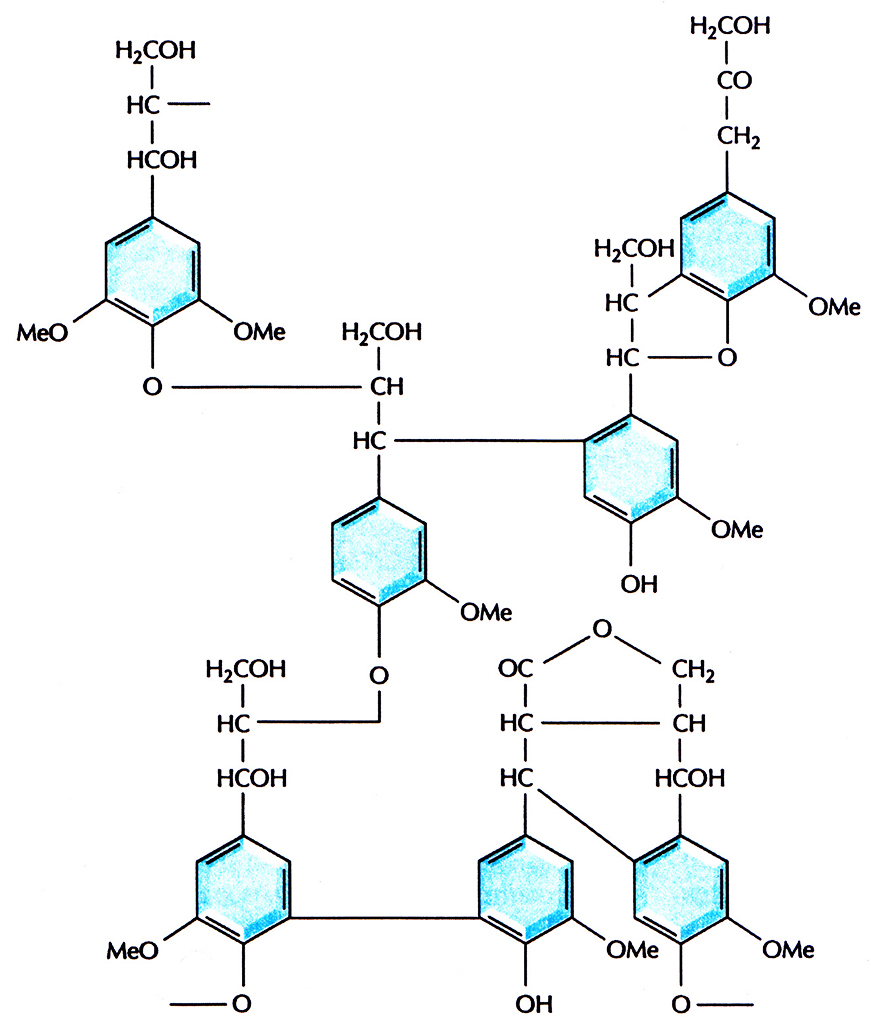
Рис. 13.13. Структура лигнина. Представлены лишь некоторые из возможных способов соединения остатков фенилпропана (шестиуглеродного ароматического соединения, содержащего алкильную группу).
Гемицеллюлозы – это короткоцепочечные гетерогенные полимеры, состоящие из гексозных (шестиуглеродные сахара, такие как глюкоза, манноза и галактоза) и пентозных (пятиуглеродные сахара, такие как ксилоза и арабиноза) единиц. Все гемицеллюлозы можно разделить на три основных типа: ксиланы, остов которых состоит из молекул поли-β-1,4-ксилана с присоединенными к ним арабинозой, глюкуроновой и арабиноглюкуроновой кислотами; маннаны, состоящие из глюкоманнанов и галактоманнанов; арабиногалактаны. Тип гемицеллюлозы обычно зависит от ее происхождения; так, ксиланы обычно содержатся в твердых сортах древесины, а глюкоманнаны – в мягких.
Целлюлоза, наиболее простой компонент лигноцеллюлозы, является самым распространенным природным полимером. Его длинные цепи состоят из остатков D-глюкозы. соединенных β-1,4-связями (рис. 13.14). При гидролизе из целлюлозы, как и из крахмала, образуется глюкоза, но сами эти исходные вещества имеют разное строение. Крахмал – запасающая энергию молекула, остатки глюкозы в которой соединены так, что полимерные цепи не могут располагаться упорядоченно и образуют сетчатую структуру, легко пропускающую воду; поэтому он растворяется в воде и легко гидролизуется амилазами и глюкоамилазами. В целлюлозе полимерные цепи упакованы так, что образуется кристаллоподобная структура, непроницаемая для воды; поэтому целлюлоза не растворяется в воде и устойчива к гидролизу.
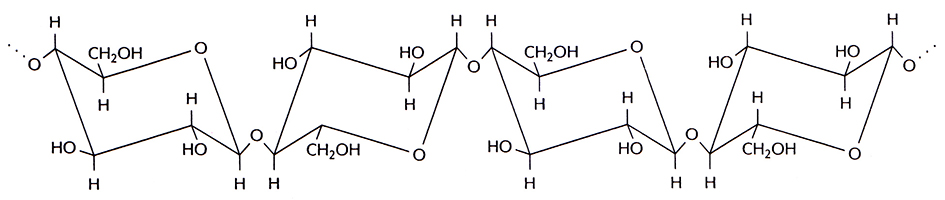
Рис. 13.14. Сегмент полимерной цепи целлюлозы. Остатки глюкозы соединены β-1,4-связями «голова к хвосту».
Целлюлоза – очень ценный материал, из которого можно получать множество продуктов (например, этанол). Но сначала необходимо высвободить ее из комплекса с лигнином и гемицеллюлозой. Для этого можно обработать лигноцеллюлозный материал сильной кислотой или сильной щелочью либо подвергнуть его действию высоких температуры и давления. В любом случае необходимые для этого энергетические затраты существенно повысят стоимость конечного продукта.
Годовое производство лигноцеллюлозы огромно, поэтому ведется непрерывный поиск более эффективных способов ферментативного расщепления целлюлозы (и, в меньшей степени, гемицеллюлозы). Кроме того, разрабатываются методы избирательного химического и ферментативного расшепления лигнина.
Выделение прокариотических целлюлозных генов
Многие бактерии и грибы способны расщеплять целлюлозу благодаря совместному действию нескольких ферментов, называемых целлюлазами.
У некоторых микроорганизмов они входят в состав целлюлосомы – белкового комплекса, находящегося на клеточной поверхности. Эти ферменты следующие:
- эндоглюканаза, которая гидролизует β-1,4-связи между соседними остатками глюкозы в неплотно упакованных областях целлюлозы, образуя разрывы в середине цепи (рис. 13.15)
- экзоглюканаза, которая расщепляет разорванные целлюлозные цепи с нередуцирующих концов с образованием глюкозы, целлобиозы (два остатка глюкозы) и целлотриозы (три остатка глюкозы)
- целлобиогидролаза, которая часто присутствует в целлюлолитических грибах и является разновидностью экзоглюканазы, отщепляющей фрагменты из 10 и большего числа остатков глюкозы с нередуцирующих концов молекул целлюлозы
- β-глюкозидаза, или целлобиаза, которая катализирует превращение целлобиозы и целлотриозы в глюкозу (рис. 13.15).
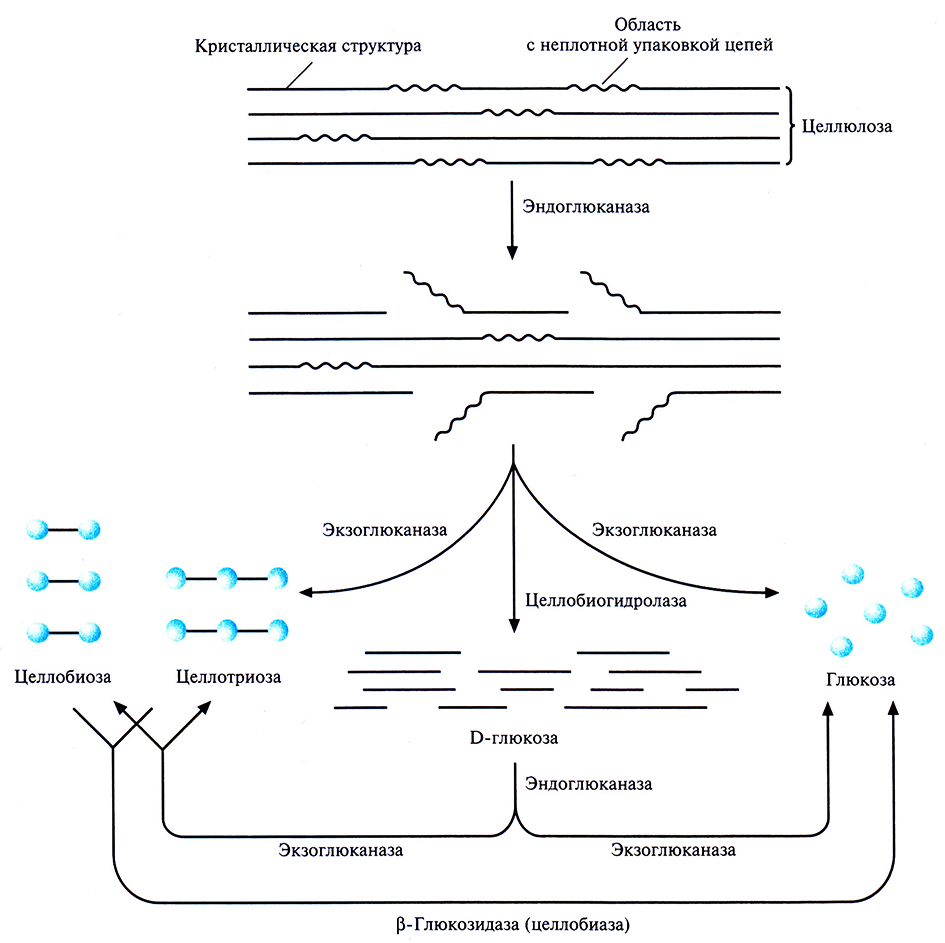
Рис. 13.15. Биодеградация целлюлозы. Гидролиз цепей начинается с расщепления эндоглюканазой β-1.4-связей в неплотно упакованных областях. Затем экзоглюканаза(ы) и целлобиогидролаза(ы) отщепляют олигосахариды с нередуцируюшего конца частично гидролизованных цепей. Далее β-глюкозидаза катализирует превращение целлобиозы и целлотриозы в глюкозу.
Расщепление целлюлозы с помощью целлюлолитических микроорганизмов происходит медленно и часто не до конца. Поэтому были предприняты попытки создать с помощью генной инженерии микроорганизмы, обладающие более высокой целлюлазной активностью. Для этого выделили про- и эукариотические гены, кодирующие отдельные ферменты целлюлазного комплекса.
Прокариотические эндоглюканазные гены клонировали и идентифицировали с помощью следующего простого, но эффективного подхода.
1. Клонированием в Е. coli создали банк ДНК-клонов целлюлолитического прокариотического организма и вырашивали рекомбинантные клетки в течение 12 ч на твердой среде, содержащей селективный антибиотик.
2. Образовавшиеся колонии покрыли слоем агара, содержащего карбоксиметилцеллюлозу (КМК), растворимое производное целлюлозы, и инкубировали при 37 °С еще несколько часов. За это время произошло частичное расщепление молекул КМК, находящихся вблизи колоний, которые синтезируют и секретируют эндоглюканазу. Трансформированные клетки, синтезирующие, но не секретирующие эндоглюканазу, не способны расщеплять данный субстрат, молекулы которого из-за большого размера не проникают в клетку.
3. Те области, где произошел гидролиз КМК, выявляли с помощью не токсичного для бактерий красителя конго красного и раствора хлорида натрия. Конго красный избирательно связывается с целлюлозой, окрашивая ее в красный цвет, и слабо связывается с низкомолекулярными сахаридами, окрашивая их в желтоватый цвет. Обработка хлоридом натрия стабилизирует цвет. Колонии, продуцирующие секретируемую эндоглюканазу, были окружены желтым гало, а фон, создаваемый нерасщепленной КМК, имел красный цвет.
С помощью этого подхода были выделены гены эндоглюканазы из Streptomyces, Clostridium, Thermoanaerobacter, Thermomonospora, Erwinia, Pseudomonas, Cellvibrio, Rumirtococcus, Cellulomonas, Fibrobacter и Bacillus.
Для выявления рекомбинантных клонов, синтезирующих экзоглюканазу, использовали иммунный скрининг, позволяющий идентифицировать белок-мишень с помощью специфичных к нему антител; секреция белка при этом необязательна. Рекомбинантные клетки лизировали in situ (парами хлороформа), перенесли цитоплазматические белки на найлоновый или нитроцеллюлозный фильтр и провели иммунологический тест. Использованный при этом метод реплик позволил сохранить жизнеспособные клетки для дальнейших исследований.
Прокариотические β-глюкозидазные гены выделяли с помощью трансформации Е. coli банком ДНК-клонов, полученным из продуцирующего данный фермент микроорганизма, и отбора трансформантов, способных расти на минимальной среде с целлобиозой в качестве единственного источника углерода. Клоны, проявляющие β-глюкозидазную активность, можно также выявлять с помощью среды, содержащей хромо генный субстрат (например, 5-бром-4-хлор-3-индол-β-D-глюкопиранозид), или целлобиозного агара Мак-Конки; в этих условиях колонии окрашиваются в красный цвет.
Выделение эукариотических целлюлозных генов
Скрининг кДНК- или геномных библиотек с помощью гибридизации с гетерологичным зондом не очень эффективен при идентификации целлюлазных генов, поскольку их нуклеотидные последовательности довольно сильно различаются у разных организмов. Поэтому нужны новые подходы для выделения мРНК целлюлолитических ферментов из грибов или растений. К сожалению, эти мРНК составляют лишь небольшую часть суммарной мРНК, поэтому приходится обогащать библиотеки этими мРНК или кДНК и элиминировать кДНК-клоны, не несушие последовательности-мишени. Для выделения некоторых генов эукариотических целлюлаз использовали метод «дифференциальной гибридизации», суть которого состоит в следующем (рис. 13. 16).
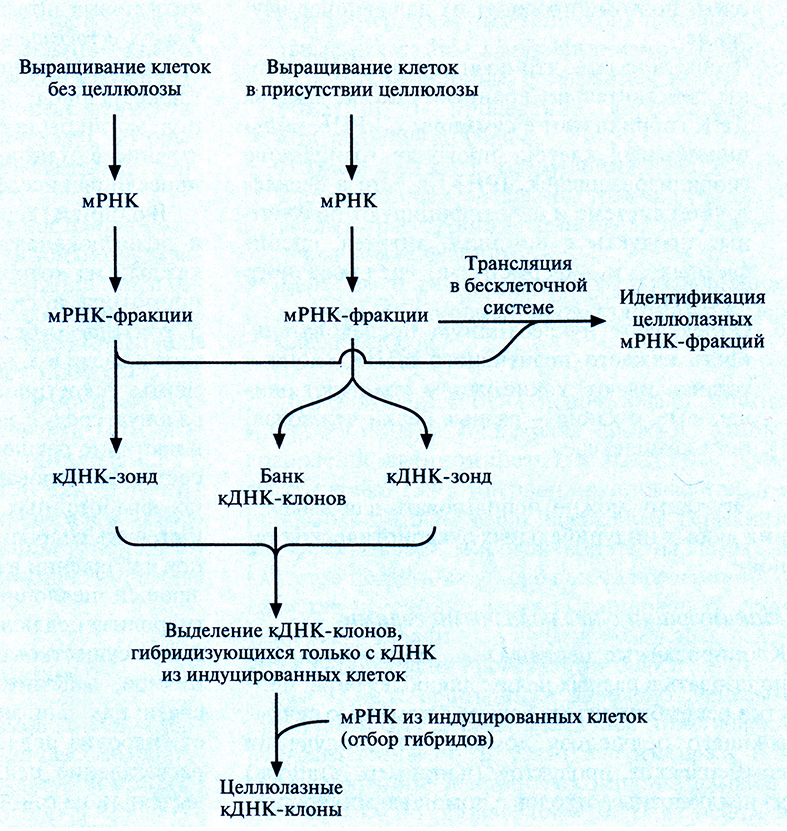
Рис. 13.16. Идентификация кДНК-клонов, кодирующих эукариотические целлюлазы, с помошью дифференциальной гибридизации.
1. Выделяют мРНК из клеток, выращенных на среде без целлюлозы (неиндуцированных клеток), и клеток, которые для увеличения продукции целлюлаз были выращены в присутствии целлюлозы или ее производных (индуцированных клеток).
2. Каждую популяцию мРНК фракционируют в градиенте плотности сахарозы. Проводят трансляцию мРНК каждой фракции в бесклеточной системе на основе ретикулоцитов кролика или зародышей пшеницы. Определяют мол. массу соответствующих белков и проводят иммунологический тест, с тем чтобы идентифицировать фракцию (или фракции), содержащую мРНК целлюлазы. Разделяют продукты трансляции в полиакриламидном геле и выявляют полосы, происходящие от индуцированных клеток и отсутствующие для неиндуцированных; материал этих полос и представляет собой белки, синтез которых был индуцирован целлюлозой.
3. мРНК-фракции индуцированных клеток, детерминирующие синтез целлюлаз, и их «партнеры» в градиенте плотности сахарозы мРНК неиндуцированных клеток по отдельности используют в качестве матриц для синтеза кДНК.
4. кДНК индуцированных клеток клонируют в плазмидном или фаговом векторе, вводят в Е. coli, высевают на чашки, делают реплики и проводят скрининг, используя в качестве гибридизационных зондов радиоактивно меченную кДНК фракций из индуцированных и неиндуцированных клеток. Клоны, гибридизуюшиеся с кДНК индуцированных и не гибридизующиеся с кДНК неиндуцированных клеток, могут содержать целлюлазные гены, поэтому проводят их дальнейшее изучение.
5. Чтобы доказать, что позитивные кДНК-клоны действительно кодируют целлюлазы, их ДНК гибридизуют с суммарной мРНК индуцированных клеток, проводят трансляцию гибридизовавшейся мРНК in vitro в бесклеточной системе и идентифицируют полученные продукты с помощью антител, специфичных к ферментам целлюлазного комплекса.
6. Определяют нуклеотидную последовательность каждого позитивного кДНК-клона и устанавливают, какие клоны кодируют одинаковые, а какие – разные белки целлюлазного комплекса.
Эту схему можно использовать для выделения любых индуцибельных эукариотических генов.
Манипуляции с целлюлазными генами
Клонированные целлюлазные гены можно использовать в разных целях: для облегчения очистки рекомбинантных белков с помощью связывающего целлюлозу домена; для получения коммерческих продуктов (например, этанола) из целлюлозных отходов с помощью микроорганизмов, в которые встроены целлюлазные гены.
Молекула целлюлазы обычно состоит из трех доменов: каталитического, шарнирного, часто обогащенного остатками пролина, серина и треонина, и связывающего целлюлозу. Каталитический и связывающий домены функционируют независимо друг от друга. Такое разделение функций можно использовать, включив нуклеотидную последовательность связывающего целлюлозу домена в состав химерного гена, другая часть которого кодирует представляющий коммерческий интерес белок. Чтобы очистить полученный белок, его экстракт пропускают через колонку, набитую целлюлозой. С целлюлозой связывается только гибридный белок; его элюируют и удаляют «целлюлозный» домен протеолизом. Эта система сходна с иммуноаффинной хроматографией, но обходится дешевле.
Большинство целлюлазных генов исходно клонировали и экспрессировали в Е. coli, но их можно ввести в другие микроорганизмы и получить новые штаммы с полезными свойствами. Так, S. cerevisiae и Z. mobilis, эффективно преобразующие в этанол простые сахара (например, глюкозу) после введения им целлюлазных генов, могли бы превращать целлюлозу непосредственно в этанол. Для проверки этой гипотезы провели ряд исследований.
В одной из серий экспериментов гены эндо- и экзоглюканазы бактерии Cellulomonas fimi. каждый из которых находился под контролем промотора и сигнальной последовательности S. cerevisiae, субклонировали в плазмидном векторе и ввели в S. cerevisiae. Некоторые трансформанты секретировали оба фермента в культуральную среду с эффективностью примерно 70% и частично расщепляли целлюлозу, входящую в состав фильтровальной бумаги и предварительно обработанных древесных стружек. Скорость и степень гидролиза этих субстратов возрастала при добавлении в смесь β-глюкозидазы, расщепляющей целлобиозу до глюкозы, но полного гидролиза целлюлозы не происходило. Это связано с существованием двух регуляторных механизмов, действующих по принципу обратной связи: накапливающаяся целлобиоза ингибирует гидролиз целлюлозы, а глюкоза ингибирует расщепление целлобиозы. Ген β-глюкозидазы выделили из грибов Trichoderma reesei, клонировали в мультикопийной плазмиде и вновь ввели в Т. reesei. Трансформированный штамм продуцировал β-глюкозидазу в 5,5-кратном избытке и расщеплял производное целлюлозы авицел (Avicel) на 33% быстрее, чем нетрансформированный штамм. Это подтверждает данные о том, что β-глюкозидаза облегчает ферментативное расщепление целлюлозы, и позволяет предположить, что для создания более эффективных целлюлолитических микроорганизмов нужно встроить в уже существующие штаммы гены β-глюкозидазы.
Эндоглюканазные гены можно использовать не только для получения из целлюлозных отходов полезных веществ, но и для других целей. Если ввести ген эндоглюканазы, находящийся под контролем конститутивного промотора актинового гена дрожжей, в винные дрожжи, можно усилить аромат получаемого вина. Это связано с повышением содержания в нем как минимум 12 летучих соединений, в том числеэтилпроттионата, 2-бутанола, изоамилацетата, изоамилонового спирта и изомасляной кислоты. С помощью такой генетической модификации можно стабилизировать процесс ферментации и создать такие штаммы дрожжей, которые будут производить вина с определенными свойствами.
Исследовалась также возможность использования целлюлаз при промышленной биопереработке бумажных отходов в этанол. Для этого отходы частично расщепляли целлюлазами при 45 °С, а затем, не удаляя целлюлаз, проводили ферментацию высвободившейся глюкозы с помощью S. cerevisiae при 37 °С. Основываясь на полученных результатах, рассчитали, что этот подход позволит получить 400 л этанола из 1 т бумажных отходов. Если все 100 млн. т бумажных отходов, ежегодно образующихся в Северной Америке, превратить в этанол и использовать его в качестве топлива, можно сэкономить примерно 16% бензина.
БЕЛОК ОДНОКЛЕТОЧНЫХ ОРГАНИЗМОВ
Белок одноклеточных организмов (БОО) – термин, принятый для обозначения белковых продуктов, синтезируемых монокультурой микробных клеток и использующихся в качестве пищевых добавок или корма для скота. Вопрос об использовании микробной биомассы в качестве источника белка рассматривается вполне серьезно. Это связано не только с дефицитом продовольствия в общемировом масштабе, но и с тем, что содержание белка в большинстве микроорганизмов весьма велико: на его долю приходится примерно 60–80% сухой массы клетки. Кроме того, благодаря высокому содержанию метионина, лизина, витаминов и важных минералов БОО обладает более высокой пищевой ценностью, чем некоторые виды пищи растительного и животного происхождения. Но широкое применение БОО сдерживается по ряду причин.
- Высокое содержание нуклеиновых кислот, что может представлять опасность при некоторых патологических состояниях.
- Возможное присутствие в продуктах токсичных веществ, адсорбированных из субстрата (например, тяжелых металлов) или вырабатываемых самим микроорганизмом (например, микотоксинов), и связанная с этим необходимость проведения дорогостоящих контрольных анализов.
- Низкая скорость разрушения микробных клеток в пищеварительном тракте, что может вызвать расстройство пищеварения или аллергические реакции.
- Более высокая стоимость БОО по сравнению с другими белковыми продуктами, например с белками сои.
Для получения БОО использовали многие микроорганизмы (бактерии, дрожжи, грибы, водоросли, актиномицеты) и различные субстраты (табл. 13.9). Впервые крупномасштабное производство БОО было налажено в Германии во время Первой мировой войны: на патоке в качестве источника углерода и солях аммония в качестве источника азота выращивали S. cerevisiae и добавляли их в супы и колбасные изделия для повышения содержания белка.
Таблица 13.9. Субстраты и микроорганизмы,
использующиеся при производстве БОО

До 1973 г. нефть была довольно дешевым продуктом, а ее запасы считались практически неограниченными. В связи с этим сразу несколько крупных нефтяных компаний разработали проект по производству БОО из нефти и продуктов ее переработки. Но цены на нефть росли, и интерес к этим проектам пропал. В 1970-х гг. компания Imperial Chemical Industries (TCI) разработала непрерывный процесс ферментации метанола с помощью бактерии Methylophilus methylotrophus для коммерческого производства белка прутина. Эта бактерия использует метан (точнее, метанол) в качестве основного субстрата. В 1979 г. был построен завод с самым большим в мире работающим в непрерывном режиме эрлифтным ферментером, способным производить до 50 000 т БОО в год. Но несмотря на инвестиции ICI, составившие более 200 млн. долл., и серьезные инженерные и биотехнологические успехи, к 1987 г. на этой установке было произведено лишь незначительное количество БОО, поскольку его получение с помощью М. methylotrophus оказалось невыгодным.
В последнее время интерес к БОО появился снова; теперь это связано с утилизацией различных отходов (например, целлюлозы и сыворотки). В одних случаях предполагается использовать природные микроорганизмы, в других – микроорганизмы, созданные методами генной инженерии. Но так или иначе, перспективы развития производства БОО будут определяться не природой микроорганизмов, а экономическими соображениями. Возможно, рентабельность производства удастся повысить, если БОО будут получать из побочных продуктов утилизации отходов. Для того чтобы разработать экономичный процесс производства БОО из отходов, необходимо изучить кинетику роста, метаболизм, возможности генетического манипулирования и безопасность многих микроорганизмов, а также вкусовые качества синтезируемых ими продуктов.
Разработан новый подход, с помощью которого можно будет обеспечивать крупный рогатый скот белком, обогащенным незаменимыми аминокислотами. Простое добавление белков в корм – дорогостоящий и не особенно эффективный способ, поскольку белки и аминокислоты разрушаются бактериями рубца еще до того, как животное успеет их использовать. Кроме того, основное количество белка они получают не с кормом; его поставляют присутствующие в рубце микроорганизмы. Рацион животных можно обогатить, если направленно модифицировать эти бактерии. Для этого сначала был синтезирован белок с высоким содержанием остатков метионина, треонина, лизина и лейцина. Он состоял из 100 аминокислот, 57 из которых были незаменимыми, и имел стабильную α-спиральную конфигурацию. Затем с помощью 14 частично перекрывающихся олигонуклеотидов синтезировали его ген и сшили его с геном белка, связывающего мальтозу; полученный гибридный ген экспрессировали в Е. coli под транскрипционным контролем tac-промотора. На долю гибридного белка приходилось примерно 12% суммарного внутриклеточного белка. Теперь нужно выяснить, будет ли этот белок синтезироваться в достаточном количестве присутствующими в рубце бактериями. Если этот подход окажется успешным, то он станет основой уникальной системы непрерывного обеспечения крупного рогатого скота незаменимыми аминокислотами.
ЗАКЛЮЧЕНИЕ
Биодеградация – это процесс разрушения микроорганизмами веществ, загрязняющих окружающую среду. Многие бактерии рода Pseudomonas несут плазмиды, кодирующие ферменты, которые катализируют расщепление ароматических и галогенсодержащих огранических соединений. В большинстве случаев одна плазмида содержит гены ферментов одного специфичного катаболического пути. Объединяя плазмиды разных штаммов Pseudomonas в одном хозяине, можно создать организм, способный к деградации нескольких соединений. Кроме того, с помощью генетических манипуляций можно расширить спектр субстратов, разрушаемых с помощью определенного ферментативного пути.
Под биомассой здесь понимается вся совокупность веществ и материалов, побочных продуктов пищевой и перерабатывающей промышленности, которая может служить сырьем для получения ценных продуктов. Производство этанола или фруктозы из молотого зерна происходит в несколько ферментативных стадий. Участвующие в этих процессах ферменты часто используются однократно. Чтобы повысить эффективность ферментативных реакций и снизить стоимость процессов, исследователи занимаются клонированием и исследованием свойств бактериальных генов, кодирующих термостабильные, обладающие высокой каталитической активностью и устойчивые к действию спирта ферменты.
Для повышения эффективности промышленного производства этанола в бактерию Zymomonas mobilis были введены гены, благодаря экспрессии которых она могла использовать в качестве источника углерода широкий спектр соединений. Предприняты первые шаги на пути создания штаммов Lactobacillus plantarum, способных эффективно расщеплять крахмал, содержащийся в большом количестве в такой важной сельскохозяйственной культуре, как люцерна.
При переработке растительного материала часто образуется большое количество лигноцеллюлозных отходов, которые раньше не находили применения. Сейсас лигноцеллюлоза служит сырьем для получения углеродсодержащих соединений, в первую очередь глюкозы, которые можно использовать в других процессах. Лигноцеллюлоза – это комплекс из лигнина, гемицеллюлозы и целлюлозы, не подверженный действию ферментов без предварительной обработки. Проводимые в последнее время исследования были направлены в основном на изучение механизма расщепления целлюлозы с образованием глюкозы. Клонированы и охарактеризованы гены эндоглюканаз, экзоглюканаз и β-глюкозидаз многих микроорганизмов, но пока не определен набор ферментов, осуществляющих масштабное эффективное расщепление целлюлозы in vitro.
Некоторые виды биомассы (например, сыворотка, целлюлозные отходы) и продукты переработки нефти могут служить субстратом при культивировании микроорганизмов. Предполагалось, что эти чистые культуры, а также их продукты (так называемый белок одноклеточных организмов, БОО) можно будет использовать в качестве пищевых добавок или корма для скота. К сожалению, вследствие дороговизны получаемых продуктов, их невысоких вкусовых качеств, а иногда и токсичности производство БОО оказалось экономически нецелесообразным. Однако есть надежда, что с помощью генетических манипуляций все-таки удастся создать систему, позволяющую получать дешевые биологические добавки на основе БОО.

